Therapie der Colitis ulcerosa, des Morbus Crohn
Werbung
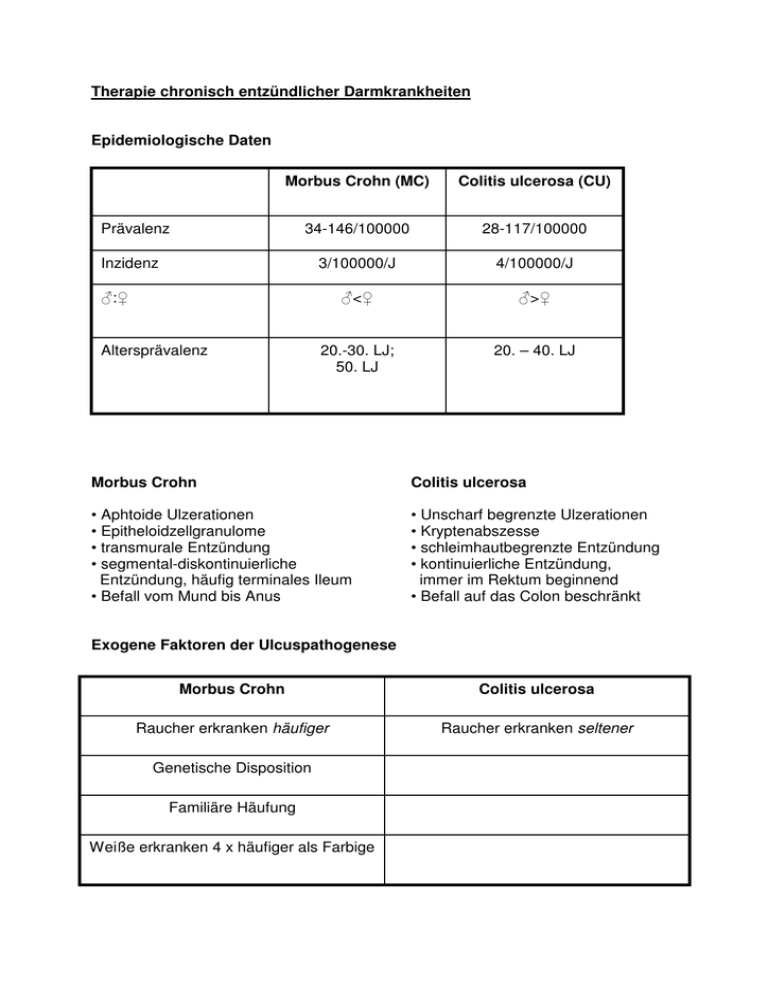
Therapie chronisch entzündlicher Darmkrankheiten Epidemiologische Daten Morbus Crohn (MC) Colitis ulcerosa (CU) 34-146/100000 28-117/100000 3/100000/J 4/100000/J ♂<♀ ♂>♀ 20.-30. LJ; 50. LJ 20. – 40. LJ Prävalenz Inzidenz ♂:♀ Altersprävalenz Morbus Crohn Colitis ulcerosa • Aphtoide Ulzerationen • Epitheloidzellgranulome • transmurale Entzündung • segmental-diskontinuierliche Entzündung, häufig terminales Ileum • Befall vom Mund bis Anus • Unscharf begrenzte Ulzerationen • Kryptenabszesse • schleimhautbegrenzte Entzündung • kontinuierliche Entzündung, immer im Rektum beginnend • Befall auf das Colon beschränkt Exogene Faktoren der Ulcuspathogenese Morbus Crohn Colitis ulcerosa Raucher erkranken häufiger Raucher erkranken seltener Genetische Disposition Familiäre Häufung Weiße erkranken 4 x häufiger als Farbige A. Umweltfaktoren • Hygienestatus Morbus Crohn ⇑ ⇑ → Industrieländer >Entwicklungsländer • Stillen ⇓ (IL-10↓ ; TGFβ↓) • Rauchen → Morbus Crohn ⇑ → Morbus Crohn ⇑ Colitis ulcerosa ⇓ • Ernährung ? B. Ernährungsfaktoren • Nahrungsinhaltsstoffe (z.B. Ballaststoffe vs. KH) • Nahrungsmittel Allergene (z.B. Bäckerhefe) • Selektive Mangelzustände (Vitamine, Spurenelemente) → → → Modulation der intestinalen Flora Hypersensitivität „intestinale Stoffwechselstörungen“ C. Infektiöse Faktoren? • Manifestation an Orten hoher Bakteriendichte Terminales Ileum, Kolon • Ausleitung von Stuhl (Ileostoma) → Besserung • Einleiten von Stuhl in ausgeschaltetes DS → Reaktivierung der Entzündung • Besserung unter Antibiotika Chinolone, Metronidazol D. Infektiöse Faktoren: Hypothesen, Spekulationen • Viren Masernviren Cytomegalieviren (1973) • Bakterien Mycobacterium tuberculosis (Vgl. Johne-Krankheit) Listeria monocytogenes Adhäsive enteropathogene E. Coli E. Genetische Faktoren • Häufung bei bestimmten ethnischen Gruppen z.B. jüdische Kaukasier • Familiäre Häufung Morbus Crohn (5 -10%) > Colitis ulcerosa (2 - 5%) • Konkordanzrate monozygoter Zwillinge 17 - 35-fach höheres für Morbus Crohn ⇒ weitere Umweltfaktoren ? • Genetische Risikofaktoren für Morbus Crohn: 12 % Allele Kombination HLA-DR1/DQ5 TNFa2b1c2d4e1 Weitere Risikogene: Chromosom 3, 7, 12 und 16 (NOD-2) Morbus Crohn Colitis ulcerosa Therapiestrategien Immunsuppression • • • • • Kortikosteroide 5-ASA Azathioprin/6-Mercaptopurin Methotrexat (MTX) Tacrolimus (FK 506 • Cyclosporin (CsA) Mycophenolat - Mofetil Immunmodulation • • Adhäsionsmoleküle - ICAM-1: Bindung von b2Integrinen Zytokine - pro- inflammatorisch TNFa, Interleukin 12 - anti-inflammatorisch Interleukin 10, (11) Pharmakotherapie 1. 5-Aminosalicylate Wirkungen: 5-ASA-Substanzen greifen unspezifisch in die Entzündung ein: - Reduktion der Leukotriensynthese - senken die Bildung proinflammatorischer Zytokine - inaktivieren freie toxische O2-Radikale - reduzieren die Leukozyten-Chemotaxis - hemmen Aktivität neutroph. Granulozyten Modifikationen der 5-Aminosalicylsäure (5-ASA): c Modifikation Freisetzungsort Freisetzungsart Proximaler Dünndarm pH-unabhängig 5-ASA (Mesalazin) Eudragit beschichtet Distaler Dünndarm pH-abhängig 5-ASA-5-ASA (Olsalazin) Proximales Kolon Bakterielle Spaltung 5-ASA-Sulfapyridin (Sulfasalazin) Proximales Kolon Bakterielle Spaltung 5-ASA (Mesalazin) Indikationen: • • • • Mittel der ersten Wahl bei aktiver CU und Standard-Therapeutikum für den Remissionserhalt Bei schwerem Schub, rektal oder oral in Kombination mit Glucocorticoiden Wirksamkeit bei MC ist deutlich geringer (Sulfasalazin nur bei zusätzlichen Gelenkbeschwerden) Akuter Schub: bis 4 g/d Remissionserh.: 1,5 g/d Nebenwirkungen (selten): Kopfschmerzen, allergische Exantheme, Diarrhoe, Pankreatitis, Leberwerterhöhung, Blutbildveränderungen, Interstitielle Nephritis, Haarausfall, Alveolitis, Peri-/Myokarditis, Kontraindikationen: Leber- und Niereninsuffizienz, Schwangerschaft, Stillzeit, Salicylatallergie 2. Glucocorticoide: Indikationen: • Glucocorticoide helfen bei aktiver CED, sie dienen nicht dem Remissionserhalt • MC: bei schwerem Krankheitsverlauf, bei Versagen der 5-ASA-Therapie bei mittelschwerem Verlauf, ca. 50% d. Pat. kommen in Remission, 50% sind steroidrefraktär Dosierung: 30-60 mg Prednisolonäquivalent/d, stufenweise Reduktion nach jeweils 1 Woche: 60/40/35/30/25/20/15/10 Erhaltungsdosis: 10 mg jeden 2.Tag für 3-6 Monate Indikationen: •MC: topisch wirksame Glucocorticoide sind weniger wirksam als systemische (aber auch weniger NW), werden vorwiegend bei ileozökalem Befall ohne systemische Komplikationen eingesetzt. z.B. Budesonid, 3 x 3 mg/d, stufenweise Reduktion •CU: leichte Verläufe einer distalen CU in Ergänzung mit 5-ASA Budesonid als Klysma oder Schaum (2 mg/d) mittelschwere bis schwere Schübe Prednisolon: initial 40-60 mg/d bis zur Remission, danach stufenweises Ausschleichen über 4 Wochen. (Osteoporoseprophylaxe mit Vit. D und Kalzium!) Nebenwirkungen: Akne, Vollmondgesicht, Büffelnacken, Stammfettsucht, Hypertonie, Diabetes, Glaukom, Osteoporose, Myopathie, Psychosen, Euphorie, Infektneigung 3. Immunsuppressive Therapie bei CED Indikationen: • akut steroidrefraktär • chronisch aktiver Verlauf • steroidabhängig • steroidrefraktär • Fisteln Ziele: • Remissionsinduktion • Remissionserhaltung • Steroideinsparung Indikationen: • Mit der immunsuppressiven Therapie nicht zu lange warten • erste Wahl sowohl bei MC als auch bei CU sind - Azathioprin (oral 2-2,5 mg/kg KG/d) - 6-Mercaptopurin (Metabolit, 1 mg/kg KG/d) • Hemmen als Purinantagonisten die Proliferation von T- und NK-Zellen • steroidabhängiger oder steroidrefraktärer Verlauf, Fisteln, wiederholte Crohn-Operation, Steroiddosis kann reduziert werden • Remissionserhalt Azathioprin Indikationen: Morbus Crohn • Remissionseinleitung bei chronisch aktivem Verlauf (kombiniert mit Steroid) • Steroideinsparung bei Steroidabhängigkeit • Behandlung von Fisteln • Remissionserhaltung Evidenzgrad Ia Ia Ib Ia Colitis ulcerosa Evidenzgrad • Steroideinsparung bei Steroidabhängigkeit Ia • Remissionserhaltung bei chronisch aktivem Verlauf Ia • Remissionserhaltung nach Cyclosporin A- oder Tacrolimus-induzierter Remission nach fulminantem Schub IIb [Stange et al., Konsensuskonferenz der DGVS] Nebenwirkungen:(Häufigkeit in %) • • • • Knochenmarkdepression (2 %) Toxische oder allergische Hepatitis (0,3 %) Pankreatitis (3,3 %) Allergische Reaktionen (2 %) Kontrollen: 1. und 2. Therapiemonat wöchentlich, dann alle 2 – 4 Wochen kontrollieren! Parameter - - Kritische Veränderung Blutbild: Leukozyten Thrombozyten Hb GPT unter 3000/µl unter 70 x 103/µl Abfall um > 20% über 50 U/l Klinsche Symptomatik: Übelkeit, Diarrhoe, Gelenkbeschwerden, Bauchschmerzen (Pankreasenzyme!), Hauterscheinungen Was tun bei kritischen Veränderungen von Blutbild, Hb, GPT sowie allergischen Reaktionen? • • • • • • zunächst Azathioprin absetzen Werte wöchentlich überprüfen Nach Normalisierung erneuter Therapieversuch in halber Dosierung möglich Bei Wiederauftreten der entsprechenden Veränderungen endgültiges Absetzen der Azathioprin-Therapie Bei Pankreatitis kein erneuter Therapieversuch! Bei sonstigen allergischen Reaktionen individuelles Vorgehen Bei Gabe hoher Azathioprindosen sollte eine Bestimmung des 6Mercaptopurin-abbauenden Enzyms Thiopurinmethyltransferase (TPMT) erfolgen, um Intoxikationen zu vermeiden. Orale Folsäuregabe (1-5 mg/Tag) zur Vermeidung von Nebenwirkungen? M. Crohn: Immunsuppressiva Indikationen: • Chronisch aktiver oder steroidresistenter VerlaufAzathioprin (2,0–2,5 mg/kg KG) bzw. 6-Mercaptopurin (1- 1,5 mg/kg KG) peroral pro Tag (Ia) • Azathioprin-resistenter chronisch aktiver Verlauf/AZA-Unverträglichkeit Methotrexat (25 mg intramuskulär pro Woche) (IV/Ib) Mycophenolat-Mofetil, Ciclosporin, Rapamun.... im Rahmen kontrollierter Studien !!! • Fisteln Metronidazol zweimal 400 mg peroral pro Tag für zwei Wochen (IIb) Azathioprin (2,0–2,5 mg/kg KG) bzw. 6-Mercaptopurin (1- 1,5 mg/kg KG) peroral pro Tag (Ia) Methotrexat: Mittel der 2. Wahl bei MC Wirkmechanismen: • Hemmung der Dihydrofolat-Reduktase Eingriff in den Purinstoffwechsel • Zytotoxizität gegenüber Immunzellen durch Apoptose-Induktion • Unterdrückung der T-Zell-Proliferation, der Aktivierung von Monozyten und Granulozyten und der Antikörperproduktion in B-Zellen • Reduzierte Zelladhäsion Rascher Wirkeintritt (2 – 10 Wochen) Dosis: 25 mg/Woche; später 15 mg/Woche Nebenwirkungen: Übelkeit, Erbrechen, Diarrhoe, Kopfschmerzen, Stomatitis, Haarausfall, Urtikaria, Photosensibilität, Leukopenie, fibrosierende Hepatitis, Pneumonie, Teratogenität, u.a. Ciclosporin A: Mittel der 2. Wahl bei CU • nicht zytotoxisch • Hemmung der T-Zell-vermittelten Immunität • Blockierung der Interleukin-2-Signalkaskade durch Bindung an spezifische Immunophiline • rascher Wirkungseintritt (wenige Tage bis 2 Wochen) • (4 mg/kg i.v. als Dauerinfusion) • Vorteile von Tacrolimus: • 100-fach potenter als Cyclosporin A • stabile galleunabhängige Resorption Nebenwirkungen: Nierenversagen, arterielle Hypertonie, Hirsutismus, Gingivahyperplasie, Tremor, Grand-mal-Anfälle, Kopfschmerzen, opportunistische Infektionen, Lymphome Wirkungsmechanismus von Etanercept Dimeres Fusionsprotein des humanen TNF-Rezeptors mit dem Fc-Anteil von humanem IgG. „löslicher TNF-Rezeptor“ Infliximab (Remicade®) •rekombinant hergestellter chimärer (Maus/Mensch) monoklonaler Anti-TNFAntikörper •Nebenwirkungen: –Infusionsreaktionen –Infektionen des oberen Respirationstraktes –unklar: erhöhte Inzidenz von malignen Erkrankungen, SLE •Problem: Auto-Antikörper gegen Infliximab, •TBC(> Etanercept) •HWZ: 9-10 d „Biologicals“ Zytokine → anti-inflammatorisch IL 10 (z.B. Tenovil®, Schering-Plough) IL 11 (z.B. Neumega®; Gen. Inst.) Adhäsionsmoleküle - Alicaforsen (ISIS 2302; ISIS Pharmaceuticals) → Antisense gegen ICAM-1 mRNA - Natalizumab: Antegren® (Elan, Biogen) → α4 Integrin-AK (human. Maus-AK)

