H Cl O H H H H H H CC
Werbung

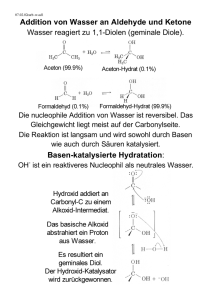
ORGANISCHE CHEMIE 1 TEIL 3 Butan, Hexan, 3-Methyl-Pentan,...,Di-Chlor Ethan, 1,2-Di-Chlorethen, 1-Chlor-Butan, 2Chlor Butan, .... Diese Oxidationsreaktion ist eine Radikalische (→bezogen auf auf das AGENS!) Substitution (→ bezogen auf das REAGENS): SR Hinweis: Selektivität von Radikalen Säure/Base-Reaktion a. Angreifer BASEN Beispiel 4: Ethanolat müßte durch +I-Effekt der Methylgruppe etwas stärker basisch als Hydroxid sein → mit NA+OH- nicht herstellbar (mit stärkerer Base, z.B.NH2- denkbar); ansonsten REDOX von Ethanol mit Na b. Angreifer Säuren Beispiel 5 H-X greift Ethanol an: 1. Schritt: Protonierung der Hydroxygruppe (z.B. Ethylhydroxoniumion und Chloridion, vergl. Wasser und Chlorwasserstoff) H H H C C H H H Cl O H → aus didaktischen und zeitökonomischen Gründen: ab jetzt Erweiterung auf alle Alkanole Dankbare weitere Schritte: I. → H2O könnte abgehen → Carbeniumion müßte zurückbleiben → Wann wahrscheinlich? → Wenn realtiv stabile Ionen vorliegen ↔ siehe Stabilität von Carbeniumionen und Einfluß des Lösungsmittels (polare Lösungsmittel erforderlich) Voraussetzung ist natürlich, dass X abwarten kann Formulieren sie selbst ein stabiles und ein total instabiles Ion! © JÜRGEN HALLER 1 ORGANISCHE CHEMIE 1 TEIL 3 → Die Reaktion kann beendet werden durch eine C-C Bindung Charakterisierung dieses Mecchanismus : Substitution von OH durch Angriff des NucleophilX-: kurz: SN II Falls X- nicht „abwarten will“, also im Vergleich zum Reagens aktiv ist (siehe S.28, Analogie 2); wie wird X vorgehen? → Annäherung an das positivierte C so, dass es die zu verdrängende Gruppe möglichst nicht „merkt“ → von der Gegenseite → dies führt zu einem Üb ergangszustand, in dem sich der C „entscheiden“ muß. Formulieren Sie einen solchen Übergangszustand! Konfiguration? Falls X- „Erfolg hat“, dann auch SN, nur auf anderem Weg! Günstige Voraussetzungen für einen solchen Weg: • X- stark nucleophil • Kein stabiles Carbenium möglich • Unpolares Lösungsmittel • Problem: Im übergangszustand müssen sich 5 Liganden um das positivierte C herum arrangieren → je nach Größe der Gruppen kann es Platzprobleme geben. Beispiel: Überlegungen zur Reaktionsgeschwindigkeit bei I und II: I Hier wird der geschwindigkeitsbestimmende Schritt die Ablösung des Wassers sein. Begründung! Nur ein Teilchen, nämlich Ist dabei beteiligt: uni-(mono)-molekulare Reaktion „1“ II Geschwindigkeitsbestimmend wird hier der „Annäherungsversuch“ bis zum Übergangszustand sein. Zwei Teilchen, nämlich © JÜRGEN HALLER 2 ORGANISCHE CHEMIE 1 TEIL 3 Sind daran beteiligt → bimolekulare Reaktion „2“ z.B. kurze Beschreibung für Weg !!: SN2 Hinweis: Allgemein Molekularität: Mit ihr geben wir an, wieviel Teilchen nach unserem Mechanismus im geschwindigkeitsbestimmenden Schritt eine Änderung ihrer Bindung erfahren. → Bei der Suche nach Argumenten für eine angenommene Molekularität kann die experimentell bestimmbare Reaktionsordnung (siehe allgem. Chemie ) hilfreich sein. Weitere Überlegungen und Aspekte an einem allgemeineren Beispiel: Selbst eintragen Übung: Formulieren Sie die Reaktionsmechanismen für SN1 („Zweischrittmechanismus mit Zwischenprodukten“) und SN2 („Einschrittmechanismus mit Übergangszustand“) Geben sie die ENERGIE/REAKTIONSWEG-Diagramme an! SN1: HINWEIS: In gewissen Fällen kann sich das Zwischenprodukt in ein stabileres Carbeniumion umlagern. Beispiel: SN2: Stereochemische Aspekte: Erklären Sie,weshalb Sie bei SN2 eine Konfigurationsumkehr und bei SN1 inder Regel ein Racemat erwarten? SN! Oder SN2? Einige Aspekte: • „Gute“ Abgangsgruppen Y begünstigen grundsätzlich die Reaktion. Y sollte möglichst schwach basisch bzw. das Anion einer starken Säure Sein. Beispiel: CL-, HSO4-, H2O, ... • Stabile Carbeniumionen und Polares Lösungsmittel→SN1 © JÜRGEN HALLER 3 ORGANISCHE CHEMIE 1 • TEIL 3 Starkes Nucleophil X- (NUCLEOPHILIE) → SN2 Zur Abschätzung der nucleophilie vonTeilchen: Hinweis: Nucleophielie bezieht sich auf den „Aktivierungsberg“, sie ist eine kinetische Größe! Wir können uns dazu orientieren an 1. einer bekannten Größe, der Basizität (thermodynamische Größe, definiert duch „Gleichgewicht“) und weitgehend für uns neu 2. der POLARISIERBARKEIT, sie hängt von der Orbitalgröße des doppelt besetzten Orbitals ab, mit dem ein Nucleophil angreift. Beispiel: Vergleich I- mit ClHier ist eine Vorhersage (Abschätzung) nicht möglich. Experiment muss entscheiden. Einige Regeln und Erfahrungswerte bezgl. Der Nucleophilie: 1. Bei ungefähr gleicher Basizität ist die Periode im PSE entscheidend, aus der das angreifende Element stammt: Elemente der 3. oder 4. Periode sind dann nucleophiler als die der 2. Periode (Polarisierbarketi) 2. Falls gleiches Element als Angreifer, z.B. „O“, dann Orientierung an Basizität: R-O- >H-O_ > Ph-O- > RCOO- > H2O > NO33. Lösungsmittel beachten: Je stärker die Solvathülle, desto weniger nucleophil. Warum???............. Insbesondere protische Lösungsmittel stabilisieren durch H-Brücken. Günstiger: polar aprotisch (Beispiel: Erfahrungswerte (in protischen Lösungsmitteln): R-S- > I: > CN- > H-O- > Br- Ph-O- > HSO4- > H2O Warum ist I- sowohl ein guter Angreifer als auch eine gute Abgangsgruppe? (Gleichgewichtssysteme beachten!) Bisher noch nicht beachtet: X kann auch als BASE angreifen,+ Sofern geeignete Protonen „zu haben sind“. Wir begeben uns damit auf einen alternativen Reaktionsweg: Mögliches Reaktionsprodukt: ALKEN Neuer Reaktionstyp: Eleiminierung E, „H-Y“ wird aus R-Y „eliminiert“ Anwendung unserer bisherigen Erkenntnisse: Es müssten zumindest einen E1 und E2 Mechaninismus geben. Formulieren Sie diese beiden Wege mit Energiediagramm. E1 Vergleich mit SN1: • Weg bis zum Carbeniumion gleich © JÜRGEN HALLER 4 ORGANISCHE CHEMIE 1 • • TEIL 3 Basizität von X- auch nicht so bedeutsam (vergl. Nucleophilie bei SN1) Bei manchen Substraten sind mehrere basische Angriffsmöglichkeiten denkbar. Verschiedene Alkene könnten entstehen. Beispiel: E2: Vergleich mit Sn2: • Reaktionswege von Anfang an verschieden • Basizität von X- wichtig („harte“ Basen, HO- oder R-O-, ...) • Keine Platzprobleme (sterische Probleme) im Übergangszustand • TRANS-(anti) Angriff denkbar Überlegen sie sich mögliche Konsequenzen bezüglich der Stereochemie! Info I- < Br- < Cl- << HSO4- < H2O < F- < < HS- < NC- < OH- < H2N- Zwischenbilanz: R-Y und X • Je nach Bau der Teilchen und en Reaktionsbedingungen üben R-Y und X einen unterschiedlichen „Reiz2 auf einander aus. • Bezeichnen wir (vielleicht teilweise willkürlich) X- als Angreifer, so kann dieser als Nucleophil und/oder als Base angreifen: Mindestens zwei konkurrierende Wege können „eingeschlagen“ werden: 1. In der Regel wählen die Teilchen den „leichtesten“ Weg 1, d.h. den mit dem niedrigsten Aktivierungsberg, die Produkte entstehen „schneller“ (kinetische Produktkontrolle)). Dieser Weg muß vor allem dann gewählt werden, wenn wenig Energie zur Verfügung steht (realtiv niedrige Temperaturen). 2. Ist genügend Energie vorhanden, die Aktivierungsenergie also nicht so bedeutsam, so wird z.B. auch ein Weg 2. Bei dem gegebenenfalls trotz größerer Aktivierungsenergiedie stabileren Produkte entstehen, also mehr Energie frei wird, aus thermodynamischen Gründen gewählt (thermodynamische Produktkontrolle). 3. Meist stellt sich ein Gleichgewicht ein. Wir haben die Möglichkeit, das Gleichgewicht zu „verschieben“. Skizzieren sie die entsprechenden Diagramme! © JÜRGEN HALLER 5 ORGANISCHE CHEMIE 1 TEIL 3 4. Bei der Eliminierung entstehen mehr Teilchen als bei der Substitution, d.h. die Entropie nimmt zu. Gemäß ∆G = ∆H - T * ∆S schlägt im hinblick auf die frei werdende Energie die Entropiezunahme bei höherer Temperatur mehr zu Buche. Eliminierungsprodukte werden daher bei höheren Temperaturen thermodynamisch begünstigt. Welche Vorhersagen können wir mit unseren bisherigen Reaktionsmodellen (Mechanismen) im Hinblick auf die KONKURRENZ zwischen SN und E „wagen“? Diskussion am Beispiel Substrat I: 2-Brom-2-Methylpropan Substrat II: Bromethan Charakterisierung: • I kann stabile Carbeniumionen bilden: • Resonanzhybrid aufschreiben! • • Hinweis: ebene, mercedessternförmige Konfiguration II wird fast nur bimolekulare Reaktionen eingehen; nur tetraedrische Konfiguration Äußerst schwach positiv polarisierte H Angreifer: a. Hydroxid b. „tert. Butylat“ c. Hydrogensulfid Formeln Charakterisierung der Angreifer: • A und b ähnlich starke basisch, b wegen der Größe u.U. schwächer nucleophil • C schwächer basisch, aber stärker nucleophil Vorhersagen: Substrat II: „Entscheidung“ über den Reaktionsweg gleich anm Anfang: a und b wären mehr an Protonen „interessiert“, sie finden aber nur wenig „attraktive“ H, deshalb wird SN2 im Vergleich zu E2 begünstigt sein. Allerdings wird für b der E-Anteil größer sein. Warum? H-S- wird fast ausschließlich zu Substitutionsprodukten führen. Lösungsmittel möglichst unpolar. Substrat I: Angriffsentscheidung erst, wenn das Carbeniumion gebildet ist. Protonen wegen des Hyperkonjugationseffektes „attraktiver“ und in größerer Anzahl vorhanden. Nach Entzug eines Protons muss sich die Konfiguration des Teilchens nicht ändern, außer Angriff auf Protonen macht auch dem größeren b keine Probleme (deshalb mit ihm noch mehr E-Produkte) Für c auch realtiv mehr S-Produkte. © JÜRGEN HALLER 6 ORGANISCHE CHEMIE 1 TEIL 3 Lösungsmittel möglichst polar/protisch. Übung: a. Sie wollen aus Ethen Bromethan herstellen. Warum wählen sie dazu eine starke spaerrige Base in möglichst hoher Konzentration und eine relativ hohe Reaktionstemperatur? Weshalb haben Sie hier „Glück“ im Hinblick auf die Gleichgewichtslage? Welche Art von Lösungsmitttel würden Sie einsetzen? Warum? b. Dehydratisierung von Alkoholen HO- ist eine schlechte Abgangsgruppe. Warum? Deshalb geben wir eine Säure H-Z hinzu. Warum? H-Z sei H-Br (I), H2SO4 (II) oder H3PO4 (III): Versuchen Sie zu erklären, weshalb man bei der Reaktion von Cyclohexanol mit (I) im Gleichgewicht mehr Bromcyclohexan und mit (II) oder (III) mehr Cyclohexen findet? Welche weitern Produkte könnten durch Konkurrenzreaktion noch im Gleichgewicht auftreten? c. Wählen sie ein Halogenalkan als Substrat und ein nucleophiles bzw. basisches Agens so aus, dass Substitutions- und Eliminierungsreaktion äußerst erschwert sind. Reaktionsverhalten von Alkenen Wir wissen: π-Elektronen gehören zu den „attraktiven“ Zonen für Elektrophile (LewisSäuren). Diese Zone ist um so attraktiver, je größer die Ladungsdichte im Bereich der πOrbitale ist. Warum nimmt die Reaktivität in der folgenden Weise zu? Chlorethen < Propensäure < Ethen < Propen < 2-Methylpropen Konstitutionsformeln Welche Produkte sind zu erwarten? → Additionsprodukte, z.B. aus Ethen und Chlor → 1,2-Dichlorethan Reaktionstyp: Addition A MÖGLICHE ANGREIFER: RADIKALE → AR ODER ELKTROPHILE → AE • Radikale Ra Mindestens 2 verschiedne Radikale müßten sie kennen! 1. Schritt Angriff auf die –bindung und Bildung einer neuen σ-C-Ra-Bindung. Erfassen Sie diesn Schritt auch formelmäßig! 2. Schritt a. Bildung der zweiten σ-C-Ra-Bindung, falls ein weiteres Ra in der Nähe ist © JÜRGEN HALLER 7 ORGANISCHE CHEMIE 1 TEIL 3 Oder b. Angriff auf ein weiteres Alken, Bildung einer neuen σ-C-C-Bindung „Dimeres“ →→→→→ Polymer Am Beispiel der Bildung von POLYETHEN (PE) auch in Formeln! Einsicht: Kettenlänge kann durch „Radikal“-Konzentration beeinflußt werden: Je geringer die Konzenration an Radikalen, desto länger die Kette. • Elektrophile: H+, positivierte Bereiche polarer Teilchen z.B. ........ Am besten ist der elektrophile Additionsmechanismus von Br2 an Ethen untersucht und aufgeklärt → überraschend! Br2 als elektrophilen Angreifer hätte man nicht vorausgesagt! → Erklärung: eine zufällige Annäherung von Br2 an die π-Elektronen des Ethens in spezieller Orientierung (vergl. WF, Orientierungsfaktor) führt zu einer temporären Polarisierung des Brommoleküls, „π-KOMPLEX“: Erfassen Sie diese Situation formelmäßig! Man stellt u.A. fest: 1. Reaktionsgeschwindigkeit ist auch im Dunkeln ziemlich groß; in unpolaren Lösungsmitteln ist sie kleiner als in polaren; Lewis-Säurenbeschleunigen → polarer Mechanismus 2. Gibt man noch Natriumchlorid oder Wasser dazu, so findet man als Nebenprodukte z.B. 1-Brom-2-Chlorethan bzw. 2-Bromethanol → mögliche Mechanismen, die diese Beobachtungen erklären könnten: Vorschlag A 1. Schritt Ae von Brom an Ethen, „synchron“. In Formeln! 2. Schritt SN: Substitition eines Br- im 1,2-Dibromethan durch z.B. Cl-. In Formeln! Probleme: Cl- müsste nucleophiler als Br- sein; Zusatzexperiment von 1,2-Dibromethan mit Cl- ergibt eine viel langsamere Geschwindigkeit als „oben“ → Entstehung des Nebenprodukts im obigen Fall mit diesem AE/SN-Mechanismus nicht erklärbar! Vorschlag B 1. Schritt: Angriff zunächst nur von Br+ und Bildung eines Carbeniumions. Formeln! 2. Schritt Nucleophiler Angriff von Br- oder ClFormeln! © JÜRGEN HALLER 8 ORGANISCHE CHEMIE 1 TEIL 3 → Problem: Stabilität des Carbeniumions? → weitere Unstimmigkeit: Bei der Addition von Brom an Cyclohexen erhält man trans-1,2Dibromcyclohexan → Br- kann also nur von der GEGENSEITE angreifen. „TRANS-Addition“. (INFO: auch bei Offenkettigen Alkenen feststellbar (Stereochemische Aspekte; Warum kann man bei einer Reaktion mit Ethen einen TRANS-Angriff experimentell nicht feststellen?) → Carbeniumion im Schritt 1 ließe eine „freie Drehbarkeit um die C-C-Achse“ bei den offenkettigen zu. Der TRANS-Angriff könnte damit also nicht erklärt werden. Vorschlag C Änderungsvorschlag für den Mechanismus B Im 1. Schritt wird kein Carbeniumion, sondern ein Halogeniumion (hier: Bromomiumion) gebildet. Skizzieren sie ein Bromomiumion! → Angriff von Br- nur von der Gegenseite möglich! Übung: Welche Produkte dürfen wir bei der Addition von Brom an 2-Buten bei einer TRANS-Addition nur erwarten? Welche nicht? Hinweis: Addition von H-X an Ethen bisher schlecht aufgeklärt. Einige denkbare Produkte, die durch AE an Alkene entstehen können: 1. Monoalkylsulfat 2. Dialkylsulfat 3. Alkanol 4. Polymer Formulieren sie den kationischen Polymerisationsmechanismus von Polyethen. 5. Ether 6. Ester 7. Nitrile durch Addition von H-CN → Bildung einer neuen C-C-Bindung, Kohlenstoffkettenverlängerung! Welche weitern diesbezügtlichen Möglichkeiten kennen Sie noch? • Mechanisch interessant und als Übung geeigent: Orientierung bei der Addition unsymmetrischer Addenden an unsymmetrisch substituierte Alkene: Beispiel: • Addition von H-X an Propen: es entsteht nur 2-X-Propan! Diese Addition verläuft regiospezifisch. Formulieren Sie die einzelnen Reaktionsschritte selbst und begründen Sie! (Hilfe: MARKOWNIKOW-Regeln), vergleichen Sie mit ANTI-MARKOWNIKOW bei einer AR. © JÜRGEN HALLER 9 ORGANISCHE CHEMIE 1 TEIL 3 Weitere Übung: Was erwarten Sie bei einer Ae von Propensäure? • • • Informieren Sie sich darüber hinaus hinsichtlich „Addition von Brom an 1,3Butadien(kinetische und termodynamische Produktkontrolle)“, „Addition an Alkin“. Vergleichen Sie AE an Alkene mit der Addition al Alkanale Wie und wo ordnen sie die GRIGNARD-Reaktion ein? Weiter Themen, die wir aus zeitlichen Gründen innerhalb der OC !-Vorlesung nicht mehr ansprechen konnten, sollten Sie spätestens während der „Organischen Chemie ! – Übung mit Experimenten“ selbst erarbeiten. Über die notwendigen Voraussetzungen verfügen Sie auf der Basis dieses Skripts. Solche Themen sind u.a.: • Reaktionsverhalten von CARBONYLVERBINDUNGEN bezogen auf im Praktikum durchgeführte Experimente bzw. selbst hergestellte Präparate • ELEKTROPHILE SUBSTITUTION AN AROMATEN (an Benzol und den wichtigsten einfachen Benzolderivaten). Ich wünsche ihnen viel Lust auf „Organische Chemie“ und viel Erfolg mit ihr, vor allem auch in Prüfungssituationen. © JÜRGEN HALLER 10