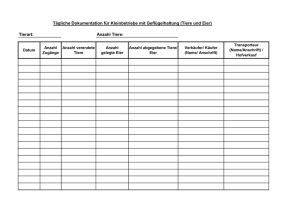
Schistosomiasis (Bilharziose) - biomed
Werbung
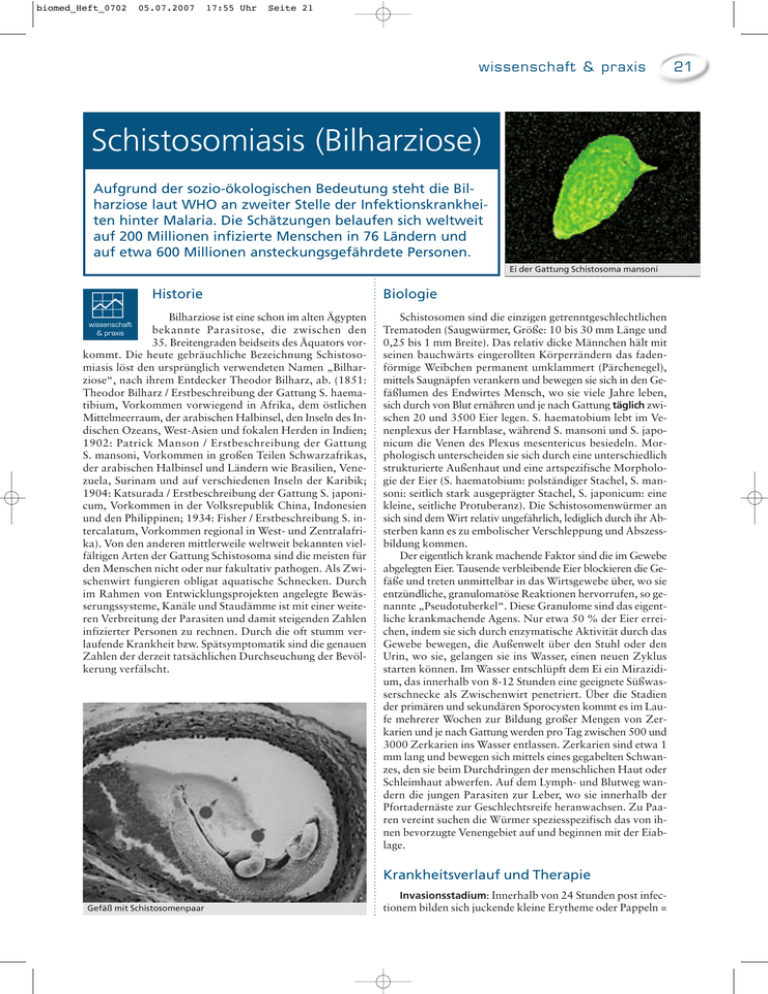
biomed_Heft_0702 05.07.2007 17:55 Uhr Seite 21 wissenschaft & praxis Schistosomiasis (Bilharziose) Aufgrund der sozio-ökologischen Bedeutung steht die Bilharziose laut WHO an zweiter Stelle der Infektionskrankheiten hinter Malaria. Die Schätzungen belaufen sich weltweit auf 200 Millionen infizierte Menschen in 76 Ländern und auf etwa 600 Millionen ansteckungsgefährdete Personen. Ei der Gattung Schistosoma mansoni Historie Bilharziose ist eine schon im alten Ägypten bekannte Parasitose, die zwischen den 35. Breitengraden beidseits des Äquators vorkommt. Die heute gebräuchliche Bezeichnung Schistosomiasis löst den ursprünglich verwendeten Namen „Bilharziose“, nach ihrem Entdecker Theodor Bilharz, ab. (1851: Theodor Bilharz / Erstbeschreibung der Gattung S. haematibium, Vorkommen vorwiegend in Afrika, dem östlichen Mittelmeerraum, der arabischen Halbinsel, den Inseln des Indischen Ozeans, West-Asien und fokalen Herden in Indien; 1902: Patrick Manson / Erstbeschreibung der Gattung S. mansoni, Vorkommen in großen Teilen Schwarzafrikas, der arabischen Halbinsel und Ländern wie Brasilien, Venezuela, Surinam und auf verschiedenen Inseln der Karibik; 1904: Katsurada / Erstbeschreibung der Gattung S. japonicum, Vorkommen in der Volksrepublik China, Indonesien und den Philippinen; 1934: Fisher / Erstbeschreibung S. intercalatum, Vorkommen regional in West- und Zentralafrika). Von den anderen mittlerweile weltweit bekannten vielfältigen Arten der Gattung Schistosoma sind die meisten für den Menschen nicht oder nur fakultativ pathogen. Als Zwischenwirt fungieren obligat aquatische Schnecken. Durch im Rahmen von Entwicklungsprojekten angelegte Bewässerungssysteme, Kanäle und Staudämme ist mit einer weiteren Verbreitung der Parasiten und damit steigenden Zahlen infizierter Personen zu rechnen. Durch die oft stumm verlaufende Krankheit bzw. Spätsymptomatik sind die genauen Zahlen der derzeit tatsächlichen Durchseuchung der Bevölkerung verfälscht. wissenschaft & praxis Biologie Schistosomen sind die einzigen getrenntgeschlechtlichen Trematoden (Saugwürmer, Größe: 10 bis 30 mm Länge und 0,25 bis 1 mm Breite). Das relativ dicke Männchen hält mit seinen bauchwärts eingerollten Körperrändern das fadenförmige Weibchen permanent umklammert (Pärchenegel), mittels Saugnäpfen verankern und bewegen sie sich in den Gefäßlumen des Endwirtes Mensch, wo sie viele Jahre leben, sich durch von Blut ernähren und je nach Gattung täglich zwischen 20 und 3500 Eier legen. S. haematobium lebt im Venenplexus der Harnblase, während S. mansoni und S. japonicum die Venen des Plexus mesentericus besiedeln. Morphologisch unterscheiden sie sich durch eine unterschiedlich strukturierte Außenhaut und eine artspezifische Morphologie der Eier (S. haematobium: polständiger Stachel, S. mansoni: seitlich stark ausgeprägter Stachel, S. japonicum: eine kleine, seitliche Protuberanz). Die Schistosomenwürmer an sich sind dem Wirt relativ ungefährlich, lediglich durch ihr Absterben kann es zu embolischer Verschleppung und Abszessbildung kommen. Der eigentlich krank machende Faktor sind die im Gewebe abgelegten Eier. Tausende verbleibende Eier blockieren die Gefäße und treten unmittelbar in das Wirtsgewebe über, wo sie entzündliche, granulomatöse Reaktionen hervorrufen, so genannte „Pseudotuberkel“. Diese Granulome sind das eigentliche krankmachende Agens. Nur etwa 50 % der Eier erreichen, indem sie sich durch enzymatische Aktivität durch das Gewebe bewegen, die Außenwelt über den Stuhl oder den Urin, wo sie, gelangen sie ins Wasser, einen neuen Zyklus starten können. Im Wasser entschlüpft dem Ei ein Mirazidium, das innerhalb von 8-12 Stunden eine geeignete Süßwasserschnecke als Zwischenwirt penetriert. Über die Stadien der primären und sekundären Sporocysten kommt es im Laufe mehrerer Wochen zur Bildung großer Mengen von Zerkarien und je nach Gattung werden pro Tag zwischen 500 und 3000 Zerkarien ins Wasser entlassen. Zerkarien sind etwa 1 mm lang und bewegen sich mittels eines gegabelten Schwanzes, den sie beim Durchdringen der menschlichen Haut oder Schleimhaut abwerfen. Auf dem Lymph- und Blutweg wandern die jungen Parasiten zur Leber, wo sie innerhalb der Pfortadernäste zur Geschlechtsreife heranwachsen. Zu Paaren vereint suchen die Würmer speziesspezifisch das von ihnen bevorzugte Venengebiet auf und beginnen mit der Eiablage. Krankheitsverlauf und Therapie Gefäß mit Schistosomenpaar Invasionsstadium: Innerhalb von 24 Stunden post infectionem bilden sich juckende kleine Erytheme oder Pappeln = 21 biomed_Heft_0702 22 05.07.2007 17:55 Uhr Seite 22 wissenschaft & praxis Schnecke der Gattung Biomphalaria glabrata mit schlüpfender Zerkarie Zerkariendermatitis. Dieser Vorgang kann aber auch völlig unauffällig verlaufen. Die in Europa und Nordamerika vertretenen Gattungen parasitieren in Entenvögeln und wenn die Zerkarien dieser Spezies die menschliche Haut penetrieren, sterben sie dort ab und lösen einen unangenehmen Juckreiz aus = Badedermatitis bzw. Zerkariendermatitis. Toxemische und hypersensitive Phase: 15-20 Tage nach Infektion tritt spontan Fieber auf, begleitet von einer Hepatosplenomegalie und Lymphadenitis. Akute Erkrankung: 50 Tage post infectionem kommt es zum Einwandern der Eier in die Schleimhäute. Die Würmer haben zu diesem Zeitpunkt wirtspezifische Antigene in ihre Membran eingebaut (Coating) und werden daher vom Immunsystem des Wirtes nicht mehr erkannt. Die Eier hingegen bewirken die Verödung von Gefäßabschnitten. Durch die Anhäufung von Pseudotuberkel entstehen große, floride Granulome, oft mit zentraler Nekrose und deutlichen Aggregaten von eosinophilen Leukozyten, mononukleären Phagozyten, Plasmazellen, neutrophilen Leukozyten, Lymphozyten und Fibroblasten. Fieber ist ein typisches Begleitsymptom. Manifeste Erkrankung: Beim Übergang in die chronische Form werden die Entzündungszelltypen immer mehr durch Fibroblasten ersetzt. Die topografische Lokalisation korreliert mit der Schistosomen Art. So erscheinen die Entzündungen und Fibrosen bei S. haematobium vor allem im Bereich der Blase, aber auch der Sexualorgane, wodurch es zu Fibrosen der Samenblasen wie der Tuben und Ovarien kommen kann. Bei S. mansoni und S. japonicum sind Regionen des Colons betroffen, entsprechend des Standortes der eierproduzierenden, adulten Parasiten. Dysenterische Phasen wechseln mit Remissionen, es kann zu einem Prolaps der Rektalschleimhaut, sowie zu einer chronischen Appendizitis kommen. Werden Eier in das portale System der Leber verschleppt, kann es bei allen Arten zu einer Fibrose der Portalfelder kommen. Diese sogenannte „Pfeifenstielfibrose“ führt allerdings nicht zu einer Zirrhose, da die Fibrose nicht mit einer Nekrose des Leberparenchyms gekoppelt ist. Bei Verschleppung der Eier in die Pulmonalarteriolen wird der kleine Kreislauf behindert und es kommt in der Folge zum Cor pulmonale. Die oft bei S. haematobium Infektion auftretende haemorrhagische Harnblasenentzündung kann unter Umständen in ein Plattenepithelkarzinom übergehen, wobei der physiopathologische Zusammenhang mit der Bilharziose noch unklar ist. Eine embolische Verschleppung sowohl eierlegender adulter Parasiten als auch die Verschleppung der Eier durch die Blutbahn kann zu ektopischen Manifestationen in praktisch allen Organen führen. Immunologie: Im Laufe der Jahre wird eine – nur teilweise wirksame – Immunität erworben, die vorwiegend gegen Zerkarien wirksam ist, und somit einen relativ guten Schutz gegen eine Re-Infektion bietet. Die adulten Parasiten sind durch das Coating geschützt. Die Diagnose erfolgt normalerweise durch den Nachweis der Eier aus Stuhl oder Urin, wobei die Unterschiede in der Eimorphologie auch eine Artdiagnose ermöglichen. Optional sind Probeexzisionen aus Blase oder Rektum mit anschließender histologischer Untersuchung. Immunologische Nachweismethoden, wie z. B. der Nachweis von an adulte Parasiten gekoppelten Antigenen durch einen Immunassay (RIA), sind im Handel. Therapie: Das Mittel der Wahl ist Praziquantel (Biltrizide® von Bayer AG oder Cysticide® von E. Merck). Das Mittel ist gegen alle adulten Schistosoma-Arten wirksam und darüber hinaus auch gegen andere Trematoden wie Clonorchis, Paragonimus u. a. einsetzbar. Bekämpfung: Alle Bekämpfungsmethoden zielen darauf ab, den Entwicklungszyklus der Schistosomen an einer oder mehreren Stellen zu durchbrechen, wobei in erster Linie der Kampf gegen den Zwischenwirt Schnecke steht, der bis heute nicht gelungen ist. Einen dauerhaften Erfolg kann nur eine konzertiert ablaufende Bekämpfung des Zwischenwirtes und der adulten Parasiten bringen. Prävention: Ein niedriges Infektionsrisiko besteht bei Wassertemperaturen unter 18°C, sowie in beschatteten stehenden oder schnell fließenden Gewässern. Kein Infektionsrisiko besteht bei Salzwasser, mindestens 2 Tage abgestandenem, gekochtem oder chloriertem Wasser. ■ Prof. Helene Breitschopf Dr. Peter Traxler Biomedizinische Analytikerin [email protected] Arzt für Allgemeinmedizin Betriebsarzt im Hanuschkrankenhaus www.tropenmedizin.at