Vorkurs Chemie Handout
Werbung

Warum Chemie?
Chemie bestimmt unser Leben:
Zucker,
Eiweiß
Eiweiß,
Fett,
Vitamine, etc.
Spielzeug
SportSportgerä
geräte
Handys
Arzneimittel
Heilmittel
Brillen
Medizintechnik
Waschmittel
Putzmittel
Seife
Zahnpasta
Kohle/Gas
Benzin
Batterien
Farben
Teppich
Möbel
Seite 1
Beginn der chemischen Industrie
Ressourcen der chemischen Industrie
um 1820 Herstellung von:
• Soda (Natriumcarbonat, Natron) fü
für Weiterverarbeitung
zu Glas, Bleichmittel, Waschmittel, Farben.
• Synthetische Dü
Düngemittel
• Farben
Ressourcen der chemischen Industrie vor 1870:
• Kohle
• Mineralien
• Pflanzenstoffe
• Tierprodukte
Ressourcen der chemischen
Industrie von 1870 - ?
• Erdö
Erdöl
Seite 2
1
Gefahren der chemischen Industrie
21. Sept. 1921; BASF, Oppau,
Oppau, : Explosion in Dü
Düngemittelfabrik:
561 Tote, 2000 Verletzte, 900 Wohnungen zerstö
zerstört, 100 m Krater Seite 3
Nutzen der chemischen Industrie
Bevölkerungsentwicklung und Chemie
"Natur macht gesund - Chemie macht krank !" ?
Entwicklung der chemische Industrie • Kunstdü
Kunstdünger
• Schä
Schädlingsbekä
dlingsbekämpfung
• Medikamente
• Hygieneartikel
Seite 4
2
Analytische/Synthetische Chemie
Analytische Chemie:
Die Umwelt verstehen wollen:
Woraus besteht das?
Was ist da drin?
Und wie viel?
Synthetische Chemie:
Können wir es genau so gut (besser)
als die Natur?
Wikipedia:
Wikipedia:
Lehre vom Aufbau, VerhalVerhalten und der Umwandlung
der chemischen Elemente
und ihren Verbindungen
sowie den dabei geltenden
Gesetzmäß
igkeiten..
Gesetzmäßigkeiten
Seite 5
Aggregatzustände
Stoffe kö
können drei Aggregatzustä
Aggregatzuständen vorkommen:
sublimieren
schmelzen
fest
verdampfen
flü
flüssig
erstarren
Temp.
gasfö
gasförmig Temp.
kondensieren
resublimieren
Beispiele für Sublimation: Trockeneis (festes CO2): -78°C
Iod: ca. 100°C
Die meisten Feststoffe schmelzen, die meisten Flü
Flüssigkeiten
verdampfen bei Temperaturerhö
Temperaturerhöhung.
Alle Gase und Flü
Flüssigkeiten werden beim Abkü
Abkühlen irgendwann fest.Seite 6
3
Gemische, Reinstoff, Elemente
Trennung durch
phys./chem. Methoden
Stoffgemische
Reinstoffe z. B Wasser
z.B. Destillation
oder reiner
z. B. Wein
Filtration, Extraktion
Alkohol
Wasser/Alkohol
sind
entweder oder
Chemische
Verbindungen
bestehen aus zwei oder mehr
chemischen Elementen
über chem. Bindungen verknü
verknüpft
z. B. Wasser H2O
aus zwei Atomen Wasserstoff (H)
und einem Atom Sauerstoff (O)
Elemente
aus einer Atomsorte;
sind mit chemischen Methoden
nicht weiter zerlegbar
z. B. Wasserstoff (H)
Sauerstoff (O)
Eisen (Fe)
Seite 7
Bedeutung der Chemie für das Leben
vom Atom
über das Molekü
Molekül
(es gibt ca. 15 Mio.!)
zum Organismus
Ascorbinsä
Ascorbinsäure
Chlorophyll
Seite 8
4
Aufbau der Materie; Stoff
Chemische Verbindung
fest
Stoff
Na+
Kochsalz
Cl-
üssig
flflü
Natriumchlorid
Natriumchlorid
Wasser
gasfö
örmig
gasf
Atome
Wassermolekü
Wassermoleküle
WasserstoffWasserstoff- SauerstoffSauerstoffatom
atom
Luft
SauerSauer- u. StickstoffStickstoffmolekü
moleküle (Mischung)
Stickstoffatom
Seite 9
Elemente und ihre Symbole
Das heute gebrä
gebräuchliche Formelsystem fü
für
chemische Elemente geht auf Berzelius zurü
zurück:
Jedes Element hat ein Symbol aus ein oder
zwei Buchstaben, das vom lateinischen oder
griechischen Namen abgeleitet wurde.
H
He
Li
Be
B
C
N
O
F
Ne
Wasserstoff
Helium
Lithium
Beryllium
Bor
Kohlenstoff
Stickstoff
Sauerstoff
Fluor
Neon
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca
Natrium
Magnesium
Aluminium
Silizium
Phosphor
Schwefel
Chlor
Argon
Kalium
Calcium
Jöns Jakob Berzelius
schwedischer Chemiker
(1779-1848)
Die ersten zwanzig
Elemente
Seite 10
5
Häufigkeit der Elemente
Über 90% der Materie im Weltall ist Wasserstoff (H);
am zwei Hä
Häufigsten ist Helium (He).
Häufigkeit der Elemente Erdkruste (0-40 km)
3%
3%
2%
2%
4%
5%
5%
8%
Häufigkeit der Elemente im Erdkern
1% 1%
2% 2%
7%
Fe
Al
O
49%
Si
Eisen
26%
O
Si
Al
Fe
80%
Ca
Na
K
Mg
H
Rest
Erdmantel (ä
(äußere) 3000 km ähnlich.
Häufigste Verbindungen:
SiO2, Silikate, AlAl-, EisenEisen-Oxide,
Carbonate, Sulfate, Hydroxide
Fe
Si
Ni
O
S
Rest
Der Erkern (innere 3000 km)
besteht hauptsä
hauptsächlich aus Eisen
(2900°
°
C,
flü
(2900
flüssig). Fe/NiFe/Ni-KonvekKonvektion am Mantel ⇒Magnetismus
Seite 11
Abgrenzung Chemie-Physik
Physik: Lehre der ZustandsZustandsänderung der Stoffe
Chemie: Lehre der Verä
Veränderung
und
Umwandlung
der
Stoffe
Beispiel:
Eisen: Metallisch, glä
glänzend, leitfä
leitfähig, schmiedbar.
Eisen erhitzen ⇒ schmilzt
Eisen an feuchter Luft ⇒ rostet
abkü
abkühlen ⇒ erstarrt.
Rost: RotRot-braun, nicht leitfä
leitfähig
Eigenschaften unverä
unverändert.
nicht verformbar.
Umkehrbare Zustandsä
Zustandsänderung
⇒ Stoffliche Umwandlung
Weiteres Beispiel:
Magnesiumband erhitzen ⇒
Platindraht erhitzen bis rotrotverbrennt mit Leuchterscheinung
glü
glühend; Abkü
Abkühlen: keine Verä
Veränd.
nd.
⇒ Magnesiumoxid (weiß
Lichtemission: Physikal.
weißes Pulver)
Pulver)
Physikal. Vorgang.
⇒ stoffliche Verä
Veränderung
Letztes Beispiel:
Starkes Abkü
Abkühlen ⇒ Verflü
Verflüssigung
Im Kö
Körper eingeatmeter SauerSauervon Luft; Langsames Erwä
Erwärmen
stoff "verbrennt" Zucker zu
(Destillation) ⇒ Trennung von
Kohlendioxid und Wasser.
Stickstoff und Sauerstoff
Energie wird frei.
Eigenschaften unverä
unverändert.
Chemischer Vorgang.
Verflü
Verflüssigung, Verdampfen, Destillation, Verbrennung, Oxidation etc.
Extraktion sind physikalische Vorgä
Vorgänge sind chemische Prozesse
Seite 12
6
Die Chemische Reaktion
Eine chemische Reaktion ist der Vorgang, bei dem aus den Atomen
der Ausgangsstoff (Edukte
(Edukte)) – auch Reaktanden genannt –
neue chemische Verbindungen (Produkte) entstehen.
Reaktionsschema: Edukt 1 (+ Edukt 2)
Produkt 1 + (Produkt 2)
Dabei ändert sich die Art der Verbindung der Atome untereinander –
ihre jeweilige Anzahl bleibt jedoch gleich.
Bei jeder chemischen Reaktion bleibt
die Gesamtmasse der Stoffe erhalten
Gesetz von der Erhaltung der Masse
Antoine Lavoisier
fr. Chem. (1743-1794)
Seite 13
Chemische Reaktion
Beispiel: Natriumchlorid
Beispiel:
Chlor
Natrium (Metall)
Kochsalz (NaCl)
+
Chemische Reaktion bedeutet eine "Umorganisation" der Atome.
Es entstehen andere chemische Verbindungen
mit vollkommen anderen Eigenschaften
Welcher Stoff reagiert mit welchem anderen Stoff
zu welcher Verbindung und in welchem Verhä
Verhältnis?
Seite 14
7
Elementarteilchen
Die Materie besteht aus Atomen;
Atome bestehen wiederum aus drei verschiedenen Elementarteilchen:
Elementarteilchen:
+
0
-
Proton (p+): groß
groß, schwer (relativ!), positiv
Neutron (n): groß
groß, schwer (relativ!),
neutral = ungeladen
Elektron (e-): klein, leicht, negativ
Seite 15
Chemische Reaktion
Beispiel: Knallgasreaktion
Wasserstoff (im Ballon) und Sauerstoff
(in der Luft) reagieren zu Wasser.
Reaktionsgleichung:
2 H2 + O2
2 H2O
2 Molekü
Moleküle Wasserstoff reagieren
mit einem Molekü
Molekül Sauerstoff
zu 2 Molekü
Molekülen Wasser.
Ein Wassermolekü
Wassermolekül (H2O) besteht aus 2 Atomen Wasserstoff und 1 Atom
Sauerstoff. Man muss doppelt so viele HH-Atome wie OO-Atome in die
Reaktion einbringen. Gasfö
Gasförmige Elemente sind 22-atomige Molekü
Moleküle.
2-atomige
2-atomiges
Wasserstoffmolekü
Sauerstoffmolekül
Wasserstoffmoleküle Sauerstoffmolekü
2 Wassermolekü
Wassermoleküle
Edukte (links) und Produkte (rechts) bestehen aus der selben Anzahl
der jeweiligen Atomsorte. Materie entsteht nicht und geht nicht verloren.
Seite 16
8
Fragestellung bei
chemischen Reaktionen
Aufklärung der chemischen Reaktion:
• qualitativ: Was reagiert mit wem zu welchem Produkt?
Warum verbinden sich Wasserstoff- und Sauerstoffatome
im Wasser im Verhältnis 2:1 (Stöchiometrie),
Natriumatome und Chloratome im Kochsalz aber 1:1?
• quantitativ: Wie viel Ausgangsstoffe (Edukte) muss man jeweils
einsetzen und wie viel Produkt bekommt man?
"Wie viel" in Gramm, Liter oder Atome bzw. Moleküle?
Achtung: die Atome bzw. Moleküle sind unterschiedlich schwer!
Seite 17
Das Periodensystem
Elementvorhersage von Mendelejew
Ga
Dimitri Mendelejew
Periodensystem
(1869)
Eigenschaften von Gallium (Ga)
Vorhersage
Beobachtet
Atommasse
~ 68
69,72
Dichte
~ 5,9 g/cm3
5,91 g/cm3
Schmelzpunkt ~ 30°C
29,8°C
Oxid
X2O3
Ga2O3
Chlorid
XCl3
GaCl3
Seite 18
9
Das Periodensystem der Elemente (PSE)
Die Elemente sind im PSE nach steigender Ordnungszahl Z angeordnet.
Beim Element Z+1 tritt im Kern ein Proton, in der Hülle ein e- hinzu.
Die Ordnungszahl Z gibt auch Auskunft über die Anzahl e- in der Hülle.
Seite 19
Aufbau des PSE
Hauptgruppennummer
= Valenzelektronenzahl
Gruppen
I.
Perioden
1.
2.
3.
4.
5.
6.
7.
VIII.
III. IV. V. VI. VII.
II.
La
Ac
Seite 20
10
Metalle, Halbmetalle, Nichtmetalle
Der metallische Charakter der Elemente nimmt im PSE
von links unten nach rechts oben ab.
Seite 21
Elementgruppen
Übergangsmetalle
Seite 22
11
Kurzcharakteristik der Hauptgruppen
VII. Halogene:
Halogene: alle NiMe
F/Cl (g), Br (l), I (s)
reaktiv; Salzbildner
VIII. Edelgase:
Edelgase: alle gasfö
gasförmig;
sehr reaktionsträ
reaktionsträge;
ge;
Spuren in Luft.
I. Alkalimetalle:
Alkalimetalle: weiß
weißsilbrige, niedigniedig-schm.,
schm.,
weiche Metalle. Sehr reaktiv,
reaktiv, in d. Natur
nur in Verbindung, nicht elementar.
elementar.
II. Erdalkalimetalle:
Erdalkalimetalle: wie Alkalis, aber
weniger reaktiv (Lagerung an Luft).
III. Borgruppe:
Borgruppe: B hartes Nichtmetall,
Al→
Al→Tl weiche Metalle. AlAl-Verbindungen
häufig in der Erdrinde.
IV. Kohlenstoffgruppe:
Kohlenstoffgruppe: C, Si, Ge = NiMe
Sn, Pb Met.; untersch.
untersch. Eigenschaften.
Si hä
häufig in Erdrinde (Quarz);
C → Naturstoffe; Pb hohe Dichte.
V. Stickstoffgruppe:
Stickstoffgruppe: N=NiMe (gasfö
(gasförmig)
P/As Met. und NiMe Modifikationen,
Sb/Bi=Met.;
Sb/Bi=Met.; N Hauptbest.teil Luft 78%
VI. Chalkogene:
Chalkogene: O gasf.
gasf. NiMe,
NiMe, lebenslebenswichtig: Wasser/Luft (20%).
S gelb,fest NiMe;Se,Te,Po auch met.
Seite 23
Kontrollfragen/-aufgaben
• Mit welchen Methoden lassen sich Stoffgemische trennen?
• Was sind Reinstoffe? Was sind Elemente? Was Verbindungen?
• Woraus besteht Luft hauptsä
hauptsächlich?
• Welches sind die drei hä
häufigsten Elemente in der Erdkruste?
• Nennen Sie die ersten 10 Elemente.
• Nennen Sie 10 Metalle und 8 Nichtmetalle.
• Nennen Sie 2 Halogene, 2 Alkalimetalle, 2 Edelgase
• Aus welchen Elementen ist Kochsalz aufgebaut?
Seite 24
12
Bindungswertigkeit
und Periodensystem
Wie viele Bindungen kann ein Atom zu anderen Atomen ausbilden?
In welchem Verhä
Verhältnis binden sich zwei Elemente zu einer Verbindung?
I.
II.
Gruppe⇒
Periode ⇓ Alkali Erdalkali
1.
H
III.
IV.
V.
Vl.
VII.
VIII.
Chalkogene Halogene Edelgase
He
2.
Li
Be
B
C
N
O
F
Ne
3.
Na
Mg
Al
Si
P
S
Cl
Ar
4.
K
Ca
Br
Kr
Bindigkeit:
1
2
1
0
3
oft 4
oft 3
meist 2
Zweibindiger Sauerstoff (O) bindet zwei einbindige Wasserstoff (H)=H2O
In welchem
Verhä
Verhältnis
verbinden sich
die jeweiligen
Elementpaare?
Na
F
Ca
Cl
K
O
Li
S
H
S
H
N
H
C
O
Na
He
Al
Br
Al
S
Mg
I
Mg
O
C
Woher kommt
die unterunterschiedliche
Bindigkeit?
Bindigkeit?
Seite 25
Atombau – Frühe Atommodelle
Prousts Gesetz der konstante Proportionen (1794):
Elemente kommen in einer chemischen Verbindung immer im gleichen
Massenverhä
Massenverhältnis vor. z. B. Natriumchlorid: Na:Cl = 23:35 = 1:1,54
Daltons Gesetz der multiplen Proportionen (1803):
Die Massenanteile von zwei Elementen in verschiedenen Verbindungen
können durch kleine, ganze Zahlen ausgedrü
ausgedrückt werden.
Z. B.: Kohlenmonoxid mC:mO=1:1,33 ; Kohlendioxid mC:mO=1:2,66
mO(Kohlenmonoxid):mO(Kohlendioxid)
(Kohlendioxid) = 1:2 ⇒ CO und CO2
Daltons Atomhypothese (180
8):
(1808):
• Materie besteht aus kleinsten kugelfö
kugelförmigen Teilchen oder Atomen.
• Atome sind unteilbar, kö
können weder geschaffen, noch zerstö
zerstört werden.
• Alle Atome eines chemischen Elements sind untereinander gleich,
sie unterscheiden sich nur in der Masse von Atomen anderer Elemente.
Elemente.
• Atome kö
können chem. Bindungen eingehen und aus d. gelö
gelöst werden.
• Eine Verbindung wird stets aus gleichen Anzahl von Atomen
der Elemente gebildet.
Seite 26
13
Rutherfordsches Atommodell
Ein Atom hat einen positiven Atomkern (Nukleus),
der von einer negativen Elektronenhü
Elektronenhülle umgeben ist.
Z=3
Lithium
Protonen und Neutronen sind
im Kern (⇒
(⇒Nukleonen).
Nukleonen).
Neutronen: keine Ladung,
Protonen: Ladung = +1 ⇒
Protonenzahl = Kernladungszahl
=Ordnungszahl (Z) im Periodensys.
Periodensys.
Die Anzahl der Protonen bestimmt, welches Element es ist.
Atomdurchmesser ca. 10-10 m, davon Kern 1/100000:
Kern: winzig, schwer, positiv
Hülle: "größ
er", leicht, negativSeite 27
"größer",
Atommasse
Nukleonenzahl (Protonen + Neutronen)= Atommasse (m
(ma),
da Elektronen sehr geringe Masse haben.
Die Anzahl der Protonen bestimmt, welches Element (Atomsorte)
es ist. (= Ordnungszahl Z)
Die Anzahl der Neutronen N plus der Protonen Z bestimmt,
welche Masse das Atom hat. (Atommasse ma = Z + N)
Beispiel: Lithium
3 Protonen ⇒ Ordnungszahl Z = 3
4 Neutronen ⇒ Massezahl = 7
Seite 28
14
Elementsymbolik
Ein Element ist ein so genannter "Reinstoff", der nur aus
einer Atomsorte - mit einer best. Ordnungszahl Z – besteht.
Elemente werden durch das Elementsymbol dargestellt,
ein Kü
Kürzel aus dem – häufig lateinischen – Namen.
Manchmal werden OrdnungsOrdnungs- und Massezahl mit angegeben:
7
ma
Beispiel: Lithium
Z
3
Li
Elementsymbol
Elementname
Protonen Z
Neutronen N
Wasserstoff
1
0
Kohlenstoff
6
6
Uran
92
146
Symbol
1
1
12
6
238
92
H
C
U
Seite 29
Übung: Massen-/Ordnungszahl
Aufgabe zu Atombau:
Die folgende Tabelle ist zu ergänzen:
Element
symbol
Ordnungs-zahl
Massenzahl
H
1
1
Zahl der
Protonen
He
7
Li
F
Fe
9
Zahl der
Neutronen
Zahl der
Elektronen
2
2
4
19
56
Au
30
118
79
Hilfe:
Ordnungszahl = Protonenzahl = Elektronenzahl
Atommassenzahl = Protonenzahl + Neutronenzahl
Seite 30
15
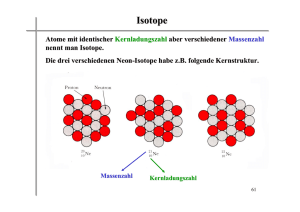
Isotope
Isotope sind Atome gleicher Ordnungszahl,
Ordnungszahl,
aber verschiedener Massenzahl.
Massenzahl.
Sie enthalten also die gleiche Anzahl an Protonen,
Aber unterschiedlich viele Neutronen.
Beispiele:
2
1
Deuterium: 1 H
Wasserstoff: 1 H
12
13
Häufigkeit; 6 C ~1%
Kohlenstoff: 6 C ~99% nat. Hä
14
Spuren von 6 C ; instabil ⇒ radioaktiv
(Altersbestimmung mit Radiocarbonmethode)
Radiocarbonmethode)
235
Uran: 92 U spaltbar; 238U nicht spaltbar, beide radioaktiv
radioaktiv
92
Isotope verhalten sich chemisch gleich (Molekü
(Molekülbildung),
aber physikalisch unterschiedlich (Masse)
Seite 31
Nicht ganzzahlige Atommasse
Viele Elemente besitzen eine nicht ganzzahlige Atommasse,
weil sie aus einem Isotopengemisch bestehen.
Beispiel:
Beispiel: Chlor, Atommasse 35,45 u
besteht aus:
Rechnung:
- 35Cl: 75,7%
- 37Cl: 24,2% 0,757 ⋅ 35u + 0,242 ⋅ 37u
= 35,45u
Elemente, die nur in einer stabilen Atomsorte (isotopenrein)
vorkommen, nennt man Reinelemente.
Reinelemente.
Beispiel:
Beispiel: 19Fluor
Seite 32
16
Die Chemische Bindung
Wenn Atome chemische Verbindungen eingehen, dann
ändern sich ihre chemischen und physikalischen Eigenschaften.
Beispiel: Natrium (Metall)
Chlor
Kochsalz (NaCl)
+
Arten der chemischen Bindung:
NichtmetallNichtmetall- Metall mit NichtNicht- Metall mit
Nichtmetall
metall (oft)
Metall
Atombindung Ionenbindung Metallbindung
Moleküle
z. B. H2O
Salze
Metalle (Legierung)
+
z.B. Na Cl z. B. Bronze
Seite 33
Metallbindung
In Metallen ordnen sich die Atome regelmäß
ig an. Die Atomkerne
regelmäßig
nehmen einen festen Platz ein. Die Valenzelektronen bewegen
sich frei zwischen den Atomrü
Atomrümpfen (⇒
(⇒ "Elektronengas")
Dadurch erhalten Metalle
ihre hohe elektrische und
thermische Leitfä
Leitfähigkeit.
Metallbindung besteht zwischen
den Atomen eines reinen Metalls,
oder in einer Mischung von zwei
oder mehr Metallen (Legierung).
Wichtige Legierungen: Bronze = Kupfer/Zinn; Messing= Kupfer/Zink
Rotgold=Gold/Kupfer;
Rotgold=Gold/Kupfer; Weiß
Weißgold=Augold=Au-Ag/Ni/Pd
Amalgam: meist Quecksilber/Silber
Quecksilber/Silber
Seite 34
17
Ionenbindung (Salzbindung)
Ionisierung
Wenn Atome Elektronen aufnehmen oder abgeben, entstehen Ionen:
Kationen sind Ionen mit positiver Ladung,
- e- Na+
Na
sie haben also Auß
Außenelektronen abgegeben.
Anionen nehmen im Gegenzug Elektronen
in ihre äußerste Schale auf
F + e Fund sind negativ geladen.
Kernladungszahl ändert sich nicht. Masse ändert sich nicht wesentlich.
Ob ein Atom dazu neigt, ein Elektron abzugeben oder aufzunehmen,
hängt mit der damit verbundenen Änderung seiner Energie zusammen:
Es strebt immer den niedrigsten Energiezustand an.
Seite 35
Salze, Ionengitter
Salze sind Feststoffe, die aus Ionen bestehen (Ionenbindung).
Kationen (+) und Anionen ((-) ziehen sich durch elektrostatische
Krä
Kräfte an. Dadurch entsteht ein Ionengitter,
Ionengitter, in dem die Ionen in
regelmäß
iger Reihefolge angeordnet sind.
regelmäßiger
Solche Ionenkristalle haben sehr hohe Schmelzpunkte.
Beispiel: NaCl-Kristall (Ausschnitt)
jedes Ion ist oktaedrisch von
sechs Gegenionen umgeben
Mit Berücksichtigung
der Ionenradien
Seite 36
18
Chemische Formeln für Salze
Salzkristalle zeigen nach auß
außen elektrische Neutralitä
Neutralität.
Das Kristallgitter ist nicht aus gleichartigen, abgegrenzten Molek
ülen
Molekü
aufgebaut, sondern es handelt sich um eine Endlosstruktur.
Endlosstruktur.
Ihre Zusammensetzung wird durch die chemische Formel beschrieben,
beschrieben,
als ein bestimmtes Zahlenverhä
Zahlenverhältnis von Kationen und Anionen.
Anionen.
Da die Kationen und Anionen einen unterschiedlichen Ladungsbetrag
tragen kö
können, muss auch ihr Verhä
Verhältnis nicht 1:1 sein.
Allgemeine Zusammensetzung:
{x⋅Ay+ y⋅Bx-} = AxBy ←Summenformel
x bzw. y = 1 wird weggelassen
Beispiele:
Ionen im Salz
so kombiniekombinieren,
ren, dass sich
die Ladungen
aufheben.
Elemente
Ionen mit
Formel
in Verbindung Elektronenoktett
Na
Br
Na+
BrNaBr
{Na+Br-}
S
K+
S2-
Ca
O
Ca2+
Ba
Cl
Al
Al
K
Name
des Salzes
Natriumbromid
K2 S
{2K+S2-}
Kaliumsulfid
O2-
CaO
{Ca2+O2-}
Calciumoxid
Ba2+
Cl-
BaCl2
{Ba2+2Cl-} Bariumchlorid
F
Al3+
F-
AlF3
{Al3+3F-}
O
Al3+
O2-
Al2O3 {2Al3+3O2-} Aluminiumoxid
Aluminiumfluorid
Seite 37
Die Elektronegativität (EN)
Die individuelle Anziehungskraft der Atome eines Elementes auf die
die
Bindungselektronen in einer (AtomAtom-)Bindung heiß
heißt Elektronegativitä
Elektronegativität (EN)
I
II
III
IV
V
VI
VII
H
2,20
VIII
He
Li
Be
0,97 1,47
B
C
N
O
F
2,01 2,50 3,07 3,50 4,10
Ne
Na
Mg
1,01 1,23
Al
Si
P
S
Cl
1,47 1,74 2,06 2,44 2,83
Ar
K
Ca
0,91 1,04
Ga
Ge
As
Se
Br
1,82 2,02 2,20 2,48 2,74
Kr
Rb
Sr
0,89 0,99
In
Sn
Sb
Te
I
1,49 1,72 1,82 2,01 2,21
Xe
Die EN nimmt im PSE
von links unten nach
rechts oben zu.
AlkaliAlkali- (I. HG) und ErdErdalkalimetalle (II. HG)
elektropositiv. ⇒
Ionenbindungen zu
Halogenen (7. HG) und
Chalkogenen (6. HG)
wichtig:
Hal > O >> C > H
Je größ
er ENgrößer
EN-Differenz desto polarer die Bindung; ∆EN>1,5 ⇒ ionisch
Verbindungen zwischen AlkaliAlkali-/Erdalkalimetallen und Chalkogenen
bzw. Halogenen sind ionisch.
Seite 38
19
Atombindung
= kovalente Bindung
Atome mit kleiner ENEN-Differenz bilden gemeinsames Elektronenpaar
aufgrund der ähnlich starken Anziehungskrä
Anziehungskräfte auf die Elektronen.
Elektronenhü
Elektronenhüllen zweier Atome überlappen ⇒
Atombindung = kovalente Bindung.
Bindung. ⇒ Molekü
Moleküle
+
+
+ +
+
H-Atome
H2-Molekü
Molekül
Beispiele:
Beispiele: Verbindung
Summenformel
+
: :
: :
Strukturformel
H:H
H-H
Wasserstoff
H2
H-F *
H-F :
Fluorwasserstoff HF
O ::
O
Wasser
H2O
H H H H
* H immer kovalent gebunden, da kein freies H+ (=Elementarteilchen)
Valenzelektronen, die nicht fü
für bindende Elektronenpaare gebraucht
werden, bilden freie Elektronenpaare.
Elektronenpaare.
Atome folgen der Oktettregel,
Oktettregel, sie fü
füllen ihre Valenzschale mit 8 Elektr.
Elektr
Seite.39
Doppelbindung
Neben der einfachen Atombindung aus einem Elektronenpaar
treten manchmal auch Doppelbindungen auf,
die aus zwei Elektronenpaaren (also 4 Elektronen) bestehen.
Sie wird durch zwei parallele Striche dargestellt.
Solche Doppelbindungen werden besonders von den Atomen des
Kohlenstoff und Sauerstoff gebildet.
Beispiel:
Beispiel: Kohlendioxid
Überprü
berprüfen Sie die Zahl der Valenzelektronen
des Kohlenstoff und des Sauerstoff, die Bindungen
oder freie Elektronenpaare bilden.
Überprü
berprüfen Sie ob die KohlenstoffKohlenstoff- und SauerstoffSauerstoffatome die Oktettregel erfü
erfüllen, wenn man ihnen
jeweils alle Bindungselektronen zurechnet.
O=C=O
Seite 40
20
Polare Atombindung
Unterscheiden sich die EN der Bindungspartner eines Molekü
Moleküls,
bildet sich eine polarisierte Atombindung aus (∆
(∆EN>0,4).
EN>0,4).
Hierbei wird das gemeinsame Elektronenpaar stä
stärker von dem
elektronegativeren Atom angezogen.
Es bilden sich Teilladungen,
Teilladungen, und ein permanenter Dipol.
Dipol.
δ+ δ-
H Cl
H Cl
EN: 2,2 2,8
Dipolmoment
H
_
H
δ+
+
δ-
Wassermolekü
Wassermolekül: polar,gewinkelt
⇒ Dipol
O
EN (H): 2,2
δO
δ+
C+
δ
O
EN (O): 3,5
δ-
Kohlendioxid: etwas polar,
aber symmetrisch ⇒ kein Dipol
Seite 41
Spaltung von Atombindungen
Chemische Bindungen kö
können durch den Einfluss von Energie
(Wä
(Wärme, Strahlung, etc.) gespalten werden.
Häufig reagieren die Spaltprodukte danach weiter.
Man unterscheidet:
Homolyse:
Homolyse: Spaltung einer unpolaren Atombindung in zwei Radikale:
Radikale sind Atome oder Molekü
Moleküle, die ein freies (ungepaartes)
Elektron besitzen. Sie sind äußerst reaktiv und kurzlebig.
Licht
Startreaktion fü
für ChlorChlorBeispiel: Cl Cl
Cl + Cl knallgasknallgas-Reaktion
Heterolyse:
Heterolyse: Spaltung einer polaren Atombindung in Kation + Anion :
H
O
H
Cl
H O⊕ H
H
+ Cl
H
δδ+
Ein Proton H+ wird übertragen (spä
(später Sä
Säureure-BaseBase-Reaktion)
Seite 42
21
Bohrsches Atommodell
Schale
K
Die Elektronen umkreisen den Kern auf konzenkonzentrischen Bahnen (Schalen). Die Anziehung durch
K;n=1
den Kern wird durch Zentrifugalkraft ausgeglichen.
L;n=2
Die Elektronen haben unterschiedliche Energien,
Kern
M;n=3 je nachdem, in welcher Schale sie sich befinden.
Die Schalen werden von innen
(am energieä
energieärmsten) nach
HauptElektroauß
ß
en
mit Elektronen befü
au
befüllt.
nenzahl
Qz n
Jede Schale kann nur eine best.
1
2
Anzahl Elektronen aufnehmen:
L
2
8
M
3
18
N
4
32
2 ·n 2
Bei den schwersten Atomen
sind 7 Energieniveaus besetzt.
Nur die Elektronen der äußersten (Valenz(Valenz-) Schale
sind an Bindungen zu anderen Atomen beteiligt.
Niels Bohr,
dän. Phys.
Atommodell 1913
Nobelpreis 1922
Seite 43
Besetzung der Schalen/Energieniveaus
mit Elektronen (Elektronenkonfiguration)
Element
Z
H
1
K n=1
max. 2
1
L n=2
max. 8
M n=3
max 8+10
He
2
2
Li
3
2
1
Be
4
2
2
F
9
2
7
Ne
10
2
8
Na
11
2
8
1
Mg
12
2
8
2
Cl
17
2
8
7
Ar
18
2
8
8
N n=4
Abgeschlossene Schalen Die Anzahl an Valenzelektronen
bestimmt das chem. Verhalten!
Valenzelektronen
Seite 44
22
Abgeschlossene Schale
Edelgaskonfiguration
Entscheidend fü
für das chemische Verhalten der Elemente ist
die Anzahl an Valenzelektronen, d.h. e- der äußersten Schale
Voll besetzte abgeschlossene Schale energetisch gü
günstig.
Die Elemente, die eine abgeschlossene Schale besitzen
(18. Gruppe, He, Ne, Ar, etc.) gehen deshalb
keine chemischen Reaktionen mit anderen Atomen ein.
Da sie allesamt Gase sind, nennt man sie Edelgase.
Edelgase.
Eine Elektronenkonfiguration mit abgeschlossener Schale
nennt man Edelgaskonfiguration.
Die Atome der anderen Elemente kö
können ihre Energie
verringern durch Elektronenabgabe oder – aufnahme
in chemischer Reaktion.
Seite 45
Oktett-Regel - Edelgaskonfiguration
Als Oktett wird eine Elektronenkonfiguration bezeichnet,
in der die äußere Elektronenschale eines Atoms mit 8 Elektronen
besetzt ist. Edelgase besitzen diese Konfiguration (auß
(außer He=2).
Die sog. Edelgaskonfiguration ist energetisch besonders gü
günstig.
EdelgasEdelgaskonfiguration:
konfiguration:
Die Oktettregel besagt,
dass Atome oft Ionen oder
Molekü
Moleküle bilde, in denen sie
8 Valenzelektronen besitzen,
und so die stabile EdelgasEdelgaskonfiguration erreichen.
-e-
+e-
+
Seite 46
23
Weitere Beispiele
zur Elektronenkonfiguration
Natrium (19K, Alkali) gibt 1 e- ab, wird zum K+-Ion,
Ion,
das die gleiche Elektronenkonfiguration hat wie Argon 18Ar.
Natü
Natürlich verhä
verhält es sich chemisch und physikalisch trotzdem
vollkommen anders (andere Protonenzahl).
Die gleiche Elektronenkonfiguration erhä
erhält Chlor (17Cl, Halogen),
wenn es ein e- aufnimmt und zum Cl- (Chlorid(Chlorid-Ion) wird.
Ähnliches geschieht, wenn Calcium (20Ca, Erdalkali)
zwei e- abgibt und zum Ca2+ wird, bzw. 16S + 2 e- → S2-:
⇒ gleiche Elektronenkonfiguration wie 18Ar
Durch die Elektronenaufnahme bzw. –abgabe erreichen
die Teilchen eine energetisch gü
günstige, abgeschlossene
Schale (Edelgaskonfiguration).
Seite 47
Valenzelektronenkonfiguration
und Periodensystem
I.
II.
Gruppe⇒
Periode ⇓ Alkali Erdalkali
1.
H
III.
IV.
V.
VII.
Vl.
VIII.
Chalkogene Halogene Edelgase
He
2.
Li
Be
B
C
N
O
F
Ne
3.
Na
Mg
Al
Si
P
S
Cl
Ar
4.
K
Ca
Br
Kr
Valenzelektronen:1
2
In welchem Verhä
Verhältnis
binden sich die
Elementpaare?
Ist die Bindung
ionisch oder
kovalent?
kovalent?
3
4
5
6
7
H
Br
Si
H
N
H
Mg
Cl
C
S
Na
He
Na
O
Rb
S
Al
F
Al
O
S
Cl
Sr
Cl
Be
O
8
Seite 48
24
Gängige Moleküle und Verbindungen
Nichtmetalle bilden miteinander Molekü
Moleküle aus über Atombindungen
Welche Verbindungen (Strukturformel) bildet Wasserstoff mit:
• Fluor, Chlor, Brom, Iod?
Iod?
• Sauerstoff, Schwefel, Stickstoff, Kohlenstoff?
Welche Verbindungen (Strukturformel) bildet
•Kohlenstoff mit Sauerstoff?
•Schwefel mit Chlor?
Seite 49
Weitere Reaktionsgleichungen
Stickstoff reagiert mit
N2 + 3H2→ 2NH3
Wasserstoff zu Ammoniak
Berü
Berücksichtigen Sie die molekulare Struktur von StickStick- und Wasserstoff
Die stö
stöchiometrischen Faktoren,
Faktoren, d. h. die molaren Verhä
Verhältnisse,
in denen Stickstoff und Wasserstoff mit einander reagieren
und in dem Ammoniak entsteht, ergeben sich aus
der molekularen Zusammensetzung des Ammoniak
1 Molekü
Molekül Stickstoff reagiert mit 3 Molekü
Molekülen Wasserstoff
zu 2 Molekü
Molekülen Ammoniak
Seite 50
25
Maßeinheiten in der Chemie (SI)
Messgröße
Länge
Masse
Volumen
Dichte
Stoffmenge
molare Masse
(Stoffmengen-)Konzentration =
Molarität
Kraft, Gewicht
Energie
Reaktions-Enthalpie
(absolute) Temperatur
Reaktions-Entropie
Symbol
l
m
V
Druck
p
ρ
n
M
c
F
E
∆H
T
∆S
Einheit
Meter
Gramm (Kilogramm)
Liter
Gramm pro cm3
Mol
Masse pro Mol; M = m/n
Stoffmenge pro Volumen;
c = n/V
Newton
Joule
Kilojoule pro Mol
Kelvin
Enthalpie pro Temperatur; ∆S =
∆H/T
Pascal
Symbol
m
g (kg)
l
g/cm3
mol
g/mol
mol/l
N = kg·m/s2
J = kg·m2/s2
kJ/mol
K
kJ/mol·K
Pa = N/m2
Seite 51
Die Masse von Molekülen
Die Masse eines einzelnen Molekü
Moleküls mM einer chemischen
Verbindung errechnet sich als die Summe der Atommassen ma
aller im Molekü
Molekül enthaltenen Atome.
Beispiel: Glucose (Traubenzucker) C6H12O6
Die tief gestellten Indexzahlen geben an, wie viel Atome
der jeweiligen Sorte das Molekü
Molekül enthä
enthält.
mM = 6·
6·ma(C)
(C) + 12·
12·ma(H) + 6·
6·ma(O)
ma(C)
(C) = 12 u
ma(H)
(H) = 1 u
ma(O)
(O) = 16 u
mM (Glucose) = 6·
6·12u + 12·
12·1u + 6·
6·16u = 180 u
Seite 52
26
Die Stoffmenge, das Mol
u beschreibt Masse einzelner Atome bzw. Molekü
Moleküle.
Die Stoffmenge n in der Einheit [mol] ist eine neue Messgröß
e,
Messgröße,
die Mengen von Stoffen und das Verhä
Verhältnis in dem sie mit einander
reagieren in laborgebrä
enordnungen beschreibt.
laborgebräuchlichen Größ
Größenordnungen
n ist keine Masse und keine Teilchenzahl
– hängt aber mit beidem zusammen:
Die Stoffmenge n ist gleich der Masse m bezogen auf
die Molare Masse M. Diese Molmasse M ist eine stoffstoffspezifische Größ
e und hat die Einheit [g/mol]
Größe
Ein Mol eines Stoffes oder einer Verbindung entspricht der jeweiligen
jeweiligen
Atommasse oder Molekü
Molekülmasse ausgedrü
ausgedrückt in Gramm.
n=
m
M
Beispiele:
Atom-/Molekülmasse
Li = 7 u
H2O = 18 u
H2 = 2 u
C6H12O6 = 180 u
Molare Masse M
M(Li) = 7 g/mol
M(H2O) = 18 g/mol
M(H2) = 2 g/mol
M(C6H12O6) = 180 g/mol
Ein Mol Li wiegt 7 g, ein Mol Wasser 18 g; 2 Mol Wasser wiegen 36
36 g.
Seite 53
Veranschaulichung des Mol
Die Stoffmenge 1 Mol enthä
enthält immer die gleiche Teilchenzahl, die
Loschmidtsche bzw. Avogadrosche Zahl oder Avogadrokonstante NA:
NA = 6·
6·1023 Teilchen ⇒ 1mol
Wie viel wiegt
23
1 mol Wasser?
Darstellung: Ein Teilchen = 10 Teilchen
1 mol Wasser
1 mol Lithium 1 mol Wasserstoff
6·1023 Atome 6·1023 Molekü
6·1023 Molekü
Moleküle
Moleküle
(7 g)
(2 g)
(2+16 = 18 g)
Wie viel wiegen 4 mol Kohlenstoff?
und 1 mol C ?
1 mol Kohlenstoff
6·1023 Atome
(12 g)
4 mol Kohlenstoff
4·6·1023 Atome
(48 g)
Seite 54
27
Rechnen mit der Stoffmenge n
Mit Hilfe der Molaren Masse M (in g/mol) kann man die Masse m (in g)
und die Stoffmenge n (in mol) in einander umrechnen:
M=
m = M ⋅n
m
n
Umformung
n=
Beispiele:
Wie viel Gramm wiegen 0,2 mol Glucose?
m
M
m = 180 g / mol ⋅ 0,2mol = 36 g
5,85 g Kochsalz (NaCl) entsprechen wie viel Mol?
mA(Na)
(Na) = 23 u; mA(Cl)
(Cl) = 35,5 u ⇒ MNaCl= 58,5 g/mol
n=
5,85 g
= 0,1mol
58,5 g / mol
Seite 55
Veranschaulichung Stöchiometrie
und Molare Massen
2 H2 + O2
2 zweiatomige
Sauerstoffatom (O):
8 P+;8 N⇒ma=16 u
2 H2O
1 zweiatomiges 2 Wassermolekü
Wassermoleküle
Wasserstoffmolekü
Wasserstoffmoleküle Sauerstoffmolekü
Sauerstoffmolekül
Wasserstoffatom (H):
1P+⇒ ma = 1u
mH2O = 16+2=18u
Ein Wassermolekü
Wassermolekül (H2O) besteht aus 2 Atomen Wasserstoff und 1 Atom
Sauerstoff. Man muss doppelt so viele HH-Atome wie OO-Atome in die
Reaktion einbringen. Gasfö
Gasförmige Elemente sind 22-atomige Molekü
Moleküle.
Molare Massen: M(H2)=2 g/mol; M(O2)=32 g/mol; M(H2O)=36 g/mol
Wasserstoff +
Sauerstoff =
Wasser
2 Moleküle (2⋅2u=4u )
1 Molekül (2⋅16u=32u) 2 Molekül (18u)
2000 Moleküle
1000 Moleküle
2000 Moleküle
2 mol (2 ⋅6 ⋅1023 Moleküle) 1 mol (6⋅1023 Moleküle) 2 mol (6⋅1023 Moleküle)
4g
+
32 g
=
Erhaltung der Masse!
36 g
Seite 56
28
Die Lösung
Eine Lö
Lösung ist ein homogenes Gemisch aus zwei oder mehr
verschiedenen Stoffen.
Geben Sie Beispiele fü
für Lö
Lösungen!
NichtNicht-homogene = Heterogene Gemische haben unterschiedliche
Phasen mit unterschiedlichen Eigenschaften an verschiedenen Stellen
Stellen
(Nicht aufgelö
aufgelöster Zucker in Caipi,
Caipi, Kaffeebodensatz etc.)
Durch das Lö
Lösen eines Stoffes in einem Lö
Lösungsmittel verä
verändert sich
seine Eigenschaft (z. B. man sieht ihn nicht mehr),
Die Lö
Lösung hat andere Eigenschaften, als das reine Lö
Lösungsmittel
Seite 57
Massenkonzentration
Wie kann man erreichen, dass der Kaffee immer gleich süß
süß ist?
Die Massenkonzentration gibt an, wie viel Masse (g) eines Stoffes
Stoffes
in einem Liter Lö
Lösungsmittel gelö
gelöst ist.
Beispiele fü
für Lö
Lösungen:
• Kochsalz in Wasser
• Zucker im Kaffee
• Farbkonzentrat in weiß
weißer Wandfarbe
• Kohlensä
Kohlensäure in Mineralwasser
je mehr, desto salziger
je mehr, desto süß
er
süßer
je mehr, desto farbiger
je mehr, desto sprudelnder
Seite 58
29
Dichte – Konzentration - Molarität
Die Dichte eines Stoffes ρ ist seine Masse bezogen auf das Volumen:
ρ =mV
Die Konzentration c (eigentlich Stoffmengenkonzentration)
n
ist die Stoffmenge n (in mol) bezogen auf das Volumen V
c =
an Lö
Lösungsmittel (in L).
V
Die Molaritä
Molarität einer Lö
Lösung ist die Anzahl Mole des gelö
gelösten Stoffes
in 1 Liter Lö
Lösung.
Beispiel:
Beispiel:
2 mol einer Substanz sind gelö
gelöst
in 500 mL Lö
Lösungsmittel.
c=
2mol
= 4mol / L
0,5L
Beispiel:
Beispiel:
1,8 g Glucose sind gelö
gelöst in 100 ml Wasser.
n=
0,01mol
m
1,8 g
= 0,1mol / L
=
= 0,01mol = 10 − 2 mol c =
0,1L
M 180 g / mol
Seite 59
Stoffmengenkonzentration
Die Konzentration c (eigentlich Stoffmengenkonzentration)
n
ist die Stoffmenge n (in mol) bezogen auf das Volumen V
c =
an Lö
Lösungsmittel (in L) = Molaritä
Molarität eine Lö
Lösung
V
Je Kugel symbolisiert
9 mol
c =
= 9 mol / l
6,022·
6,022·1023 Teilchen
1l
= 1mol
Das Gefäß
Gefäß hat ein
n konstant
Volumen von V = 1 l
Volumen verdoppelt
Volumen konst.
Volumen
n verdoppelt n halbiert
halbiert
c = 18mol / l c = 4,5mol/ l
Übungen Tafel
c=
9mol
4,5mol
9mol
= 9mol/ l c = 1 = 18mol/ l
1 l
c=
= 4,5mol / l
2l
2
2l
Seite 60
30
Säuren/Basen
Allgemeines, Historisches
Der Begriffe Säure leitet sich vom Geschmack bestimmter
Substanzen ab (Essig, Zitrone).
Sie fä
färben bestimmte
Pflanzenfarbstoffe
(Rotkohl; Lackmus) rot.
(R. Boyle, 1663)
basisch
sauer Rotkohlsaft
Seifig schmeckende Substanzen, nannte man alkalisch (arab.:
arab.:
al kalja=Pottasche←Kaliumcarbonat).
Kaliumcarbonat). Lauge = alkalische Lö
Lösung
Spä
Später bezeichnete man sie auch als Basen,
Basen, weil sie zusammen
mit Sä
Säuren die Basis fü
für Salze sind.
Auch sie kö
können viele Pflanzenfarbstoffe verfä
verfärben.
Lavoisier (~1770) nahm an, dass Sä
Säuren Sauerstoff enthalten,
weil Nichtmetalloxide (z. B. CO2) mit Wasser Sä
Säuren bilden. Seite 61
Saurer Regen
Ursache fü
für den sauren Regen Die entstehenden Sä
Säuren schä
schädigen
sind die Oxide des Kohlenstoff, Pflanzen, Gewä
Gewässer und Gebä
Gebäude:
Stickstoff und Schwefel, die bei
der Verbrennung fossiler BrennBrennstoffe (Kohle, Erdö
ö
l,
Erdgas)
Erd
entstehen. Zusammen mit Wasser
ergeben sie Sä
Säuren:
Kohlenstoffdioxid:
• CO2 + H2O → H2CO3
Stickoxide:
• 2 NO2 + H2O → HNO2 + HNO3
Schwefeloxide:
• SO2 + H2O → H2SO3
• SO3 + H2O → H2SO4
1908
1968
Sandsteinfiguren im Ruhrgebiet
CaCO3+H2SO4→CO2+H2O+Ca2++SO42fest
gasf.
lö
gasf.
löslich
Seite 62
31
Säureure-Base Theorie von Brø
Brønsted
Umfassendere Säureure-BaseBase-Th.
Th. von Brø
Brønsted,
nsted, Lowry (1923):
Säuren: Protonendonatoren; Stoffe oder Teilchen,
die Protonen abgeben können.
Basen: Protonenakzeptoren; Stoffe oder Teilchen,
die Protonen aufnehmen können.
Joh.
Joh. N. Brø
Brønsted
dän.Chem.
n.Chem.
In Wasser bilden
Brø
Brønstednsted-Säuren
HydroniumHydronium-Ionen:
Ionen:
H-A +
O
H
Basen müssen Freies Elektronenpaar besitzen, um ein Proton
aufnehmen zu können.
A- + H O⊕H
H
H
Säure löst Kalk (CaCO3) und Zink auf, Kupfer dagegen nicht,
weil sich nur unedle Metalle in verdü
verdünnten Sä
Säuren auflö
auflöst.
Seite 63
Allgemeine Struktur einer Sä
Säure
Wie ist eine (Br
ønsted)(Brø
nsted)-Säure im allgemeinen aufgebaut?
Brø
ø
nstedS
ä
ure
enthä
Br nsted
enthält polar gebundenen Wasserstoff.
Welche Elemente bilden polare Bindungen zu H ?
Nichtmetalle (elektronegativ!) bilden polare Bindungen zu H.
Beispiel:
Beispiel: Chlorwasserstoff H Cl
analog andere Halogene
Bei weniger elektronegativen Elementen (S,N,P,C) kö
können
weitere Bindungen zu Sauerstoff die Polaritä
Polarität erhö
erhöhen:
Beispiele: Salpetersä
Salpetersäure Schwefelsä
Zitronensäure
Schwefelsäure
H
S
O
O
H
O
O
N
O
H
Seite 64
32
O
O
Ampholyt
Stoffe oder Teilchen die je nach Reaktionspartner
sowohl als Sä
Säure wie auch als Base fungieren kö
können,
nennt man Ampholyte.
Ampholyte.
Sie enthalten sowohl polar gebundenen Wasserstoff,
als auch mind. ein freies Elektronenpaar.
Beispiel:
Wasser wirkt gegenü
gegenüber Salpetersä
Salpetersäure H O + HNO → H O+ + NO 2
3
3
3
als Base: Es nimmt ein Proton auf
und wird zum HydroniumHydronium-Ion.
Ion.
Gegenü
Gegenüber der Base Ammoniak
wirkt Wasser aber als Sä
Säure,
H2O + NH3 → OH- + NH4+
es gibt ein Proton ab
und wird zum HydroxidHydroxid-Ion.
Ion.
Weitere Beispiele fü
für Ampholyte:
HCO3- (HydrogencarbonatHydrogencarbonat-Ion),
Ion), HSO4- (HydrogensulfatHydrogensulfat-Ion)
Ion)
Säure/Base bezeichnet chem. Verhalten gegenü
gegenüber Reaktionspartner.
Stoffbezeichnung (z .B. Salpetersä
Salpetersäure) historisch bezogen auf Wasser.
Seite 65
Autoprotolyse des Wassers
Salzlö
Salzlösungen leiten den elektrischen Strom, weil sie Ionen enthalten.
Legt man eine Spannung an wandern Kat+→ Kathode (Minus(Minus-Pol)
An- → Anode (Plus(Plus-Pol)
Auch reinstes, destilliertes Wasser leitet Strom,
denn es enthä
enthält immer Ionen durch die Autoprotolyse:
Autoprotolyse:
H2O + H2O
H3O+ + OH-
Wasser wirkt hier als Sä
Säure und als Base,
es entstehen HydroniumHydronium-Ionen und HydroxidHydroxid-Ionen
in geringer Konzentration.
Seite 66
33
Der pH-Wert
Die Konzentration an HydroniumHydronium-Ionen ist ein Maß
Maß dafü
dafür,
wie sauer oder alkalisch (basisch) eine Lö
Lösung ist.
Darstellung in 10er10er-Potenzen unü
unübersichtlich, daher:
Der pHpH-Wert ist der negative dekadische Logarithmus
der HydroniumHydronium-Ionen Konzentration. (p
(potentia Hydrogenii)
ydrogenii)
pH = − log[c( H 3O + )]
c(H3O+) mol/L dezimal
c(H3O+) mol/L Potenz
pH-Wert
Lösung
0,1
10-1
1
sehr sauer
0,0001
10-4
4
schwach sauer
0,0000001
10-7
7
neutral
0,0000000001
10-10
10
schwach basisch
0,0000000000001
10-13
13
stark basisch
Seite 67
Zusammenhang der Konzentration von
Hydronium- und Hydroxid-Ionen
In neutralem Wasser gilt: c(H3O+) = c(OH-) = 10-7 mol/L
Für jede Lö
Lösung gilt: c(H3O+) · c(OH-) = 10-14 mol2/L2
merke: Konzentrationen werden multipilziert!
multipilziert!
Analog zum pHpH-Wert kann man den pOHpOH-Wert definieren:
Der pOHpOH-Wert ist der negative dekadische Logarithmus
der HydroxidHydroxid-Ionen Konzentration.
pOH = − log[c (OH − )]
c(H3O+)·c(OH-)=10-14 mol2/L2 logarithmieren ⇒ pH + pOH = 14
pH
pOH
Lösung
2
12
sauer
7
7
neutral
11
3
basisch
Seite 68
34
pHpH-Wert Berechnung
(starke Sä
Säure bzw. starke Base)
Beispiel:
n =0,1mol einer einprotonigen,
einprotonigen, starken Sä
Säure V=10 L Wasser.
+
HA + H2O→ H3O + A
n= 1 mol
+
→ 1 mol
c( H 3O ) = nS / V = 0,1mol / 10L = 0,01mol / L = 10−2 mol / L
pH = − log[c( H 3O + )] = − log10 −2 = 2
Beispiel:
0,01 mol einer starken Base werden in 100 L Wasser gelö
gelöst.
c(OH − ) = nB / V = 0,01mol / 100L = 0,0001mol / L = 10−4 mol / L
pOH = − log[c(OH − )] = − log 10 −4 = 4
pH = 14 − pOH = 14 − 4 = 10
Seite 69
Redoxreaktionen
Redoxreaktionen sind Grundlage fü
für die chemische EnergieEnergiespeicherung und -umwandlung: Brennstoffzelle
Sowohl in der
Batterie
Technik:
als auch
in der Natur:
Verbrennung
Gä
ärung
alkoholische G
Photosynthese
Seite 70
35
Ursprü
Ursprünge der Begriffe
Oxidation/Reduktion
Ursprü
Ursprünglich bezeichnete man als Oxidation vor die Reaktion
von organischen Stoffen, Metalle etc. mit (Luft
(Luft--)Sauerstoff;
)Sauerstoff;
also die Verbrennung von
Holz, Öl, Wachs oder Kohle oder das Rosten von Eisen
4 Fe + 3 O2
→ 2 Fe2O3
C + O2 → CO2
Als Reduktion (Zurü
(Zurückfü
ckführung) bezeichnete man die Gewinnung
von Metallen aus ihren Oxiden, z. B.: 2 HgO → 2 Hg + O2
Da es viele ähnliche Prozesse ohne Beteiligung von Sauerstoff gibt,
wird der Begriff Oxidation heute weiter gefasst.
Seite 71
Heutige Definition von
Oxidation/Reduktion
Als Oxidation bezeichnet man Prozesse, bei denen
ein Atom, Ion oder Molekü
Molekül Elektronen abgibt:
abgibt:
Oxidation = Elektronenabgabe:
Dabei ändern ich die Eigenschaften der Materie deutlich:
Bsp:
Bsp: Kupfer (rot glä
glänzendes Metall) geht über in Kupfer(Cu
Kupfer(Cu2+)Ionen.
2+
Cu -Ionen bilden mit Anionen Salze oder liegen gelö
gelöst vor.
Solvatisierte Cu2+-Ionen besitzen Hydrathü
Hydrathülle und sind blau gefä
gefärbt.
Der Prozess ist
umkehrbar =
reversibel
Bei der Reduktion , lä
läuft der umgekehrte Vorgang ab;
ein Atom, Ion oder Molekü
Molekül nimmt Elektronen auf:
auf:
Reduktion = Elektronenaufnahme:
Seite 72
36
Redoxreaktion
Beispiele
Da Elektronen nicht frei existieren, sind Oxidation und Reduktion
stets gekoppelt.
gekoppelt.Redoxreaktion = Elektronenübergabe:
Es kö
können auch – je nach Reaktionspartner - mehrere Elektronen
übertragen werden.
In der Redoxreaktion mü
müssen bei der Reduktion genau so viel ElektroElektronen aufgenommen werden, wie bei der Oxidation abgegeben wurden!
Daher tauchen in der Gesamtgleichung nie Elektronen auf!
Oxidation:
Zn → Zn2+ + 2eReduktion: S + 2 e-→ S2Redoxreaktion: Zn + S → Zn2+ + S2- = ZnS
Man kann die Redoxreaktion formal in Oxidation und Reduktion
unterteilen. Die Teilschritte laufen aber nie einzeln ab!
Erhaltung der Masse und Ladung: Auf beiden Seiten der Reaktionspfeile
Reaktionspfeile
muss die gleiche Anzahl jeder Atomsorte und gleiche Ladung sein.
Hinweise: Keine Elektronen "abziehen": Zn - 2e- → Zn2+
Keine halben Molekü
:
Moleküle
½ Cl 2
Seite 73
Beispiel: Zink + Schwefel:
ThermitThermit-Reaktion
(eine bekannte Redoxreaktion)
Eisenoxidpulver wird mit Aluminiumpulver fein vermischt.
Die Reaktion wird mit einer Wunderkerze gezü
gezündet.
Exotherme
Reaktion!
Energie wird
in Form von
Wärme und
Licht abgegeben.
Wie kann man überprü
berprüfen
ob das ausgelaufene Metall
Eisen ist, und nicht Aluminium?
ThermitThermit-VerVerfahren zum
Verschweiß
Verschweißen
von Schienen
Seite 74
37
Knallgasprobe
Viele Redoxreaktion laufen exotherm ab, d. h. unter Energieabgabe.
Energieabgabe.
Eine weitere solche Reaktion ist die KnallgasKnallgas-Probe (auf Wasserstoff)
Größ
te Knallgasreaktion aller Zeiten?
Größte
Luftschiff "Hindenburg"
Lakehurst 1937
2 H2 + O2 → 2 H2O + Energie
Oxidation:
H2 → 2 H+ + 2 eReduktion:O2 + 4 e- → 2 O2Redox: 2 H2 + O2 → (4H+ + 2O2-)→ 2H2O
H (I. HG) gibt 1 e- ab,
O (VI. HG) nimmt 2 e- auf,
um Oktettregel zu erfü
erfüllen.
Beides zweiatomige Gase!
Tatsä
Tatsächlicher Mechanismus nicht ionisch,
ionisch, sondern radikalisch!
radikalisch!
Seite 75
Weitere Redoxreaktionen
Reduktion von EisenEisen-(II)(II)-oxid zu Eisen:
Redox : 2 FeO + C → CO2 + 2 Fe
Oxidation : C + 2 O2→ CO2 + 4 e2+
Reduktion: 2 Fe + 4 e → 2 Fe
Redoxreaktion ohne Sauerstoff:
Redox:
2 Na + Cl2 → 2 NaCl
Oxidation:
2·(Na → Na+ + e-)
Reduktion: Cl2 + 2 e- → 2 Cl-
Wo läuft diese Reaktion
groß
großtechnisch ab?
ab?
Na (I. HG) gibt 1 e- ab,
Cl (VII. HG) nimmt 1 e- auf,
um Oktettregel zu erfü
erfüllen.
Chlor zweiatomiges Gas.
Redoxreaktion mit komplexer Stö
Stöchiometrie:
chiometrie:
Redox: 16 Al + 3 S8→8 Al2S3={2Al3+3S2-}
Oxidation:
16·(Al → Al3+ + 3 e-)
Reduktion: 3·(S8+16 e-→8S2-)
Al (III. HG) gibt 3 e- ab,
S (VI. HG) nimmt 2 e- auf,
um Oktettregel zu erfü
erfüllen.
Schwefel als S8-Ring.
Die stö
stöchiometrischen Faktoren ergeben sich aus der Bilanz
der Teilreaktionsschritte.
Seite 76
38
Oxidationsmittel/Reduktionsmittel
Ein Stoff, der andere Verbindungen oxidieren (Elektronen entziehen)
entziehen)
kann, nennt man Oxidationsmittel = Elektronenakzeptor
Er selbst wird dabei reduziert!
Typische Oxidationsmittel:
• Sauerstoff O2 + 4 e-→ 2 O2Cl2 + 2 e-→ 2 Cl• Chlor
• Oxoanionen z.B.: MnO4- (Permanganat),
Permanganat), Cr2O72- (Dichromat)
• Anionen der Halogensauerstoffsä
Halogensauerstoffsäuren, z.B. ClO3- (Chlorat)
Chlorat)
• Edelmetallionen,
Edelmetallionen, z. B. Ag+ + e-→ Ag
Ein Stoff, der andere Verbindungen reduzieren (Elektronen abgeben)
abgeben)
kann, nennt man Reduktionsmittel = Elektronendonator
Er selbst wird dabei oxidiert!
Typische Reduktionsmittel:
H2 → 2 H+ + 2 e• Wasserstoff
• Zink
Zn → Zn2+ + 2e• Kohlenstoff
Seite 77
Bauprinzipien und Klassifizierung
organischer Verbindungen
• Kohlenstoff bildet in der Regel 4 Bindungen zu anderen Atomen aus
aus
4 EinfachEinfach-; 1 DoppelDoppel- +2 Einfach; (2 DoppelDoppel-); 1 EinfachEinfach- + 1 DreifachDreifachH
H C H
H
H
H
C O
H
H
H
H C C H
O C O
C C
H
• In org. Verb. kö
können nahezu beliebig viele CC-Atome verknü
verknüpft sein,
von einem (s. o.) bis viele Tausend (DSN, Proteine, synth. Polymere)
Polymere)
• Organische Verbindungen bestehen aus KohlenstoffKohlenstoff-Grundgerü
Grundgerüst
(z.B. -Kette) und sog. funktionellen Gruppen (aus O,N,H, etc.)
⇒ chem. Verhalten
CH2
CH2
H3C
R
CH2
CH2
CH2
• Entsprechend der funktionellen Gruppen Zuordnung zu Stofffamilien
Stofffamilien
(Alkohole, Carbonsä
Carbonsäuren, Amine, ...
• Die Stofffamilien lassen sich durch org.org.-chem. Reaktionen auseinander
entwickeln, wä
während das Grundgerü
Grundgerüst oft gleich bleibt.
• Molekü
Molekülreihen mit sukzessive steigender CC-Anzahl im Grundgerü
Grundgerüst,
aber gleichen funkt. Gruppen (⇒
(⇒ chem. Verhalten) = Homologe Reihe.
Seite 78
39
Homologe Reihe der Alkane
Alkane bestehen aus (geraden o. verzweigten) Ketten von sp3-hybridihybridisierten Kohlenstoffatomen, die mit Wasserstoffatomen abgesä
abgesättigt sind.
Zwischen den Atomen liegen nur Einfachbindungen (σ-Bindungen) vor.
Name Summen- Strukturformel
Halbstruk- Kurzschreib * Alle Alkane haben
-weise **
formel *
turformel
die Summenformel:
H
C
H
MethylMethylGruppe
H
Ethan
C2 H6
H
H
H
C
C
H
H
H
Propan C3H8
H
H
C
C4H10
Pentan C5H12
H
H
MethylenMethylen-
C
H
Mit jedem weiteren
C-Atom kommt eine
Methylengruppe
-CH2- dazu.
H3C CH3
H
H
C
H
Butan
CnH2n+2
H
Methan CH4
** Die KurzschreibKurzschreibweise zeigt nur die
C-C-Bindungen.
H3C CH2 CH3
H
H
H
H
H
H
C
C
C
C
H
H
H
H
CH2
H
H
H
H
H
H
C
C
C
C
C
H
H
H
H
H
H3C
CH2
H H C
3
CH3
C6H14 Hexan
C7H16 Heptan
C8H18 Octan
C9H20 Nonan
C10H22 Decan
CH2
CH2
CH2
CH3
Seite 79
Isomerie
Konstitutionsisomerie der Alkane
Kohlenwasserstoffe mit mehr als 3 CC-Atomen können verzweigte Ketten
bilden. Ab Butan mehrere Isomere gleicher Summenformel;
unterschiedliche Konnektivitä
Konnektivität = KonstitutionsKonstitutions-Isomerie.
Chemisch und physikalisch unterschiedliches Verhalten.
Mehr CC-Atome ⇒ exponentiell mehr Isomere.
Das Auftreten unterschiedlicher Substanzen mit gleicher Summenformel
wird als Isomerie bezeichnet, die Verbindungen selbst als Isomere
n-Butan
Summenformel
iso-Butan
2-Methyl-propan
2,2-Dimethyl-propan
C4H10
C5H12
C4H10
Strukturformel
H
H
H
H
H
C
C
C
C
H
H
H
H
H
H
H
H
C
H
C
H
H
C
C
MethinMethin- H H H
neo-Pentan
H
H
H
H
H
C
H
H
C
C
C
H
H
C
H
H
H
H
quartäres C-Atom
Seite 80
40
Molekü
Molekülgeometrie der Alkane
1858 Friedrich Kekulé
Kekulé: Vierbindigkeit Molekülorbitalmodell des Methan (CH4)
des Kohlestoffs; bindet 4 einbindige
Atome. Tetraedrische Ausrichtung
(109°
(109°-Winkel) 1874 von van't Hoff
postuliert, spä
später exp.
exp. bestä
bestätigt.
Erklä
Erklärung durch Hybridisierung:
Das s, px,
px, py,
py, pzpz-Orbitale →
4 energiegleiche sp3-Hybridorb.
sp3-hybridisierter Kohlenstoff kann
falsches MO-Modell Tetraedermodell
4 EinfachEinfach-(σ-)Bindungen ausbilden.
Ethan:
Stereochemische
Schreibweise
σ-Bindungen sind drehbar
Seite 81
Funktionelle Gruppen
- Übersicht Bindungen in KW unpolar. Sind Heteroatome (O, N, S,...) gebunden
⇒ polare Bindungen ⇒ reaktive, funktionelle Gruppen
Vielzahl org. Verb. mit unterschiedlichen Eigenschaften+Reaktionen
Eigenschaften+Reaktionen
Funktionelle Gruppen
Funktionelle Gruppen mit
mit Einfachbindungen
C=O-Doppelbindung
Ersetzt man
in Wasser
H- durch
Alkylrest
⇒ Alkohol
O
O
H
zwei
Alkylreste
⇒ Ether
R
H
H
R
R
S
R
H
Carbonsäuren
R
Amine
R
H
R
H
R
N
R
Ketone
Thioether
S
N
Aldehyde
O
Thiole
(Mercaptane)
R
(Carbonyl-Verbindungen)
N
H
R
R
Funktionelle Gruppen bestimmen
phys. Eigenschaften: (Schmelz(Schmelz-,
Siedepunkt, Lö
Löslichkeit) und die
chem. Eigensch. (Reaktionen)
Seite 82
41
Alkohole
δ- δ+
Alkohole haben mind. eine HydroxylHydroxyl-Gruppe (-OH),
an einem CC-Atom, das keine weitere funkt. Gruppe trä
trägt.
R-O-H
OH
Methanol
Ethanol
Phenol (aromatisch)
Abhä
Abhängig davon, wie viele weitere CC-Atome gebunden sind,
unterscheidet man primä
primäre, sekundä
sekundäre und tertiä
tertiäre Alkohole:
1-Butanol
2-Butanol
tert.-Butanol
primär
sekundär
tertiär
Seite 83
Nachweis von Alkohol
im Teströ
Teströhrchen
Frü
Früher wurde bei Verkehrskontrollen Alkohol nachgewiesen
durch Grü
Grünfä
nfärbung im Pusterö
Pusteröhrchen:
-I
+VI
+I
+III
Redoxreaktion: Ethanol wird oxidiert zum Acetaldehyd
Das gelbgelb-orange Dichromat wird zum grü
grünen Chrom (III) reduziert.
Der Alkohol wird oxidiert nicht durch Sauerstoffaufnahme
(Oxigenierung), sondern durch Entzug von 2 Wasserstoffatomen
(Dehydrogenierung).
Das Produkt ist ein Aldehyd (Alcoholus
(Alcoholus dehydrogenatus)
dehydrogenatus)
Seite 84
42
Oxidierbarkeit von Alkoholen
Primä
Primäre Alkohole
lassen über das
Aldehyd weiter bis
zur Carbonsä
Carbonsäure
oxidieren;
Sekundä
Sekundäre nur bis
zum Keton;
Tertiä
Tertiäre Alkohole
können nicht oxidiert
werden, weil der
Wasserstoff fü
für die
Dehydrierung fehlt.
Seite 85
43