Isotope
Werbung
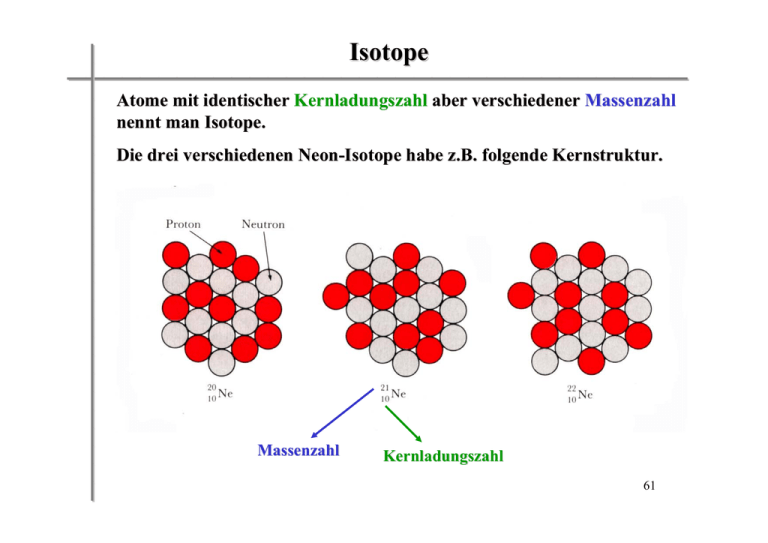
_________________________ Isotope __________________________________ Atome mit identischer Kernladungszahl aber verschiedener Massenzahl nennt man Isotope. Die drei verschiedenen Neon-Isotope habe z.B. folgende Kernstruktur. Massenzahl Kernladungszahl 61 _________________________ Einige wichtige Isotope __________________________________ 62 _________________________ Die atomare Masseneinheit u __________________________________ Es ist bequem, mit einfachen Zahlen zu rechnen. Deshalb werden die Massen von Atomen in der sogenannten atomaren Masseneinheit u angegeben. Eine atomare Masseneinheit u entspricht einem Zwölftel (1/12) der Masse des Kohlenstoffisotopes 12C. Der Kern eines 12C Atoms enthält 12 Nukleonen (6 Protonen und 6 Neutronen). Die Masse eines 12C Atoms beträgt 1.9926 x 10-26 kg → 1u = 1.66054 x 10-27 kg In diesen Einheiten hat 1H eine Masse von 1.0078 u und 16O eine Masse von 15.9949 u. 63 _________________________ Die Methode zur Massenbestimmung __________________________________ Die Massenspektrometrie: 2 Beispiele Die Signalintensität spiegelt die Häufigkeit des jeweiligen Isotopes wider. 64 _________________________ Erweiterung des Bohr´schen Atommodells durch Erwin Schrödinger (1926) (Quantenmechanik) __________________________________ 1. Hauptquantenzahl n = 1,2,3,….. (Bezeichnung der Schale bei Bohr) Wird n größer, dann hält sich das Elektron weiter vom Kern entfernt auf ⇒ Elektron hat höhere Energie und ist daher weniger stark an den Kern gebunden. 2. Für jedes n gibt es Nebenquantenzahlen l = 0 bis n-1; l = 0(s), 1(p), 2(d), 3(f) l beschreibt die räumliche Aufenthaltswahrscheinlichkeit (Orbitale) der Elektronen mit steigender Hauptquantenzahl (Schale). 3. Die Gesamtzahl an Orbitalen in einer Schale ist n2 (1,4,9,16). Jedes Orbital kann 2 Elektronen aufnehmen. 65 _________________________ Wie werden die Elektronen in den Schalen und Orbitalen untergebracht? ⇒ Elektronenkonfiguration __________________________________ Hauptquantenzahl n Nebenquantenzahl l Zahl der Orbitale max. Elektronenzahl 1 0 1x1s 2 2 0,1 1x2s, 3x2p 8 3 0,1,2 1x3s, 3x3p, 5x3d 18 4 0,1,2,3 1x4s, 3x4p,5x4d,7x4f 32 Die Orbitale werden systematisch nach steigender Energie aufgefüllt, wobei die p-, d- und f-Orbitale immer zuerst einzeln aufgefüllt werden. 66 _________________________ Beispiele einiger Elektronenkonfigurationen __________________________________ 1s 2s 2p 3s Elektronenkonfiguration H: 1s He: 1s2 Li: 1s22s1 Be: 1s22s2 B: 1s22s22p1 C: …. N: …. O: …. F: …. Ne: 1s22s22p6 Na: 1s22s22p63s1 67 _________________________ Atome, Moleküle, Molekülverbindungen __________________________________ Das Atom ist die kleinste Einheit eines Elementes, aber nur die Edelgase treten in der Natur als einzelne, isolierte Atome auf. Warum? Die anderen Elemente treten in einem Verbund von zwei und mehr Atomen auf (z.B. Wasserstoff H2, Stickstoff N2, Sauerstoff O2). Molekülverbindungen sind Ensembles von verschiedenen Atomen. 68 _________________________ Chemische Formeln __________________________________ Chemische Formeln dienen zur Darstellung von Molekülverbindungen, vor allem im Rahmen chemischer Reaktionen. Nebenstehend sind verschiedene Möglichkeiten zur Repräsentation von Molekülen gezeigt. 69 _________________________ Avogadro-Zahl __________________________________ Auch kleinste Mengen von Substanz, die wir im Labor oder im täglichen Leben benutzen enthalten eine enorm große Zahl von Atomen oder Molekülen. So enthält z.B. ein Teelöffel Wasser (∼ 5 mL) etwa 2x1023 Wassermoleküle !! Chemiker haben daher eine spezielle Einheit festgelegt (ähnlich wie z.B. im täglichen Sprachgebrauch ein Dutzend (12)), um derart große Zahlen von Atomen, Ionen oder Molekülen zu beschreiben. Diese Einheit ist das Mol (mol). Ein Mol wird als die Menge an Substanz definiert, die so viele Atome, Ionen oder Moleküle enthält, wie Atome in genau 12 g 12C enthalten sind. Besonders zwei Wissenschaftler haben sich um die Bestimmung dieser Zahl verdient gemacht: Amadeo Avogadro und Joseph Loschmidt. Sie wird daher auch Avogadro-Zahl (NA) oder (weniger häufig) Loschmidt-Zahl (NL) genannt. NA = 6.022 x 1023 1 mol H2O enthält 6.022 x 1023 Wassermoleküle. 1 mol NO3- enthält 6.022 x 1023 Nitrat-Ionen. 70











