SICHERHEITSRELEVANTE KORREKTIVE MASSNAHME
Werbung

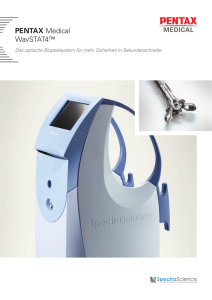
PENTAX Europe GmbH Datum AZ: FSCA-PMJ-17-01-1 SICHERHEITSRELEVANTE KORREKTIVE MASSNAHME FÜR GERÄTE VOR ORT Aufbereitungsanleitung PENTAX Medical ED-3490TK Duodenoskop und Inspektion aller PENTAX Duodenskope An: <Kundenadresse> Sehr geehrte Damen und Herren, PENTAX Europe GmbH (“PENTAX”) ist stets bestrebt, potenzielle Infektionsrisiken im Zusammenhang mit Duodenoskopen zu reduzieren. Im Rahmen dieser Aktivitäten wurde die Aufbereitungsanleitung, die PENTAX für alle Anwender von ED-3490TK Duodenoskopen von PENTAX Medical veröffentlicht hat, im Juni 2016 überarbeitet (Ref.Nr. FSCA-PMJ-16-01-1). Um das potenzielle Kontaminationsrisiko weiter zu senken, informiert PENTAX heute Anwender schriftlich über potenzielle Probleme im Zusammenhang mit der distalen Kappe von ähnlich konstruierten Duodenoskopen, von denen einige bereits nicht mehr hergestellt werden. MÖGLICHES PROBLEM: Bei der Herstellung von Duodenoskopen (einschließlich der unten aufgeführten, ähnlich konstruierten Duodenoskopmodelle) wird vor dem Anbringen der distalen Kappe an der distalen Spitze Silikonkleber appliziert. Im Gebrauch können sich gelegentlich Risse oder Spalten im Kleber bilden, in die Flüssigkeiten und Verunreinigungen eindringen können. Abgesehen hiervon möchte PENTAX darauf hinweisen, dass bisher diesbezüglich keine Beanstandungen von Kunden eingegangen sind und PENTAX keine Vorfälle im Zusammenhang mit diesem Problem gemeldet wurden. EMPFEHLUNG: Wir haben festgestellt, dass Ihre Einrichtung möglicherweise betroffene Modelle besitzt, die in der folgenden Tabelle aufgeführt sind. Wir bitten Sie, dringend zu überprüfen, ob Ihre Einrichtung PENTAX Duodenoskope besitzt, die in den vergangenen zwölf Monaten noch nicht vom PENTAX Kundendienst inspiziert wurden. Wenn Sie derartige Geräte besitzen, wenden Sie sich bitte an den für Sie zuständigen PENTAX Kundendienst, um eine entsprechende Inspektion zu veranlassen. Duodenoskop-Modell Video/Fiber ED-3490TK Video FD-34V2 Fiber Formular Nummer:LT-AA-001-Form7 Formular-Revision: R00 PENTAX Europe GmbH Seite 1 / 3 Text-Revision: R00 PENTAX Europe GmbH ED-3270K ED-3430 ED-3430TK ED-3670TK ED-3470TK Video ED-3230 ED-3230K ED-3430K ED-3430T ED-3630T MASSNAHMEN: PENTAX erinnert Anwender an die bestimmungsgemäße Verwendung von Duodenoskopen im Sinne des aktuellen Verwendungszwecks. Die Gebrauchsanweisung für die Aufbereitung bleibt unverändert. Gesundheitseinrichtungen müssen sicherstellen, dass sämtliches Aufbereitungspersonal („Anwender“) die aktuelle Gebrauchsanweisung für die manuelle Aufbereitung dieser Geräte kennt und sorgfältig geschult wurde. Die schwer zugänglichen Stellen im Bereich des Albarranhebels sind sorgfältig zu reinigen, und alle Aufbereitungsanleitungen sind zu beachten. Wie bereits in allen unseren aktuellen Gebrauchsanweisungen beschrieben, empfiehlt PENTAX, dass Sie alle Duodenoskope, die sichtbare Zeichen der Abnutzung oder Beschädigungen aufweisen, umgehend aus dem Verkehr ziehen. Der weitere Gebrauch von nicht unversehrten Geräten (z. B. mit Löchern, Rissen, Knicks und Kratzern) kann zu einer dauerhaften Kontamination der Geräte und in Folge zu einer Infektion von Patienten beitragen. PENTAX wird sich mit Ihrer Einrichtung in Verbindung setzen, um Inspektionen Ihrer Duodenoskope zu vereinbaren. Dabei wird ein besonderes Augenmerk auf die Unversehrtheit der distalen Kappe gelegt. Darüber hinaus empfiehlt PENTAX allen Kunden, die die oben genannten Duodenoskope besitzen, die jährliche Inspektion und Instandhaltung. PENTAX bedauert mögliche Unannehmlichkeiten und bittet Gesundheitseinrichtungen bei etwaigen Fragen zu dieser sicherheitsrelevanten korrektiven Maßnahme vor Ort, sich mit dem für sie zuständigen PENTAX Medical Kundendienst in Verbindung zu setzen. Kontakt: <Angabe des Kontakts bei PENTAX Medical bzw. beim Händler, an den sich der Kunde bei Fragen wenden kann. Name der Kontaktperson mit Telefonnummer und E-Mail-Adresse> Vorfälle oder Qualitätsprobleme in Verbindung mit dem Gebrauch von PENTAX Geräten sind unter [email protected] umgehend an PENTAX zu melden. PENTAX wird Sie weiter informieren, sobald neue Informationen vorliegen. Formular Nummer:LT-AA-001-Form7 Formular-Revision: R00 PENTAX Europe GmbH Seite 2 / 3 Text-Revision: R00 PENTAX Europe GmbH Mit freundlichen Grüßen PENTAX Europe GmbH Formular Nummer:LT-AA-001-Form7 Formular-Revision: R00 PENTAX Europe GmbH Seite 3 / 3 Text-Revision: R00