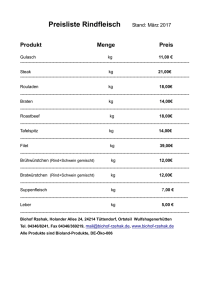
- Vetstudy
Werbung

Protozoa 1 PROTOZOEN (URTIERE) Systematik (Auszug) Stamm Unterstamm Klasse Mastogophora Ordnung Familie Kinetoplastida Trypanosomatidae Diplomonadida Hexamitidae Zoomastigophorea Monocercomonadidae Trichomonadida Sarcomastigophora Trichomonadidae Entamoebidae Stamm Amoebida Sarcidina Lobosea Klasse Schizopyrenida Unterklasse Ordnung Adeleina Hartmannellidae Vahlkampfiidae Familie Haemogregarinidae Eimeriidae Cryptosporiidae Coocidia Eimeriina Isosporidae Apikomplexa Sporozoea Sarcocystidae Haemosporina Babesiidae Theileriidae Piroplasmia Microspora Ciliophora Micosporea Ciliata Plasmodoidae Microsporida Nosematidae Pleistophorida Trichostomatida Pleistophoridae Balantidiidae Gattung Trypanosoma, Leishmania, Trypanoplasma Giardia, Hexamita Dientamoeba, Histomonas Trichomonas, Tritrichomonas, Tetratrichomonas, Pentatrichomonas Endolimax, Jodamoeba (=Iodamoeba) Acanthamoeba, Hartmanella Naegleria Gattung Hepatozoon Eimeria, Goussina, Nenyorella, Tyzzeria, Caryospora Cryptosporidium Isospora, Cystoisospora, Toxoplasma, Neospora, Hammonidia, Besnoitia Sarcocystis, Frenkelina Leucocytozoon, Plasmodium Babesia Theileria, Cytauxzoon Nosema, Encephalitozoon, Enterocytozoon Pleistophora Balantidium Kennzeichen Die Protozoen zeichnen sich dadurch aus, daß Nahrungsaufnahme, Stoffwechsel, Exkretion, Reproduktion, Reizbarkeit, Motilität, ect. in einer Zelle stattfindet. Es sind Eukaryonten, die artspezifisch einen, zwei oder relativ wenige Kerne besitzen. Zwar kann Poliploidie auftreten, jedoch ist die Vielkernigkeit auf wenige Phasen des Entwicklungszyklus beschränkt. Die Zellbegrenzung stellt stets eine Zellmembran dar. Diese sowie auch die zahlreichen Organellen (ER, Mitochondrien, Golgi-Apparate, Vakuolen, Ribosomen, Basalapparate, Centriolen, Axonemen, Flagellen, Cilien, Lysosomen, Mikrotubuli, ect.) können bei den einzelnen Protozoengruppen in unterschiedlicher Weise auftreten. Ihre Anordnung und Spezialisierung dient zur Diagnose insbesondere der parasitischen Formen. Die meist sehr schnelle Teilungsrate der Protozoen führt bei parasitischen Formen häufig zur Überschwemmung von Wirten und damit einhergehend zu bedeutsamen Erkrankungen. Die Nahrungsaufnahme erfolgt entweder durch einen Zellmund (Zytostom) oder durch Phagozytose/ Pinocytose. Protozoa 2 Morphologie Kernmembran: • • ca. 10 nm dicke Unit membrane (Plasmalemma), meist 3-schichtig (im EM): außen Mucopolysaccharid (surface coat) und innen 1 bis mehrere Membranen (pellicle) darunter sog. subpellicular microtubuli (12 - 25 nm Durchmesser), Zytoskelett-assoziiert (z. B. Trypanosoma), beteiligt bei Motilität (z. B. Amöben) Zytoskelett: Im Zyoplasma von Protozoen sind viele Mikrofilamente (4 - 10 nm Durchmesser), häufig in Bündeln, meistens der Actomyosin-Gruppe, häufig assoziiert zu den subpellicular microtubuli. Motilität: • • • Flagellen (9 Paar äußere und 1 Paar innere Microtubuli), verankert mit einem Basalkörper (Kinetosom) Zilien (im Prinzip Mikroausführung von Flagellen) Pseudopodien (gleitende Bewegungen mittels der subpelicular microtubuli) Zytoplasma: • • Ektoplasma: kleine periphere Zone Endoplasma: eigentliches Plasma, enthält Zellorganellen Kern(e): Protozoen haben mindestens 1 (bis mehrere) Kerne. Im Kern befinden sich gelegentlich mehrere Endosomen (Nucleoli), die RNA enthalten. Ziliaten: 1 Makronukleus und 1 Mikronukleus Mitochondrien: enthalten Enzyme für die oxidative Phosphorylisierung sowie für den TricarboxylsäureZyklus, sind in allen Protozoen enthalten, außer Trichomonaden und Mikrosporidien, Trypanosomen haben zusätzlich einen sog. Kinetoplasten (enthält auch DNA und ist mit dem Basalkörper assoziiert) Entwicklung Die Vermehrung erfolgt bei vielen Arten nur ungeschlechtlich durch einfache Zweiteilung. Eine ungeschlechtliche Vielfachteilung wird als Merogonie oder Schizogonie bezeichnet. Die ursprünglichste Art der Schizogonie ist die Endodyogenie oder Endopolygenie genannte innere Sprossung. Bei der Endodyogenie entstehen in einer Mutterzelle 2, bei der Endopolygenie mehrere Tochterindividuen. Bei den Apicomplexa kommt noch eine ungeschlechtliche Generation hinzu. Dabei werden besondere geschlechtliche Formen gebildet: zunächst Gamonten (Gametozyten), die zu weiblichen Makrogameten oder männlichen Mikrogameten heranreifen. Nach der Befruchtung der Makro- durch die Mikrogameten entsteht die Zygote, die bei einigen Arten beweglich ist (Ookinet). Ist die Zygote von eiern festen Hülle umgeben, spricht man von einer Ooozyste. Der in einer Oozyste stattfindende Teilungsvorgang wird Sporogonie genannt. Es entstehen Sporozysten, die jeweils mehrere Sporozoiten enthalten. Eine Reihe von parasitischen Protozoen hat nur einen Wirt, bei anderen findet die Entwicklung bei mehreren Wirten (neben dem Wirbeltierwirt) zumeist in einem Arthropoden, gelegentlich auch in einem Nematoden oder in einem anderen Wirbeltierwirt statt. Veterinär-Protozoologie (wichtige Gattungen und Erkrankungen) Wiederkäuer Gattung Babesia Cryptosporidium Eimeria, u. a. Giardia „Wohnort“ Blut Darm Duodenum Duodenum Erkrankung Babesiosen (Piroplasmosen) Kryptosporidiose Kokkzidiosen Giardiose Protozoa 3 Sarcocystis, u. a. Theilleria Toxoplasma Trichomonas u. a. Trypanosoma Gewebe Gewebe, Blut innere Organe Genitale Blut Sarcocystose Theilleriosen Toxoplasmose Trichomonose Nagana, Surra „Wohnort“ Darm Darm Duodenum Gewebe innere Organe Erkrankung Balantidiose Kryptosporidiose Kokkzidiosen Sarcocystose Toxoplasmose „Wohnort“ Blut Duodenum Gewebe innere Organe Blut Erkrankung Babesiosen (Piroplasmosen) Kokkzidiosen Sarcocystose Toxoplasmose Nagana, Surra, Beschälseuche „Wohnort“ Blut Darm Duodenum innere Organe, Haut Darm, Gewebe Darm innere Organe Erkrankung Babesiosen (Piroplasmosen) Kokkzidiosen Giardiose Leishmaniose Neosporose Sarcocystose Toxoplasmose Schwein Gattung Ballantidium Cryptosporidium Eimeria, u. a. Sarcocystis, u. a. Toxoplasma Pferd Gattung Babesia Eimeria, u. a. Sarcocystis, u. a. Toxoplasma Trypanosoma Hund und Katze Gattung Babesia Cystoisospora Giardia Leishmania Neospora Sarcocystis u. a. Toxoplasma Human-Protozoologie (wichtige Arten und Erkrankungen) Rhizipoda Gattung Entamoeba histolytica Naegleria fowleri Acanthamoeba-Arten „Wohnort“ Darm, Leber, u. a. ZNS ZNS, u. a. Erkrankung Amöbiose Naegleriose Akanthamöbose Protozoa 4 Zoomastigophora Gattung Trypanosoma gambienese, T. rhodesiense T. cruzi Leishmania donovani L. infantum L. tropica L. major „Wohnort“ Blut Blut, innere Organe innere Organe Haut, innere Organe Haut L. braziliensis, L. mexicana Haut, Schleimhäute Trichomonas vaginalis Giardia duodenalis Genitale Duodenum Erkrankung Schlafkrankheit Chagas-Krankheit Viszerale Leishmaniose, Kalar-Azar Meditrerane Leishmaniose Kutane Leishmaniose Orientbeule Amerikanische Haut- und Schleimhautleishmaniose Trichomonose Giardiose, Lambliose Sporozoa Gattung Toxoplasma gondii Isospora belli Sarcocystis-Arten Cryptosporidium Plasmodium vivax, P. ovale P. malariae P. falciparum „Wohnort“ innere Organe Darm Darm Darm Leber, u. a. Haut, Schleimhäute Erkrankung Toxoplasmose Kokkzidiose Sarcocystose Kryptosporidiose Malaria tertiana Malaria quartana Malaria tropica „Wohnort“ Darm Erkrankung Balantidiose Ciliophora Gattung Balantidium coli Protozoa 5 SARCOMASTIGOPHORA TRYPANOSOMATIDAE Zur Familie gehören einige für Mensch und Tier bedeutsame Parasiten. Morphologie Die einzelnen Tryposomatidae haben alle einen spindelförmigen Körper (Ausnahme: amastigote Form), einen Zellkern, einen Kinetoblasten, eine freie oder über eine „unduierende Membran“ mit dem Zellkörper verbundene Zuggeißel (Ausnahme: amastigote Form). Alle Stadien sind nach einem gemeinsamen Bauprinzip gestaltet. Besondere Merkmale der Trypanosomatidae: Gestaltwechsel im Verlauf des Entwicklungszyklus, der sich meist über 2 Wirte erstreckt. Bei dieser Formveränderung können unterschiedlich strukturierte Stadien mit verschiedenem Geißelansatz aufeinanderfolgenden Polymorphismus oder gleichartig begeißelte Stadien schlank (engl. slender) oder gedrungen (engl. stout, stumpy) erscheinen (Pleomorphismus). Die polymorphen Stadien werden nach dem Ansatz der Begeißelung als amastigot - epimastigot - promastigot - trypomastigot (= trypanosomaform) bezeichnet. Im Entwicklungszyklus der einzelnen Spezies folgen stets obligat nur bestimmte Stadien aufeinander, die je nach Aufenthaltsort (Wirbeltier oder wirbelloser Wirt) während fortgesetzter Zweiteilung kontinuierlich ineinander übergehen. Formen der Trypanosomatidae: Je nach Art der Trypanosomatidae befinden sich im Wirbeltier trypo- und/ oder amastigote Formen, im Evertrebraten auch pro- und epimastigote Formen. • amastigot (A): abgerundet, ohne Geißel (Geißelrudiment), nur intrazellulär vorkommend (Leishmania spp., Trympansoma cruzi) • promastigot (B): Kinetoblast vor Kern (pro = vor), freie Geißel (z. B. bei Leishmania spp. im Vektor) • epimastigot (C): Kinetoblast neben Kern (epi = auf), Geißel mit undulierender Membran (z. B. bei Trypanosma spp. im Vektor) • trypomastigot (D): Kinetoblast hinter dem Kern (trypanon = Bohrer, mastigon = Flagellum), Geißel mit unduliernder Membran (extrazelluläre Blutformen von Trypanosoma spp.) Protozoa 6 Zytologie Einfache Zellmembran, unter der spiralig angeordnete Mikrotubuli ein stabiles Zytoskelett bilden. bei Blutstadien befindet sich außen auf der Zellmembran eine etwa 10 - 15 nm dicke Schicht, die als „surface coat“ bzw. „Glycokalyx“ bezeichnet wird. und offenbar Schutz vor Antikörpern des Wirtes bietet. Sie wird dabei im Verlauf auf einer der folgenden Teilungen umgebildet (Änderung des antigenen Charakters). Diese Schicht besteht jeweils aus einem Typ von Glycoproteinen, die bei afrikanischen Trypanosomen-Arten wegen ihres Wechselns auch englisch als „variable surface glycoprotein“ (VSG) bezeichnet werden und von denen jedes Molekül 500 AS enthält. Das Genom jeder Trypanosomen, bei denen bisher diese Antigenvarianz nachgewiesen wurde, enthält mehr als 1000 derartige VSG-Gene. Diese sind auf allen sehr heterogenen Trypanosoma-Chromosomen lokalisiert und machen nahezu 10 % der parasitären, nukleäre DNA aus. Von ihnen wird allerdings stets nur eines exprimiert. Der Aktivitätswechsel eines Gens erfolgt spontan nur bei wenigen Individuen (exakte Steuermechanismen sind unbekannt), bewirkt so die Produktion eines anderen surface coats und führt so zum Überleben dieser Individuen im Wirt. Eine Vakzinierung erscheint bei diesen Arten wegen dieser spontanen Antigenvarianz aussichtslos. Neue Arbeiten fokussieren deshalb auf die immunologische Untersuchung konservierter Oberflächenstrukturen, wie z. B. die der sog. flagellar pocket. Entwicklungszyklus Die Entwicklung erfolgt mit Wirtswechsel (obligat heteroxene Entwicklung, Ausnahme: Trypanosoma equiperdum). Im Vertebratenwirt befinden sich die trypomastigoten Formen im extrazellulären Raum, die amastigoten Formen im intrazellulären Raum. Im Evertebratenwirt kommen alle Stadien vor. Hier erfolgt die ungeschlechtlicher Vermehrung durch Längsteilung. Übersicht Trypanosoma Arten T. brucei brucei Vertebraten Krankheit Symptome T. equiperdum Naganaseuche Fieber, Meningoencephalitis, Lähmungen Mensch Schlafkrank- Schwellung der Naheit cken-Lnn., Ödeme, Meningoencephalitis Mensch Schlafkrank- Fieber, Schlafsucht heit Wiederkäuer Nagana Fieber, Tobsucht, Anämie Wiederkäuer, Souma chronisch, heilt von Equiden selbst Equiden, Surra Fieber, Ödeme, AWiederkäuer, nämie Hunde Equiden, Mal de Fieber, Anämie Rinder Caderas Equiden BeschälseuGenitale Schwellung, che, Dourine Lähme T. cruzi Mensch T. theileri Rinder T. brucei gambiense T. T. brucei rhodesiense T. congolense T. vivax T. evansi T. equinum Equiden Chagaskrank- Ödeme, Myocarditis, heit ZNS-Befall apathogen - Überträger GlossinaArten Übertragungsart Stich Westafrika GlossinaArten Stich Ostafrika GlossinaArten GlossinaArten GlossinaArten Tabanus-/ StmoxysArten TabanusArten - Stich Verbreitung trop. Afrika Kongo Afrika Stich Stich Afrika, China, Australien, Mittelund Südamerika Süd- und Mittelamerika Mittelmeerregionen, Indien, China, Amerika Südamerika Wanzen Stich kosmopolitisch Kot Tabaniden Stich Deckakt Kot Protozoa 7 TRYPANOSOMOSE, Trypanosoma spp. Epidemiologie Infektionen mit Trypanosoma von Mensch und Nutztier sind v. a. in Afrika von großer sozialer und ökomischer Bedeutung. Man geht davon aus, daß in ca. 36 betroffenen Ländern Afrikas (wo die Tse-tse-Fliege vorkommt), ungefähr 50 Millionen Stück Vieh potentiell einer Infektion ausgesetzt sind. Die gemeldete Zahl neuer Schlafkrankheitsfälle beim Menschen in Afrika liegt im Moment bei 20 000 Fälle pro Jahr und ist im zunehmen begriffen. Übertragung • inokultativ durch Evertrebratenwirt (Vektor) während des Blutsaugaktes (Salivaria: z. B. Trypanosoma vivax, Glossina spp., Trypanosoma theilria/ Tabaniden) • kontaminativ nach Blutsaugakt durch Kot des Vektors (Stercoraria: z. B. Trypanosoma cruzi/ Raubwarzen) • Kontaktinfektion (Trypanosoma equiperdum) Rind Nagana (T. congolense und T. vivax, selten T. brucei) Vorkommen Die Erkrankung kommt in Afrika vor. Es ist dort eine wirtschaftlich folgenschwere Erkrankung des Rindes (Erkrankungen auch bei den kleinen Wiederkäuern). Pathogenese, Pathologie T. vivax kommt fast ausschließlich im Blutplasma vor und führt zu einer Anämie. T. congolense und T. brucei finden sich auch in interzellulären Gewebeflüssigkeiten und führen zu einer Anämie, zu degenerativen, entzündlichen und nekrotisierenden Veränderungen in diversen Organen, durch die Einwanderung von Lymphozyten, Makrophagen und Plasmazellen. Es treten keine zentralnervösen Störungen wie bei der Schlafkrankheit des Menschen auf. Bei manchen Tieren kann es zu immunpathologischen Reaktionen (Hypersensibilitätsreaktionen (Typ IV) und/ oder Immunkomplex-Reaktionen (Typ III)) kommen, das zur Erschöpfung des Immunsystems durch eine unspezifische Immunstimulation ausgelöst durch Trypanosomen führt. Pathologisch-anatomisch fallen endokardiale Petechien, Vergrößerung der Milz sowie seröse Atrophie des Körper- und organfettes auf. Seröse Flüssigkeitsansammlungen in Körperhöhlen, insbesondere im Perikard, sind häufig. Mitunter sieht man auch ausgeprägte Ödeme der Subcutis. Bei akuten Erkrankungen werden Splenomegalie und Lymphknotenvergrößerungen beobachtet. In chronischen Fällen können Milz und Lymphknoten von normaler Größe sein. Glomerulonephritis. Trypanotoleranz Eigenschaft autochtoner Rinderrassen, trotz latenter Trypanosomeninfektion nicht zu erkranken. Genetische Toleranz-Prädisposition. Tiere erbringen ohne vorbeugende Behandlung ihre normale Leistung und überstehen auch Streßfaktoren (Hunger, Durst, Märsche, ...) leichter als andere Rassen. Auch einzelne afrikanische Schafund Ziegenrassen zeigen im Verlauf der Trypanosemeninfektionen nur mäßige klinische Symptome und haben trotz bestehender Parasitämie eine geringere Mortalität Protozoa 8 Übertragung Entwicklungszyklus von Trypanosoma brucei gambiense und Trypanosoma brucei rhodensiense (VSG-Surface coat als Oberflächliche Striche dargestellt) 1. Schlanke, trypomastigote Blutform. Diese diploiden Stadien dringen später auch in die Cerebrospinalflüssigkeit ein. Nach 48 Stunden p. i. treten a- bzw. mikromastigote Formen in der Chorioidea auf. Umwandlung über „späromastigte Formen“ zur Blutform. 2. Intermdiäre Form mit einem Mitochondrion mit einigen Christae. Hier erfolgt eine intensive Vermehrung durch Längsteilung 3. Gedrungene trypomastigote Blutformen mit zahlreichen Christae im Mitochondrion. Nur diese Stadien entwickeln sich in der Tse-TseFliege weiter. 4. Trypmastigotes Stadium ohne „surface coat“ im Kropf der Fliege. Dieser Aufenthalt (mind. 1 Stunde) ist obligat, da hier das Mitochondrium umstrukturiert wird. Als sog. prozyklische (noch trypomastigote) Form mit Procyclin-Surface-Coat teilt sich dieses Stadium für etwa 10 Tage im Mitteldarm und wandert dann auf noch nicht geklärtem Weg durch das Darmepithel bzw. durch Aufsteigen innerhalb der Speicheldrüsengänge in das Innere der Speicheldrüse. Der Kineoblast und die Geißel sind bei der prozyklischen dichter an den Zellkern herangerückt. 5. Transformation zur epimastigoten Form während ständiger Längsteilungen im Inneren der Speicheldrüse. 6. Epimastigote Form mit einem Mitochondrion, das ein aktives Cytochrom-System aufweist. Hier findet die Reduktion zu haploiden Stadien statt. danach erfolgt die Fusion zu diploiden Stadien. 7. Metazyklische Form = infektiöse trypomastigote Form in der Speicheldrüse. Dieses Stadium besitzt wieder ein VSP surface coat und das Mitochondrium wird in der Ausdehnung reduziert. Für die gesamte Entwicklung werden temperaturabhängig etwa 25 - 50 Tage benötigt. Die Tse-Tse-Fliegen bleiben lebenslang (etwa 3 Monate) übertragungsfähig und können bis zu 50 000 metazyklische Stadien bei Stich injizieren - etwa 500 reichen allerdings bereits für eine sichere Infektion aus. ES entstehender, bei Übertragung voll ausgebildeter VSG-SC, F Geißel, KF Kurzflagellum, KI Kinetoblast, MI Mitochondrium, N Nukleus, Kern, SC Surface coat Klinik Klinisch verläuft die Trypanosomose beim Rind akut (Fieber, Anämie) meist subakut oder chronisch (schwere Anämien, intermittierndes Fieber). Bei kleinen Wiederkäuern verläuft die Erkrankung im allgemeinen chronisch. Zu Beginn der Erkrankung (7. - 10. Tag p. i.) treten lokale Hautreaktionen auf. Im typischen Fall führt die Infektion beim Rind und beim kleinen Wiederkäuer zu einem fortschreitenden Konditionsverlust bei zunehmender Schwäche, extremer Abmagerung und schließlich Tod. Gesamtprotein, Albumin und hämolytische Komplementaktivität werden reduziert. Auch hohe Sterilitätsraten werden auf die Trypanosmeninfektion zurückgeführt. In Ostafrika gilt T. congolense als die gefährlichste Art, in Westafrika nimmt die Stellung T. vivax ein. Protozoa 9 Diagnose Die Diagnose wird durch eine Herdenanamnese (Rückgang der Milch- und Fleischleistung) sowie durch verschiedene Nachweismethoden gestellt: • • • • • bei frischer Infektion durch Parasitennachweis im Blutausstrich bei schwacher später Infektion durch Anreicherung mittels QBC chromatographische Anreicherungmittel: DEAE-Zellulose Mäuseinokkulationstest Serologie: ELISA und IFAT Therapie • • • • Diminazenaceturat (BERENIL , 3,5 - 8,0 mg/kg i. m.) Quinapyraminduimethylsulfat (ANTRYCIDE , u. a., 5 mg/kg KM s. c.) Homidiumbromid oder -chlorid (ETHIDIUM , NOVIDIUM , 1 mg/kg KM i. m.) Isomethymidiumchlorid (SAMORIN , TRYPAMIDIUM , 0,5 mg/kg KM i. m.) Beim Vorliegen resistenter Erreger ist Berenil das Mittel der Wahl, da zwischen den anderen Substanzen fast immer Kreuzresistenz vorliegt. Bei der selten vorkommenden Diminazenaceturat-Resistenz ist die Dosis auf 7,0 - 8,0 mg/kg KM zu erhöhen. Bekämpfung Bekämpfung der afrikanischen Trypanosomose des Rindes in Afrika: • Überwachungs- und Behandlungsmethode: Bei der Überwachung und Behandlung werden entweder nur erkrankte Tiere therapiert oder eine ganze Herde wird therapeutischen Maßnahmen unterworfen, wenn bei regelmäßigen Kontrolluntersuchungen etwa 20 % der Rinder Trypanosomen im Blut haben. • Chemoprophylaxe: Eine Chemoprophylaxe kann durch die regelmäßige Injektion von Substanzen mit Depotwirkung im Abstand von 6 - 10 Wochen durchgeführt werden (z. B. Isomethymidiumchlorid (SAMORIN , TRYPAMIDIUM , 1,0 mg/kg KM tief i. m. oder s. c. im Triel). Die Resistenzentwicklung kann durch zwischenzeitliche Injektionen von Diminazenaceturat verzögert, jedoch nicht verhindert werden. Überwachung und Behandlung sowie Chemoprophylaxe sind nur in Gebieten mit niedrigem Infektionsrisiko möglich. • Tsetsekotrolle und –eradikation: Zur Tsetsekontrolle setzten sich zunehmend einfach herzustellende bikonale Fallen nach Callier und Laveissiere und mit Insektiziden imprägnierte Schirmwände durch. Die etwa 1,5 m großen Fallen werden an Baumästen oder spezielle gebauten Gerüsten aufgehängt. Die Fliegen werden zunächst durch die Silouette der Falle, dann durch ein schwarz erscheinendes rundes oder ovales Loch im unteren Konus angelockt. Sie fliegen inein und erden dann durch den Lichteinfall einer an der Spitze des oberen Konu befindlichen Öffnung angelockt. Darüber befindet sich ein kleiner Käfig, in dem sich die Fliegen sammeln. In den Fallen könne auch Insektizid-geträngte Stoffstreifen aufgehängt werden. Zur besseren Anlockung können Duftstoffe (z. B. Extrakt aus Warzenschweinhaut) in den Fallen verbracht werden. Danach werden Insektizide versprüht und Biotopveränderungen vorgenommen (z. B. landwirtschaftliche Bearbeitung, Fällen von Schattenbäumen zur Beseitigung der Brutplätze). Die Tsetsekontrolle beim Rind wird auch durch regelmäßige Applikation von Pyrethroiden im Pour-on-Verfahren eingesetzt. Durch das einziehen von pyrethroidhaltigen Ohrmarken läßt sich die Infektionsrate vermindern, nicht aber ganz verhindern. Die sehr aufwendige Tsetseeradikation (systemische Insektizidversprühung, Biotopveränderungen, Sterile-Männchen-Technik) war auf Dauer bisher nur in vergleichsweise winzigen, isolierten Tsetsegebieten erfolgreich. Protozoa 10 • Einführung trypanotoleranter Rassen: Trypanotolerante Rinderrassen sind durch natürliche Selektion in Westafrika entstanden. Es sind taurine, zwergwüchsige Rinder mit geringer Leistung (z. B. N’Dama, Baoule, Westafrican Shorthorn). Auch bei Schafen und Ziegen haben sich in Westafrika trypanotolerante Zwergrassen herausgebildet. Auch diese Tiere können in Gebieten mit niedrigem oder mittlerem Infektionsrisiko überleben. In der feuchten Guineazone mit sehr hohem Infektionsrisiko ist auch bei ihnen eine Chemoprophylaxe erforderlich. • Vakzinierung: Eine Vakzinierung ist aufgrund der Fähigkeit der Trypanosomen zur Antigenvarianz zur Zeit noch nicht möglich. Surra (T. evansi) Vorkommen Surra kommt in Nordafrika, Asien, Mittel- und Südamerika bei Kameldiden, Pferden, Wiederkäuern und Hunden vor. Pathogenese, Pathologie T. evansi wird azyklisch durch Tabaniden und Stomoxys calcitrans sowie in einigen Teilen Südamerikas auch durch Vampire übertragen. Es wird angenommen, daß T. evansi aus T. brucei brucei durch Vektorenwechsel entwickelt hat. Wegen beträchtlicher Leistungsminderungen bei Nutztieren hat die Surra in vielen Verbreitungsgebieten in Afrika und Asien große wirtschaftliche Bedeutung. • • • Die Pathogenität einzelner T. evansi-Stämme ist sehr unterschiedlich. Die Krankheit verläuft bei Wiederkäuern in der Regel milder als bei Equiden und Kamelen. Das Krankheitsbild ist dem der Nagana sehr ähnlich. Diagnose (wie bei Nagana) Die Diagnose wird durch eine Herdenanamnese (Rückgang der Milch- und Fleischleistung) sowie durch verschiedene Nachweismethoden gestellt: • • • • • bei frischer Infektion durch Parasitennachweis im Blutausstrich bei schwacher später Infektion durch Anreicherung mittels QBC chromatographische Anreicherungmittel: DEAE-Zellulose Mäuseinokkulationstest Serologie: ELISA und IFAT Therapie • • Diminazenaceturat (BERENIL , 5,0 - 10,0 mg/kg i. m.). Bei Kamelen wirkt Diminazenaceturat toxisch. Quinapyraminduimethylsulfat (ANTRYCIDE , u. a., 5 mg/kg KM s. c., bei Kamelen 3,0 - 5,0 mg/kg s. c. aufgeteilt auf 2 Injektionen im Abstand von 6 Stunden) Protozoa 11 Pferde/ Equiden Übersicht über die beim Pferd vorkommenden Erkrankungen Erkrankung Erreger Trypanosoma Nagana brucei Trypanosoma Surra evansi Trypanosoma Mal de equinum Cadras Vorkommen nur in Afrika (südlich der Sahara) in Afrika (v. a. Verbreitungsgebiet von Kamelen) in Südamerika Übertragung zyklisch durch Glossinen, mechanisch durch Tabaniden mechanisch durch Tabaniden und Stomoxys mechanisch durch Tabaniden, Stomoxys und Vampire Diagnose Blutausstrich Giemsafärbung Blutausstrich Giemsafärbung Blutausstrich Giemsafärbung Serologie: diagnostisch relativ unbedeutend. Nach einer Chemotherapie (Suramin, Diminazen, QuinapyraminSulfat) fällt die Antikörperkonzentration im Rahmen von Monaten ab. Nagana • • • • • • Haupterreger: Trypanosoma brucei Nebenerreger: Trypanosoma congolense, Trypanosoma vivax Vorkommen: Afrika (südlich der Sahara) bei Equiden, Wiederkäuern, Schweinen und Hunden Reservoirwirte: Antilopen Übertragung: Glossina-Arten (Tse-Tse-Fliege), Stechrüssel, Darm und Speicheldrüsen Klinik: akute und perakute Erkrankung führen ohne Behandlung zum Tod und chronische Erkrankungen zu zentralnervösen Schädigungen (Hydrocephalus, Ödematisierung des Gehirns) • Diagnose: siehe Nagana der Rinder • Therapie: Suramin (10 mg/ kg i. v. 2 - 3 x im wöchentlichen Abstand), Diminazen (5 - 7 mg/ kg i. m.) und Quinapyraminsulfat ( 3 mg/ kg) Surra • • • • • Haupterreger: Trypanosoma evansi Vorkommen: Nordafrika und Asien (Verbreitungsgebiet der Kamele) Reservoirwirte: Kamel Übertragung: Tabaniden und Stomoxys Klinik: intermittierendes Fieber, Schwäche, Ödeme Meningoencephalitis, Tod nach 2 - 3 Monaten (Pferd), subakut bis chronische Erkrankung (Esel) • Therapie: Suramin, Diminazen und Quinapyraminsulfat Mal de Caderas • • • • • Haupterreger: Trypanosoma equinum Vorkommen: Südamerika Reservoirwirte: Wasserschweine, Hunde und Rinder Übertragung: Tabaniden, Stomoxys und Vampire Klinik: Verlauf akut oder chronisch, Kreuzlähme, Abmagerung, Schwäche und Ödeme Protozoa 12 • Diagnose: direkter Erregernachweis oder indirekter Erregernachweis durch serologische Untersuchugen (DAT, ELISA, IFAT) • Therapie: Suramin, Diminazen und Quinapyraminsulfat Beschälseuche/ Dourine (T. equiperdum) Erreger, Vorkommen und geographische Verbreitung Der Erreger ist T. equiperdum. Der vorwiegend im Gewebe persistierende Erreger ist morphologisch nicht von T. evansi zu unterscheiden. Die Erkrankung ist weltweit verbreitet. In Mitteleuropa ist sie seit den 50ger Jahren getilgt. In Italien wurde der letzte Ausbruch 1984 registriert Entwicklung und Epidemiologie Die Übertragung erfolgt durch den Deckakt. Gelegentlich kommt es galaktogen zu einer Übertragung (?). Die Trypanosomen vermehren sich zunächst lokal in Läsionen der Genitalschleimhaut, treten dann im Blut auf und dringen schließlich in das Zentralnervensystem ein. Pathogenese und Klinik Es st eine meist chronisch verlaufende Erkrankung. nach 2 bis 12 Wochen kommt es zunächst zu einer Ödematisierung der Vulva, des Präputiums und des Skrotums. Schleimiger Ausfluß und Schwellung der Scham- und Inguinallymphknoten. Es treten pigmentlose Stellen an der Vulva auf. Die anschließende Allgemeinerkrankung geht einher mit typischer Urtikaria (Talerflecken) in Form 3,0 - 5,0 cm2 großen ringförmigen Quaddeln an Hals, Schulter, Unterbrust und Kruppe. Schließlich treten motorische Lähmungen, charakteristische Ausfallserscheinungen bzw. einzelner Nerven (Nachschleifen der Hinterhand und Beugehaltung des Sprunggelenkes sowie periphere Polyneurtidn) auf. Diagnose und Therapie Direkter Parasitennachweis im Genitalsekreten und frischen Hautveränderungen. Zur amtlichen Diagnose ist eine KBR vorgeschrieben. Es eignen sich ebenfalls IFAT und ELISA. In der Regel werden befallene Tiere euthanasiert. Ausnahmsweise kann bei besonders wertvollen Tieren folgendes eingesetzt werden: • • • • Diminazenaceturat (BERENIL , 3,5 mg/kg i. m.) Quinapyraminduimethylsulfat (ANTRYCIDE , 5 mg/kg KM s. c.) Suramin (NAGANOL , 2 x 2 g i. v. im Abstand von 14 Tagen) Isomethymidiumchlorid (SAMORIN , 0,25 mg/kg KM i. m.) Hund / Mensch Chagas-Krankheit (T. cruzi) Beschreibung Die Chagas-Kranheit ist eine in Südamerika auftretende Erkrankung des Menschen. Gemäß der WHO ist diese Erkrankung eine der wichtigsten Infektionskrankheiten in einigen Ländern Südamerikas. Protozoa 13 Übertragung Für die Übertragung der Erkrankung ist die Raubwanze (Reduviidae) verantwortlich. der Hund st dabei der wichtigste Reservoirwirt. Die Abbildung zeigt den Entwicklungszyklus von Trypanosoma cruzi (VSG-Surface coat als Oberflächliche Striche dargestellt) ES entstehender, Surcface coat, F Geißel, KF Kurzflagellum, KI Kinetoblast, MI Mitochondrium, N Nukleus, NH Kern der Wirtszelle, SC Surface coat, WZ Wirtszelle 1. A- bzw. mikromastigotes Stadium direkt im Cytoplasma von verschiedenen Wirtszellen, z. B. RES-Zellen, Herzmuskel. Diese Stadien vermehren sich durch Zweiteilung so stark, daß cystenartige Nester entstehen (sog. Pseudozysten). 2. Transformation zur trypomastigoten Form, die eine Surface coat besitzt (via epimastigote Stadien). 3. Transformation zur trypomastigoten Form. 4. Trypomastigote Form im Blut nach Aufreißen der Wirtszelle. Dieses Stadium wird von den Raubwanzen beim Stich übernommen. 5. Nach dem Sich folgt eine kontinuierliche Umwandlung zur epimastigoten Form während häufiger Längsteilungen im Mitteldarm der Raubwanze. 6. Epimastigote, teilungsaktive Form im Enddarm der Wanze 7. Metazyklische Form = übertragungsbereite, trypomastigote Form aus dem Rektum der Wanze. Dieses sich nicht mehr teilende Stadium vollzieht eine Veränderung im Aufbau seines Surface coats, der in allen Stadien zwar gleich dünn, der chemisch anders strukturiert ist. nach Abgabe in Kottropfen der Wanze dringt es durch den Strichkanal oder direkt über Schleimhäute in den Wirbeltierwirt ein. LEISHMANIOSE, Leishmania spp. Leihmania-Infektionen (Auswahl) bei Menschen, Hund und Katze Leishmania-Arten/ UnterGeographische Verbreitung Wirte arten vorwiegend viszerale Leishmanioseformen L. donovani dovovani Asien (China, Indien, u. a.) Mensch L. donovani sp. Kenia, Somalia Mensch, Hund L. donovani chagasi S. - und Z.-Amerika Mensch, Hund. Fuchs Mittelmeerländer (v. a. PorMensch, Hund, Fuchs, L. infantum tugal bis Italien), Mittlerer Ratten Osten, Asien vorwiegend kutane Leishmanioseformen Naher/ mittlerer Osten (ab Mensch, Hund, Katze L. tropica Balkan), Indien (Stadtgebiete) Krankheitsbezeichnung beim Menschen Kala-Azar Viszerale Leishmaniose Kutane Leishmaniose Protozoa L. major 14 Naher/ mittlerer Osten, Afrika, Asien (GUS) Mensch, Nager, Musteliden L. braziliensis braziliensis Brasilien Mensch, Tiere? L. mexicana mexicana L. mexicana pifanoi Mensch, Nager Mensch, Nager Mexiko, Belize, Guat. Venezuela Orientbeule Mucocutane Haut- und Schleimhautleishmaniose Amerikanische Haut- und Schleimhautleishmaniose Entwicklungszyklus von Leishmania-Arten B Basalapparat, F Flagellum, KF Kurzflagellum, KI Kinetoblast, N Nukleus, NH Kern der Wirtszelle, PV parasitophore Vakuole, RW Reste des Wirtszellcytoplasmas, WZ Wirtszelle. Alle Stadien besitzen einen dünnen Surface coat, der sich allerdings in den beiden Wirten im Aufbau unterscheidet. 1. Promastigotes Stadium wird nach dem Stich von einem Makrophagen im Hauptbereich aufgenommen, meist mit der Geißel voran. 2. Umwandlung zu einer mikromastigoten Form (im Wirtszytoplasma, in Vakuolen, sog. Phagosomen) binnen 24 Stunden. 3. Vermehrung durch Zweiteilung. Die Wirtszelle wird stark gedehnt und platzt schließlich, vorher liegen die Parasiten häufig direkt in de Resten des Wirtscytoplasmas. Bei Arten des L. donovani-Komplexes befallen mikromastigote Stadium auch das RES innerer Organe. 4. Mit dem Stich aufgenommene mikromastigote Formen wandeln sich im Darm der Sandmücke zu promastigoten Formen um, die sich in der Darmwand mit den Geißen anhaften. 5. Vermehrung durch Längsteilung. 6. Differenzierung zum schließlich infektiösem Stadium. Die Reifung zu Infektionsstadien und die Vermehrung findet vor allem nach dem Aufreißen der als „Sack“ ausgebildeten peritrophischen Membran statt. Die Parasiten heften sich dann an die Darmwand mit Hilfe ihrer Geißel fest, gelangen so in den Vorderdarm und von dort aus beim nächsten Stich wieder in einen neuen Wirt. Allerdings haben sie auch hier zuvor metazyklische Formen (von 5 - 8 µm) Länge). Die gesamte Entwicklung in der Mücke dauert meist nur 5 Tage. 7. s. 6. Hund/ Mensch Erreger Die Leishmaniose der Hunde wird in der alten Welt im wesentlichen durch Leishmania donovani und L. infantum hervorgerufen. In welchem Umfang Infektionen mit L. tropica oder möglicherweise mit L. major beim Hund Protozoa 15 zu Erkrankungen führen, bleibt abzuklären. In Südamerika wird die Leishmaniose des Hundes durch L. braziliensis verursacht. Auch die Katze kann gelegentlich infiziert sein. Übertragung Die Übertragung der Leishmaniose erfolgt inokulativ durch Phlebotomen, sog. Schmetterlingsmücken, die als Vektor dienen In der alten Welt sind es Phlebotomus-Arten und in der neuen Welt sind es Lutzomyia-Arten und eine Psychodopygus-Art. Vorkommen Die Leishmaniose ist in tropischen und subtropischen Gebieten Asiens, Afrikas und Amerikas verbreitet. In Europa tritt sie vorwiegend in den Mittelmeerländern auf. In Griechenland, Spanien und Italien haben regional bis zu 28 % der Hunde Serumantikörper gegen Leishmanien. Autochthone Fälle wurden auch aus der Schweiz bereichtet. Phlebotomerarten, die potentiell Leishmanien übertragen können, sind im Kanton Tessin bereits nachgewiesen worden. In weiter nördlich gelegenen Ländern nahm mit dem Anwachsen des Tourismus auch die Zahl der eingeschleppten Fälle an Hundeleishmaniose zu. Morphologie der Erreger Die im Säugetierwirt zu findenden Leishmanien sind eiförmig oder rund und 2,5 - 5,0 x 1,22 µm groß. Im gefärbten Präparat sieht man einen deutlichen Kern und einen intensiv gefärbten stäbchenförmigen Kinetoblasten. Die einzelnen im Hund parasitierenden Leishmania-Arten lassen sich weder morphologisch noch serologisch unterscheiden. Im Gegensatz zum Menschen rufen sie auch ein gleichartiges Krankheitsbild hervor. Entwicklung und Epidemiologie Im Wirbeltierwirt parasitiert L. donovani in der amastigoten (geissellosen Form) in Zellen des retikuloendothelialen Systems (vorwiegend in der Leber, Milz, Knochenmark und Lymphknoten). Die Vermehrung erfolgt intrazellulär durch Zweiteilung. Hauptwirte sind im Mittelmeerraum Mensch und Hund. Überträger sind vor allem dämmerungs- oder nachtaktive Schmetterlingsmücken der Familie Phlebotomidae, die mit der Blutmahlzeit insbesondere in Monozyten enthaltenen Leishmanien aufnehmen. Im Mitteldarm der Mücken wandeln sich die amastigoten Leishmanien in promastigote (begeißelte) Formen um, vermehren sich stark, gelangen in den Oesophagus und werden beim Saugakt in einen neuen Wirt übertragen. Pathogenese Es kommt zu einer raschen Vermehrung der T-Zell-Population. B-Zellen in den Lymphknoten proliferieren. De Parasiten verteilen sich trotz hoher Antikörpertiter über den ganzen Organismus. Gewöhnlich werden enorme Mengen an Immunglobulinen produziert. Zirkulierende Antigen-Antikörper-Komplexe werden vor allem für das Auftreten von Glomerulonephritis, Polyarthritis und Vaskulitis verantwortlich gemacht. Als Haupttodesursache gibt Nierenversagen. Die tritt normaler Freßlust auftretende Abmagerung wird auf eine Konkurrenz um essentielle Aminosäuren (Tryptophan) zurückgeführt. Pathologie und Klinik Im Mittelmeergebiet wird die durch L. infantum hervorgerufene (viszerale) Kinderleishmaniose beobachtet. Bei Hunden wird unabhängig von der Leishmanienart immer eine generalisierte Form festgestellt, bei der es regelmäßig auch zu Hautveränderungen kommt. Pathologisch-anatomische Veränderungen sind Splenomegalie, Hepatomegalie sowie allgemeine Lymphknotenschmwellungen und oft auch zu einer Glomerulonephritis. Röntgenologisch wird eine Proliferation des Periostes und Osteolyse der Knochen festgestellt. Protozoa 16 Haut: Im Bereich der Ohrmuscheln, an den Lidrändern, am Nasenrücken und an den Ellenbogen fallen weißliche, grobe Schuppungen, Bokenbildung, kleine herdförmige Knötchen und Haarausfall auf. Gelegentlich sieht man auch Ulzera mit braungelblichen Krusten, an Augen gelegentlich eine Endophthalmitis. Atypische Verlaufsformen treten unter Ausbildung tumorartiger, erregerarmer Histiozyteninfiltrate in inneren Organen auf. Erkrankungssymptome: Einsetzten mäßiger fieberhafter Temperaturschwankungen, Diarrhoe, Abmagerung und Anämie. Lokomotorische Störungen, wie Schwäche der Hinterhand, Gleichgewichtsstörungen, Hinken und Stimmverlust. Die Inkubationszeit beträgt mehrere Wochen bis Monate, in seltenen Fällen bis zu einem Jahr. In der Regel endet die chronische Erkrankung beim Hund mit dem Tod. Eine Chemotherapie bewirkt meist nur eine klinische Heilung, die Wochen oder Monate dauert. Die Wunden hinterlassen deutliche Narben. Diagnose • • • • Giemsa-Färbung von Ausstrichen aus Lymphknoten- oder Knochenmarksbiopsien Serologie mit ELISA und Western blot: − diagnostische Sensitivität des Antikörpernachweises im ELISA > 95 % und Spezifität des ELISA > 90 %), geringe Kreuzreaktion mit Babesia, relevante Kreuzreaktionen mit Trypanosoma möglich. − Western blot vermittelt eine 100 %ige Spezifität (CAVE: gilt nur L. infantum des Mittelmeerraumes) Erregeranzüchtung (Popliteallymphknotenpunktat) Typisierung in-vitro-isolierter Parasiten mittels Isoenzymmuster und PCR Therapie der Leishmaniose des Hundes Allopurinol: Langzeittherapie mit Allopurinol (20 mg/ kg KM täglich oral über Monate bis Jahre) Antimonpräparate: Sie bewirken selten eine dauerhafte klinische Heilung. Die Therapie ist mit erheblichen Nebenwirkungen verbunden. Hunde mit Nephritis sind von der Therapie auszuschließen. Eingesetzt werden: • Megluminantimonat: − 1. und 2. Tag: 100 mg/ kg KM und 3. - 10. Tag: täglich 200 300 mg/ kg KM, 2 x im Abstand von 14 Tagen s. c. oder langsam i.v. − 75 mg/ kg KM 2 x täglich s. c. über 14 Tage • Natrium-Stibogluconat (10 - 20 mg/ kg KM täglich über 2 x 10 Tage mit 10 tägigem Intervall mit viel Flüssigkeit i. v.) Kombinationen: • Megluminantimonat (100 mg/ kg KM) + Allopurinol (30 mg/ kg KM), täglich bis zur klinischen Heilung, dann jeweils über 1 Woche 1 x pro Monat Allopurinol (20 mg/ kg KM). Weitere Behandlungsmaßnahmen: • Kombination mit Corticosteroiden, z. B. Prednisolon (1 - 2 mg/ kg KM täglich) • antibakterielle Therapie der Hautulzera Protozoa 17 HEXAMITIDAE GIARDIOSE, Giardia spp. Allgemeines Es handelt sich bei Giardien um Protozoen, die bei Menschen und bei Tieren im Dünndarm extrazellulär vorkommen. Es sind Parasiten, die zu Enteritis führen können. Die Giardiose ist eine Zoonose. Deshalb ist die Giardien-Infektion bei Hund und Katze veterinärmedizinisch von besonderem Interesse. Gelegentlich erkranken auch Kälber und Lämmer. Vorkommen und geographische Verbreitung Giardia sind weltweit vorbereitet, jedoch mit regional unterschiedlicher Befallshäufigkeit (0,5 % - 18 % für Hunde, 2,0 - 3,0 % für Katzen). Aus den USA werden bei Hunden Infektionsraten bis zu 50 % und bei Katzen bis zu 16 % berichtet. Eine epidemiologische Untersuchung in der Schweiz ergab, daß 6,5 % der Hunde und 5,3 % der Katzen mit Giardia befallen sind. Durch eine andere epidemiologische Studie wurde festgestellt, daß 27 % der Kälber und 30 % der Schaflämmer Giardia-Zysten ausschieden. Erreger Bei Giardia unterscheidet man folgende Entwicklungsformen: • Trophozoit: Der Trophozoit (vegetative Form) ist 11 - 17 µm lang, besitzt die Form einer halben Birne, die dorsal aufgewölbt und ventral im vorderen Teil mit einer Saugscheibe („Adhäsonsscheibe“) versehen ist, die zur Anheftung an Epithelzellen des Dünndarms dient. Der Trophozoit hat 2 Kerne, 8 Geißeln und einen sog. Mediankörper. • Zyste: Die in der Entwicklung gebildeten Zysten (exogenes Dauerstadium) werden mit dem Kot ausgeschieden. Sie sind rundoval (9 - 15 x 7 - 11 µm), besitzen 4 Kerne, Geißeln und einen Mediankörper. Früher sprach man von ca. 40 Giardia-Arten, heute aufgrund moderner molekularbiologisch-taxononischer Untersuchungen von 3 Gruppen: G. duodenalis (G. lambia, G. intestinalis), G. murris und G. agilis. Die in der Giardia duodenalis-Gruppe enthaltenen Arten lassen sich morphologisch nicht unterscheiden. Pathogenese und Klinik Giardia-Befall kann besonders bei Tieren im ersten Lebenshalbjahr zu einer katarrhalischen Entzündung des Duodenums und Jejunums führen. Folgen sind eine Atrophie von Darmzotten und eine vermehrte Desquamation von Epithelzellen. Die Giardiose ist eine Faktorenerkrankung, die erst bei vorliegen einer entsprechenden Disposition manifest wird. In vielen Fällen verläuft jedoch die Giardiose symptomfrei. Licht- und Raster-EM-Untersuchungen ließen verschiedne Veränderungen am Darm erkennen. Dazu zählen zirkuläre, der Adhäsionsscheibe der Trophozoiten entsprechende Läsion der Mikrovilli der Epithelzellen, Verkürzung und Vakuolisierung der Mikrovilli, Degeneration von Epithelzellen und Epithelzellverlust, kleine Zottenulzera mit eingedrungenen Trophozoiten, Abflachung und Verkürzung der Zotten und Ödeme sowie herdförmige Zellinfiltration in der Lamina propria. Protozoa 18 Diese morphologischen Veränderungen sind mit diversen Funktionsstörungen verbunden. Dazu zählen Enteritis und Durchfall,Malabsorption von Kohlenhydraten, Fetten und evtl. von Vitaminen und bei schweren Darmveränderungen: Proteinverlust in den Darmkanal. Entwicklung und Epidemiologie Die Infektion erfolgt durch die orale Aufnahme von Zysten mit kontaminiertem Futter oder Trinkwasser. Im Dünndarm parasitieren de vegetativen Stadien (Trophozoiten) vorwiegend im proximalen Abschnitt, wo sie frei zwischen den Zotten oder mit der ventralen Adhäsionsscheibe am Epithel haftend angetroffen werden. Die Entwicklung erfolgt ohne Wirtswechsel (homoxene Entwicklung). Durch eine ungeschlechtliche Vermehrung (Zweiteilung) des Trophozoiten kommt es zu einer intensiven Vermehrung, die bei gesunden oder erkrankten Individuen zu einem Massenbefall führen. So wurden bei einem gesunden Kaninchen über 1 Mio. Trophozoiten pro cm2 Schleimhautfläche festgestellt. Der Hautbildungsort für die Zysten ist der Blinddarm. Die Präpatenz dauert nach der oralen Aufnahme von Zysten 5 - 16 Tage. Die Ausscheidung der Zysten erfolgt intermittierend für 4 - 5 Wochen. Zysten bleiben in der Außenwelt unter günstigen Bedingungen mindestens 3 Wochen lang infektiös. Symptome • Hund: chronisch rezidivierender Durchfall mit schleimigem Kot, der Blut enthalten kann, auch Erbrechen. Am häufigsten bei Junghunden bis zum Alter von 6 Monaten. • Katze: schleimiger, fettiger Kot und Gewichtsverlust. • Wiederkäuer: in der Regel symptomlos • Menschen: Hauptsymptome sind Durchfall und Oberbauchbeschwerden, Fettstuhl und Malabsorption. Immunpathologie Die experimentelle Infektion empfänglicher Mäusestämme mit Giardia lamblia erwies sich als geeignetes Modell, immunpathologische Aspekte der Wirt-Parasit-Interaktion zu studieren. Es zeigt sich, daß Giardia labliaKlone i. d. R. auf ihrer Oberfläche in dominantes Proteinantigen exprimieren, daß seine antigenen Eigenschaften variieren kann (VSP = variable surface protein). Experimentelle Infektionen persistieren bei immunkompetenten Mäusen während 6 Wochen und heilen anschließend ab. Ein Verlust der ursprünglichen OberflächenAntigenvariante kann am 12. Tag nach Infektion festgestellt werden. Die Tiere reagieren mit einer parasitenspezifischen humoralen (IgG und IgA) Immunantwort bei T-Lymphozyten (v. a. CD4+-Zellen) in Pleyer’schen Platten. In immundefizienten scid-Mäusen tritt keine „Antigenvariante“ auf, was darauf hinweißt, daß IgA für das Phänomen der „Antigenvariante“ verantwortlich sein könnte. Diagnose • Dünndarmabstrich mit mikrokopischer Untersuchung bei der Sektion • Nachweis von Zysten (seltener von Trophozoiten) bei Kotuntersuchungen mit geeigneten Untersuchungsverfahren (z. B. SAF-Methode, Anreicherung mit Zinksulfatlösung (D: 1.2)). Evtl. sind mehrmalige Untersuchungen bei verdacht auf Giardiose notwendig, da die Ausscheidung der Erreger unregelmäßig erfolgt. Aus Amerika werden gute Diagnoseerfolge mit dem aus der Humanmedizin übernommenen Entero-Test berichtet, bei dem an einem faden befestigte Gelatinekapsel eingegeben wird, die im Duodenum einen Docht entläßt. Protozoa 19 Der mit Duodenalsaft vollgesogene Docht wird zurückgezogen und mikroskopisch auf vegetative Giardien untersucht. Bei Sektion findet man häufig noch 24 Stunden post mortem lebende Trophozoiten in Abstrichen der Dünndarmschleimhaut (am ehesten am Beginn des Jejunums). Sie sind nativ an ihrer schaukelnden Bewegung leicht zu erkennen. Therapie Zur Behandlung erkrankter Tiere wird Nitroimidazol-Verbindungen eingesetzt, u. a. Metronidazol und Ornidazol. Neuerdings bewähren sich auch einige Benzimidazole, insbesondere Albendazol. Die Behandlung führt oft nicht zur völligen Erregerelimination, doch aber zu einer deutlichen klinischen Besserung. Hund: • Metronidazol (FRAGYL , ELYZOL ), 12,5 - 22,0 mg/ kg KM, 2 x täglich über 5 Tage • Ipronidazol (IPROPAN ), 126,0 mg/ l Trinkwasser über 7 tage • Tinidazol (FASUGYN ), 44,0 mg/ kg KM über 3 Tage Katze: • Metronidazol (FRAGYL , ELYZOL ), 22,0 mg/ kg KM, 2 x täglich über 5 Tage Da Giardia-Infektionen in den Hunde- und Katzenpopulationen offenbar weltweit verbreitet sind, wird empfohlen nur erkrankte Tiere und nicht jeden Ausscheider zu behandeln. Eine Behandlung von Ausscheidern kann jedoch ratsam sein, wenn diese Tiere eine potentielle Infektionsquelle für Menschen (Kleinkinder) darstellen. Wirtsspezifität und epidemiologische Aspekte Im allgemeinen galt bis vor kurzer Zeit eine hohe Wirtsspezifität der verschiedenen Giardia-Arten als wahrscheinlich. In den letzten Jahren mehren sich jedoch die Hinweise dafür, daß dieser Auffassung einer Reversion bedarf und zwar aufgrund folgender Faktoren: • Bei einem Ausbruch von Giardiose bei den Bewohnern von Rome im Staate New York in den USA wurde das städtische aus einem natürlichen Reservoir stammende und ungenügend chlorierte Trinkwasser als Infektionsquelle ermittelt. Nach der Übertragung von G. lamblia-Zyten aus dem Stuhl eines erkrankten Patienten auf 2 Hunde, erkrankten beide Tiere an Giardiose. • In einem (aus ethisch-moralischen gründen umstrittenen) Selbstversuch gelang es einer polnischen Ärztin, eine Infektion von einem Tierisolat auf sich selber zu übertragen. Generell können wir annehmen, daß in Abhängigkeit verschiedener Isolate die Krankheit hervorgerufen wird, wobei nicht nur das Patientenisolat, sondern wahrscheinlich auch eine Wirtsprädisposition für eine diesbezügliche Erkrankung vorliegen könnte. MONOCERCOMONADIDAE HISTOMONOSE, Histomonas spp. Allgemeines Die pathogene Art ist Histomonas meleagridis. Er ist einer der ätiologischen Faktoren der Blinddarm/ Leberentzündung von Truthuhn und Huhn (Synonyme: enzootische Typhlohepatitis, infektiöse Enterohepatitis, „blackhead disease“, Schwarzkopfkrankheit). Protozoa 20 Vorkommen und geographische Verbreitung • • Histomonas meleagridis parasitiert in den Blinddärmen (Lumen und Mucosa) sowie in der Leber von Truthühnern. Hühner sind häufig befallen, erkranken aber relativ selten. Beim Truthuhn (Pute) kommt es häufiger zu Erkrankungen. Geographische Verbreitung: weltweit. Histomonas wennchi lebt in den Blinddärmen und Hühnervögeln und ist apathogen. Morphologie • • Gewebe-Form: vielgestaltig, 6 - 20 µm Durchmesser, amöboid beweglich, lebt extrazellulär im Gewebe (Blinddarm und Leber) Lumen-Form: 5 - 10 µm Durchmesser, amöboid beweglich, mit einer, selten mit 4 kurzen Geißeln; im Lumen der Blinddärme, in vitro entwickelt sich dieser Parasit in dieser Gestalt. (Die Vermehrung der verschiedenen Stadien erfolgt durch asexuelle Vermehrung.) Entwicklung und Epizoologie Übertragung: Trophozoiten werden mit dem Kot latent infizierter oder erkrankter Truthühner, Hühner oder wildlebender Hühnervögel (Fasan, Wachtel, u. a.) ausgeschieden. Sie sind in der Außenwelt wenig resistent und gehen bei + 20°C in wenigen Stunden zugrunde. Die Übertragung von H. meleagridis kann auf verschiedenen Wegen erfolgen: • durch Futter, das mit frisch abgesetztem, erregerhaltigem Kot kontaminiert ist, • durch embryonierte Eier, der in den Blinddärmen von Hühnervögeln parasitierenden Nematoden-Art Heterakis gallinarum, • durch Arthropoden (Fliegen, Heuschrecken) und Regenwürmer, die infizierte Eier von H. gallinarum verschleppen. Nach heutiger Auffassung ist der Übertragungsweg durch embryonierte Eier am wichtigsten. Die Entwicklungsstadien von H. meleagridis sind in weiblichen H. gallinarum nachweisbar, wo sie sich in der Keimzone des Ovariums zunächst extrazellulär vermehren, und dann im distalen Teil in die sich bildenden Eier eindringen. In den in die Außenwelt gelangten, sehr wiederstandsfähigen Eiern von H. gallinarum kann der Parasit mehrere Monate bis jahrelang (150 Wochen) überleben. Entwicklung im Wirt: Die in den Darmkanal gelangten Parasiten leben im Lumen in der begeißelten Form. Unter bestimmten, nicht näher bekannten Bedingungen wandern sie in die Wand des Zaekums ein, nachdem sie die Geißel abgeworfen und sich dadurch in das Invasiosstadium umgewandelt haben. Dieses dringt mit Hilfe der Pseudopodien in die Tiefe, löst offenbar durch extrazelluläre Verdauung, Zellen und Gewebe auf und ernährt sich durch Phagozytose von Gewebstrümmern. Vom Darm aus können die Parasiten mit dem Blutstrom in die Leber gelangen. Diese ebenfalls im Gewebe zu beobachtende Form bewegt sich wenig und liegt in abgerundeter Gestalt zwischen den Zellen. In Späteren Phasen der Infektion werden viele dieser Stadien von Riesenzellen und Makrophagen aufgenommen und zerstört. Sowohl erkrankte als auch gesunde Träger können den Erreger mit dem Kot ausscheiden. Die Erkrankung tritt am häufigsten bei Truthühnern im Alter von 3 Wochen bis zu 3 - 4 Monaten zur Zeit der Mauser und der Entwicklung der Schwellkörper des Kopfes auf. Der Verlauf ist bei dieser Altersgruppe gewöhnlich akut und mit hoher Mortalität verbunden, die bei mehr chronischre Erkrankung älterer Tiere abnimmt. Hühner sind weniger empfänglich als Truthühner, Jungtiere (gelegentlich auch ältere Tiere) können jedoch erkranken. Ebenfalls hochempfänglich für Erkrankungen sind Pfau und Fasan. Protozoa 21 Ätiologie und Pathogenese Durch experimentelle Untersuchungen an bakterienfreien Versuchstieren wurde festgestellt, daß die Erkrankung nur durch Zusammenwirken von H. meleagridis und bestimmten Bakterienarten (Escherischia coli, Clostridium perfringens, u. a.) entsteht (Faktorenerkrankung). Andere Theorien über die Ätiologie (Pilze: Candida albicans, Virus, Amoeben) sind experimentell nicht ausreichend geschützt oder widerlegt. Durch das Zusammenwirken von H. meleagridis und Bakterien entstehen in den Blinddärmen und in der Leber, z. T. auch in anderen Organen, Veränderungen die schwere klinische Störungen zur Folge haben. Pathologie • Blinddärme: ein- oder beidseitig unregelmäßig verdickt, mit hypertrophischer Wand, die ulzeröse Veränderungen aufweist und mit diphteroiden Auflagerungen bedeckt sind. Diese füllen pfropfenartig das Lumen aus. • Leber: Gewöhnlich stark vergrößert mit multiplen, kreisförmigen (bis 1 cm im Durchmesser) zentral eingesunkenen Nekoseherden, die durch eine breite, gelbe Demarkationszone begrenzt sind. Häufig seröse Flüssigkeit im Herzbeutel und in der Leibeshöhle. Klinisches Bild • Perakute Form: häufig bei jungen truthühnern, Krankheitsrscheinungen kaum zu beobachten, selten, dunkle, zyanotische Verfärbungen der Kopfhaut („black head“). • Akute Form: bei jungen Truthühnern und Hühnerküken, Mattigkeit, gesträubtes Gefieder, Hängenlassen der Flügel, schwefelgelber Durchfall. • Chronische Form: bei älteren Tieren, starke Abmagerung. Genesene Tiere sind immun. Wirtschaftliche Bedeutung Die wirtschaftliche Bedeutung der Histomonose ist in den letzten Jahren dank verbesserter Bekämpfungsmaßnahmen zurückgegangen. Immerhin werden in den USA die Ausfälle durch Histomonose auf 4 - 5 % der Gesamtverluste bei Geflügel geschätzt. Diagnose Die Diagnose kann gestellt werden: • aufgrund des Sektionsbefundes und der Anamnese, • durch histopathologischen Erregernachweis, wobei vor allem die PAS-Färbung zur Differenzierung von Pilzen empfehlenswert ist, • Kultivierung des Erreger aus frischem Material. Bekämpfung In der Bekämpfung der Histomonose stehen Maßnahmen der Chemoprophylaxe bzw. Chemotherapie im Vordergrund. Dabei werden heute vorwiegend Verbindungen der Nitroimidazolgruppe eingesetzt, die sich über das Trinkwasser oder Futter verabreichen lassen. In der Praxis wird die Applikation zur Prophylaxe über das Futter sowie für die Therapie über das Wasser bevorzugt. Die folgende tabellarische Übersicht gibt nähere Angaben über die Therapie: Protozoa 22 Histomonadostatika: Substanzen Dosis ReinDosierung in mg substanz in mg/ kg KM/ Liter Wasser kg Futter Tag Dimetridazol Ipronidazol Ronidazol 55 - 70 50 – 75 9 - 21 10 - 18 6 - 10 6 – 10 300 - 500 100 - 600 60 - 150 125 - 250 10 - 60 80 - 120 Behandlungsdauer in Tagen 10 - 14 10 - 14 10 - 14 10 - 14 10 - 14 10 - 14 Bemerkungen 100 - 200 ppm als Zusatzstoff im Putenalleinfutter und für Perlhühner 125 - 150 ppm bis zur Legereife 60 - 85 ppm als Zusatzstoff im Putenalleinfutter bis zu Legereife 60 - 90 ppm als Zusatzstoff im Putenalleinfutter bis zu Legereife Bei diesen Maßnahmen ist zu berücksichtigen, daß nur bestimmte Mittel zur Bekämpfung der Histomonose zugelassen sind. Weitere Maßnahmen sind: • Truthühnern von Hühnern streng getrennt aufziehen • Bekämpfung des Heterakis-Befalls durch regelmäßige anthelmintische Behandlungsmaßnahmen. TRICHOMONADIDAE TRICHOMONOSE, Trichomonas spp. Vorkommen Pferd: Die Trichomonose kommt beim Pferd gelegentlich vor. Wichtige Erreger sind Trichomonas equibuccalis (apathogen) und Tritrichomonas equi (Blinddarm und Colon, Diarrhoe?). Schwein: Es sind mehrere Arten von Tritrichomonas spp., z. B. T. suis (apathogen, sehr häufig) an der Erkrankung beteiligt. Sie betrifft v. a. Blinddarm und Dünndarm (Nasenhöhle und Magen). Rind: Die Tritrichomonose (Dechseuche) wird durch Tritrichomonas foetus (weltweit vorkommend) ausgelöst. Sie unterliegt der Anzeigepflicht (±). In Mitteleuropa ist sie kaum mehr oder nur sehr selten vorkommend (KB), in Südamerika und Australien stellt sie z. T. ein großes Problem dar. Hund und Katze: Es sind diverse Trichomonadenarten als Opportunisten (immundefiziente Tiere) bekannt. Taube: Die wichtigste Art ist Trichomonas gallinae (weltweit vorkommend). Sie führt zu einer latentne Infektion bei fast allen Tauben und ist die häufigste Jungtiererkrankung. Befroffen sind Tauben aller Rassen (Haus- und Wildtauben). Es stellt eine typische Zuchtseuche dar, die mit jahreszeitlichen Schwankungen (typisch Ansteig im Frühjahr (April) bis Sommer (August), dann Abfall) auftritt. Mensch: Der wichtigste Vertreter ist Trichomonas vaginalis. Es sind 200 Mio. Infektionen weltweit pro Jahr bekannt. In Europa sind gemäß WHO ca. 10 - 20 % der Frauen mittleren Alters chronisch infiziert, Männer zu ca. 5 %. Protozoa 23 Pathogene und apathogene Trichomonasden (Auswahl) von Tier und Mensch Art Wirt Lokalisation Krankheit Tritrichomonas foetus Rind Tritrichomonadenseuche Tritrichomonas suis Schwein, (Rind) Trichomonas tenax Trichomonas canistomae Mensch, Affen Hund Taube, andere Vogelarten Mensch Huhn, Truthuhn, andere Hühnervögel Schaf Mansch, Affen, Hund, Katze, Nager, ... Genitaltrakt Nasenschleimhaut, Verdauungskanal Mundhöhle Mundhöhle Verdauungskanal, Leber, andere Organe Urogenitaltrakt Zaekum, manchmal Leber Caecum, Pansen apathogen apathogen (?) Aviäre Trichomonose („gelber Knopf“ Urogen. Trichomonose Zaekum, Kolon apathogen (?) Trichomonas gallinae Trichomonas vaginalis Tetratrichomonas gallinarum Tetratrichomonas ovis Pentatrichomonas hominis apathogen (?) apathogen (?) apathogen Morphologie und Entwicklung Trophozoiten: 6 - 11 x 12 - 17 µm Rind: • Tritrichomonas: beim männlichen Rind in der Präputialhöhle, im Penisgraben und in der Harnröhre; beim weiblichen Rind in Vagina und Uterus (T. foetus ist auch auf Schaf, Ziege und Schwein übertragbar, ruft dort aber keine Erkrankung hervor) • Übertragung: Deckakt und KB mit kontaminiertem Samen (Seit der Einführung der künstlichen Besamung ist die Tritrichomonose in Mitteleuropa selten geworden. In den großen Fleischrinderherden, vor allem in Südamerika und Australien, ist sie nach wie vor ein großes Problem.) • Infektion persistiert vor allem bei älteren Rindern. Bullen bis zum Alter von 3 Jahren sind weniger empfänglich. Beim weiblichen Tier bleibt die Infektion nur 35 - 140 Tage bestehen. • Nahrungsaufnahme von T. foetus: v. a. endosmotisch • Vermehrung: Zweiteilung (keine Zysten) Taube: • Trichomonas gallinae: birnenförmig, 6 - 18 µm lang, mit 4 Vordergeißeln und einem nach hinten gerichteten Flagellum, das eine undulierende Membran bildet. • Trichomonose: T. gallinae persistiert primär im Rachen, in der Speiseröhre und im Kropf, bei erkrankten Tieren Gewebsinvasion, v. a. Leber • Vermehrung: Längsteilung (keine Zysten) • Die Infektion der Jungtauben erfolgt durch latent infizierte Alttauben bereits bei der ersten Fütterung mit Kropfmilch. Pathogenese, Pathologie und Klinik Rind: Infizierte Bullen haben keine Krankheitserscheinungen und kein gestörtes Paarungsverhalten. Beim weiblichen Rind kommt es bald nach der Ansteckung zur Rötung und Schwellung der Lymphfollikel der Schleimhaut der Protozoa 24 Vagina (Vestibulitis, Vaginitis) + aszendierende Besiedlung des Uterus und der Eileiter. Der größte Schaden entsteht durch Sterilität. Häufig nehmen die Tiere aber auch auf und es kommt nach 6 - 16 Wochen Trächtigkeit zum Abort, selten später. Meistens ausstoßen der Frucht, nachdem vorher schleimig-eitriger Scheidenausfluß zu beobachten war. Das Wiederauftreten der Brunst 2 - 3 Monate nach dem Decken deutet auf den häufig nicht bemerkten Abort hin. In seltenen Fällen kommt es zur Mazeration der Frucht und zur Pyometra. Beim weiblichen Rind werden die Erreger nach 2 - 5 Monaten spontan eliminiert. Ein Teil der Rinder bleibt dann wenigstens 1 Jahr lang vor weiteren Erkrankungen geschützt. Hund und Katze: Massive Infektionen nach Immunsuppression, z. B. bei Katzen mit FeLV oder FIV. dabei werden verschiedene Arten involviert. Taube: Jungtauben zeigen typische Veränderungen durch Eindringen der Flagellaten in das Gewebe. Pathogenitätsfaktoren sind v. a. unterschiedlich virulente Stämme und Immunität. Bei der Rachen-Kropf-Trichomonose befinden sich auf den Schleimhäuten der Rachen- und Schnabelhöhle gelblich-käsige Belege. Prädilektionstelle ist die Rachenschleimhaut im Bereich der Rachenpapillen. Hier ist die Membran geschichtet und bis bohnengroß („Gelber Kropf der Tauben“). Bei der inneren Krankheitsform befinden sich nekrotische Herde in der Leber. bei der Herz-Lungen-Form befinden sich Nekroseherde an der Herzspitze. Das klinische Erscheinungsbild ist geprägt von Appetitlosigkeit und Verdauungsstörungen. Durch die Veränderungen im Rachen werden die Trinkwasserund Nahrungsaufnahme behindert. Kachexie. Hohe Mortalität. Diagnose Rind: • Abortierte Früchte: mikroskopischer Nachweis von T. foetus in den frisch abortierten Früchten (insbesondere im Magen), in Eihäuten, Fruchtwasser, Uterus und Vagina oder besser in-virtoKultivierung mit denselben diagnostischen Substraten. • Weibliche Rinder: Scheidentupferproben 2 Tage vor bis 2 Tage nach der Brust oder nach Aborten • Männliche Rinder: Erregernachweis in Präputialspülproben (in-virto-Kultivierung). Beim Entnehmend er Proben ist darauf zu achten, daß sie nicht mit an der Haut haftenden Kotteilchen verunreinigt werden, die den Trichomonaden ähnliche koprophile Flagellaten enthalten können. Der direkte Erregernachweis in Sekreten des Genitaltraktes gelingt nur bei etwa 30 % der Fälle, günstigere Ergebnisse liefert eine Trichomonadenkultur mit einer Trefferquote von > 75 %. Zum kulturellen Nachweis werden Proben aus dem Bereich der Fornix entnommen und in ein Nährmedium gebracht, Bebrütung bei 37°C. Zur in-vitro-Anzüchtung eignet sich der sog. InPouch -Test zur zeit am besten. Zur artspezifischen Identifizierung von T. foetus ist ein sog. PCR-Test entwickelt worden. Das Institut für Parasitologie in Bern führt im Rahmen seiner Aktivitäten als „Nationales Referenzlabor für Trichomonosen“ diese PCR durch. Eine Serologie ist weniger zuverlässig. Taube: Kropfabstrich mittels mittelstarke Sonden mit Öse und Watte. Wattetupfer mit physiologischer Kochsalzlösung befeuchten. Vom Tupfer wird 1 tropfen auf einen Objektträger abgepreßt und mikroskopisch untersucht. Therapie Rind: Eine Behandlung wird in Europa nur ausnahmsweise bei wertvollen Elitebullen durchgeführt. In der Regel werden die infizierten Bullen geschlachtet. Beim weiblichen Rind ist eine Kausaltherapie nicht erforderlich. Die Behandlung wird mit folgenden Medikamenten durchgeführt: • Dimetridazol (DIMETRIDAZOL ), 50 - 60 mg/ kg KM täglich über 5 Tage p. o. • Ironidazol (IPROPAN ), 1 x 30 g/ Tier i. m. (Therapieerfolg von 93 %) bzw. 30 g/ Tier i. m. am 1. Tag und je 15 g/ Tier am 2. und 3. Tag (Trichomonadenfreiheit aller Bullen) Protozoa Taube: 25 • Carnidazol (SPARTRIX ), 1 x 10 mg/ Taube, steht in Tablettenform zur Verfügung • Dimetridazol (EMTRYL , HISTOMON ), 0,05 %ig im Trinkwasser über 6 - 7 Tage • Ronidazol (DUODEGRAN ), 0,05 %ig im Trinkwasser über 7 Tage Bei schwerer Erkrankung wird die Kurdauer bei der Anwendung von Dimetridazol oder Ronidazol 2 20 Tage verlängert. Bekämpfung Rind: Die Tritrichomonose der Rinder ist anzeigepflichtig. Taube: Es sollten auch die latent infizierten Tiere behandelt werden. Zuchttiere sollten prophylaktisch vor Brutbeginn (bis Ende Januar) und nochmals im April/ Mai mit Abschliß der Kur etwa eine Woche vor Schlupf des Geleges behandeln. Während der Behandlung kein Freiflug. Eine Immunisierung mit einem schwach virulenten Stamm ist prinzipiell möglich, ebenso die passive Immunisierung mit dem Blutplasma (2 ml als Einzeldosis oder 1 ml 0,5 und 10 Tage später p. i.) infizierter Tauben. ENTAMOEBIDAE AMOEBIASIS, Entamoeba histolytika Vorkommen In den Tropen und Subtropen sind etwa 2 - 70 % der menschlichen Bewohner Träger von Entymoeba histolytica. In Mitteleuropa sind es meistens importiere Fälle, doch sind auch autochtone Infektionen möglich. Weltweit beträgt die Zahl der Entymoeba histolytica infizierten Personen 500 Millionen, von denen 40 - 50 Millionen erkranken und jährlich 40 000 - 100 000 sterben (WHO 1991). Für die Veterinärmedizin ist Erkrankung in Mitteleuropa klinisch in der Regel unbedeutend, da die meisten Arten (Ausnahme: Primaten mit E. histolytica) apathogen sind. Tiere dienen in den Tropen als Reservoirwirt. Morphologie des Erregers Vegetative Stadien (Trophozoiten) und Zysten: • Trophozoiten: Zellen mit variabler Form und Größe, Ausstülpungen von Zellmembranen und Ektoplasma (Lobopodien), die eine „fließende“ Bewegung ermöglichen. Charakteristisch für die Gattung Entamoeba ist der ringförmig erscheinende Kern mit zentralem Kernkörperchen und an der Kernmembran angelagerten Chromatingranula. Man unterscheidet nach der Größe: − kleine, 10 - 20 µm lange Formen (Miniaturformen) − größere, 20 - 60 µm lange Formen (Magnaformen) • Kugelförmige Zysten: 10 - 16 µm lang, aus der Miniaturform gebildet, werden allein oder gemeinsam mit vegetativen Stadien im Stuhl chronisch infizierter Personen ausgeschieden. Die mit einer widerstandfähigen Hülle versehenen, unbeweglichen Zysten enthalten zunächst Amöben mit einem Kern. Durch Kernteilung entstehen zweikernige und später die infektionsfähigen vierkernigen Zysten. Entwicklung, Pathogenese und Pathologie Protozoa 26 Nach der oralen Aufnahme reifer Zysten wird die vierkernige Amöbe im Dünn- und Dickdarm frei und teilt sich dort in 4 oder 8 einkernige Miniaturformen. Die invasiven Formen (Magnaform) oder Minutaform befindet sich im Dickdarm, Diese enthält Enzyme (Kollagenase) und andere Substanzen („pore forming protein“) zur Gewebeauflösung („histolytica“) und zur Penetration in die Darmwand. Im Gewebe bilden sich Nekroseherde mit Entzündungsreaktionen. Diese bilden tumorartige Verdickungen der Darmwand („Amöbom“). Von der Darmwand aus kommt es zur hämatogenen Absiedelung in andre Organe. Die häufigste Komplikation ist die Leberaböbiasis. Die Abbildung zeigt den Entwicklungszyklus von Entamoeba histolytica. AB Abszeß, CH Chromadialkörper, CW Cystenwand, E Erythrozyt, P Ektoplasma, N Nukleus, NV Nahrungsvakuole, V Vakuole 1. Vierkernzyste wird oral aufgenommen. 2. Im Darm schlüpft die Amoebe (besitzt hyaline Pseudopodien, meist eins). 3. Kernvermehrung und Teilung in 8 Amoeben. 4. Kleine Formen (Minutaformen) vermehren sich durch Zweiteilung. 5. s. 4. 6. s. 4. 7. Einkernige Zyste mit Chomidialkörper (CH). 8. Zweikernige Zyste 9. In Faeces angesetzte 4-Kern-Zyste. 10. Minuta-Formen entwicken sich zu Magna-Formen, wenn sie ins Gewebe eindringen. 11. In der Leber (a), Lunge (b) und Gehrin (c) entstehen durch bakterielle Sekundärinfektion Abszesse, due Eiter und Magnaformen enthalten. Bakterien sind in nur etwa 5 % der Fälle beteiligt. In Zerfallsherd befindet sich meist eine bakteriologisch sterile, bräunliche oder gelbliche, eiternde Flüssigkeit oder nach deren Eindickung eine nekrotische Masse. Amöben sind oft in der Zone des Übergangs zum intakten Lebergewebe nachweisbar. Klinik Intestinale Formen: • Die „invasive Darmaböbiasis“ ist eine Erkrankung des Dickdarms wegen Invasion der Darmwand durch E. histolytica. Symptome sind zuerst Abdominalbeschwerden und Durchfallepisoden unterschiedlicher Dauer (Stuhl mit erythrozytenhaltigen Magnaformen von E. histolytica). Weiterhin treten rezidivierende Koliken auf. Bei geschwächtem Organismus schwere Exsikkose und bedrohliche Komplikationen. • Die „nichtinvasive Darmaböiasis“ verläuft asymptotisch. Darmveränderungen sind nicht vorhanden. Im Stuhl finden sich Zysten sowie Minutaformen, jedoch keine Magnaformen von E. histolytica. Extraintestinale Formen: Protozoa 27 Eine hämatogene Verschleppung der Erreger führt zum sog. „Leberabszeß“. CAVE: nur bei 9 % der Patienten mit Leberabszeß liegt eine Amöbencolitis vor, auch sind häufig keine Amöben im Kot nachweisbar. Seltener sind andere Organen (Gehirn) betroffen. Diagnose Intestinale Amöbiasis: • Frischer Stuhl: mit Erythrozyten beladene Magnaformen, pathognomotisch für invasive Darmanöbiasis. Diese sofort in MIF- oder SAF-Lösung geben. Eine diagnostische Sicherheit gibt es erst bei Untersuchung von 3 an verschiedenen Tagen entnommene Kotproben. • Kopro-Antigentest (ELISA) zum Nachweis von „Adhesin“ ist geeignet zur diagnostischen Untersuchung für pathogene E. histolytica-Stämme. CAVE: Verwechslung von Amöben mit Darmepithelien, Granulozyten, Makrophagen und Pilzen. Entamoeba histolytica muß morphologisch von apathogenen Amöben (Entamoeba coli, Entamoeba hartmanni, Iodamoeba, Endolimax) abgegrenzt werden. • Avirulente und virulente Stämme: Isoelektrophorese und Southern-blots, neu ebenfalls PCR. Bei vorliegen virulenter Stämme: Serologie meist positiv, auch bei asymptomatischen Befall. APIKOMPLEXA EIMERIIDAE Eimeria-, Isospora- und Cystoisospora-Arten (Auswahl) Art Eimeria bovis E. auburnensis E. zuemii E. ellipsoidalis E. bakuensis E. faurei E. intricata E. ovinoidalis E. arloingi E. christenseni E. scabra E. suis I. suis Oozystengröße (µm) Rind 23 - 34 x 17 - 23 hinterer Dünndarm, Dickdarm 36 - 42 x 19 - 26 Dünndarm 16 - 20 x 15 - 18 Dünndarm, Dickdarm 18 - 26 x 13 - 18 Dünndarm Schaf 23 - 36 x 16 - 24 Dünndarm 22 - 33 x 19 - 24 Dünndarm 40 - 56 x 30 - 41 Dünndarm, Zaekum 17 - 25 x 13 - 20 Kolon Ziege Dünndarm-Krypten 25 - 33 x 16 - 21 Dünndarm 34 - 41 x 23 - 38 Schwein Dünndarm 25 - 45 x 17 - 28 Dünndarm 13 - 20 x 11 - 15 Dünndarm 17 - 22 x 17 - 19 Wirt/ Organ E. leuckarti Dünndarm E. intestinalis E. perforans E. magna Zaekum, Kolon Dünndarm Dünndarm Pferd 70 - 90 x 50 - 69 Kaninchen 23 - 32 x 15 - 20 16 - 28 x 12 - 16 28 - 40 x 18 - 30 Präpatenz (Tage) Pathogenität 18 - 21 17 - 18 16 - 19 8 - 10 + + + + 19 14 - 15 20 - 27 10 - 15 + + + + 20 ? + + 8-9 10 5 + + + 31 - 37 (+) 10 6 6-7 + + + Protozoa E. stiedai 28 Gallengänge E. tenella E. maxima E. necatrix E. acervulia E. brunetti E. praecox Zaekum Dünndarm Dünndarm Dünndarm Ileum, Rektum Dünndarm C. felis C. rivolta Dünndarm Duodenum C. canis C. ohioensis Dünndarm Dünndarm I. belli Dünndarm Entwicklungszyklus 26 - 40 x 16 - 25 Nutzgeflügel 23 x 19 (x) 30 x 20 (x) 22 x 17 (x) 18 x 15 (x) 25 x 19 (x) 21 x 17 (x) Katze 30 - 53 x 23 - 37 22 - 30 x 21 - 27 Hund 26 - 44 x 29 - 36 19 - 27 x 18 - 23 Mensch 20 - 33 x 10 - 19 16 + 6 5 6 4 5 4 + + + + + (+) 6 - 17 5 (+) (+) 9 6 (+) (+) 9 - 10 (+) Protozoa 29 Orale Aufnahme von Oozysten, die 4 Sporozysten mit je 2 Sporozoiten enthalten. Im Darm des Wirtes werden die Sporozoiten frei und dringen in die Darmepithelien ein. Dort werden sie in einer sog. parasitophoren Vakuole eingeschlossen und beginnen mit der Nahrungsaufnahme durch Ultrazytome (auch als Mikroporen bezeichnet). Schizogonie: Die Schizogonie spielt sich nur intrazellulär ab. Es kommt zu einer ungeschlechtlichen Vermehrung (Zerfallsteilung) in einem Schizonten, in dem sich der mehrfach durch Zweiteilung teilt. In der Peripherie sind viele Kerne angeordnete aufweisen. Die daraus entstehenden Tochterzellen werden als Merozoiten bezeichnet. Sie dringen aktiv in andere Wirtszellen in und werden zu neuen Schizonten. Die Anzahl der aufeinander folgenden Schizontengenerationen ist artspezifisch. Die Anzahl der Merozoiten, die von einem Schizonten gebildet werden, ändert sich vielfach von Generation zu Generation. Sonderformen treten bei „zystenbildenden“ Kokzidien auf: • Endodyogenie (Bildung von Zystozoiten im Gewebe, z. B. bei Toxoplasma und Sarcocystis spp.), • Endopolygenie (Bildung von Endozoiten, z. B. bei Toxoplasma und Sarcocystis spp.) Gametogonie: Die Gametogonie findet ebenfalls intrazellulär statt. Nach Abschluß der Schizogonie differenziert sich ein Merozoit zum Mikro- oder Makrogamont (geschlechtliche Formen), die beide wiederum in einer parasitophoren Vakuole heranwachsen. Aus dem Mikrogamonten entstehen zahlreiche, begeißelte männliche Gameten. Durch Befruchtung (Syngamie) kommt es zur Bildung einer unsporulierten Oozyste (umschalte Zygote). Sporogonie: Die Sporogonie findet abhängig von der Rasse entweder exogen (z. B. Eimeria, Cystoisospora spp., Toxoplasma spp.) oder endogen (z. B. Sarcocystis spp.) statt. Nach dem Ansetzten der Oozyste mit dem Kot kommt es innerhalb der Oozystenhülle zur ungeschlechtlichen Vermehrung des Sporonten zu Sporoblasten und im Anschluß daran zur Bildung bananenförmiger Sporozoiten (meist innerhalb von Sporozysten). Die Oozystenwand ist sehr stabil und kann z. B. mehrere Monate eine Lagerung in 2 %igem Kaliumbihromat oder schwacher Formalinlösung überstehen. Einige Sporolationstypen: • Eimeria-Typ: Oozyste mit 4 Sporozysten mit je 2 Sporozoiten (z. B. Eimerien) • Isospora-Typ: Oozyste mit 2 Sporozysten mit je 4 Sporozoiten (z. B. Cystoisospora., Toxoplasma, Sarcocystis) • Kryptosporidien-Typ: Oozyste ohne Sporozyste mit 4 Sporozoiten (z. B. Kryptosporidien) Begriffe • Schizont: Verteilungskörper mit oft hunderten bis tausenden bananenförmiger Merozoiten • Mikrogamont: männliches, vielkerniges Vorstadium, in dem zahlreiche begeißelte, randständig gelegene Mikrogameten entstehen. • Makrogamont: weibliches, einkerniges Stadium mit peripheren Hüllbindungskörpern • Oozyste: exogenes Dauerstadium mit unterschiedliche Formen (z. B. rund, oval, birnenförmig), Wand dünn oder dick, farblos oder gefärbt, mit oder ohne Öffnung (Mikropyle), diese mit oder ohne Polkappe, enthält eine Zelle (Sporont, Zygote) KOKZIDIOSE, Eimeria spp. Protozoa 30 Vorkommen Wichtigste und artenreichste Gruppe: Eimeria (mehr als 800 Arten). Eimerien kommen bei allen Vertebratenklassen vor, sind sehr wirtsspezifisch und stellen eine der wirtschaftlich bedeutensten Arten dar. Die sog. Kokzidiose kommt vor allem bei Hühnervögeln und Kaninchen vor. In Mitteleuropa kommen 13 Arten vor, davon sind 190 von Bedeutung und davon sind 4 Rind: wichtig bzw. pathogen: Eimeria bovis, E. auburnensis, E. zuemii, E. ellipsoidalis (E. cylindrica, E. brasiliensis, E. bukidnonensis). Die Befallsrate ist je nach Haltungsart zwischen 12 - 100 % mit einem weltweitem Schaden von 700 Mio. US$ pro Jahr. Schaf und Ziege: Es sind über 10 Arten beim Schaf wichtig: E. bakuensis (= ovina), E. faurei, E. intricata, E. ovinoidalis und über 10 Arten bei der Ziege: E. arloingi, E. christenseni. Früher stellte die Kokzidiose ein Problem als Weideseuche, heute nur noch bei Lämmermast dar. I. d. R. sind alle Schafe ab der 10. Lebenswoche zu 100 % infiziert. Pferd: Es kommen 3 Arten vor, davon hat E. leuckarti eine relativer Bedeutung, v. a. beim Fohlen. Die Befallsintensität beträgt beim Pferd in Mitteleuropa 0,3 - 3 %. Schwein: Es sind 13 Arten beim Schwein bekannt, sind jedoch nur von geringer klinischer Bedeutung. Das Vorkommen beträgt 6 - 60 %. Viechtiger sind Isospora-Arten, die im Anschluß an Eimeria abgehandelt werden. Hund und Katze: Es sind keine Eimeria-Arten bekannt. Wichtiger sind Cystospora-Arten (später abhenadelt). Kaninchen: Eimerien gehören zu den wirtschaftlich bedeutendsten Parasiten. Sie sind beim Kaninchen weltweit verbreitet, bei praktisch jeder Haltungsart. Man unterscheidet zwischen: • Darmkokzidiose: in Europa 9 Arten vorkommend: E. intestinalis, E. perforans, E. magna • Leberkokzidiose: E. stiedal Nutzgeflügel: Eimerien gehören zu den wirtschaftlich bedeutendsten Parasiten. Eine der häufigsten Krankheiten in den Geflügelbetrieben, Tendenz zunehmend (Bodenhaltung!), 9 Eimeria-Arten von Bedeutung: • Dünndarmkokzidiose: E. necatrix, E. maxima, E. acervulina, E. praecox • Blindarmkokzidiosen: E. tenella • Dickdarmkokzidiosen: E. brunetti Wild: Eimeria-Arten spielen vor allem in Wildgehegen eine Rolle und haben gelegentlich klinische Relevanz. Von Bedeutung sind dann v. a. die Sarcosporidien (später abgehandelt). EIMERIOSE des Rindes Epidemiologie Typisch ist, daß die meisten Rinder befallen sind, jedoch nur wenige Tiere erkranken. Die Morbidität beträgt bis zu 100 % (sehr selten). Unter den meisten Haltungsbedingungen bildet sich eine enzootische Stabilität, d. h. ständige Infektionen mit subklinischen Mengen an Oozysten führt zu einem Immunzustand mit Schutz vor Erkrankung.. Erkrankungen treten auf, wenn nicht-immune Tiere in eine kontaminierte Umgebung gebracht oder immune Tiere einem übermäßigem Infektionsdruck ausgesetzt werden. Infektionsquellen sind: kotverschmutztes Wasser, Futter und Einstreu, Wände, Gegenstände sowie das Haarkleid der Tiere, die beleckt werden können. Klinische Kozidiosen sind typisch für Jungrinder, vor allem wenn die Kälber aus den Einzel- oder Gruppenboxen umgestallt werden. Erste Krankheitsanzeichen treten nach 3 Wochen nach Umstellung auf. Entwicklung Protozoa 31 • Eimeria bovis: Die bei pH 7,5 - 8,5 unter Einfluß von Trypsin und Galle freigesetzten Sporozoiten dringen in die Schleimhaut er hinteren Dünndarmhälfte ein. Die Reifung erfolgt in den Endothelzellen der zentralen Lymphkapillaren. Man kann die Makroschizonten als 300 µm große und weiße Punktchen erkennen. Sie entwickeln sich innerhalb von 14 - 18 Tagen 12 µm lange Merozoiten. Diese dringen in Epithelzellen von Zaekum und Kolon ein und bilden dort in 2 Tagen die 2. Schizontengeneration mit nur je 30 - 36 Merozoiten. Diese entwickeln sich zu Makro- und Mikrogamonten, welche im wesentlichen die Schädigungen und klinische Symptome bedingen. Oozysten sind ab dem 18. - 21. Infektionstag im Kot. • Eimeria auburnensis: Die Entwicklung erfolgt in den Epithelzellen an der Basis der Krypten von Jejunum und Ileum. Zwischen dem 8. und 10. Infektionstag sind die Schizonten 240 µm groß und enthalten viele tausend Merozoiten. Einige Tage später bilden sich die 2. Generation Schizonten. Die Gamonten befinden sich in den Mesodermzellen der Lamina propria. Oozysten sind ab dem 17. Infektionstag im Kot nachweisbar. • Eimeria ellipsoidalis: E. ellipsoidalis ist bedingt pathogen. Die Entwicklung erfolgt in den Epithelzellen der Krypten in Jejunum und Ileum. Die 2. Schizontengeneration bildet je 24 - 36 Merozoiten. Die Präpatenz beträgt 8 - 10 Tage. • Eimeria zuemii: Es ist eine sehr pathogene Art. Die erste Schizontengeneration befindet sich in der Lamina propria des Ileums. Die dort gebildeten Makroschizonten befallen zur 2. Schizogonie die Epithelzellen des Zaekums. Die Gamogonie findet im Zaekum und Kolon statt. Die Präpatenz beträgt 17 Tage. • Eimeria labamensis: Diese Eimerienart entwickelt sich intranukleär in Epithelzellen und führt nur bei starkem befall zu Durchfall. Die Schizonten enthalten je 16 - 32 Merozoiten und befinden sich intranukleär in den Epithelzellen des Jejunums (distales Drittel). Die Gamonten befinden sich überwiegend in den Epithelzellen des Jejunums, bei starkem Befall aber auch des Zaekums und des Kolons. Pathogenese und Pathologie Die Pathogenese und die Pathologie ist abhängig vom Entwicklungsort der einzelnen Spezies. Die meisten Eimeria-Arten verursachen epitheliale Dünndarmschäden. Ein Befall mit E. bovis und E. zuernii führt zu Dickdarmläsionen, die tiefere Gewebeschichten erfassen. Die Pathologie der Makroschizonten ist relativ gering. Schwere Veränderungen entstehen durch die 2. Schizonten und Gamonten vor allem im Zaekum, den distalen 2 m des Dünndarms und im proximalen Kolon. Die Drüsen sind erweitert, subepithelial zellulär infiltriert und im Bereich der Lamina propria und Submucosa ödematös. (hämorrhagische Enteritis). Eine einmalige Infektion mit z. B. E. bovis führt zu einer Immunität gegenüber symptomatischen Reinfektionen. Die Immunität wird durch TLymphozyten vermittelt. Klinik E. bovis und E. zuernii führen zu Durchfall mit grün-braunem, schleimigen, stinkenden Kot, evtl. dünnflüssiger, blutiger Kot mit Schleimhautfetzen oder diphteroiden Membranen (sog. rote Ruhr). Durch die Druckentleerung sind der Schwanz und die Hinterbeine verschmutzt. Die Körpertemperatur ist um 40°C. Die Futteraufnahme sinkt, die Wasseraufnahme steigt. Der Leib ist aufgeschürzt, die Flanken eingefallen. Die Schleimhäute sind blaß und der erhöhte, pochende Herzschlag weist auf eine Anämie hin. Ab dem 6. Krankheitstag kommt es zur Genesung. Bei einer nicht-hämorrhagischen Enteritis beginnt die Genesung bereits früher. Diagnose Die Diagnose wird anamnestisch und mittels klinischer Symptome ermittelt. Durch wiederholte Kotuntersuchungen können Oozysten nachgewiesen werden (CAVE: Zahl der ausgeschiedenen Oozysten nicht korrelierend mit Protozoa 32 der Infektion und Klinik). Für die Artdiagnose müssen die Oozysten evtl. sporolieren gelassen werden (v. a. beim Kaninchen) in 2 %iger Kaliumbromidlösung bei RT. Therapie und Bekämpfung Eine kausale Therapie ist nicht möglich, da die meisten Wirkstoffe auf Schizonten wirken, klinische Erscheinungen aber bei Gamonten auftreten. Trotzdem sollte eine Herdenbehandlung durchgeführt werden, da. i. d. R. alle Tiere infiziert werden und klinische Erscheinungen bei „späten Tieren“ so verhindert werden können. Die Behandlung kann durchgeführt werden mit: • Sulfadimidin, als Medizinalfutter oder als Einzeltierbehandlung (Rinder, Schweine, Kälber) • Amprolium (AMPROLVET ), 10 mg/ kg KM p. o. täglich über 10 Tage • Toltrazuril (BAYCOX ), 2 x 10 mg/ kg KM an zwei aufeinaderfolgenden Tagen Zur Bekämpfung gehören Hygienemaßnahmen zur Verringerung der Oozystenaufnahme. Es wird empfohlen eine Desinfektion mit einem Dampfstrahlgerät und einem Desinfektionsmittel (z. B. LYSOCOC ) durchzuführen. In der USA wird zusätzlich bei gefährdeten Beständen eine Chemoprophylaxe durchgeführt. EIMERIOSE der kleinen Wiederkäuer Entwicklung • Eimeria bakuensis (= ovis, Schaf) entwickeln sich in den Endothelzellen der zentralen Lymphkanäle der Dünndarmzotten. Nach 13 Tagen p. i. sind die Makroschizonten 140 µm groß und enthalten viele tausend Merozoiten. Sie bilden papillenförmige Erhebungen der Mukosa. Merozoiten befallen die Zottenepithelzellen und nach einer 7-tägigen Gamogonie entsteht eine 28 x 18 µm große, durch eine Mikrophyle und die rundliche Polkappe charakterisierte Oozyste. • Eimeria arloing (Ziege): Diese spezifische Eimeria-Art der Ziege läßt sich experimentell nicht auf das Schaf übertragen. Sie ist aber E. bakuensis des Schafes ehr ähnlich. Es gibt 2 Schizontengenerationen. Die Makroschizonten befinden sich in den Epithelzellen sowie in den Pleyerschen Platten des gesamten Dünndarms. Später bilden sich 21 x 12 µm große Schizonten, die in der 2. Generation 24 Merozoiten bilden und sich in den Epithelzellen von Zotten und Krypten des Dünndarms befinden. (katarrhalische bis hämorrhagische Entzündungen und Ödematsierung der Dünndarmwand) Pathogenese, Pathologie und Klinik Pathogenese und Klinik wie beim Rind! Eine klinische Kokzidiose tritt vor allem bei Lämmern im Alter von 4 - 7 Wochen auf. Weidetiere sind v. a. im Mai/ Juni und Masttiere v. a. in den ersten 6 Wochen nach der Aufstallung zur Mast betroffen. Diagnose, Therapie und Bekämpfung Siehe Eimeriose der Rinder! EIMERIOSE des Nutzgeflügels Protozoa 33 Vorkommen Kokzidien von vor allem Aufzucht- und Masttieren: E. necatrix und E. tenella. Die anderen Eimeria-Arten befallen hauptsächlich Legehennen. Man unterscheidet folgende Formen: • Dünndarmkokzidiose: E. necatrix, E. maxima, E. acervulina, E. praecox (nur GB) • Blinddarmkokzidiosen: E. tenella • Dickdarmkokzidiose: E. brunetti Entwicklung am Beispiel von E. tenella Die 1. Schizogonie findet in den Epithelzellen der Eigendrüsen (Blinddarm) statt. Die 2. Schizogonie findet in allen Epithelzellen, auch Lamina propria (wenige Merozoiten) statt. Im Anschluß an die 3. Schizogonie treten die meisten Merozoiten in eine Gamogonie ein. Die Oozystenausscheidung beginnt max. am 10 Tag p. i. Pathologie Die Pathologie ist abhängig von der Infektionsdosis. Veränderungen entstehen vor allem durch die 2. Schizontengeneration und durch Gamonten, die tiefer in der Lamina propria sitzen. Sie führen zu Gewebezerstörung und Protozoa 34 Blutverlust (bis zu 10 % des Körpergewichtes). Der massive Proteinverlust führt zu einem massiven Gewichtsverlust. Zudem treten schwere, blutige Durchfälle („rote Ruhr“). Eine Infektion mit E. tenella führt zu einer hyperämischen Blinddarmwand, starken Blutungen (bis Ausfüllen des gesamten Blinddarms mit Blut, das koaguliert und verkäst). Schwere Infektionen (hämorrhagisch) führen zum Tod. Diagnose und Differentialdiagnosen Zur Diagnose der Kokzidiose beim Geflügel gibt es die Möglichkeiten Oozysten im Kot nachzuweisen, eine Probesektion oder einen Schleimhautabstrich durchzuführen. Die Tabelle zeigt einige Differentialdiagnosen von 6 Eimeria-Arten des Haushuhns (modifiziert nach REID 1975, SIEBOLD 1964 u. a.): Eimeria-Art E. acervulina E. brunetti E maxima E. mivati E. necatrix E. tenella verdickte Schleimhaut, Petechien und mucöses, blutig verfärbtes Exsudat leichte Infektion: runde Herde (Oozysten) weiße, aufgequollene Pünktchen, Petechien, mucoides blutiges Exsudat zu Beginn: Blutungen 2 Schizontengeneration subepithelial 2 Schizontengeneration subepithelial veränderter Bereich makroskopische Veränderungen Lage der Stadien: leichte Infekti- Koagulatioson: längliche nekrose und weiße Streifen mucoide, blutige Enterischwere Infek- tis tion: zusammenfließende Herde, verdickte Schleimhaut epitheial Oo18 µm zystengröße max. Schi10 µm zontengröße Päpatenz 97 Stunden schwere Infektion: verdickte Schleimhaut, zusammenfließende Herde epithelial später: verdickte weiße Darmschleimhaut, geronnenes Blut 2 Schizontengeneration subepithelial Gamonten groß, tief im Epithel 25 µm 31 µm 16 µm 20 µm 22 µm 30 µm 9 µm 17 µm 66 µm 54 µm 120 Stunden 123 Stunden 93 Stunden 99 Stunden 138 Stunden Therapie und Bekämpfung Die Therapie und die Bekämpfung bestht in der Gabe von Kokzidostatika, z. B. Sulfaclozin (= Sulfachlorpyrazin, Esb 3 ), 300 ppm im Trinkwasser über 3 - 6 Tage oder bis zum Abklingen der Symptome. CAVE: Gegen die meisten Kokzidostatika entwickeln sich innerhalb von 5 Jahren resistenzen. Deshalb sollte bei der Behandlung die Wirkstoffgruppe regelmäßig gewechselt werden. Ein neuer Ansatz ist dabei das Wechseln zwischen Vakzinen und Chemoprophylaxe. Vakzinen werden in der USA als Lebendvakzinen bei der Legehennenaufzucht (z. B. COCCIVAX ) eingesetzt. In GB gibt es „precocious lines“ (eine Schizogonie weniger). Protozoa 35 Legehennen dürfen während der Legeperiode keine Antikokzidia erhalten. In der Frühphase werden „schwache“ Antikokzidia gegeben, die die Immunitätsbildung nicht unterdrücken. EIMERIOSE der Kaninchen Pathogenese, Pathologie und Klinik Kokzidiosen treten vor allem bei 6 - 7 Wochen alten Jungtieren auf. Es handelt sich dabei meistens um Mischinfektionen: • Darmkokzidiose: E. intestinalis, E. perforans, E. magna. Es kommt zu einer katarrhalischen - diphteroiden hämorrhagischen Darmentzündungen. • Leberkokzidiose: E. stiedal. Es kommt zu einer Zerstörung des Gallengangepithels, Verdickung der Gallengangswände und zur Verstopfung der Gallengänge. Zudem tritt eine 25 %ige Lebervergrößerung und Organveränderungen in Form von Knotenbildung durch Verschmelzung von Läsionen auf. Häufiger sind auch Bakterielle Sekundärinfektionen (E. coli) beteiligt. Diagnose, Therapie und Bekämpfung Zur Diagnose siehe Eimeriose der Rinder! Die Therapie und die Prophylaxe wird mit Toltrazuril (BAYCOX ) durchgeführt. Es sollten 25 ppm im Trinkwasser über 2 Tage verabreicht werden. Kombiniert werden sollte die Therapie mit Antibiotika (wegen E. coli). CRYPTOSPORIIDAE CRYPTOSPOROSE, Cryptosporidium parvum Vorkommen Es handelt sich hierbei um ein typischen Darmprotozoen, der bei vielen Tierarten und beim Menschen vorkommt, aber nicht wirtsspezifisch ist (ZOONOSE). Beim Säugetier hat nur C. parvum eine pathogenetische Bedeutung. Es ist eine typische Jungtiererkrankung und ist meist nur in dieser Zeit symptomatisch. Die Oozystenausscheidungsraten betragen bei Kälbern 14 - 100 %, bei Kühen 8 % und bei Schafen 7 - 43 %. • • • • Pferd: gelegentlich beim Fohlen Schweine: 5 % der Mastschweine in den USA (wahrscheinlich nur bedingt pathogen beim Schwein) Hund und Katze: Kryptosporidien kommen vor, spielen jedoch pathogenetisch (fast ?) keine Rolle Geflügel: C. baileyi (Hühner), C. meleagridis (Truthahn), Befallsintensität: 6 - 50 % Epidemiologie Die Kryptosporidiose stellt häufig ein Bestandsproblem dar. Das Ausscheidungsmaximum von Oozysten ist bei 11 Tage alten Kälbern. Die Ansteckung erfolgt in den mit Oozysten kontaminierten Kälberboxen. Die Tenazität der Oozysten ist sehr hoch. Bei + 4 °C und ausreichender Feuchtigkeit überleben sie bis zu 6 Monaten. Zum Teil Protozoa 36 sind sie nach 4 Monaten noch infektiös. Bei - 18°C oder bei Temperaturen über 65°C sterben sie in kurzer Zeit ab. Entwicklung und Morphologie Der Sporozoit befällt eine Endothelzelle und bildet dort einen Schizont mit 8 Merozoiten. Repetierte Schizogonien finden bis zum 7 Tag p. i. mit einer Generationszeit von 48 Stunden statt. Danach folgt die Gamogonie mit Bildung einer Zygote, dann einer Oozyste und zum Schluß einer Sporozyste (Mikrogamont mit 16 Mikrogameten). Danach können 2 Wege beschritten werden: • Endo-Autoinvasion (Sporolierung bereits in Dünndarmwand) • unsporulierte Oozystenausscheidung (Sporulation an der Außenwelt). Die Präpatenz beträgt 4 Tage. Die Patenz beträgt 1 - 2 Wochen. Pathogenese, Pathologie und Klinik Protozoa 37 Es ist eine typische Jungtiererkrankung. Kälber und Lämmer erkranken im Alter von 5 – 14 Tagen für 2 – 14 Tage an einer fauligen, profusen gelbgrünen oder wäßrigen Diarrhoe mit Gewichtsverlust. Bei über 4 Wochen alten Tieren sind die Symptome weniger ausgeprägt. Betroffen sind vor allem die hinteren Teile des Jejunums, Ileums sowie teilweise Dickdarm. Im Bereich der Anheftungszone verdrängt C. parvum den Mikrovillisaum der Epithelzelle. Die Funktion der Darmmukosa ist gestört. Es kommt zum Verlust der Enzymaktivität (unzureichende Spaltung von Zucker und Eiweiß). Die resorptive Darmoberfläche ist verkleinert, es kommt zur Malabsoprtion. Häufig sind enteropathogene Escherischia coli (auch Rotaviren und Coronaviren) am Durchfallgeschehen beteiligt. In der Sektion findet man eine Enteritis mit Entzündung und Hyperplasie der Mucosa. In der Histologie kommt eine Atrophie der Darmzotten, eine Dilatation der Lieberkühnschen Krypten, epitheliale Brücken und Fusionen zwischen benachbarten Zotten sowie eine Infiltration von neutrophilen Granulozyten vor. Die Abbildung zeigt die vermuteten pathogenetischen Vorgänge bei einem durch Kryptosporidien verursachten Durchfall: a Anheftungszone, b Hyperplasie der Kryptenzellen, c gestörte Na+Absorption (NaCl oder Na+/SubstrateCotransport), d verstärkte Cl -Sekretion, e erhöhte parazelluläre Permeabilität, f Defekte und Tod der Epithelzellen, g Produktion von TNF-α durch infiltrierte Makrophagen, h gesteigerte PGE2Produktion. Die Immunität gegen C. parvum kann mit in den Darmsekreten enthaltenem IgA nachgewiesen werden. Ob mit dem Kolostrum aufgenommene spezifische Antikörper einen Einfluß auf den Verlauf der Infektion haben, ist noch nicht ganz geklärt. Angenommen wird, daß bei hohem Anteil an Cryptosporidium-spezifischen Ig das Kolostrum einen guten Schutz vor Erkrankung, nicht jedoch vor Infektion vermittelt. Diagnose • • Beim verendeten Kalb oder Lamm werden methanolfixierte, nach Giemsa gefärbte Tupferpräparate der Ileumschleimhaut hergestellt. Zur Histologie ist eine HF-Färbung notwendig. Am lebenden Tier erfolgt der Oozystennachweis im Kot. Untersuchungsmethoden sind Flotation in ZnC12NaCl-Lösung oder direkter Kotausstrichpräparate. Für beide Methoden wird eine modifizierte ZiehlNeelsen-Färbung angewendet. Mit Immersionsöl und Phasenkontrast können 4 – 5 µm große, stark lichtbrechende Gebilde von runder Gestalt dargestellt werden (Oozystenrestkörper als dunkler Fleck). Therapie und Bekämpfung Es ist keine Therapie zugelassen. Experimentell funktioniert Lasalocid-Natrium (CAVE: toxisch bei erhöhter Dosierung), 15 mg/ kg KM in Form von 3 mg/ kg KM in 500 ml Milch 3 x Im Abstand von 24 Stunden. Zur Bekämpfung der Kryptosporidien zusätzlich auf eine gute Stallhygiene und auf eine gute KolostrumVerabreichung bei Neugeborenen achten. ISOSPORIDAE Protozoa 38 CYSTOISOSPOROSE, Cystoisospora spp. Vertreter und Vorkommen Cystoisospora spp. kommen weltweit vor. In Mitteleuropa beträgt der Befall beim Hund pro Art ca. 0,5 - 4 % und bei der Katze 2 - 5 %. Wichtige Arten des Hundes sind Cystoisospora canis., C. ohionesis, C. burrowski, wichtige Arten der Katze Cystoisospora felis, C. rivolta. Entwicklung Cystoisospora spp. durchleben einen fakultativ zweiwirtigen Zyklus. Bei der endogenen Entwicklung erfolgen 2 3 Schizogonien in Zellen oder der Lamina propria im Dünndarm, Zaekum oder Kolon. Die Schizogonien werden evtl. gefolgt von Endodyogenie oder Endopolygenie. In der anschließenden Gamogonie entstehen die Gamonten und letztendlich die Oozyste. Die Oozysten werden unsporuliert ausgeschieden. Die Sporulatioszeit beträgt 1 - 4 Tage. Die Präpatenz bträgt 4 - 11 Tage. Die Patenz beträgt 2 - 3 Wochen. Fakultative Zwischenwirte (ohne Vermehrung der Parasiten) sind Nagetiere (alle Arten), Ziegen (C. canis, C. felis), Rind, Schaf und Kaninchen (C. felis, C. rivolta). In den Zwischenwirten dringen die Sporozoiten in die Zellen der PP, Mesenteriallymphknoten, Milz, Leber, Niere, Herz, Lunge und Skelettmuskulatur ein. Sie bilden dort Hypozoiten (bis zu 23 Jahren). Pathogenese und Pathologie Es sind vor allem Jungtiere betroffen, aber auch ältere Tiere (Zystenausscheider). Die Cystoisosporose führt zu einer Verdickung der Schleimhaut it Petechien. Bei schwerem Befall entsteht eine hämorrhagische Enteritis im Jejunum und Ileum. leichte Infektionen sind asymptomatisch. Stärkere Infektionen bei Jungtieren führt zu starkem (selten blutiger) Durchfall, Fieber, Inappetenz, Apathie und Abmagerung. Die Infektion hinterläßt eine artspezifische Teilprotektivität. Diagnose und Therapie Die Oozysten werden im Kot durch Flotation nachgewiesen. Die Behandlung kann mit Amprolium, Sulfonamide, u. a. durchgeführt werden. ISOSPOROSE, Isospora suis Entwicklung nach Infektion mit Sporozoiten Entwicklungsstufe 1. Schizonten („type I“) 2. Schizonten („type II“) Gamonten Oozysten im Kot Merozoiten (bis 16, groß) Merozoiten (zahlreich, klein) Zeitpunkt 20 Stunden p. i. 4 Tage p. i. 4 - 5 Tage p. i. 5 - 14 Tage p. i. Die Sporulationszeit beträgt bei 37°C 12 Stunden und bei 30°C 16 Stunden. Biologie Symptomatik Enteritis Durchfall (Durchfall) Diagnose Protozoa 39 Es handelt sich hierbei um einen Epithelparasit. Mäuse dienen hier nicht als Zwischenwirte (siehe aber IsosporaArten der Fleischfresser). Eine Altersresistenz wird ab einem Alter von 2 Wochen erreicht (?). Pathologie und Klinik Die Erkrankung äußert sich abhängig vom Alter der betroffenen Tiere (5 - 10 Tage). Es treten keine klinischen Erscheinungen bei der Muttersau auf. Das Krankheitsbild ist gekennzeichnet von Durchfall (gelb-grau, schaumigpastig, ranzig riechend), Apathie (Appetit aber vorhanden) und reduzierter Gewichtsaufnahme. Die Mortalität beträgt bis zu 20 % pro Wurf, bei Fehlen anderer enteropathogener Erreger. Es tritt keine Besserung nach antibiotischer Behandlung ein. In der Pathologie findet man fibrinös - diphtroid - nekrotisierende Membran auf der Mucosa des Jejunums und des Ileums. Zudem tritt eine Zottenatrophie (Hauptbefall distale Bezirke der Zotten), Villusatrophie und Epithelzellzerstörung auf. Die Entwicklungsstadien befinden sich im Epithel. Diagnose und Therapie Die Diagnose wird beim lebenden Tier mit einem Oozystennachweis ab dem 6. Tag p. i. gestellt. Post mortem werden Abklatsch- und Abstrichpräparate genommen, Färbung nach Giemsa, u. a. Die Bekämpfung erfolgt medikamentös. Ist aber bei Jungtieren fraglich, weil die Therapie meist zu spät eingeleitet wird. Ein wirksames Präparat ist Lasalocid, 150 mg/ kg Futter. Die Medikation sollte bereits bei frühabgesetzten ferkeln während 4 Wochen stattfinden. Zudem müssen strenge Hygienemaßregeln eingehalten werden, damit die Muttersau keine Ansteckungsquelle darstellt. Wichtig st deshalb die Reinigung und Desinfektion vor Belegung der Abferkelbucht. (Hintergrund: schwere Erkrankungen sind abhängig von der Anzahl aufgenommener Oozysten) TOXOPLASMOSE, Toxoplasma gondii Allgemeines Toxoplasma gondii ist ein zu den zystenbildenen Kokzidien gehörendes Sporozoon. Als Zwischenwirte dienen fast alle warmblütigen Tiere. Endwirte sind nur Hauskatzen und einige wildlebende Feliden. Die Erkrankung stellt für den Menschen eine besondere Bedeutung dar. T. gondii führt zu Aborten und frühkindlichen Schäden. Bei AIDS-Patienten ist es ein Erreger akuter Krankheiten sowie eine häufige Todesursache. In der Veterinärmedizin ist es in sofern von Bedeutung, da es zu Aborten in der Schaf und Ziegenzucht und zu Neuropathien führt. Vorkommen Der Erreger ist weltweit verbreitet. Schafe und Ziegen mit Weidegang haben in Mitteleuropa nahezu alle Zysten. Die meisten Weiderinder haben Antikörper gegen T. gondii, meist jedoch keine Toxoplasma-Zysten im Fleisch von Schlachttieren nachweisbar. Oozysten sind in 0,1 – 1 % der Katzenkotproben nachweisbar. Die folgende Tabelle zeigt Prävalenzen und Seroprävalenzen beim Schlachttier in der Schweiz. Kühe Jungrinder Mastrinder Positive Tiere (in %) Toxoplasma-PCR positiv Toxoplasma-Seropositiv Toxoplasma-PCR positiv Toxoplasma-Seropositiv Toxoplasma-PCR positiv Toxoplasma-Seropositiv 3% 32 % 6% 32 % 2% 21 % 95%-Konfidenz-Intrvall 0,6 – 8,5 % 23 – 42 % 1,2 – 16,5 % 19,5 – 46,6 % 0,2 – 7 % 13,5 – 30,5 % Protozoa 40 Kälber Schafe Pferde Mastschweine Mutterschweine Toxoplasma-PCR positiv Toxoplasma-Seropositiv Toxoplasma-PCR positiv Toxoplasma-Seropositiv Toxoplasma-PCR positiv Toxoplasma-Seropositiv Toxoplasma-PCR positiv Toxoplasma-Seropositiv Toxoplasma-PCR positiv Toxoplasma-Seropositiv 1% 4% 6% 53 % 0 4% 0 1% 0 27 % 0,03 – 5,3 % 1,1 – 9,9 % 2,8 – 11 % 44,4 – 60,9 % 1,4 – 9,5 % 0,03 – 5,3 % 18,6 – 36,8 % Entwicklung Endwirt (Katze): Die Katze infiziert sich mit Muskelzysten (unsporulierte Oozysten), die in den Epithelzellen der Zottenspitzen des Dünndarms eine Schizogonie (verschiedene Schizontentypen mit 14 – 250 Merozoiten) durchlaufen. Die Merozoiten befallen neue Epithelzellen. 3 Tage p. i. differenzieren sie sich zu Mikround Makrogamonten. Die Oozysten sind etwa 12 µm groß und vom Isospora-Typ (intestinale Phase). Die Präpatenz beträgt 3 – 9 Tage, die Patenz 1 – 14 Tage. Parallel dazu werden auch Zellen diverser anderer Organe befallen. In diesen erfolgt eine Zystenbildung wie sie in Zwischenwirten stattfindet (extraintestinale Phase). Bei der Infektion mit sporulierten Oozysten erfolgt die Infektion wie beim Zwischenwirt. Es wird nur die extraintestinale Phase in den Organen durchlaufen mit Zystenbildung. Einige Parasiten kehren zurück zur Darmwand. Hier Die statt. findet Präpatenz eine beträgt Gamogonie in diesem Fall dann 20 – 36 Tage. Zwischenwirte: Nach der Infektion mit Oozysten werden die Sporozoiten auf dem Blut-Lymph-Weg in innere Organe transportiert, in denen sie sich durch Endodyogenie (Tachyzoiten) vermehren. Fast alle kernhaltigen Zellen sind betroffen. Es kommt zur Parasitämie. Freie Merozoiten wird durch Antikörper (Antikörperbildung) und zytotoxische Zellen lysiert. Zystenbildung erfolgt vor allem in Zwerchfell-, Skelett- und Herz-Muskulatur. De Trophozoiten sind ca. 3 x 6 µm groß, halbmond- bis sichelförmig mit einem länglich-runden vorderen und einem stumpfen hinteren Pol. Der Zellkern liegt in der hinteren Hälfte des Parasiten. Die Zysten sind 50 – 100 µm groß. Sie enthalten im ausgereiften Zustand bis zu 14 000 Zystozoiten. Diese sind den Endozoiten ähnlich, doch etwas kleiner. Im Gegensatz zu letzteren enthalten sie vor und hinter dem Kern zahlreiche PAS-positive Granula mit Reservestoffen. Protozoa 41 Pathogenese, Pathologie und Klinik Allgemeines: Es ist eine unterschiedliche Virulenz von Toxoplasma-Stämmen in Mäusen dokumentiert. Eine akute Toxoplasmose ist selten und dann nur während der explosionsartigen ersten Vermehrungsphase des Parasiten im Zwischenwirt. (CAVE: Immunsuppressionen, u. ä.) es entstehen multifokale Nekroseherde in den verschiedensten Organen einschließlich der Plazenta und Nekrosen in der Leber. Klinische Toxoplasmosen werden bei Wiederkäuern selten diagnostiziert. Bei Rindern und nicht trächtigen kleinen Wiederkäuern verläuft sie weitgehend symptomlos. Ledigleich im verlauf der ersten Vermehrungsphase (Endozoiten) kommt es vorrübergehend zu leichtem Fieber. Bei Schafen und Ziegen gilt er Parasit als wichtigste Ursache von Aborten. Für den Menschen ist Toxoplasma gondii vor allem dann gefährlich, wenn sich eine Frau während der Schwangerschaft zum ersten Mal infiziert. Es kann dann zu Aborten oder intrauterinen Infektionen mit schwerwiegenden Folgen für das Kind kommen. Toxoplasmose des Rindes: Etwa 4 Wochen p. i. sind in den verschiedensten Organen Toxoplasmen nachweisbar. Aus den meisten Rindern werden die Parasiten bis etwa zur 8. Woche p. i. wieder vollständig eliminiert. Pathologischanatomische Veränderungen bei experimentell infizierten Tieren sind sehr gering. Natürlich erworbene klinische Toxoplasmosen sind bei Rindern kaum beschrieben. Rindfleisch hat praktisch keine Bedeutung als Ansteckungsquelle für den Menschen. Kuhmilch ist in der Regel toxoplasmenfrei. Toxoplasmose der kleinen Wiederkäuer: Eine mit Oozysten infizierte Weide bleibt etwa 2 Jahre lang infektiös. Daneben ist eine kongenitale Weiterverbreitung der latenten Toxoplasma-Infektion möglich. Experimentell infizierte Schafe und Ziegen scheiden zwischen den 10. und 34. tag p. i. Toxoplasmen mit der Milch aus. Zumeist sind alle Tiere einer Herde befallen, oder die ganze Herde ist toxoplasmenfrei. In den meisten gebieten tritt der Erreger in enzootischer Stabilität auf, d. h. die Tiere haben sich bis zum Eintritt der Geschlechtsreife infiziert und sind immun. Aborte oder Totgeburten treten vor allem bei toxoplasmenfrei aufgewachsenen Schafen und Ziegen auf. T. gondii ist eine wichtige Ursache von Aborten und Lämmerverlusten bei Schafen und Ziegen. In GB werden die durch Toxoplasma verursachen Lämmerverluste auf insgesamt 2,2 % geschätzt. Toxoplasma-Infektionen werden für 12 – 20 % aller Lämmerverluste verantwortlich gemacht. In manchen Herden kann die Verlustrate bis zu 40 % betragen. Experimentelle Infektionen mit 1000 Oozysten führen nach 26 – 55 Tagen zu Aborten. Eine erstmalige Infektion im ersten Drittel der Trächtigkeit führt zur Resorption der Frucht. Eine Infektion zu einem späteren Zeitpunkt der Trächtigkeit führt zu Aborten, Totgeburten oder zur geburt lebensschwacher Jungtiere. Beim Toxoplasma-Abort sind Veränderungen an der Plazenta wesentlich häufiger und ausgeprägter als beim Fötus. Läsionen an abortierten Föten zeigen seröse Infiltration des subkutanen Bindegewebes, ein Hydroperikard, einen Hydrothorax sowie einen Aszites. Oft sind die Lymphknoten oder die Milz vergrößert. Mikroskopisch befinde sich im Gehirn perivaskuläre Infiltrate mit lymphoiden Zellen sowie fokale Entzündungsherde und eine Dissemination in andere Organe. Die Plazenta weist herdförmige, bisweilen nekrotisierende Entzündungen in den Kotyledonen auf. Die Klinik ist meist inapparent. Bei experimentell infizierten Schafen und Ziegen tritt zwischen dem 2 und 10. Tag p. i. Fieber bis 41,8°C und zwischen dem 4. und 14. Tag. P. i. eine Parasitämie auf. Symptome sind Husten, Atemnot, Anämie, Durchfall, Appetitlosigkeit, Muskelzittern, Lähmungen und Enzephalitis. Infektionen bei Ziegen sind schwerer als bei Schafen. Toxoplasmose des Hundes: Hunde sind ziemlich empfänglich v. a. bei großen Infektionsdosen. Eine Primärinfektion führt im Alter von 7 – 12 Wochen zu einer generalisierten Form mit Fieber, Dyspnoe, Diarrhoe und Erbrechen. Infektionen ab einem Alter von 4 Monaten führten zur zentralnervösen Form mit Ataxie, Hemiparese und Tremor. Infektionen unter 3 Monaten führen zu progressiver Paralyse oder Parese und zur Retikuloneuritis. Immunologie Neben der Fähigkeit der Toxoplasmen die Verschmelzung der Lysosomen mit dem Phagosom in Makrophagen zu inhibieren, wird die Aktivierung von CD8+-Suppressorzellen durch Toxoplasma-Antigen als ein Virulenzfak- Protozoa 42 tor angesehen. Ein weiterer Faktor der in das Wachstum von Endozoiten regulierend eingreift, ist das Interferon γ. T. gondii kann sowohl die Bildung von Interferon induzieren als auch von dieser Substanz im Wachstum gehemmt werden. Diagnose Endwirt (Katze): Die Diagnose wird mittels Oozystennachweis im Kot gestellt. Differentialdiagnostisch kann bei Neuropathien ein Antikörpernachweis mittels SFT, IFAT oder Elisa (IgM-Antikörper-Elisa) durchgeführt werden. Zwischenwirt: Differentialdiagnostisch kann bei Neuropathien ein Antikörpernachweis mittels SFT, IFAT oder Elisa (IgMAntikörper-Elisa) durchgeführt werden. Bei Toxoplasma-Aborten gelten die weißen Punkte auf den Kotyledonen als charakteristisch. Ein direkter Toxoplasmen-Nachweis kann durch einen Mäuseinokkulationstest (Materials aus Plazenta, Herzmuskulatur, Gehirn oder Leber der abortierten Föten) oder alternativ als in-virtro-Anzüchtung in Zellkulturen. Therapie Hund: Sulfonamide, Clindamycin (das in der Humanmedizin verwendete Pyrimethamin ist beim Hund schlecht verträglich) Schaf: Sulfonamide in hoher Dosierung Mensch: Sulfonamid/ Pyrimethamin (nicht während der ersten 15 Schwangerschaftswochen, teratogen!), dann Spiramycin (ROVAMYCIN ®) Bekämpfung In Problembeständen kann eine Chemoprophylaxe mit 16 mg Monensin (RUMENSIN ®) pro Tier (während Trächtigkeit bis zum Lammen) täglich durchgeführt werden. Beim Mensch ist die Hautansteckungsquelle das Schaffleisch (Ziegenfleisch), Schweinefleisch und Pferdefleisch. Infektionen können somit verhindert werden (Aufklärung wichtig!) Praktische Aspekte zur Toxoplasmose der Katze Ziel einer Prophylaxe ist die Verhinderung der Ausscheidung von Oozysten, die eine wichtige Infektionsquelle für den Menschen darstellen. Folgende Maßnahmen können dabei getroffen werden: • • • • • Ausschließlich füttern von Dosenfutter Fleisch ausreichend kochen oder mindestens für 3 tage bei – 20°C einfrieren. Toltrazuril (BAYCOX ®), 5 mg/ kg KM täglich über das Futter geben (kann die Ausscheidung drastisch reduzieren, aber nicht eliminieren) Tägliches Reinigen und desinfizietren des Katzenklos mit kochendem Wasser Tragen von Handschuhen während der Gartenarbeit von schwangeren, seronegativen Frauen (Verhinderung der Ansteckung an Kot von fremden Katzen) Wann scheidet die Katze Oozysten aus? Infektion Muskelzysten Oozysten Oozystenausscheidung 3 – 23 Tag p. i. (ungefähre Angaben) 20 – 35 Tag p. i. (ungefähre Angaben) Positive Serologie Ab ca. 8. Tag. P. i. Ab ca. 28. Tag p. i. Protozoa 43 Es stellt ich aus humanmedizinischer Sicht die Frage nach dem gefährdungspotential einer Hauskatze, können folgende Abklärungsschritte eingeleitet werden: • • 1. Schritt: Entnahme einer Kot- sowie einer Serumprobe, mit anschließender koprologischer resp. serologischer Untersuchung 2. Schritt: Resultatinterpretation der koprologischen und serologischen Untersuchung: − Oozystenausscheider: Die Katze stellt ein Infektionsrisiko dar und muß für 3 – 4 Wochen aus dem Haushalt entfernt werden. − Antikörpernachweis positiv: Wenn zugleich in 2 koprologischen Untersuchungen im Abstand von 2 Wochen im Kot keine Oozysten nachgewiesen werden, stellt die Katze mit hoher Wahrscheinlichkeit im Moment keine Infektionsquelle mehr dar. (CAVE: immunschwächende Faktoren wie z. B. Leukose-Komplex, Panleukopenie, ect. Können bei früher infizierten Katzen trotz Seropositivität zu einer erneuten Oozystenausscheidung führen.) − Antikörpernachweis negativ: Katze hat in den meisten Fällen noch keinen Erregerkontakt gehabt, gelegentlich kann sie aber auch sehr frisch oder latent infiziert sein (Immunsuppression). Wenn bei 4 Kotuntersuchungen im Abstand von jeweils 1 Woche keine Oozysten gefunden werden und in dieser und der folgenden Zeit keine Infektion durch die geeignete Haltungs- und Fütterungsart vermieden wird, ist die Katze als Toxoplasmafrei zu betrachten. HAMMONDIOSE Art Hammondina hammondi Hammondia heydorni Endwirt Nur Katze Hund (D: 0,5 – 1 %), (Fuchs, u. a. Caniden) Zwischenwirt Haus- und Wildwiederkäuer, Meerschweinchen, u. a. Nager, Schwein, Ziege, Kaninchen, Hund (Schaf und Rind nicht) BESNOITIOSE Art Besnoitia spp. Endwirt Katze (??) Zwischenwirt Je nach Art: Kleinnager, Reptilien, Rind, u. a. NEOSPOROSE, Neospora spp. Vorkommen Neospora caninum ist seit 1988 als eigene Spezies bekannt und verursacht ähnliche Symptome wie T. gondii, weshalb es bis 1988 fälschlicherweise als T. gondii diagnostiziert wurde. N. caninum verursacht Paralyse beim Hund und Aborte bei landwirtschaftlichen Nutztieren (Rind, Schaf, Ziege, Pferd). Erst seit kurzem ist bekannt, daß N. caninum der wichtigste protozoäre Erreger von Aborten beim Rind ist (DUBEY et. al. 1992) Im Westen der USA wurde bei 19 % aller zur Untersuchung eingesandten Rinderföten ein Neospora-Befall festgestellt, in einigen Gebieten sogar bis zu 60 %. Nebst Infektionen in den USA wurden Infektionen mit Neospora auch in Neuseeland, England sowie in den Niederlanden nachgewiesen und als wichtigste Abortursache bei Rindern erkannt. Neu stehen nun praktikable Diagnosemöglichkeiten wie Serologie, Immunhistologie sowie molekulare Techniken wie PCR für Massenuntersuchungen zur Verfügung. Bein Hund wurden in mehreren Fällen die Infektion nachgewiesen. Verdachtsdiagnosen werden beim Hund regelmäßig gestellt. In Endland waren 15 % einer durchschnittlichen Hundepopulation seropositiv im IFAT (TREES et. al. 1993). Protozoa 44 Biologie Durch experimentelle Infektionen beim Hund wurde gezeigt, daß dieser als Endwirt funktioniert und Toxoplasma-ähnliche Zysten ausscheiden kann, die morphologisch nicht von denjenigen von Toxoplasma im Katzenkot unterschieden werden können. Andere Entwirte konnten bisher nicht nachgewiesen werden. Der Hauptübertragungsmodus beim Rind ist in vielen Fällen vertikal, d. h. diaplazentar von der Neospora-positiven Mutterkuh auf das ungeborene Kalb. Perorale Infektionen von nachbarkühnen über infizierte Plazenten werden diskutiert. In einigen Ländern werden sog. „abortion storms“ berichtet, deren Ursprung evtl. Oozysten-ausscheidende Hunde sind. Klinische Symptomatik Rind: Experimentell infizierte Rinder zeigen zunächst keine klinischen Symptome. Gelegentlich wird kurzzeitig auftretendes Fieber festgestellt. Während der Trächtigkeit der Tiere kommt es jedoch häufig zu Aborten zwischen dem 4. und 6. Monat. Ebenso weisen Totgeburten oder die Geburt lebensschwacher Kälber mit auffälligen neuromuskulären Symptomen auf eine Neosporose hin. Hierbei können mehrere Aborte mit anschließender Geburt eines gesunden kalbes aufeinander folgen. Hund: Das Leitsymptom der Neosporose beim Hund ist eine progressive aszendierende Paralyse, die häufig bei mehreren Welpen eines Wurfes festgestellt wird. Hierbei sind die Tiere in der Regel über 5 Wochen alt. Die Hinterextremitäten sind meist stärker betroffen. Auch ältere Tiere können eine ausgeprägte Symptomatik zeigen, die von Apathie über zentralnervöse Störungen bis zum Tod führen kann. • • • • • • Neosporose & Abortgeschehen Abort erfolgt i. d. R. um den 5. Monat Sowohl Rinder als auch Kühe Keine Mumien Keine saisonale Häufung Lokale Häufung (Betriebsproblem) Mütterliche Verwandtschaft der Aborttiere (vertikale Transmission dominiert) • • • • • Indikationen für einen Neospora-Verdacht Sporadische oder gehäufte Aborte über längere Zeit Ähnliche Symptome wie bei BVD Maternale Verwandtschaft abortierter Tiere BVD ausgeschlossen Andere prädisponierende Faktoren (ausscheidende Hunde?) Diagnostik Am IPB werden zur Zeit folgende diagnostische Methoden zum Nachweis einer Neosporose (und einer Toxoplasmose) eingesetzt: Direkter Nachweis: • Polymerase-Ketten-Reaktion (PCR): Die am IPB entwickelte PCR ist ein methodisch hochsensitives Verfahren, mit dem genomische DANN des Parasiten aus diagnostisch gewonnenem Untersuchungsmaterial nachgewiesen werden kann. Zusätzlich wird ein „DNS-hybridization immuno-assay“ (DGEN-ETI-K ® DEIA) durchgeführt, der als hochsensitives und spezifisches Verfahren zum Nachweis von PCRAmplifukaten unseren Bestätigungstest darstellt. • In-vito-Isolierung von Neospora sp. oder T. gondii aus Abort- und Gewebematerial: Die Isolierung der Parasiten aus frischem, möglichst unter aseptischen Bedingungen entnommenen Abort- oder BiopsieMaterial ist sehr aufwendig und nicht in jedem Fall erforderlich. Sie jedoch grundsätzlich am IPB durchgeführt, um weitere Parasiten-Isolate für die Erforschung von Neospora zu gewinnen. • Histopathologisch sowie immunhistologische Untersuchungen in Zusammenarbeit mit dem Institut für Pathologie: Abort- und Biopsiematerial wird auf histologische Veränderungen untersucht. Mit Hilfe immunhistologischer Methoden (Immunperoxidase und Immunfluoreszenz) kann eine Differenzierung von Gewebzysten und Trophozoiten vorgenommen werden. Protozoa 45 Indirekter Nachweis: • Indirekter Immunfluoreszenz-Antikörpertest (IFAT): Als Antigen werden aus in-vitro-Zellkulturen gewonnene Tachyzyten eingesetzt. Die Untersuchung wird zur Zeit beim Hund und Rind durchgeführt. • Enzyme-linked immunosorbent assay (ELISA): Diese Methode ist diagnostisch sehr sensitiv und wird ergänzend zu dem am IPB verwendeten IFAT beim Hund und Rind eingesetzt. Zur Resultatangabe werden die Antikörperkonzentrationen prozentual auf den Wert eines Referenzserums bezogen. Ein Wert von 0 AE (0 Antikörpereinheiten) entspricht einem „negativen Resultat“, d. h. keine spezifischen Antikörper nachweisbar, ein Wert von 100 AE entspricht der Antikörperkonzentration im positiven Referenzserum. „Positive“ Ergebnisse liegen ab 1 AE und größer vor. Artdifferenzierung: • Western Blot Technik: Da bei den serologischen Tests Kreuzreaktionen mit T. gondii nicht in allen Fällen auszuschließen sind, wird zur Zeit an der Entwicklung eines geeigneten Western-Blot-Test gearbeitet. Erforderliches Untersuchungsmaterial: • Allgemeines: Gewebeproben und entsprechende Flüssigkeiten sollten gekühlt und per Express verschickt werden. Bei Abortmaterial bitte einen großen teil des Gehirns, bei allen übrigen Geweben möglichste von vielen verschiedenen teilen des Organs Proben bis zu einer Gesamtmenge von 50 g entnehmen. Das Gewebe darf für die Untersuchung mittels PCR und für die in-vitro-Kultivierung nicht fixiert werden (kein Formalin!). bei Flüssigkeiten sollten bis zu 50 ml entnommen werden. Für die serologische Untersuchungen benötigen wir mindestens 1 ml Serum oder 5 – 10 ml Vollblut. • In-vito-Isolierung von Neospora sp. oder T. gondii aus Abort- und Gewebematerial: − Aborte: unfixierte, möglichst aseptisch entnommene Gewebeproben aus Gehirn, Rückenmark, Herz, Muskulatur, Plazenta, Ammniomflüssigkeit, Liquor (ZNS), Blut (Herzpunktion), Labmageninhalt. − Biopsie: unfixierte, möglichst aseptisch entnommene Gewebeproben aus der Muskulatur • Polymerase-Ketten-Reaktion (PCR): − Aborte: unfixierte, möglichst aseptisch entnommene Gewebeproben aus Gehirn, Rückenmark, Herz, Muskulatur, Plazenta, Ammniomflüssigkeit, Liquor (ZNS), Blut (Herzpunktion), Labmageninhalt. − Biopsie: unfixierte, möglichst aseptisch entnommene Gewebeproben aus der Muskulatur • Histopathologische Untersuchung: − Aborte: Gewebeproben (evtl. 4 % gepuffertes Formalin) aus Gehirn, Rückenmark, Herz, Muskulatur, Plazenta Therapie Für das Rind ist keine Therapie bekannt. In Einzelfällen wurde beim Hund eine Behandlung analog der Toxoplasmose durchgeführt. Eingesetzt wurden bisher: • • Kombinationstherapie mit Clindamycin (ANTIROBE ®), 13,5 mg( kg KM 3 x täglich während 10 Tage und Sulfadiazin/ Trimethoprim (TRIBRISSEN ®), 15 mg/ kg KM 2 x täglich während 4 Wochen Kombinationstherapie mit Pyremithamin (DARAPRIM ®), 1 mg/ kg KM 1 x täglich während 14 Tagen und Sulfadiazin/ Trimethoprim (TRIBRISSEN ®), 15 mg/ kg KM 2 x täglich während 4 Wochen Nach den ersten berichten wirkt Clindamycin allein weniger gut als in Kombination. Mit der Kombination Pyremithamin und Sulfadiazin/ Trimethoprim soll in einigen Fällen sogar eine klinische Heilung erzielt worden sein. Hierbei sind die Heilungsaussichten bei frühzeitiger Diagnose günstiger zu beurteilen. Prophylaxe und Bekämpfung Zur Zeit sind noch zu wenige epidemiologische Informationen verfügbar, um eine relevante Bekämpfungsstrategie auszuarbeiten. Es kann jedoch davon ausgegangen werden, daß seropositive Muttertiere chronische Neospo- Protozoa 46 ra-Trägerinnen sind und somit nicht nur ein erhöhtes Risiko für einen Neospora-Abort darstellen, sondern auch daß sie bei Gebären von gesunden Kälbern – da diese ebenfalls Neospora-infiziert sein können, dazu beitragen, Neospora-problembehaftete Zuchtlinien aufzubauen. SARCOCYSTDAE SACROCYSTIOSE, Sarcocystis spp. Vorkommen Sarcocystis spp. kommt bei allen Haustieren und beim jagdbaren Wild sehr häufig vor. Die Schizogonie mit Bildung von Sarcozysten erfolgt in herbi- und omnivoren Zwischenwirten. Eine geschlechtliche Entwicklung findet in Carnivoren und dem Menschen statt. Die wirtschaftliche Verluste in den USA betragen jährlich 95 Millionen US$. Die Infektionsraten bei den Wiederkäuern beträgt bis zu 100 %. Sarcosporidiensporozyten sind bei 15 – 16 % der Hunde- und 4 – 5 % der Katzenkotproben sowie etwa 7 % der menschlichen Stuhlproben nachweisbar. Vertreter Sarcocysts-Arten S. hominis S. suihominis S. cruzi S. tenella S. capraecanis S. miescheriana S. bertrami S. capraeolicanis S. horvathi S. hirsuta S. gigantea S. medusiformis S. moulei S. caniculi S. neuronea S. neuronea-like organisms Endwirte Mensch, Affen Mensch, Affen Hund, Fuchs, u. a. Hund, Fuchs, u. a. Hund Hund, Fuchs, u. a. Hund Hund, Fuchs, u. a. Hund Katze Katze, Fuchs Katze Katze Katze ? (Opossum) ? Zwischenwirte Rind Schwein Rind Schaf Ziege Schwein Pferd, Esel Reh Huhn Rind Schaf, Wildschafe Schaf Schaf Kaninchen Pferd (Myeloencephalitis, USA) Diverse Tierarten Bei Reptilien, Vögeln und Säugern (einschließlich Mensch, Affen, Wale) sind bisher 122 Sarcocystis-Arten beschrieben. Die End- und Zwischenwirte sind jedoch erst von 56 Arten bekannt. Morphologie der Erreger Protozoa 47 Die Zysten (= Miescher’sche Schläuche) sind meist unter 1 mm groß und mit dem bloßen Auge nicht zu erkennen. In Muskelfasern sind schlauch- bzw. spindelförmig. Bei Schaf und Ziege sind Arten mit bis zu 1,5 cm großen Zysten bekannt. Die Zysten befinden sich ausnahmslos intrazellulär (parasitophore Vakuole). Während des Zystenwachstums kommt es zur Oberflächenvergrößerung durch unterschiedliche Auffaltung der Primärhülle. Reife Zysten sind meist gekammert und mit einer charakteristisch aufgebauten Zystenwand. Der Inhalt besteht aus mehreren tausend bananenförmigen Zystozoiten (12 – 15 µm). Die Sporozysten sind dickwandig und enthalten je 4 Sporozoiten sowie einen Restkörper. Entwicklung Obligat zweiwirtiger Entwicklungszyklus: Sie sind nur in herbi- und omnivoren Zwischenwirten streng wirtsspezifisch. Im Endwirt sind die Parasiten weniger spezialisiert. Die Arten der Katze können z. B. ihre geschlechtliche Entwicklung auch in anderen Feliden und die dies Hundes auch im Wolf, Fuchs oder Schakal vollenden. Nach der Schizogonie werden die Merozoiten in die Muskulatur geschwemmt. Dort erfolgt die Zystenbildung, ab dem 70. Tag p. i. infektiös sind. Im Endwirt findet direkt eine Gamogonie statt. Epidemiologie: In der Regel herrscht eine enzootische Stabilität, d. h. alle Tiere infizieren sich frühzeitig durch die Aufnahme subklinischer Sporozystenmengen mit kontaminierter Nahrung und bilden eine Immunität aus. Ständige Reinfektionen erhalten die vor Erkrankung schützende Immunität. Akute Erkrankungen treten nur auf, wenn vollempfängliche Tiere plötzlich größere Sporozystenmengen aufnehmen. Sporozysten passieren zum Teil die Kläranlagen unbeschadet. Auf mit Abwasser beregneten Grünflächen infizieren sich die Rinder sehr rasch mit Sarkosporidien, zu akuten Erkrankungen kam es dort allerdings nicht. Pathogenese, Pathologie und Klinik Eine akute Sarcocystiose tritt während des Reifens der 2. Schizontengeneration auf. Die Schwere des Krankheitsbildes ist von der zahl der aufgenommenen Sporozysten abhängig. Die akute Sarcocystiose führt zu einer normozytären und normochromen Anämie (Hämatokrit auf 50 – 60 % des Aufgangswertes), Hyperbilirubinämie, Abnahme der Plasmaosmolalität, und zu einer Erhöhung der Enzymaktivitäten (AST, CK, LDH, Aldolase, G-6PDH, SDH) wegen der Gewebezerstörungen (insbesondere in der Herzmuskulatur). Pathologisch-anatomisch: Protozoa 48 Zahlreiche Petechien und Ekchymosen in allen Organen sowie Ödeme in der Muskulatur. Lymphknoten sind vergrößert und ödematös. Milz und Leber sind vergrößert. Die Muskulatur ist graurot marmoriert und mit Blutungsherden durchsetzt. Später wird sie milchig-weiß und wäßrig. Histologie (gilt nur für pathogene Arten): Hämorrhagien sowie entzündliche Reaktionen mit mononukleären Zellinfiltraten (v. a. Lymphozyten, weniger häufig Makrophagen, eosinophile Leukozyten und Plasmazellen). In vielen Orten kommt es zu degenerativen Veränderungen und Nekroseherden. Die Pathogenese des durch Sarcocystis induzierten Abortes beim Rind ist noch wenig untersucht. In den abortierten Föten sind keine Parasitenstadien nachweisbar. Klinik von S. cruzi: 200 000 Sporozysten von S. cruzi p. o. führt zu schweren Erkrankungen, Aborte und Todesfälle. Dabei tritt zuerst Fieber, Appetitlosigkeit und Apathie auf. Nach einer deutliche Besserung des Allgemeinbefindens tritt ab dem 26. Tag p. i. während der 2. Schizogonie erneut Fieber auf. Tragende Kühe verkalben. Schleimhäute sind blaß und zum Teil ikterisch. Im Endstadium, um den 30 Tag p. i., kommt es zum Festliegen und schließlich zum Exitus letalis. Die Schwere der Symptome ist abhängig von der Infektionsdosis. Schizonten von S. cruzi führen zu Enzephalitiden mit herdförmigen Erweichungen, Vaskulitis und Infiltrationen mononukleärer Zellen sowie zahlreiche Schizonten. Klinik von S. neuronea: S. neuronea kommt beim Pferd vor und führt zur Equinen Protozoeal Myeloencephalitis (EPM) in den USA. Klinische Zeichen der EPM entspricht der Symptomatik einer herdförmigen Myelitis, seltener Encephalitis (Läsionen sind vor allem auf den Hirnstamm beschränkt). Es kommt zur Facialislähmung und zur spinale Ataxie bis zur komplexen Symptomatik einer multifokalen Encephalomyelitis. Zudem tritt eine Vorhandschwäche mit extremer Extension der Vordergliedmaßen und mit tiefer Kopfhaltung, Schwitzen und Muskelatrophie (Zunge, M. quadriceps und M. gluteus), auch schwere Ataxie Para- und Tetraplegie auf. Eine sichere Diagnose kann nur post mortem gestellt werden. Differentialdiagnosen sind Herpesvirus-1-Enzephalomyelitis, klassische spinale Ataxie, evtl. Tollwut, Borna’sche Krankheit, Vergiftungen und Neuritis caudae equinae. Klinik von S. neuronea-like organisms: • Nerz (USA): Meningoencephalitis aufgrund von Sarcocystic neuronea-like organisms. Immunhistologischer Nachweis erfolgte mit entsprechenden Antiseren. Bedeutung bisher unbekannt. • Schaf (USA): Meningoencephalitis-Leukomyelomalazie aufgrund von Sarcocystic neuronea-like organisms. Parese des Beckens und der hinteren Extremitäten. Ähnliche Fälle bereits in Australien, Neuseeland und Frankreich. Bedeutung bisher unbekannt. Diagnose Die Diagnose der akuten Sarcocystiose ist schwierig (IFAT, ELISA erst nach abklingen der Erkrankung positiv). Bei gestorbenen Tieren: Schizontennachweis in Giemsa-gefärbten Organabklatschpräparaten (vor allem Niere) oder im histologischen Schnitt (vor allem im Myokard, Gehirn). Makroskopisch bei großen Zysten. In Aufschwemmung zerkleinertre Muskulatur. In physiologischer Kochsalzlösung können auch intakte Zysten gefunden werden (ebenfalls nach Verdauungsmethode). Anhand der haarartigen Fortsätze auf der Zystenoberfläche ist S. cruzi meistleicht zu erkennen. Die Zysten von S. hirsuta und S. hominis haben palisadenartig strukturierte Wände. Sie sind nicht voneinander zu unterscheiden. Im Endwirt können die Zysten mittels Flotation (Arten nicht unterscheidbar) nachgewiesen werden. Therapie und Bekämpfung Zur Zeit noch keine. Mit 100 mg/ kg Amprolium über 30 Tage beginnend am Tag der Infektion, läßt sich eine akute Erkrankung verhindern. Wird Sarcocystis-haltiges Fleisch bei der Fleischuntersuchung festgestellt, wird dies untauglich und entsorgt. Protozoa 49 PIROPLASMIDAE, Piroplasmen Morphologie und Vorkommen Sie ähneln in ihrer Morphologie den Kokzidien, nur der Apikalkomplex ist unvollständig. Sie leben intrazellulär, wobei vorwiegend Blutzellen von Wirbeltieren befallen werden. Entwicklung Es liegt eine obligat heteroxene Entwicklung vor, wobei Generationswechsel zwischen einer geschlechtlichen (Gamogonie) und zwei ungeschlechtlichen Vermehrungen (Sprorogonie und Schizogonie) stattfinden. Die Gamogonie und Sporogonie findet ausschließlich im Vektor statt (Zecken!). Die Infektionsstadien für den Vertebratenwirt stellen die Sporozoiten dar, die an Ende der Sporogonie entstehen. Im Vertebratenwirt erfolgt die Schizogonie. Bei Babesia-Arten findet man Schizonten und Merozoiten in den Erythrozyten, bei Theilleria-Arten befinden sich die Schizonten in Lymphozyten („Koch’sche Kugeln“) und die Merozoiten in den Erythrozyten. THEILLERIOSE, Theilleria spp. Theilleria-Arten der Haustiere Art T. parva parva T. orientalis (syn. T. sergenti) Verbeitung Ost- und Zentralafrika Afrika (südlich der Sahara) Nordafrika, Mittelmeerländer, Asien Afrika (südlich der Sahara) Europa, Nordafrika, Asien, Australien T. hirci Europa, Asien, Afrika Schaf, Ziege Hyalomma Bösartige Theilleriose der Schafe und Ziegen T. ovis Europa, Asien, Afrika Schaf, Ziege Rhipicephalus, Dermacentor, Haemaphyllis Gutartige Theilleriose der Schafe und Ziegen T. parva lawrenci T. annulata T. mutans Wirte Rind, Büffel Überträger Rhipicephalus Theilleriose Afrikanisches Küstenfieber Rind, Büffel Rhipicephalus Korridorkrankheit Rind, Büffel Hyalomma Mittelmeerküstenfieber Rind, Büffel Ablyomma Pseudoküstenfieber, „milde Theilleriose“ Rind Haemaphysalis apathogen Epidemiologie Enzootische Stabilität in Endemiegebieten bedeutet, daß eine frühzeitige Infektion von Kälbern kaum zu Erkrankungen führt und diese bereits infizierten Tiere dann zeitlebens immun sind. Nur bei T. parva parva liegt eine relativ geringe enzootische Stabilität vor. Klinische Probleme ergeben sich beim Zukauf von Tieren, vor allem bei sog. Importrassen und in Gebieten mit geringer Zeckenpopulation kommt es zu keiner vollständigen Durchseuchung der Jungtiere. Pathogenese, Pathologie, Klinik Protozoa 50 Die einzelnen Stämme weisen eine unterschiedliche Virulenz auf. Die pathogenen Stadien befinden sich nicht intra-erythrozytär (wie bei Babesia), sondern intra-lymphozytär. Schizonten induzieren die Killer-Zell-Aktivität und es kommt zu einer Lymphopenie. Bei der Infektion mit T. anulata kommt es zur Erythropenie, da einerseits eine fehlende regenerative Knochenmarksleistung vorliegt und andererseits Makrophagen befallene und später nicht befallene Erythrozyten fressen. Das klinische Bild ist geprägt von Fieber und allgemeiner Schwäche, blutiger Durchfall. Es tritt kein Ikterus und keine Hämoglobinurie auf. Gelegentlich kommt es zum Tod wegen des hohen Fiebers und aufgrund von Herzversagen. Die Inkubationszeit beträgt 15 - 18 Tage. Die Inkubationszeit bei T. parva beträgt 12 - 15 Tage. Das klinische Bild zeigt hohes Fieber und eine Anämie. Die Mortalität beträgt 70 - 90 % (v. a. bei älteren, nicht-immunen Tieren). Die Haupttodesursachen sind Lungenödem und Nierenversagen. Es tritt keine Splenomegalie auf. Die zerebrale Form wird als turning sickness bezeichnet. Kälber zeigen häufig einen chronischen Verlauf. Entwicklung Die Inokulation mit Sporozoiten erfolgt mittels Zeckenspeichel. Diese penetrieren in die Lymphozyten, in denen eine asexuelle Vermehrung durch Schizogonie stattfindet („Koch’sche Kugeln“). Der Nachweis kann ab dem 6. Tag p. i. in den regionären Lymphknoten geführt werden. Es kommt zu einer Transformation der Lymphozyten in riesenwüchsigem sich ewig teilende Lymphoblastoid-Zellen (wahrscheinlich über eine Interaktion des Parasiten mit dem T-Zell-Rezeptor). Bei der Wirtszellteilung teilt sich der Schizont synchron mit. Es entstehen zuerst Makroschizonten mit großen Kernen, später dann Mikroschizonten mit bis zu 100 Merozoiten (0,5 x 1,0 - 2,0 µm). Diese dringen in Erythrozyten ein. Die Vermehrung erfolgt nur bei T. annulata u. a. Arten in den Erythrozyten, bei T. parva nicht. Die Übertragung erfolgt mit Schildzecken. dabei ist des nur möglich, daß Stadium zu Stadium (transstadial) übertragen wird. Transstadial bedeutet, daß innerhalb der gleichen Zeckengeneration von einem Entwicklungsstadium zum anderen (Larve → Nymphe; Nymphe → Adulte) übergeht. Die Abbildung zeigt den Lebenszyklus von Theilleria-Arten: AV Spweicheldrüsenalveole, BI binäre Teilung, E Erythrozyt, IV innere Vakuole, JS junger Sporont, KB Kochscher Körper (= Schizont), N Nucleus, NH Nucleus der Wirtszelle, SP Sporozoit, SPO Sporoblast, TH Dorn (Strahlenspitze bei Mikrogamonen und -gameten) 1. Sporozoit wird beim Zeckenstich injiziert. 2. - 3. Bildung von Schizonten und den Lymphozyten. 4. - 5. Merozoiten dringen in Erytrozyten ein und vermehren sich dort durch Zweiteilung. 6. Abrundung der Merozoiten zu ovoiden Stadien (Gamonten). 7. - 8. Gamonten nach dem Saugakt im Zeckendarm (8. - 8.4 Bildung von Mikrogameten.) 9. Makrogamont 10. Zygote (Syngamie in vitro und pr DNAMessung nachgewiesen. 11. - 12. Bildung eines Kineten aus jeder Zygote. 13. Kinten verlassen den Zeckendarm (13. a. T. annulata, T. ovis, T. mutans, T. velifera, 13. b. T. parva: hier kann der Kern des Kineten schon mit Teilungen beginnen; Kinet ist oft mehrkernig) 14. Eindringen der Kinete in Zellen der Speicheldrüsen und Umwandlung zu vielkernigen Plasmodien (nach Häutung der Zecke). Protozoa 51 15. Bildung von zahlreichen Sporozoiten und Übertragung beim nächsten Saugakt auf den nächsten Wirt. Diagnose Der Nachweis von Theillerien erfolgt mittels Lymphozyten, die aus Lymphknotenpunktaten gewonnen werden. Das Punktat wird ausgestrichen und mit Giemsa-Lösung gefärbt. Zudem kann auch eine Serologie (z. B. IFAT) durchgeführt werden. Therapie Die Chemotherapie erzielt gute Erfolge, wenn sie bereits zu Beginn der Erkrankung verabreicht wird: T. parva u. a.: • Parvaquone (CLEXON , 2 x 10,0 mg/ kg KM im Intervall von 48 Stunden i. m. T. annulata: • Parvaquone (CLEXON , 1 x 20,0 mg/ kg KM i. m. • Buparvaquone (BUTALEX ), 2,5 mg/ kg KM i. m. BABESIOSE, Babesia spp. Babesien leben intrazellulär in Erythrozyten (selten auch in Lymphozyten, z. B. B. equi). Sie werden in der Regel durch Zecken übertragen. 1988 beschrieb erstmals der rumämische Tierarzt BABES das Vorkommen von Babesien in Erythrozyten von Wiederkäuern. Babesia-Arten der Haustiere Art Größe B. bigemia groß B. majot groß B. divergens klein B. bovis Verbreitung Mittel-/ Südamerika, Südeuropa, Afrika, Asien, Australien Afrika, Südamerika, Europa (Niederlande, Schweiz, Deutschland) Wirte Überträger Name der Babesiose Rind, wildlebende Wiederkäuer Boophilus spp. Texasfieber, Redwater Rind Haemaphysalis punctata Enzootische Milzruptur West-/ Zentraleuropa Rind, wildlebende Wiederkäuer Ixodes ricinus Seuchenhafte Hämoglobinurie, „Weiderot“ klein UDSSR, Südeuropa, Frankreich, Afrika, Australien, Mittel- und Südamerika Rind, wildlebende Wiederkäuer B. caballi groß Südeuropa, UDSSR, Asien, Afrika, Mittelamerika Pferd, Esel, Maultier, Zebra B. equi klein Europa, UDSSR, Asien, Afrika, Südamerika B. motasi groß Europa, Asien, Afrika, Südamerika B. crassa groß Iran Pferd, Esel, Zebra, Maultier Schaf, Ziege, wildlebende Wiederkäuer Schaf B. ovis klein Europa, Asien, Afrika B. trautmanni groß UDSSR, Afrika, Südeuropa Schaf, Ziege Schwein, Warzen- und Buschschwein Boophilus spp., Rhipicephalus bursa, Ixodes ricinus Hyalomma spp., Dermacentor spp., Rhipicephalus spp. Hyalomma spp., Dermacentor spp. Rhipicephalus bursa, Rhipicephalus ricinus unbekannt Seuchenhafte Hämoglobinurie Pferdebabesiose (Piroplasmose) Pferdebabesiose (Piroplasmose) Schafbabesiose Schafbabesiose Rhipicephalus spp. Schafbabesiose Ixodidae ? Schweinebabesiose Protozoa 52 B. perronvitoi klein B. canis groß B. gibsoni klein B. felis klein UDASSR, Afrika, Südeuropa Schwein Südeuropa, Asien, Afrika, Hund, Rotfuchs, Mittel-/ Süd-/ Zentralameriu. a. ka Hunde und andeAsien, Afrika, Nordamerika re Kaniden Katze, Löwe, u. Afrika, Asien a. Ixodidae ? Schweinebabesiose Rh. sanguineus Hundebabesiose Haemaphysalis Hundebabesiose Haemaphysalis ? Katzenbabesiose Entwicklung (CAVE: B. equi-Zyklus mit Lymphozyten-Initialphase). Beim Zyklus der Babesien werden die Sporozoiten mit dem Zeckenspeichel in den Wirt verbracht. Im Wirt dringen sie in die Erythrozyten ein. Die Merozoiten vermehren sich durch Zweiteilung kontinuierlich. In der Zecke ist die Übertragung in der Regel transovariell, jedoch auch von Stadium zu Stadium. Die Abbildung zeigt den Lebenszyklus von Babesia canis und anderen BabesiaArten: CY Cytomere, DE Gamont der Entwicklung, DK Kinet in der Entwicklung, E Erythrozyt, ES entwickletre Sporont, GP großes Plasmodium, HC Wirtszelle, IV innere Vakuole, JS junger Sporont, N Nucleus, NH Nucleus der Wirtszelle, NP polyploider Nucleus, R Strahlenkörper, SP Sporozoit, TH Dorn (Strahlenspitze bei Mikrogamonen und -gameten) 1. Sporozoit im Zeckenspeichel. 2. - 5. Bildung von Merozoiten durch Zweiteilung in Erythrozyten des Wirbeltiers. (5. 1. intraerythrozytärer Merozoit, 5.2. Merozoiten gehen im Zeckendarm zugrunde). 6. Intraerythrozytärer, abgerundeter Gamont. 7. Gamonten bilden strahlenförmige Fortsätze. 8. Ausdifferenzierter Strahlenkörper (aus ihm gehen direkt „weibliche“ und durch Teilungen „männliche Gameten hervor.) 9. Verschmelzung von Isogameten, die den Strahlenkröern (6) gleichen. 10. - 14. Aus der Zygote entsteht in einem Prozeß, der dem der Theilleria-Arten gleicht, ein Kinet. 15. - 18 a. In verschiedenen Organen entsteht aus jedem Kineten zahlreiche weitere von gleichem Aussehen. Über das Ovar werden auch die Eier und somit die nächste Zeckengeneration (Transovarielle Übertragung) befallen. 19. - 21. Dringt ein Kinet in eine Zelle der Speicheldrüsenalveolen ein, so entwickeln sich auf ungeschlechtlichem Weg zahlreiche Sporozoiten. Morphologie Es gibt große Babesien (> 3 µm Durchmesser) und kleine Babesien (< 3 µm Durchmesser). Die Lage in den Erythrozyten ist zentral oder peripher. Die Form ist stumpf oder spitz, amöboid-, ring- oder birnenförmig. Es gibt zudem einfache Formen, Doppelformen und Viererformen. Bei Doppelformen liegen die Babesien in einem Winkel zueinander. Allgemeines zur Pathogenese und Pathologie Protozoa 53 Bei z. B. B. canis kommt es zur Aktivierung des Kallikrein-Kinin-System und damit zur Erhöhung der Kapillarpermeabilität und zur zirkulatorischen Stase. Erythrozyten haften an den Kapillarendothelien und führen zur Verklumpung des Blutes in den Kapillaren, zur Hämostase und Anoxie. Daraus resultieren Leber- und Nierenschäden. Rind: • B. divergens: Überträger ist Ixodes ricinus. In gebieten mit enzootischer Stabilität sind alle Tiere infiziert, es gibt praktisch keine Krankheitsausbrüche. Jungtiere erhalten einen Immunschutz über das Kolostrum und eine ständige Reinfektion führt zur Ausbildung einer Immunität, die zeitlebens aufrecht erhalten wird. Krankheiten treten bei neu zugekauften Tieren sowie in Gebieten, wo Zecken eingeschleppt werden (z. B. über Wild, Kleinsäuger, Vögel) auf. Hauptinfektionszeiten sind Mai/ Juni und September. Pathologischanatomische Veränderungen sind eine Vergrößerung der Milz, degeneriertes Leberparenchym und degenerierte Nierenglobuli, Lungenödem und eine katarrhalische Gastroenteritis. Aufgrund er Symptomatik wird die Erkrankung Weiderot oder Mairot genannt. Bei Jungtieren tritt ein meist milder Verlauf mit Fieber (einige Tage) und Freßunlust auf. Ältere Tiere zeigen Fieber, Pansenparese, Durchfall, Anämie, Ikterus, Hämoglobinurie und eine Erythropenie (1 – 3 Mio./ mm3). • B. major: Führt i. d. R. zu keiner Hämoglobinurie, jedoch zu einer massiven Splenomegalie (Milzruptur). • B. bovis: 8 Tage p. i. entwickelt sich Fieber, ein struppiges Haarkleid, Anämie, Hämoglobinurie, Ikterus, Muskelzittern, allgemeine Schwäche, Blockierung von gehirnkapillaren und zentralnervöse Störungen. Die Tiere sterben oder es kommt zu einer raschen Erholung. Pferd: • B. caballi: Transovarielle Übertragung bei der Zecke. Die Präpatenz beträgt 7 – 12 Tage. Die Parasitämie beträgt nur < 1 % (bis ca. 2 %). Es kommt zur Agglutination der Erythrozyten in den Kapillaren, zum Lungenödem, Anämie der Schleimhäute und selten zu einer Hämoglobinurie. Die klinische Symptomatik ist geprägt von Fieber, Apathie, Tränenfluß, Schwellung der Augenlider, erhöhte Atem- und Pulsfrequenz und evtl. Schock bei akuten Lungenödem. Die Latenz beträgt bis zu 4 Jahre und ist i. d. R. selbst ausheilend. • B. equi: Transstadiale und keine transovarielle Übertragung bei der Zecke. Die Präpatenz beträgt 12 – 14 Tage. Die Parasitämie ist höher als bei B. caballi (1 – 7 %), bis zu ca. 20 – 80 %, jedoch gelegentlich sehr niedrig (< 1 %), insbesondere bei autochtonen Fällen in der Schweiz. Bei hoher Parasitämie kommt es zu einer schweren hämolytischen Anämie, Ikterus, Hämorrhagien in diversen Organen und zur Splenomegalie. Eine Hämoglobinurie ist häufig. Symptome sind Fieber, Apathie, Tachycardie, Tachypnoe, schwere Anämie, Leukozytose, Ikterus und zu einem Abfall des Hämatokritwertes. Es kommen ebenso auch milde Formen vor, vor allem in Zentraleuropa. Chronisch-persistierende Verlaufsformen kommen bei nicht vollständiger Parasitenelimination vor. Hund: • B. canis: Die Pathogenese ist ähnlich wie bei der Babesiose des Rindes. Es kommt zu einer Spleno- und Hepatomegalie, Glomerulonephritis und Ödeme in den Körperhöhlen. Es betrifft Hunde jeglichen Alters. Bei Jungtieren treten mildere Verlaufsformen auf. Die Krankheit wird bei der Tiereinreise in Endemiegebiete übertragen. Die Inkubationszeit beträgt 1 – 3 Wochen, Symptome sind Fieber, Konditions- und Gewichtsverlust, Anämie, Thrombozytopenie, Ikterus, Splenomegalie, Hämoglobinurie, Ödeme, Aszites und Blutungen in der Haut und in der Schleimhaut. Typische Veränderungen an den Augen sind Keratitis, Iritis sowie eine Netzhautablösung. Probleme des ZNS führen zu Bewegungsstörungen, Paresen, Nierenversagen und über eine hämorrhagische Enteritis zum Tod. Chronische Verlaufsformen mit deutlicher Anämie. Vektoren sind: Rhipicephalus sanguineus, Dermacentor reticulatus und Dermacentor marginatus. Diagnose • • Der Erregernachweis erfolgt bei frischen Infektionen (Kapillarblutausstriche, Malaria-QBC), klinische Symptome und der Anamnese (Jahreszeit!). Der Babesiennachweis im Kapillarblutausstrich (während der Fieber-Phase, ca. erste 14 Tage p. i.) mittels Giemsa-Färbung oder Diff-Quick. Bei latenten Infektionen kann eine Serologie und IFAT (KBR ist nur in der Anfangsphase positiv). Protozoa • 54 Bei Pferdebabesionen ist eine Artdifferenzierung serologisch möglich. Weiterführende Abklärungen werden mittels 2D-Immunblots ermöglicht. Therapie • • Diminazen (BERENIL ®) Rind und Schaf: 3,5 – 8 mg/ kg KM (i. m.) Hund: 3,5 – 7 mg/ kg KM (i. m.) • • • Imidocarb (IMIZOL ®) Rind: 1,2 mg/ kg KM (s. c.) Pferd: 2 ml/ 100 kg KM (120 mg Wirkstoff/ ml) Hund: 0,05 ml/ kg KM • Phenamidin (OXOPIRVENIDINE ®) Hund: 1 x 15 mg/ kg KM (Wiederholung am 3. und 4. Tag) Prophylaxe • • Zeckenprophylaxe Immunprophylaxe (PIRODOG ®-Vakzine): inaktivierte, konzentrierte, lösliche Antigene von Babesia canis (die Babesien werden in Erythrozyten in-vitro gezüchtet. Die Vakzine ist lyophilisiert. Dosierung: − − − Hunde > 7 kg KM: Lyophilisat in 1 ml Lösungsmittel lösen Hunde < 7 kg KM: Lyophilisat in 0,5 ml Lösungsmittel lösen Hunde < 1 kg KM: Lyophilisat in 0,25 ml Lösungsmittel lösen. Anwendung: subcutan in subscapuläre Region, 2 Injektionen im Intervall von 3 – 4 Wochen. Die erste Impfung erfolgt im Alter von 3 Monaten. Booster-Injektion nach 1 Jahr oder 6 Monaten, in Abhängigkeit von der epidemiologischen Situation. Wirkung: Verhütet Todesfälle durch Babesiose, verhindert aber bei starkem Infektionsdruck die Infektion nicht immer. Impfschutz im französischen Endemiegebiet 80 – 90 %, in anderen gebieten wesentlich geringer. Nicht während der zeit der epidemiologischen Hochsaison vakzinieren (vorher. Nicht mit anderen Impfungen kombinieren. Der Impfschutz tritt erst nach der 2. Impfdosis ein und hält für bis zu 6 – 8 Monate hin. Bein Rind werden ebenfalls Vakzinen erprobt, z. B. in Deutschland regelmäßig im Frühjahr (Mai/ Juni), i. d. R. bestrahltes Blut). CAVE Übertragung von Viren (z. B. Leukose!).