Synthese von C1-[18F]Fluorethylamino
Werbung
![Synthese von C1-[18F]Fluorethylamino](http://s1.studylibde.com/store/data/008995042_1-13a1cdcf97e38156d96d6114d7db55a0-768x994.png)
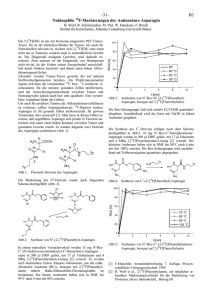
Synthese von C1-[18F]Fluorethylamino-Asparagin zu Tumorstudien B. Wolf1, R. Schirrmacher1, S. Höhnemann1, T. Held2, G. Förster2, P. Bartenstein2, F. Rösch1 Institut für Kernchemie, Johannes Gutenberg Universität, Fritz-Straßmann-Weg 2, 55128 Mainz 2 Klinik und Poliklink für Nuklearmedizin, Langenbeckstr. 1, 55131 Mainz 1 Die 2-[18F]FDG ist der am breitesten eingesetzte PETTumor-Tracer. Da sie als Glykolyse-Marker für Tumorwie auch für Normalzellen relevant ist, reichert sich 2[18F]FDG nicht nur in Tumoren, sondern auch in entzündlichem Gewebe an. Die Diagnostik malignen Gewebes wird dadurch erschwert. Zum anderen ist die Diagnostik von Hirntumoren nicht trivial, da das Gehirn seinen Energiebedarf ausschließlich durch Glukose bestreitet und damit einen hohen Aktivitätsuntergrund liefert. Alternativ dazu bieten sich Proliferationsmarker wie Aminosäuren zur PET-Tumor-Diagnostik an. Es wurde Asparagin zur Markierung mit [18F]Fluor ausgewählt, da bekannt ist, das einige Tumorarten Asparagin nicht selbst synthetisisieren können, was gesunde Zellen ausgehend von der aOxobuttersäure können. Der verbreiteste Typ dieser Tumorart ist die Leukemie [1]. Als Zieltracer wurde C1[18F]Fluorethylamino-Asparagin (1) [Abb. 1] gewählt. 18 F 1 Abb. 1: C1-[18F]Fluorethylamino - Asparagin Die Synthese erfolgte nach folgendem Schema [Abb. 2]: [18F]fluoride // K2CO3 // Kryptofix® OTos boc H N 2 boc boc HN F3CCOOH 18 F O F 3 N(CH2-CH3)3 O + H2N 18 F 4O NO2 boc HN 6 O 18 N H H2N F O F3CCOOH H2N 18 N H F H2N O O 6 RPM I 2650 M el 398 Mz 7 M el F O 5 A 549 Abb. 3: Inkubation von C1-[18F]Fluorethylamino-Asparagin mit verschiedenen Zelltypen 18 N H H2N O 30 PC I 13 HN 4 40 0 H2N boc 50 10 18 3 H N 60 20 1 Abb. 2: Syntheseschema von C1-[18F]Fluorethylamino-Asparagin N-Boc-2-[18F]Fluoretylamin (3) wird aus N-Boc-2-OTosyl-Aminoethanol (2) in 10 min bei 140 °C in DMSO mittels [18F]Fluorid, K2CO3 und Kryptofix® erhalten. Die RCA beträgt 50 %. (3) wird mittels Triflouressigsäure quantitativ innerhalb von 8 min zu 2-[18F]Fluoretylamin (4) umgesetzt. Der so hergestellte sekundäre Markierungvorläufer (4) [2] wird mit N1-Boc-C1-p-Nitrophenol-Asparagin (5) zu N1-Boc-C1-[18F]Fluorethylamino-Asparagin mit einer RCA > 90 % innerhalb von 6 min umgesetz. Das Produkt (1) erhält man nach 8 min Behandelung mit TFA. Die Der Vergleich mit den analogen Werten für 2-[18F]FDG und O-(2-[18F]Fluorethyl)-L-Tyrosin ([18F]FET) ist in Abb. 4 dargestellt. Demnach zeigt das C1-[18F]FluorethylaminoAsparagin ([18F]FEAA) einen 3-10-fach höheren Uptake in die Tumorzellen als die anderen [18F]markierten Tumortracer. 60 kBq/100 mg protein boc H N 5 min 10 min 20 min 30 min 60 min blocked 80 70 H N O NH2 O 90 kBq / 100 mg proteine NH2 Aufreinigung wird wie folgt durchgeführt: Man verdünnt mit Wasser, gibt die Lösung erst über eine SCX-Kartusche. Anschließend wird das Produkt auf eine EN-Kartusche fixiert und mit Ethanol eluiert. Dieses Produktgemisch wird eingedampft und mittels HPLC aufgereinigt (Eluens: Wasser: Ethanol: 70:30). Nach der HPLC wird das Produkt nochmals eingeengt, damit kein Ethanol mehr in der Lösung die Zellversuche stört. Mit dem C1-[18F]Fluorethylamino-Asparagin wurden Zellversuche durchgeführt, wobei unterschiedliche Tumorzelltypen (3 Plattenepitele (PCI13; A549; RPMI 2650) und 2 Hautkrebszellstämme (Mel398; Mz7Mel) unterschiedlich lang mit dem C1-[18F]Fluorethylamino-Asparagin inkubiert wurden (Abb. 3). 50 40 [18F]FEAA [18F]FET 2-[18F]FDG 30 20 10 0 PCI 13 Mel 624/398 Abb. 4: Uptake-Vergleich einiger [18F]Tumortracer [1.] F. Mutschler, Artzneimittelwirkung, 7 Auflage, Wissenschftsverlag, 1994 [2.] M. Jelinski, K. Hamacher, H.H. Coenen; Nuklearmedizin 38, A22, (1999)