Nukleophile 18 F-Markierungen der Aminosäure Asparagin
Werbung

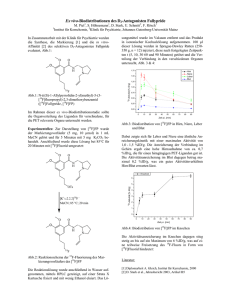
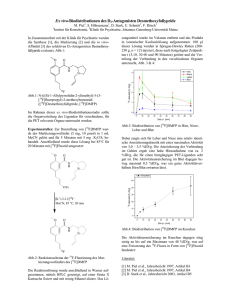
-31Nukleophile F-Markierungen der Aminosäure Asparagin B2 18 B. Wolf, R. Schirrmacher, M. Piel, W. Hamkens, F. Rösch Institut für Kernchemie, Johannes Gutenberg-Universität Mainz H H2N O H COOH H2 N H 1 N H O H NH 2 18 O H 18 F 80 60 RT 60 °C 80 °C 95 °C 40 20 0 0 2 4 6 8 t [min] Die Boc-Schutzgruppe ließ sich mittels F3CCOOH quantitativ abspalten. Anschließend wird der Ester mit NaOH in hohen Ausbeuten gespalten. Die Synthese des C1-Derivats erfolgte nach dem Schema durchgeführt in Abb.2. 10 mg N1-Boc-C1-NitrophenolesterAsparagin werden in 500 µl DMF gelöst, mit 17 µl Ethylamin und 4 MBq 2-[18F]Fluorethylamin-Lösung [2] versetzt. Die höchsten Ausbeuten ließen sich in DMF bei 80°C nach 6 min mit fast 100% erzielen. Die Boc-Schutzgruppe wird anschließend mit Trifluoressigsäure quantitativ abgespalten. boc O H N 18 H2N O O F boc NH 2 O O boc DCC H N H N O 80 O O boc NH2 O OH O F 100 O O 18 N H O N RCA [%] boc N O Abb.4: Synthese von C1-(2-[18F]Fluorethyl)-Asparagin OH O H N H N O NO2 Abb.1: Fluorierte Derivate des Asparagins Die Markierung des N2-Derivats wurde nach folgendem Schema durchgeführt (Abb. 2). 10 Abb.3: Ausbeuten von N1-Boc-N2-(2-[18F]Fluorethyl)Asparagin, bezogen auf 2-[18F]Fluorethylamin. H NH2 F 100 RCA [%] Die 2-[18F]FDG ist der am breitesten eingesetzte PET-TumorTracer. Da sie als Glykolyse-Marker für Tumor- wie auch für Normalzellen relevant ist, reichert sich 2-[18F]FDG zum einen nicht nur in Tumoren, sondern auch in entzündlichem Gewebe an. Die Diagnostik malignen Gewebes wird dadurch erschwert. Zum anderen ist die Diagnostik von Hirntumoren nicht trivial, da das Gehirn seinen Energiebedarf ausschließlich durch Glukose bestreitet und damit einen hohen Aktivitätsuntergrund liefert. Alternativ werden Tumor-Tracer gesucht, die auf anderen Stoffwechselparametern beruhen. Als Proliferationsmarker eignen sich dazu die verschiedene 18F- bzw. 11C-markierte Aminosäuren. Da die meisten gesunden Zellen proliferieren, sind die Anreicherungsunterschiede zwischen Tumor und Normalgewebe jedoch auch hier stets qualitativ. Eine wesentliche Ausnahme bildet das Gehirn. Um auch für periphere Tumore die Akkumulationsverhältnisse zu verbesser, sollten Asparaginderivate 18F-fluoriert werden. Asparagin ist für gesunde Zellen nichtessenziell, für gewisse Tumorarten aber essenziell [1]. Man kann in diesen Fällen erwarten, daß zugeführtes Asparagin sich primär in Tumoren anreichert und somit einen hohen Kontrast zwischen Tumor und gesundem Gewebe erzielt. Es wurden folgende zwei Derivate des Asparagins synthetisiert (Abb. 1). O NH 2 18 F 60 70 °C 80 °C 95 °C 105 °C 40 O 20 O NH 0 0 18 F 2 2 4 18 Abb.2: Synthese von N -(2-[ F]Fluorethyl)-Asparagin 1 1 In einem typischem Versuchsverlauf werden 15 mg N -BocC4-[N-Hydroxysuccinimidester]-C1-Benzylester-Asparaginsäure in 500 µl DMF gelöst, mit 17 µl Triethylamin und 4 18 MBq 2-[ F]Fluorethylamin-Lösung [2] versetzt. Es werden nach bestimmten Zeiten Aliquots entnommen, um die radiochemische Ausbeute (RCA, bezogen auf 2-[18F]Fluorethylamin) mittels Radio-Dünnschicht-Chromatographie zu bestimmen. Die besten Ausbeuten ließen sich in DMF bei 95°C nach 8 min mit 80% erzielen. 6 8 10 t [min] 1 18 Abb.5: Ausbeuten von N -Boc-C -(2-[ F]Fluorethylamino)Asparagin, bezogen auf 2-[18F]Fluorethylamin. [1] F.Mutschler, Arzneimittelwirkung, 7. Auflage, Wissenschaftliche Verlagsgesselschaft, 1994 [2] B. Wolf et al., 2-[18F]Fluorethylamin, ein möglicher sekundärer Markierungsvorläufer für die Markierung von Proteinen, dieser Jahresbericht, Beitrag B1
![Synthese von C1-[18F]Fluorethylamino](http://s1.studylibde.com/store/data/008995042_1-13a1cdcf97e38156d96d6114d7db55a0-300x300.png)








