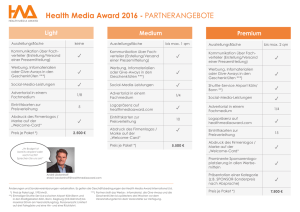
Teil 2: Integration von Genetik in Public Health
Werbung

Westerfeldstraße 35/37 33611 Bielefeld Fax 05221 8007-200 [email protected] www.loegd.nrw.de Genetik in Public Health • Teil 2: Integration von Genetik in Public Health Landesinstitut für den Öffentlichen Gesundheitsdienst des Landes Nordrhein-Westfalen Genetik in Public Health Teil 2: Integration von Genetik in Public Health Wissenschaftliche Reihe 24 www.loegd.nrw.de Genetik in Public Health lögd: Wissenschaftliche Te i l 2 : I n t e g r a t i o nReihe von Genetik in Public Health Genetik in Public Health Teil 2: Integration von Genetik in Public Health Hg. von Angela Brand, Peter Schröder, Alfons Bora, Peter Dabrock, Karl Kälble, Notburga Ott, Christa Wewetzer, Helmut Brand Landesinstitut für den Öffentlichen Gesundheitsdienst NRW, 2007 311u Impressum Herausgeber: Prof. Dr. Angela Brand MPH Deutsches Zentrum Public Health Genomics (DZPHG) Fachhochschule Bielefeld Kurt-Schumacher-Straße 6 33615 Bielefeld Dr. Peter Schröder Landesinstitut für den Öffentlichen Gesundheitsdienst NRW (lögd) Westerfeldstraße 35/37 33611 Bielefeld Prof. Dr. Alfons Bora Institut für Wissenschafts- und Technikforschung (IWT) Fakultät für Soziologie Universität Bielefeld Postfach 100131 33501 Bielefeld Prof. Dr. Peter Dabrock M.A. Juniorprofessur für Sozialethik (Bioethik) Fachbereich Evangelische Theologie Philipps-Universität Marburg Lahntor 3 35037 Marburg Dr. Karl Kälble Abteilung für Medizinische Soziologie Albert-Ludwigs-Universität Freiburg Hebelstraße 29 79104 Freiburg Prof. Dr. Notburga Ott Lehrstuhl Sozialpolitik und öffentliche Wirtschaft Fakultät für Sozialwissenschaft GCFW/04 Ruhr-Universität Bochum 44780 Bochum Dr. Christa Wewetzer Zentrum für Gesundheitsethik (ZfG) an der Evangelischen Akademie Loccum Knochenhauerstraße 33 30159 Hannover Dr. Helmut Brand MSc Landesinstitut für den Öffentlichen Gesundheitsdienst NRW (lögd) Westerfeldstraße 35/37 33611 Bielefeld Landesinstitut für den Öffentlichen Gesundheitsdienst des Landes Nordrhein-Westfalen (lögd) Leiter: Dr. Helmut Brand MSc Westerfeldstraße 35/37 D-33611 Bielefeld Tel.: Fax.: 0521 / 80 07-0 0521 / 80 07-2 00 Gestaltung, Satz, Druck und Verlag: lögd, Bielefeld, August 2007 lögd, Bielefeld, August 2007 Titelbild © U.S. Department of Energy Human Genome Program Redaktion: lögd Bielefeld Nachdruck und Vervielfältigung nur mit schriftlicher Genehmigung des Landesinstitutes. ISBN 978-3-88139-149-8 t312 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Inhalt TEIL 1: Grundlagen von Genetik und Public Health Geleitwort Ipke Wachsmuth.......................................................................9 Einleitung...........................................................................11 I. Genetik Henn, Wolfram: Die Bedeutung genetischer Mutationen und ihrer Diagnostik für Prävention und Therapie multifaktoriell bedingter Krankheiten – Aktueller Stand und Perspektiven für Public Health..................................................23 Schreiber, Stefan: Stand der Aufklärung genetischer Ursachen komplexer Erkrankungen und potentieller Einfluss genetischer Erkenntnisse auf Public Health Strategien........................................................ 109 Wewetzer, Christa: Der Beitrag der Genetik zu Public Health Aufgaben . ............... 141 II. Public Health Kälble, Karl: Public Health in Deutschland Entwicklung und Entwicklungsstand (mit einem Exkurs zu Public Health und Genetik)....................... 215 Kälble, Karl: Zum Begriff des Risiko. Die versicherungsmathematische, die soziologische und die (in Public Health und Genetik dominante) epidemiologische Sichtweise.................................................. 253 Neus, Hermann: Von der mathematischen Analyse zur Risikokommunikation. Die Risikodebatte im Bereich des umweltbezogenen Gesundheitsschutzes............................................................. 277 313u Teil 2: Integration von Genetik in Public Health III. Genetik in Public Health Bromen, Katja: Genetik-Umwelt-Interaktionen bei Krebserkrankungen am Beispiel des Lungenkrebses aus der Perspektive der Genetischen Epidemiologie unter besonderer Berücksichtigung der Anwendung dieser Erkenntnisse auf Public Health Genetik........................................................... 317 Lühmann, Dagmar; Bartel, Carmen; Raspe, Heiner: Ethische Aspekte und gesellschaftliche Wertvorstellungen in HTA-Berichten zu genetischen Testverfahren.......................... 349 Wewetzer, Christa; Brand, Angela: Public Health Genetics Eine Übersicht über die Entwicklung und aktuelle Aufgaben....... 417 Brand, Angela; Brand, Helmut: Risikoabschätzung, Risikomanagement und Risikokommunikation in Public Health Genomics............................... 471 IV. Ethik und Policy Norbert Paul: Genetik, Gesundheit und Gesellschaft: Anmerkungen zu Geschichte, Theorie und Ethik einer schwierigen Beziehung........................................................................... 493 Dabrock, Peter; Schröder, Peter: Ethik der Public Health Genetik.............................................. 515 Sass, Hans-Martin: Genetic Knowledge reduces Health Risk and Promotes Health Care Competence......................................... 561 t314 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Metraux, Peter: How to Get the Message Through?......................................... 579 Wandl, Ursula: Gentests: Besonderheiten in der Versicherungswirtschaft............ 591 V. Autoren/Herausgeberverzeichnis.............................. 601 315u t316 Genetik in Public Health III. Genetik in Public Te i l 2 : Health Integration von Genetik in Public Health Genetik-Umwelt-Interaktionen bei Krebserkrankungen am Beispiel des Lungenkrebses aus der Perspektive der Genetischen Epidemiologie unter besonderer Berücksichtigung der Anwendung dieser Erkenntnisse auf Public Health Genetik Gutachten erstellt für die ZiF-Kooperationsgruppe „Public Health Genetics“ 1 Katja Bromen 1 Die Erstellung dieses Gutachtens wurde ermöglicht durch den Stifterverband der deutschen Wissenschaft. 317u t318 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Inhalt III. Genetik in Public Health Genetik-Umwelt-Interaktionen bei Krebserkrankungen am Beispiel des Lungenkrebses aus der Perspektive der Genetischen Epidemiologie unter besonderer Berücksichtigung der Anwendung dieser Erkenntnisse auf Public Health Genetik. 1. Einführung.................................................................. 320 2. Die Genetische Epidemiologie und ihre Bedeutung bei der Untersuchung von Zivilisationskrankheiten........... 320 3. 3.1. 3.2. Grundlagen und Methoden der genetischen Epidemiologie............................................................ 322 Einteilung der Methoden.............................................. 323 Segregationsanalyse.................................................... 323 4. 4.1. 4.2. 4.3. 4.4. Beispiel Lungenkrebs .................................................. 326 Public Health Relevanz................................................ 326 Histologische Typen..................................................... 328 Risikofaktoren............................................................. 329 Prävention, Früherkennung und Diagnostik..................... 336 5. Public Health Genetik und Lungenkrebs – Ausblick und Empfehlungen.......................................... 339 Literatur.............................................................................. 341 319u Genetik-Umwelt-Interaktionen 1. Einführung Bösartige Neubildungen gehören zu denjenigen Erkrankungen, die als komplex bezeichnet werden. Dies bedeutet, dass die Krankheitsentwicklung nicht auf eine oder einige wenige Ursachen zurückgeführt werden kann, die in vorhersagbarer Weise eine Krankheit verursachen, sondern dass mehrere Faktoren in meist komplexer Form zusammenwirken müssen, um die Entstehung der Erkrankung auszulösen. Dabei ist derzeit in den meisten Fällen weder eine vollständige Liste aller verursachenden Faktoren noch eine Quantifizierung der Effektstärke der einzelnen Faktoren bekannt. Es gibt jedoch zahlreiche Hinweise, dass hier sowohl endogene als auch exogene Faktoren eine Rolle spielen und bei Präventionsansätzen in Betracht gezogen werden müssen. Speziell gibt es bei einer ganzen Reihe von Krebserkrankungen Hinweise darauf, dass den Genen in der Krankheitsgenese eine entscheidende Rolle zukommt. Hier sind beispielsweise Neoplasmen der Brust, Eierstöcke, Prostata, Cervix, Hoden, Darm, Magen und Haut zu nennen, jedoch ist diese Liste keineswegs vollständig. Eine weitere Krebserkrankung, deren Entstehung immer wieder mit Genen in Verbindung gebracht wird, ist das Lungenkarzinom. Dieses Krankheitsbild bildet den Mittelpunkt der vorliegenden Arbeit. In den folgenden Abschnitten wird zunächst eine Einführung in die Genetische Epidemiologie gegeben, welche die für die Untersuchung dieser Zusammenhänge relevante Methodik bereitstellt. Dabei wird insbesondere auf ihre Bedeutung bei der Untersuchung von Zivilisationskrankheiten eingegangen. Am Beispiel Lungenkrebs wird dann aufgezeigt, welche Bedeutung die Berücksichtigung von familiärer Vorbelastung, Genen und Gen-Umwelt-Interaktionen bei der Entwicklung dieses Phänotyps zukommt und wie sich dieses auf den Bereich Public Health Genetik auswirkt. In diesem Zusammenhang wird eine Übersicht der Epidemiologie des Lungenkarzinoms gegeben, seine Public Health Relevanz erläutert und der derzeitige Stand von Prävention, Früherkennung und Diagnostik präsentiert. Abschließend wird ein Ausblick zur derzeitigen Bedeutung der Public Health Genetik für die Erkrankung Lungenkrebs dargestellt. 2. Die Genetische Epidemiologie und ihre Bedeutung bei der Untersuchung von Zivilisationskrankheiten Unter dem Begriff der genetischen Epidemiologie verbergen sich mehrere Verfahren und Methoden, die ihre Wurzel im Wesentlichen in der Statistik, t320 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Mathematik, Genetik und Epidemiologie haben und durch ihren Einfluss aus weiteren, labortechnisch orientierten Bereichen, wie beispielsweise der Molekularbiologie, stark interdisziplinär geprägt sind. Die genetische Epidemiologie untersucht die Rolle genetischer Faktoren, deren Interaktion untereinander und mit Umweltfaktoren im Auftreten von Krankheiten in menschlichen Populationen. Dieses relativ junge Forschungsgebiet hat ihren Ursprung insbesondere in den Mendel’schen Vererbungsmodellen und der Populationsgenetik. Letztere verfolgt wiederum das Ziel, mathematische Eigenschaften von Genen in Populationen bzw. Faktoren, die die genetische Zusammensetzung einer Population bestimmen, zu untersuchen. Ihre Entwicklung ergab sich nicht zuletzt aus dem Humanen Genomprojekt (HUGO), das Ende der 80er Jahre begann und primär das Ziel der Sequenzierung des menschlichen Genoms verfolgte. Dabei galt es, alle Gene zu lokalisieren und zu identifizieren mit dem weiterreichenden Ziel, deren funktionelle Bedeutung und Zusammenhänge zu verstehen. Hierbei ist zu berücksichtigen, dass es sich bei den untersuchten Kollektiven üblicherweise um Populationen mit bestimmten Abhängigkeitsstrukturen, wie z.B. Familien handelt. Die zunehmende Verzahnung von Genetik und Epidemiologie wurde durch die rasanten Entwicklungen in der Molekularbiologie unterstützt. Dabei gilt es, suszeptible Individuen möglichst frühzeitig zu identifizieren und dadurch gezielt zu Primär- und Sekundärprävention beizutragen. Ein weiteres, langfristiges Ziel besteht darin, durch individuelle Therapien, die auf genetische und andere persönliche Attribute zugeschnitten sind, den Heilungserfolg zu verbessern. Anders als die molekulare Epidemiologie, die sich ganz allgemein mit erblichen und erworbenen Veränderungen auf molekularer Ebene befasst, hat die genetische Epidemiologie ihren Fokus auf hereditären, d.h. erblichen Mechanismen, wie z.B. Keimbahnmutationen und setzt neben Bevölkerungs- auch Familienstudien ein. Durch ihren häufig populationsbezogenen Ansatz erreicht die genetische Epidemiologie eine gewisse Bevölkerungsrepräsentativität. Sie liefert die methodische Basis zur Untersuchung des Gen-Merkmal-Zusammenhangs und bietet die Möglichkeit, Interaktionen zwischen Genen sowie zwischen Genen und Umwelteinflüssen zu untersuchen. Neben der funktionalen Analyse von Genen untersucht sie die Rolle von Genen in komplexen Funktionszusammenhängen, beispielsweise bei polygenetischen oder multifaktoriellen Erkrankungen. Die genetische Epidemiologie hat im bereits erwähnten Humanen Genomprojekt insbesondere durch das Verfahren der Kopplungsanalyse eine zentrale Rolle gespielt. Man kann festhalten, dass die 321u Genetik-Umwelt-Interaktionen genetische Epidemiologie einerseits der Wegbereiter für die Bioinformatik war, indem sie die Identifikation und Lokalisation von Genen unterstützt, andererseits ist es möglich, die mithilfe bioinformatischer Methoden gewonnenen Erkenntnisse im Rahmen (genetisch)-epidemiologischer Studien zu verifizieren bzw. weitergehend zu untersuchen. Aus den bisher dargestellten Punkten zeigt sich, dass die genetische Epidemiologie einerseits einen Fokus auf genetische Mechanismen hat. Andererseits berücksichtigt sie jedoch auch exogene Faktoren, wie z.B. Umwelteinflüsse, Lebensstilfaktoren und soziale Determinanten. Dies ist nicht nur möglich, sondern geradezu zwingend, insbesondere bei „Zivilisations“-Krankheiten mit bedeutsamer exogener Komponente. Die Rolle der genetischen Epidemiologie ist hierbei darin zu sehen, dass sie einen Beitrag zur Erklärung der komplexen Zusammenhänge leistet, insbesondere in den Bereichen, in denen die Erklärung durch bekannte Faktoren unzureichend ist. Zusammengefasst hat die genetische Epidemiologie die folgenden Aufgaben und Inhalte: n Untersuchung der Ätiologie und des Vererbungsmechanismus von Erkrankungen n Schätzung des erblichen Anteils einer Erkrankung im Vergleich zu exogenen Expositionen n Lokalisation und Identifikation relevanter Krankheitsgene n Untersuchung der Bedeutung einzelner Gene und deren Interaktion mit anderen Genen bzw. Umweltfaktoren 3. Grundlagen und Methoden der genetischen Epidemiologie Im Folgenden wird eine kurze Übersicht über die Verfahren gegeben, die in der genetischen Epidemiologie angewendet werden. Der interessierte Leser sei an die entsprechende Fachliteratur verwiesen. Einen Überblick über das Gebiet vermittelt beispielsweise Khoury et al. (Khoury et al. 1993) oder Elston et al. in enzyklopädischer Form (Elston et al. 2002). Die verschiedenen methodischen Ansätze, die in der genetischen Epidemiologie eingesetzt werden, können nach verschiedenen Kriterien in Klassen eingeteilt werden. Diese werden im Folgenden dargestellt: t322 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h 3.1. Einteilung der Methoden Populations- versus Familienstudien Erstere haben einen Bevölkerungsbezug und untersuchen meist unabhängige Individuen, die einer bestimmten, definierten Population entstammen. Dabei werden beispielsweise die Verteilung von, sowie Einflussfaktoren für genetische Merkmale und ihre Bedeutung für die Entwicklung von Erkrankungen untersucht. Familienstudien beziehen dagegen die Familienangehörigen bzw. relevante Informationen zu diesen ein und ermöglichen Stammbaumanalysen. Sie untersuchen außer dem Vorliegen genetischer Merkmale in Familien u.a. familiäre Erkrankungscluster sowie deren Ursache, erlauben Heritabilität sschätzungen und führen Tests zu genetischen Mechanismen durch. Beide Ansätze lassen sich sinnvoll kombinieren. Deskriptive versus analytische Verfahren Bei ersteren werden die Verteilung von Genen und Erkrankungen in Populationen (bzw. in Familien) untersucht, bei letzteren deren Zusammenhang untereinander bzw. zu Risikofaktoren. Weiterhin werden spezifische genetische Mechanismen in Familien analysiert. Epidemiologische versus genetisch-mathematische Ansätze Epidemiologische Methoden werden beispielsweise eingesetzt, um Erkrankungshäufigkeiten bei Verwandten von erkrankten Personen mit denen eines gesunden Kollektivs bzw. mit der Allgemeinbevölkerung zu vergleichen. Spezielle statistische bzw. genetisch-mathematische Verfahren werden dagegen verwendet, um Vererbungsmodelle zu detektieren oder Vererbungsmechanismen zu quantifizieren. Weiterhin unterscheidet man zwischen Methoden, die auf dem Vorliegen genetischen Materials basieren und solchen, die ohne dieses auskommen. Generell ist anzumerken, dass die Abgrenzung manchmal schwierig und unscharf ist und die Verfahren meist den Einsatz komplexer statistischer Methoden erfordern. Häufig werden zur Untersuchung eines genetischen Mechanismus mehrere Verfahren angewendet. 3.2.Segregationsanalyse Das statistische Verfahren der Segregationsanalyse (Segregation = Aufspaltung) wurde ursprünglich entwickelt, um zu überprüfen, ob das Vorliegen eines Phänotyps in Familien mit einem der Mendel‘schen Vererbungsmodelle, d.h. einem (autosomal oder X- bzw. Y-chromosomal) dominanten, rezessiven oder kodominanten Erbgang kompatibel ist. In der medizinischen Genetik hatte sie insbesondere das Ziel, innerhalb einer 323u Genetik-Umwelt-Interaktionen Familie bzw. einer Gruppe von Geschwistern den zu erwartenden Anteil erkrankter Geschwister und damit die Erkrankungswahrscheinlichkeit einzelner Personen zu schätzen und zu prüfen, ob dieser Anteil zu einem der Mendel‘schen Vererbungsformen passt (Khoury et al. 1993). Wenngleich das Verfahren im Laufe der Zeit um allgemeinere Vererbungsmodelle erweitert worden ist, blieben Grundgedanke und Ziel im Wesentlichen unverändert. Die Methode basiert auf der Anpassung verschiedener genetischer Modelle an vorliegende Daten und identifiziert unter den zur Wahl stehenden das am besten geeignete. Ebenso wie epidemiologische Methoden kann auch die Segregationsanalyse das Vorliegen eines Vererbungsweges nicht beweisen, sondern lediglich zu dessen wissenschaftlicher Evidenz beitragen. Das Vorliegen eines plausiblen biologischen Mechanismus, der die Kausalität des Zusammenhangs unterstützt, ist auch hier von großer Bedeutung. Weiterhin ist es wichtig, alle Modelle, die den Zusammenhang zwischen dem Auftreten des Phänotyps in den einzelnen Generationen potentiell beschreiben, in der Segregationsanalyse zu berücksichtigen und sich nicht nur auf die einfachen Mendel‘schen Vererbungsmodelle zu beschränken. Zu dem Verfahren der Segregationsanalyse erschienen bereits in den 50er Jahren, vor allem von Morton verschiedene Publikationen, jedoch wurde sie erst ab den siebziger Jahren durch ihre Weiterentwicklung zur komplexen Segregationsanalyse verstärkt angewendet. Als „komplex“ wurde die Methode ursprünglich deshalb bezeichnet, weil sie erlaubt, unterschiedliche Segregationsmuster, d.h. genotypische Paarungstypen und andere Einflussfaktoren, z.B. unvollständige Penetranz, variable Lebensfähigkeit, polygene Merkmale etc., innerhalb eines bestimmten elterlichen phänotypischen Paarungstyps zu berücksichtigen (Elandt-Johnson 1970). Mittlerweile wird der Begriff allgemein verwendet, wenn das Verfahren zur Charakterisierung von Genen eingesetzt wird, welche zum Teil im Zusammenspiel mit anderen Faktoren, wie z.B. den oben beschriebenen und Umweltfaktoren, eine phänotypische Variation verursachen. Dabei sind die Gene selbst im Allgemeinen nicht beobachtbar, d.h. man kennt ihre Ausprägung nicht. Gerade bei komplexen Erkrankungen ist davon auszugehen, dass mehrere Gene einen relativ kleinen Einfluss ausüben, deren gemeinsamer Effekt wiederum beträchtlich sein kann. Dabei ist anzunehmen, dass einige dieser Gene einen deutlichen Einfluss haben, der möglicherweise einem Mendel‘schen Vererbungsmuster entspricht. Auf die Identifikation und statistische Beschreibung solcher Gene konzentriert sich das Verfahren. t324 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Im Folgenden wird eine simplifizierte Übersicht über das Prinzip der Modellierung bei der Segregationsanalyse gegeben. Die Darstellung beschränkt sich dabei auf diejenigen Aspekte, die für Kernfamilien (Kernfamilie = Eltern und ihre Kinder) mit Rekrutierung bzw. Datenerhebung durch eines der Kinder relevant sind. Für Details hinsichtlich Methodik und Umsetzung anhand eines Beispiels sei auf (Bromen 2002) verwiesen. Das mathematische Modell, das der Segregationsanalyse zugrunde liegt, besteht im Wesentlichen aus den folgenden vier Komponenten (Elston 1981): n Gemeinsame Genotypverteilung der Paarungen (joint genotypic frequencies of mating pairs) n Zusammenhang zwischen Genotyp und Phänotyp (relationship between genotype and phenotype) Hier ist beispielsweise eine Modellierung des Phänotyps anhand von erkrankungsfreien Überlebenszeiten möglich. Auf das Beispiel Lungenkrebs Hier solche ist beispielsweise eine darüber Modellierung dessinnvoll, Phänotypsdaanhand bezogen, ist eine Modellierung hinaus diese von erkrankungsfreien Überlebenszeiten möglich. Auf das Beispiel bezogen, ist eine solche MoErkrankung üblicherweise erst im fortgeschrittenen AlterLungenkrebs auftritt. dellierung darüber hinaus sinnvoll, da diese Erkrankung üblicherweise erst im fortge- n Übertragungswahrscheinlichkeiten schrittenen Alter auftritt. der Genotypen von einer Generation auf die nächste (genetic transition probabilities) • Übertragungswahrscheinlichkeiten der Genotypen von einer Generation auf die nächste n Auswahlwahrscheinlichkeit der Familien (ascertainment probability) (genetic transition probabilities) Typisch ist die Situation, in der die Familien über einen Fall rekrutiert • Auswahlwahrscheinlichkeit der Familien (ascertainment probability) oder zumindest durch diesen erfasst werden. Man spricht dann von „single ascertainment“.Typisch Dabei ist ist die dieSituation, Wahrscheinlichkeit, dass eine in die in der die Familien überFamilie einen Fall rekrutiert oder zumindest Stichprobe gerät proportional zu der Zahl ihrer erkrankten Angehörigen. Aus durch diesen erfasst werden. Man spricht dann von "single ascertainment". Dabei ist die diesen Komponenten lässt sich nun des jeweiligen Wahrscheinlichkeit, dassunter eine Berücksichtigung Familie in die Stichprobe gerät proportional zu der Zahl ihVererbungsmodus für jede Familie eine sogenannte Likelihood L berechF rer erkrankten Angehörigen. Aus diesen Komponenten lässt sich nun unter Berücksichtinen (Elston 1981). gung des jeweiligen Vererbungsmodus für jede Familie eine sogenannte Likelihood LF berechnen (Elston 1981). Die Likelihood für einen Datensatz bestehend aus D unabhängigen Familien Ff (f = 1,...,D) sich für schließlich aus dem bestehend Produkt der Die ergibt Likelihood einen Datensatz aus einzelnen D unabhängigen Familien Ff Likelihoods:(f = 1,...,D) ergibt sich schließlich aus dem Produkt der einzelnen Likelihoods: D L Datensatz = ! L Ff f =1 Diese ist noch für den Auswahlmodus der Familien zu korrigieren. Diese Korrektur besteht Diese ist noch für den Auswahlmodus der Familien zu korrigieren. darin, die Likelihood LF jeder Familie unter der Bedingung zu berechnen, dass eine solche in Diese Korrektur besteht darin, die Likelihood LF jeder Familie unter der die Stichprobe gerät. An dieser Stelle kommt die vierte der oben beschriebenen KomponenBedingung zu berechnen, dass eine solche in die Stichprobe gerät. An dieser ten, die Auswahlwahrscheinlichkeit ! bei der Berechnung der Likelihood zum Tragen (im Stelle kommt die vierte der oben beschriebenen Komponenten, die Auswahlvorliegenden Fall ein „single ascertainment“). Insgesamt ergibt sich für den Gesamtdatensatz folgende, für den Selektionsmodus korrigierte Likelihood: 325u D LF L Datensatz | single ascertainment = ! LC f f =1 f Die Likelihood für einen Datensatz bestehend aus D unabhängigen Familien Ff (f = 1,...,D) ergibt sich schließlich aus dem Produkt der einzelnen Likelihoods: D L Datensatz = ! L Ff G e n e t i k - U m w e l t - I n tf =e1 r a k t i o n e n Diese ist noch für den Auswahlmodus der Familien zu korrigieren. Diese Korrektur besteht darin, die Likelihood LF jeder Familie unter der Bedingung zu berechnen, dass eine solche in die Stichprobe gerät. An dieser Stelle kommt die vierte der oben beschriebenen Komponen- wahrscheinlichkeit π bei der Berechnung Likelihood Tragenzum (imTragen (im ten, die Auswahlwahrscheinlichkeit ! bei der der Berechnung derzum Likelihood vorliegenden Fall ein „single ascertainment“). vorliegenden Fall ein „single ascertainment“). Insgesamt ergibt fürGesamtdatensatz den Gesamtdatensatz für den korrigierInsgesamt ergibt sich sich für den folgende, fürfolgende, den Selektionsmodus Selektionsmodus korrigierte Likelihood: te Likelihood: D LF L Datensatz | single ascertainment = ! LC f f =1 f Nachdem die Likelihood der Familien wie beschrieben spezifiziert worden ist, werden im Nachdem die Likelihood der Familien wie beschrieben spezifiziert worden nächsten Schritt die nicht festgelegten Parameter geschätzt. Schließlich ist, wie bereits erist, werden im nächsten Schritt die nicht festgelegten Parameter geschätzt. wähnt, das Ziel der Segregationsanalyse, aus den verschiedenen Vererbungsmodellen dasSchließlich ist, wie bereits erwähnt, das Ziel der Segregationsanalyse, aus jenige auszuwählen,Vererbungsmodellen welches der Datensituation besten entspricht. erfolgt den verschiedenen dasjenige am auszuwählen, welches Dieses der schließlich anhand Modellvergleichs. Datensituation ameines besten entspricht. Dieses erfolgt schließlich anhand eines Modellvergleichs. Im Folgenden soll nun anhand des Beispiels Lungenkrebs aufgezeigt werden, wie Erkenntnisse, die sich anhand genetisch epidemiologischer 8 Verfahren gewinnen lassen, in Strategien der Public Health Genetik umgewandelt werden können. F w 4. Beispiel Lungenkrebs 4.1.Public Health Relevanz Wenn man die Public Health Relevanz einzelner Krebserkrankungen bewertet, so kommt dem Lungenkrebs eine besondere Bedeutung zu. Zum einen ist die Inzidenz dieser Erkrankung vergleichsweise hoch, in Deutschland erkranken jährlich über 42000 Menschen (31800 Männer, 10400 Frauen) an dieser Erkrankung (AG Bevölkerungsbezogener Krebsregister in Deutschland 2004), zum anderen ist ihre Prognose nach wie vor sehr ungünstig und konnte im Laufe der Zeit kaum verbessert werden (Nackaerts et al. 2002b). Auch führten Präventions- und Früherkennungsmaßnahmen bislang nicht zu einer deutlichen Reduktion von Inzidenz und Mortalität. So beträgt nach aktuellen Angaben die relative 5-Jahres-Überlebensrate etwa 13% bei den Männern und 14% bei den Frauen (AG Bevölkerungsbezogener Krebsregister in Deutschland 2004). Dieses erklärt die hohe Mortalität der Erkrankung. In Deutschland versterben jährlich knapp 40.000 Personen an Lungenkrebs, bei den Männern lag er im Jahr 2002 auf Platz drei, bei den Frauen auf Platz sieben der Todesursachen. Der Lungenkrebs ist damit jedoch nicht nur hierzulande die bedeutsamste Krebserkrankung. Weltweit gehen insgesamt über eine Million Todesfälle auf diese Erkrankung zurück, allein etwa 1.2 A D ru D kr m t326 vö in 19 w Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Millionen (12.3% aller Neuerkrankungen mit Krebs) Neuerkrankungen und 1.1 Millionen Todesfälle (810000 Männer, 293000 Frauen) im Jahr 2000 (Parkin et al. 2001). Dieses entspricht einer Zunahme von fast 20% zwischen 1990 und 2000. Bei der Verwendung altersstandardisierter Raten, die Veränderungen in der Bevölkerungsgröße und der Altersstruktur berücksichtigen, stellt man fest, dass diese Veränderungen hauptsächlich auf den Anstieg der Lungenkrebsmortalität in den Entwicklungsländern und bei Frauen zurückzuführen sind. Hier ist der wachsende Trend ungebrochen wohingegen bei den Männern in den westlichen Industrienationen der jahrzehntelange Anstieg der Inzidenz und damit auch der Mortalität seit einigen Jahren abflacht bzw. sogar rückläufig ist. Die bislang bei Frauen relativ moderaten Mortalitätsraten sind in den letzten Jahren drastisch angestiegen. In Deutschland stieg die altersstandardisierte Mortalitätsrate seit den frühen 50er Jahren kontinuierlich an und erreichte bei den Männern Ende der 70er Jahre ihr Maximum. Seither ist ein leichter Abfall zu verzeichnen (Abbildung 1) (AG Bevölkerungsbezogener Krebsregister in Deutschland 2002; AG Bevölkerungsbezogener Krebsregister in Deutschland 2004; Casper et al. 1995). Im Gegensatz dazu hat sich die Inzidenz und entsprechend die Mortalität bei den Frauen seit den frühen 70er Jahren aufgrund Frauen seit den frühen 70er Jahrenimaufgrund von Änderungen im Rauchverhalten, von Änderungen Rauchverhalten, dem wichtigsten Risikofaktordem für diese wichtigsten Risikofaktor für diese Erkrankung, verdoppelt (Abbildung 1). Erkrankung, verdoppelt (Abbildung 1). pro 100.000 120 100 Männer (alte Länder) Männer (neue Länder) 80 Frauen (alte Länder) Frauen (neue Länder) Männer (Deutschland) 60 40 Frauen (Deutschland) 20 0 1960 1965 1970 1975 1980 1985 1990 1995 2000 Standardbevölkerung: Bundesrepublik 1989 (alte und neue Länder), für gesamtdeutsche Mortalität ab 1990: Europabevölkerung Abb. 1: Altersstandardisierte Mortalitätsrate des Lungenkrebses bei Männern und Frauen, Deutschland (AG Bevölkerungsbezogener Krebsregister in Deutschland 2002; AG Bevölkerungsbezogener Krebsregister in Deutschland 2004; Casper et al. 1995) Abb. 1: Altersstandardisierte Mortalitätsrate des Lungenkrebses bei Männern und Frauen, Das lebenslange Risiko eines 1940 geborenen 2002; Menschen, bis zum Deutschland (AG Bevölkerungsbezogener Krebsregister in Deutschland AG Bevölkerungsbezogener Krebsregister in Deutschland 2004; Casper et al. 1995) 75. Lebensjahr Lungenkrebs zu entwickeln, beträgt bei den Männern etwa 8% und bei den Frauen etwa 1%. Das mittlere Erkrankungsalter beträgt bei Das lebenslange Risiko einesund 1940 geborenen Menschen, zum(AG 75. Lebensjahr LungenMännern Frauen etwa 67 bzw. 68bis Jahre Bevölkerungsbezogener krebs zu entwickeln, beträgt bei den Männern etwa 8% und bei den Frauen etwa 1%. Das mittlere Erkrankungsalter beträgt bei Männern und Frauen etwa 67 bzw. 68 Jahre (AG Bevölkerungsbezogener Krebsregister in Deutschland 2004). Dies ist vergleichbar zu Krebs insgesamt und ist während der letzten 30-40 Jahre geringfügig angestiegen (Schön et al. 1999). Jeder an Lungenkrebs erkrankte Patient verliert etwa 12-13 Jahre seiner Lebenserwartung. Damit ist die Gesamtzahl der verlorenen Lebensjahre in Deutschland mit 541.300 327u Genetik-Umwelt-Interaktionen Krebsregister in Deutschland 2004). Dies ist vergleichbar zu Krebs insgesamt und ist während der letzten 30-40 Jahre geringfügig angestiegen (Schön et al. 1999). Jeder an Lungenkrebs erkrankte Patient verliert etwa 12-13 Jahre seiner Lebenserwartung. Damit ist die Gesamtzahl der verlorenen Lebensjahre in Deutschland mit 541.300 Jahren insgesamt (394.000 bei Männern) größer als für jede andere Lokalisation (AG Bevölkerungsbezogener Krebsregister in Deutschland 2002). Diagnosestadium und Erkrankungsalter sind bedeutsame Prädiktoren der Überlebenszeit und, wie erwartet, wird die Prognose mit steigendem Erkrankungsalter schlechter. Diese Veränderung in der Überlebenswahrscheinlichkeit wird besonders deutlich, wenn man die Überlebensraten derjenigen unter und über 70 Jahren vergleicht (Schön et al. 1999). Die Ausführungen dieses Kapitels verdeutlichen bereits das Ausmaß der Bedeutung der Erkrankung Lungenkrebs sowohl für die Patienten und ihr persönliches Umfeld als auch für die Gesellschaft und das Gesundheitssystem. Sie führen zu der Frage, mit welchen möglicherweise neuen Strategien und Erkenntnissen sich eine nachhaltige Reduktion der Krankheitslast erzielen lässt. 4.2.Histologische Typen Nahezu alle Bronchialkarzinome entwickeln sich aus dem Epithelgewebe. Dabei bilden die Plattenepithel-, Adeno- und kleinzellige Karzinome mit etwa 80% aller histologischen Typen die häufigsten Formen (Jöckel et al. 1995). Weiterhin gibt es großzellige Karzinome, andere Gewebetypen und Kombinationstumore. Geschlechtsspezifisch existieren deutliche Unterschiede in der histologischen Verteilung. Während das Plattenepithelkarzinom die häufigste Form bei den Männern darstellt, ist es bei den Frauen das Adenokarzinom. Dieser Unterschied ist jedoch nicht direkt auf das Geschlecht sondern eher auf unterschiedliche Risikoprofile, insbesondere hinsichtlich des Rauchens zurückzuführen. Das Adenokarzinom ist der häufigste Typ bei Nichtrauchern – in einer großen europäischen Multizenterstudie betrug der Anteil von Adenokarzinomen bei männlichen und weiblichen nichtrauchenden Lungenkrebspatienten jeweils 50% (Boffetta et al. 1998) Weltweit wird ein Zuwachs des Anteils der Adenokarzinome berichtet. Dabei ist noch unklar, ob es sich um einen tatsächlichen Anstieg handelt oder ob veränderte diagnostische Maßnahmen für diesen verantwortlich sind. Obwohl die Überlebenszeit nach Zelltypen insgesamt nur wenig variiert, haben Patienten mit nichtkleinzelligen Lungenkarzinomen einen prognostischen Vorteil (Blot et al. 1996). t328 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h 4.3.Risikofaktoren Rauchen Das Tabakrauchen ist der bedeutsamste Risikofaktor für den Lungenkrebs. Anhand von Risikoschätzungen der Mortalität für gegenwärtige und ehemalige Raucher aus dem Report des amerikanischen Surgeon General sowie deutschen Daten zu Rauchverhalten und Lungenkrebsmortalität, wurden krude Schätzer des Attributivrisikos und der rauchassoziierten Lungenkrebsmortalität für Deutsche ab 14 Jahren für das Jahr 1998 berechnet. Es ergaben sich Attributivrisiken von 90.5% bei den Männern und 74.6% bei den Frauen. Dies entspricht einer Anzahl von 32.847 Lungenkrebsfällen, die dem Rauchen zuzuschreiben sind (25.923 Männer, 6.924 Frauen) (Sachverständigenrat (SVR) für die Konzertierte Aktion im Gesundheitswesen 2002). Der Zusammenhang zwischen Rauchen und Lungenkrebs wurde bereits von Soemmering am Ende des 19. Jahrhunderts erwähnt (Rigdon et al. 1958) und in den folgenden Jahrzehnten wiederholt in Tierexperimenten, Fallberichten und Beobachtungsstudien bestätigt. Eine der frühesten Fall-Kontrollstudien wurde in diesem Zusammenhang von Müller in den späten 30er Jahren durchgeführt (Müller 1939). Daran schlossen sich einige Kohortenstudien an, die in den USA und Großbritannien in den 50er und 60er Jahren durchgeführt wurden und hauptsächlich das Zigarettenrauchen untersuchten. Eine Dosis-Wirkungsbeziehung der kumulativen Rauchdosis ist wissenschaftlich gut abgesichert (Blot et al. 1996). Aber auch Intensität und Rauchdauer haben einen starken Effekt. Weiterhin weisen Studienergebnisse darauf hin, dass ein früher Rauchbeginn (Jöckel et al. 1992), das Rauchen von Zigaretten ohne Filter oder solchen mit einem hohem Teergehalt (Blot et al. 1996) zu einer Risikoerhöhung beitragen. Darüber hinaus haben die Tabaksorte (Blot et al. 1996; Simonato et al. 2001) sowie das Rauchen von Zigarren und Pfeifen (siehe z.B. Boffetta et al. 1999) einen verstärkenden Effekt. Das Rauchen stellt bei allen histologischen Typen einen Risikofaktor dar, jedoch ist die Assoziation und der dosisabhängige Gradient bei Adenokarzinomen geringer als bei Plattenepithel- und kleinzelligen Karzinomen (Jöckel et al. 1995). Bei verschiedenen histologischen Typen wurde die klinische Beobachtung gemacht, dass Lungenkrebspatienten bereits vor Diagnosestellung aufgehört hatten zu rauchen (Pohlabeln et al. 1997). Es wird nach wie vor diskutiert, ob das rauchassoziierte Lungenkrebsrisiko bei Frauen stärker ist als bei Männern. Epidemiologische Evidenz aus großen Untersuchungen existiert für beide Richtungen, selbst nach Berücksichtigung 329u Genetik-Umwelt-Interaktionen der Expositionsdosis. Während beispielsweise verschiedene nordamerikanische Studien einen solchen Effekt entdeckt haben (Risch et al. 1993; Zang et al. 1996), wurde dieses in zwei großen europäischen Studien nicht gefunden (Agudo et al. 2000; Kreuzer et al. 2000a; Prescott et al. 1998; Simonato et al. 2001). Mögliche Erklärungen für einen solchen Risikoanstieg sind z.B. Östrogene, Körpergröße, Body-Mass-Index (Kabat et al. 1992), sowie eine höhere GRP (gastrin releasing peptide)-Expression (Shriver et al. 2000). Jedoch könnte diese scheinbar größere Suszeptibilität der Frauen auch ein Artefakt sein, da Männer aufgrund einer stärkeren beruflichen Exposition zu relevanten Lungenkrebskarzinogenen (siehe Kapitel 4.3.3) ein höheres Basisrisiko für den Lungenkrebs haben. Des Weiteren haben Frauen traditionell eine höhere Wahrscheinlichkeit, einen rauchenden Partner zu haben als Männer, insbesondere wenn sie selber rauchen. Aufgrund dieser zusätzlichen Passivrauchexposition haben sie eine höhere Tabakbelastung als durch das aktive Rauchen per se. Ein Rauchstopp, insbesondere im frühen Alter, verbessert den Gesundheitszustand allgemein (Samet 1992) und reduziert vor allem das Lungenkrebsrisiko im Vergleich zur Rauchfortsetzung (Peto et al. 2000). Das Risiko sinkt mit zunehmender Zeit seit Rauchbeendigung und approximiert das Risiko eines Nichtrauchers nach etwa 20 Jahren. Allerdings hängt diese Zeitspanne und das Ausmaß der Risikoreduktion auch von Menge und Dauer der vorhergehenden Exposition ab. Da sich ein Rauchstopp jedoch jederzeit vorteilhaft auf den Gesundheitszustand auswirkt, sollte grundsätzlich jeder Raucher ermutigt werden, mit dem Rauchen aufzuhören (Jöckel et al. 2002a). Passivrauchen Passivrauchen (ETS – Environmental Tobacco Smoke) ist die Exposition zu Tabakverbrennungsprodukten, die durch das Rauchen anderer Menschen erzeugt werden. Seine Public Health Relevanz wurde zuerst in epidemiologischen Studien entdeckt, die das erhöhte Lungenkrebsrisiko nichtrauchender Ehefrauen von Rauchern zeigten (Hirayama 2000; Trichopoulos et al. 1981). Seitdem haben viele Studien diesen Zusammenhang untersucht (für einen Überblick siehe z.B. Jöckel 2000). Toxikologisch ist der Effekt von ETS aus verschiedenen Gründen plausibel. Erstens ist die Konzentration effektiver Karzinogene im Nebenstromrauch des Passivrauchens im Vergleich zum Hauptstromrauch des Aktivrauchens höher. Zweitens unterstützen die Ergebnisse von Tierexperimenten diesen kausalen Zusammenhang. Viele epidemiologische Studien zum Passivrauchen konzentrieren sich allerdings auf das Lungenkrebsrisiko von Nichtrauchern (z.B. Kreuzer et t330 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h al. 2000b), insbesondere auf nichtrauchende Partnerinnen von Rauchern und wurden von der Tabakindustrie und kooperierenden Wissenschaftlern scharf kritisiert. Die angeführten Argumente konzentrierten sich vor allem auf methodische Aspekte, wie z.B. die Beobachtung, dass Raucher häufiger Partner von Rauchern sind. Im Falle einer Missklassifikation eines Rauchers als Nichtraucher würde dieses zu einer artifiziellen Risikoerhöhung führen. Trotz dieser Kritikpunkte kommen nationale und internationale Studien (Boffetta et al. 1998), Reviews, Metaanalysen und Aussagen von Regierungsagenturen wie z.B. der amerikanischen EPA zu der Schlussfolgerung, dass auch nach Berücksichtigung dieser methodischen Schwächen der lungenkarzinogene Effekt des Passivrauchens existiert. Entsprechend wurde es von der Senatskommission zur Prüfung gesundheitsschädlicher Arbeitsstoffe der DFG als menschliches Karzinogen eingestuft (Greim 1998). Beruf Bereits in den frühen 80er Jahren hatten Doll and Peto geschätzt, dass etwa 15% der männlichen und 5% der weiblichen Lungenkrebsfälle auf berufliche Exposition zurückzuführen sind (Doll et al. 1981). Die Ergebnisse späterer deutscher Studien deuten an, dass die Situation hierzulande vergleichbar ist (Jöckel et al. 1997). Die gemeinsame Auswertung zweier großer deutscher Fall-Kontroll-Studien als sogenannte Pooling-Studie (BrüskeHohlfeld et al. 2000; Jöckel et al. 1998b) zeigte, dass die Beschäftigung in verschiedenen Berufen und Industriezweigen mit sehr unterschiedlichen Lungenkrebsrisiken assoziiert ist. Bei den Berufstätigkeiten zeigte sich z.B., dass eine Beschäftigung in typischen Bluecollar-Berufen (z.B. Arbeiter) mit einem relevanten Anstieg des Lungenkrebsrisikos einhergeht, während bei Whitecollar-Berufen (z.B. Büroangestellte) das Gegenteil vorliegt. Diese Ergebnisse zeigten sich auch nach Adjustierung für Rauchen und Asbestexposition und ergaben sich ebenfalls für die nichtrauchenden Teilnehmer der bereits zuvor erwähnten IARC-Studie (Pohlabeln et al. 2000a). Asbest ist trotz des Verbots seiner Produktion und Verwendung in den 80er Jahren, als seine gesundheitsschädliche Wirkung erkannt wurde, nach wie vor das bedeutendste berufliche Karzinogen. Weitere anerkannte Lungenkarzinogene sind die polyzyklischen aromatischen Kohlenwasserstoffe (PAK), Radionuklide, Dichlordimethyl- und Monochlordimethylether, Arsen-, Nickel- und Chrom-(VI)-Verbindungen sowie ionisierende Strahlung. Belege für den lungenkarzinogenen Effekt dieser Strahlung stammen sowohl von medizinischen Anwendungen als auch von Überlebenden der Atombombenangriffe auf Japan (Blot et al. 1996). Es gibt eine Reihe weiterer Substanzen, die mit wachsender wissenschaftlicher Evidenz mit Lungenkrebs assoziiert werden. Zu erwähnen 331u Genetik-Umwelt-Interaktionen sind hier insbesondere Dieselmotoremissionen, kristallines Silizium, künstliche Mineralfasern (Brüske-Hohlfeld et al. 2000; IARC 1997; Jöckel et al. 1998b), künstliche Glasfasern (Pohlabeln et al. 2000b) sowie Cadmium (Wolf 1998) und Schweissrauche (Jöckel et al. 1998a). Radon Radon ist ein Edelgas, das sich aus Radium während des natürlichen Zerfalls von Uran entwickelt. Ein erhöhtes Lungenkrebsrisiko wurde bei Uranbergarbeitern mit einer hohen Exposition zu Radon und Radonspaltprodukten beobachtet (Darby et al. 2001a; Hornung 2001; Lubin et al. 1997; Samet et al. 2000). Deshalb ist eine Risikoerhöhung aufgrund von Innenraumexposition zu Radon wahrscheinlich (Darby et al. 2001a). Basierend auf Expositionsmessungen in Haushalten wurde anhand von Risikoextrapolationen geschätzt, dass etwa 7% der Lungenkrebsfälle in der ehemaligen Bundesrepublik Deutschland durch Umweltradon verursacht werden (Steindorf et al. 1995). Es bleibt umstritten, ob diese Übertragung in den Niedrigdosisbereich zulässig ist, zumal die Beweislage aus epidemiologischen Studien zu Radon in Haushalten uneinheitlich ist. Eine Studie, die in einer westdeutschen Region mit erhöhten Radonkonzentrationen durchgeführt wurde, zeigte eine grenzwertig relevante Risikoerhöhung (Kreienbrock et al. 2001) und entspricht damit dem Ergebnis einer Metaanalyse (Lubin et al. 1997). Luftverschmutzung Es wird vermutet, dass allgemeine Luftverschmutzung das Lungenkrebsrisiko erhöht, da zum einen in Ballungsräumen eine deutlich erhöhte Lungenkrebsmortalität beobachtet wurde und außerdem gesicherte oder vermutete Karzinogene, aus industriellen Prozessen, Heizölverbrennung und Verkehr (insbesondere Dieselmotoren), in der Atemluft vorliegen. Jedoch konnten individuelle Risikofaktoren wie Rauchverhalten und berufliche Exposition in den zur Hypothesenüberprüfung durchgeführten ökologischen Studien nicht angemessen berücksichtigt werden. Nach dem derzeitigen Kenntnisstand liegt das relative Risiko deutlich unter 1.5. Es sollten nicht mehr als 5-10% der Lungenkrebsfälle in hochbelasteten Gegenden und etwa 2% in Gesamtdeutschland der Luftverschmutzung zuzuschreiben sein (Pesch et al. 1995). Jedoch wurde in einer neueren großen Studie ein Zusammenhang zwischen Langzeitexposition zu Luftverschmutzung durch feine Partikel (Schwebstaub) und einer erhöhten Lungenkrebsmortalität gefunden (Pope, III et al. 2002). Als relevante Quelle von Innenraumluft verschmutzung werden schließlich Kochdämpfe diskutiert. Studien hierzu wurden vor allem in Asien, beispielsweise bei nichtrauchenden chinesischen Frauen durchgeführt (Seow et al. 2000). t332 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Ernährung Häufiger Konsum von frischem Obst und Gemüse wurde in vielen epidemiologischen Studien mit einer Risikoreduktion von Lungenkrebs in Verbindung gebracht (Brennan et al. 2000; Darby et al. 2001b). Weiterhin gibt es konsistente Hinweise, dass diese Protektion auch für andere Krebserkrankungen besteht. Aufgrund biochemischer Daten erscheint es plausibel, dass u.a. das Betakarotin für diese Risikoreduktion verantwortlich ist. Jedoch ist dieses möglicherweise ein Marker für gesunde Ernährung, d.h. der Einnahme einer gesundheitsförderlichen Mischung von Nährstoffen (Micronutrients) (Epstein 2003). Als weiterer, potentiell lungenkrebspräventiver Nährstoff gilt das Vitamin E. Jedoch waren bisherige Bemühungen, das Betakarotin oder Vitamin E zur Chemoprävention einzusetzen, erfolglos (Omenn et al. 1996; The Alpha-Tocopherol Beta Carotene Cancer Prevention Study Group 1994). Vitamin C und Selen gelten ebenfalls als protektiv, wohingegen eine cholesterin- und fettreiche Diät mit einer Risikoerhöhung einher zu gehen scheint (Blot et al. 1996). Weitere nichtgenetische Risikofaktoren Es wurde häufig beobachtet, dass Patienten mit Asbestose und Silikose ein erhöhtes Lungenkrebsrisiko haben und diese Assoziation ist nicht zuletzt aufgrund der zuvor beschriebenen Situation plausibel. Dagegen ist die Rolle anderer Lungenerkrankungen, wie z.B. der Tuberkulose, weniger klar. Die vorliegende Evidenz zu der Rolle von Vogelhaltung ist inkonsistent (Jöckel et al. 2002b). Als weitere potentielle Risikofaktoren gelten psychosoziale Faktoren (Jahn et al. 1995), das Immunsystem sowie Hormone (Blot et al. 1996). Letzteres könnte zum Teil die möglicherweise erhöhte Suszeptibilität von Frauen für den Lungenkrebs erklären. Hierfür könnte eine Interaktion von Rauchstatus, genetischen und hormonellen Faktoren eine Rolle spielen (Gasperino et al. 2004). Genetische Faktoren Obwohl bis zu 90% der Lungenkrebsfälle dem Zigarettenrauchen zugeschrieben werden, entwickeln kaum mehr als 10% der Raucher diese Erkrankung. Zudem ist ein beträchtlicher Anteil von Lungenkrebspatienten Nichtraucher. Deshalb wird davon ausgegangen, dass Suszeptibilitätsgene das individuelle Erkrankungsrisiko mitbestimmen, eine Sichtweise, die von unterschiedlichen Studientypen unterstützt wird. Zum einen haben molekularepidemiologische Studien gezeigt, dass bestimmte Genpolymorphismen in Lungenkrebspatienten häufiger vorliegen. In der Vergangenheit haben sich diese Studien primär auf Gene konzentriert, die in den beiden Phasen des Metabolismus von Umweltkarzinogenen involviert sind, wie z.B. das Zytochrom P450-System, GSTM1 und NAT2. Neuere Studien haben darü- 333u Genetik-Umwelt-Interaktionen ber hinaus Gene untersucht, die, wie das Dopaminrezeptorgen DRD2, möglicherweise zur Nikotinsucht beitragen und dadurch indirekt am Lungenkrebs beteiligt sind. Weiterhin haben klassische epidemiologische Studien mit Angehörigeninformation eine stärkere Aggregation des Lungenkrebses in Familien von Lungenkrebspatienten gezeigt, insbesondere für diejenigen Patienten, bei denen die Erkrankung verhältnismäßig früh aufgetreten ist. Eine Fall-Kontroll Studie, die u.a. das Vorliegen einer genetischen / familiären Komponente untersuchte, bestätigte die zum Teil schon in vorhergehenden Untersuchungen gefundenen Ergebnisse: Das Lungenkrebsrisiko in Familien von Lungenkrebspatienten war im Vergleich zu Familien von Personen ohne Lungenkrebs um etwa 70% erhöht. Dieses Risiko was besonders hoch in Familien von Patienten, die frühzeitig erkrankten. Ein erhöhtes familiäres Risiko zeigt sich lediglich beim Lungenkrebs, nicht jedoch bei anderen rauchbezogenen oder sonstigen Krebsarten. Das familiäre Lungenkrebsrisiko blieb auch nach Adjustierung für verschiedene andere Risikofaktoren erhöht, inklusive der individuellen Rauchmenge sowie des Rauchstatus’ der Eltern. Dieser Befund spricht gegen die Vermutung, dass die Korrelation des Rauchverhaltens innerhalb von Familien allein für die familiäre Aggregation verantwortlich ist. Es lag außerdem eine DosisWirkungsbeziehung vor, d.h. Lungenkrebspatienten hatten eine höhere Wahrscheinlichkeit, mehrere an Lungenkrebs erkrankte Angehörige zu haben (Bromen et al. 2000). Der Anteil einer familiären Vorbelastung am Lungenkrebsrisiko wurde in dieser Studie insgesamt auf 3%, in der jungen Population allerdings auf knapp 10% geschätzt. Diese Ergebnisse deuten an, dass Unterschiede im Rauchverhalten zwischen den Familien der Fälle und der Kontrollen die Unterschiede im familiären Lungenkrebsrisiko zwischen diesen Gruppen nicht alleine erklären. Auch zeigte sich innerhalb der Fall- bzw. Kontrollpopulationen kein grundlegender Unterschied im Rauchverhalten zwischen denjenigen mit und ohne familiären Lungenkrebs. Dieses könnte ein Hinweis darauf sein, dass es suszeptible Subpopulationen insbesondere, aber nicht ausschließlich, innerhalb der Fallpopulation gibt, die für Expositionen zu den etablierten Risikofaktoren besonders gefährdet sind. Eine solche, bereits zuvor erwähnte Suszeptibilität sollte deshalb nicht losgelöst vom Rauchverhalten betrachtet werden. Einige Ergebnisse der angesprochenen Arbeit legen das Vorliegen einer Gen-Umwelt (d.h. Rauch)-Interaktion nah. Zum einen hatten Rauchgewohnheiten einen besonders schwerwiegenden Effekt bei den Eltern der Lungenkrebspatienten und dieser zeigte sich spezifisch in dem elterlichen Lungenkrebsrisiko, nicht jedoch in anderen rauchassoziierten Krebserkrankungen. Zum anderen war ein gemeinsamer Effekt von Rauchen und familiärer Vorbelastung auch bei den Studienteilnehmern selbst erkenn- t334 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h bar. Die Risikoschätzer für das Rauchen waren bei denjenigen Teilnehmern mit familiärer Vorbelastung besonders hoch. Für eine detaillierte Darstellung der Ergebnisse siehe (Bromen et al. 2000; Bromen 2002). Schließlich haben Segregationsanalysen eine gewisse Kompatibilität der Vererbungsmuster mit Mendel’schen Modellen gezeigt. Dieses Verfahren erlaubt auch eine Berücksichtigung nicht-genetischer Faktoren. So wurden bei (Bromen 2002) als Kovariaten außer dem –nicht gemessenen – Status eines einzelnen Gens auch Alter, Geschlecht, Rauchstatus sowie eine Interaktion zwischen dem Rauchstatus und dem Genstatus untersucht. Diese Analyse ergab, dass ein Mendel’sches Vererbungsmodell mit exogenen Faktoren sich am besten an die Daten anpassen ließ und weiterhin, dass die Berücksichtigung einer Gen-Rauch Interaktion diese Modellanpassung deutlich verbessern konnte. Es zeigte sich insgesamt, dass rauchende Träger eines seltenen Allels (Populationshäufigkeit des krankheitsassoziierten Allels=0.12%) im Verhältnis zu nichtrauchenden Personen, die das Allel nicht tragen, ein extrem hohes Lungenkrebsrisiko tragen. Andererseits lässt das Ergebnis dieses Ansatzes keine eindeutigen Schlussfolgerungen über den genauen Vererbungsmechanismus zu. Ein Grund dafür ist der Mangel an Information zu den Kovariaten der Geschwistern der Studienteilnehmer. Weiterhin konnte nur wenig Vorwissen über die Modellparameter, wie z.B. die Allelfrequenz und über die Zahl der eventuell beteiligten Genorte in die Analyse eingebracht werden, insbesondere da zum Lungenkrebs bislang nur wenige Segregationsanalysen durchgeführt worden sind. Zudem ist anzunehmen, dass, wie bei anderen Krebsarten, mehr als ein Gen, möglicherweise mit niedriger Penetranz, die Suszeptibilität für die Erkrankung beeinflusst. Eine ausführlichere Beschreibung der Ergebnisse dieser Analyse und der aufgetretenen verfahrenstechnischen Schwierigkeiten findet sich bei (Bromen et al. 2002). Für einen Überblick über den Kenntnisstand der genetischen Epidemiologie zum Lungenkrebs siehe z.B. (Bromen et al. 2002; Bromen 2002; Nackaerts et al. 2002a). Allerdings ist die Interpretation solcher Ergebnisse schwierig, da Familienmitglieder nicht nur Gene, sondern auch andere Risikofaktoren, wie z.B. das Rauchen und andere Lebensstilfaktoren etc. teilen (Bromen et al. 2000; Kreuzer et al. 1998). Insbesondere der Hauptrisikofaktor Zigarettenrauchen stellt eine Gewohnheit dar, für die es innerhalb von Familien Verhaltensübereinstimmung gibt. Die gegenwärtige Beweislage für die Rolle genetischer Suszeptibilitätsmarker bleibt zwiespältig, insbesondere da in verschiedenen Populationen unterschiedliche Polymorphismen existieren. Auch liegen zwar inzwischen zahlreiche Hinweise auf die Bedeutsamkeit genetischer Faktoren für die Ätiologie des Lungenkrebses vor, jedoch ist der 335u Genetik-Umwelt-Interaktionen Kenntnisstand über den möglichen Wirkmechanismus einzelner Gene nach wie vor diffus und es gibt bislang keine klaren Kandidatengene. Darüber hinaus ist der Lungenkrebs ein typisches Beispiel für eine multifaktorielle und sozial determinierte Erkrankung, wenn man die zuvor beschriebenen Risikofaktoren betrachtet. Es soll an dieser Stelle nochmals betont werden, dass Lungenkrebs eine Erkrankung ist, die in erster Linie durch exogene Risikofaktoren wie z.B. Rauchen und Asbestexposition verursacht wird, was sich auch in früheren Analysen zur Bremer Lungenkrebsstudie gezeigt hat (Jöckel et al. 1995). Nichtsdestotrotz ist es sehr wahrscheinlich, dass eine Interaktion von genetischen und Umweltfaktoren an der Erkrankungsgenese beteiligt ist (Kiyohara et al. 2004). Aufgrund von Ergebnissen aus Tierexperimenten (Tripodis et al. 2001) wird zudem erwartet, dass dabei mehrere niedrig penetrante Gene interagieren (Shields et al. 2000). Insofern ist die Frage relevant, welche zusätzlichen Erklärungsmöglichkeiten sich mit Hilfe der Genetischen Epidemiologie bieten: Ein verbessertes ätiologisches Verständnis erhöht möglicherweise das Präventionspotential, was angesichts der hohen Inzidenz und der aus der ungünstigen Prognose resultierenden hohen Mortalität besonders lohnenswert erscheint. 4.4.Prävention, Früherkennung und Diagnostik Trotz allen Fortschritts in der Forschung und trotz intensiver Bemühung, Diagnose und Behandlung von Lungenkrebs zu verbessern, ist die Prognose für Lungenkrebs nach wie vor ungünstig. Patienten, deren Diagnose in einem frühen Stadium (0 oder 1) erfolgt, haben die größte Chance auf eine längere Überlebenszeit. Deshalb erscheint es erstrebenswert, Lungentumoren so früh wie möglich, d.h. im asymptomatischen Stadium, zu entdecken. Hochrisikoindividuen, wie z.B. diejenigen mit starker Umwelt- und Rauchexposition sowie einer hohen Suszeptibilität, sollten am meisten von Früherkennungsmaßnahmen profitieren. Zudem erhöhen sich, bei gegebener Sensitivität und/oder Spezifität, der positive und negative prädiktive Wert eines jeden Tests mit zunehmender Prävalenz der Erkrankung in der untersuchten Population. Allerdings konnten randomisierte klinische Studien bislang keine relevante Mortalitätsverringerung als Ergebnis solcher Früherkennungsmaßnahmen zeigen. Dies könnte jedoch teilweise auf den bislang noch sehr lückenhaften Wissensstand zur Rolle der genetischen Suszeptibilität bzw. die fehlende Identifikation relevanter Gene und ihrer Bedeutung zurückzuführen sein. Bislang jedenfalls konnte für den Lungenkrebs weder eine Assoziation zwischen Tumorgröße und biologischem Verhalten noch die Äquivalenz von kleinen Läsionen mit einem frühen Erkrankungsstadium bestätigt werden (Patz, Jr. et al. 2000). In der Beurteilung der Sinnhaftigkeit solcher Screeningansätze müssen auch die Kosteneffizienz und das Strahlenrisiko, welches das Mortalitätsrisiko für t336 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h andere Erkrankungen, z.B. Mamma-CA, möglicherweise erhöht, berücksichtigt werden. Wenngleich bereits einige potentielle Marker für die Erkrankung im Frühstadium, beispielsweise das heterogene nukleare Ribonukleoprotein (hnRNP) identifiziert wurden, lässt sich generell feststellen, dass genetische Aberrationen und andere molekulare Marker der präklinischen Erkrankung der weiteren Untersuchung im Rahmen klinischer Studien bedürfen, bevor sie im Screening eingesetzt werden können. Dieses gilt jedoch für alle Arten von Screeningmethoden, die gegenwärtig verfügbar sind. Es ist verfrüht, irgendeines der vorhandenen Verfahren, wie z.B. Bronchoskopie, Röntgenuntersuchung der Brust, Niedrigdosis-Computertomographie oder Untersuchung molekularer Marker in Sputum, peripherem Blut oder in Flüssigkeit aus Bronchoalveolärer Lavage (BAL), für ein Massenscreening zu empfehlen (Chanin et al. 2004; Cohen et al. 2004; Manser 2004; Manser et al. 2003). Hierbei ist anzumerken, dass man sich bei der Evaluierung dieser Methoden nicht ausschließlich auf die Reduktion der lungenkrebsspezifischen Mortalität fokussieren sollte, sondern zusätzlich die allgemeine Mortalität berücksichtigt werden muss (Black et al. 2002). Dies zum einen, weil die allgemeine Mortalität nicht von einem Missklassifikationsbias der Todesursache beeinträchtigt wird, sondern vor allem, weil Screeningverfahren wie z.B. die Thoraxübersichtsaufnahme oder das Niedrigdosis-Spiral-CT Nebenwirkungen haben, die letztendlich den Tod aus anderen Gründen als dem Lungenkrebs verursachen können. Die exklusive Berücksichtigung der krankheitsspezifischen Mortalität vermittelt eine limitierte und potentiell verzerrte Sicht des Benefits, der durch das Screening erworben wird. Es existieren Beispiele aus randomisierten Studien, die zeigen, dass Vorteile entweder nur hinsichtlich der krankheitsspezifischen, nicht aber in der allgemeinen Mortalität erworben wurden und umgekehrt (Black et al. 2002). Gegenwärtig gibt es weder eine allgemeine Übereinstimmung hinsichtlich eines Screening-Ansatzes für Hochrisiko-Individuen (Boyle 2002) noch eine klare Empfehlung, Früherkennungsmaßnahmen bei asymptomatischen Personen mit einem starken Risikoprofil einzusetzen (Smith et al. 2003). Deshalb ist die Primärprävention, insbesondere des Rauchens, eindeutig die effektivste Methode zur Vermeidung des Lungenkrebses. Im wesentlichen verfolgen Antirauchprogramme drei Ziele: 1. Menschen, insbesondere Jugendliche vom Beginn des Rauchens abzuhalten. (primary prevention of active smoking). 337u Genetik-Umwelt-Interaktionen 2. Personen bei der Rauchentwöhnung zu unterstützen oder zumindest zu helfen, ihr Expositionsniveau zu reduzieren (primary prevention of passive smoking). 3. Die Allgemeinbevölkerung vor Passivrauchexposition zu schützen (smoking cessation, primary, secondary and tertiary prevention). Es hat sich gezeigt, dass diese Ziele am besten mit umfassenden TabakKontroll-programmen erreicht werden können, die verschiedene Ansätze umfassen, wie z.B. Aufklärung, radikale gesellschafts- und medienbasierte Anti-Rauch-Kampagnen, Werbeverbot, preisregulierende Maßnahmen (Steuererhöhung), Verbot des Verkaufs an Kinder und Jugendliche, sowie ein Rauchverbot in Öffentlichkeit und am Arbeitsplatz (Jöckel et al. 2002a; Sachverständigenrat (SVR) für die Konzertierte Aktion im Gesundheitswesen 2002). Solche Initiativen werden auf internationaler Ebene durch verschiedene politische Maßnahmen und Kampagnen, z.B. in Form der „WHO Framework Convention on Tobacco Control“ u.a. von der WHO und von der Europäischen Kommission („Feel free to say no“-Kampagne) unterstützt. Für den Erfolg dieser Maßnahmen ist es essentiell, verschiedene Akteure und Institutionen auf unterschiedlichen Ebenen (z.B. Eltern, Schule, Arbeitgeber, Vereine etc.) in ihre Umsetzung einzubinden. Auch bei Rauchentwöhnung und -reduktionsmaßnahmen hat sich ein mehrdimensionaler Ansatz, der u.a. Nikotinersatz und psychotherapeutische Ansätze (kognitive Verhaltenstherapie) beinhaltet, die besten Ergebnisse gezeigt (Sachverständigenrat (SVR) für die Konzertierte Aktion im Gesundheitswesen 2002). Für eine erfolgreiche Rauchentwöhnung ist die umfassende Unterstützung und Stärkung der Motivation des Einzelnen durch sein soziales Umfeld von größter Bedeutung, da die eigene Motivation das entscheidende Element darstellt. Zusätzlich zu Rauchpräventionsmaßnahmen, beispielsweise in Form von Aufklärung, Werbeverbot, Steuern, Rauchverbot in öffentlichen Räumen etc. ist es wünschenswert, relevante berufliche Expositionen zu reduzieren bzw. wenn möglich ganz zu vermeiden und gefährdete Arbeitnehmer über relevante Schutzmaßnahmen aufzuklären. Diese Ergebnisse unter Berücksichtigung der in der Literatur beschriebenen lassen die folgenden Schlussfolgerungen zu einem möglichen Präventionspotential dieser Erkrankung zu: Neben der Vermeidung oder Verringerung der etablierten Risikofaktoren beispielsweise durch Rauchentwöhnung, Schutz vor Arbeits- und Umweltexpositionen und Verbesserung der Ernährung sollten insbesondere bei Personen mit familiärer Vorbelastung oder mit noch zu identifizierenden ungünstigen t338 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Genpolymorphismen gezielte Maßnahmen hinsichtlich Primär- und Sekundärprävention unternommen werden. So könnten möglicherweise geeignete Aufklärungs- und Screeningmaßnahmen bei Personen mit mindestens einem an Lungenkrebs erkrankten Angehörigen, einem bestimmten Genprofil und weiteren Risikofaktoren einen größeren Erfolg erzielen als in der Allgemeinbevölkerung. 5. Public Health Genetik und Lungenkrebs – Ausblick und Empfehlungen Der Lungenkrebs ist eine weitverbreitete bösartige Neubildung und das typische Beispiel ei-ner multifaktoriell verursachten Krebserkrankung. Die Belastung der Bevölkerung weltweit und die ökonomischen Konsequenzen sind entsprechend groß, während gleichzeitig die Identifikation relevanter Risikofaktoren, abgesehen von dem Hauptrisikofaktor Rauchen, schwierig ist. Neben dem Rauchen sind jedoch andererseits bereits eine ganze Reihe von Faktoren – insbesondere aus dem beruflichen Umfeld – identifiziert worden und fordern Maßnahmen zur Primärprävention und, falls dies nicht mehr möglich ist, sozialmedizinische Konsequenzen. Substantielle Fortschritte in Diagnostik und Therapie dieser Erkrankung lassen trotz intensiver Bemühungen nach wie vor auf sich warten. Jedoch ist auch weiterhin Forschung essentiell, um molekularbiologische Prinzipien, das Zusammenspiel verschiedener Gene, Gen-Umwelt-Interaktion sowie das Potential von Früherkennung und Therapie dieses Tumors besser zu verstehen und zu nutzen. Letztendlich sollte es das Ziel sein, potentielle Risiken zu identifizieren und zu quantifizieren, notwendige Maßnahmen bereitzustellen und umzusetzen, wo relevante Expositionen bereits identifiziert wurden und die Möglichkeiten der Früherkennung und Therapie zu verbessern. Es bleibt zu hoffen und ist zu erwarten, dass mit dem Fortschreiten der Erkenntnisse auf molekularbiologischer und genetischer Ebene, nicht zuletzt unterstützt durch die Bioinformatik, schließlich auch Fortschritte in Prävention, Diagnostik und Therapie erzielt werden. Bezogen auf eine Public Health Genetik bedeutet dieses, dass zur Reduktion der Inzidenz dieses Krankheitsbildes der Schwerpunkt derzeit noch auf der Fortführung und Intensivierung von klassischen, nicht-genetischen Public HealthAufgaben liegen muss, wie sie zuvor angesprochen wurden: Hier ist zum einen die Gesundheitserziehung und Aufklärung über die Effekte bekannter Risikofaktoren zu nennen. Dabei sollten selbstverständlich über den Lungenkrebs hinausgehend die vielfältigen Effekte der Risikofaktoren, insbesondere des Rauchens veranschaulicht werden, d.h. es muss verdeut- 339u Genetik-Umwelt-Interaktionen licht werden, dass nicht nur der Lungenkrebs sondern eine Vielzahl von Erkrankungen durch das Rauchen verursacht werden kann. Weiterhin sollten auch andere physische Effekte, die möglicherweise gerade das Interesse junger Menschen ansprechen (Stichwort: Hautalterung / Faltenbildung – „Rauchen macht alt“ oder „Rauchen macht hässlich“) kommuniziert werden. Im Rahmen der klassischen Public Health Aufgaben sind hier, wie bereits dargestellt, die Prävention bzw. Reduktion bereits bekannter Risikofaktoren zu nennen. Hierzu sind multidimensionale und multiprofessionelle Ansätze erforderlich. In Richtung der Genetik lautet die Aufforderung, auf dem derzeitigen Kenntnisstand aufzubauen und die derzeitigen Forschungsbemühungen fortzusetzen. Zum jetzigen Zeitpunkt ist es verfrüht, aus dem bisherigen, limitierten Wissensstand bereits konkrete Handlungsempfehlungen abzuleiten, da zum einen weder relevante Gene identifiziert wurden noch ihr Zusammenspiel untereinander und mit anderen Faktoren verstanden ist. Eine Ausnahme bildet hier jedoch der Fall einer Vorbelastung von Familienmitgliedern mit der Erkrankung. Diese familiäre Prädisposition ist als potentieller Risikofaktor anzusehen und sollte als solcher auch in Präventionsstrategien berücksichtigt und beispielsweise vom Hausarzt oder vom behandelnden Arzt entsprechend kommuniziert werden. Hierbei sollten Hochrisikopersonen (Rauchen + Familiäre Vorbelastung + berufliche Exposition) besondere Aufmerksamkeit erfahren. Auch könnte in langfristig angelegten prospektiven Studien überprüft werden, ob bislang enttäuschende präventive und diagnostische Maßnahmen in solchen Hochrisikokollektiven zum erhofften Erfolge führen. Ethische und sozialgemeinschaftliche Fragen wie der Umgang der Gesellschaft mit Personen, die rauchen, obwohl ihr Genprofil ein hohes Riskio für den Lungenkrebs aufweist, sind einerseits aufgrund des mangelhaften Wissensstand verfrüht, sollten aber trotzdem auf allgemeiner Ebene diskutiert werden. Dies umso mehr, als dieses kein krankheitsspezifisches Problem sondern eine gesamtgesellschaftliche Aufgabe ist, die allgemein im Rahmen der Public Health Genetik zu diskutieren und auf gesellschaftspolitischer Ebene zu lösen ist. t340 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Literatur AG Bevölkerungsbezogener Krebsregister in Deutschland (2002): Krebs in Deutschland. Häufigkeiten und Trends, Riegelsberg: Braun Druck. 3. Aufl. AG Bevölkerungsbezogener Krebsregister in Deutschland (2004): Krebs in Deutschland. Häufigkeiten und Trends. Riegelsberg: RoBo-print 4. Aufl. Agudo A, Ahrens W, Benhamou E, et al. (2000): Lung cancer and cigarette smoking in women: a multicenter case-control study in Europe. Int J Cancer. 88, 820-827. Black WC, Haggstrom DA, Welch HG (2002): All-cause mortality in randomized trials of cancer screening. J Natl Cancer Inst. 94, 167-173. Blot WJ, Fraumeni JF (1996): Cancers of the lung and pleura. In: Schottenfeld D, Fraumeni JF: (Hrsg.) Cancer Epidemiology and Prevention. Oxford: Oxford University Press. 2. Aufl. Boffetta P, Agudo A, Ahrens W, et al. (1998): Multicenter case-control study of exposure to environmental tobacco smoke and lung cancer in Europe. J Natl Cancer Inst. 90, 1440-1450. Boffetta P, Pershagen G, Jöckel KH, et al. (1999): Cigar and pipe smoking and lung cancer risk: a multicenter study from Europe. J Natl Cancer Inst. 91, 697-701. Boyle P (2002): Current situation of screening for cancer. Ann Oncol. 13 Suppl 4, S. 189-198. Brennan P, Fortes C, Butler J, et al. (2000): A multicenter case-control study of diet and lung cancer among non-smokers. Cancer Causes Control. 11, 49-58 Bromen K (2002): Familiäre Aggregation des Lungenkrebses – Untersuchungen anhand einer bevölkerungsbasierten Fall-Kontroll Studie: Ecomed. Bromen K, Jöckel K-H (2002): Epidemiologie des Bronchialkarzinoms. Atemwegs- und Lungenkrankheiten. 28, 524-533. 341u Genetik-Umwelt-Interaktionen Bromen K, Pohlabeln H, Jahn I, et al. (2000): Aggregation of lung cancer in families: results from a population-based case-control study in Germany. Am J Epidemiol. 152, 497-505. Brüske-Hohlfeld I, Mohner M, Pohlabeln H, et al. (2000): Occupational lung cancer risk for men in Germany: results from a pooled case-control study. Am J Epidemiol. 151, 384-395. Casper W, Wiesner G, Bergmann KE (1995): Mortalität und Todesursachen in Deutschland. München: MMV Medizin Verlag GmbH. Chanin TD, Merrick DT, Franklin WA, et al. (2004): Recent developments in biomarkers for the early detection of lung cancer: perspectives based on publications 2003 to present. Curr.Opin.Pulm.Med. 10, 242-247. Cohen V, Khuri FR (2004): Chemoprevention of lung cancer. Curr.Opin. Pulm.Med. 10, 279-283 Darby S, Hill D, Doll R (2001a): Radon: a likely carcinogen at all exposures. Ann.Oncol. 12, 1341-1351. Darby S, Whitley E, Doll R, et al. (2001b): Diet, smoking and lung cancer: a case-control study of 1000 cases and 1500 controls in South-West England. Br J Cancer. 84, 728-735. Doll R, Peto R (1981): The causes of cancer: quantitative estimates of avoidable risks of cancer in the United States today. J Natl Cancer Inst. 66, 1, 191, 308. Elandt-Johnson RC (1970): Segregation analysis for complex modes of inheritance. Am J Hum Genet. 22, 129-144. Elston RC (1981): Segregation analysis. Adv.Hum.Genet. 11: 63-120, 372373. Elston RC, Olson J, Palmer L (2002): Biostatistical Genetics and Genetic Epidemiology. Cleveland: Wiley & Sons. Epstein KR (2003): The role of carotenoids on the risk of lung cancer. Semin.Oncol. 30, 86-93. t342 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Gasperino J, Rom WN (2004): Gender and lung cancer. Clin.Lung Cancer. 5, 353-359. Greim H (1998): Gesundheitsschädliche Arbeitsstoffe. Toxikologischarbeitsmedizinische Begründungen von MAK-Werten (Maximale Arbeit splatzkonzentrationen) Weinheim: VCH Verlagsgesellschaft mbH. Hirayama T (2000): Non-smoking wives of heavy smokers have a higher risk of lung cancer: a study from Japan. 1981. Bull.World Health Organ. 78, 940-942. Hornung RW (2001): Health effects in underground uranium miners. Occup. Med. 16, 331-344. IARC (1997): Silica, Some Silicates, Coal Dust and para-Aramid Fibrils. Lyon: International Agency for Research on Cancer / World Health Organisation. Jahn I, Becker U, Jöckel KH, et al. (1995): Occupational life course and lung cancer risk in men. Findings from a socio-epidemiological analysis of job-changing histories in a case-control study. Soc.Sci Med. 40, 961975. Jöckel KH (2000): Gesundheitsrisiken durch Passivrauchen. Deutsches Ärzteblatt. 43, 2417-2422. Jöckel KH, Ahrens W, Bolm-Audorff U, et al. (1997): [Occupationallyinduced lung cancer--a quantitative evaluation for the North Germany area]. Gesundheitswesen. 59, 275-278. Jöckel KH, Ahrens W, Jahn I, et al. (1995): Untersuchungen zu Lungenkrebs und Risiken am Arbeitsplatz (Schlussbericht). Berlin: Bundesanstalt für Arbeitsmedizin. Jöckel KH, Ahrens W, Pohlabeln H, et al. (1998a): Lung cancer risk and welding: results from a case-control study in Germany. Am J Ind.Med. 33, 313-320. Jöckel KH, Ahrens W, Wichmann HE, et al. (1992): Occupational and environmental hazards associated with lung cancer. Int J Epidemiol. 21, 202-213. 343u Genetik-Umwelt-Interaktionen Jöckel K-H, Bromen K, Schmidt B, et al. (2002a): Anti-smoking campaigns and their contribution to health promotion. Dtsch.Med Wochenschr. 127, 250-251. Jöckel KH, Brüske-Hohlfeld I, Wichmann E (1998b): Lungenkrebsrisiko durch berufliche Exposition.Landsberg: Ecomed. Jöckel KH, Pohlabeln H, Bromen K, et al. (2002b): Pet birds and risk of lung cancer in North-Western Germany. Lung Cancer. 37, 29-34. Kabat GC, Wynder EL (1992): Body mass index and lung cancer risk. Am J Epidemiol. 135, 769-774. Khoury MJ, Beaty TH, Cohen BH (1993): Fundamentals of Genetic Epidemiology. Oxford: Oxford University Press. Kiyohara C, Yoshimasu K, Shirakawa T, et al. (2004): Genetic polymorphisms and environmental risk of lung cancer: a review. Rev.Environ. Health. 19, 15-38. Kreienbrock L, Kreuzer M, Gerken M, et al. (2001): Case-control study on lung cancer and residential radon in western Germany. Am J Epidemiol. 153, 42-52. Kreuzer M, Boffetta P, Whitley E, et al. (2000a): Gender differences in lung cancer risk by smoking: a multicentre case-control study in Germany and Italy. Br J Cancer. 82, 227-233. Kreuzer M, Krauss M, Kreienbrock L, et al. (2000b): Environmental tobacco smoke and lung cancer: a case-control study in Germany. Am J Epidemiol. 151, 241-250. Kreuzer M, Kreienbrock L, Gerken M, et al. (1998): Risk factors for lung cancer in young adults. Am J Epidemiol. 147, 1028-1037. Lubin JH, Boice JD Jr. (1997): Lung cancer risk from residential radon: meta-analysis of eight epidemiologic studies. J Natl Cancer Inst. 89, 49-5.7 Manser R (2004): Screening for lung cancer: a review. Curr.Opin.Pulm.Med. 10, 266-271. t344 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Manser RL, Irving LB, Byrnes G, et al. (2003): Screening for lung cancer: a systematic review and meta-analysis of controlled trials. Thorax. 58, 784-789. Müller FH: (1939) Tabakmißbrauch und Lungenkrebs. Z Krebsforschung. 49, 57-85. Nackaerts K, Axelson O, Brambilla E, et al. (2002a): Epidemiology of lung cancer: a general update. Eur Respir Rev. 12, 112-121. Nackaerts K, Brambilla E, van Zandwijk N et al. (2002b): Early detection and prevention of lung cancer. Eur Respir Rev. 12, S. 122-130. Omenn GS, Goodman GE, Thornquist MD, et al. (1996): Effects of a combination of beta carotene and vitamin A on lung cancer and cardiovascular disease. N Engl J Med. 334, 1150-1155. Parkin DM, Bray FI, Devesa SS (2001): Cancer burden in the year 2000. The global picture. Eur J Cancer. 37 Suppl 8, 64-66. Patz EF Jr., Goodman PC, Bepler G (2000): Screening for lung cancer. N Engl J Med. 343, 1627-1633. Pesch B, Jöckel K-H, Wichmann HE (1995): Luftverunreinigungen und Lungenkrebs. Informatik, Biometrie und Epidemiologie in Medizin und Biologie. 26, 134-153. Peto R, Darby S, Deo H, et al. (2000): Smoking, smoking cessation, and lung cancer in the UK since 1950: combination of national statistics with two case-control studies. BMJ. 321, 323-329. Pohlabeln H, Boffetta P, Ahrens W, et al. (2000a): Occupational risks for lung cancer among nonsmokers. Epidemiology. 11, 532-538. Pohlabeln H, Jöckel KH, Brüske-Hohlfeld I, et al. (2000b): Lung cancer and exposure to man-made vitreous fibers: results from a pooled case-control study in Germany. Am J Ind.Med. 37, 469-477. Pohlabeln H, Jöckel KH, Müller KM (1997): The relation between various histological types of lung cancer and the number of years since cessation of smoking. Lung Cancer. 18, 223-229. 345u Genetik-Umwelt-Interaktionen Pope CA III, Burnett RT, Thun MJ, et al. (2002): Lung cancer, cardiopulmonary mortality, and long-term exposure to fine particulate air pollution. JAMA. 287, 1132-1141. Prescott E, Osler M, Hein HO, et al. (1998): Gender and smoking-related risk of lung cancer. The Copenhagen Center for Prospective Population Studies. Epidemiology. 9, 79-83. Rigdon RH, Kirchoff H (1958): Cancer of the lung from 1900 to 1930. Surg Gynec Obstet. 107, 105-118. Risch HA, Howe GR, Jain M, et al. (1993): Are female smokers at higher risk for lung cancer than male smokers? A case-control analysis by histologic type. Am J Epidemiol. 138, 281-293. Sachverständigenrat (SVR) für die Konzertierte Aktion im Gesundheitswesen (2002): Onkologische Erkrankungen. In: Über-, Unter- und Fehlversorgung. Ausgewählte Erkrankungen: Rückenleiden, Krebserkrankungen und depressive Störungen. Band III.3. Baden-Baden: Nomos Verlagsgesellschaft. 58-189. Samet JM (1992): The health benefits of smoking cessation. Med Clin North Am. 76, 399-414 Samet JM, Eradze GR (2000): Radon and lung cancer risk: taking stock at the millenium. Environ.Health Perspect. 108 Suppl 4, 635-641. Schön D, Bertz J, Görsch B, et al. (1999): Entwicklung der Überlebensraten von Krebspatienten in Deutschland. Berlin: Robert Koch-Institut . Seow A, Poh WT, Teh M, et al. (2000): Fumes from meat cooking and lung cancer risk in Chinese women. Cancer Epidemiol Biomarkers Prev. 9, 1215-1221. Shields PG, Harris CC (2000): Cancer risk and low-penetrance susceptibility genes in gene-environment interactions. J Clin Oncol. 18, 2309-2315. Shriver SP, Bourdeau HA, Gubish CT, et al. (2000): Sex-specific expression of gastrin-releasing peptide receptor: relationship to smoking history and risk of lung cancer. J Natl Cancer Inst. 92, 24-33. t346 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Simonato L, Agudo A, Ahrens W, et al. (2001): Lung cancer and cigarette smoking in Europe: an update of risk estimates and an assessment of inter-country heterogeneity. Int J Cancer. 91, 876-887. Smith RA, Cokkinides V, Eyre HJ (2003): American Cancer Society guidelines for the early detection of cancer. CA Cancer J Clin. 53, 27-43. Steindorf K, Lubin J, Wichmann HE, et al. (1995): Lung cancer deaths attributable to indoor radon exposure in West Germany. Int J Epidemiol. 24, 485-492. The Alpha-Tocopherol Beta Carotene Cancer Prevention Study Group (1994): The effect of vitamin E and beta carotene on the incidence of lung cancer and other cancers in male smokers. The Alpha-Tocopherol, Beta Carotene Cancer Prevention Study Group. N Engl J Med. 330, 1029-1035. Trichopoulos D, Kalandidi A, Sparros L et al. (1981): Lung cancer and passive smoking. Int J Cancer. 27, 1-4. Tripodis N, Hart AA, Fijneman RJ et al. (2001): Complexity of lung cancer modifiers: mapping of thirty genes and twenty-five interactions in half of the mouse genome. J Natl Cancer Inst. 93, 1484-1491. Wolf S (1998): Epidemiologische Untersuchungen zur lungenkarzinogenen Wirkung von Cadmium. Aachen: Shaker Verlag. Zang EA, Wynder EL (1996): Differences in lung cancer risk between men and women: examination of the evidence. J Natl Cancer Inst. 88, 183192. 347u t348 Genetik in Public Health III. Genetik in Public Te i l 2 : Health Integration von Genetik in Public Health Ethische Aspekte und gesellschaftliche Wertvorstellungen in HTA-Berichten zu genetischen Testverfahren Gutachten erstellt für die ZiF-Kooperationsgruppe „Public Health Genetics“ Dagmar Lühmann, Carmen Bartel, Heiner Raspe 349u t350 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Inhalt III. Genetik in Public Health Ethische Aspekte und gesellschaftliche Wertvorstellungen in HTA-Berichten zu genetischen Testverfahren 1. Policy Question und Fragestellungen.............................. 352 2. Hintergrund................................................................ 354 2.1. Ethische Aspekte ........................................................ 354 2.2. Health Technology Assessment...................................... 357 3. Methoden.................................................................. 360 3.1. Recherchen................................................................ 360 3.2. Der Leitfaden.............................................................. 362 4. Ergebnisse................................................................. 363 4.1. Fragile-X-Syndrom....................................................... 363 4.2. Das hereditäre Mammakarzinom................................. 383 5. 5.1. 5.2. 5.3. 5.4. 5.5. Diskussion.................................................................. 396 Wird in HTA-Berichten zur Bewertung von genetischen Testverfahren auf die ethischen Implikationen des Technologieeinsatzes eingegangen?..... 396 Welche ethischen und Public Health relevanten Fragestellungen werden angesprochen?......................... 397 Welche Forschungsmethoden werden zur Bewertung ethischer und sozialer Konsequenzen eingesetzt?............ 398 Wie werden die Ergebnisse der Bewertung von ethischen und sozialen Implikationen bei der Generierung von Schlussfolgerungen von HTA-Berichten umgesetzt?............................................. 400 Gibt es Weiterentwicklungs- und / oder Forschungsbedarf zur Integration von ethischen Aspekten in Bewertungen genetischer Testverfahren?........ 401 Resümee............................................................................. 406 Literatur.............................................................................. 407 Rechercheergebnisse............................................................. 413 351u H TA - B e r i c h t e 1. Policy Question und Fragestellungen Mit der Entschlüsselung des menschlichen Genoms, der Entdeckung einer Vielzahl von Assoziationen von Genen und Krankheiten bzw. Krankheitsdispositionen und der Entwicklung von akkuraten molekularbiologischen Testverfahren haben sich in den letzten Jahren die Möglichkeiten zur Erkennung von vererbbaren Gesundheitsstörungen vervielfacht. In der Datenbank GeneTests-GeneClinics sind über 800 genetische Tests verzeichnet, die derzeit zur Verfügung stehen oder sich in Entwicklung befinden. Die Interpretation von Ergebnissen genetischer Tests ist jedoch in den seltensten Fällen klar und unproblematisch. Oftmals sind GenotypPhänotyp-Assoziationen uneindeutig. Krankheiten können mit einer Vielzahl interagierender und zum großen Teil unverstandener genetischer Veränderungen einhergehen und schließlich führt bei manchen Störungen erst die Einwirkung von umweltabhängigen Faktoren zur Manifestation der Erkrankung. Hinzu kommt, dass die Entwicklung der diagnostischen Möglichkeiten von genetischen Störungen die Entwicklung von Therapien weit hinter sich gelassen hat. So können eine Reihe von Erkrankungen und Dispositionen zwar diagnostiziert, aber nicht behandelt werden. Solche Informationen sind nicht nur kritisch für Individuen und ihre Angehörigen, welche sich für ihren weiteren Lebensweg und möglicherweise für den der Nachkommen mit einer Risikokonstellation auseinandersetzen müssen, sondern auch für die Gesellschaft insgesamt. Genetische Informationen, beispielsweise erfasst in Gendatenbanken, ausgewertet nach dem Methoden der genetischen Epidemiologie versprechen Fortschritte bei der Aufklärung und Bekämpfung von chronischen Krankheiten, bergen aber gleichzeitig ein nicht zu unterschätzendes Missbrauchspotenzial. Versicherungsrechtliche Konsequenzen von genetischen Merkmalen werden bereits diskutiert. Vor diesem Hintergrund wird klar, dass die Entscheidung genetische Testverfahren in die Gesundheitsversorgung einzuführen, für jeden Test sehr sorgfältig abgewogen werden muss. Es reicht dabei nicht, die Testqualitäten, die therapeutischen Konsequenzen und die Kostenaspekte zu diskutieren, sondern in die Bewertung von genetischen Testverfahren sind, vor allem wegen der Tragweite der Ergebnisse, die ethischen Implikationen (Schadensvermeidung, Wohlergehen, Autonomie und Gerechtigkeit) aus individueller und aus Public Health Sicht zu diskutieren. Die umfassende Beratung von Entscheidungsträgern zu Folgen eines Technologieeinsatzes ist das zentrale Aufgabengebiet von Health Technology Assessment. Nach der Definition des International Network of Agencies for Health Technology Assessment (INAHTA) ist Health Technology t352 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Assessment (HTA) eine Form der Politikfeldanalyse, die systematisch kurz- und langfristige Konsequenzen der Anwendung einer medizinischen Technologie, einer Gruppe verwandter Technologien oder eines technologiebezogenen Sachverhalts untersucht. Ziel von HTA ist die Unterstützung von Entscheidungen in Politik und Praxis. Dabei haben sich seit der Initiierung von HTA durch das OTA (Office for Technology Assessment) in den USA in den 70er Jahren zwei Richtungen der Verfahrensbewertung entwickelt: 1. Das „Parlamentarische“ TA (PTA), dessen breit gefasste Fragestellungen in erster Linie die gesellschaftlichen Auswirkungen von neuen technologischen Konzepten, auch in der Gesundheitsversorgung, behandeln. Adressat für TA Berichte ist die Politik, die gesetzgebende Instanz. 2. „Health Technology Assessment“ dagegen fokussiert auf enger umschriebene Fragestellungen, die aus einem direkten Entscheidungsbedarf (z.B. für oder gegen die Kostenübernahme für ein medizinisches Verfahren) resultieren. In diesem Kontext steht die Bewertung von Sicherheit, Wirksamkeit und Kosteneffektivität der Verfahren im Vordergrund. Es besteht jedoch Konsens, dass auch die Bewertung von ethischen, rechtlichen und sozialen Konsequenzen des Technologieeinsatzes notwendiger Bestandteil von HTA ist, insbesondere wenn diese Aspekte im Zusammenhang mit der zu bewertenden Technologie kontrovers diskutiert werden. HTA bietet so zumindest das Potenzial, Entscheidungsträger umfassend zu den Folgen eines Technologieeinsatzes zu informieren. Vorarbeiten haben jedoch gezeigt, dass zumindest für Kurz-HTA-Verfahren diese Anforderung nur selten umgesetzt wird. Der vorliegende Bericht soll sich an zwei Beispielen mit folgenden Fragen auseinandersetzen: n Wird in HTA-Berichten zur Bewertung von genetischen Testverfahren auf die ethischen Implikationen des Technologieeinsatzes eingegangen? n Welche ethischen Fragestellungen, Theorien und Konzepte werden angesprochen? n Welche Forschungsmethoden werden zur Bewertung ethischer und sozialer Konsequenzen eingesetzt? n Wie werden die Ergebnisse der Bewertung von ethischen und sozialen Implikationen bei der Generierung von Schlussfolgerungen von HTABerichten umgesetzt? n Gibt es Weiterentwicklungs- und / oder Forschungsbedarf zur Integration von ethischen Aspekten in Bewertungen genetischer Testverfahren? 353u H TA - B e r i c h t e 2. Hintergrund 2.1.Ethische Aspekte Um eine Bestandsaufnahme ethischer Überlegungen in HTA-Berichten durchführen zu können, müssen erst einige im Weiteren verwendete Begriff­ lich­kei­ten klar gestellt werden: Nach Burke et al. ist ein „genetischer Test“ jeder Labortest, der benutzt wird, um eine erbliche Veranlagung zu identifizieren – nicht nur DNA-basierte Analyseverfahren (Burke, Atkins, Gwinn, et al. 2002). Ähnlich definiert auch das Institut für Technikfolgenabschätzung (ITA) der österreichischen Akademie der Wissenschaften in ihrem HTA-Bericht zu „Prädiktiver humangenetischer Diagnostik“ diesen Begriff, er steht für eine Vielzahl verschiedener Labormethoden. Sie grenzen davon den Ausdruck „genetische Diagnostik“ ab: Damit wird der Einsatz besonderer Untersuchungsverfahren zur Identifikation einer genetischen Krankheitsdisposition bei einer ausgesuchten Person beschrieben, die beispielsweise auf Grund ihrer Familienanamnese ein erhöhtes Risiko hat (Jonas et al. 2002). Um „ethische Aspekte“ im weitesten Sinne in HTA-Berichten zu identifizieren, wurde eine einfache, pragmatische Erklärung dieses Begriffs benötigt. Droste, Gerhardus und Kollek (2003) haben hierzu eine Arbeitsdefinition geliefert: „… Ethik ist – kurz gesagt- die Theorie vom richtigen Handeln. Sie reflektiert und überprüft die Richtigkeit menschlichen Handelns, das von den gesellschaftlichen Wertvorstellungen und Normen, die in einer bestimmten Kultur soziale Geltung erlangt haben, geprägt wird. Im Kontext dieser Studie werden deshalb als „ethische Aspekte“ und gesellschaftliche Wertvorstellungen diejenigen Bestandteile eines Kurz-HTA-Berichtes verstanden, die sich auf die Bewertung medizinischen Handelns beziehen und die explizit oder implizit auf ethische Prinzipien und/oder auf Begriffe und Kategorien Bezug nehmen, die von diesen Prinzipien abgeleitet sind oder ihnen zugrunde liegen….“ Ein simples Schema zur Identifikation von „ethischen Aspekten“ schlagen Beauchamp und Childress vor (Beauchamp, Childress 1994): Autonomie einschließlich Achtung vor der Person und ihrer Selbstbestimmung, Wohltun, Nicht-Schaden und Gerechtigkeit. Diese eher individuumsbezogenen Prinzipien reichen allerdings nicht aus, um Public Health relevante ethische Betrachtungen abzubilden. Hierzu schlägt Brand (2002) fünf weitere Prinzipien vor: Verhältnismäßigkeit, Befähigungsgerechtigkeit, t354 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Bürgerbeteiligung, umfassende Sicherheit der Gesundheitsversorgung und Verantwortlichkeit des Einzelnen. Wie gelangt man von den Prinzipien zu einer ethischen Bewertung? Nach Marckmann (2003) stehen bei Beauchamp und Childress die ersten vier Aspekte der o. g. Liste zunächst gleichberechtigt nebeneinander, sie haben keine absolute moralische Geltung und müssen im Falle eines Konflikts gegeneinander abgewogen werden. Diese Gewichtung soll mit gut begründeten Argumenten erfolgen. Die Ordnung nach den Prinzipien gibt keine schematischen Lösungen ethischer Probleme vor und lässt Raum für Interpretationen. Sie hilft allerdings, den Konflikt in der konkreten Situation herauszuarbeiten (Marckmann 2003). Im Zusammenhang mit prädiktiven genetischen Tests wird eine sorgfältige Diskussion von ethischen Aspekten gefordert, unter anderem: n weil die Informationen durch die Gefährdung der sozialen und biologischen Existenzintegrität und ihr Diskriminierungspotential (zur Zeit noch) einen schicksalhaften Charakter für das Individuum haben, n weil die Ergebnisse genetischer Tests aufgrund variabler Genotyp-PhänotypKorrelationen und (noch) fehlender Informationen häufig niedrige prädiktive Werte liefern, was einen hohen Anteil falsch positiver Testergebnisse bedeutet. Hieraus erwächst ein nicht zu unterschätzender Interpretationsund Bewertungsbedarf, n weil vererbbare genetische Informationen Rückschlüsse vom Einzelnen auf die Familie (ggf. auf ganze Populationen) erlauben, also Dritte betreffen. Für den bundesdeutschen Kontext wird von der Bundesärztekammer, der DFG und der deutschen Gesellschaft ein normativer Hintergrund für den Einsatz von prädiktiven genetischen Testverfahren skizziert. Die Richtlinien der Bundesärztekammer sind im Vergleich zu den Leitlinien der verschiedenen wissenschaftlichen Gesellschaften und Berufsverbände rechtsverbindlich. In der Richtlinie der Bundesärztekammer zur „Diagnostik der genetischen Disposition für Krebserkrankungen“ vom 29. Mai 1998 wird ein Bevölkerungsscreening zu diesen Krankheiten abgelehnt, weil die hereditären Tumorerkrankungen höchstens 10% aller Malignome ausmachen. Sie fokussiert auf die Früherkennung innerhalb der Familie, wenn nach Identifizierung eines Indexpatienten die genetische Disposition als wahrscheinlich angenommen werden kann. Folgende Voraussetzungen müssen für ein solches Risikogruppenscreening gegeben sein: Die zu testende Person sollte volljährig sein. Ein Minderjähriger darf nur gete- 355u H TA - B e r i c h t e stet werden, wenn durch den frühen Beginn einer Vorsorge/ Behandlung, die Krankheit verhindert werden kann. Die Bundesärztekammer verlangt außerdem ein interdisziplinäres, fachlich qualifiziertes Ärzteteam, das eine angemessenen Beratung sicher stellen und den Ratsuchenden auch über die Möglichkeit nicht zu interpretierender Testergebnisse und das Risiko in der Allgemeinbevölkerung informieren kann. In der Richtlinie der Bundesärztekammer zur „Pränatalen Diagnostik von Krankheiten und Krankheitsdispositionen“ (1998) wird festgehalten, dass die Einführung der pränatale Diagnostik in erster Linie dazu dient, die perinatale Morbidität und Mortalität zu senken und die Abklärung besonderer genetischer Risiken im Einzelfall zu ermöglichen. In der Richtlinie wird betont, dass keine Maßnahme der pränatalen Diagnostik einer eugenischen Zielsetzung folgen darf. Ethische Aspekte werden hier explizit angesprochen, z.B. die Nutzen- und Risiko-Abwägung für Mutter und Kind als auch der Respekt vor der Entscheidung der Schwangeren. Zentrales Problem der pränatalen Diagnostik ist der (mögliche) Schwangerschaftsabbruch, der mit dem Tötungsverbot im Konflikt steht. Aber auch die Risiken einer (invasiven) Diagnostik für das Kind, die nicht notwendigerweise zum Tod führen, sollten berücksichtigt werden. Die Deutsche Forschungsgemeinschaft (DFG) äußert sich in ihrer „Stellungnahme zur prädiktiven genetischen Diagnostik“ zuerst zu Sachfragen wie den genetischen Grundlagen als auch der Anwendung und Interpretation genetischer Tests. In einem eigenen Kapitel wendet sich die DFG ethischen und rechtlichen Aspekten der prädiktiven genetischen Diagnostik zu. Hier werden die wichtigsten vorgestellt: Die DFG schlägt einen Arztvorbehalt für das Angebot genetischer Testverfahren vor. Dieser soll durch die Sicherstellung einer qualifizierten Beratung die Autonomie der Ratsuchenden schützen (Befähigung zum „informed consent“ / „informed refusal“). Des Weiteren fordert sie, die Qualitätssicherung der genetischen Testverfahren zu regeln. Die DFG führt die vier ethischen Aspekte (Autonomie, Wohlergehen, Nicht-Schaden und Gerechtigkeit) an und beschreibt mögliche Folgen der Technologieeinführung. Sie sieht ein Schadenspotenzial: Die Gefahr der Diskriminierung im Rahmen von Kranken- oder Lebensversicherungen als auch im Beruf ist offensichtlich. Sie diskutiert die Gerechtigkeit im Hinblick auf den Zugang zu genetischen Tests und die Kostenübernahme für diese Verfahren. Weiterhin argumentiert sie, dass die Autonomie eines t356 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Ratsuchenden durch den oben erwähnten Arztvorbehalt nicht eingeschränkt sondern gestärkt wird. Die Kommission für Öffentlichkeitsarbeit und Ethik der Gesellschaft für Humangenetik e. V. (GfH) äußert sich in ihrem Positionspapier wie folgt: Sie betont die Wichtigkeit der vier Prinzipien (Autonomie, Gerechtigkeit im Sinne des Gleichheitsgrundsatzes, Nicht-Schaden und Wohlergehen) bei der humangenetischen Beratung. Sie erklärt, dass sie die Autonomie und Selbstbestimmung von Patienten und deren Familien fördern will, und spricht sich ausdrücklich gegen eugenische Intentionen aus. Zudem verweist sie auf die ärztliche Schweigepflicht und Vertraulichkeit, aber auch auf den möglichen Konflikt, Schaden für Dritte (Familienangehörige) zu verhindern versus der Schweigepflicht gegenüber dem Ratsuchenden (GfH 1996). Fazit: Unter „Ethischen Aspekten“ werden diejenigen Bestandteile eines HTA-Berichtes verstanden, die sich auf die Bewertung medizinischen Handelns beziehen und die explizit oder implizit auf ethische Prinzipien und/oder auf Begriffe und Kategorien Bezug nehmen, die von diesen Prinzipien abgeleitet sind oder ihnen zugrunde liegen. Einen pragmatischen Ansatz zur Identifikation von ethischen Problemen im Kontext eines Technologieeinsatzes, zu ihrer Beschreibung und zur Vorbereitung der ethischen Diskussion liefert der „4-Prinzipien“ Ansatz von Beauchamp und Childress. Aus der Public Health Perspektive sind darüber hinaus die Aspekte „Verhältnismäßigkeit“, „Befähigungsgerechtigkeit“, „Verantwortlichkeit des Einzelnen“ und „Bürgerpartizipation“ von Relevanz. 2.2.Health Technology Assessment Health Technology Assessment (HTA) ist per Definitionem „eine Form der Politikfeldanalyse, die systematisch kurz- und langfristige Konsequenzen der Anwendung einer medizinischen Technologie, einer Gruppe verwandter Technologien oder eines Technologiebezogenen Sachverhalts untersucht….“ (Banta 1997). Dabei werden die Folgen des Technologieeinsatzes aus unterschiedlichen Perspektiven untersucht. Ein umfassendes „Assessment“ nimmt Bewertungen der Sicherheit einer Technologie (für Patienten und Anwender), ihrer „medizinischen Wirksamkeit“ (unter Studien- und Alltagsbedingungen), ihres Entwicklungs- und Diffusionsstandes sowie der organisatorischen Einbettung in das Versorgungssystem, ihren psycho-sozialen Konsequenzen und ihren rechtlichen und ethischen Implikationen vor. Die Vielfalt der Perspektiven weist auf ein weiteres Charakteristikum von HTA: die Multidisziplinarität. Das übergeordnete Ziel 357u H TA - B e r i c h t e von HTA ist immer die Unterstützung von Entscheidungen in Politik und Praxis. Die Wurzeln von HTA liegen in den Arbeiten des „Office for Technology Assessment“ (OTA) in den USA. Dort wurden seit Mitte der 60er Jahre multidisziplinäre Technikfolgenabschätzungen vorgenommen, für solche Technologien, für die gesamtgesellschaftliche Auswirkungen anzunehmen waren (z.B. Umwelt-, Verkehrs-, Weltraum-, Informationstechnologien). Mit der Einführung eines Gesundheitsprogramms 1976 wurde die Grundlage des eigentlichen „Health Technology Assessments“ gelegt. HTA hat sich seitdem in zwei Richtungen weiter entwickelt, die zwar häufig die gleichen Themen, diese aber aus unterschiedlichen Perspektiven bearbeiten, sie sind somit komplementär zu sehen. An Themen der Gesundheitsversorgung, aber in der Tradition der klassischen Technikfolgenabschätzung arbeiten die so genannten parlamentarischen TA Institutionen (in Deutschland, zum Beispiel, das Büro für Technikfolgenabschätzung des deutschen Bundestages). Sie befassen sich in der Regel mit Technologien oder Gruppen von Technologien in einem frühen Entwicklungsstadium, vor der breiten Implementation in die Gesundheitsversorgung. Die direkt an die Politik (legislative Ebene) gerichtete Bewertung zielt in erster Linie auf die sozialen und juristischen Auswirkungen des Technologieeinsatzes und benennt ethische Problemfelder. TA setzt in erster Linie sozialwissenschaftliche qualitative Methoden ein. Ebenfalls auf der Grundlage der OTA Arbeiten hat sich das „Health Technology Assessment“ oder das „pragmatische“ HTA entwickelt. Im Gegensatz zum parlamentarischen TA sind die Adressaten für diese Art von Verfahrensbewertung Entscheidungsträger auf unterschiedlichen Ebenen innerhalb der Gesundheitssysteme. HTA-Berichte fokussieren vor allem auf klinische und ökonomische Technologiefolgen. Soziale, rechtliche und ethische Implikationen gehören zwar zu den Anforderungen an ein vollständiges Assessment, nehmen aber in der Praxis einen eher untergeordneten Stellenwert ein. HTA wird von einer Vielzahl abhängiger und unabhängiger öffentlich und privat finanzierter Institutionen durchgeführt. Dabei haben vor allem im Bereich Methodenentwicklung internationale Zusammenarbeiten auf dem öffentlich rechtlichen Sektor (z.B. INAHTA – International Network of Agencies for Health Technology Assessment, ein Netzwerk von öffentlich finanzierten HTA-Institutionen; ECAHI – European Collaboration for Assessment of Health Interventions) Bedeutung erlangt. ECAHI schlägt für HTAs ein methodisches Vorgehen in 7 Schritten vor: t358 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Am Anfang steht immer die „Policy Question“, die den Informationsbedarf, der durch das Assessment gedeckt werden soll, im gesundheitspolitischen Kontext beschreibt. Es folgen die Erstellung eines wissenschaftlichen Protokolls und die Aufarbeitung des Hintergrundes, die zur Formulierung von präzisen Forschungsfragen führen. Diese werden in systematischen Informationsaufarbeitungen (systematische Reviews) zu den Aspekten Sicherheit, Wirksamkeit, soziale und ethische Implikationen, Organisation und Ökonomie behandelt. Dabei wird im Rahmen von HTA in erster Linie auf bereits bestehende Informationen zurückgegriffen. Nur in Einzelfällen werden Primärstudien durchgeführt. An die Informationssynthese und die Ableitung von Schlussfolgerungen schließt sich ein Peer-Review-Prozess und die Veröffentlichung der Ergebnisse an. Formulierung der Policy Question Vorbereitung eines HTA-Protokolls Aufarbeitung der Hintergrundinformationen / Bestimmung des Status der Technologie Formulierung der Forschungsfragen Sicherheit Wirksamkeit Quellen Bewertung Synthese Quellen Bewertung Synthese Soziale/ethische Folgen Quellen Bewertung Synthese Organisation Ökonomie Quellen Bewertung Synthese Quellen Bewertung Synthese Schlussfolgerungen / Empfehlungen Peer Review und Veröffentlichung(en) Abbildung 1: Schritte im HTA Prozess (Busse & Orvain 2002) Bei der Durchsicht von Methodenpapieren und Handbüchern zu HTA wird ein Problem offensichtlich: Während die meisten Werke die Berücksichtigung von „ethischen Implikationen“ als essentiellen Bestandteil von HTA würdiBei der Durchsichtgen, von Methodenpapieren und Handbüchern zu HTA wird ein Problem gibt es nur vereinzelte und ungenaue Hinweise, wie offensichtlich: eine derartige Während die meisten Werke die Berücksichtigung von "ethischen Implikationen" als essentiellen BeBewertung inhaltlich und methodisch umgesetzt werden soll. Es ist daher standteil von HTA würdigen, gibt es nur vereinzelte und ungenaue Hinweise, wie eine derartige Benicht verwunderlich, dass eine systematische Durchsicht von Kurz-HTAwertung inhaltlich und methodisch umgesetzt werden soll. Es ist daher nicht verwunderlich, dass eine Berichten (Droste, Gerhardus, Kollek 2003) feststellen konnte, dass von insAbbildung 1: Schritte im HTA Prozess (Busse & Orvain 2002) systematische Durchsicht von Kurz-HTA-Berichten (Droste, Gerhardus, Kollek 2003) feststellen konnte, dass von insgesamt 282 verfügbaren Assessments weniger als 10% der Berichte ethische Aspekte explizit in die Bewertung einbezogen haben. Weitere 10% befassten sich zumindest implizit mit der Thematik. Eine systematische Methodik zur Bewertung ethischer Implikationen wurde auch in diesen Berichten nicht erkennbar. Die Autoren stellten fest, dass möglicherweise die Bewertung von ethischen Aspekten ausführlichen HTA-Berichten (im Gegensatz zum Kurz-Bericht) vorbehalten sei. Andererseits könnte das von Droste et al. beschriebene Defizit auch an der fehlenden thematischen Selektion der analysierten Kurz-HTA-Berichte liegen. Nicht bei allen medizinischen Technologien 359u H TA - B e r i c h t e gesamt 282 verfügbaren Assessments weniger als 10% der Berichte ethische Aspekte explizit in die Bewertung einbezogen haben. Weitere 10% befassten sich zumindest implizit mit der Thematik. Eine systematische Methodik zur Bewertung ethischer Implikationen wurde auch in diesen Berichten nicht erkennbar. Die Autoren stellten fest, dass möglicherweise die Bewertung von ethischen Aspekten ausführlichen HTA-Berichten (im Gegensatz zum Kurz-Bericht) vorbehalten sei. Andererseits könnte das von Droste et al. beschriebene Defizit auch an der fehlenden thematischen Selektion der analysierten Kurz-HTA-Berichte liegen. Nicht bei allen medizinischen Technologien spielt die Bewertung von ethischen Aspekten eine gleichermaßen wichtige Rolle. Im Zusammenhang mit der Einführung von genetischen Testverfahren, insbesondere im Kontext von Screeningprogrammen, sind sie jedoch wesentlich. Die folgende Analyse soll daher feststellen, in wieweit HTA-Berichte zu genetischen Testverfahren ethische Aspekte bei der Verfahrensbewertung berücksichtigen und mit welchen Methoden dies erreicht wird. 3. Methoden 3.1.Recherchen Die Beantwortung der oben skizzierten Fragestellungen wurde an HTABerichten zu zwei exemplarisch ausgewählten Themen vorgenommen. Die Auswahl der Themen erfolgte nach folgenden Kriterien: n monogenetische Störung, mit DNA-basierten Testverfahren zu diagnostizieren; n mehrere ausführliche, im Volltext verfügbare HTA-Berichte (keine „Rapid Assessments“, keine „Technology Briefs“) aus unterschiedlichen Ländern zum Thema zugänglich; n spezifische, entscheidungsrelevante Fragestellung (kein PTA mit übergreifender Perspektive) Eine Recherche nach HTA-Berichten wurde in der HTA-Database des „Center for Reviews and Dissemination“, York, UK (CRD) und im (inzwischen abgeschafften) Recherchesystem „NLM-Gateway“ der National Library of Medicine durchgeführt. Neben der kostenpflichtigen (und von uns nicht recherchierten) ECRIDatenbank ist die HTA-Datenbank des CRD die umfassendste Quelle für HTA-Berichte. In sie werden regelmäßig vollständige HTA-Berichte, t360 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Kurzberichte, Systematische Literaturübersichten und Protokolle aus 56 verschiedenen, öffentlich finanzierten HTA-Institutionen, darunter die Mitgliederorganisationen des INAHTA (International Network of Agencies for Health Technology Assessment), gestellt. Es wurde eine bewusst einfache Suchstrategie verwendet, um eine hochsensitive Suche zu erhalten. Als Stichworte für die Datenbankrecherchen wurden die Begriffe „genetic OR genom*/All fields OR chromosome OR chromosomal/All fields AND screening OR diagnostic test /All fields“ eingesetzt. Die Recherche erzielte 77 Treffer, von denen 41 auf den ersten Blick ausgeschlossen werden konnten (13 Hinweise auf laufende Projekte; 28 Referenzen zu Gentherapie, rein technischen Verfahrensbewertungen oder themenfremde Arbeiten). So kamen 36 Arbeiten in die engere Auswahl (s. Anhang 1). Insgesamt wurden 19 unterschiedliche Themen in den 36 HTA Reports angesprochen: Thema n Berichte* aus n Institutionen Ewing Sarkom 1 1 Neuroblastom 1 1 Zystische Fibrose 2 2 Down Syndrom 1 1 "Fetale Chromosomenanomalien" 5 5 Fragile-X-Syndrom 5 3 "Erbliche Krebserkrankungen" 1 1 Kolorektales Karzinom 2 2 Mamma-Karzinom 2 2 Prostatakarzinom 1 1 "Erbkrankheiten" 1 1 Hereditäre Thrombophilie 1 1 Hämochromatose 4 3 Familiäre Tyrosinämie 1 1 "Genetisches Screening"; DNA-Diagnostik 4 2 Ovarialkarzinom 2 2 Muskeldystrophie Duchenne-Becker 1 1 Myotone Dystonie 1 1 Tabelle 1: HTA-Berichte zu genetischen Testverfahren. * Die Zahl der gelisteten Themen stimmt nicht mit der oben genannten Referenzzahl überein, da einige Berichte mehr als ein Thema behandeln. Tabelle 1: HTA-Berichte zu genetischen Testverfahren. * Die Zahl der gelisteten Themen stimmt nicht mit der oben genannten Referenzzahl überein, da einige Berichte mehr als ein Thema behandeln. Die Ergebnisse der NLM-Gateway-Recherche lieferten zwar eine große Menge an Hintergrundliteratur und Einzelstudien, Hinweise auf weitere Die Ergebnisse derHTA-Berichte NLM-Gateway-Recherche lieferten eine große Menge an Hintergrundliterakonnten ihr nichtzwar entnommen werden. Da das Gatewaytur und Einzelstudien, Hinweise auf weitere HTA-Berichte konnten ihr nicht entnommen werden. Da das Gateway-System inzwischen nicht mehr angeboten wird, haben wir auf eine detaillierte Darstellung der Recherche verzichtet. Unsere Rechercheergebnisse können nicht als "repräsentativ" für die Gesamtzahl der publizierten HTA-Berichte zu genetischen Testverfahren angesehen werden. Wir haben auf eine Recherche nach kommerziell erstellten HTA-Berichten verzichtet und außerdem keinen Versuch unternommen, PTABerichte zu genetischen Testverfahren aufzufinden. Kommerzielle HTA-Berichte werden häufig mit 361u H TA - B e r i c h t e System inzwischen nicht mehr angeboten wird, haben wir auf eine detaillierte Darstellung der Recherche verzichtet. Unsere Rechercheergebnisse können nicht als „repräsentativ“ für die Gesamtzahl der publizierten HTA-Berichte zu genetischen Testverfahren angesehen werden. Wir haben auf eine Recherche nach kommerziell erstellten HTA-Berichten verzichtet und außerdem keinen Versuch unternommen, PTA-Berichte zu genetischen Testverfahren aufzufinden. Kommerzielle HTA-Berichte werden häufig mit einer sehr speziellen Fragestellung für den Auftraggeber erstellt, so dass die Public Health Perspektive nur einen untergeordneten Stellenwert einnimmt. In der Regel sind diese Berichte auch nicht kostenfrei zugänglich. Auf die Recherche nach PTA wurde verzichtet, weil ihre Fragestellungen selten auf die Information von konkreten Entscheidungen zugeschnitten sind. Sie beschäftigen sich zwar häufig mit ethischen und gesellschaftlichen Technikfolgen, räumen aber konkreten Aussagen zu Sicherheit und Wirksamkeit eines Technologieeinsatzes eher wenig Raum ein (Hennen 2001). Zur exemplarischen Analyse wurden die Themen „Fragile-X-Syndrom“ und „Mamma-Karzinom“ ausgewählt. Für „Fetale Chromosomenanomalien“ lagen zwar mehr Berichte vor, allerdings waren die zum Screening verwendeten Verfahren so heterogen (zytogenetische Methoden, DNA-basierte Methoden, Nachweis von Stoffwechselprodukten), dass uns eine vergleichende Analyse der ethischen Implikationen nicht zielführend erschien. Alle ausgewählten Berichte zu den beiden Beispielthemen konnten im Volltext von den Internetseiten der erstellenden Institutionen heruntergeladen werden. Die strukturierte Erfassung der ethischen Aspekte in den genannten HTABerichten wurde mithilfe eines Leitfadens durchgeführt. 3.2.Der Leitfaden Als Hilfsmittel für die Analyse der HTA-Berichte wurde ein Leitfaden entworfen, der für jeden Bericht einzeln zur Dokumentation folgender Aussagen eingesetzt wurde: n Policy Question n Beschreibung der zu bewertenden Technologie (Test und Substrat; analytische Testcharakteristika) n Beschreibung der Erkrankung bzw. des Erkrankungsrisikos, zu deren Erkennung der Test eingesetzt wird; t362 der erstellenden Institutionen heruntergeladen werden. Die strukturierte Erfassung der ethischen Aspekte in den genannten HTA-Berichten wurde mithilfe eines Leitfadens durchgeführt. 3.2 Der Leitfaden G e n e tder i k füri njeden P uBeblic Health Als Hilfsmittel für die Analyse der HTA-Berichte wurde ein Leitfaden entworfen, richt einzeln zur Dokumentation folgender Aussagen eingesetzt Te i l 2 :wurde: Integration von Genetik in Public Health • Policy Question • Beschreibung der zu bewertenden Technologie (Test und Substrat; analytische Testcharakten Indikationsstellung für den Testeinsatz (Screening oder diagnostische ristika) • Beschreibung der Erkrankung bzw. des Erkrankungsrisikos, zu deren Erkennung der Test n im HTA-Bericht diskutierte Folgen des Technologieeinsatzes (physisch, eingesetzt wird; • Indikationsstellung für den Testeinsatz (Screening oder diagnostische Maßnahme) • im HTA-Bericht diskutierte Folgen des Technologieeinsatzes (physisch, psychisch, sozial, ökonomisch für die Zielperson, das familiäre und weitere soziale Umfeld und für die GesellAbschließend erfolgt die Einordnung der angesprochenen ethischen Aspekte schaft). Maßnahme) psychisch, sozial, ökonomisch für die Zielperson, das familiäre und weitere soziale Umfeld und für die Gesellschaft). nach den Prinzipien von Beauchamp und Childress, die Feststellung, ob eine Diskussion der ethischen Implikationen vorgenommen wurde und Abschließend erfolgt die Einordnung der angesprochenen ethischen Aspekte nach den Prinzipien von welche Auswirkungen diese Diskussion auf die Schlussfolgerung der HTABeauchamp und Childress, die Feststellung, ob eine Diskussion der ethischen Implikationen vorgeBerichte, d.h. auf die Beantwortung der Policy Question hat. nommen wurde und welche Auswirkungen diese Diskussion auf die Schlussfolgerung der HTABerichte, d.h. auf die Beantwortung der Policy Question hat. 4. Ergebnisse 4 Ergebnisse 4.1 4.1.Fragile-X-Syndrom Fragile-X-Syndrom Zum Thema Fragile-X-Syndrom waren fünf HTA-Berichte aus drei ver- schiedenen Institutionen unserem Rechercheergebnis enthalten. Dabeiinist Zum Thema Fragile-X-Syndrom waren fünfinHTA-Berichte aus drei verschiedenen Institutionen unserem Rechercheergebnis enthalten. Dabei besonders interessant, drei Berichte aus dem besonders interessant, dassistdrei Berichte aus demdass gleichen HTA-Programm gleichen HTA-Programm aus Großbritannien stammen aufeinander aufbauen. aufbauen. aus Großbritannien stammen und und zumzum TeilTeil aufeinander Titel Jahr Land Institution Umfang Screening for fragile X syndrome 1997 GB NCCHTA 84 S. An assessment of screening strategies for fragile X syndrome in the UK 2001 GB NCCHTA 101 S. Screening for fragile X syndrome: a literature review and modelling study 2003 GB NCCHTA 132 S. Le Syndrome du X-Fragile: La Place du diagnostic moléculaire et du dépistage dans une Approche intégrée des Services. 2001 CA AETMIS 244 S. Tabelle 2: HTA-Berichte zum Fragile-XSyndrom (Fragile X Syndrome: The role of molecular diagnosis and screening in an integrated approach to services.) Genetic tests for fragile X syndrome 2002 Aus MSAC 60 S. Tabelle 2: HTA-Berichte zum Fragile-X-Syndrom Legende: + Informationen direkt angegeben; (+) Information indirekt berichtet; - keine Information angegeben Methoden 1 Murray, Cuckle, Taylor, et al. (1997) 11 2 Pembrey, Barnicoat, Carmicheal, et al. (2001) 3 Song, Barton, Sleightholme, et al. (2003) 4 Medical Services Advisory Committe (2002) 5 Blancquaert, Caron (2002) 363u H TA - B e r i c h t e 4.1.1. Policy Question 4.1.1.1. Policy Question Folgt man der Definition von HTA von Liberati (1997), dann sind alle vorliegenden fünf Berichte zum Fragile-X-Syndrom eindeutig „pragma4.1.1 HTA-Berichte. Policy QuestionSie / Beschreibung derder Krankheit /Beschreibung Technologie tische“ wurden mit Zielsetzung erstellt, der gesundheitspolitischen Entscheidungsträgern valide Informationen zum Nutzen 4.1.1.1 Policy Question genetischer Screeningstrategien nach Fragile-X-Mutationen zu liefern. Für man der von HTA von Liberatilässt (1997), sind alle vorliegenden fünf Berichte zum denFolgt Kontext derDefinition fünf vorliegenden Berichte sichdann „Entscheidungsträger“ Fragile-X-Syndrom eindeutig "pragmatische" HTA-Berichte. Sie wurden mit der Zielsetzung erstellt, mit „Kostenträger“ gleichsetzen, da alle Berichte aus Ländern mit staatlich gesundheitspolitischen Entscheidungsträgern valide Informationen zum Nutzen genetischer Screefinanzierten Gesundheitssystemen stammen. ningstrategien nach Fragile-X-Mutationen zu liefern. Für den Kontext der fünf vorliegenden Berichte lässt sich "Entscheidungsträger" mit "Kostenträger" gleichsetzen, da alle Berichte aus Ländern mit Diestaatlich Differenziertheit eigentlichen gesundheitspolitischen Fragestellungen finanziertender Gesundheitssystemen stammen. (Policy Questions) ist dabei unterschiedlich. Legt man die Anforderungen an Die Differenziertheit der eigentlichen gesundheitspolitischen Fragestellungen (Policy Questions) ist dendabei Informationsgehalt einer Question“ander Group 4einer des "Policy Question" unterschiedlich. Legt man„Policy die Anforderungen denWorking Informationsgehalt ECAHI Projektes zugrunde, nur die drei Berichte aus dem der Working Group 4 des erfüllen ECAHI Projektes zugrunde, erfüllen nurNCCHTA die drei Berichte aus dem alleNCCHTA Anforderungen: alle Anforderungen: T Frage Tabelle 3: Policy Questions, Fragile-X-Syndrom: NCCHTA 19971 NCCHTA 20012 NCCHTA 20033 MSAC4 AETMIS5 Wer initiierte den Report? (+) (+) (+) (+) (+) Wer finanzierte den Report? (+) (+) (+) (+) (+) Warum wird die Bewertung jetzt gebraucht? + + + - + Welche Entscheidung soll unterstützt werden? + + + + - Wer sind die Adressaten? + + + + - A u e v Tabelle 3: Policy Questions, Fragile-X-Syndrom: Legende: + Informationen direkt angegeben; (+)(+) Information indirekt berichtet; - keine Legende: + Informationen direkt angegeben; Information indirekt berichtet; - keine Information angegeben Information angegeben 1 Murray, Cuckle, Taylor, et al. (1997) 4 D d T w 1 Murray, Cuckle, Taylor, et al. (1997) 2 Pembrey, Barnicoat, Carmicheal, et al. (2001) 2 Pembrey, Barnicoat, Carmicheal, et al. (2001) 3 Song, Barton, Sleightholme, et al. (2003) 3 Song, Barton, Sleightholme, et al. (2003) 4 Medical Services Advisory Committe (2002) 5 Blancquaert, Caron (2002) Committe (2002) 4 Medical Services Advisory t364 F d D z 5 Blancquaert, Caron (2002) Die Fragen nach Auftraggeber und Geldgeber für die Assessments werden in den Berichten, mit Ausnahme des AETMIS Berichtes, nicht explizit erwähnt. Bei den herausgebenden Einrichtungen handelt Die Fragen nach Auftraggeber und Geldgeber für die Assessments werden in es sich jedoch durchweg um Behörden, die zumindest mittelbar an die staatlichen Gesundheitssysteme den Berichten, mit Ausnahme des AETMIS Berichtes, nicht explizit erwähnt. angebunden sind, und daher die Projekte aus öffentlichen Mitteln finanzieren. Die Berichte aus dem BeiNCCHTA den herausgebenden Einrichtungen handelt sich jedoch durchweg um als Auftragsforund der australische Bericht wurden vones den herausgebenden Institutionen Behörden, die zumindest mittelbar an dievergeben. staatlichen Gesundheitssysteme schungsprojekte an Universitätsabteilungen Der AETMIS Bericht entstand innerhalb eines angebunden sind, und daher die Projekte aus öffentlichen Mitteln finanzieForschungsprogramms zur Evaluation genetischer Testverfahren durch eine agentureigene Forren.schungsabteilung. Die Berichte aus dem NCCHTA und der australische Bericht wurden • vonAETMIS den herausgebenden alsdie Auftragsforschungsprojekte an gibt keine präziseInstitutionen Entscheidung an, durch den Report vorbereitet werden soll. Die übri- V b w H gen Berichte sollten Entscheidungsträger informieren, ob, und wenn ja, in welcher Form staatlich finanzierte Screeningprogramme für das Fragile-X-Syndrom eingeführt werden sollen. Dabei wird schon in der "Policy Question" angedeutet, welche Dimensionen von Technologiefolgen dabei angesprochen werden sollen. Ergebnisse 12 • • • • • ( " F s Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Universitätsabteilungen vergeben. Der AETMIS Bericht entstand innerhalb eines Forschungsprogramms zur Evaluation genetischer Testverfahren durch eine agentureigene Forschungsabteilung. AETMIS gibt keine präzise Entscheidung an, die durch den Report vorbereitet werden soll. Die übrigen Berichte sollten Entscheidungsträger informieren, ob, und wenn ja, in welcher Form staatlich finanzierte Screeningprogramme für das Fragile-X-Syndrom eingeführt werden sollen. Dabei wird schon in der „Policy Question“ angedeutet, welche Dimensionen von Technologiefolgen dabei angesprochen werden sollen. NCCHTA, 1997 Effizienz: Senkung der Prävalenz und Auffinden von Fällen im Verhältnis zu finanziellen und "humanen" Kosten. NCCHTA, 2001 Umsetzbarkeit und Akzeptanz von Screeningstrategien, in der sehr knapp gehaltenen Policy Question keine weiteren Angaben zu den Dimensionen der Bewertung. NCCHTA, 2003 Bezieht sich auf die beiden vorangegangenen Berichte; Kostenwirksamkeit. MSAC, 2002 Sicherheit, Wirksamkeit (gesundheitliche und psychosoziale Ergebnisse), Kostenwirksamkeit. Tabelle 4: Intensionen der HTA Bericht zum Fragile-X-Syndrom Tabelle 4: Intensionen der HTA Bericht zum Fragile-X-Syndrom AETMIS erwähnt in der Policy Question keine Zielgrößen, anhand derer der Nutzen von Screening- und / oder Diagnosemaßnahmen bewertet AETMIS erwähnt in der Policy Question keine Zielgrößen, anhand derer der Nutzen von Screeningwerden soll. Es wird aber angeführt, dass „many social and ethical issues und / oder Diagnosemaßnahmen bewertet werden soll. Es wird aber angeführt, dass "many social and surrounding the identification of the …“ inunddie Planungs- und ethical issues surrounding the identification of the syndrome …"syndrome in die PlanungsOrganisationsOrganisationsvorschläge eingehen sollen, die dem Bedarf betroffener vorschläge eingehen sollen, die dem Bedarf betroffener Individuen und ihrer Familien gerecht werden. ihrer Familien gerecht werden. Fazit: Drei der fünf Individuen Berichte zumund Fragile-X-Syndrom deuten bereits in der Policy Question an, dass die Bewertung der Technologie über die Bewertung des rein medizinischen Nutzens hinausgehen soll. Fazit:"Ethik" Drei der fünf Berichte zum allerdings Fragile-X-Syndrom deuten bereits in der Dabei wird der Terminus in der "Policy Question" nur in einem der Berichte expliPolicy Question an, dass die Bewertung der Technologie über die Bewertung zit verwendet (AETMIS 2002). des rein medizinischen Nutzens hinausgehen soll. Dabei wird der Terminus 4.1.1.2 Beschreibung der Krankheit „Ethik“ in der „Policy Question“ allerdings nur in einem der Berichte expliDie Beschreibung der HTA-Berichten soll (neben der Beschreibung der Technologie) zit Krankheit verwendetin (AETMIS 2002). den Entscheidungsträger befähigen, das Gesundheitsproblem und die im HTA ermittelten Folgen des Technologieeinsatzes adäquat Beschreibung beurteilen zu können. Dabei sollen folgende Aspekte angesprochen 4.1.1.2. der Krankheit werden: Die Beschreibung der Krankheit in HTA-Berichten soll (neben der • "Krankheitsmechanismus" Pathologie) Beschreibung(Ursachen, der Technologie) • gen, das Gesundheitsproblem "Klinik" (Erscheinungsbild, Verläufe, Prognose) und die im HTA ermittelten Folgen des den Entscheidungsträger befähi- • adäquat beurteilen zu können. Dabei sollen folgende "Outcomes"Technologieeinsatzes (Konsequenzen, Endzustände) • Aspekte angesprochen werden: "Behandlungsmöglichkeiten" (Status Quo, Alternativen, Versorgungsstand) • "Epidemiologie" (Inzidenz, Prävalenz) • "Zielgruppe" (Alter, Geschlecht, Risikofaktoren) n „Krankheitsmechanismus“ (Ursachen, Pathologie) n „Klinik“ (Erscheinungsbild, Verläufe, Prognose) (nach Busse & Orvain n2002) „Outcomes“ (Konsequenzen, Endzustände) Von allen vorliegenden HTA-Berichten werden diese Aspekte in unterschiedlicher Ausführlichkeit behandelt. Im Folgenden wird daher auf die Wiedergabe der Inhalte verzichtet sondern nur angemerkt, wenn sich in den einzelnen Abschnitten inhaltlich relevante Unterschiede in den Darstellungen der HTA-Berichte fanden. 365u "Krankheitsmechanismus" Für die Folgenabschätzung der weiter unten angeführten Screeningansätze ist ein grundlegendes Verständnis für die genetischen Grundlagen und den Erbgang der Störung erforderlich. Die ausführlichste H TA - B e r i c h t e n „Behandlungsmöglichkeiten“ (Status Quo, Versorgungsstand) n „Epidemiologie“ (Inzidenz, Prävalenz) n „Zielgruppe“ (Alter, Geschlecht, Risikofaktoren) (nach Busse & Orvain 2002) Alternativen, Von allen vorliegenden HTA-Berichten werden diese Aspekte in unterschiedlicher Ausführlichkeit behandelt. Im Folgenden wird daher auf die Wiedergabe der Inhalte verzichtet sondern nur angemerkt, wenn sich in den einzelnen Abschnitten inhaltlich relevante Unterschiede in den Darstellungen der HTA-Berichte fanden. „Krankheitsmechanismus“ Für die Folgenabschätzung der weiter unten angeführten Screeningansätze ist ein grundlegendes Verständnis für die genetischen Grundlagen und den Erbgang der Störung erforderlich. Die ausführlichste Beschreibung dieser Hintergründe erfolgt im NCCHTA-Bericht von 1997, die folgenden britischen und der australische Bericht nehmen direkt auf diese Publikation Bezug. Der grundlegende genetische Defekt liegt in einer als zytogenetisch „fragil“ imponierenden Region auf dem FRM-I Gen (Xq27.3). Dort findet sich ein Abschnitt mit einer variablen Anzahl von CGG-Repeats, in der Regel 29 oder 30. Die pathologische Veränderung beim Fragile-X-Syndrom besteht in einer Erhöhung der Anzahl der Repeats. Das FMR-I Gen transkribiert normalerweise ein zytoplasmatisches Protein, FMRP, welches in allen Zellen in niedriger Konzentration, in Hoden- und in Gehirnzellen in höherer Konzentration anzutreffen ist. Überschreitet die CGG-Repeatzahl etwa 200, findet keine Transkription statt – es kommt zur Ausprägung des Fragile-X-Syndroms. Es besteht Konsens, eine Repeatzahl von ≥ 200 als „Vollmutation“ zu bezeichnen. Charakteristisch für das Fragile-X-Syndrom ist jedoch der dynamische Charakter der Mutation, in betroffenen Familien kann sich bei Weitervererbung des betroffenen Allels die CGG-Repeatzahl von Generation zu Generation erhöhen (Expansion), bis es zur Ausprägung der Vollmutation kommt. Wiederholungsfrequenzen, von denen aus die Entwicklung einer Vollmutation innerhalb einer Generation beobachtet wurde, werden als „Prämutation“ bezeichnet. Die Grenzwerte zwischen „normal“, „Prämutation“ und „Vollmutation“ sind kritisch, wenn die Prävalenz der Veränderungen bestimmt werden soll und wenn, z.B. in einer Beratungssituation, das Risiko ein betroffenes Kind zu haben, geschätzt werden soll. In den HTA-Berichten werden hier leicht abweichende Werte t366 kommt zur Ausprägung des Fragile-X-Syndroms. Es besteht Konsens, eine Repeatzahl von ! 200 als "Vollmutation" zu bezeichnen. Charakteristisch für das Fragile-X-Syndrom ist jedoch der dynamische Charakter der Mutation, in betroffenen Familien kann sich bei Weitervererbung des betroffenen Allels die CGG-Repeatzahl von Generation zu Generation erhöhen (Expansion), bis es zur Ausprägung der Vollmutation kommt. Wiederholungsfrequenzen, von denen aus die Entwicklung einer Vollmutation innerhalb einer Generation G ebeobachtet n e t i k wurde, i n P werublic Health den als "Prämutation" bezeichnet. Die Grenzwerte zwischen "normal", "Prämutation" und "Vollmuta Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h tion" sind kritisch, wenn die Prävalenz der Veränderungen bestimmt werden soll und wenn, z.B. in einer Beratungssituation, das Risiko ein betroffenes Kind zu haben, geschätzt werden soll. In den HTA-Berichten werden hier leicht abweichende sie betreffen vor allemnormalen eine "Grauangegeben, sie betreffen vorWerte allemangegeben, eine „Grauzone“ zwischen und zone" zwischen normalen und Prämutationsallelen: Prämutationsallelen: NCCHTA 1997 NCCHTA 2001 NCCHTA 2003 MSAC AETMIS Vollmutation ! 200 > 200 ! 200 ! 200-230 ! 200 Prämutation 55-199 61-200 55-199 55-200 55-200 Grauzone "um 55" 41-60 40-60 - - Normal < 55 < 41 < 55 5-55 6-54 Tabelle 5: Allelgröße und Mutationsdefinition, Fragile-X-Syndrom Tabelle 5: Allelgröße und Mutationsdefinition, Fragile-X-Syndrom Eine entscheidende Rolle spielen weiterhin bei der Risikobestimmung die Expansionswahrscheinlichkeiten von Prämutationen zu Vollmutationen. Eine entscheidende Rolle spielen weiterhin bei der Risikobestimmung die ExpansionswahrscheinlichHierauf gehen die BerichteHierauf von MSAC undBerichte AETMIS den drei keiten von Prämutationen zu Vollmutationen. gehen die von nicht MSACein. undInAETMIS britischen Berichten wurden, vor dem Hintergrund fehlender belastbarer nicht ein. In den drei britischen Berichten wurden, vor dem Hintergrund fehlender belastbarer empiriempirischer Daten, statistische eingesetzt.Daten Diewurden in das scher Daten, statistische Modellierungen eingesetzt. DieModellierungen in das Modell einfließenden aus systematischen Literaturübersichten Prävalenz vonaus CGG-Frequenzen, Prävalenz von VollmuModell einfließendenzur Daten wurden systematischen Literaturübersichten tations- und Prämutationsträger/innen der Bevölkerung und betroffenen erhalten. Die Mozur Prävalenz vonin CGG-Frequenzen, Prävalenz Familien von Vollmutationsund dellierungen zeigten, dass die Expansionswahrscheinlichkeit abhängig istund von der CGG-Frequenz der Prämutationsträger/innen in der Bevölkerung betroffenen Familien Prämutation. Der erhalten. NCCHTA Die Report von 2003 berücksichtigt diedass beiden Berichte und Modellierungen zeigten, dievorangegangenen Expansionswahrscheinlich ermittelt eine mittlere Übergangswahrscheinlichkeit von Prämutation zur Vollmutation innerhalb von keit abhängig ist von der CGG-Frequenz der Prämutation. Der NCCHTA Fragile-X-Familien von 63% (95% KI: 60-66%), für in der Allgemeinbevölkerung angetroffene PräReport von 2003 berücksichtigt die beiden vorangegangenen Berichte und mutationen beträgt die Expansionswahrscheinlichkeit im Mittel ca. 10% (95% KI: 5,5-14%). ermittelt eine mittlere Übergangswahrscheinlichkeit von Prämutation zur Vollmutation innerhalb von Fragile-X-Familien von 63% (95% KI: 60"Klinik" 66%), für in der Allgemeinbevölkerung angetroffene Prämutationen beträgt Zentrales Symptom, den "Krankheitswert" des Fragile-X-Syndroms ist5,5-14%). eine geistidie welches Expansionswahrscheinlichkeit im Mittel ca. 10%bestimmt, (95% KI: ge Retardierung, die mit zunehmendem Alter zunimmt. Dysmorphien, Verhaltensauffälligkeiten und Makroorchidismus bei Jungen können ebenfalls vorhanden sein, haben jedoch per se keinen Krank„Klinik“ heitswert. Zentrales Symptom, welches den „Krankheitswert“ des Fragile-X-Syndroms Häufigkeit und Ausprägung des Phänotyps unter Träger/innen der Vollmutation sind wichtige Angabestimmt, ist eine geistige Retardierung, die mit zunehmendem Alter ben, die bei der Bewertung von Diagnostik- und Screeningstrategien eine zentrale Rolle spielen. Zu zunimmt. Dysmorphien, Verhaltensauffälligkeiten und Makroorchidismus diesem Punkt werden durchaus differente Angaben in den HTA-Berichten gefunden: bei Jungen können ebenfalls vorhanden sein, haben jedoch per se keinen Krankheitswert. Ergebnisse 14 Häufigkeit und Ausprägung des Phänotyps unter Träger/innen der Vollmutation sind wichtige Angaben, die bei der Bewertung von Diagnostikund Screeningstrategien eine zentrale Rolle spielen. Zu diesem Punkt werden durchaus differente Angaben in den HTA-Berichten gefunden: Während die Angaben zu den Schweregraden der Beeinträchtigung homogen sind, liegen die geschätzten Anteile von beeinträchtigten Individuen an der Gesamtheit der Mutationsträger (und damit das Risiko, dass ein Kind mit nachgewiesener Mutation eine relevante Beeinträchtigung aufweist) für Männer zwischen 100% und 80% und für Frauen zwischen 55% und 33%. 367u H TA - B e r i c h t e NCCHTA 1997 NCCHTA 2001 NCCHTA 2003 MSAC AETMIS Männer " .. Approximately 80% of affected males are moderately to profoundly mentally impaired, with an IQ of less than 50.” "..The degree of impairment can vary from profound handicap to isolated learning problems but most affected males have a severe to moderate degree of impairment with IQs in the range of 35-49." "…Affected males are generally unable to live alone…" "… male foetuses with FM are certainly affected…" "..in males an FM or mosaic mutation will usually result in the characteristic features of the FX-Syndrome (intellectual disability), some FM and mosaic males will be clinically normal…" "… most affected boys present with moderate to severe mental retardation…" Frauen "…. Females with a F-XSyndrome usually display a milder phenotype, the majority having a borderline low IQ of 70-85…" "…about a third of female gene carriers are intellectually impaired, but ususally less than males." "..while affected females may have learning difficulties, but may live independently…." "… only about half of female foetuses with FM will be affected…" "… Females will have a varying phenotype, with approximately 50% having mental disability…." "… while only 55% of affected girls will have mental retardation, generally mild to moderate…." Tabelle 6: Penetranz des Fragile-X-Syndroms (Hervorhebungen DL) In females only half of the FM Carriers are affected. Tabelle 6: Penetranz des Fragile-X-Syndroms (Hervorhebungen DL) „Outcomes“ Für den Betroffenen: Die Folgen (Outcomes) des Fragile-X-Syndroms für die Angaben Schweregraden homogenund sind, liegen die gedieWährend Betroffenen werdenzuin den erster Linie durchder dasBeeinträchtigung intellektuelle Defizit schätzten Anteile von beeinträchtigten Individuen an der Gesamtheit der Mutationsträger (und damit assoziierte Verhaltensstörungen bestimmt. Dabei sind männliche Betroffene das Risiko, dass ein Kind mit nachgewiesener Mutation eine relevante Beeinträchtigung aufweist) für mit durchschnittlichen IQs von unter 50 meistens nicht in der Lage, ein Männer zwischen 100% und 80% und für Frauen zwischen 55% und 33%. eigenständiges Leben zu führen. Obwohl auch kardiale, endokrine, orthopädische und neurologische Dysfunktionen bei den Betroffenen beobachtet "Outcomes" wurden, wird von allen HTA-Berichten eine relevante Beeinträchtigung den Betroffenen: Die Folgenverneint. (Outcomes)Bei des betroffenen Fragile-X-Syndroms für die werden in derFürphysischen Gesundheit Frauen ist Betroffenen der erster Linie durch das und assoziierte Verhaltensstörungen bestimmt. Dabei sind Symptomkomplex im intellektuelle Vergleich zuDefizit den Männern weniger stark ausgeprägt Betroffene mitder durchschnittlichen IQs von unter 50 meistens der Lage, ein eigen(s. männliche o.). Bei Trägerinnen Prämutation wird überzufällig häufig nicht eine in vorständiges Leben zubeobachtet führen. Obwohl auch kardiale, orthopädische und neurologische Dyszeitige Menopause (NCCHTA 2001;endokrine, AETMIS). funktionen bei den Betroffenen beobachtet wurden, wird von allen HTA-Berichten eine relevante Beeinträchtigung der physischen Gesundheit verneint. Bei betroffenen Frauen ist der Symptomkomplex Für die Familie: Auf die Folgen des Fragile-X-Syndrom für Familien im Vergleich zu den Männern weniger stark ausgeprägt (s. o.). Bei Trägerinnen der Prämutation wird mitüberzufällig betroffenen Kindern gehen vor allem die Berichte von AETMIS und häufig eine vorzeitige Menopause beobachtet (NCCHTA 2001; AETMIS). NCCHTA 1997 und 2001 ein. Dabei werden besonders soziale und finanzielle Probleme im Zusammenhang mit der Versorgung von geistig behinderten Familienangehörigen genannt, sowohl vor als auch nach Kenntnis der Diagnose. Zu psychischen und intrafamiliären sozialen Belastungen führt darüber hinaus die unsichere Prognose für weitere Nachkommen bzw. der Verzicht auf (weitere) Kinder. Ergebnisse t368 15 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Für die Gesellschaft: Aus gesellschaftlicher Perspektive werden in den Berichten des NCCHTA in erster Linie die finanziellen Folgen des FragileX-Syndrom angesprochen, als Kosten pro zu versorgendem Fall / Jahr (20.000 Pfund) und Kosten für das NHS von England und Wales / Jahr (200 Mio. Pfund) (NCCHTA, 2003). „Behandlungsmöglichkeiten“ Das Fragile-X-Syndrom ist nicht heilbar. Inwieweit der Verlauf und die Ausprägung des intellektuellen Defizits mit seinen psychischen und sozialen Folgen für Individuum, Familie und Gesellschaft beeinflussbar sind, wird in den fünf HTA-Berichten unterschiedlich beurteilt. Die Berichte des MSAC und NCCHTA sparen die Frage nach der Behandelbarkeit des Fragile-XSyndrom komplett aus, der Bericht NCCHTA 2003 konstatiert ein Defizit an wirkungsvollen Behandlungsmöglichkeiten. Die Berichte NCCHTA, 1997 und AETMIS dagegen nehmen ausführlich Stellung zu symptomatischen Therapie- und Fördermöglichkeiten für betroffene Kinder. Dabei wird vor allem im AETMIS Bericht auf die Notwendigkeit von Frühförderung in einem multidisziplinären Programm hingewiesen, da zu einem späteren Zeitpunkt (nach dem 3. Lebensjahr) vor allem die Verhaltensstörungen nicht mehr aufzufangen seien (Evidenz?). In beiden Berichten wird festgehalten, dass die Wirksamkeit der (häufig vorgeschlagenen) Folsäurebehandlung auf die kognitiven Defizite bisher nicht erwiesen werden konnte. „Epidemiologie“ Die Angaben zur Häufigkeit der Fragile-X-Mutation in verschiedenen Bevölkerungsgruppen werden in allen Berichten durch mehr oder weniger systematische Übersichten über die Ergebnisse epidemiologischer Studien gegeben. Die umfangreichste (da zuletzt veröffentlichte) Übersicht findet sich bei NCCHTA 2003. Es werden Häufigkeiten der Vollmutation und der Prämutation unter lernbehinderten Personen und in der Allgemeinbevölkerung angegeben, jeweils differenziert nach Geschlecht. Daraus lässt sich eine Häufigkeit für das Fragile-X-Syndrom in der männlichen Allgemeinbevölkerung von etwa 1:4000 ableiten. Die Autoren gehen von der Annahme aus, dass das Allel mit der gleichen Häufigkeit in der weiblichen Allgemeinbevölkerung vorkommt, diese aber nur zu 50% von einer klinischen Manifestation betroffen ist. Die Häufigkeit wird damit auf ca. 1:8000 in der weiblichen Allgemeinbevölkerung geschätzt. 369u H TA - B e r i c h t e Häufigkeit der Vollmutation bei Männern mit Lernbehinderung unklarer Ätiologie Anzahl der Studien Mutationsträger/innen Untersuchte Personen % 21 3,52 180 5107 Häufigkeit der Vollmutation bei Männern mit Lernbehinderung, inklusive bekannte Ätiologie 21 187 10899 1,72 16006 2,29 Alle Männer mit Lernbehinderung 42 367 Häufigkeit der Vollmutation bei Frauen mit Lernbehinderung unklarer Ätiologie 11 9 1462 0,62 Häufigkeit der Vollmutation bei Frauen mit Lernbehinderung, inklusive bekannte Ätiologie 11 48 7215 0,67 8677 0,66 Alle Frauen mit Lernbehinderung 22 57 Vollmutation (Fragile-X-Syndrom) in der männlichen Allgemeinbevölkerung [als Rate] Tabelle 7: Häufigkeit der Fragile-XMutationen Anzahl der Studien Mutationsträger/innen Untersuchte Personen /10000 8 137 8701 2,42 4186 0 45817 1,53 Prämutation in der männlichen Allgemeinbevölkerung 3 0 Prämutation in der weiblichen Allgemeinbevölkerung 7 7 Tabelle 7: Häufigkeit der Fragile-X-Mutationen „Zielgruppe“ In Daraus den HTA-Berichten werden drei Zielgruppen für genetische Tests aufAllgemeinbevölkelässt sich eine Häufigkeit für das Fragile-X-Syndrom in der männlichen Fragile-X und Prämutationen genannt: rung vonMutationen etwa 1:4000 ableiten. Die Autoren gehen von der Annahme aus, dass das Allel mit der gleichen Häufigkeit in der weiblichen Allgemeinbevölkerung vorkommt, diese aber nur zu 50% von einer • klinischen Klinisch Manifestation auffällige (lernbehinderte) zur damit Diagnostik als in der weiblichen betroffen ist. DieIndividuen: Häufigkeit wird auf ca. und 1:8000 Allgemeinbevölkerung geschätzt. „Case Finding“ für Kaskadenscreening-Strategien. • Familien von Fragile-X-Betroffenen als Hochrisikogruppe • "Zielgruppe" Die Allgemeinbevölkerung, im Rahmen von Neugeborenenscreeningprog bzw. nur Frauen Rahmen von präkonzeptionellen präna- Mutationen und Inrammen den HTA-Berichten werdenimdrei Zielgruppen für genetische Tests oder auf Fragile-X talen Screeningstrategien. Prämutationen genannt: • Klinisch auffällige (lernbehinderte) Individuen: zur Diagnostik und als "Case Finding" für 4.1.1.3. Beschreibung der Technologie Kaskadenscreening-Strategien. In •den Berichten unterschiedlicheals Testverfahren zu Diagnostik von Familien werden von Fragile-X-Betroffenen Hochrisikogruppe und• Screening auf Fragile-X-Syndrom Mutationsund Prämutationsträgern Die Allgemeinbevölkerung, im Rahmen von Neugeborenenscreeningprogrammen bzw. nur beschrieben. Frauen im Rahmen von präkonzeptionellen oder pränatalen Screeningstrategien. Die4.1.1.3 Ausführungen zur der analytischen Beschreibung TechnologieTestqualität beruhen in zwei der fünf Berichte auf systematischen Literaturanalysen, in einem Bericht von auf und „intrinIn den Berichten werden unterschiedliche Testverfahren zu Diagnostik Screening auf Fragilesischen“ Kenntnissen, Berichten ist die Herkunft der Informationen X-Syndrom Mutations-bei undzwei Prämutationsträgern beschrieben. zu den Testcharakteristika unklar. Ergebnisse t370 17 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h NCCHTA, 1997 NCCHTA, 2001 NCCHTA, 2003 MSAC Zytogenetik + PCR + Southern Blot Blotting von PCR Produkten + - + - + + + + + + + + + + - - - - PCR + selektiver Southern Blot + + + + - Southern Blot + selektive PCR - - - - + FMRP Proteinnachweis + + - - + PCR basierter Methylierungsnachweis + - - - - Sequenzierung - + - - - systematischer Review + unklar - + AETMIS Tabelle 8: Genetische Testmethoden zum Fragile-X-Syndrom unklar Tabelle 8: Genetische Testmethoden zum Fragile-X-Syndrom Analytische Testcharakteristika Während der Southern Blot geeignet dender Nachweis von auf vollen Mutationen Die Ausführungen zur analytischen Testqualität beruhen inist, zwei fünf Berichte systematischen Literaturanalysen,und in einem Bericht auf "intrinsischen" Kenntnissen,istbeidie zwei Berichten ist die Her„großen“ Prämutationen zu erbringen, PCR geeignet, normale kunft der Informationen den„kleine“ Testcharakteristika unklar. korrekt zu erfassen. Mit Ausnahme des Allele zu und Prämutationen australischen HTA-Berichtes sind die Autoren sehr zurückhaltend bei der Angabe von quantitativen Daten zur analytischen Sensitivität und Spezifität Analytische Testcharakteristika der DNA-basierten Dievollen Testgüte der Kombination von PCR Während der Southern Blot geeignet ist,Testverfahren. den Nachweis von Mutationen und "großen" Prämutaund, unklaren Fällen, anschließendem Southern Blot wird in einem tionen zu erbringen, istindie PCR geeignet, normale Allele und "kleine" Prämutationen korrekt zuBericht erfasalsdes „…australischen almost 100% Accuracy...“ bezeichnet, zwei weiteren Berichten sen. Mit Ausnahme HTA-Berichtes sind die Autoreninsehr zurückhaltend bei der An-als gabe von quantitativen Daten analytischen Sensitivität Spezifität identifizieren der DNA-basierten „high“. Mitzur Ausnahme des AETMISund Berichtes alleTestverReports fahren. Die Testgüte der Kombination von PCR und, in unklaren Fällen, anschließendem Southern die Kombination von PCR + selektivem Southern Blot als das Verfahren der Blot wird in einem Bericht "… almostnach 100%Fragile-X-Mutationen Accuracy..." bezeichnet, in zwei weiteren Berichten Wahl zumalsScreening und -Prämutationen. Der als "high". Mit Ausnahme des AETMIS Berichtes identifizieren alle Reports die Kombination von AETMIS Bericht wählt die umgekehrte Reihenfolge. PCR + selektivem Southern Blot als das Verfahren der Wahl zum Screening nach Fragile-XMutationen und -Prämutationen. Der AETMIS Bericht wählt die umgekehrte Reihenfolge. Der australische Bericht unternimmt den Versuch für zytogenetische Der australische Bericht unternimmt den Versuch für zytogenetische Methoden, PCR und Southern Methoden, PCR und Southern Blot die analytische Sensitivität und Spezifität Blot die analytische Sensitivität und Spezifität zu ermitteln. Für die Zytogenetik, unter Verwendung zu ermitteln. Für die Zytogenetik, unter Verwendung der DNA basierten der DNA basierten Verfahren als "Goldstandard", wurde die analytische Sensitivität zwischen 15% Verfahren als „Goldstandard“, wurde die analytische Sensitivität zwischen und 77% (je nach verwendetem Cut-off an positiven Zellen) und die Spezifität zwischen 93% und und 77% Werte (je nach verwendetem Cut-off an positiven und die 100% angegeben.15% Die berichteten für die DNA-basierten Verfahren sind schwerZellen) zu interpretiezwischen 93% und 100% angegeben. berichteten Werte die ren, da sie sich Spezifität wechselseitig als "Goldstandard" einsetzten, obwohl Die sie bekanntermaßen nichtfür das DNA-basierten Verfahren sind schwer zu interpretieren, da sie sich wechselgleiche Substrat messen. seitig als „Goldstandard“ einsetzten, obwohl sie bekanntermaßen nicht das gleiche Substrat messen. Ergebnisse 18 371u H TA - B e r i c h t e Die Berichte aus Australien und Kanada weisen darauf hin, dass in ihren Ländern keine käuflichen, nach den gängigen Normen (?) qualitätsgesicherte, Testkits zur Verfügung stehen. Lediglich einer der Berichte geht ausführlich auf Probleme bei der Materialgewinnung ein. Dabei werden technische Aspekte angesproDie Berichte aus Australien und Kanada weisen darauf hin, dass in ihren Ländern keine käuflichen, chen (Versagen der PCR des SouthernTestkits Blot aufgrund mangelhafter nach den gängigen Normen (?)und qualitätsgesicherte, zur Verfügung stehen. Materialqualität, Notwendigkeit neuer Abstriche oder Blutentnahmen) Lediglich einer der Berichte geht ausführlich auf Probleme bei der Materialgewinnung ein. Dabei aber auch rechtliche und psychologischen (Zulässigkeit werden technische Aspekte angesprochen (Versagen Aspekte der PCR und des Southern von Blot aufgrund manBlutentnahmen bei geistig behinderten Erwachsenen, von denen kein „inforgelhafter Materialqualität, Notwendigkeit neuer Abstriche oder Blutentnahmen) aber auch rechtliche med consent“ zu erhalten Zulässigkeit Blutentnahmen zumbehinderten Zwecke Erwachsenen, und psychologischen Aspekteist? (Zulässigkeit von von Blutentnahmen bei geistig des von lernbehinderten Kindern,von fürBlutentnahmen die keinerleizum Zwecke des von Fragile-X-Screenings denen kein "informed consent" zu erhalten ist? Zulässigkeit Fragile-X-Screenings von lernbehinderten Kindern, für die keinerlei therapeutische Konsequenzen therapeutische Konsequenzen entstehen?). entstehen?). Diagnostische Testcharakteristika Die Eignung Testcharakteristika der molekulargenetischen Testverfahren zur Diagnostik eines Diagnostische Fragile-X-Syndroms bzw. zur Bestimmung des zur Risikos für ein Fragile-XDie Eignung der molekulargenetischen Testverfahren Diagnostik eines Fragile-X-Syndroms bzw. Syndrom unter den Nachkommen der getesteten Person hängt weniger der vongetesteten Person zur Bestimmung des Risikos für ein Fragile-X-Syndrom unter den Nachkommen hängtanalytischen weniger von den analytischen Testcharakteristika sondern von vielmehr der Genotyp-Phänotyp den Testcharakteristika sondern vielmehr der von GenotypAssoziation der Störung der und Störung den Übergangswahrscheinlichkeiten einer Prämutation zur vollen MutaPhänotyp Assoziation und den Übergangswahrscheinlichkeiten tion ab (vergl. Abschnitt 4.1.1.2). einer Prämutation zur vollen Mutation ab (vergl. Abschnitt 4.1.1.2). Australien DNA-basierte Testverfahren nicht kommerziell verfügbar; für zytogenetische Testverfahren sind Abrechnungsnummern vorhanden. Der Bericht enthält keine Angaben zum infrastrukturellen / organisatorischen Kontext für Fragile-X Diagnostik oder Screening. Kanada DNA-basierte Testverfahren werden in ausgewählten (3) Laboratorien durchgeführt. Die Zuweisung von Verdachtsfällen zur Diagnostik erfolgt auf unterschiedlichen Wegen (Schulen, Kindergärten, Hausärzte etc.), es gibt keine standardisierte diagnostische Aufarbeitung von Verdachtsfällen. Die Versorgung und Förderung von betroffenen Individuen und Familien erfolgt eher unkoordiniert. (Quebec) Großbritannien Tabelle 9: Infrastruktureller Kontext, FragileX-Syndrom DNA-basierte Testverfahren stehen zur Verfügung. Es gibt kein reguläres Screeningprogramm, aber Neonatalscreening und Kaskadenscreening in betroffenen Familien werden, wenn machbar und akzeptabel, durchgeführt. Die genetische Beratung erfolgt in speziellen humangenetischen Zentren, zu denen Patienten bzw. Familien meist nach Diagnosestellung durch niedergelassene Kinderärzte zugewiesen werden. In etwa der Hälfte der Zentren werden spezielle Fragile-X-Register geführt. Tabelle 9: Infrastruktureller Kontext, Fragile-X-Syndrom 4.1.2 Indikationen 4.1.2. Indikationen InInallen fünf wirdderderEinsatz Einsatz genetischen Testverfahren allen fünf HTA-Berichten HTA-Berichten wird derder genetischen Testverfahren für Screeningzwecke für Screeningzwecke auch implizit die Test Bewertung diskutiert, obwohl auch diskutiert, implizit die obwohl Bewertung als diagnostischer enthaltenals ist – das "Kaskadenscreening" (Screening unter Verwandten Patienten) erfordert beispielsweise eine Strategie des diagnostischer Test enthalten ist – dasvon„Kaskadenscreening“ (Screening "Case Verwandten Finding". Dabei ist schon die übergeordnete Zielsetzung für Screeningstrategien unter von Patienten) erfordert beispielsweise eine Strategie nicht einheitlich. „Case Im MSAC Bericht wird keineistallgemeine Zielsetzung für die vorgeschlagenen des Finding“. Dabei schon die übergeordnete Zielsetzung Screeningmaßnahmen angegeben. Der Bericht des NCCHTA, 1997 definiert zwei übergeordnete Zielsetzungen für für Screeningstrategien nicht einheitlich. Im MSAC Bericht wird keine t372 mögliche Screeningprogramme: die Senkung der Geburtenrate von Fragile-X-Kindern und die Erkennnung von betroffenen Individuen. Im Bericht aus dem NCCHTA von 2001 wird die übergeordnete Bestimmung von Screeningmaßnahmen breiter gefasst: aus Public Health Sicht kann es nicht Ziel einer Screeningmaßnahme sein, die Inzidenz von betroffenen Geburten zu senken. Dies sei vielmehr das Ergebnis, wenn das primäre Ziel erreicht ist: die Erkennung von betroffenen Familien und Indivi- Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h allgemeine Zielsetzung für die vorgeschlagenen Screeningmaßnahmen angegeben. Der Bericht des NCCHTA, 1997 definiert zwei übergeordnete Zielsetzungen für mögliche Screeningprogramme: die Senkung der Geburtenrate von Fragile-X-Kindern und die Erkennnung von betroffenen Individuen. Im Bericht aus dem NCCHTA von 2001 wird die übergeordnete Bestimmung von Screeningmaßnahmen breiter gefasst: aus Public Health Sicht kann es nicht Ziel einer Screeningmaßnahme sein, die Inzidenz von betroffenen Geburten zu senken. Dies sei vielmehr das Ergebnis, wenn das primäre Ziel erreicht ist: die Erkennung von betroffenen Familien und Individuuen und die Durchführung adäquater Beratungsmaßnahmen, die zu einer informierten Familienplanung führen. Der Bericht von 2003 schließt sich dieser Zielsetzung an, greift zusätzlich aber das 1997 formulierte Ziel, der frühen Erkennung von betroffenen Individuen wieder auf. Die gleichen Ziele werden auch im AETMIS Bericht vertreten. duuen und die Durchführung adäquater Beratungsmaßnahmen, die zu einer informierten Familienplazweivonder britischen HTA-Berichte durchgeführte Modellrechnungen nung führen. Der In Bericht 2003 schließt sich dieser Zielsetzung an, greift zusätzlich aber das 1997 kamen zu der Schlussfolgerung, dass aus rein monetärer SichtZiele alle formulierte Ziel, der frühen Erkennung von betroffenen Individuen wieder auf. Die gleichen betrachteten Screeningstrategien (populationsbezogen oder Hochrisiko) als werden auch im AETMIS Bericht vertreten. „effizient“ einzustufen sind. D.h. die finanziellen Aufwendungen für das In zwei der britischen HTA-Berichte durchgeführte Modellrechnungen kamen zu der SchlussfolgeScreeningprogramm geringerScreeningstrategien als die Mittel, die(populationsbezogen für die Versorgung von rung, dass aus rein monetärer Sicht allesind betrachteten oder „nicht-verhinderten“ FällenD.h. aufgewendet werden müssten. für das ScreeHochrisiko) als "effizient" einzustufen sind. die finanziellen Aufwendungen ningprogramm sind geringer als die Mittel, die für die Versorgung von "nicht-verhinderten" Fällen aufgewendet werden müssten. Nicht in allen HTA-Berichten werden alle möglichen Screeningstrategien Nicht in allen HTA-Berichten werden alle möglichen Screeningstrategien bewertet, Übersicht istIm bewertet, eine Übersicht ist der folgenden Tabelle zueine entnehmen. der folgenden Tabelle zu entnehmen. Im Anschluss erfolgt die Darstellung der eigentlichen TechnikAnschluss erfolgt die Darstellung der eigentlichen Technikfolgenabschätz folgenabschätzung, einzeln für jede Screeningstrategien und gegliedert nach betrachteten Folgedimenung, einzeln für jede Screeningstrategien und gegliedert nach betrachteten sionen. Folgedimensionen. NCCHTA NCCHTA NCCHTA 1997 2001 2003 Screeningziel: Identifikation von betroffenen Individuen MSAC AETMIS Neonatales Screening (alle Neugeborenen) + + - - + "Case Finding" (lernbehinderte Kinder od. Erwachsene) + - - - - + + - - + + + + + + Kaskadenscreening mit systematischem "Case Finding" - + + - + Pränatales Screening (Schwangere bzw. Feten) + + + - + Screeningziel: Identifikation von Carriern Präkonzeptionelles Screening (Frauen vor der ersten Schwangerschaft) Kaskadenscreening (Familien von Betroffenen) Tabelle 10: Screeningstrategien, Fragile-XSyndrom Tabelle 10:Screeningstrategien, Fragile-X-Syndrom 373u H TA - B e r i c h t e Neonatales Screening Neonatales Screening auf Fragile-X-Mutationen und Prämutationen ist eine typische bevölkerungsbezogene Low-Risk Screeningstrategie. Ihr Ziel ist einerseits Neonatales Screeningdie Erkennung von betroffenen Kindern, um diese einer Frühförderung zuzuführen bzw. diese „Fälle“und oder Kinder mitist Prämutationen Neonatales Screening auf Fragile-X-Mutationen Prämutationen eine typische bevölkerungsbeals Ausgangspunkt für „Kaskadenscreeningprogramme“ verwenden. zogene Low-Risk Screeningstrategie. Ihr Ziel ist einerseits die zu Erkennung von betroffenen Kindern, um diese einer Frühförderung zuzuführen bzw. diese "Fälle" oder Kinder mit Prämutationen als Aus"Kaskadenscreeningprogramme" zu verwenden. Ingangspunkt den dreifürBerichten, die eine Bewertung von Neonatalen Screeningprogrammen vornehmen, desScreeningprogrammen Technologieeinsatzes In den drei Berichten, die eine werden Bewertungdie vonFolgen Neonatalen vornehmen, werden die die Folgen des Technologieeinsatzes fürdas die übrige Zielperson, für die Familie, dasfür übrige für Zielperson, für die Familie, soziale Umfeld und die soziale Umfeld und für die Gesellschaft benannt: Gesellschaft benannt: Folgendimension medizinisch / physisch für die Zielperson psychisch für die Zielperson sozial - privat (Familie) Vorteile Nachteile Ansatz für Frühförderung – bei unklarer Evidenz zur Wirksamkeit (NCCHTA 1997; NCCHTA 2001; AETMIS) Bei 30% aller Mädchen: 2. Blutentnahme erforderlich (NCCHTA 2001) Stigmatisierung (NCCHTA 2001) Beratung für künftige Schwangerschaften möglich (NCCHTA 2001) Beratungsunsicherheit, wenn Prämutation gefunden wird (AETMIS); Prognose für Mädchen unsicher, wenn FM gefunden wird; Stigmatisierung der Familie, Schuldgefühle bei der Mutter, Vernachlässigung der übrigen Kinder, Eheprobleme, (NCCHTA 2001; AETMIS) sozial - öffentlich (Institutionen) Infrastruktur vorhanden (Zugang zur Zielgruppe, Blutentnahmen) (NCCHTA 1997) gesellschaftlich Tabelle 11: Technologiefolgen, Neonatales Screening, Fragile-Xökonomisch Syndrom Effektivität (Auffinden von Mutationen und Prämutationen) größer als bei Hochrisikostrategien (AETMIS; NCCHTA 2003) Betroffenengruppen: Neugeborenenscreening in 85% befürwortet für Jungen, aber eigentlich "zu spät", ohne das Angebot eines pränatalen Screenings nicht akzeptabel (NCCHTA 2001) - Verständnis der Ursachen für die Retardierung (AETMIS) Infrastruktur vorhanden (s. o.) finanzielle Belastungen der Familie Tabelle 11: Technologiefolgen, Neonatales Screening, Fragile-X-Syndrom Kaskadenscreening Diese Screeningstrategie nimmt ihren Ausgang von einem „Fall“ und richtet sich auf die Erfassung von weiteren Mutations- und Prämutationsträgern im familiären Umfeld. Ziel ist die Risikoaufklärung und Ermöglichung zu einer informierten Familienplanung. In der Regel ist das Kaskadenscreening den Hochrisikostrategien zuzuordnen, einen Bevölkerungsbezug gewinnt es, wenn es mit einem systematischen „Case Finding“ verbunden ist. Dies kann die Anbindung an eine neonatale Screeningstrategie bedeuten oder die t374 Ergebnisse 21 Kaskadenscreening Diese Screeningstrategie nimmt ihren Ausgang von einem "Fall" und richtet sich auf die Erfassung G eistndie e t Risikoaufklärung ik in Public Health von weiteren Mutations- und Prämutationsträgern im familiären Umfeld. Ziel Familienplanung. und Ermöglichung zu einer informierten Te iIn l 2der : IRegel n t e g ist r a tdas i o nKaskadenscreening v o n G e n e t i k i den n Public Health Hochrisikostrategien zuzuordnen, einen Bevölkerungsbezug gewinnt es, wenn es mit einem systematischen "Case Finding" verbunden ist. Dies kann die Anbindung an eine neonatale Screeningstrategie bedeuten oder die systematische Suche Suche nach bei klinisch auffälligen Kindern systematische nachFragile-X-Mutationen Fragile-X-Mutationen bei klinisch auffälligen oder Erwachsenen. Kindern oder Erwachsenen. Folgedimension medizinisch / physisch für die Zielperson "Vorteile" psychisch für die Zielperson Erleichterung durch Ausschluss des Carrierstatus, "normale" Fortpflanzung (NCCHTA 2001); Informierte Familienplanung nach Bestimmung des Carrierstatus und Beratung (NCCHTA, alle; MSAC) sozial - privat (Familie) "Probleme" Cases: keine unmittelbaren Konsequenzen (im Sinne einer Behandlung) für die Person (NCCHTA, alle) Carrier: Entscheidung zur Sterilisation? (MSAC) Cases: psychische Irritation durch notwendige Blutentnahme bei Erwachsenen / Kinder in Case-Finding Strategien; Informed Consent bei geistig Behinderten? (NCCHTA. 2001) Carrier: asymptomatische Personen werden zu "Hochrisikopersonen" – mit folgender psychischer Belastung. Beratung limitiert evtl. Lebens- und Reproduktionsplanung Oftmals Vorkenntnisse in der Familie Kontakt der Zielgruppe nur durch primäre (durch den "Fall") – erleichtert Beratung Angehörige des "Falls" (Cave: Schuldgefühle, Stigmatisierung könnten dies beein(NCCHTA 2001) trächtigen) NCCHTA, 1997 sozial - öffentlich (Institutionen) Beratung von Frauen mit FM kann aus intellektuellen Gründen problematisch sein (NCCHTA 2001) In Australien: Kinder unter 18 dürfen nur getestet werden, wenn es für sie unmittelbare Konsequenzen hat (MSAC) gesellschaftlich Hohe Prätestwahrscheinlichkeit in der Zielgruppe; damit hohe prädiktive Werte (NCCHTA 2003) Geringere "Effektivität" (Zielgröße: aufgefundene Mutationen und Prämutationen) im Vergleich zu bevölkerungsbezogenen Strategien (NCCHTA 2003) ökonomisch Kein Benefit, wenn Personen nicht bereit sind zur Geburtenkontrolle; Infrastruktur zum Kontakt der Zielgruppe nicht gegeben (NCCHTA 2003) Carrier ohne "Fall" werden nicht erkannt; ungleiche Zugangschancen (AETMIS) "Teurer" als neonatales Screening und als pädiatrisches Screening; Aufbau einheitlicher Infrastruktur erforderlich (AETMIS) Tabelle 12: Technologiefolgen, Kaskadenscreening, FragileX-Syndrom Tabelle 12: Technologiefolgen, Kaskadenscreening, Fragile-X-Syndrom Ergebnisse Pränatales Screening Das Pränatalscreening wird in den HTA-Berichten sowohl als bevölkerungs­ bezogene Strategie als auch als Hochrisikostrategie im Rahmen von Kaska denscreeningprogrammen diskutiert. Primäre Zielgruppe sind schwangere Frauen, zur Bestimmung des Carrierstatus. Im Falle eines positiven mütterlichen Befundes besteht die Möglichkeit der vorgeburtlichen Diagnostik beim Feten. 22 375u Pränatales Screening Das Pränatalscreening wird in den HTA-Berichten sowohl als bevölkerungsbezogene Strategie als H TA - B e r i c hauch t e als Hochrisikostrategie im Rahmen von Kaskadenscreeningprogrammen diskutiert. Primäre Ziel- gruppe sind schwangere Frauen, zur Bestimmung des Carrierstatus. Im Falle eines positiven mütterlichen Befundes besteht die Möglichkeit der vorgeburtlichen Diagnostik beim Feten. Folgedimension medizinisch / physisch für die Zielperson "Vorteile" psychisch für die Zielperson Erleichterung bei negativem Befund "Probleme" Amniozenteserisiko 1% für Abort / Chorionzottenbiopsie; Risiko des Abbruchs (NCCHTA 2001, AETMIS) Emotionale Belastung (MSAC); Psychologische Reaktionen auf Feststellung einer „Normabweichung“ unklar; hohe Menge an Informationen zu verarbeiten; Kommunikation von komplizierten Risikozusammenhängen bei Personen mit Allel mit grenzwertiger Repeatzahl NCCHTA 2001) Dilemma, wenn Fötus weiblich ist und eine komplette Mutation aufweist (AETMIS) sozial - privat (Familie) sozial - öffentlich (Institutionen) gesellschaftlich Erleichterung bei negativem Befund Teilnahme am pränatalen Screening keine Option für Personen die Schwangerschaftsabbrüche generell ablehnen (NCCHTA 2003) Hoher Bedarf an Aufklärungsgesprächen und allgemeiner Aufklärung (NCCHTA 2001; AETMIS) Tabelle 13: Technologiefolgen, Pränatales Screening, Fragile-X-Syndrom ökonomisch Wenn kostenpflichtiger Test, Uptake niedrig, wenn frei, Uptake hoch (NCCHTA 2001) Tabelle 13: Technologiefolgen, Pränatales Screening, Fragile-X-Syndrom Präkonzeptionelles Screening Adressaten einer präkonzeptionellen bevölkerungsbezogenen Screeningstrategie sind alle Frauen vor Eintritt einer ersten Schwangerschaft. Zielsetzung wäre erneut die Erkennung von Mutationsund Prämutationsträgerinnen und das Ermöglichen einer informierten Familienplanung. Die Überlegungen der HTA-Berichte von NCCHTA 1997, 2001 und AETMIS zu diesem Modell sind rein hypothetisch, eine solche Fragile-X-Screeningstrategie wurde noch nie erprobt. Die Auflistung der in den HTA-Berichten angesprochen Technologiefolgen zeigt, dass eine ganze Reihe von Problemen berührt wird, die im weitesten Sinne der oben eingeführten Arbeitsdefinition von „ethischen Aspekten“ entspricht („…Bestandteile eines Kurz-HTA-Berichtes ….., die sich auf die Bewertung medizinischen Handelns beziehen und die explizit oder implizit auf ethische Prinzipien und/oder auf Begriffe und Kategorien Bezug nehmen, Ergebnisse die von diesen Prinzipien abgeleitet sind oder ihnen zugrunde liegen.“) t376 23 Präkonzeptionelles Screening Adressaten einer präkonzeptionellen bevölkerungsbezogenen Screeningstrategie sind alle Frauen vor Eintritt einer ersten Schwangerschaft. Zielsetzung wäre erneut die Erkennung von Mutations- und Genetik in Public Health Prämutationsträgerinnen und das Ermöglichen einer informierten Familienplanung. Die Überlegungen der HTA-Berichte von NCCHTA Te i lzu2diesem : I n t e gModell r a t i o nsind v orein n Ghypothetisch, enetik in Public Health 1997, 2001 und AETMIS eine solche Fragile-X-Screeningstrategie wurde noch nie erprobt. Folgedimension "Vorteile" "Probleme" Beratung vor Eintritt einer Schwangerschaft möglich; alle reproduktiven Entscheidungen stehen offen (NCCHTA 2001) Beratungsunsicherheit bei "Grauzonenallelen" medizinisch / physisch psychisch Daten zur Akzeptanz eines möglichen präkonzeptionellen Screenings fehlen (NCCHTA 1997) sozial - privat Cave: Datenschutz, Gruppenzwang, Stigmatisierung; breite Aufklärung notwendig (NCCHTA 2001) sozial - öffentlich gesellschaftlich ökonomisch Organisatorische Infrastruktur vorhanden (Schulen) Hohe Kosten für Gesundheitswesen Tabelle 14: Technologiefolgen, Präkonzeptionelles Screening, Fragile-X-Syndrom Tabelle 14: Technologiefolgen, Präkonzeptionelles Screening, Fragile-X-Syndrom Im Folgenden soll versucht werden, die diskutierten Aspekte den vier ethischen Grundprinzipien nach Beauchamp und Childress bzw. den ergänDie Auflistung der in den HTA-Berichten angesprochen Technologiefolgen zeigt, dass eine ganze zenden Prinzipien fürimPublic Health zuzuordnen. Reihe von Problemen berührt wird, die weitesten SinneMaßnahmen der oben eingeführten Arbeitsdefinition von "ethischen Aspekten" entspricht ("…Bestandteile eines Kurz-HTA-Berichtes ….., die sich auf die 4.3.1.Handelns Ordnung derund diskutierten ethischen nach Bewertung medizinischen beziehen die explizit oder implizit auf Aspekte ethische Prinzipien und/oder auf Begriffe und Kategorien Bezug nehmen, die von diesen Prinzipien abgeleitet sind oder Beauchamp und Childress ihnen zugrunde liegen.") Autonomie Im Folgenden soll4.1.3.1. versucht werden, die diskutierten Aspekte den vier ethischen Grundprinzipien nach Beauchamp und Childress bzw. den ergänzenden Prinzipien für Public Health Maßnahmen zuzuordAlle HTA-Berichte sehen durch Fragile-X-Screeningmaßnahmen einernen. seits das Recht auf Autonomie der Zielgruppe gefährdet, andererseits wird 4.1.3 4.1.3.1 aber festgestellt, dass bestimmte Personengruppen erst durch Mitteilung der Testergebnisse (eingebettet in Beratungsmaßnahmen) zur autonomen Entscheidungsfindung befähigt werden. Autonomie Ordnung der diskutierten ethischen Aspekte nach Beauchamp und Childress Alle HTA-Berichte sehen durch Fragile-X-Screeningmaßnahmen einerseits das Recht auf Autonomie Situationen, in denen die autonome Entscheidung von Einzelpersonen der Zielgruppe gefährdet, andererseits wird aber festgestellt, dass bestimmte Personengruppen erst ist, sind(eingebettet gegeben wenn: durch Mitteilung gefährdet der Testergebnisse in Beratungsmaßnahmen) zur autonomen Entscheidungsfindung befähigt werden. Ergebnisse n die Probenentnahme für den DNA-Test von geistig retardierten Erwachsene verweigert wird bzw. sich diese aktiv gegen eine Probenentnahme wehren, 24 n der Carrierstatus von noch nicht einwilligungsfähigen Kindern bestimmt werden soll (im Zusammenhang mit einem Kaskadenscreeningprogramm), n sich ein Gruppendruck (Familie, soziales Umfeld, Gesellschaft) zur Teilnahme am Screening aufbaut. Der Gruppendruck kann im Widerspruch stehen zum individuellen „Nicht-wissen-wollen“, zur Absicht eine 377u H TA - B e r i c h t e Schwangerschaft mit einem betroffenen Kind auszutragen oder mit der Absicht den vermeintlichen „Makel“ vor der weiteren Familie geheim zu halten. Eine Befähigung zur autonomen Entscheidungen wird dann gesehen, wenn durch die Kenntnis des genetischen Befundes in Zusammenhang mit adäquaten Beratungsmaßnahmen eine informierte Entscheidung zur Familienplanung getroffen werden kann. 4.1.3.2 Schadensvermeidung Im Zusammenhang mit dem Fragile-X-Screening wird eine Reihe von möglichen Schäden als Folge des Technologieeinsatzes genannt. Dabei betreffen die Schäden sowohl die Zielperson, als auch die Familie und das weitere soziale Umfeld. Für die Zielperson stehen im Falle des „Case Finding“ neben geringfügigen Schäden durch die Probenentnahme vor allem psychische Folgen im Sinne von Stigmatisierungen im Vordergrund. Im Zusammenhang mit dem Pränatalscreening / der Pränataldiagnostik werden physische Schäden für Mutter und Kind durch die Probenentnahme (Amniozentese, Chorionzottenbiopsie) und durch den möglicherweise folgenden Schwangerschaftsabbruch angeführt. Auch in dieser Situation sind, folgt man den HTA-Berichten, allerdings die psychischen Schäden höher zu bewerten. Hierzu gehören Angst und Anspannung während der Testsituation und der Wartezeit auf das Ergebnis. Außerdem die Belastung durch einen positiven oder unsicheren Befund mit den möglicherweise resultierenden Konsequenzen, nämlich der Entscheidung für einen Schwangerschaftsabbruch oder einer zu ändernden Familienplanung. An Schädigungen des sozialen Umfeldes werden wieder Stigmatisierung (der Familie), Partnerprobleme und mögliche versicherungsrechtliche Konsequenzen diskutiert. 4.1.3.3 Wohltun Dem Prinzip der Schadensvermeidung steht das Prinzip der Fürsorge, des Wohltuns (Beneficience) gegenüber. Ein Aspekt in mehreren Berichten ist die Möglichkeit, Betroffene schon früh gezielten Fördermaßnahmen zuzuführen, die eine bestmögliche Entwicklung der Kinder unterstützen sollen. Dabei ist nicht klar, ob durch spezifische Frühfördermaßnahmen im Vergleich zu den regulären Fördermaßnahmen für Kinder mit mentalen Retardierungen tatsächlich Vorteile erzielt werden können. Weiterhin wird postuliert, dass in Kenntnis des genetischen Befundes das Verständnis der t378 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Familie und des sozialen Umfeldes für die Symptome und Auffälligkeiten des Betroffenen größer sei. Von allen HTA-Berichten wird als positiver Effekt jeder Screeningstrategie die emotionale Erleichterung bei negativen Testergebnissen genannt. 4.1.3.4 Gerechtigkeit Aspekte der Gerechtigkeit werden vor allem im Zusammenhang mit dem Zugang zu den Screeningmaßnahmen diskutiert. Dabei wird festgestellt, dass vor allem die bevölkerungsbezogenen Screeningstrategien eine sorgfältige Aufklärung der Allgemeinbevölkerung, insbesondere aber auch von Berufsgruppen, die unmittelbaren Kontakt mit der jeweiligen Zielpopulation haben (Erzieher, Lehrer, Gynäkologen, Geburtshelfer) erfordern. Der Zugang wird weiterhin von der zur Abwicklung eines Screeningprogramms erforderlichen Infrastruktur (Zugang zur Zielgruppe, Beratungsangebote, Kommunikation von Schul- und Gesundheitssystem, Verfügbarkeit von qualitativ hochwertigen Testkits) beeinflusst. Diese ist je nach Land und vorgeschlagener Screeningstrategie in unterschiedlichem Maße vorhanden. Für die Hochrisikostrategien gilt, dass Prämutationsträger(innen), in deren Familie bisher kein Indexfall aufgetreten ist, prinzipiell keinen Zugang zum Screeningsystem haben. 4.1.4. Ordnung der diskutierten ethischen Aspekte aus Public Health Sicht 4.1.4.1. Verhältnismäßigkeit Eine Abwägung von erzielbarem Nutzen und in Kauf zu nehmendem Schaden wird in den Berichten NCCHTA, 2001 und AETMIS ausdrücklich, in den übrigen Berichten implizit vorgenommen. Dabei werden drei unterschiedliche Gruppen von Betrachtungen angestellt: n die Nutzen- / Schadenabwägung auf individueller Ebene (für die Zielpersonen und Familie); n die Gegenüberstellung des „Nutzen“ (Anzahl / Anteil aufgefundener Fälle / Carrier) aus gesellschaftlicher Perspektive gegen den „Schaden“ auf individueller Ebene (psychosoziale Konsequenzen des genetischen Befundes); n die Abwägung von Nutzen und Schaden aus gesellschaftlicher Perspektive, dies allerdings nur aus rein monetärer Sicht. 379u H TA - B e r i c h t e 4.1.4.2 Befähigungsgerechtigkeit Befähigung meint die „… Bereitstellung tragfähiger Bedingungen zum Zweck der Teilnahmemöglichkeit an interpersoneller Kommunikation. Es geht um die Befähigung zu einer längerfristig integral-eigenverantwortlichen Lebensführung unter den gegebenen leiblichen und altersspezifischen Möglichkeiten….“ (Dabrock 2001). Dieser Aspekt wird in mehreren HTABerichten implizit angesprochen: n Betonung der Notwendigkeit von Aufklärungsmaßnahmen im Kontext aller Screeningprogramme; n im Kontext mit Zugangsgerechtigkeit (Problem der Unterdiagnostik); n der Notwendigkeit einer umfassenden, verständlichen Beratung als Voraussetzung für informed consent / informed refusal zur Teilnahme an Screeningmaßnahmen. Verschärft wird das Problem bei Personen mit grenzwertigen intellektuellen Fähigkeiten. Bei der Formulierung des generellen Screeningziels in den Berichten des NCCHTA von 1997 und 2001 wird ein Paradigmenwechsel zugunsten der Herstellung von Befähigungsgerechtigkeit im oben genannten Sinne deutlich. 1997 war klar das oberstes Screeningziel die Reduktion der Geburten von Kindern mit Fragile-X-Syndrom („The principal aim of screening for fragile X syndrome is to reduce the birth prevalence of the disorder, by prenatal diagnosis and selective termination of pregnancy, or by reducing the number of pregnancies in women who have the FM or PM alleles.“). Die Autoren des Berichtes von 2001 definieren dagegen als Ziel (nicht nur für Screeningmaßnahmen, sondern für die Humangenetik allgemein) Familien mit genetisch bedingten Beeinträchtigungen Hilfestellung zu einem so weit wie möglich „normalen“ Leben und Fortpflanzungsverhalten zu geben („.. to help those families with a genetic disadvantage live and reproduce as normally as possible“). Zentrale Bedeutung bei der Umsetzung dieses Ziels kommt dabei den Risikoaufklärungs- und Beratungsmaßnahmen zu, die informierte Entscheidungen zum Reproduktionsverhalten ermöglichen sollen. Eine Folge könnte möglicherweise die Senkung der Inzidenz von betroffenen Geburten sein. 4.1.4.3. Verantwortlichkeit des Einzelnen im gesellschaftlichen Kontext Die Verantwortlichkeit von Einzelnen kann im Zusammenhang mit Screeninginterventionen aus verschiedenen Perspektiven betrachtet werden. Verantwortung kann sich auf Individuen (Kinder, Familienangehörige, zukünftige Nachkommen) beziehen oder das soziale Umfeld, die Gesellschaft betreffen. In den HTA-Berichten wird der Anspruch auf Übernahme von t380 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Verantwortung für die Effektivität der Screeningmaßnahmen als gegenläufiges Prinzip zum Recht auf Autonomie thematisiert. 4.1.4.4. (Bürger-)Partizipation in Entscheidungsprozessen Die Forderung nach Bürgerpartizipation in Entscheidungsprozessen, soweit es die Allgemeinbevölkerung betrifft, wird in den HTA-Berichten nicht nachgekommen. Allerdings waren zumindest betroffene Laiengruppen (Selbsthilfeorganisationen, nicht-medizinische Professionen, die mit dem Problem Fragile-X-Syndrom konfrontiert sind,) an drei der fünf HTABerichte beteiligt. Die Autoren des NCCHTA-Berichtes 2001 führten eine Anhörung von Betroffenenfamilien im Rahmen der Nutzen-SchadenAbwägung von Screeningstrategien durch. Zwei weitere Institutionen gewährleisten ein Minimum von Partizipation durch multidisziplinär (incl. Betroffenenvertreter) zusammengesetzte „Beiräte“ (AETMIS, MSAC). 4.1.4.5. Umfassende Sicherung der Gesundheitsversorgung Unter diesem Aspekt wird insbesondere in den Berichten von AETMIS und NCCHTA, 2001 die Verantwortung des (staatlichen) Gesundheitssystems für die Finanzierung einer gleichmäßigen, für die Betroffenen akzeptablen Infrastruktur (Betreuung betroffener Patienten, Beratungen, Schwa ngerschaftsbegleitung, Monitoring, Register) im Rahmen von Fragile-XScreeningkonzepten angesprochen. 4.1.5. Bewertung In vier von fünf Berichten zum Fragile-X-Screening wird die Berücksichtung von ethischen Erwägungen bei der Entscheidung für oder gegen eine Screeningstrategie für essentiell relevant gehalten. Es werden Gefährdungen der Autonomie, mögliche Schäden, möglicher Nutzen und Gerechtigkeitsprobleme angesprochen. Werden die unterschiedlichen Perspektiven eingebracht (Individuum, soziales Umfeld - privat, Professionen, Gesellschaft) lassen sich die Konfliktbereiche unschwer erkennen. Die Notwendigkeit zur Differenzierung zwischen „ethischen Aspekten“ und „Public Health relevanten Aspekten“ wird überflüssig (vergl. Abschnitt 5.5). Es wird nicht klar, welche ethische Theorie oder welches ethische Konzept die Berichtsautoren zu den genannten Betrachtungen motiviert hat. Eine Gewichtung und Bewertung der Probleme (im Sinne einer ethischen Diskussion) erfolgt in keinem der HTA-Berichte. Lediglich im AETMIS Bericht ist ein eigenes Kapitel sozialen und ethischen Aspekten gewidmet, in den übrigen finden sich die Überlegungen verteilt auf unterschiedliche Berichtsteile (Hintergrund, Bewertung der Strategien, Diskussion). 381u t382 Befähigung zur informierten Familienund Lebensplanung durch Beratung (alle Strategien) Befähigung zum "informed consent" durch Beratung Befähigung zur informierten Familienund Lebensplanung durch Beratung. Autonomie - Chancen Prämutationsträger(innen) ohne Indexfall in der Familie haben keinen Zugang zum System (Hochrisikostrategien) Ergebnisse Tabelle 15: „Ethische“ Probleme im Zusammenhang mit dem Fragile-X-Screening Fortsetzung Fehler! Verweisquelle konnte nicht gefunden werden. Gerechtigkeit - Gefährdung Gerechtigkeit - Chancen Psychische Belastung durch Konsequenzen für Lebensplanung (alle Strategien); physische / psychische Belastungen durch Folgemaßnahmen (Pränatalscreening: invasive Pränataldiagnostik, Interruptio) bei positivem Test: Stigmatisierung, Diskriminierung Psychische / emotionale Entlastung (alle Strategien) (alle Strategien) finanzielle Belastungen durch ein behindertes Kind (Case Finding, Neonatalscreening) Schuldgefühle Partnerschaftsprobleme Stigmatisierung Gezielte Frühförderung (Case finding) SchadensBelastungs(potential) Psychische / emotionale Entlastung (alle Strategien) Bei Erkrankung: Nutzen(potential) bei negativem Test: bei negativem Test: Recht auf "Nicht-wissen-wollen" vs. Verantwortung für Familie/Gesellschaft. "consent" bei geistig retardierten Personen und Kindern? (alle Strategien) Autonomie - Gefährdung (alle Strategien) soziales Umfeld Individuum Einführung 29 Aufbau und Sicherstellung bedarfsgerechter, gleichmäßiger Infrastruktur für Beratungen, Testungen, Nachsorge steht aus (alle Strategien) (bevölkerungsbezogene Strategien) Zugang zur Zielgruppe vorhanden (alle Strategien) Effizienz im Vergleich zu anderen Maßnahmen der Gesundheitsversorgung? Effizienz der Screeningstrategien im Vergleich? (alle Strategien) Senkung der Inzidenz von "betroffenen Geburten" (alle Strategien) "verborgene" Eugenik? (alle Strategien) (alle Strategien) Beratungsunsicherheit bei Prämutation; FM bei Mädchen / weiblichen Feten Senkung der Inzidenz von "betroffenen Geburten" Akzeptanz der Konsequenzen muss geklärt werden (Schwangerschaftsabbruch, Familienplanung) (alle Strategien) Befähigungsgerechtigkeit durch Aufklärung, Bürgerpartizipation zu erreichen? Gesellschaft Ärztliches Berufsethos verpflichtet zum Wohltun (alle Strategien) Ärztliche Entscheidungsfreiheit bei "verordneten" Strategien eingeschränkt – moralische Bewertung der Konsequenzen (Schwangerschaftsabbruch, Familienplanung) Professionen H TA - B e r i c h t e Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Viele der angeführten ethischen Probleme werden mit Daten aus empirischen Studien belegt, eine systematische Aufarbeitung der Literatur (vollständiges Auffinden, Qualitätsbewertung) erfolgt allerdings nicht. 4.2. Das hereditäre Mammakarzinom In den Rechercheergebnissen waren zwei HTA-Berichte enthalten, die Bewertungen des Einsatzes von prädiktiven genetischen Testverfahren 4.2 Das hereditäre zur Mammakarzinom Risikobestimmung für das hereditäre Mammakarzinom vornahmen. In den Rechercheergebnissen zwei aus HTA-Berichte enthalten,Coordinating die BewertungenOffice des Einsatzes von Der erste waren stammt dem Canadian for Health prädiktiven genetischen Testverfahren zur Risikobestimmung für das Technology Assessment (CCOHTA 1999), derhereditäre zweite Mammakarzinom aus dem Institut vornahmen. Der erste aus dem Canadian Coordinating for Health Technology Assess-der für stammt Technikfolgenabschätzung der Office österreichischen Akademie ment (CCOHTA Wissenschaften 1999), der zweite (ITA aus dem Institut für Technikfolgenabschätzung der österreichi2002). Beide Berichte beschäftigen sich außerdem schen Akademie der Wissenschaften (ITA 2002). Beide Berichte beschäftigen sich außerdem mit weimit weiteren hereditären Karzinomen (Prostata, Ovarien, Kolon), die im teren hereditären Karzinomen (Prostata, Ovarien, Kolon), die im Folgenden aber außer Acht bleiben. Folgenden aber außer Acht bleiben. Titel Jahr Land Institution Umfang Noorani H. Z. et McGahan L. 1999 Kanada CCOHTA 85 S. 2002 Österreich ITA 90 S. Technical report Predictive genetic testing for breast and prostate cancer Jonas S., Schamberger C. et Wild C. Prädiktive Humangenetische Diagnostik bei hereditärem Mamma- und Kolorektal-karzinom – ein Assessment Tabelle 16: HTA-Berichte zum hereditären Mammakarzinom Tabelle 16: HTA-Berichte zum hereditären Mammakarzinom 4.2.1 4.2.1.1 4.2.1. Policy Question / Beschreibung der Krankheit / Beschreibung der Technologie Policy Question / Beschreibung der Krankheit / Beschreibung der Technologie Policy Question 4.2.1.1. Policy Question Die „Policy Question“ des CCOHTA-Berichtes beschäftigt sich mit der aktuellen Situation der genetiDie „Policy Question“ desderCCOHTA-Berichtes mit der schen Tests bei Brustkrebs in Kanada, fragt nach potenziellen klinischenbeschäftigt Relevanz der sich genetischen der genetischen Tests bei und Brustkrebs Kanada, fragt Suszeptibilität füraktuellen BrustkrebsSituation und untersucht ethische, psychosoziale politischeinAuswirkungen, der potenziellen klinischen der genetischen die sich durch dienach augenblicklich verfügbaren und noch Relevanz zu entwickelnden TechnologienSuszeptibilität ergeben. Es soll der Bedarf zur von klinischen Leitlinienethische, abgeschätztpsychosoziale werden. Der ITA-Bericht fragt fürErstellung Brustkrebs und untersucht und politische nach der aktuellenAuswirkungen, und künftigen Bedeutung genetischer Tests für verfügbaren Individuen undund die Gedie sichprädiktiver durch die augenblicklich noch sellschaft. Die Validität und der gesellschaftliche Nutzen der Testverfahren werden hinterfragt, insbezu entwickelnden Technologien ergeben. Es soll der Bedarf zur Erstellung sondere weil die Finanzierung in einem solidarischabgeschätzt organisierten werden. Gesundheitssystem geregelt werden von klinischen Leitlinien Der ITA-Bericht fragt muss. Der ITA-Bericht fokussiert zum Thema „hereditäres Mammakarzinom“ auf die Erkennung von nach der aktuellen und künftigen Bedeutung prädiktiver genetischer Tests Mutationen der BRCA1- und BRCA2-Gene. für Individuen und die Gesellschaft. Die Validität und der gesellschaft- Wie unter 4.1 wird auch hier die Forderung der Working Group 4 des ECAHI an den Informationsgeliche Nutzen der Testverfahren werden hinterfragt, insbesondere weil die halt einer Policy Question zugrunde gelegt: Finanzierung in einem solidarisch organisierten Gesundheitssystem geregelt werden muss. Der ITA-Bericht fokussiert zum Thema „hereditäres Frage CCOHTA Mammakarzinom“ auf die Erkennung von Mutationen ITA der BRCA1- und Wer initiierte den Report? BRCA2-Gene. Wer finanzierte den Report? - + Warum wird die Bewertung jetzt gebraucht? + + Welche Entscheidung soll unterstützt werden? + + Wer sind die Adressaten? + + Tabelle 15: Policy Questions, Hereditäres Mammakarzinom 383u Die „Policy Question“ des CCOHTA-Berichtes beschäftigt sich mit der aktuellen Situation der genetischen Tests bei Brustkrebs in Kanada, fragt nach der potenziellen klinischen Relevanz der genetischen Suszeptibilität für Brustkrebs und untersucht ethische, psychosoziale und politische Auswirkungen, die sich durch die augenblicklich verfügbaren und noch zu entwickelnden Technologien ergeben. Es soll der Bedarf zur Erstellung von klinischen Leitlinien abgeschätzt werden. Der ITA-Bericht fragt H TA - B e r i cnach h t eder aktuellen und künftigen Bedeutung prädiktiver genetischer Tests für Individuen und die Gesellschaft. Die Validität und der gesellschaftliche Nutzen der Testverfahren werden hinterfragt, insbesondere weil die Finanzierung in einem solidarisch organisierten Gesundheitssystem geregelt werden muss. Der ITA-Bericht fokussiert zum Thema „hereditäres Mammakarzinom“ auf die Erkennung von Mutationen der BRCA1- und BRCA2-Gene. Wie unter 4.1 wird auch hier die Forderung der Working Group 4 des ECAHI 4.1 wird auch hiereiner die Forderung der Working Group 4gelegt: des ECAHI an den InformationsgeanWie denunter Informationsgehalt Policy Question zugrunde halt einer Policy Question zugrunde gelegt: Tabelle 17: Policy Questions, Hereditäres Mammakarzinom Frage CCOHTA ITA Wer initiierte den Report? - - Wer finanzierte den Report? - + Warum wird die Bewertung jetzt gebraucht? + + Welche Entscheidung soll unterstützt werden? + + Wer sind die Adressaten? + + Tabelle 15: Policy Questions, Hereditäres Mammakarzinom Die Frage nach den Auftraggebern bleibt in beiden Berichten unbeantwortet. Das ITA weist auf die Teilfinanzierung durch den Fonds Gesundes Österreich Ergebnisse 30 hin, der kanadische Bericht wurde im staatlich finanzierten Canadian Coordinating Office for Health Technology Assessment erstellt. Da man Die Frage nach den Auftraggebern bleibt in beiden Berichten unbeantwortet. Das ITA weist auf die sowohl in Kanada als auch in Österreich mit einer rasanten Entwicklung der Teilfinanzierung durch den Fonds Gesundes Österreich hin, der kanadische Bericht wurde im staatlich Genetik undCanadian einer Kommerzialisierung prädiktiven Tests Da man sowohl finanzierten Coordinating Office forvon Health Technologygenetischen Assessment erstellt. rechnet, wird eine Bewertung der aktuellen und künftigen Situation in Kanada als auch in Österreich mit einer rasanten Entwicklung der Genetik und für einer Kommerzialiunerlässlich gehalten. Der BerichtTests des ITA sollwird die eine Öffentlichkeit allgemein sierung von prädiktiven genetischen rechnet, Bewertung der aktuellen und künftigen informieren, der kanadische Bericht wendetdes sich diedie Entscheidungsträger Situation für unerlässlich gehalten. Der Bericht ITAansoll Öffentlichkeit allgemein informieren, der staatlich kanadische Bericht wendet sich an die Entscheidungsträger des staatlich organisierten Gesunddes organisierten Gesundheitswesens. heitswesens. derPolicy PolicyQuestion Questionwird wirdangegeben, angegeben, welche welche Folgen in den beiden BeInInder Folgendes des Technologieeinsatzes Technologieeinsatzes richten betrachtet werden sollen: in den beiden Berichten betrachtet werden sollen: Tabelle 18: Intensionen der HTA Bericht zum Hereditären Mammakarzinom ITA 2002 Frage der Finanzierung genetischer Tests: durch die Solidargemeinschaft? Klinische Relevanz der prädiktiven genetischen Tests (Prävention möglich?), ethische, soziale und gesellschaftliche Auswirkungen der Tests CCOHTA 1999 Klinische Relevanz der genetischen „Anfälligkeit“, ethische, psychosoziale und politische Auswirkungen der genetischen Suszeptibilität und der prädiktiven genetischen Test Tabelle 16:Intensionen der HTA Bericht zum Hereditären Mammakarzinom 4.2.1.2. Beschreibung der Krankheit 4.2.1.2 Beschreibung der Krankheit „Krankheitsmechanismus“ „Krankheitsmechanismus“ beiden Berichten wird ausführlich über die Pathomechanismen des hereditären Mammakarzinoms InIn beiden Berichten wird ausführlich über die Pathomechanismen des berichtet. Dabei liegt ein besonderes Gewicht auf den Mutationen in den Tumorsuppressorgenen hereditären Mammakarzinoms berichtet. Dabei liegt ein besonderes BRCA1 und BRCA2. Für das 1994 entdeckte BRCA1-Gen, das auf dem langen Arm des Chromosoms Gewicht auf den Mutationen in den Tumorsuppressorgenen BRCA1 und 17 lokalisiert ist, sind 450 Mutationen und für das BRCA2-Gen 250 bekannt. Letzteres befindet sich BRCA2. Für das entdeckte13BRCA1-Gen, auf beschrieben. dem langen auf dem langen Arm 1994 des Chromosoms und wurde 1995das erstmals Die Vererbung erArm des Chromosoms 17 lokalisiert ist, sind 450 Mutationen und fürTabelle sind die folgt autosomal-dominant, allerdings mit variabler Penetranz. In der nachfolgenden das BRCA2-Gen 250 bekannt. Letzteres befindet sich auf dem langen bekannten Mutationen aufgeführt: Arm des Chromosoms 13 und wurde 1995 erstmals beschrieben. Die Bekannte Art der Mutation Anzahl der Deletion Insertion Mutationen t384 Gen BRCA1 318 BRCA2 154 143 45% 81 44 13,8% 29 Stopcodon Splicedefekt Punktmutation 61 19,2% 17 26 8,2% 26 44 13,8% 5 Tabelle 16:Intensionen der HTA Bericht zum Hereditären Mammakarzinom 4.2.1.2 Beschreibung der Krankheit „Krankheitsmechanismus“ In beiden Berichten wird ausführlich über die Pathomechanismen des hereditären Mammakarzinoms Genetik in Public Health berichtet. Dabei liegt ein besonderes Gewicht auf den Mutationen in den Tumorsuppressorgenen BRCA1 und BRCA2. Für das 1994 entdeckte BRCA1-Gen, Te i ldas 2 :auf I n dem t e g rlangen a t i o n Arm v o ndes G Chromosoms enetik in Public Health 17 lokalisiert ist, sind 450 Mutationen und für das BRCA2-Gen 250 bekannt. Letzteres befindet sich auf dem langen Arm des Chromosoms 13 und wurde 1995 erstmals beschrieben. Die Vererbung erVererbung erfolgt mit autosomal-dominant, allerdings mit variabler folgt autosomal-dominant, allerdings variabler Penetranz. In der nachfolgenden TabellePenetranz. sind die In der nachfolgenden Tabelle sind die bekannten Mutationen aufgeführt: bekannten Mutationen aufgeführt: Bekannte Art der Mutation Anzahl der Deletion Insertion Mutationen Gen BRCA1 318 BRCA2 154 143 45% 81 52,6% 44 13,8% 29 18,8% Stopcodon Splicedefekt Punktmutation 61 19,2% 17 11,0% 26 8,2% 26 8,2% 44 13,8% 5 4,0% Tabelle 19: Mutationen beim Hereditären Mammakarzinom. Tabelle 17:Mutationen beim Hereditären Mammakarzinom. Quelle: Mutationsdatenbank (www.nhgri.nih.gov/Intramural_research/Lab_Transfer/Bic/); zitiert nach Jonas et al. Quelle: Mutationsdatenbank (www.nhgri.nih.gov/Intramural_research/Lab_Transfer/Bic/); „Klinik“ zitiert nach Jonas et al. Der österreichische Bericht als auch der kanadische stellen die Klinik des Tumors gleichartig dar: Das „Klinik“ zeichnet sich dadurch aus, dass es bereits in jüngeren Jahren (prämenohereditäre Mammakarzinom Der österreichische auchalsder stellen die Klinik des pausal) diagnostiziert wird und häufigerBericht bilateral als auftritt daskanadische sporadische Mammakarzinom. ITA Tumors gleichartig dar: Das hereditäre Mammakarzinom zeichnet sich dadurch aus, dass es bereits in jüngeren Jahren (prämenopausal) diagnostiErgebnisse 31 ziert wird und häufiger bilateral auftritt als das sporadische Mammakarzinom. ITA gibt an, dass Histologie, Metastasierungsmuster und Überlebenszeiten gibt an, dass Histologie, Überlebenszeiten ähnlich sind wie bei einem spoähnlichMetastasierungsmuster sind wie bei einem und sporadischen Mammakarzinom. radischen Mammakarzinom. CCOHTA dagegen weist darauf hin, dass BRCA1-asssoziierte CCOHTA dagegen weist darauf hin, dass BRCA1-asssoziierte häufiger schlecht differenTumoren häufiger schlecht differenziertTumoren sind, p53 überexprimieren und ziert sind, p53 überexprimieren und Östrogenrezeptornegativ sind, was mit einer ungünstigeren ProgÖstrogenrezeptornegativ sind, was mit einer ungünstigeren Prognose einnose einhergeht. hergeht. Zu den Erkrankungswahrscheinlichkeiten bei einer Mutation in den äußern sichBRCAbeide Zu den Erkrankungswahrscheinlichkeiten bei BRCA-Genen einer Mutation in den Berichte: Die Lebenszeit-Inzidenz wird mit mehr als 80% für das BRCA1-Gen und bis zu 85% für Genen äußern sich beide Berichte: Die Lebenszeit-Inzidenz wird das mit BRCA2-Gen angegeben. Diese Schätzungen stammen allerdings aus Untersuchungen von Hochrisikomehr als 80% für das BRCA1-Gen und bis zu 85% für das BRCA2-Gen familien und können nicht ohne weiteres auf andere Personengruppen übertragen werden. angegeben. Diese Schätzungen stammen allerdings aus Untersuchungen So finden sich in den HTA-Berichten auch differierende Angaben wegen der unterschiedlichen Bevon Hochrisikofamilien und können nicht ohne weiteres auf andere zugsgrößen: Personengruppen übertragen werden. Frauen Männer CCOHTA, 1999 ITA, 2002 ".. Overall, disease [Brustkrebs*] was linked to BRCA1 in an estimated 52% of families [mit familiärem Brustkrebs], to BRCA2 in 32% of families, and to neither gene in 16%...." Für Frauen in der Allgemeinbevölkerung wird die Häufigkeit der BRCA1-Mutation auf 1:500 geschätzt. "…dass in maximal 50% der Hochrisikofamilien BRCA1 und BRCA2 nachweisbar sind…" "… die autosomal-dominante Vererbung betrifft 1-6/1000 Individuen und bietet ein Lebenszeitrisiko von über 80% …" "…The cumulative risk of breast cancer in female BRCA2 gene carrier is estimated to be…79.5% by age of 70, while that for male carriers is 6.3% by age 70." "..BRCA2 Mutationen werden …… mit einigen männlichen Mammakarzinomen assoziiert…." Tabelle 20: Penetranz der BRAC1 und BRCA2 Gene; * [Erläuterung durch CB] Tabelle 18:Penetranz der BRAC1 und BRCA2 Gene; * [Erläuterung durch CB] „Prävention“ Die Präventionsmöglichkeiten des Erkrankungsausbruchs werden als limitiert angegeben. Eine prophylaktische Antiöstrogentherapie wird laut ITA in der Literatur kontrovers diskutiert. Des weiteren wird berichtet, dass in Europa eine prophylaktische Mastektomie von den betroffenen Frauen über- 385u H TA - B e r i c h t e So finden sich in den HTA-Berichten auch differierende Angaben wegen der unterschiedlichen Bezugsgrößen: „Prävention“ Die Präventionsmöglichkeiten des Erkrankungsausbruchs werden als limitiert angegeben. Eine prophylaktische Antiöstrogentherapie wird laut ITA in der Literatur kontrovers diskutiert. Des weiteren wird berichtet, dass in Europa eine prophylaktische Mastektomie von den betroffenen Frauen überwiegend abgelehnt wird. Engmaschige Früherkennungsuntersuchungen werden als sekundärpräventive Maßnahme in den Mittelpunkt gestellt, der prädiktive genetische Test soll bei positivem Befund helfen, sich für die Teilnahme an Früherkennungsuntersuchungen zu entscheiden. Auch CCOHTA betont, dass eine prädiktive Testung hilfreich sein kann bei der Entscheidung für eine engmaschige Überwachung oder vorbeugende Behandlung (z. B.: prophylaktische Mastektomie), die in Amerika – anders als in Europa – eher akzeptiert wird. Sie fügen allerdings noch die gezielte Familienplanung (zur Verhinderung der Genweitergabe) als Grund für einen prädiktiven genetischen Test im Zusammenhang mit dem hereditären Mammakarzinom hinzu. „Epidemiologie (Inzidenz, Prävalenz)“ Beide Berichte geben an, dass das Mammakarzinom der häufigste bösartige Tumor der Frau ist. CCOHTA weist darauf hin, dass in Kanada ca. 19.300 Frauen jährlich an Brustkrebs erkranken und dass 5.300 jedes Jahr daran sterben (Gesamtpopulation etwa 30 Mio. Einwohner). In Österreich erkranken jährlich etwa 4.553 Frauen und 46 Männer an Brustkrebs (Gesamtpopulation etwa 8 Mio. Einwohner). Schätzungen nach sind 250 bis 400 Frauen pro Jahr vom hereditären Mammakarzinom betroffen. Das entspricht ungefähr 5-10% aller Brustkrebsfälle (ITA, 2002). „Zielgruppe (Alter, Geschlecht, Risikofaktoren)“ Der Bericht aus dem ITA nennt als Zielgruppe einer möglichen Screeningintervention Personen (in erster Linie Frauen) aus Risikofamilien. Der Status „Risikofamilie“ ist dann gegeben, wenn eine Frau zwei oder mehr erstgradige Angehörige (Mutter, Schwester, Tochter) mit prämenopausal diagnostiziertem Brustkrebs hat. Der prädiktive genetische Test wird zentral in Wien durchgeführt, die begleitende genetische Beratung erfolgt wohnortnah. CCOHTA legt dar, dass eine genetische Beratung im Zusammenhang mit erblichen Krebserkrankungen hauptsächlich in US amerikanische Studien t386 Einwohner). Schätzungen nach sind 250 bis 400 Frauen pro Jahr vom hereditären Mammakarzinom betroffen. Das entspricht ungefähr 5-10% aller Brustkrebsfälle (ITA, 2002). „Zielgruppe (Alter, Geschlecht, Risikofaktoren)“ Der Bericht aus dem ITA nennt als Zielgruppe einer möglichen Screeningintervention Personen (in Ggegeben, e n e t i wenn k i neineP uFrau blic Health erster Linie Frauen) aus Risikofamilien. Der Status "Risikofamilie" ist dann zwei oder mehr erstgradige Angehörige (Mutter, Schwester, Tochter) mit prämenopausal diagnosti Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h ziertem Brustkrebs hat. Der prädiktive genetische Test wird zentral in Wien durchgeführt, die begleitende genetische Beratung erfolgt wohnortnah. CCOHTA legt dar, eine genetische Beratung im Zusammenhang mit erblichen Krebserkrankunmitdass erstgradigen Verwandten von Krebspatientinnen und -patienten in der gen hauptsächlichLiteratur in US amerikanische Studien mit erstgradigen Verwandten von Krebspatientinnen beschrieben ist. In Kanada wurden (zum Berichtszeitpunkt 1999) und -patienten inprädiktive der Literaturgenetische beschriebenTests ist. In auf Kanada wurden (zum Berichtszeitpunkt 1999)nur prä-im hereditäre Karzinomerkrankungen diktive genetischeRahmen Tests aufvon hereditäre Karzinomerkrankungen nur im Rahmen von wissenschaftlichen wissenschaftlichen Untersuchungen eingesetzt. Untersuchungen eingesetzt. 4.2.1.3 4.2.1.3. Beschreibung der Technologie Beschreibung der Technologie Analytische Testcharakteristika Analytische Testcharakteristika In den Berichten werden unterschiedliche Testverfahren zu Diagnostik und Screening bei hereditärem In den Berichten werden unterschiedliche Testverfahren zu Diagnostik und Brustkrebs beschrieben: Screening bei hereditärem Brustkrebs beschrieben: CCOHTA, 1999 ITA, 2002 Sequenzanalyse + + Denaturing High Performance Liquid Chromatography DHPLC - + Multiplex Heteroduplex Analysis MHX + - Single-Strand Conformation Polymorphism SSCP + - Protein-Trunkationstest PTT + + Fluorescence in situ Hybridization FISH + - Dideoxy Fingerprinting DDF + - PCR SSCP MHX + - Southern Blot + - serologische Tests - - Chip-Technologie - (+) Tabelle 21: Genetische Testmethoden zum Hereditären Mammakarzinom Tabelle 19: Genetische Testmethoden zum Hereditären Mammakarzinom Beide Berichte werten die Gensequenzierung als „Goldstandard“. ITA gibt die DHPLC mit einer Sensitivität bis zu 100% als alternative Möglichkeit Beide Berichte werten die Gensequenzierung „Goldstandard“. ITA gibt(PTT) die DHPLC Senan. Die Sensitivität des als Protein-Trunkationstest wird mit bei einer CCOHTA sitivität bis zu 100% als alternative Möglichkeit an. Die Sensitivität des Protein-Trunkationstest (PTT) mit 70-90% bzw. von ITA mit 65-90% beziffert. Die Sensitivität von wird bei CCOHTA mit 70-90% bzw. von ITA mit 65-90% beziffert. Die Sensitivität von Verfahren Verfahren wie Multiplex Heteroduplex Analysis (MHX) oder Single-Strand wie Multiplex Heteroduplex Analysis (MHX) oder Single-Strand Conformation Polymorphism Conformation Polymorphism (SSCP) wird bei CCOHTA als variabel (SSCP) wird bei CCOHTA als variabel bezeichnet. Die Kanadier weisen zwar daraufhin, dass für bezeichnet. Die Kanadier weisen zwar daraufhin, dass für DNA-basierte DNA-basierte Tests optimale Schätzungen der Sensitivität und Spezifität vorliegen müssen, damit sie Tests optimale Schätzungen der Sensitivität und Spezifität vorliegen müsin die klinische Diagnostik eingeführt werden können, geben allerdings für keinen Test an, wie hoch sen, damit sie in die klinische Diagnostik eingeführt werden können, geben die Spezifität ist. Auch die Autoren des ITA äußern sich nicht zur Spezifität. Beide Berichte geben für keinen Test an. an, wie hoch die Spezifität ist. Auch die Autoren aber für einzelne allerdings Studien Falsch-Positiv-Raten des ITA äußern sich nicht zur Spezifität. Beide Berichte geben aber für einErgebnisse 33 zelne Studien Falsch-Positiv-Raten an. Diagnostische Testcharakteristika Die analytische Validität eines genetischen Tests ist abhängig von der Genauigkeit, der Zuverlässigkeit als auch von der Qualität, mit der das Labor arbeitet (Lagerung und Aufarbeitung der Proben, z.B.) (ITA). 387u H TA - B e r i c h t e Diagnostische Testcharakteristika Testcharakteristika Diagnostische DerDie Vorhersagewert des prädiktiven Tests hängt von der klinischen Validität der Zuverlässiganalytische Validität Validität eines genetischen genetischen Tests ist ist abhängig von der der Genauigkeit, Genauigkeit, Die analytische eines Tests abhängig von der Zuverlässig(vgl.keitBurke et al. 2002), der Prävalenz der Störung in der Zielpopulation als auch auch von von der der Qualität, Qualität, mit mit der der das das Labor Labor arbeitet arbeitet (Lagerung (Lagerung und und Aufarbeitung Aufarbeitung der der Proben, Proben, keit als undz.B.) der(ITA). Penetranz des genetischen Defekts (Genotyp-Phänotypz.B.) (ITA). Korrelation) ab. Unter nahezu Sensitivität der Burke et al. 2002), Der Vorhersagewert Vorhersagewert desAnnahme prädiktiveneiner Tests hängt hängt von von100%igen der klinischen klinischen Validität (vgl. (vgl. Der des prädiktiven Tests der Validität Burke et al. 2002), Sequenzierungsanalysen liegen die positiv prädiktiven Werte in betroffenen der Prävalenz Prävalenz der der Störung Störung in in der der Zielpopulation Zielpopulation und und der der Penetranz Penetranz des des genetischen genetischen Defekts Defekts (Genotyp(Genotypder Familien zwischen 50% und 80%. Phänotyp-Korrelation) ab. Unter Annahme einer nahezu 100%igen Sensitivität der SequenzierungsaPhänotyp-Korrelation) ab. Unter Annahme einer nahezu 100%igen Sensitivität der Sequenzierungsanalysen liegen liegen die diepositiv positiv prädiktiven prädiktiven Werte Wertein in betroffenen betroffenen Familien Familien zwischen zwischen 50% 50%und und 80%. 80%. nalysen Infrastruktureller und organisatorischer Kontext Infrastruktureller und organisatorischer organisatorischer Kontext DieInfrastruktureller berichteten infrastrukturellen undKontext organisatorischen Voraussetzungen in und Die berichteten infrastrukturellen und organisatorischen Voraussetzungen in Kanada Kanada und und Österreich Österreich Kanada und Österreich sind sehr verschieden, was auf die grundlegenden Die berichteten infrastrukturellen und organisatorischen Voraussetzungen in sind sehr verschieden, was auf die grundlegenden Differenzen der beiden Gesundheitssysteme oder Differenzen der beiden was Gesundheitssysteme oderDifferenzen auch auf der die beiden unterschiedsind sehr verschieden, auf die grundlegenden Gesundheitssysteme oder auch auf die unterschiedlichen Zeitpunkte der Veröffentlichung der HTA-Berichte zurückzuführen auchZeitpunkte auf die unterschiedlichen Zeitpunkteder der HTA-Berichte Veröffentlichungzurückzuführen der HTA-Berichte zurückzuführen lichen der Veröffentlichung sein könnte. könnte. seinsein könnte. Artdes desGesundheitssystems Gesundheitssystems Art Prädiktive genetischeTests Testsbereits bereitsimpleimplePrädiktive genetische mentiert mentiert Tabelle 22: Infrastruktureller Kontext, Hereditäres Mammakarzinom Kanada(CCOHTA) (CCOHTA) Kanada staatlich staatlich Österreich(ITA) (ITA) Österreich Sozialversicherungssystem Sozialversicherungssystem Nurinnerhalb innerhalbvon von Nur Forschungsprojekten Forschungsprojekten Ja,mit mitIndikation, Indikation,z.B.: z.B.:FrauFrauJa, enaus ausBrustkrebs-belasteten Brustkrebs-belasteten en Familien Familien BestehendeGesetzliche GesetzlicheRegelungen Regelungen zu zu(prä(prä- Verbot medizinischer Tests Bestehende Verbot medizinischer Tests diktiven)genetischen genetischen Tests/ Tests/medizinischen medizinischen durchArbeitgeber Arbeitgeber vor vorEinEindiktiven) durch Tests stellung Tests stellung Ja,Gentechnik-Gesetz Gentechnik-Gesetz Ja, Tabelle20:Infrastruktureller 20:InfrastrukturellerKontext, Kontext,Hereditäres HereditäresMammakarzinom Mammakarzinom Tabelle 4.2.2. Indikationen 4.2.2 Indikationen Indikationen Im 4.2.2 folgenden Abschnitt werden die in den HTA-Berichten genannten Im folgenden Abschnitt werden werden die die in in den den HTA-Berichten HTA-Berichten genannten genannten Indikationen Indikationen für für eine genetische Im folgendenfür Abschnitt Indikationen eineoder genetische Testung aufbesprochen. BRCA1- oder BRCA2- eine genetische Testung auf BRCA1BRCA2-Genmutationen Testung auf BRCA1- oder BRCA2-Genmutationen besprochen. Genmutationen besprochen. Tabelle 23: Screeningstrategien, Hereditäres Mammakarzinom CCOHTA 1999 1999 CCOHTA ITA 2002 2002 ITA + ++ ++ ++ Screeningziel: Identifikation Identifikationvon von betroffenen betroffenen Individuen Individuen Screeningziel: Individuelle Risikobestimmung + Individuelle Risikobestimmung Screeningziel: Identifikation Identifikationvon vonCarriern Carriern Screeningziel: Kaskadenscreening Kaskadenscreening Tabelle21: 21:Screeningstrategien, Screeningstrategien,Hereditäres Hereditäres Mammakarzinom Mammakarzinom Tabelle 4.2.2.1. Individuelle Risikobestimmung 4.2.2.1 Individuelle IndividuelleRisikobestimmung Risikobestimmung Als4.2.2.1 Indikation für eine prädiktive genetische Testung auf BRCA1Als Indikation für eine prädiktive genetische genetische Testung auf auf BRCA1- und und BRCA2-Mutationen BRCA2-Mutationen wird wird in in Indikation für eine prädiktive undAlsBRCA2-Mutationen wird in beiden Testung Berichten BRCA1die Feststellung des beiden Berichten die Feststellung des Brustkrebsrisikos von Frauen aus Hochrisikofamilien genannt. beiden Berichten von die Feststellung desHochrisikofamilien Brustkrebsrisikos vongenannt. Frauen ausDer Hochrisikofamilien genannt. Brustkrebsrisikos Frauen aus gene-und/ oder sekundärDer genetische genetische Befund Befund soll soll die die informierte informierte Entscheidung Entscheidung für für oder oder gegen gegen primärprimär- und/ Der oder sekundärtische BefundMaßnahmen soll die informierte Entscheidung für oderggf. gegen primär- und/ präventive (Früherkennungsuntersuchungen, prophylaktische Operation, FamilienFamilienpräventive Maßnahmen (Früherkennungsuntersuchungen, ggf. prophylaktische Operation, oderplanung) sekundärpräventive Maßnahmen (Früherkennungsuntersuchungen, ggf. unterstützen. BRCA1und BRCA2-Testungen werden auch als "Kaskadenscreening" planung) unterstützen. BRCA1- und BRCA2-Testungen werden auch als "Kaskadenscreening" prophylaktische Operation, Familienplanung) unterstützen. BRCA1- und BRCA2-Testungen werden auch als „Kaskadenscreening“ Ergebnisse Ergebnisse t388 34 34 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h (vergl. 4.1.2.2) im familiären Umfeld von betroffenen Patientinnen (bzw. in Ausnahmefällen auch Patienten) eingesetzt. In Österreich genetische Beratungen vor (bzw. und nach der Untersuchung (vergl. 4.1.2.2) im familiärensind Umfeld von betroffenen Patientinnen in Ausnahmefällen auch Patienten) eingesetzt. gesetzlich vorgeschrieben. In ÖsterreichDie sindFolgen genetische vor und nach der Untersuchung gesetzlich vorgeschrieben. desBeratungen Technologieeinsatzes werden in beiden Berichten ganz ähnDie Folgen des werden in beiden Berichten ganz ähnlich gesehen. lichTechnologieeinsatzes gesehen. Folgedimension medizinisch / physisch für die Zielperson "Vorteile" "Probleme" Prophylaktische Mastektomie senkt das Risiko relativ um 90% (ITA) Eine in jungen Jahren beginnende regelmäßige Mammographie bei Frauen aus Hochrisikogruppen hat das Potenzial selbst Schaden auszulösen. Man schätzt, dass ein zusätzlicher strahleninduzierter Tod bei 10.000 gescreenten Frauen im Verlauf von 10 Jahren auftritt (ITA). Prophylaktische Tamoxifengabe (USA) senkt das Risiko relativ um 45% (ITA) Wenn eine prophylaktische Mastektomie in Anspruch genommen wird, dann ist mit einer Narbenbildung und den entsprechenden Folgen sowie mit der Beeinträchtigung der sexuellen Identität zu rechnen (CCOHTA). psychisch für die Zielperson sozial Familie Ausschluss des Trägerstatus in belasteten Familien kann entlastend wirken („… the psychological benefit of relief from uncertainty…“ (ITA) Die Familie kann durch das Wissen um Die Familie kann durch das Wissen um den Träger-/ Nicht-Trägerstatus entlastet den Träger-/ Nicht-Trägerstatus belastet werden (CCOHTA). werden (CCOHTA). sozial Konfliktpotenzial, falls die getestete Person Informationen zum Carrierstatus weiteren gefährdeten Familienangehörigen nicht preisgeben möchte, obwohl für diese Personen Prävention sinnvoll und möglich wären (CCOHTA). Arzt-Patienten-Beziehung sozial Stigmatisierungspotenzial in Familie sowie unter Freunden, Kollegen Freunde, Kollegen, Nachbarn gesellschaftlich Arbeitswelt, Versicherungen, Die Belastung einer Frau, die ihren Trägerstatus kennt, kann erheblich sein, insbesondere bei den bekannten Grenzen der präventiven Möglichkeiten (CCOHTA). Bestehende gesetzliche Regelung in Österreich in Bezug auf Versicherungen und genetische Tests (ITA) Der kanadische HTA-Bericht fragt nach dem möglichen Verlust des Versicherungsschutzes oder des Arbeitsplatzes. Gesundheitswesen mögliche versicherungsrechtlichen Konsequenzen eines positiven Testergebnisses (ITA) kulturell Personen (z. B.: Ashkenazi, USA) aus Hochrisikogruppen könnten einem moralischen Zwang zum Test mit seinen unerwünschten Handlungskonsequenzen unterliegen (CCOHTA). Gesellschaft „Kranke ohne Symptome“ nach positivem genetischem Test (ITA) ökonomisch Entsolidarisierung öffentlicher Gesundheitssysteme (ITA) Tabelle 24: Technologiefolgen, Risikoscreening, Hereditäres Mammakarzinom Tabelle 22: Technologiefolgen, Risikoscreening, Hereditäres Mammakarzinom Ergebnisse 35 389u H TA - B e r i c h t e 4.2.3.Ordnung der diskutierten ethischen Aspekte nach Beauchamp und Childress Auch in den HTA-Berichten zum hereditären Brustkrebs werden Technologiefolgen angesprochen, die im weitesten Sinne der oben eingeführten Arbeitsdefinition von „ethischen Aspekten“ entsprechen. Sie werden, soweit möglich, im Folgenden den vier ethischen Grundprinzipien nach Beauchamp und Childress bzw. den ergänzenden Prinzipien für Public Health-Maßnahmen zugeordnet. 4.2.3.1. Autonomie Zu diesem Punkt nehmen beiden Berichte Stellung. Das Recht auf Selbstbestimmung (informed consent/ informed refusal zur Testteilnahme) sowie das Recht auf Wissen bzw. Nicht-Wissen werden angesprochen. Die Notwendigkeit einer begleitenden genetischen Beratung wird betont. ITA weist darauf hin, wie wichtig die Art und Weise ist, in der das Testergebnis an die entsprechende Person weitergegeben wird (non-direktive Beratung vor und nach Testdurchführung, verständliche Risikokommunikation). Die Privatsphäre des Ratsuchenden muss geschützt werden (CCOHTA). Die Vertraulichkeit der Testergebnisse darf nicht außer Acht gelassen werden, was laut CCOHTA angesichts der Besonderheit der genetischen Information im Widerspruch zu den Bedürfnissen der Familie stehen kann. Die Befähigung zu einer autonomen Entscheidung bedarf der Information. ITA fordert: „Mitbestimmen setzt ein gewisses Maß an Mitwissen voraus!“ CCOHTA thematisiert darüber hinaus den Besitzstand genetischer Proben und ihre Verwahrung sowie datenschutzrechtliche Aspekte. 4.2.3.2. Schadensvermeidung CCOHTA betont die Verpflichtung gegenüber der zu testenden Person, Risiken und Belastungen zu verhindern, abzuwenden oder zu minimieren. Hierzu gehöre, zum Beispiel, Frauen durch die Unterstützung des betreuenden Arztes Angst und Depressivität zu nehmen. ITA sieht in der Unsicherheit und fraglichen Qualität der angebotenen genetischen Tests und der Beratung ebenso ein Schadenspotenzial wie im fraglichen Nutzen eines Tests, wenn keine Therapiemöglichkeit existiert. Generell besteht die Gefahr einer Stigmatisierung durch die „Etikettierung“ der testpositiven Personen als „Kranke ohne Symptome“. t390 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h In beiden HTA-Berichten wird angenommen, dass es zu einer Kommerzialisierung des Marktes genetischer Tests kommt. ITA befürchtet, dass wenig aussagekräftige Tests auf den Markt kommen und in Anspruch genommen werden. Darüber hinaus könnten Testung und qualifizierte Beratung aus monetären Gründen entkoppelt werden. Finanzierungsmodalitäten sind für prädiktive genetische Tests noch zu klären. ITA fordert deshalb Regulierungsmaßnahmen auf europäischer Ebene für Testqualität und Rahmenbedingungen. CCOHTA schlägt zu diesem Zweck die Erstellung von (nationalen) Leitlinien vor. CCOHTA empfiehlt einen prädiktiven genetischen Test „Personen unter Risiko“ anzubieten, was darunter zu verstehen ist, wird nicht weiter spezifiziert. Schadenspotenzial besteht durch die als Konsequenz eines positiven Testergebnisses eingeleiteten prophylaktischen Maßnahmen (psychologische Belastung durch häufige Früherkennungsunte rsuchungen mit Warten auf Ergebnisse; Strahlenbelastungen durch häufige und frühzeitig initiiertes Mammographien; physische, psychische und soziale Belastungen durch prophylaktische Mastektomie) (CCOHTA, ITA). Die Autorinnen des ITA stellen die prophylaktische Mastektomie als präventive Maßnahme in Frage, und zwar nicht unbegründet: Die Organ erhaltende Operation ist heute therapeutischer Standard, eine prophylaktische Mastektomie wäre somit ein radikaleres Vorgehen als die kurative Behandlung einer erkrankten Person. Die prophylaktische Mastektomie ist zwar in der Lage, das Risiko an Brustkrebs zu erkranken, zu verringern, kann es aber nicht aufheben. Außerdem, so berichten Jonas et al., sei der Überlebensvorteil eines solchen Eingriffes fraglich. Auch für die Mammographie als Früherkennungsmaßnahme ist ein Schadenspotenzial anzunehmen: ITA gibt Schätzun-gen an, nach denen auf 10.000 mammographierte Frauen innerhalb von 10 Jahren mit einem zusätzlichen Todesfall zu rechnen ist. 4.2.3.3. Wohltun Das Prinzip der Schadensvermeidung wird ergänzt durch das Prinzip des Nutzens, des Wohltuns. CCHOTA und ITA führen die potenzielle psychische Entlastung (Wohlergehen) von Personen aus Hochrisikofamilien bei Kenntnis des Trägerstatus, unabhängig vom Ausfall des Testergebnisses, an. Vor allem von CCOHTA, aber auch von ITA werden unter der Vorgabe „Wohltun“ die möglichen Effekte der wenigen verfügbaren Prophylaxemaßnahmen angeführt, auch wenn die Studienergebnisse nicht immer eindeutig sind. Dazu gehören die Verbesserung der Lebenserwartung 391u H TA - B e r i c h t e durch Früherkennungsmaßnahmen und frühzeitige Therapie, aber auch mögliche positive Aspekte der prophylaktischen Operation („einzige effektive Möglichkeit zur Risikoreduktion“ und „psychological peace of mind“). 4.2.3.4. Gerechtigkeit Die Autoren des ITA thematisieren unter dem Aspekt der Gerechtigkeit den Anspruch auf gleichen Zugang zu medizinischen Leistungen. Dabei sei es vor allem erforderlich, die Verantwortlichkeit der Solidargemeinschaft bei prädiktiven genetischen Tests genau zu definieren und die Finanzierung im solidarisch organisierten Gesundheitssystem zu organisieren. 4.2.4.Ordnung der diskutierten ethischen Aspekte aus Public Health Sicht 4.2.4.1. Verhältnismäßigkeit Der Aspekt der „Verhältnismäßigkeit“, d.h. eine direkte Gegenüberstellung von Nutzen und Schaden des prädiktiven Tests wurde in den Berichten nicht explizit bearbeitet. Bei ITA findet sich allerdings eine direkte Nutzen- und Schadenabwägung der Testkonsequenzen. Es werden Studiendaten zum Nutzen (angegeben in QALYs) von intensiven Früherkennungsprogrammen, prophylaktischer Mastektomie, medikamentöser Prophylaxe allein oder in Kombination vorgestellt, nachdem zuvor ihr Schadenspotential beschrieben wurde. 4.2.4.2. Befähigungsgerechtigkeit Der Aspekt Befähigungsgerechtigkeit (vergl. 4.1.4.2) wird in den HTABerichten implizit angesprochen: n im Kontext mit Zugangsgerechtigkeit (ITA); n im Zusammhang mit der Notwendigkeit einer non-direktiven, umfassenden, verständlichen Beratung als Voraussetzung für informed consent / informed refusal zur Teilnahme an diagnostischen Maßnahmen (ITA, CCOHTA) 4.2.4.3. Verantwortlichkeit des Einzelnen Im kanadischen HTA-Bericht wird die Verantwortlichkeit des Einzelnen gegenüber der Familie bei positivem Testergebnis angesprochen, z.B. die Verantwortung einer jüdischen Frau (Ashkenazi) ihren Angehörigen gegenüber. Wie weiter oben unter „Folgen des Technologieeinsatzes auf die ArztPatienten-Beziehung“ angedeutet, wird von CCOHTA angesprochen, dass für den Arzt eine „ethische“ Verpflichtung bestehen könnte, das erhöhte t392 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h familiäre Krebsrisiko auch ohne Einwilligung des getesteten Probanden mitzuteilen. Das Vorgehen soll den Familienmitgliedern die Möglichkeit zur wirksamen Prophylaxe und / oder Frühtherapie geben und eine informierte Familienplanung erlauben. 4.2.4.4. (Bürger-)Partizipation in Entscheidungsprozessen Bei beiden HTA-Berichten bleibt unklar, ob und in welchem Maße die Perspektiven von Betroffenen und der Allgemeinbevölkerung in die Bewertungen integriert worden sind. Der Aspekt „Bürgerpartizipation“ wird bei CCOHTA nicht thematisiert. Bei ITA wird zumindest als beratende „Expertin“ eine Mitarbeiterin eines Frauengesundheitszentrums genannt, ihre Rolle im Rahmen der Berichterstellung wird allerdings nicht näher erläutert. ITA fordert in seinen Schlussfolgerungen eine Verbesserung der Informationslage für die Bevölkerung zu prädiktiven genetischen Testverfahren und die Schaffung von Strukturen zur partizipativen Prioritätensetzung nach dem Muster der „Bürgerkonferenz“ in Deutschland bzw. den „Publiforen“ der Schweiz. Diese Empfehlung betrifft allerdings den ganzen Bereich prädiktive genetische Testung, nicht allein das hereditäres Mammakarzinom. 4.2.4.5. Umfassende Sicherung der Gesundheitsversorgung Der HTA-Bericht aus Österreich spricht die Finanzierung prädiktiver genetischer Test auf dem Hintergrund einer drohenden Kommerzialisierung und eines möglichen Angebots unsinniger Tests an. Eine Regelung wird für die Solidargemeinschaft gefordert. Im staatlich organisierten Gesundheitssystem Kanadas fordert CCOHTA Leitlinien für die Implementierung genetischer Tests in die Regelversorgung. 4.2.5.Bewertung CCOHTA weist auf begrenzte Präventionsmöglichkeiten (inkomplette Penetranz der BRCA1- bzw. BRCA2-Mutation, Unsicherheiten im Rahmen der konventionellen klinischen Diagnostik, eingeschränkte Möglichkeit einer prophylaktischen Therapie) hin. Ihr qualitativer HTA-Bericht fordert genetische Tests zur Senkung von Morbidität und Mortalität bei hereditärem Brustkrebs. Dabei wird betont, dass die herkömmlichen klinischen Verfahren wie klinische Brustuntersuchung und Mammographie dazu nicht unbedingt geeignet sind. Zum Zeitpunkt der Berichtserstellung wurde in Kanada nur innerhalb klinischer Forschung eine prädiktive genetische Testung durchgeführt. Noorani et al. (1999) fordern, die Entwicklung von Leitlinien zum Umgang mit prädiktiven genetischen Tests. 393u H TA - B e r i c h t e ITA gibt folgendes zu bedenken: Es handelt sich bei dem hereditären Mammakarzinom um ein schweres Krankheitsbild, die Behandlung ist aufwendig und langwierig. Die Autoren erörtern die Aussagekraft und Validität der angebotenen Tests als auch die begrenzte Möglichkeit zu Prävention, Früherkennung und Therapie. Sie bezeichnen das Bevölkerungsbezogene Risiko an Brustkrebs zu erkranken als hoch. Aus den Erörterungen epidemiologischer und ethischer Aspekte in ihrer Bewertung schlussfolgern sie, dass es eine Partizipation der Bevölkerung an Entscheidungen zu prädiktiven genetischen Tests geben muss. Dazu ist die Öffentlichkeit möglichst umfassend zu informieren. Inwieweit genetische Tests von der Solidargemeinschaft getragen werden sollen, soll geklärt werden. Da nur 5% aller Frauen, die an Brustkrebs erkranken, ein hereditäres Leiden haben, wird ein prädiktiver genetischer Test bisher nur der entsprechenden Risikogruppe angeboten. Notwendig ist eine verständliche Risikokommunikation auf dem Boden einer qualifizierten genetischen Beratung. Nach unterschiedlichen Perspektiven (Individuum, Familie, Profession, Gesellschaft) differenzierte Ansätze für eine ethische Diskussion können Tabelle 25 entnommen werden. t394 "Indexfall" schafft Zugang zum Versorgungssystem für Verwandte? Positive Testergebnisse führen zu Folgen, die psychisch und sozial als negativ wahrgenommen werden (Angst, Stigmatisierung, Diskriminierung)? Ergebnisse Tabelle 25:23: "Ethische" Probleme im Zusammenhang mit der BRCA1 und BRCA2 Testung Tabelle „Ethische“ Probleme im Zusammenhang mit der BRCA1 und BRCA2 Testung Gerechtigkeit - Gefährdung Gerechtigkeit - Chancen Positive Testergebnisse und ihre Konsequenzen können zu psychischem und physischem Schaden führen (prophylaktische Mastektomie, Tamoxifeneinnahme, Strahlenbelastung durch Mammographie) Präventionsmaßnahmen werden möglicherweise gezielt in Anspruch genommen Korrekte Informationen durch richtig positive / richtig negative Testergebnisse können zur psychischen Entlastung führen Widerspruch zwischen dem Recht auf Datenschutz seitens des Getesteten und dem Informationsbedarf der Familie. 40 Sicherstellung eines gleichmäßigen, qualitativ hochwertigen Test- und Beratungsangebotes durch Leitlinien. Non-direktive Beratung als Instrument für eine informierte, tragfähige Arzt-PatientBeziehung? Professionen Kommerzialisierungstendenz schafft ungleiche Zugangsvoraussetzungen Gleichmäßigkeit des Zugangs und der Versorgung? Menschlicher und monetärer Aufwand für Testdurchführung und Beratung im Falle der Testeinführung zulasten der Solidargemeinschaft. (Allokation knapper Ressourcen) Fraglich: Verminderung der Krankheitslast durch Prävention des Krankheitsausbruchs? Druck durch Versicherungswirtschaft (Lebens- und Krankenversicherungen) Partizipative Entscheidungsprozesse vor dem Hintergrund eines wachsenden Marktes für genetische Testverfahren (ökonomischer Druck), Partizipationsmöglichkeiten der Bürger beim Entscheidungsprozess? Befähigung der Gesellschaft zur informierten Entscheidung für oder gegen die Einführung des Testverfahrens? Befähigung der Gesellschaft zur Konsentierung von erwünschten Testfolgen? Gesellschaft Schadens- und Belastungspotenzial Nutzen(potenzial) Gefahr, wenn der Besitzstand genetischer Proben nicht klar ist. Verantwortungsgefühl für Familie, Gesellschaft beeinflusst die eigene freie Entscheidung Gruppendruck, -zwang? Vertraulichkeit der Daten Mitteilung von unerwünschten Informationen? Ausreichend Informationen zur Befähigung eines "informed consent" / "informed refusal", einer informierten Familienund Lebensplanung? Ausreichend Informationen zur Befähigung eines "informed consent" / "informed refusal" durch qualifizierte, nondirektive genetische Beratung Informierte Familien- und Lebensplanung? soziales Umfeld Individuum Autonomie - Gefährdung Einführung Autonomie - Chancen Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h 395u H TA - B e r i c h t e 5. Diskussion 5.1.Wird in HTA-Berichten zur Bewertung von genetischen Testverfahren auf die ethischen Implikationen des Technologieeinsatzes eingegangen? Insgesamt wurden sieben HTA-Berichte zu genetischen Testverfahren analysiert, ob und in wieweit eine Diskussion ethischer Konsequenzen des Verfahrenseinsatzes vorgenommen wurde und ob diese Ergebnisse Eingang in die Schlussfolgerungen der Berichte gefunden haben. In zwei von sieben Berichten wird die Notwendigkeit zu Betrachtung ethischer Konsequenzen explizit (AETMIS 2001; CCOHTA 1999) in drei weiteren (MSAC 2002; ITA 2002; Murray 1999) implizit als Gegenstand der Bewertung benannt. Im Bericht NCCHTA, 2001 folgt die Einführung in ethische Probleme im Teil „Hintergrund“, der Bericht NCCHTA, 2003 klammert die Beschreibung ethischer Probleme weitgehend aus und gibt lediglich in der abschließenden Diskussion ausgewählte Punkte zu bedenken. Allen Berichten gemeinsam ist jedoch die Tatsache, dass eine Definition bzw. die Nennung eines Konzeptes als Basis für „ethische“ Bewertungen fehlt. ITA 2002 und NCCHTA 1997 verweisen auf nationale Positionspapiere, ohne dass deren zugrunde liegende Konzepte näher erläutert werden. Weiterhin wird in allen Berichten die Tendenz erkennbar, ethische mit sozialen, psychologischen und teilweise rechtlichen Konsequenzen des Verfahrenseinsatzes vermengt zu diskutieren. Die Angaben aus den Berichten selber lieferten somit kein Gerüst für eine „Bestandsaufnahme“ der ethischen Diskussion. Legt man die unter 2.1 angeführte Arbeitsdefinition für ethische Aspekte („Unter „Ethischen Aspekten“ werden diejenigen Bestandteile eines HTABerichtes verstanden, die sich auf die Bewertung medizinischen Handelns beziehen und die explizit oder implizit auf ethische Prinzipien und/oder auf Begriffe und Kategorien Bezug nehmen, die von diesen Prinzipien abgeleitet sind oder ihnen zugrunde liegen.“) von Droste et al. zugrunde, lässt sich feststellen, dass die Autoren aller hier analysierten HTA-Berichte „ethische“ Betrachtungen in ihre Verfahrensbewertungen einfließen lassen. Umfang und Stellenwert im Gesamtwerk sind dabei allerdings variabel. Es werden drei prinzipielle Herangehensweisen an ethische Fragestellungen erkennbar: 1. Ethische, psychologische und gesellschaftliche Konsequenzen des konkreten Verfahrenseinsatzes werden in einem separaten Kapitel des Berichtes diskutiert und fließen unmittelbar in die Formulierung der Schlussfolgerungen ein (AETMIS 2001; CCOHTA 1999). Dabei wird auch zwischen diesen t396 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h beiden Optionen noch ein Unterschied deutlich: während im AETMIS Bericht die ethischen Erwägungen modifizierend in den Schlussfolgerungen berücksichtigt wurden, werden im Bericht von CCOHTA die ethischen Problembereiche genannt, ohne dass klar wird, ob und wie sie bei der Formulierung der Schlussfolgerungen Berücksichtigung fanden. Sie stehen quasi „separat“ neben den Forderungen nach Qualitätssicherung und der Durchführung weiterer klinischer Studien. 2. Die Autoren stellen allgemeine Ausführungen zu ethischen Implikationen und Reflexionen zum gesellschaftlichen Diskurs prädiktiver genetischer Testverfahren voran bzw. ans Ende der Verfahrensbewertung. Implizit legen diese Ausführungen einen Bezug zu den bewerteten Verfahren nahe und gehen, ebenfalls implizit, in die Schlussfolgerungen ein (ITA 2002). 3. Die Autoren reflektieren an verschiedenen Stellen der Verfahrensbewertung ethische, (psychologische und soziale) Konsequenzen des Verfahrenseinsatzes. Dabei wird dies in einem der Berichte regelmäßig bei den verschiedenen Einsatzoptionen vorgenommen (NCCHTA 2001), in anderen nur sporadisch (MSAC 2001; NCCHTA 1997) oder sehr kursorisch in der Abschlussdiskussion (NCCHTA 2003). 5.2.Welche ethischen und Public Health relevanten Fragestellungen werden angesprochen? Die Analyse der HTA-Berichte zum Fragile-X-Syndrom und zum hereditären Mammakarzinom hat gezeigt, dass einzelne Aspekte, die den Prinzipien von Beauchamp und Childress zuzuordnen sind, in fast allen Berichten genannt wurden. Dabei wurden das Recht auf Autonomie und die Verhinderung von Schaden am häufigsten diskutiert, Wohlergehen und Gerechtigkeit wurden eher selten thematisiert. Eine systematische Gegenüberstellung von sich widersprechenden Prinzipien im Sinne einer ethischen Diskussion und Gewichtung wurde allerdings in keinem der Berichte vorgenommen. Nur in zwei Berichten (NCCHTA 2001 und ITA 2002) wurden die ethischen Problembereiche aus den verfügbaren klinisch-epidemiologischen Informationen zum Krankheitsbild und zu den Testverfahren abgeleitet und vor dem Hintergrund der allgemein akzeptierten Voraussetzungen für die Einführung von (genetischen) Screeningverfahren (nach NSC modifizierte Wilson und Jungner Kriterien; Österreichisches Gentechnikgesetz) entwickelt. Unter den Public Health relevanten Aspekten wurde am häufigsten auf die Befähigungsgerechtigkeit (im Sinne von erforderlichen Aufklärungsund Beratungsmaßnahmen) und auf die Sicherstellung einer umfassenden Gesundheitsversorgung (vor allem unter dem Aspekt „erforderliche Infrastruktur“) eingegangen. Die ausführlichsten und differenziertesten 397u H TA - B e r i c h t e Stellungnahmen zu den Public Health relevanten Aspekten finden sich im Bericht des ITA, allerdings beschäftigen sich viele der Ausführungen mit den Konsequenzen prädiktiver genetischer Tests allgemein. Konsequente Analysen der nationalen bzw. regionalen Vorbedingungen, die hinweisend auf Probleme bei der Sicherstellung der umfassenden Versorgung, der Zugänglichkeit und Gerechtigkeit geben, finden sich in den Berichten des NCCHTA, AETMIS, ITA und teilweise bei CCOHTA. Die Berichte von MSAC, 2001 und NCCHTA, 2003 zum Fragile-X-Syndrom enthalten ausgesprochen kurze Ausführungen zu ethischen Aspekten. Der Bericht des NCCHTA ist dabei in der Reihe der Berichte von 1997 und 2001 zu sehen, wobei differenzierte ethische Ausführungen im Bericht von 2001 zu finden sind. MSAC gehört zu den HTA Institutionen, die auf Anforderung Verfahrensbewertungen zu unterschiedlichen Themen auf dem Boden systematischer Literaturübersichten für die australische Gesundheitsbehörde erstellt. Im Vordergrund stehen dabei Sicherheit und Wirksamkeit unter Studien- wie unter Alltagsbedingungen. Für die Bearbeitung ethischer Implikationen bleibt vor dem Hintergrund stringenter methodischer Vorgaben wenig Raum. 5.3.Welche Forschungsmethoden werden zur Bewertung ethischer und sozialer Konsequenzen eingesetzt? Auswahl der Themen: Hinweise, mit welchem methodischen Ansatz ethische Fragestellungen in den Berichten bearbeitet wurden, sind nur in wenigen Berichten ansatzweise zu erkennen. Die Berichte von ITA, 2002 und NCCHTA, 2001 identifizieren die von ihnen besprochenen ethischen Problembereiche aus den (nicht erfüllten) Kriterien für sinnvolle Screeningmaßnahmen (CancerWeb, Report of the National Screening Committee). Dabei werden vor allem die Unsicherheit der Prädiktion von Krankheit bei variabler Penetranz der genetischen Veränderung und das Problem der fehlenden Behandelbarkeit der vererbten Störung (Fragile-X-Syndrom) bzw. der Belastung durch drastische Präventionsmaßnahmen (präventive Mastektomie) thematisiert. CCOHTA, NCCHTA 1997, NCCHTA 2001 und ebenfalls ITA entnehmen zu diskutierende Punkte den nationalen Gesetzgebungen (Medical Research Council for Canada, Österreichisches Gentechnikgesetz, National Screening Committee). t398 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h In den Berichten von MSAC und NCCHTA 2003 wird nicht klar, wie die Auswahl der (wenigen) angesprochenen ethischen Aspekte getroffen wurde. ITA und NCCHTA, 2001 greifen darüber hinaus auf die aktuelle wissenschaftliche Diskussion um den Stellenwert prädiktiver genetischer Testverfahren zurück. AETMIS greift die zu diskutierenden Aspekt aus dem aktuellen gesellschaftlichen Diskurs um prädiktive genetischen Testverfahren auf und stellt einen engen Bezug zum lokalen / regionalen Kontext her. Alle Berichte geben weiterhin Kooperationspartner aus den Gebieten Onkologie (Brustkrebsberichte), Pädiatrie (Fragile-X-Berichte), Humangenetik, Labordiagnostik und Gynäkologie an. Bei AETMIS gehörten auch Patientenvertreter, Juristen, Physiotherapeuten, Erzieher und Lehrer zum Beratungsgremium. Inwieweit diese Kooperationspartner in die Identifikation von relevanten ethischen Aspekten involviert waren, wird nicht klar. Ein theoretisches Konzept, welches die ethischen Diskussionen strukturiert und leitet, wird in keinem Bericht erkennbar. Themenbearbeitung: In keinem der Berichte wird klar, ob eine systematische Bearbeitung der ethischen Fragestellungen erfolgte. Die Berichte aus dem NCCHTA, CCOHTA und MSAC geben an, systematische Literaturrecherchen durchgeführt zu haben, nachvollziehbar dokumentiert ist diese allerdings nur bei CCOHTA. Ob spezifische Stichworte zur Auffindung von mit ethischen Problemen befassten Artikeln eingesetzt wurden, bleibt unklar, ebenso die Selektion der Rechercheergebnisse. Den Berichten von ITA und AETMIS sind keine Angaben zur Informationsrecherche und Selektion zu entnehmen. Ein einziger Bericht (NCCHTA 2001) integriert eigene Erhebungen zu Patientenpräferenzen in die ethischen Bewertungen. Bei ITA und AETMIS werden ethische Argumente zum größten Teil mit Daten aus publizierten empirischen Untersuchungen untermauert. Die Berichte des NCCHTA und CCOHTA belegen ihre Aussagen teilweise mit Studiendaten, teilweise mit Zitaten aus sonstigen Publikationen und teilweise überhaupt nicht. Im MSAC Bericht werden die Anmerkungen zu ethischen Aspekten nicht mit Zitaten belegt. 399u H TA - B e r i c h t e Zusammenfassend lässt sich feststellen, dass in den durchgesehenen HTABerichten keine systematische Methodik zur Bearbeitung von ethischen Fragestellungen eingesetzt bzw. dokumentiert wurde. 5.4.Wie werden die Ergebnisse der Bewertung von ethischen und sozialen Implikationen bei der Generierung von Schlussfolgerungen von HTABerichten umgesetzt? Beide HTA-Berichte zum hereditären Mammakarzinom lassen Teile der diskutierten ethischen Aspekte in die Schlussfolgerungen einfließen. Bei ITA liegt hier ein eindeutiger Schwerpunkt auf der Befähigung sgerechtigkeit. Angesichts sich entwickelnder bzw. zu befürchtender Kommerzialisierung und Verfügbarmachung von genetischen Tests werden vor allem adäquate Informationsstrategien für unterschiedliche Zielgruppen in der Bevölkerung gefordert, so wie Modelle zur aktiven Partizipation der Bürger an der Prioritätensetzung im Gesundheitswesen. Dabei beziehen sich die Schlussfolgerungen allerdings nicht allein auf das hereditäre Mammakarzinom, sondern auf prädiktive genetische Testverfahren allgemein. Der Bericht aus dem CCOHTA sieht vor dem Hintergrund des gleichen Szenarios Regulationsbedarf zur Sicherung des Zugangs und der Qualität von Screeningstrategien. Es wird die Erstellung von Leitlinien empfohlen. Unter den HTA-Berichten zum Fragile-X-Syndrom gehen bei AETMIS und NCCHTA, 2001 ethische und Public Health relevante Aspekte direkt in die Schlussfolgerungen ein. Bei AETMIS stehen dabei die Sicherung einer adäquaten Gesundheitsversorgung und die Zugangsgerechtigkeit im Vordergrund. NCCHTA, 2001 lehnen eine bevölkerungsbezogene Screeningstrategie ab, weil aus monetären (begrenzte Ressourcen) und sachlichen (unsichere Prognose für Frauen mit „intermediate Allelen“) Gründen die Sicherstellung einer adäquaten Gesundheitsversorgung derzeit nicht gewährleistet werden kann. t400 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h 5.5.Gibt es Weiterentwicklungs- und / oder Forschungsbedarf zur Integration von ethischen Aspekten in Bewertungen genetischer Testverfahren? Im Gegensatz zu der Analyse von Kurz-HTAs (Droste et al. 2001) konnte für die kleine Stichprobe von (pragmatischen) HTA-Berichten zu genetischen Testverfahren gezeigt werden, dass ethische und Public Health relevante Fragen angesprochen, bearbeitet und teilweise in die Schlussfolgerungen der Berichte eingeflossen sind. Dabei werden allerdings einige Defizite erkennbar: n Es wird nicht deutlich, welches theoretische Konzept der Bewertung von ethischen Implikationen zugrunde liegt. n In den HTA-Berichten wird unscharf getrennt, ob die angesprochenen ethischen Probleme mit dem spezifisch zu bewertenden Testverfahren assoziiert sind oder ob es sich um eine Erörterung von ethischen Implikationen genetischer Diagnostik allgemein handelt. n Es wird keine systematische Methodik der Bewertung von ethischen Aspekten erkennbar. n Die Umsetzung von ethischen Erwägungen in Schlussfolgerungen scheint unsystematisch und beliebig. Die Defizite sind in der internationalen Diskussion um Methoden von HTA bekannt und nicht auf die Bewertung von genetischen Testverfahren beschränkt. Gängige, von der wissenschaftlichen Gemeinschaft konsentierte Methodenpapiere (z.B. Liberati 1997, Busse, Orvain 2002) nennen die Bewertung ethischer Implikationen als notwendigen Bestandteil von HTA. Umfang, Methodik und Zuständigkeit (Professionen, Expertise) werden allerdings nicht weiter spezifiziert. Unklar bleibt auch, welchen Stellenwert der ethischen Diskussion im Rahmen von HTA zukommt – ist sie ein wichtiger Bestandteil oder eher „Beiwerk“ neben Sicherheits-, Wirksamkeitsund ökonomischen Bewertungen? (Banta, 2004) Ein weiteres Problem wird offensichtlich, wenn die äußeren Rahmenbedingungen für das HTA berücksichtigt werden. Einerseits gibt es HTA-Aufträge, die einen mehr explorativen Charakter tragen und im Sinne eines wissenschaftlichen Forschungsprojektes bearbeitet werden können, andere werden vor dem Hintergrund eines konkreten und dringenden Entscheidungsbedarfs vergeben, was ihren zeitlichen und finanziellen Rahmen relativ eng fasst (z.B. Projektdauer 6-12 Monate, 1 wissenschaftliche Vollzeitstelle). Auch in den hier bewerteten Berichten werden diese Unterschiede deutlich: AETMIS und ITA nahmen die Bewertung mehr im Sinne eines wissenschaftlichen Forschungsprojektes vor, bei MSAC und 401u H TA - B e r i c h t e CCOHTA bestand konkreter Entscheidungsdruck. Die drei Berichte des NCCHTA nehmen eine Mittelstellung ein – sie wurden vor dem Hintergrund eines konkreten Entscheidungsbedarfs vergeben, waren aber zeitlich und von der finanziellen Ausstattung eher großzügig dimensioniert. Methodische Vorschläge zur ethischen Bewertung müssen so angelegt sein, dass sie in beiden Modellen von (pragmatischem) HTA anwendbar sind. [Von diesen HTA Modellen, die die Bewertung einer (oder mehrerer) Technologien zum Gegenstand haben, sind solche zu unterscheiden, die die Bewertung einer ganzen Gruppe oder Klasse von Technologien vornehmen (z. B.: „Prädiktive genetische Tests“). Ihre Ergebnisse richten sich an die Gesellschaft bzw. die Legislative und fließen gegebenenfalls in die normativen Rahmenbedingungen ein. D. h. es geht hier nicht allein um die Bewertung von ethischen Implikationen der Technologie, sondern es findet vielmehr eine Wechselwirkung zwischen Technologie und Gesellschaft statt. Diese Art von „parlamentarischem“ HTA bzw. TA ist in den folgenden Ausführungen nicht gemeint.] In pragmatischen HTAs kann die Zielsetzung einer „ethischen Bewertung“ zunächst das systematische Aufzeigen von Konfliktpotenzial (im Sinne von widerstreitenden moralischen Einschätzungen/Prinzipien) der Technologiefolgen sein. Um zu einer für die zu bewertende Technologie spezifischen Beschreibung der Technologiefolgen zu gelangen, sind zunächst die Ausgangsbedingungen zu klären. Hierzu gehören: n Darstellung des gesundheitspolitischen Entscheidungskontext („Policy Question“). n Beschreibung der Zielerkrankung: zugrunde liegender (genetischer) Defekt, Pathomechanismus, Genotyp-Phänotypassoziation, Klinik, Verlauf, präventive und therapeutische Optionen, Outcomes, Epidemiologie. n Technologie: technische Charakteristika, analytisches Substrat, analytische Testcharakteristika (zum Nachweis des Substrats: Validität, Reliabilität, Sensitivität, Spezifität). n Technologieeinsatz zur Erkennung der Zielerkrankung: diagnostische Testcharakteristika (prädiktive Werte in unterschiedlichen Zielpopulationen; Einbettung in unterschiedliche Untersuchungsstrategien); diagnostische Testcharakteristika im Kontext infrastruktureller, ökonomischer und rechtlicher Rahmenbedingungen (normativer Hintergrund). t402 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Für den Bereich genetische Testverfahren wird von der ACCE (Analytical validity, Clinical validity, Clinical utility, Ethical, legal and social implications) Arbeitsgruppe des CDC eine Struktur vorgeschlagen. Ein Gerüst für die Beschreibung der Zielerkrankung, der Krankheitslast, des Tests mit seinen Testcharakteristika, den Kontextbedingungen und möglichen (Differential)­indikationen liefern neben ACCE auch fast alle Methodenhandbücher für HTA – sie ist regulärer Bestand­teil jedes HTA. Zum Standardmethodenrepertoire des pragmatischen HTA gehören systematische Literaturübersichten, Meta-Analysen, die Analyse von administrativen Daten und Experteninterviews. Für ausgewählte Aspekte werden bei Bedarf gezielte (quantitative) Erhebungen durchgeführt, qualitative Methoden kommen eher selten zum Einsatz. Ein Abgleich mit Kriterien für „sinnvolle“ Screeningprogramme (z.B. Wilson & Jungner 1968; NSC 2003) kann an dieser Stelle bereits Hinweise auf (noch) fehlende Informationen oder Problembereiche, in denen gegenläufige Interessen manifest werden, geben. Die eigentliche Identifikation von moralischem Konfliktpotenzial setzt eine Struktur voraus, die die Einhaltung grundlegender ethischer Prinzipien aus der Perspektive aller Beteiligten (Individuen, familiäres und institutionelles Umfeld, Professionen, Gesellschaft) erlaubt. Hierdurch würde die getrennte Bewertung von „ethischen“ und „Public Health-relevanten“ Technologiefolgen entfallen. Im vorliegenden Bericht wurde eine Systematik zugrunde gelegt, die die Kriterien von Beauchamp und Childress (modifiziert) mit Public Health relevanten Diskussionspunkten zusammenführt. Die vorgeschlagenen Kriterien sind mit allgemein formulierten Fragen (nicht bezogen auf ein bestimmtes Testverfahren) in Tabelle 26 als „Template“ dargestellt. Unter „Individuum“ wird dabei die Person verstanden, die eine Testdurchführung in Erwägung zieht bzw. für die stellvertretend eine Testdurchführung in Erwägung gezogen wird. Das „Individuum“ ist unmittelbar von den Testergebnissen und ihren Konsequenzen betroffen. Unter „engem sozialen Umfeld“ soll die Familie, aber auch andere soziale Gemeinschaften verstanden werden, mit denen das Individuum in direktem Kontakt steht (z.B. Freundeskreis, Nachbarschaft, Arbeitsumfeld, Schule etc.). Die Testergebnisse können die Interaktion zwischen Individuum und Umfeld beeinflussen, bei manchen Teststrategien (z.B. Kaskadenscreening) können Personen aus dem sozialen Umfeld aber auch zu Betroffenen werden. Unter den „Professionen“ verstehen wir Anbieter und Kostenträger für alle, mit der Testdurchführung zusammenhängenden Leistungen. In dieser Gruppe allein werden schon drei, möglicherweise konkurrierende Interessen zu erkennbar: der Anspruch, eine bestmögliche Versorgung von Individuen 403u H TA - B e r i c h t e zu leisten, die Verantwortung für eine optimale und (bedarfs)gerechte Versorgung der (Versicherten)gruppe und die eigenen, z.B. monetären Interessen. Mit „Gesellschaft“ sind im Kontext von pragmatischem HTA alle Personen und Gruppen gemeint, die innerhalb eines Gesundheitssystems und eines Wirtschaftsgefüges leben, welche durch gesetzliche Regularien geformt werden. D. h. der Rahmen ist ein äußerer, innerhalb der Gesellschaft kann es unterschiedlich große Gruppen mit sehr unterschiedlichen Wert- und Moralvorstellungen geben. Die direkte Gegenüberstellung von Autonomiechancen und -gefährdungen, Nutzen- und Schadenspotential sowie Gerechtigkeitschancen und -gefährdungen in einer tabellarischen Übersicht erlaubt die Identifikation von widerstreitenden Interessen sowohl „zeilenweise“ als auch „spaltenweise“. Es können beispielsweise den Autonomieinteressen des Individuums und der Familie gegenläufige Autonomieinteressen der Gesellschaft oder der Professionen entgegenstehen. Aber auch innerhalb einer „Spalte“ werden widersprüchliche Interessen offensichtlich. So steht das Nutzenpotential immer seinem Schadenspotential gegenüber und geht, zumindest auf der Seite der Professionen und Gesellschaft (vor dem Hintergrund eines solidarisch finanzierten Gesundheitssystems), mit dem Anspruch auf eine bedarfsgerechte, gleichmäßige Versorgung und ihrem Ressourcenaufwand einher. Die Aufstellung geht von Interessenkonflikten im Falle der „Einführung“ eines genetischen Testverfahrens aus, es kann aber ebenfalls sinnvoll sein, Konflikt im Falle der „Nicht-Einführung“ zu diskutieren. Werden unterschiedliche Indikationen und Einsatzstrategien (z.B. Hochrisikogruppensc reening versus bevölkerungsbezogenes Screening) für den Test diskutiert, sollte für jede Indikation eine eigene Aufstellung vorgenommen werden. und falsche Informationen durch „falsch positive“ Testergebnisse führen zu Folgen, die physisch, psychisch und sozial als negativ und/oder inakzeptabel wahrgenommen werden? t404 Mitteilung von unerwünschten Informationen? Verantwortungsgefühl für Familie, Gesellschaft beeinflusst die eigene freie Entscheidung? Tabelle 26: Vorschlag: Ethische DiskussionsDiskussion punkte in HTAs zur Einführung von genetischen Testverfahren Gerechtigkeit - Gefährdung Gerechtigkeit - Chancen Korrekte Informationen durch "richtig positive" und falsche Informationen durch "falsch positive" Testergebnisse führen zu Folgen, die physisch, psychisch und sozial als negativ und/oder inakzeptabel wahrgenommen werden? SchadensBelastungs(potential) 48 Unterangebot aus monetären Gründen? Fehlender Zugang durch hohe Kosten? Gleichmäßigkeit des Zugangs und der Versorgung? Effizienz (Opportunitätskosten)? Effizienz (Opportunitätskosten)? Gleichmäßiges, bedarfsgerechtes Risikomanagement / gleichmäßige, bedarfsgerechte Versorgung sichergestellt? Ressourcenaufwand für Infrastruktur, Schulungen, Informationskampagnen? Versteckte Eugenik? Stärkung des Solidarprinzips? Verminderung der Krankheitslast? Versicherungswirtschaftliche Konsequenzen? Partizipative Entscheidungsprozesse vor dem Hintergrund wirtschaftlicher Interessen Einzelner (Firmen) möglich? Bedarfsgerechter Zugang vorhanden? Zum Überangebot führender "Moral Hazard"? "Indexfall" schafft Zugang zum Versorgungssystem für Verwandte? Ressourcenaufwand für Infrastruktur, Beratungen, Testdurchführung. Zu Überinanspruchnahme führender "Moral Hazard"? Datenmissbrauch? Unerwünschte Wirkungen bei der Testdurchführung? Korrekte Informationen durch richtig positive und falsche Informationen durch falsch positive Testergebnisse führen zu Folgen, die physisch, psychisch und sozial als negativ wahrgenommen werden (Stigmatisierung, Diskriminierung, Partnerschafts- und Familienprobleme, finanzielle Belastungen)? Verständnisvoller, solidarischer Umgang mit Betroffenen? Korrekte Informationen durch richtig positive / richtig negative Testergebnisse unterstützen die weitere Beratungs- / Behandlungsplanung? Paternalistische Regulationsmechanismen? Einschränkung der ärztlichen Diagnostikund Therapiefreiheit? Partizipationsmöglichkeiten der Bürger beim Entscheidungsprozess? Befähigung der Gesellschaft zur informierten Entscheidung für oder gegen die Einführung des Testverfahrens? Umgang mit differierenden Entscheidungen von Individuen? Befähigung der Gesellschaft zur Konsentierung von erwünschten und unerwünschten Testfolgen? Gesellschaft Falsch negative Informationen führen zu falscher Sicherheit? Korrekte Informationen durch richtig positive / richtig negative Testergebnisse führt zu Folgen (inklusive Präventions- oder Therapieoptionen), die physisch, psychisch und sozial als positiv wahrgenommen werden? Nutzen(potential) Unzureichende oder falsche Vorinformationen zum Nutzen-Risikopotential gefährden / verhindern "informed consent"? Korrekte Testergebnisse erlauben die Ausweitung der Nutzen tragenden Zielgruppe? Respekt vor den Präferenzen und der Entscheidung der Gruppe (Familie)? Respekt vor den Präferenzen und der Entscheidung des Individuums? Non-direktive Beratung als Instrument für eine informierte, tragfähige Arzt-PatientBeziehung? Professionen Gruppendruck, -zwang? Ausreichend Informationen zur Befähigung eines "informed consent" / "informed refusal", einer informierten Familien- und Lebensplanung? Ausreichend Informationen zur Befähigung eines "informed consent" / "informed refusal", einer informierten Familien- und Lebensplanung? Autonomie - Chancen Autonomie - Gefährdung soziales Umfeld Individuum Einführung Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h 405u H TA - B e r i c h t e Resümee Weitere Arbeiten müssten erweisen, ob diese pragmatische Einteilung sinnvoll ist oder ob andere Kriterien herangezogen werden sollten. In jedem Fall soll eine kriteriengebundene Reflexion von Technologiefolgen aus unterschiedlichen Perspektiven Transparenz in den Prozess der ethischen Diskussion bringen und verhindern, dass die subjektive Sichtweise des Bewerters in den Vordergrund tritt. Ein valides methodisches Repertoire zur systematischen Identifikation von Konfliktpotential ist im Kontext von pragmatischem HTA bisher nicht gebräuchlich. In zukünftigen Untersuchungen wird zu zeigen sein, inwieweit mit den zur Verfügung stehenden Methoden der Literatur- und Datenanalyse ausreichend Informationen zu gewinnen sind oder ob in ausgewählten Fällen interaktive bzw. partizipative Methoden herangezogen werden müssen, um eine vollständige Problembeschreibung zu erlauben. Noch deutlicher wird das methodische Defizit bei der Bewertung und Gewichtung der widersprüchlichen Argumentationen und ihrer Umsetzung in Schlussfolgerungen. In den gesichteten Berichten wird, mit Ausnahme der Reflexion auf den normativen Hintergrund und auf die Kriterien für „sinnvolle“ Screeningkriterien, keine systematische Heran­ge­hens­weise erkennbar. Die Rolle der unterschiedlichen, in den Beiräten vertretenen Professionen bleibt unklar. Hier fehlt eine Methodik, die eine Gewichtung der Konflikte unter Beachtung der unterschiedlichen Perspektiven erlaubt und sie transparent in Schluss­folgerungen transferiert. Gerade in diesem Bereich verfügt das „parlamenta­ri­sche“ TA über ein breites Methodenspektrum, welches den Entwicklungs­prozess im Be­reich HTA sicher unterstützen könnte (Reuzel et al. 2004). Gleichzeitig muss sicher ge­stellt sein, dass der zeitliche und ressourcenabhängige Rahmen von HTA dabei nicht ge­sprengt wird. t406 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Literatur Agencia e Evaluacion de Tecnologias Sanitarias de Andalucia (2002): Genetic testing services for hereditary diseases in Spain: results form a survey - primary research. Sevilla: Agencia e Evaluacion de Tecnologias Sanitarias de Andalucia (AETSA). Alberta Heritage Foundation for Medical Research (1999): BRAC Analysis genetic test. Edmonton, Alberta Heritage Foundation for Medical Research (AHFMR). Banta D (1997): EUR-ASSESS Project completed. Institut für Technikfolgenabschätzung und Systemanalyse (ITAS) Forschungszentrum Karlsruhe (Hrsg.): TA-Datenbank-Nachrichten 2 (6). Banta D (2004): Foreword. Poiesis & Praxis 2, 93-95. Bassett K, Lee PM, Green CJ, et al.: Triple-marker screening in British Columbia: current practice, future options. Office of Health Technology Assessment, Centre for Health Services and Policy Research, University of British Columbia. Beauchamp TL, Childress JF (1994): Principles of Biomedical Ethics. New York: Oxford University Press. Bell R, Petticrew M, Luengo S (1998): Screening for ovarian cancer: a systematic review. Health Technology Assessment 2(2). Blancquaert I, Caron L (AETMIS) (2002): Fragile X syndrome: the role of molecular diagnosis and screening in an integrated approach to services. Montreal: Agence d‘Evaluation des Technologies et des Modes d‘Intervention en Sante (AETMIS). Bloomington, MN (2002): Genetic testing for hereditary nonpolyposis colorectal cancer (HNPCC). Institute for Clinical Systems Improvement (ICSI), Technology Assessment Report. Bloomington, MN (2003): Genetic carrier testing for cystic fibrosis. Institute for Clinical Systems Improvement (ICSI), Technology Assessment Report. 407u H TA - B e r i c h t e Brand A (2002): Herausforderungen für das Handeln von Public Health. In: Möller PA (Hrsg.): Heilkunst, Ethos und die Evidenz der Basis. Frankfurt/M., Berlin, Bern, Bruxelles, New York, Oxford, Wien: Peter Lang - Europäischer Verlag der Wissenschaften, 115-122. Brasselet S, Charvet-Protat S, Fleurette F (1995): Opportunity of a screening program of Hemochromatosis in France. Agence Nationale pour le Developpement de l‘Evaluation Medicale, Paris. Bundesärztekammer (1998): Richtlinie zur Diagnostik der genetischen Disposition für Krebserkrankungen. Deutsches Ärzteblatt 95, 22. Bundesärztekammer (1998): Richtlinie zur pränatalen Diagnostik von Krankheiten und Krankheitsdispositionen. Deutsches Ärzteblatt 95, 50. Burke W, Atkins D, Gwinn M, et al (2002): Genetic Test Evaluation: Information Needs of Clinicians, Policy Makers, and the Public. American Journal of Epidemiology 156, 311-318 Busse R, Orvain J (2002): Working Group 4: Best Practice in Undertaking and Reporting HTA. European Collaboration for Assessment for Health Intervention (ECAHI) Report. Chicago IL (2002): Genetic testing for HFE gene mutations related to hereditary hemochromatosis. Blue Cross Blue Shield Association, TEC Assessment 16(22). Comis J, Conlon J (1991): An annotated bibliography of the costs and benefits of prenatal screening programs. Canadian Coordinating Office for Health Technology Assessment, Ottawa. Comite de Evaluation et de Diffusion des Innovations Technologiques (CEDIT) (1999): DNA genotyping with molecular beacon (systematic review, primary research, expert panel). CEDIT, Paris. Comite d‘ Evaluation et de Diffusion des Innovations Technologiques (CEDIT) (2001): DNA genotyping with molecular beacon - systematic review, primary research, expert panel. CEDIT, Paris. Conseil d‘Evaluation des Technologies de la Sante du Quebec (CETS) (1997): Duchenne and Becker muscular dystrophies: family screening and molecular diagnosis - nonsystematic review. CETS, Montreal. t408 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Conseil d‘Evaluation des Technologies de la Sante du Quebec (CETS) (1997): Family screening and molecular diagnosis of myotonic dystrophy. CETS, Montreal. Conseil d‘Evaluation des Technologies de la Sante du Quebec (CETS) (1998): Hereditary tyrosinemia type I: the contribution of molecular genetics to family-based carrier screening - nonsystematic review. CETS, Montreal. Dabrock P (2001): Capability Approach und Decent-Minimum. Befähigungsgerechtigkeit als Kriterium möglicher Priorisierungen im Gesundheitswesen. Zeitschrift für Evangelische Ethik 46, 202-215. Daele van den W (2004): Die Praxis vorgeburtlicher Selektion und die Anerkennung der Rechte von Menschen mit Behinderungen. In: A. Leonhardt (Hrsg.): Wie perfekt muss der Mensch sein? Behinderung, molekulare Medizin und Ethik, München: Ernst Reinhardt Verlag. Danish Centre for Evaluation and Health Technology Assessment (2002): Preimplantation genetic diagnosis - an HTA. Danish Centre for Evaluation and Health Technology Assessment (DACEHTA), Copenhagen. Deutsche Forschungsgemeinschaft (DFG) (2003): Prädiktive genetische Diagnostik. Wissenschaftliche Grundlagen, praktische Umsetzung und soziale Implementierung. Stellungnahme der Senatskommission für Grundsatzfragen der Genforschung. Bonn. Dewitz von C (2003): Stellungnahme für den Deutschen Bundestag. EnqueteKommission: Ethik und Recht der Modernen Medizin zur Frage der Forschung an Nichteinwilligungsfähigen. Charite – Universitätsmedizin Berlin Ethikkommission am Campus Virchow-Klinikum und Campus Berlin-Buch, Berlin. Droste S, Brand A (2001): Biochemical Screening for fetal chromosome abnormalities and neural tube defects - a technology assessment. Deutsches Institut für Medizinische Information und Dokumentation (DIMDI), Köln. Droste S, Gerhardus A, Kollek R (2003): Methoden zur Erfassung ethischer Aspekte und gesellschaftlicher Wertvorstellungen in Kurz-HTA-Berichten – eine internationale Bestandsaufnahme. Health Technology Assessment. Schriftenreihe des Deutschen Instituts für Medizinische Information und Dokumentation (DIMDI), Köln. 409u H TA - B e r i c h t e First Report of the National Screening Committee (1998). Health Departments of the UK, London. Framarin A (2003): First-trimester prenatal screening for Down syndrome and other aneuploidies. Agence d‘Evaluation des Technologies et des Modes d‘Intervention en Sante (AETMIS), Montreal. Gesellschaft für Humangenetik e. V. (1996) Positionspapier der Gesellschaft für Humangenetik e.V. medgen 8, 125–131. Gezondheidsraad (1994): Genetic screening. Rijswijk: Health Council of the Netherlands, Den Haag. Gezondheidsraad (1998): DNA diagnostics. Rijswijk: Health Council of the Netherlands, Den Haag. Gezondheidsraad (1999): Clinical genetic testing and counselling. Rijswijk: Health Council of the Netherlands, Den Haag. Grimshaw GM, Szczepura A, Hulten M, et al (2003): Evaluation of molecular tests for prenatal diagnosis of chromosome abnormalities. Health Technology Assessment 7(10). Hennen L (2001): TA in Biomedicine and Healthcare - from clinical evaluation to policy consulting. TA Datenbank-Nachrichten 10(1), 13-22. Ho C, Banerjee S, Mensinkai S (2003): Molecular diagnosis for hereditary cancer predisposing syndromes: genetic testing and clinical impact. Coordinating Office for Health Technology Assessment (CCOHTA), Technology Report Issue 41, Ottawa. http://cancerweb.ncl.ac.uk/ (accessed 18.05.2004) Institute of Technology Assessment (ITA) (1995): Genetic analysis: practice of diagnosis and counseling in Austria. Österreichische Akademie der Wissenschaften, Wien. Jonas S, et al (ITA) (2002): Prädiktive humangenetische Diagnostik bei hereditärem Mamma- und Kolorektalkarzinom. Institut für TechnikfolgenAbschätzung der österreichischen Akademie der Wissenschaften, Wien. L‘Agence Nationale d‘Accreditation d‘Evaluation en Sante (ANAES) (1999): Genetic hemochromatosis screening in France. ANAES, Paris. t410 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Liberati A, Sheldon TA, Banta HD (1997): EUR-ASSESS project subgroup report on methodology. Methodological guidance for the conduct of Health Technology Assessment. Int J Technol Assess Health Care 13,186-219. Marckmann G (2003): Was ist eigentlich prinzipienorientierte Medizinethik? In: Wiesing U (Hrsg.): Diesseits von Hippokrates. 20 Jahre Beiträge zur Ethik in der Medizin im Ärzteblatt Baden-Württemberg. Stuttgart: Gentner Verlag, 325-330. McIntyre L (2001): Pre-implantation diagnosis. Wessex Institute for Health Research and Development, University of Southampton, STEER: Succint and Timely Evaluated Evidence Reviews 1(15), Bazian Ltd (Editors), London. Medical Services Advisory Committee (MSAC) (2002): Antenatal screening for heritable thrombophilia. Medical Services Advisory Committee, Canberra, MSAC application 9b. Medical Services Advisory Committee (MSAC) (2002): Genetic test for fragile X syndrome. Medical Services Advisory Committee, Canberra, MSAC application 1035. Murray J, Cuckle H, Taylor G, et al. (1999): Screening for cystic fibrosis. Health Technology Assessment 3, 8. Murray J, Cuckle H, Taylor G, et al. (National Coordinating Centre for Health Technology Assessment - NCCHTA) (1997): Screening for fragile X syndrome. Health Technology Assessment 1, 4. National Screening Committee (NSC) (2003): Criteria for appraising the viability, effectiveness and appropriateness of a screening programme. March 2003. Nohr-Jensen L (2000): Triple Test for all pregnant women? A health technology assessment. Danish Centre for Evaluation and Health Technology Assessment (DACEHTA). Noorani HZ, McGahan L (1999): Predictive genetic testing for breast and prostate cancer. Coordinating Office for Health Technology Assessment (CCOHTA), Technology Report Issue 41, Ottawa. 411u H TA - B e r i c h t e Pauchard-Civadier MS (1998): Spectral cytogenetic chromosome analyser (Spectracube SD 200) (systematic review, primary research, expert panel) Comite d‘Evaluation et de Diffusion des Innovations Technologiques, Paris. Pembrey ME, Barnicoat AJ, Carmichael B, et al (NCCHTA) (2001): An assessment of screening strategies for fragile X syndrome in the UK. Health Technology Assessment 5, 7 Reuzel R, Oortwijn W, Decker M, et al. (2004): Ethics and HTA: some lessons and challenges for the future. Poeisis & Praxis 2, 247-256. Riley RD, Burchill SA, Abrams, KR, et al (2003): A systematic review and evaluation of the use of tumour markers in paediatric oncology: Ewing‘s sarcoma and neuroblastoma. International Journal for Health Technology Assessment 7, 5. Song FJ, Barton P, Sleightholme V, et al (NCCHTA) (2003): Screening for fragile X syndrome: a literature review and modelling study. Health Technology Assessment 7, 16. Swedish Council on Technology Assessment in Health Care (2001): Genetic test in screening for hereditary hemochromatosis - early assessment briefs (Alert) Swedish Council on Technology Assessment in Health Care (SBU), Stockholm. Wilson JMG, Jungner G (1968): Principles of Screening for Disease. Geneva: World Health Organization. t412 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Rechercheergebnisse ANHANG Erkrankung Institution Genetischer Test Aussage Ewing Sarkom, Neuroblastom NCCHTA, 2003 Genetische Tumormarker Prognose Literatur Carrierstatus CF ICSI, 2003 Carriergen Diagnose Carrierstatus Down-Syndrom, Aneuploidien AETMIS, 2003 Chromosomenanomalien NCCHTA, 2003 Fragile X Syndrome NCCHTA, 2003 Erbliche Krebserkrankungen CCOHTA, 2003 Fragile X Syndrome AETMIS, 2002 Mutation auf dem FMR1 Gen Diagnostik (Carrierstatus) Kolon-Ca, Mamma-Ca ITA, 2002 Genetische Tests Predictive Genetic Testing (Risikoschätzung?) Jonas et al. 2002 "Erbkrankheiten" Danish Centre for multiple Evaluation and Health Technology Assessment, 2002 Präimplantationsdiagnostik Danish Centre for Evaluation and Health Technology Assessment 2002 Fragile X Syndrom Medical Services Advisory Committee (MSAC), Canberra, 2002 NAA, Southern Blot Diagnostik (bei klinischem Verdacht), Carrierstatus in der Familie Medical Services Advisory Committee 2002 "Erbkrankheiten" AETSA, Andalusien, 2002 multiple Screening* Agencia e Evaluacion de Tecnologias Sanitarias de Andalucia 2002 Hereditäre Thrombophilie Medical Services Advisory Committee (MSAC), Canberra, 2002 Biochemische Tests; eine genetische Mutation Pränatales Screening Medical Services Advisory Committee 2002 Nonpolypopöses Kolonkarzinom (HNPCC) ICSI, 2002 ? Screening Hämochromatose Blue Cross Blue Shield Technology Evaluation Center, 2002 HFE Gen Diagnostik bei klinischer Auffälligkeit; Screening von Familienangehörigen Fragile X Syndrom NCCHTA, 2001 Mutation auf dem FMR1 Gen Screening Riley et al. 2003 Bloomington 2003 Pränatale Diagnostik Framarin 2003 Molekulares Karyotypisieren (FISH and Q-PCR test) (Pränatale) Diagnostik Grimshaw et al. 2003 Mutation auf dem FMR1 Gen Präkonzeptionelles, Pränatales Screening; Song et al. 2003 Case Finding Ho et al. 2003 Risikobestimmung Blancquaert & Caron 2002 Bloomington 2002 (auch Prognose?) Literatur Chicago IL 2002 Pembre et al. 2001 55 413u H TA - B e r i c h t e ?? Cedit, 2001 DNA Typisierung mit Beacon Methode ?? ?? Comite de Evaluation et de Diffusion des Innovations Technologiques 1999 Hämochromatose SBU, 2001 Genetischer Test Screening Swedish Council on Technology Assessment in Health Care 2001 ?? Wessex Institute for Health Research and Development, 2001 ? Präimplantationsdiagnostik McIntyre L 2001 Fetale Chromosomenanomalien; Neuralrohrdefekte DIMDI, 2001 Biochemische Tests Screening Droste, Brand 2001 Fetale Chromosomenanomalien; Neuralrohrdefekte BCOHTA, 2000 Biochemische Tests (Triple-Test) Screening Bassett 2000 Fetale Chromosomenanomalien; Neuralrohrdefekte Danish Centre for Biochemische Tests Evaluation and (Triple-Test) Health Technology Assessment, 2000 Screening Nohr-Jensen 2000 Brustkrebs, Prostatakrebs CCOHTA, 1999 BRCA1, BRCA2, Bcl- Risikobestimmung, 2, HPC1 Prognose Mukoviszidose NCCHTA, 1999 Genetischer Test (?) Präkonzeptionelles, Pränatales Screening, Case Finding bei Symptomen ?? Cedit, 1999 DNA Typisierung mit Beacon Methode ?? ?? Comite de Evaluation et de Diffusion des Innovations Technologiques 1999 Hämochromatose ANAES, 1999 ? Screening L'Agence Nationale d'Accreditation d'Evaluation en Sante 1999 BRAC Analyse AHFMR, 1999 DNA Test Screening Alberta Heritage Foundation for Medical Research 1999 Genetisches Screening Gezondheitsraad Nederlands, 1999 ? Screening Gezondheidsraad 1999 Familiäre Tyrosinämie 1 CETS, 1998 Molekulare Genanaly- Screening Carrierstatus in betroffenen se Familien Conseil d'Evaluation des Technologies de la Sante du Quebec 1998 DNA Diagnostik Gezondheitsraad Nederlands, 1998 ? Gezondheitsraad 1998 t414 Literatur ? Noorani & McGahan 1999 Murray et al. 1999 56 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h "Erbkrankheiten", Chromosomenanomalien CEDIT, 1998 Spectral cytogenetic chromosome analyser (Spectracube) Pränataldiagnostik Comite de Evaluation et de Diffusion des Innovations Technologiques 1998 Ovarialkarzinom NCCHTA, 1998 u.a. genetische Mutationen Screening Bell et al. 1998 Risikobestimmung Muskeldystrophie Duchenne, Becker CETS, 1997 Genetische Mutationen Screening von betroffenen Familien Conseil d'Evaluation des Technologies de la Sante du Quebec 1997 Fragile X Syndrom NCCHTA, 1997 ? Pränatales Screening, Screening in betroffenen Familien Murray et al. 1997 Myotone Dystonie CETS, 1997 Genetische Mutation auffinden Screening in betroffenen Familien, Diagnostik Conseil d'Evaluation des Technologies de la Sante du Quebec 1997 Hämochromatose ANAES, 1995 Genetisches Testen und Beratung ITA, 1995 verschiedene Screening / Diagnostik Institute of Technology Assessment 1995 DNA Diagostik Gezonheitsraad Nederlands, 1994 ? ? Gezonheitsraad 1994 Bibliographie der Kosten und Benefits von pränatalen Screeningprogrammen CCOHTA, 1991 verschiedene Screening Comis & Conlon 1991 Screening Brasslet 1995 415u Literatur 57 t416 Genetik in Public Health III. Genetik in Public Health Te i l 2 / 2 0 0 7 Public Health Genetics Eine Übersicht über die Entwicklung und aktuelle Aufgaben Christa Wewetzer, Angela Brand 417u t418 Genetik in Public Health Te i l 2 / 2 0 0 7 Inhalt III. Genetik in Public Health Public Health Genetics Eine Übersicht über die Entwicklung und aktuelle Aufgaben 1. Ausgangslage............................................................. 420 2. Die Institutionalisierung von Public Health Genetics ........ 423 3. Die Integration von Public Health Genetics in die universitäre Ausbildung................................................ 426 4. 4.1. 4.2. Public Health Genetics – Definitionen............................. 430 Abgrenzung zur klinischen patientenzentrierten Versorgung................................................................. 431 Abgrenzung zu Community Genetics............................. 432 5. Aufgaben und Methoden von Public Health Genetics: Die Public Health Trias................................................. 436 6. 6.1. 6.2. 6.3. 6.4. 6.5. 6.6. 6.7. Aktuelle Schwerpunkte von Public Health Genetics........... 441 Überwachung des Gesundheitsstatus: „Surveillance“....... 441 Public Health Genetics – Forschung............................... 446 Evaluation genetischer Tests.......................................... 448 Genetisch-epidemiologische Forschung.......................... 451 Einrichtung und Nutzung genetischer Datenbanken.......... 452 Public Health Genetics – Ethik....................................... 454 Entwicklung von Richtlinien und Entscheidungskriterien: Health Technology Assessment...................................... 457 7. Schlussbetrachtung...................................................... 459 Literatur.............................................................................. 462 419u Public Health Genetics: Eine Übersicht In den USA, Kanada und Großbritannien, aber auch in Italien, den Niederlanden sowie unter der Federführung der WHO in Ländern Südamerikas und Afrikas findet seit vielen Jahren eine als „Public Health Genetics“ bzw. „Community Genetics“ etablierte und institutionalisierte Diskussion über die Auswirkungen der Genetik auf das öffentliche Gesundheitswesen statt. In diesen Ländern hat Public Health Genetics/Community Genetics die führende Rolle übernommen, Kriterien für einen verantwortungsvollen Umgang mit den Möglichkeiten der Genetik im Rahmen des öffentlichen Gesundheitswesen zu entwickeln. Dieser Beitrag will einen Einblick in die Entstehung, die Methoden und Aufgaben von Public Health Genetics vor allem in den USA und Großbritannien geben und auf die Bedeutung einer solchen Forschungs- und Diskussions-Plattform für die Bewertung genetischer Technologien hinsichtlich ihres praktischen Nutzens aber auch der mit ihnen einhergehenden ethischen Probleme hinweisen. 1. Ausgangslage In einigen wenigen Bereichen der bevölkerungsbezogenen, öffentlichen Gesundheitsversorgung ist die Genetik bereits etabliert. Genetisches Screening wird im Rahmen des Neugeborenen-Screenings seit Beginn der 1960er Jahre angeboten. Darüber hinaus ist in Staaten, in denen Bevölkerungsgruppen mit einer hohen Prävalenz für bestimmte genetisch bedingte Erkrankungen leben, die Prävention dieser Erkrankungen zur Aufgabe der öffentlichen Gesundheits-Vorsorge und medizinischen Versorgung geworden. Nationale Programme zur Prävention wurden unter anderem 1976 in den USA initiiert für die Sichelzellanämie, die Cooley’s Anämie und die Tay-Sachs-Krankheit durch „The National Sickle Cell Anemia, Cooley’s Anemia, Tay-Sachs and Genetic Diseases Act“ (Fineman et al. 2000) oder für die ß-Thalassämie in verschiedenen Mittelmeerländern (Cao 2000). Diese Programme sind ausgerichtet auf monogen bedingte Erkrankungen, die in der Allgemeinbevölkerung selten vorkommen und daher nur einen geringen Teil der medizinischen Versorgung ausmachen. Ein breiteres Interesse an genetischen Fragestellungen im Rahmen der Gesundheitsversorgung entstand, nachdem sich seit etwa 30 Jahren die chronischen Erkrankungen wie Herz-Kreislauferkrankungen, Krebs, Diabetes oder die Alzheimer Krankheit zu den häufigsten Krankheiten der Bevölkerung in den Industrienationen t420 Genetik in Public Health Te i l 2 / 2 0 0 7 entwickelt haben (WHO 2003) und die neueren genetischen Erkenntnisse belegen, dass an der Entstehung dieser Krankheiten neben äußeren, umweltund verhaltensabhängigen Faktoren auch sogenannte „wirtsinterne“, genetische Bedingungen beteiligt sind (Khoury et al. 1993). Die führenden Wissenschaften der Public Health Forschung haben sich, wie unter anderem an dem 1995 veröffentlichten Bericht der Europäischen Union über den Gesundheitsstatus in Europa ersichtlich ist, bis vor etwa zehn Jahren bei der Suche und Erforschung krankheitsauslösender Ursachen auf diejenigen Risikofaktoren konzentriert, die außerhalb des menschlichen Körpers liegen. So richtet der Bericht sein Augenmerk auf die gesundheitsbeeinflussenden Faktoren Verhalten, Umwelt und sozialer Status.1 Die Konzentration auf die Einflüsse dieser „äußeren“ Faktoren auf die Gesundheit der Bevölkerung wurde zum einen gefördert durch die Identifizierung entsprechender Risiken, wie z.B. der Tabakkonsum, körperliche Inaktivität oder falsche Ernährung, durch den Nachweis von Zusammenhängen zwischen sozialen, ökologischen und ökonomischen Lebensbedingungen und bestimmten Erkrankungsrisiken und der in wissenschaftlichen Studien nachgewiesenen präventiven Wirksamkeit durch Vermeidung dieser Risiken. Zum anderen fehlten wissenschaftliche und technologische Möglichkeiten, „wirtsspezifische“ – hier: genetische – Faktoren zu identifizieren. Daher wurde der methodischen Untersuchung der Wechselwirkungen zwischen internen und außerhalb des Körpers liegenden Faktoren sowie ihrer Auswirkungen auf die Entstehung von Krankheiten wenig Aufmerksamkeit beigemessen (Omenn 2000, Beskow et al. 2001a). Dieses änderte sich jedoch im Verlauf der vergangenen 10 Jahre. Die raschen Fortschritte der Genetik und vor allem die im Verlauf des Humangenomprojektes entwickelten Technologien werden zukünftig vermehrt dazu beitragen, die Einflüsse von Umweltfaktoren auf das Genom bzw. auf die Genfunktion zu untersuchen, und zu neuen Erkenntnissen über den Einfluss genetischer Mutationen und Suszeptibilitäten auf die Entstehung der in der Bevölkerung weit verbreiteten chronischen Erkrankungen führen. Damit wird die Erwartung verbunden, Krankheitsrisiken individuell diagnostizieren und gezieltere Präventionsmaßnahmen entwickeln zu können (Peltonen und McKusick 2001). 1 Health Status in Europe: Summary of 1995 Report http://europa.eu.int/comm/health/ph_overview/previous_programme/monitoring/monitoring_status_1995_en.htm (30.3.2004) 421u Public Health Genetics: Eine Übersicht Obwohl die molekulare Genetik sich im Rahmen der molekular-medizinischen Forschung als bedeutender Baustein etabliert hat, besteht jedoch eine erhebliche Lücke zwischen der Grundlagenforschung und der Entwicklung anwendungsfähiger diagnostischer und therapeutischer Werkzeuge (Paul 2003). So können zwar mit Hilfe von prädiktiven genetischen Tests individuelle Suszeptibilitäts-Allele identifiziert werden. Es können jedoch, wie im Genetik-Kapitel zuvor ausführlicher erläutert wurde, für weit verbreitete komplexe Erkrankungen keine hinreichend genauen Aussagen über die Assoziation dieser Polymorphismen mit individuellen Krankheitsrisiken getroffen werden. Es fehlen vor allem Informationen über die Verteilung bestimmter Genotypen in unterschiedlichen Populationen und darüber hinaus Untersuchungen und Nachweise über die Effektivität präventiver Interventionen.2 Daher ist die Einschätzung der zukünftigen Bedeutung der Genetik für Public Health Aufgaben schwierig. Holtzman und Marteau vertreten die Position, dass genetische Informationen ausschließlich im Zusammenhang mit den seltenen, monogenen Erkrankungen sinnvoll sind. Für multifaktorielle Erkrankungen wie Krebs oder Diabetes werden die auf prädiktiven Tests beruhende Prävention oder Therapie auch in Zukunft von geringer Bedeutung sein (Holtzman und Marteau 2000). Die Centers for Disease Control and Prevention (CDC) hingegen erwarten in den kommenden Jahren erhebliche Fortschritte der Genetik und sich daraus entwickelnde „endlose Möglichkeiten“ 3 (eigene Übersetzung) der Erkennung von Krankheiten und der Prävention. Wie wissenschaftliche Erkenntnisse in sinnvolle Strategien für die Verwendung genetischer Tests und die Prävention umgesetzt werden können, ist also noch ungewiss. Dennoch stellt sich angesichts des großen Interesses der Medizin, forcierter Forschungsanstrengungen, genetische Informationen für eine gezieltere Prävention zu nutzen, und des wachsenden Angebotes genetischer Tests nicht mehr die Frage, „wann“ sondern „wie“ die genetischen Möglichkeiten in der Medizin und im Rahmen einer bevölkerungsbezogenen Gesundheitssicherung eingesetzt werden und welche Aufgaben die Public Health Wissenschaften dabei künftig übernehmen (French und Moore 2003). 2 3 t422 siehe Henn in diesem Band http://www.cdc.gov/genomics/oldWeb01_16_04/info/factshts/revolution1.htm (30.3.2004) Genetik in Public Health Te i l 2 / 2 0 0 7 Im Folgenden soll am Beispiel der USA und Großbritanniens zunächst dargestellt werden, wie die Institutionalisierung und die Integration von Genetik in Aufgaben der öffentlichen Gesundheitsversorgung sowie in die Aus- und Fortbildung erfolgte. Die Beschreibung dieser Entwicklung führt gleichzeitig in die sich daran anschließende ausführlichere Darstellung der Aufgaben und Methoden von Public Health Genetics ein. 2. Die Institutionalisierung von Public Health Genetics Als sich die neuen technischen Möglichkeiten und Erkenntnisse der Genetik für die Untersuchung genetischer Einflüsse auf multifaktorielle Erkrankungen abzeichneten, begann in den USA und in Großbritannien die Institutionalisierung von Genetik in bestehende Public Health Einrichtungen und die Spezialisierung von Ausbildungsangeboten verschiedener Public Health Institute auf Public Health Genetics. Diese Integration von Public Health Genetics in die Public Health Ausbildung sollte es den Studierenden sowie den bereits in Public Health-Bereichen Tätigen ermöglichen, sich frühzeitig mit den Entwicklungen der Genetik auseinanderzusetzen. Diese bestanden in der Untersuchung der Implikationen der gentechnischen Möglichkeiten für die Praxis und ihrer Auswirkungen auf die Gesellschaft. In den USA wurde die Humangenomforschung bereits frühzeitig durch Untersuchungen über ihre Auswirkungen auf die Medizin und ihrer ethischen, rechtlichen und sozialen Implikationen (ELSI) begleitet. Verantwortlich für diese Forschung war seit Beginn der 90er Jahre die ELSI-Arbeitsgruppe des Nationalen Humangenom-Forschungsinstitutes National Human Genome Research Institute (NHGRI). Für die Bildung des Forschungsschwerpunktes Genetik in Public Health (Public Health Genetics) auf nationaler Ebene waren jedoch vor allem die Empfehlungen der 1995 vom National Institute of Health (NIH) und des Department of Energy (DoE) einberufenen ad hoc Arbeitsgruppe Task Force on Genetics in Disease Prevention ausschlaggebend. Sie hatte die Aufgabe, einen Strategieplan für die künftige Koordination und Verstärkung der bereits bestehenden zahlreichen Aktivitäten der CDC von Genetik in Public Health zu entwickeln. Die Arbeitsgruppe empfahl, bestehende genetische Präventionsaktivitäten zu sichten und zu evaluieren sowie diejenigen Angebote zu identifizieren, die für die öffentliche Gesundheitsversorgung von besonderer Bedeutung waren. Für diese Aufgabe wurde 1997 das Office of Genomics and Disease Prevention (OGDP) gegründet. Diese Einrichtung der CDC sollte der internen Koordination von Aktivitäten dienen und externe Partner anregen, Maßnahmen im 423u Public Health Genetics: Eine Übersicht Zusammenhang mit Genetik, Prävention und Gesundheitsförderung durchzuführen.4 Dazu wurde der Aktionsplan „Translating Advances in Human Genetics into Public Health Action: A Strategic Plan“ entwickelt. In diesem Plan wurde empfohlen, die Ergebnisse der genetischen Forschung durch die strategische Zusammenarbeit der CDC mit anderen staatlichen Behörden sowie mit privaten und öffentlichen Partnern in die bestehenden Einrichtungen der öffentlichen Gesundheitsversorgung zu integrieren. Das Ziel dieser Zusammenarbeit sollte sein, die im öffentlichen Gesundheitswesen Tätigen bei ihrer Aufgabe zu unterstützen, durch Förderung der Gesundheit und Verhindern von Krankheit und Behinderung die Situation derjenigen Menschen zu verbessern, bei denen ein erblich bedingtes Risiko vorliegt (CDC 1997). Der Aufgabenschwerpunkt liegt seit 1997 in der Verbreitung von Informationen und der Förderung der Kompetenzen der Public Health Professionen in Bezug auf die Genetik und ihrer Bedeutung für die öffentliche Gesundheitsversorgung. Darüber hinaus wurde eine Kooperation mit der Foundation for Blood Research aufgebaut, einer NonprofitForschungsorganisation, um Studien über Verfahren zur Kontrolle der Qualität und Effektivität genetischer Tests durchzuführen. 1998 wurde das Human Genome Epidemiology Network (HuGE Net) gegründet. Ihm gehören Vertreter verschiedener Disziplinen an wie der Epidemiologie, der Genetik, der Klinischen Medizin, der Politik, Public Health, der Lehre und der biomedizinischen Wissenschaften. Die Mitglieder von HuGE Net sind Studenten, Forscher, Lehrende und Anbieter von Gesundheitsdienstleistung en aus staatlichen, akademischen, privaten und öffentlichen Einrichtungen. Ihr gemeinsames Ziel ist die Untersuchung der Bedeutung genetischer Varianten für die Gesundheit der Bevölkerung und für die Aufgaben von Public Health wie z.B. die Entwicklung von Richtlinien und Strategien oder die Beurteilung der Eignung genetischer Tests für Screening-Programme und für die Prävention. Das OGDP initiert seit seiner Gründung verschiedene Programme: Unterstützung bestehender und Gründung weiterer Centers for Genomics and Public Health, die Aufrechterhaltung des Informationszentrums Genomics and Health Information System, das Erstellen eines jährlichen Berichtes zum Zweck der Darstellung aktuellen Wissens und Wissensbedarfes über verschiedene genetisch bedingte Erkrankungen („National Report on Genomics and Health“),5 die Entwicklung einer Forschungsagenda und Förderung von Studien über bestehende Wissenslücken über Krankheiten und ihre gene4 5 t424 http://www.cdc.gov/genomics/about.htm (30.03.2004) Der erste Bericht wurde im März 2004 vorgelegt Genetik in Public Health Te i l 2 / 2 0 0 7 tischen Komponenten („Applied Research“), die Unterstützung von CDCund anderen staatlichen Maßnahmen bei der Integration von Genomik in ihre Public Health Programme („Public Health Capacity“).6 In Großbritannien wurden seit Beginn der 1990er Jahre Stellungnahmen über den Nutzen genetischer Techniken und Erkenntnisse für die Medizin und über soziale und ethische Implikationen sowie Empfehlungen von auf regionaler Ebene bereits bestehenden Organisationen, Berufsverbänden oder von der Regierung einberufenen Kommissionen erarbeitet. Ihr Einfluss war jedoch begrenzt. Von erheblicher Bedeutung für Public Health Genetics war der 1995 veröffentlichte Report des Science and Technology Committee des britischen Unterhauses: „Human Genetics: The Science and Its Consequences“. Er führte unter anderem zu der Gründung der Human Genetics Advisory Commission (HGAC) durch die Regierung und des Advisory Committee on Genetic Testing (ACGT) (Holtzman und Shapiro 1998, Zimmern und Cook 2000). 1997 wurde die Public Health Genetics Unit (Public Health GeneticsU) gegründet. In den ersten 5 Jahren ihres Bestehen wurde sie unterstützt durch das Research and Development Directorate des National Health Service und durch mehrere regionale Gesundheitszentren (Health Authorities). Seit Oktober 2002 wird die Einrichtung durch das Gesundheitsministerium sowie durch den Wellcome Trust, einer unabhängigen privaten Stiftung, und das Department of Trade and Industry finanziert. Die Public Health GeneticsU ist Teil des National Health Service (NHS). Ihre Aufgaben sind (Zimmern 2002): n die Bedeutung der Fortschritte der Humangenetik für Public Health und für die Gesellschaft zu untersuchen n die Aufmerksamkeit der in der Gesundheitsversorgung Tätigen und der Politik für genetische Fragestellungen zu fördern n die epidemiologische und Public Health-Perspektive in die RichtlinienEntwicklung für genetische Dienstleistungen einzubringen. Durch die Institutionalisierung von Public Health Genetics auf der Ebene nationaler Gesundheitsbehörden bzw. politischer Steuerungsebenen wurde es ermöglicht, die vielfältigen Auswirkungen der Genetik auf die Gesundheitsversorgung der Bevölkerung zu untersuchen und die 6 Ein Überblick über die Aktivitäten des CDC seit 1996 ist zu finden auf der Homepage der CDC http://www.cdc.gov/genomics/about.htm (30.3.2004) 425u Public Health Genetics: Eine Übersicht Entwicklung von Strategien und verbindlicher Richtlinien für eine angemessene Anwendung der Genetik zu unterstützen. 3. Die Integration von Public Health Genetics in die universitäre Ausbildung Mit dem raschen Anwachsen genetischer Erkenntnisse und Technologien und ihrer Verwendung in der medizinischen Versorgung ging ein zunehmender Bedarf an Fortbildung einher. Verschiedene Arbeitsgruppen, z.B. die American Society of Human Genetics (ASHG 1991), die Task Force on Genetics in Disease Prevention (CDC 1997), die World Health Organisation (WHO 1998), und die Association of State and Territorial Health Officials (ASTHO),7 befassten sich mit den Folgen des Humangenomprojektes und sprachen sich in ihren Empfehlungen dafür aus, den in Public Health Tätigen das Wissen und die Fähigkeiten zu vermitteln, die für eine Integration der Genetik in die Public Health-Aufgaben erforderlich sind. Vor allem in den USA und in Großbritannien begannen universitäre Public Health Ausbildungseinrichtungen in der Mitte der 1990er Jahre mit der Einrichtung spezieller Public Health Genetics Schwerpunkte. Dabei wurden zum einen Public Health Genetics spezifische Kurse eingerichtet und zum anderen die Entwicklungen der Genomik in bestehende Fachbereiche, wie z.B. in die Epidemiologie oder in die Public Health Ethik, integriert. Durch die Integration der Genomik in die bestehende Public Health Ausbildung sollte die die Public Health Forschung und Praxis kennzeichnende Multidisziplinarität gewährleistet werden. Als eine der ersten universitären Ausbildungseinrichtungen für Public Health in den USA gründete die School of Public Health der University of Michigan 1996 einen eigenständigen Fachbereich für Public Health Genetics. Als Anlass für die Gründung werden die zunehmenden sozialen, rechtlichen und ethischen Herausforderungen und Implikationen für den Regelungsbedarf des öffentlichen Gesundheitswesens durch die raschen Fortschritte der Genetik genannt. Das Ziel der Ausbildung war es, künftigen Public Health Fachleuten Wissen darüber zu vermitteln, wie Gene, Umwelteinflüsse und Verhalten die Gesundheit beeinflussen, und wie sie dieses Wissen in ihren späteren praktischen oder wissenschaftlichen Tätigkeitsbereichen anwenden können. 7 t426 http://www.astho.org/pubs/consolidatedpolicy.html (3.9.2004) Genetik in Public Health Te i l 2 / 2 0 0 7 Das Kursangebot repräsentiert die Multidisziplinarität von Public Health (Genetics) durch die Beteiligung der einzelnen Forschungs- und Praxisbereiche von Public Health wie der Biostatistik, der Epidemiologie, Umwelt und Gesundheit (Environment Health Science), Gesundheitsmanagement und Richtlinienentwicklung (Health Management and Policy) sowie Gesundheitsverhalten und -erziehung (Health Behaviour and Health Education) beteiligt. Die Studierenden sollen dadurch auf die multidisziplinäre Arbeit in Public Health Genetics vorbereitet werden: “The Interdepartmental Concentration (IC) is a unique approach in public health education and is designed to provide students with multidisciplinary preparation to work in the public health genetics arena. Participating in the IC is a great opportunity to work and study with faculty and students from each of the five departments in the School of Public Health.” 8 Neben der Vermittlung der Grundlagen der beteiligten Wissenschaften findet in den Kursen eine Auseinandersetzung mit ethischen, rechtlichen und sozialen Implikationen der Genetik statt. Dazu gehören unter anderem: die Vermittlung und Diskussion des technischen Entwicklungsstandes und des sozialen Hintergrundes populationsbezogener genetischer Eingriffsmöglichkeiten, der Kriterien der Entscheidung über die Durchführung genetischer ScreeningProgramme und Gentherapie-Versuche, der Rahmenbedingungen, wie z.B. Kosten-Nutzen-Analysen, und ethischer Kriterien, die bei der Auswahl und Gestaltung genetischer Programme und Richtlinien hilfreich sein können.9 1997 etablierte die University of Washington das Institute for Public Health Genetics (IPHG). Der Auftrag des Institutes besteht darin, eine umfassende, multidisziplinäre Ausbildung für zukünftige Public Health Fachleute anzubieten, die Forschung in Public Health Genetics zu fördern und eine ständige berufliche Weiterbildung zur Verfügung zu stellen. Das IPHG-Programm verbindet die Genetik und die wissenschaftlichen Public Health Disziplinen Epidemiologie, Pathobiologie und Biostatistik sowie die Forschung zu Umwelt und Gesundheit und die Forschung über Gesundheitsangebote mit der Ethik, den Sozialwissenschaften, den öffentlichen Angelegenheiten (Public Affairs), der Ökonomie und den Rechtswissenschaften zu einem einheitlichen akademischen Ausbildungsprogramm. Das IPHG stellt die phänotypische Prävention in Gemeinden und Populationen in den Mittelpunkt ihres Curriculums. 8 9 http://www.sph.umich.edu/genetics/ (01.02.2005) University of Michigan: “Issues of Genetics in Public Health”, Course HMP 517, http://www3. sph.umich.edu/caid/display_course_all_genetics.cfm (20.4.2005) 427u Public Health Genetics: Eine Übersicht Es beinhaltet die Vermittlung von Kenntnissen der rechtlichen, ethischen, finanziellen, regulatorischen und organisatorischen Verantwortungsbereiche der Gesellschaft, die sich aus dem Angebot genetischer Dienstleistungen und der Entwicklung von umwelt- und verhaltensbezogenen Maßnahmen zur bevölkerungsbezogenen Prävention genetisch bedingter Erkrankungen und Suszeptibilitäten ergeben. In Ethikkursen im Rahmen der Public Health Genetics-Ausbildung der University of Washington werden den Studierenden Grundlagen ethischer Urteilsbildung vermittelt; sie werden in historische ethische Probleme eingeführt, die sich aus der Anwendungen der Genetik ergeben haben, wie z.B. eugenische Programme, frühe Screening-Programme und Beratungspraktiken. Des Weiteren werden die ethischen Voraussetzungen für Public Health Genetik untersucht. Dazu gehören die Konflikte, die durch die Wahrung individueller Interessen bei gesellschaftlichen Zielsetzungen entstehen können.10 Im Jahr 2002 wurden mit Hilfe von Fördergeldern der CDC an drei bereits bestehenden Schools of Public Health – die oben bereits genannten Public Health School der Washington University und der University of Michigan sowie die School of Public Health der University of North Carolina – Centers for Genomics and Public Health gegründet. Sie haben die Aufgabe, Kenntnisse über die Zusammenhänge zwischen genetischen und modifizierbaren Risikofaktoren wie der Ernährung, körperlicher Aktivität oder der Schadstoffexposition zu vermitteln, örtlichen, regionalen und staatlichen Public Health-Organisationen technische Unterstützung anzubieten sowie Fortbildungskonzepte für die im Public Health Bereich Tätigen zu entwickeln und anzubieten. Durch die Gründung dieser Zentren sollen bereits bestehende Aktivitäten gebündelt sowie Synenergie-Effekte erzielt und die Zusammenarbeit zwischen Public Health Schools und Einrichtungen verbessert werden.11 Das Institute of Medicine (IOM) sieht eine wachsende Notwendigkeit, Genetik in die Ausbildung zu integrieren, und fasst die zukünftigen Aufgaben der Public Health Ausbildung wie folgt zusammen: Neben den weiterhin wichtigen traditionellen Bereichen Epidemiologie, Biostatistik, Umwelt-Gesundheit, der Verwaltung von Dienstleistungen des öffentlichen Gesundheitswesens und der Sozialwissenschaften werden 10 University of Washington: “Ethical Frameworks of Public Health Genetics”, Course PHG 522, Spring 2004 http://depts.washington.edu/phgen/coursewebs/522/522info.html (10.04.2005) 11 http://depts.washington.edu/phgen/AboutPublic Health Genetics/phg.html (30.03.2004) t428 Genetik in Public Health Te i l 2 / 2 0 0 7 die Public Health Professionen besser auf die neuen Herausforderungen der Gesellschaft vorbereitet werden müssen: Informatik, Genomik, Kommunikation, kulturelle Kompetenz, Erforschung von Möglichkeiten der Bürgerbeteiligung („community-based participatory research“), Globalisierungsaspekte von Gesundheit, Politik und Recht sowie Public Health Ethik. Aus der Perspektive des IOM erwachsen diese Bereiche aus den traditionellen Aufgaben von Public Health und sind die Reaktion auf die sich ständig verändernden sozialen, ökonomischen, technologischen und demographischen Rahmenbedingungen für die Gesundheit der Bevölkerung (Institute of Medicine 2005). In Großbritannien gründete die Public Health Sektion der Sheffield School of Health and Related Research (ScHARR) im Jahr 2000 das Sheffield Centre for Integrated Genetics. In einer Stellungnahme anlässlich der Gründung heißt es: „… Discussion during early 2000 has identified the new Genetics as an important development which will have great significance for the health of the population…” 12 Das Zentrum bietet eine integrierte Ausbildung in Forschung, Beratung und Lehre für die an den Schnittstellen zwischen Genetik, Molekularbiologie und Krankenversorgung sowie den in der Public Health Forschung Tätigen an, um die Implikationen für Patienten, für die Bevölkerung und das Gesundheitssystem zu untersuchen. Ein spezieller Forschungsschwerpunkt liegt auf der Untersuchung der Entwicklung von Datenbanken (Trent Public Health Observatory), einschließlich genetischer Datenbanken. Entscheidungsträger sollen unter anderem darin unterstützt werden, gesundheits- und krankheitsrelevante Entwicklungen zu beobachten, Lücken in der Gesundheitsinformation zu identifizieren, auf Methoden hinzuweisen, die der Untersuchung von Gleichheit und von Ungleichheiten in der Gesundheit dienen, Informationen zusammenzutragen, um neue Möglichkeiten der Sicherstellung von Gesundheit zu entwickeln und die Fortschritte örtlicher Behörden bei der Sicherstellung von Gesundheit und der Verhinderung von Benachteiligungen zu evaluieren. 12 s. dazu: ScHARR Strategig Statement 2000-2002. http://www.shef.ac.uk/~scharr/publich/ research/genetics/SCIG.html (30.03.2004) 429u Public Health Genetics: Eine Übersicht Mit der Beschreibung der Integration der Genetik in die Public Health Forschung und Ausbildung in den USA und Großbritannien sollte vor allem auf den multidisziplinären Ansatz von Public Health Genetics hingewiesen werden. Durch die Integration von Public Health Genetics in die zahlreichen, an Public Health beteiligten Disziplinen wird den vielfältigen und komplexen Herausforderungen, die sich durch die Integration der Erkenntnisse der Genetik in die Gesundheitsversorgung ergeben, Rechnung getragen. Der Auftrag und die Methoden von Public Health Genetics sollen im folgenden Teil weiter präzisiert werden. 4. Public Health Genetics – Definitionen Public Health Genetics ist keine eigenständige Wissenschaft und nicht definiert durch eine spezifische Disziplin, sondern fasst die Kompetenzen aller in der Praxis und der Forschung der Gesundheitsversorgung Tätigen zusammen (Omenn 2000). Daher versteht sich Public Health Genetics als ein Spezialgebiet von Public Health (Brand 2001) bzw. strebt die Integration der Genetik in die Aufgaben und Einrichtungen von Public Health an (Beskow 2001b). Public Health Genetics ist, wie Khoury beschreibt, ein „hybrider Wissenschaftszweig“ aus Genetik und der öffentlichen Gesundheitsversorgung (Public Health) (Khoury et al. 2000). Von der School of Public Health der University of Michigan wurde Public Health Genetics definiert als die Anwendung der Fortschritte der Genetik und molekularen Biotechnologie zur Sicherstellung der Gesundheit der Bevölkerung und zur Vorbeugung von Krankheiten.13 Wylie und Burke erweitern diese Definition um den Aspekt der ethischen Prüfung von Handlungsstrategien: „…integrating advances in human genetics and molecular technology into effective and ethical public health action to promote health and prevent disease and disability.“ 14 Ähnlich definiert das University of Washington Institute for Public Health Genetics (IPublic HealthGs) Public Health Genetics als die Anwendung der Fortschritte und Erkenntnisse der Genetik und molekularen Biotechnologie 13 http://www.sph.umich.edu/genetics/ (30.03.2004) 14 http://depts.washington.edu/ceeh/issues/issues.html (30.3.2004) t430 Genetik in Public Health Te i l 2 / 2 0 0 7 für die bevölkerungsbezogene Sicherstellung der Gesundheit und Prävention, die sich mit der Frage nach dem gesellschaftlichen Bedarf an spezifischen genetischen Gesundheitsleistungen befasst. Ziel ist es, zur Verlängerung des Lebens und Verbesserung der Lebensqualität des Einzelnen und der Bevölkerung beizutragen. Dazu beschäftigt sich Public Health Genetics unter anderem mit der Frage, wie die Einrichtungen des öffentlichen Gesundheitssystems darauf vorbereitet werden sollten, dass die Informationen über die Gen-Umwelt-Interaktionen angemessen verwendet werden. Dieses beinhaltet auch die Untersuchung über die Auswirkungen der Genetik auf das Versorgungssystem.15 Public Health Genetics erbringt sowohl praktische als auch wissenschaftliche Dienstleistungen. Wie auch Community Genetics ist Public Health Genetics im Rahmen ihrer praktischen Aufgaben bestrebt, genetische Angebote bevölkerungsnah bzw. gemeindenah anzubieten. Der wissenschaftliche Aufgabenbereich umfasst die für die Entwicklung und Evaluation genetischer Angebote notwendige Forschung. Public Health Genetics unterscheidet sich von Community Genetics durch den spezifischen Auftrag, die Berücksichtigung gesellschaftlicher Interessen bei der Sicherstellung von Bedingungen zu gewährleisten, unter denen Menschen gesund leben können.16 Damit verbindet Public Health Genetics die „unvermeidliche Integration neuer genetischer Information in alle Public Health Programme und in Bezug auf alle Krankheiten, unabhängig davon, ob die Krankheiten als ‚genetisch bedingt’ definiert sind oder Angebote als ‚genetische Angebote’ gekennzeichnet sind.“ (Khoury et al. 2000, eigene Übersetzung). 4.1.Abgrenzung zur klinischen patientenzentrierten Versorgung Eine umfassende Übersicht über die Unterschiede zwischen der Individualmedizin und Public Health stellte Harvey Fineberg von der Harvard University School of Public Health 1990 zusammen. Hiernach unterscheidet sich Public Health von der individualmedizinischen Versorgung im Wesentlichen dadurch, dass sie zahlreiche Disziplinen umfasst, die sich mit der Überwachung und Diagnose gesundheitlicher Probleme ganzer Bevölkerungen bzw. Bevölkerungsgruppen befassen. Public Health hat die Aufgabe, gesunde Lebensbedingungen und gesunderhaltendes Verhalten kontinuierlich zu fördern, während in der individualmedizinischen Versorgung ein zeitlich begrenzter Arzt-Patientenkontakt 15 http://depts.washington.edu/phgen/about/about_intro.shtml (30.3.2004) 16 weitere Differenzierungen zw. PH – und Community s. Principles of the Ethical Practice of PH, Vers.2.2; © 2002 Public Health Leadership Society 431u Public Health Genetics: Eine Übersicht aus Anlass einer bestimmten Erkrankung oder gesundheitlichen Störung erfolgt. Public Health bezieht ein Spektrum von Interventionsmöglichkeiten ein, das sich auf den Lebensstil, das Verhalten und die Umwelt richtet. Aus diesem Grund sind die Sozialwissenschaften ein wesentlicher Bestandteil von Public Health. In der klinischen Medizin haben sie eine untergeordnete Bedeutung, da sich die Perspektive der Medizin an den Bedürfnissen des einzelnen Patienten orientiert. Public Health Wissenschaftler und Praktiker sind in zahlreichen Bereichen tätig. Ein einheitliches Public Health Berufsbild existiert vor allem in der Öffentlichkeit nicht – Fineman spricht von „multiplen Identitäten“ – während das Berufsbild des Arztes/der Ärztin klar umrissen ist. Ebenso vielfältig wie die an Public Health beteiligten wissenschaftlichen Disziplinen und Berufsgruppen sind die Zertifizierungen, wohingegen die Ausbildung innerhalb der Medizin einheitlich geregelt ist. Die biologischen Wissenschaften spielen sowohl in Public Health als auch in der Medizin eine zentrale Rolle. Ausgangspunkt für die biologische Forschung sind in der Individualmedizin die Bedürfnisse des einzelnen Patienten. Der Transfer der Erkenntnisse erfolgt „vom Labor zum Krankenbett“. Public Health nutzt biologische Erkenntnisse, um die Gefährdung der Gesundheit der Bevölkerung zu verhindern. Die Forschungsinteressen und die Umsetzung der Erkenntnisse sind das Ergebnis der Wechselwirkung zwischen dem Labor und dem Anwendungs-„Feld“. 17 4.2.Abgrenzung zu Community Genetics Der Begriff Public Health Genetics ist vor allem in den angloamerikanischen Ländern gebräuchlich. Der in den europäischen Ländern und im Sprachgebrauch der WHO verwendete Begriff Community Genetics wird häufig synomym verwendet. Obwohl es gemeinsame Merkmale gibt, unterscheidet sich Community Genetics vor allem in seinen historischen Wurzeln und ursprünglichen Zielsetzungen von Public Health Genetics. Diese sollen im Folgenden dargestellt werden. Auf internationaler Ebene war die WHO federführend für die Integration der Genetik in die Gesundheitsversorgung auf der Bevölkerungsebene. Der Begriff Community Genetics wurde erstmalig 1990 von Bernadette Modell, Genetikerin bei der WHO, verwendet und bezeichnet seitdem die bevölker17 Association of Schools of Public Health (ASPH) http://www.asph.org/document.cfm?page=724 (30.3.2004) t432 Genetik in Public Health Te i l 2 / 2 0 0 7 ungsbezogenen Aspekte der medizinischen Genetik und ihrer Umsetzung auf der Ebene der Grundversorgung der Bevölkerung mit medizinischen Dienstleistungen (primary care).18 Das Konzept von Community Genetics umfasst die frühestmögliche Identifikation und Prävention genetisch bedingter Risiken und vereinigt Fähigkeiten der Medizinischen Genetik und der Sozialmedizin. Ein wesentlicher Bestandteil von Community Genetics ist der Aufbau regionaler, wohnortnaher genetischer Dienste bzw. ihre Integration in die Primärversorgung durch praktische Ärzte und anderes medizinisches Personal (Modell und Kuliev 1998). Der niederländische Genetiker Leo ten Kate führt an, eine der vordringlichsten Aufgaben eines „Community-Genetikers“ sei es dafür zu sorgen, dass alle Mitglieder einer Community die Möglichkeit haben, klinischgenetische Einrichtungen aufzusuchen. Seine künftigen Aktivitäten bestehen insbesondere darin, genetische Screenings durchzuführen, Fortbildungen sowohl für die in der medizinischen Versorgung Tätigen als auch für die Bevölkerung anzubieten, Genetik in der individuellen Gesundheitsversorgung anzuwenden, genetische Angebote für benachteiligte Bevölkerungen und Bevölkerungsgruppen bereitzustellen sowie genetische und angeborene Behinderungen zu erfassen (ten Kate 2000). Von der WHO wurden die Herausforderungen der Genetik für Fragestellungen im Zusammenhang mit Krankheit und Gesundheit der Bevölkerung bereits vor etwa 40 Jahren erkannt. Sie begann ab 1963 die Bedeutung der Genetik für die Sicherung der Gesundheit zu untersuchen, nachdem eine Expertenkommission der WHO befand, dass die Genetik der bevölkerungsbezogenen Gesundheitsversorgung eine neue Dimension hinzufüge: (WHO 1963) 18 Einer Definition des Institute of Medicine zufolge ist primary care gekennzeichnet durch Erreichbarkeit, Umfang, Koordinierung, Kontinuität und Zuverlässigkeit der medizinischen Einrichtungen, Angebote und Dienstleistungen. Die Versorgung durch Primary-Care-Ärzte umfasst Gesundheitsförderung, Prävention, Heilbehandlung und Symptomlinderung. Ihre Hauptaufgabe besteht jedoch in der Behandlung des kranken Patienten. Primary-Care-Ärzte sind diejenigen, die zuerst von den Kranken aufgesucht werden, um Beratung und Hilfe zu zu erhalten. Ein weiteres Merkmal von primary care ist das Entstehen dauerhafter Beziehungen zwischen Arzt und Patienten bzw. deren Familie (Abramson und Kark 1983, zitiert nach: National Nursing Research Institute: Health Care: Nursing Strategies. National Research Agenda http://ninr.nih. gov/ninr/research/vol7/ (30.3.2004) 433u Public Health Genetics: Eine Übersicht “...genetic considerations add a new dimension to public health work: a concern not only for the health and well-being of persons now living, but also for … generations yet to come”. Daraufhin wurde eine Arbeitsgruppe eingesetzt, die der Abteilung für Biomedizinische Wissenschaften zugeordnet war. Referenzzentren wurden eingerichtet, um die Verfahren und Methoden für genetische Populationsstudien zu standardisieren. Die Einführung erster koordinierter Programme zur Prävention erblich bedingter Erkrankungen wird von der Genetikerin Bernadette Modell, Mitinitiatorin dieses Arbeitsbereiches, auf 1981 datiert. In diesem Jahr begann die WHO, eine Bestandsaufnahme durchzuführen, um einen Überblick über die Bereiche zu gewinnen, in denen genetische Erkenntnisse bereits in der Praxis angewandt wurden. Die Ergebnisse wurden 1985 in dem Bericht „Community approaches on hereditary diseases“ zusammengefasst. In diesen Bericht gingen die praktischen Erfahrungen der zu diesem Zweck 1981 gegründeten Arbeitsgruppe über die Prävention genetisch bedingter Hämoglobinopathien ein. Sie hatte die für eine Umsetzung von Präventionsprogrammen notwendigen Fragestellungen, Methoden und Regeln entwickelt. Im Mittelpunkt stand dabei der Aufbau bzw. die Nutzung bestehender kommunaler und regionaler primary care-Einrichtungen mit dem Ziel, Menschen mit einer genetisch bedingten Benachteiligung zu helfen und ihnen eine möglichst normale Fortpflanzung zu ermöglichen: „...to help people with a genetic disadvantage to live and reproduce as normally as possible“. Die genetischen Dienste stellten Beratungs- und Behandlungsmöglichkeiten für Betroffene und ihre Familien zur Verfügung und boten pränatale Diagnostik an. Es wurden Programme zur Kontrolle und Prävention erblich bedingter Erkrankungen entwickelt mit dem Ziel, über eine, an die jeweiligen politischen, kulturellen und sozialen Bedingungen der Lebensgemeinschaften adaptierte Aufklärung und Schulung sowie durch Screening der Bevölkerung, durch genetische Beratung und des Angebotes einer Pränataldiagnostik die bestmögliche Prävention und Versorgung für Patienten und Risikopersonen anzubieten (WHO 1985). t434 Genetik in Public Health Te i l 2 / 2 0 0 7 Die Erfahrungen dieser Programme haben wesentlich zu einer Etablierung der Genetik in den Aufgabenbereich der WHO beigetragen. Modell prägte für diesen Schwerpunkt den Begriff „Community Genetics“. Der enge Bezug von Community Genetics zu Primary Care ist zurückzuführen auf einen Beschluss der WHO Ende der 1970er Jahre, eine Infrastruktur für die Gesundheitsversorgung zu entwickeln, die allen Menschen den bestmöglichen Zugang zu den von der WHO beschlossenen Gesundheitsprogrammen ermöglicht. Die für die WHO ausschlaggebenden Merkmale von Primary Care bestehen darin, dass sie praktische Erfahrungen und wissenschaftliche Grundlagen vereinigt, auf sozial-akzeptablen Methoden und Technologien der Medizin basiert und Selbstverantwortung und Selbstbestimmung zugrunde legt. Sie ist jedem Einzelnen und den Familien einer Gemeinschaft zugänglich. Die Kosten sollen so bemessen sein, dass sie von der Gemeinschaft, der Gemeinde, der Region bzw. dem Land zu jeder Zeit aufgebracht werden können. Einrichtungen von Primary Care sind die erste Kontaktstelle für Menschen, Familien und Gemeinde bzw. der Gemeinschaft mit dem nationalen Gesundheitssystem. Primary Care Einrichtungen sind dadurch gekennzeichnet, dass sie die Gesundheitsversorgung in die Lebens- und Arbeitswelt der Menschen – die Community – integrieren (WHO 1997). Damit greift das Programm der WHO auf ein weiteres, wesentliches gesundheitskonstituierendes Element zurück – die fördernde Zugehörigkeit zu einer lebens- und arbeitsweltlichen Gemeinschaft: „The community development model or the process of empowering and strengthening community action is important so that people can have greater control over their lives, develop supportative relationships and skills in decision making and the ability to access resources. The challenge for health promotion is to work with communities and not for communities.“ 19, 20 Den Einrichtungen der gemeinde- bzw. gemeinschaftsnahen Gesundheitsversorgung kommt bei der Implementierung von WHO- 19 S. Department of Health and Children (DoHC): The National Health Promotion Strategy 2000 -2005. S.11, 49 http://www.doh.ie/pdfdocs/hpstrat.pdf (30.3.2004) 20 Der Begriff community kann sowohl eine verwaltungstechnische Einheit, z.B. eine politische Gemeinde oder Stadt, bezeichnen als auch eine durch gemeinsame religiöse oder ethnokulturelle Traditionen verbundene Gruppe von Menschen. Kennzeichen einer „Community“ ist das gemeinsame Bestreben, Traditionen aufrecht zu erhalten und Bedingungen zu schaffen, die ihren Mitgliedern gute Lebensbedingungen sichern (Moon 1998). 435u Public Health Genetics: Eine Übersicht Programmen, so auch dem Programm zur Prävention genetisch bedingter Erkrankungen, eine zentrale Bedeutung zu. Mit einem sich vor allem durch die Fortschritte der Genetik verändernden Verständnis von der Rolle der Gene bei der Entstehung von Krankheiten („new genetics“), der Erweiterung genetischer Testmöglichkeiten und eines wachsenden Angebotes genetischer Tests sehen sich die im Bereich von Community Genetics tätigen Mitarbeiter neuen Anforderungen ausgesetzt. Sollten Ärzte und andere Mitarbeiter der primären Krankenversorgung zukünftig diese „neue“ Genetik in ihre Arbeit einbeziehen, werden größere Kompetenzen im Bereich der Untersuchung und Kommunikation genetischer Risiken erforderlich sein. Es wird sich eine verstärkte multidisziplinäre Zusammenarbeit mit Humangenetikern entwickeln müssen. Darüber hinaus sollten sie die Öffentlichkeit und potentielle Patienten in einem frühen Alter darauf hin informieren und schulen, welche Anforderungen und Entscheidungen hinsichtlich einer angemessenen Verwendung genetischer Informationen zur Gesundheitsförderungen und Krankenversorgung sie zu erwarten haben (The Royal College of General Practitioners 1998, Fry et al 1999, Knottnerus 2003).21 Diese wachsenden Aufgaben stellen eine neue Herausforderung sowohl für die Community Genetics Praxis als auch für die Forschung dar. In den Niederlanden ist daher Community Genetics seit Mitte der 1990er Jahre bestrebt, den Bezug zwischen Community Genetics und Public Health herzustellen. Die wissenschaftliche Plattform von Public Health soll dazu dienen, bei der Bewertung der Bedeutung der Genetik für die Medizin die gesellschaftlichen Perspektiven und Anforderungen einzubeziehen. Dennoch bleibt es die zentrale Aufgabe von Community Genetics, humangenetische Dienstleistungen in der Primary Care anzubieten (Ten Kate 1998, ten Kate 2000). 5. Aufgaben und Methoden von Public Health Genetics: Die Public Health Trias Die Zielsetzung und die Methoden von Public Health Genetics wurden maßgeblich durch den Report eines Komitees des Institute of Medicine (IOM), „The Future of Public Health“, beeinflusst (IOM 1988). 21 S. auch Sheffield School of Health and Related Research http://www.shef.ac.uk/~scharr/publich/ research/genetics/oldandne.html (30.03.2004) t436 Genetik in Public Health Te i l 2 / 2 0 0 7 Das Komitee hatte den Auftrag, die zukünftige Entwicklung von Public Health zu planen. Es formulierte den Auftrag von Public Health als Erfüllung gesellschaftlicher Interessen bei der Sicherstellung von Bedingungen, unter denen Menschen gesund leben können. Public Health sucht diesen Auftrag durch organisierte, interdisziplinäre Bemühungen, die physischen, mentalen und lebensweltabhängigen Gesundheitsbedingungen von Gemeinschaften und Population, die besonderen Risiken für Krankheit und gesundheitliche Schäden ausgesetzt sind, zu beeinflussen. Dieser Auftrag wird erfüllt durch Maßnahmen der Gesundheitsförderung, des Einsatzes von Technologien der Krankheitsprävention sowie durch Interventionen zur Sicherung und Verbesserung der Lebensqualität. Die Gesundheitsförderung und Krankheitsprävention umfasst ein breites Spektrum von Aufgaben und Expertisen, die in drei zentralen Public Health-Zielen zusammengefasst werden können: n Untersuchung (assessment) und Überwachung (surveillance) der Gesundheit in Gemeinschaften und Bevölkerungen mit einem erhöhten Krankheitsrisiko, um gesundheitliche Probleme und vorrangige Bedürfnisse zu identifizieren n Entwicklung von Strategien und Richtlinien (policy development) in Zusammenarbeit mit Vertretern der Gemeinschaften und Regierungen, die darauf ausgerichtet sind, die identifizierten regionalen und nationalen Gesundheitsprobleme nach Dringlichkeit einzustufen und zu lösen n Sicherstellung (assurance) der Möglichkeit, dass jede Bevölkerung bzw. jede Bevölkerungsgruppe Zugang zu einer angemessenen und kosteneffektiven Versorgung, zu Angeboten der Gesundheitsförderung und Prävention erhalten, sowie die Evaluation der Effektivität dieser Versorgung und Angebote. Diese Funktionen wurden 1994 konkretisiert durch die Aufstellung von zehn sogenannten „Essential Public Health Services“ durch das Public Health Functions Steering Committee “Public Health in America”: 22, 23 22 http://web.health.gov/phfunctions/public.htm (20.3.2004) 23 Die Zusammensetzung des Public Health Functions Steering Committee entspricht dem multidisziplinären Ansatz von Public Health: American Public Health Association, Association of Schools of Public Health, Association of State and Territorial Health Officials, Environmental Council of the States, National Association of County and City Health Officials, National Association of State Alcohol and Drug Abuse Directors, National Association of State Mental Health Program Directors, Public Health Foundation, U.S. Public Health Service -Agency for Health Care Policy and Research, Centers for Disease Control and Prevention, Food and Drug Administration, Health Resources and Services Administration, Indian Health Service, National Institutes of Health, Office of the Assistant Secretary for Health Substance Abuse and Mental Health Services Administration 437u Public Health Genetics: Eine Übersicht Bewertung (assessment): n Überwachen des Gesundheitsstatus der Bevölkerung bzw. von Bevölkerungsgruppen, um Gesundheitsprobleme zu identifizieren n Aufdecken und untersuchen von Gesundheitsproblemen und -Risiken für die Gesundheit der Bevölkerung Entwicklung von Strategien und Richtlinien (policy developmen“): n Informieren, Erziehen und Befähigen der Bevölkerung in Fragen der Gesundheit n Mobilisieren und Festigen von Partnerschaften, um gesundheitliche Probleme zu identifizieren und zu lösen n Entwickeln von Richtlinien und Plänen zur Unterstützung individueller und gemeinschaftlicher Bemühungen um Gesundheit Sicherstellung (assurance“): n Durchsetzen von Gesetzen und Regeln, welche die Gesundheit schützen und die Sicherheit gewährleisten n Schaffen von notwendigen Gesundheitsdiensten, Sicherstellen der Versorgung n Sicherstellen der Kompetenz der in den öffentlichen und individuellen Gesundheitsdienstleistung Tätigen n Evaluation der Effektivität, der Erreichbarkeit und der Qualität der individuellen und bevölkerungsbezogenen Gesundheitsdienste n Erforschung neuer Möglichkeiten und innovativer Lösungen für gesundheitliche Probleme.24 Die drei Grundfunktionen von Public Health und die oben genannten zehn Forderungen wurden anschließend von Arbeitsgruppen, die sich mit der Bedeutung der Genetik für Public Health beschäftigten, wie z.B. der Genetics Working Group at the Centers for Disease Control and Prevention, übernommen. Sie bildet die Basis für die Entwicklung von Strategien zur Umsetzung von Public Health Genetics in die Praxis der bevölkerungsbezogenen Gesundheitsversorgung verwendet („Need for public health leadership in genetics“ (CDC 1997). Beskow et al. adaptierten die Public Health-Funktionen an die Aufgaben der Genetik in Public Health (Beskow et al. 2001b): 24 Eine ausführlichere Darstellung des Auftrages und der Aufgaben von Public Health in den USA ist zu finden auf der Homepage der Association of Schools of Public Health (ASPH) http://www. asph.org/document.cfm?page=300 (30.3.2004) t438 Genetik in Public Health Te i l 2 / 2 0 0 7 Assessment: Das systematische Sammeln, Aufbauen, Analysieren und Verbreiten von Informationen, einschließlich humangenetisch-epidemiologischer Informationen, über die Gesundheit der Gemeinschaft: Dazu notwendige Dienstleistungen: n Epidemiologische und Labor-Forschung zur Quantifizierung der Bedeutung genetischer Varianten für die menschliche Gesundheit und Identifizierung und Quantifizierung von umweltbedingten Risikofaktoren und ihrer Wechselwirkung mit genetischen Varianten n Gesundheitsüberwachung: Überwachung des Gesundheitsstatus, einschließlich genetisch bedingter Erkrankungen, um gesundheitliche Probleme in der Bevölkerung oder einer Bevölkerungsgruppe zu identifizieren n Diagnostik und Untersuchung: Untersuchung der Verteilung genetischer und modifizierbarer Risikofaktoren in der Gemeinschaft, um ihren Beitrag zu den Gesundheitsproblemen und die Folgen für die Gesundheit zu ermitteln. Policy Development: In Zusammenarbeit mit Interessenvertretern die Formulierung von Standards und Richtlinien, eine angemessene Verwendung genetischer Informationen und die Kontrolle der Effektivität, die Förderung des Zugangs zu genetischen Tests und Dienstleistungen sowie Sicherstellung ihrer Qualität: Dazu notwendige Leistungen: n Politik- und Kommunikationsforschung: Identifizierung und Analyse ökonomischer, sozialer, ethischer und politischer Implikationen der Fortschritte der Humangenetik einschließlich des Informations- und Kommunikationsbedarfs der Interessenvertreter n Information, Bildung und Befähigung: Fördern der Kommunikation und Kenntnisse über die Bedeutung der Integration der Genetik in Programme der Gesundheitsförderung und Prävention n Fördern von Partnerschaften: Stärken der Zusammenarbeit zwischen öffentlichen und privaten Einrichtungen und Gruppen, um die effektive und effiziente Kommunikation und Richtlinienentwicklung in Bezug auf die Genetik zu fördern n Entwicklung von Richtlinien: Aufstellen von Standards und Richtlinien darüber, wie und wann genetische Informationen angewandt werden sollen, um die Gesundheit zu sichern und Krankheiten vorzubeugen. 439u Public Health Genetics: Eine Übersicht Assurance: Die Sicherstellung, dass genetische Informationen angemessen verwendet werden und genetische Tests und Dienstleistungen den vereinbarten Zielen „Effektivität“, „Zugang“ und „Qualität“ dienen: Dazu notwendige Leistungen: n Gesundheitsdienstleistungs-Forschung: Identifizierung und Analyse der Faktoren, welche die Auswirkungen genetischer Informationen, die Auslieferung, Verwendung und Qualität genetischer Tests und genetischer Dienstleistungen beeinflussen n Einfordern von Gesetzen: Die Durchsetzung von Richtlinien und Standards fördern, die eine angemessenen Verwendung genetischer Informationen, die Effektivität, den Zugang und die Qualität genetischer Tests und Dienstleistungen garantieren n Herstellen der Verbindung von Patienten und Betroffenen zu und Anbieten von Krankenversorgung: Sicherstellung des Angebotes von und des Zugangs zu genetischen Tests und Dienstleistungen und den damit verbundenen Interventionen zur Sicherstellung von Gesundheit und Vermeidung von Krankheit n Sicherstellen der Kompetenz: Sicherstellen, dass gegenwärtig und zukünftig im Gesundheitswesen Tätige Fortbildung erhalten und Fähigkeiten für die angemessene Verwendung genetischer Informationen erwerben n Evaluation: Beurteilung der Auswirkung genetischer Information, der Effektivität, des Zugangs und der Qualität genetischer Tests und Dienstleistungen. System-Management: n Der Aufbau und die Aufrechterhaltung der Public Health-Infrastruktur für die Integration der Genomik in die Praxis und Forschung von Public Health. Forschung: Einen besonderen Stellenwert nimmt die Forschung in Public Health Genetics ein. Das Potential der unsachgemäßen und voreiligen Anwendung genetischer Information ohne einen adäquaten Schutz der Vertraulichkeit und der Daten erfordert sowohl eine wissenschaftlich-technische Begleitforschung als auch eine Evaluation und Auseinandersetzung mit den zahlreichen ethischen, rechtlichen und sozialen Fragen, die sich durch die wachsende Zahl genetischer Daten ergeben (Austin et al. 2000). Daher wird die Integration der Genetik in Public Health begleitet durch eine multidisziplinäre Forschung t440 Genetik in Public Health Te i l 2 / 2 0 0 7 und Technikfolgenabschätzung hinsichtlich ihrer ethischen, rechtlichen und sozialen Auswirkungen auf den Einzelnen und die Gesellschaft. Mit der rasch voranschreitenden Entdeckung genetischer Varianten, die mit weit verbreiteten chronischen Krankheiten assoziiert sind, wurden und werden die in der öffentlichen Gesundheitsversorgung Tätigen mit einer Fülle neuer Informationen, Erkenntnissen und Technologien konfrontiert, die die medizinische Versorgung und Prävention beeinflussen werden. Die Forschung in Public Health Genetics stellt die wissenschaftliche Basis für alle von Public Health Genetics entwickelten Dienstleistungen und Angebote zur Verfügung. Weiterhin dient die begleitende Forschung wiederum der Validierung aller Public Health Genetics-Maßnahmen in den Bereichen „Assessment“, „Policy Development“ und „Assurance“. Public Health Genetics ist somit ein selbstreflexives System aus Praxis und wissenschaftlicher Begleitforschung 6. Aktuelle Schwerpunkte von Public Health Genetics Angesichts der Erwartungen, dass die Erkenntnisse der Humangenomforschung rasch zur Verbesserung der Gesundheit beitragen könnten, und der Bestrebungen vor allem in den angloamerikanischen Länder, die Genetik in die Public Health Praxis zu integrieren, stellt sich heute die Frage, welche Schwerpunkte sich für die Public Health Praxis und Forschung ergeben haben. 25 6.1.Überwachung des Gesundheitsstatus: „Surveillance“ Die Voraussetzung für eine bevölkerungsbezogenen Prävention und Sicherstellung der Gesundheit ist die Überwachung des Gesundheitsstatus. Die systematische Gewinnung, Analyse und Veröffentlichung bevölkerungsbezogner Gesundheitsdaten (surveillance bzw. monitoring) gehören daher zu den Kernaufgaben von Public Health. Dem 1997 im Auftrag der CDC erarbeiteten Strategieplan zufolge werden die Ziele von surveillance definiert als Erfassung 25 Ausführlicher dazu: ASTHO (2001) 441u Public Health Genetics: Eine Übersicht n der Verteilung und Ausbreitung genetischer Varianten in der Bevölkerung, die für bestimmte Krankheiten mit verantwortlich sind. Dazu gehören die seltenen Erkrankungen ebenso wie die häufig auftretenden Krankheiten n der Zahl der Erkrankungen und Todesfälle, die durch diese Erkrankungen verursacht werden n der Umweltfaktoren, von denen bekannt ist, dass sie durch Interaktion mit den jeweiligen Genotypen an der Krankheitsentstehung beteiligt sind. Das System zur Erfassung krankheitsrelevanter Daten soll genetische Faktoren einbeziehen, die den Gesundheitsstatus einer Population oder einer Gruppe beeinflussen. Die populationsbezogenen Register sollen die Verteilung und Häufigkeit genetischer Variationen und modifizierbarer Risikofaktoren für Krankheit und Behinderung fortlaufend erfassen sowie die mit genetischen Mutationen assoziierte Morbidität und Mortalität der Bevölkerung verfolgen. Ein Ziel dieser Überwachung ist unter anderem, Betroffenengruppen zu identifizieren, die von einer Aufklärung über genetische Risiken und von anderen genetischen Dienstleistungen profitieren könnten, und ein System zu entwickeln, mit dessen Hilfe die Validität und der Nutzen genetischer Tests untersucht werden kann. Des Weiteren stellen die gewonnenen Daten die Basis für die Planung, Implementierung und Evaluation von Maßnahmen einer bevölkerungsbezogenen Prävention bzw. Sicherung der Gesundheit dar (Teutsch und Churchill 1994). Die Daten über die Verteilung und Häufigkeit genetisch bedingter Erkrankungen und genetischer Suszeptibilitäten für komplexe chronische Erkrankungen können auf verschiedene Weise gewonnen werden. So kann auf bereits existierende Daten- und Probensammlungen zurückgegriffen werden, die den Gesundheitsbehörden aus zurückliegenden ScreeningProgrammen vorliegen. Weiterhin besteht die Möglichkeit, Biomaterial und Aufzeichnungen von Laboratorien, Krankenhäusern und anderen medizinischen Versorgungseinrichtungen zu verwenden oder gesundheitsbezogene Informationssammlungen spezieller Bevölkerungsgruppen, wie z.B. die genealogischen und krankheitsbezogenen Aufzeichnungen der isländischen Bevölkerung auszuwerten. Darüber hinaus existieren in zahlreichen Ländern, geographischen und kulturellen Regionen Aufzeichnungen fortlaufend durchgeführter Screening-Programme bzw. krankheitsspezifische Melderegister. Die überwiegende Zahl der in diesen Sammlungen gespeicherten Proben und Daten werden bzw. wurden ursprünglich nicht zur Überwachung des Gesundheitsstatus gewonnen, sondern zu anderen Zwecken (Burris et al. 2000). t442 Genetik in Public Health Te i l 2 / 2 0 0 7 Die Einrichtung bzw. die Verwendung bestehender genetischer Datenbanken wirft Fragen nach wissenschaftlichen und ethischen Kriterien auf. So weist die Association of State and Territorial Health Officials (ASTHO) darauf hin, dass die Entscheidung darüber, genomische Informationen zur Untersuchung von Public Health Ereignissen zu sammeln, den wissenschaftlichen Anforderungen entsprechen muss (ASTHO 2001). Diese bestehen unter anderem in Kenntnissen über die Zusammenhänge zwischen genetischen Faktoren und der zu untersuchenden Erkrankung. Die verfügbaren Quellen müssen überprüft werden hinsichtlich ihrer Standards zur Sammlung und Lagerung von Proben, ihrer genomischen Testverfahren und möglicher Versäumnisse bei der Auswertung von Protokollen oder durch erhöhte Anforderungen an alle Beteiligten (Lingappa und Lindgren 2003). Eine breite öffentliche Diskussion ethischer Fragen bei der Einrichtung genetischer Datenbanken findet erst seit einigen Jahren statt, obwohl bereits in den 1970er Jahren zahlreiche genetische Datenbanken angelegt wurden. Diese bezogen sich jedoch vornehmlich auf monogen bedingte Erkrankungen, erfassten demzufolge überwiegend kleine Bevölkerungsgruppen und waren von verhältnismäßig geringem Umfang. Die Erfassung genetisch bedingter Erkrankungen wurde daher ohne bemerkenswerten Widerstand der Öffentlichkeit durchgeführt. Eine Diskussion über den möglichen Missbrauch genetischer Daten fand lediglich unter den auf diesem Gebiet tätigen Fachleuten statt. Seit einigen Jahren ermöglicht die computergestützte Datenerfassung, -auswertung und -vernetzung die Verarbeitung erheblich größerer Datenmengen und die Identifizierung von genetischen Polymorphismen, die mit weit verbreiteten Erkrankungen assoziiert sind. Dadurch wird der Kreis der für die Registrierung in Frage kommender Risikopersonen und -populationen erheblich erweitert. Diese Möglichkeiten werfen neue ethische Fragen auf und können Ängste und Widerstände bei der Einrichtung genetischer Datenbanken und der Erfassung genetischer Erkrankungen hervorrufen (Chadwick und Berg 2001). 26 Burris et al. identifizieren mögliche soziale Risiken, die mit einem Missbrauch genetischer Daten verbunden sein können. Konkrete Befürchtungen richten sich auf eine Bedrohung der Bürgerrechte, des sozialen Status oder auf ökonomische Interessen Einzelner. Diese Ängste gründen nach Burris jedoch auf historischen Erfahrungen, einer geringen Zahl an empirischen 26 verschiedene Autoren weisen darauf hin, dass in Deutschland eine besonderer Skepsis gegenüber der Erfassung gesundheitsrelevanter Daten besteht, wie z.B. Eser (1989) und Link (2002). 443u Public Health Genetics: Eine Übersicht Untersuchungen und auf den Berichten Einzelner und stellen daher keine ausreichende empirische Basis für die Bewertung sozialer Risiken im Zusammenhang mit einem Monitoring genetisch bedingter Erkrankungen dar (Burris et al. 2000). Dennoch kann, wie das Washington State Board of Health in seiner Stellungnahme zum Stand der Richtlinien- und Gesetzeslage zu Fragen der Diskriminierung und Vertraulichkeit genetischer Daten feststellt, aus dem Mangel an quantitativen Daten nicht geschlossen werden, dass Diskriminierung oder ein Missbrauch vertraulicher Daten nicht vorkommt. Die Ursachen für die fehlenden Daten können daraus resultieren, dass 1) Opfer von Diskriminierung oder Mitwissende ihre Erfahrungen aus Angst, Verlegenheit oder in Unkenntnis des erfolgten Missbrauchs nicht berichten, 2) Verantwortliche diese Vorkommnisse nicht erkennen, da eine systematische Überwachung und Richtlinien bzw. gesetzliche Regelungen zum Schutz vor Diskriminierung fehlen oder nicht ausreichen, 3) der Öffentlichkeit, Anbietern von Gesundheitsdienstleistungen und Krankenversorgung und Forschern bestehende Erfassungssysteme und Rückmeldewege nicht bekannt sind (Washington State Board of Health 2002). Für eine ethische Abwägung, ob ein surveillance für eine genetische Suszeptibilität gerechtfertigt ist, schlagen Burris et al. (2000)drei Leitfragen vor: 1. Wird ein surveillance die Gesundheit der Bevölkerung verbessern? Eine bevölkerungsweite Untersuchung genetischer Merkmale ist ethisch gerechtfertigt, wenn sie signifikant zur Reduzierung genetischer Erkrankungen oder Sterblichkeit bezogen auf die gesamte Gesellschaft oder einer betroffenen Bevölkerungsgruppe beiträgt. Die Verwendung von Public Health-Ressourcen ist dagegen nicht zu rechtfertigen, wenn ein Nutzen lediglich für einzelne Individuen besteht. Ein genetisches surveillance ist folglich auch dann gerechtfertigt, wenn damit für die gesamte Bevölkerung ein hoher Nutzen, für den einzelnen jedoch lediglich geringe Vorteile erwartet werden. 2. Ist ein surveillance für bestimmte genetisch Informationen ein kluger und gerechter Einsatz von Ressourcen? In Anbetracht knapper Ressourcen unterliegt der Einsatz von Geldern, die der öffentlichen Gesundheitsversorgung zur Verfügung stehen, der Verpflichtung, den größten Nutzen für die Gesundheitssicherung der Bevölkerung zu erzielen. Die Fragen einer gerechten Verteilung knapper Ressourcen ist ein genuiner Bestandteil von Public Health Ethik, wohinge- t444 Genetik in Public Health Te i l 2 / 2 0 0 7 gen in der patientenzentrierten Medizin bisher Schwierigkeiten bestehen, diese Problematik in die medizinisch-ethische Diskussion einzubeziehen. 3. Wird ein surveillance akzeptabel sein für die darin einbezogene Bevölkerung? Die Akzeptanz von Public Health Maßnahmen ist von erheblicher Bedeutung für die Bereitschaft, sich freiwillig zu beteiligen und die mit den Maßnahmen verbundenen Richtlinien zu befolgen. Eine mangelnde Compliance kann zusätzliche Kosten verursachen und den Erfolg der Public Health Maßnahme gefährden. Daher sollte nachvollziehbar zu belegen sein, dass ihr Nutzen die Kosten überwiegt. Burris et al. ziehen die Schlussfolgerung, dass ein genetisches surveillance grundsätzlich kostengünstig durchgeführt werden und nützliche Daten für eine verbesserte Bedarfsplanung gesundheitsfördernder Leistungen liefern könnte. Damit entspräche es den ethischen Forderungen nach einem effektiven Einsatz von Mitteln der öffentlichen Gesundheitsversorgung. Dem stehen jedoch die Ängste und die Skepsis der Bevölkerung in Bezug auf die Verwendung genetischer Daten und damit das Problem der sozialen Risiken entgegen. Als Ursache für diese Zurückhaltung vermuten Burris et al. ein in der Bevölkerung vorherrschendes Konzept von Krankheit, Gesundheit, Aussehen und Verhalten, dem die Überzeugung zugrunde liegt, dass „Gesundheit in den Genen liegt“. Krankheit ist demzufolge ein unveränderliches Merkmal der einzelnen Betroffenen. Ein genetisches Screening werde als ein weiteres medizinisches Instrumentarium der Bestandsaufnahme individueller Krankheitsrisiken gesehen und die Sicht des Einzelnen bestärken, für die eigene Gesundheit allein verantwortlich zu sein. Diese Sicht kann darüber hinaus durch Schuldzuweisungen verstärkt werden. Im Anschluss an ihre Analyse empfehlen Burris et al. vor, die Erforschung sozialer Risiken zu verstärken, und insbesondere die Fälle von sozial schädlichem Verhalten zu erfassen sowie zu untersuchen, wie groß das Vertrauen von Individuen in gesetzliche Regelungen ist bei gesundheitsrelevanten Entscheidungen (Burris et al. 2000). Fazit: Chronische Krankheiten sind für Public Health von besonderem Interesse, da sie die derzeit größte gesundheitliche Belastung der Bevölkerung darstellen (WHO 2003). 445u Public Health Genetics: Eine Übersicht Wie aus dem bisher Erörterten hervorgeht, ist der Einsatz von Tests in der Public Health Praxis zur Überwachung des Gesundheitsstatus der Bevölkerung und zur Beobachtung der Verteilung und Verbreitung genetischer Risikofaktoren für diese komplexen Erkrankungen in der Bevölkerung noch nicht anwendungsreif. Ein bisher noch nicht gelöstes Problem bei der Überwachung der Verteilung genetisch bedingter Erkrankungen stellt die noch weitgehend ungeklärte Korrelation krankheitsassoziierter genetischer Polymorphismen mit phänotypischen Ausprägungen komplexer Erkrankungen dar. Wie bereits an anderer Stelle erläutert, ist ein positiver genetischer Test für eine genetische bedingte Suszeptibilität, z.B. für eine Herz-Kreislauferkrankung, nicht gleichbedeutend mit dem Ausbrechen der betreffenden Krankheit. Die derzeitigen epidemiologischen Daten, die Kosten-Nutzen-Analysen und die Untersuchung möglicher Auswirkungen genetischer Screenings auf die Gesellschaft reichen aus der Sicht von Vertretern aus Public Health Genetics, der Humangenetik und der Epidemiologie daher noch nicht aus, um bevölkerungsbezogene Screenings genetischer Risikofaktoren in die Überwachung des Gesundheitsstatus einzubeziehen (Dorman und Mattison 2000; Khoury et al. 2003; Henn 2004). Wie Khoury im Vorwort des ersten Jahresberichtes des Office of Genetics and Disease Prevention betont, besteht trotz der Verheißungen und Aufregung im Zusammenhang mit den Entdeckungen im Verlauf der Humangenomforschung eine erhebliche Lücke zwischen den Forschungsergebnissen und dem Wissen, das notwendig ist, um diese Ergebnisse zum Nutzen für die Gesundheit der Bevölkerung einzusetzen. Für die Durchführung von Untersuchungen der Gesundheit der Bevölkerung in Zusammenhang mit der Genomik, der Entwicklung wissenschaftlicher Evidenz hinsichtlich der Bewertung genomischer Informationen und der Integration genomischer Information in die Praxis und in Programme von Public Health sind weitere Public Health Genetics-Forschungen notwendig (Khoury 2003). 6.2.Public Health Genetics – Forschung Die wissenschaftliche Begleitforschung ist, wie oben bereits genannt, essentieller Auftrag von Public Health Genetics. Ebenso diente die Institutionalisierung von Public Health Genetics und Schaffung von Public Health Genetics Schwerpunkten in der universitären Ausbildung von Beginn an dazu, eine die Humangenomforschung begleitende interdisziplinäre Bewertungs- und Diskussionsplattform zu schaffen und t446 Genetik in Public Health Te i l 2 / 2 0 0 7 Forschungsprogramme zu entwickeln. So sollen mögliche Public Health Aufgaben aber auch die Risiken identifiziert werden, die mit dem Einsatz der Genetik für die Bevölkerung verbunden sein könnten. Bereits 1997 heißt es im Vorwort eines Strategie-Papiers der CDC (CDC 1997): „Recent discoveries have associated specific gene variants with the development of disease or chronic conditions, many with affect broad segments of the population....Simultanous with these advances, genetic tests are increasingly being developed and made publicly available. Putting this information to good use to promote health and well-being of all members of society requires a keen understanding of complex issues. Chief among these issues are the ethical ramifications of using new genetic technologies, and variations in personel and cultural views on what constitutes disease and disability.“ Obwohl nach Abschluss der Sequenzierung des menschlichen Genoms zu Beginn des 21. Jahrhunderts die Erforschung genetischer Polymorphismen vor allem durch internationale Forschungsprojekte intensiviert wurde (s. z.B. das HapMap-Projekt) ist es bisher nicht gelungen, die erhebliche Lücke, die zwischen den Entdeckung neuer genetischer Polymorphismen und der Nutzung dieser Entdeckungen für die Medizin besteht, zu schließen. Wie führende Public Health Wissenschaftler und Praktiker betonen, haben sich die hohen Erwartungen in Bezug auf die praktische Umsetzung genetischer Erkenntnisse in die Public Health-Praxis nach wie vor nicht erfüllt. Gwinn und Khoury schlagen vor, innerhalb des breiten Spektrums von Forschungsfragen, die sich dadurch für Public Health Genetics ergeben, folgende Schwerpunkte auszuwählen (Gwinn und Khoury 2002): n Untersuchung des Einflusses genomischer Faktoren auf die Gesundheit der Bevölkerung durch Ausweitung genetisch-epidemiologischer Forschung von einzelnen Genen auf genomweite Untersuchung, auf die Einbeziehung von Einflüssen wie Ernährung und anderer gemeinsamer Umweltfaktoren in Familienstudien, von der Untersuchung einzelner betroffener Familien auf Bevölkerungsgruppen und umfangreiche Genotypisierungen und Messungen von Biomarkern. n Untersuchung des Nutzens genomischer Tests für Screening und Prävention: In Anbetracht der Erwartungen der Öffentlichkeit an eine personalisierte Medizin und des sich rasch entwickelnden Marktes für neue genomische 447u Public Health Genetics: Eine Übersicht Tests besteht eine wesentliche Aufgabe der Public Health Wissenschaften darin, die Aussage und den Nutzen genomischer Tests zu untersuchen. Diese Untersuchungen erfassen Tests, die nicht nur einzelne Genvarianten nachweisen, sondern komplexe Genotypen, erworbene Mutationen und Genexpressionen untersuchen und sowohl DNA-Tests, RNA-Microarrays und biochemischen Methoden umfassen. An der Untersuchung des Nutzens dieser Tests sollen nicht nur medizinische und statistische Wissenschaften sondern auch z.B. die Sozialwissenschaften beteiligt werden. n Information über die Fortschritte der Genetik und Förderung der Kommunikation zwischen Wissenschaft und Öffentlicheit, um eine breite Öffentlichkeit an der Forschung zu beteiligen. Hierbei sollen die in Public Health Tätigen ihre besondere Stellung in der Gemeinschaft nutzen, um die Akzeptanz für die Public Health Forschungsagenda zu fördern und individuelle und soziale Interessen auszugleichen. Die Darstellung der Interessen einer bevölkerungsbezogenen Gesundheitsforschung soll den fortgesetzten Dialog über Fragen des „informed consent“ und der Vertraulichkeit fördern und die Vermittlung von Forschungsergebnissen in alle Teile der Bevölkerung verbessern. Die Aufgabe von Public Health Genetics besteht zum einen nach wie vor darin, diese Lücke zwischen den Ergebnissen der Genomforschung und ihrer Anwendung in der Medizin durch weitere Public Health Forschung zu schließen und Richtlinien für den angemessenen Umgang mit genetischen Tests und genetischen Daten zu entwickeln Zum anderen beziehen die von Khoury und Gwinn benannten Forschungsschwerpunkte bereits die Erkenntnisfortschritte und neuen Forschungsstrategien der „post genome era“ ein. Dieser Paradigmenwechsel der Forschung kann zu einem neuen Verständnis für die Entstehung von Krankheiten beizutragen, in dem genetische Varianten als eine Komponente unter anderen darstellen, die in einem komplexen Netz von Interaktionen verschiedener Faktoren Krankheit und Gesundheit beeinflussen. Er stellt daher eine in Bezug auf die Prävention chronischer Erkrankungen und damit für Public Health Aufgaben einen vielversprechenden Forschungsansatz dar (Khoury 2003a).27 6.3.Evaluation genetischer Tests Die Fortschritte bei der Entdeckung weiterer genetischer Krankheitsfaktoren, die mit den multifaktoriell bedingten Erkrankungen assoziiert sind, können dazu beitragen, die Vorhersage von Krankheitsrisiken an asymptomatischen Individuen zu verbessern (Burke 2002). Sind solche Polymorphismen erst einmal bekannt, werden in der Regel genetische Tests entwickelt und ange27 S. auch: „Der Beitrag der Genetik in Public Health“ in diesem Band. t448 Genetik in Public Health Te i l 2 / 2 0 0 7 boten. 28 Sie können im Rahmen der klinischen Forschung, der klinisch relevanten, individuellen Diagnostik oder eines Screenings eingesetzt werden (Khoury et al. 2003). Die Aussagefähigkeit prädiktiver Tests zum Nachweis genetischer Suszeptibilitäten für chronische, komplexe Erkrankungen ist jedoch begrenzt. Trotz einzelner Erfolge, die durch den präsymptomatischen Nachweis einer genetischen Mutation bei der Prävention und Behandlung einiger genetisch mitbedingter Erkrankungen erzielt wurden, wie z.B. bei der Hämochromatose oder bei entzündlichen Darmerkrankungen, sind bisher kaum spezielle Präventionsstrategien und Behandlungsstrategien für chronische Erkrankungen entwickelt worden, die eine Kenntnis genetischer Suszeptibilitäten voraussetzen. Negative (normale) Testergebnisse können ein späteres Auftreten der Erkrankung nicht ausschließen; positive Testergebnisse bedeuten nicht zwangsläufig, dass die Krankheit ausbricht. Die Risiken und Chancen der Mehrzahl der bisher angebotenen Tests sind weitgehend unbekannt (CDC 1997, Henn 2004). Insbesondere die Tatsache, dass gesunden Individuen angeboten wird, ihre Anlageträgerschaft für bestimmte erblich bedingte Erkrankungen testen zu lassen, zeigt die Chancen, aber auch das Dilemma der genetischen, prädiktiven Tests. Das derzeitige Problem besteht darin, dass zwar zusätzliches genetisches Wissen über Gesundheitsrisiken zur Verfügung gestellt, dieses Wissen jedoch als belastend empfunden werden kann. Die Human Genetics Commission führt dazu an (HGC 2003): „We accept that the right to obtain information about oneself is an important right and the State should not intervene unless there is a risk of harm, particulary to vulnerable people like children or the elderly.” Prädiktive genetische Tests sollten nach Einschätzung von Public Health Genetics Experten im Rahmen von Screening-Programmen gegenwärtig nicht eingesetzt werden, da die Mehrzahl der angebotenen prädiktiven Tests für komplexe chronische Erkrankungen bisher keinen Beitrag für die Prävention dieser Krankheiten leisten können. Allerdings unterscheiden sich die Einschätzungen hinsichtlich künftiger Entwicklungen. 28 Aktuelle Informationen über die Anzahl verfügbarer genetischer Tests finden sich auf der Homepage von GeneTest http://www.genetests.org/ (30.3.2004) 449u Public Health Genetics: Eine Übersicht Khoury et al. erwarten, dass angesichts des raschen Erkenntniszuwachses der Genetik innerhalb der kommenden 10 bis 20 Jahre genetische Screeningtests in der Bevölkerung oder in Subgruppen durchgeführt werden und einen sinnvollen Beitrag zur Prävention von komplexen Erkrankungen leisten können (Khoury et al. 2003). Holtzman und Marteau lehnen die Verwendung genetischer Tests für ein bevölkerungsweites Screening ab, da auch in Zukunft keine auf der Kenntnis individueller genetischer Suszeptibilitäten beruhenden, spezifischen Präventionsmöglichkeiten zur Verfügung stehen werden (Holtzman und Marteau 2000). Trotz dieser Unsicherheiten wächst die Verfügbarkeit und das Anwendungsspektrum genetischer Tests. Ein wachsender Markt kommerzieller Testanbieter sowie ein zunehmendes Interesse von Patienten an Informationen über genetische Prädispositionen und über genetische Testmöglichkeiten führt zu einem Legitimationsdruck sowohl auf die in der medizinischen Versorgung tätigen Ärzte als auch auf die Patienten, verfügbare Tests auch anzuwenden. In Anbetracht der Ressourcenknappheit des öffentlichen Gesundheitswesens wird darüber hinaus die Kosten-Nutzen-Abwägung bei Entscheidungen über medizinische Maßnahmen an Bedeutung gewinnen. In dem Maße, in dem genetische Tests zur Verfügung stehen, werden die entstehenden Kosten für ein bevölkerungsbezogenes Screening in Entscheidungen über die Durchführung bestimmter Screening-Programme einbezogen werden (Zimmern und Cook 2000). Wie bereits in dem Strategiepapier der Task Force Genetics des CDC angeführt, sind auch in Zukunft umfassende epidemiologische sowie soziale und ethische Forschungen notwendig, um die Kriterien für genetische Tests und Richtlinien für die Umsetzung in die Praxis zu entwickeln (CDC 1997). Die Aufgabe von Public Health Genetics ist es zudem, den aktuellen Stand der wissenschaftlichen Forschung auf diesem Gebiet aufzugreifen und den Entwicklungen in der Medizin, dem Gesundheitswesen und der Gesellschaft Rechnung zu tragen, d.h. sowohl gesundheitssichernde, bevölkerungsmedizinische Aspekte in den Blick zu nehmen als auch eine umfassende Bewertung ökonomischer, ethischer, rechtlicher und sozialer Fragen vorzunehmen (Brand 2001). t450 Genetik in Public Health Te i l 2 / 2 0 0 7 6.4.Genetisch-epidemiologische Forschung Von zentraler Bedeutung für diese Public Health Genetics Forschung ist die genomische Epidemiologie. Sie integriert die Methoden der Epidemiologie und die Erkenntnisse der Humangenomforschung. Im Verlauf der vergangen zwei Jahrzehnte wurde die Epidemiologie zunehmend von den Entwicklungen der Genetik beeinflusst. Die genetische Epidemiologie erhielt durch die Entdeckung krankheitsassoziierter Marker auf DNA-Ebene neue Impulse und es entstanden mit der molekularen Epidemiologie und der Humangenom-Epidemiologie neue Zweige der Epidemiologie (Beskow et al. 2001a). Die Epidemiologie untersucht die Verteilung und die Determinanten gesundheitsbezogener Bedingungen oder Ereignisse und wendet die Erkenntnisse dieser Studien zur Kontrolle gesundheitlicher Probleme an. Sie schafft die Voraussetzungen für die Definition von Risikogruppen innerhalb einer Bevölkerung, für die Erarbeitung von Präventionskonzepten, für die Evaluation der medizinischen Versorgung, für die Ermittlung der Bedeutung eines Gesundheitsproblems und für die Krankheitskontrolle unter anderem durch Krankheitsverhütung (Primärprävention) und Früherkennung (Last 1995). Die genetische Epidemiologie dient der Entdeckung neuer Gene und genetischer Varianten sowie der Bestimmung der Prävalenz in der Bevölkerung bzw. in Bevölkerungsgruppen. Die molekulare Epidemiologie untersucht die Bedeutung bestimmter Gene, Moleküle und Stoffwechselprozesse für die Krankheitsätiologie und erstreckt sich z.B. auch auf die Untersuchung bakterieller Krankheitserreger. Sie definiert die genetische Suszeptibilität auf der Basis molekularer Marker an Stelle von Risikoberechnungen (Elsworth und Manolio 1999). Die Humangenom-Epidemiologie entstand in den 1990er Jahren. Seit Beginn des Humangenomprojekts, vor allem mit Abschluss der Sequenzierung des menschlichen Genoms wächst die Zahl identifizierter und lokalisierter Gene und genetischer Polymorphismen. Damit einher geht ein wachsendes Interesse, diese Kenntnisse für Aufgaben der prädiktiven Medizin und Public Health anzuwenden. Die Entdeckung neuer Gene hat jedoch bisher eine geringe Bedeutung für die Praxis, so dass eine gewisse Skepsis entstanden ist hinsichtlich des Nutzens der genetischen Information für die Prävention verbreiteter Krankheiten. Um den Transfer von der genetischen Forschung in die Entwicklung und Anwendung genetischer Tests zu beschleunigen, ist es notwendig, die Funktion der zumeist im Rahmen der Untersuchungen von 451u Public Health Genetics: Eine Übersicht Hoch-Risikofamilien oder von selektierten Bevölkerungsgruppen entdeckten Gene zu charakterisieren. Die Humangenom-Epidemiologie will dafür die wissenschaftliche Plattform entwickeln (Gwinn und Khoury 2002). Ihr Ziel ist es, die Bedeutung der genetischen Polymorphismen für die Krankheitsentstehung zu quantifizieren, modifizierbare Risikofaktoren zu identifizieren und ihren Einfluss auf genetische Varianten zu messen. Weitere Aufgaben bestehen in der klinischen Validierung neuer genetischer Tests, in der Überwachung der Verwendung genetischer Tests in der Bevölkerung und der Überprüfung der Bedeutung, die genetische Informationen für die Gesundheit einer Bevölkerung bzw. einer Bevölkerungsgruppe hat. Darüber hinaus strebt die Humangenom-Epidemiologie die Entwicklung von einheitlichen Kriterien und Richtlinien für die Durchführung der Studien an, da angesichts der immer zahlreicher werdenden genetisch-epidemiologischen Studien, ihre Unterschiede im Design und ihre Durchführung, die Synthese und Bewertung der Ergebnisse erschwert wird (Khoury et al. 2004). Zur Koordinierung der weltweit durchgeführten populationsgenetischen Untersuchungen wurde 1998 von den Centers for Disease Control das Human Genome Epidemiology Network (HuGENetTM) gegründet. Damit wird eine weltweite Kooperation ermöglicht zwischen Epidemiologen, klinischen Genetikern, Grundlagenforschern, medizinischen und Public Health Fachleuten, die in Regierungen, in der Praxis, an Universitäten, in der Industrie oder in Verbraucherorganisationen tätig sind. Das Ziel von HuGENetTM ist es, durch den weltweiten Austausch von Ergebnissen und Daten populationsbezogener Studien und durch den Zugang zu bevölkerungsbezogenen Datensammlungen die Effizienz epidemiologischer Untersuchungen zu verbessern. 29 6.5.Einrichtung und Nutzung genetischer Datenbanken Komplexe Erkrankungen werden zwar von genetischen Faktoren mit beeinflusst. Die Mehrzahl der an der Entstehung einer Krankheit beteiligten genetischen Mutationen ist jedoch bisher nicht identifiziert und der Beitrag einzelner bekannter genetischer Mutationen zu der klinischen Symptomatik kaum bekannt. Um eine Korrelation zwischen einem genetischen Polymorphismus und einer Krankheit herzustellen, sind umfangreiche populationsweite Studien notwendig. Darüber hinaus variiert die Verteilung und Interaktion von Suszeptibilitätsgenen zwischen verschiedenen Populationen erheblich, so dass die durch Untersuchung einer Population gewonnenen Erkenntnisse 29 s. http://www.cdc.gov/genomics/hugenet/default.htm (30.3.2004) t452 Genetik in Public Health Te i l 2 / 2 0 0 7 über den Einfluss genetischer Suszeptibilitäten nicht auf andere Populationen übertragen werden können (Wright et al. 1999). Um die Identifizierung krankheitsassoziierter Mutationen zu beschleunigen, werden daher in verschiedenen Ländern sog. „Biobanken“ aufgebaut (Austin et al. 2003). Biobanken sind Sammlungen von Proben menschlicher Körpersubstanzen (z.B. Zellen, Gewebe, Blut und die DNA als Träger genetischer Information), die mit personenbezogenen Daten und Informationen ihrer Spender verknüpft sind bzw. verknüpft werden können. Biobanken haben einen Doppelcharakter als Proben- und Datensammlungen. Sammlungen biologischer Proben und genetische Aufzeichnungen existieren bereits seit langem sowohl in privaten als auch in öffentlich unterhaltenen Einrichtungen. Infolge der modernen Methoden der molekulargenetischen Analyse, der elektronischen Datenverarbeitung und der Vernetzung durch die Organisationsform der Biobanken nehmen der Informationsgehalt und die Verbreitung der in ihnen enthaltenen Informationen jedoch erheblich zu. Biobanken sind zum einen Hoffnungsträger für die medizinische und pharmazeutische Forschung. Sie lösen jedoch auch Ängste und Misstrauen aus. Es wird unter anderem befürchtet, dass die Proben unkontrolliert verwendet werden oder die potenziellen Spender unter Druck gesetzt werden, unvertretbare Risiken einzugehen und persönliche Risiken unbedacht preiszugeben. Neben datenschutzrechtlichen Aspekten spielt weiterhin eine Rolle, ob die Spender und ihre genetisch Verwandten wirksam vor Stigmatisierung und Diskriminierung geschützt werden können (Nationaler Ethikrat 2004). Obwohl es bereits zahlreiche Empfehlungen und Stellungnahmen zur Verwendung menschlicher Körpermaterialien für Forschungszwecke gibt, 30 hat die internationale Diskussion gezeigt, dass durch die Möglichkeiten der genetischen Analyse die Biobanken mit weiterreichenden ethischen, sozialen und rechtlichen Herausforderungen verbunden werden. Diese werden, wie die Bestandsaufnahme des EUROGRAPP-Projekts „Data storage and DNA-banking“ zeigt, vor dem Hintergrund jeweiliger sozialer und kultureller Identitäten in den einzelnen Nationen unterschiedlich diskutiert (Godard et al. 2003). 30 Eine Übersicht über die europäische Situation findet sich bei Godard et al. (2002). 453u Public Health Genetics: Eine Übersicht Während in zahlreichen Empfehlungen Ängste und Befürchtungen hinsichtlich der Verletzung individueller Interessen und Schutzansprüche im Vordergrund stehen, ist der Bericht der Human Genetics Commission „Inside information: balancing interests in the use of personal genetic data“ darauf bedacht, vor allem für die biomedizinische Forschung dem Altruismus und der Solidarität ein besonderes Gewicht zu verleihen. Sie führt an, dass es unter bestimmten Umständen eine Verpflichtung des Einzelnen gegenüber anderen Familienmitgliedern oder der Gesellschaft als Ganzes gibt, ihnen ihre genetische Information zur Verfügung zu stellen (HGC 2002). Die Bereitschaft in der Gesellschaft, an genetischen Forschungsprojekten teilzunehmen, hängt unter anderem von den Rahmenbedingung wie der Sicherstellung des Datenschutzes, der Vertraulichkeit und der Transparenz der Forschungsziele ab (Schröder und Williams 2002). Von Public Health Genetics wird die Aufgabe wahrgenommen, die Öffentlichkeit bei der Definition von Forschungszielen und bei der Entwicklung von Kriterien für die Abwägung zwischen individuellen und gesellschaftlichen Interessen zu unterstützen. Dazu ist es erforderlich, den ständigen Dialog z.B. über Fragen im Zusammenhang mit dem informed consent und der Vertraulichkeit zu fördern sowie die Vermittlung von Forschungsergebnissen an Individuen, Familien und der Bevölkerung zu verbessern (Beskow et al. 2001a). Public Health-Wissenschaftler können aufgrund ihrer Mittlerstellung dazu beitragen, die “Öffentlichkeit” mit der “Wissenschaft“ durch die Organisation einer qualifizierten Kommunikation zwischen Forschungsorganisationen, Berufsgruppen, Einrichtungen des öffentlichen Gesundheitsdienstes und den Vertretern gesellschaftlicher Interessen zu verbinden. So können mögliche Konflikte zwischen den Interessen der Gemeinschaft und des Individuums aufgenommen und die Zusammenarbeit gefördert werden (Khoury et al. 2000). 6.6.Public Health Genetics – Ethik In der Öffentlichkeit besteht eine hohe Sensibilität im Hinblick auf die ethischen, rechtlichen und sozialen Folgen durch die Weitergabe genetischer Informationen und Vernetzung mit anderen gesundheitsrelevanten Daten. Public Health (Genetics) unterscheidet sich von der klinisch orientierten Medizin durch ihren Auftrag, die Prävention und Gesundheitsversorgung der Bevölkerung bzw. von Bevölkerungsgruppen sicherzustellen bzw. deren Voraussetzungen zu erforschen und zu verbessern. Die dazu eingesetzten t454 Genetik in Public Health Te i l 2 / 2 0 0 7 Methoden – genetisches Screening zur Überwachung des Gesundheitsstatus der Bevölkerung bzw. von Bevölkerungsgruppen und molekulargenetische epidemiologische Untersuchungen zur Verbesserung des Verständnisses des Einflusses von Umwelt und Verhalten auf genetische Polymorphismen im Hinblick auf die Entstehung von Krankheiten – liefern eine Fülle genetischer Informationen, die im Unterschied zur medizinisch-humangenetischen Individualversorgung für gesellschaftliche Ziele der Gesundheitssicherung verwendet werden sollen. Die Anwendung genetischer Erkenntnisse in Public Health bereitet jedoch erhebliche Probleme. Vor allem die „gesellschaftliche“ Nutzung, also die Verwendung genetischer Daten für bevölkerungsbezogene Gesundheitsziele, wird unter verschiedenen Interessengruppen kontrovers diskutiert (Wright und Clayton 2000). Die Human Genetics Commission vermutet, dass die Auswertung individueller genetischer Daten für Public Health Zwecke der verbreiteten Auffassung widerspricht, wonach die genetische Information eines Menschen ein wesentliches Merkmal seiner Individualität und damit mehr als jede andere Information vertraulich zu behandeln ist (HGC 2003). Diese auch als “genetischer Exzeptionalismus” bezeichnete Sonderstellung genetischer Information resultiert nicht unwesentlich aus individuellen Leiderfahrungen Betroffener mit monogenen Erkrankungen durch soziale Stigmatisierung und Diskriminierung in der Arbeitswelt oder durch Versicherungen (European Commission 2004). Eine Vielzahl von wissenschaftlichen Abhandlungen, Stellungnahmen und Regelungen beschäftigen sich mit den ethischen, rechtlichen und sozialen Herausforderungen genetisch-epidemiologischer Forschung, (Coughlin 1996) genetischer Tests, (Holtzman und Watson 1998) oder Fragen des informed consent (ASHG 1996). Empfehlungen für Studien, die auf der Untersuchung von Familien basieren, entsprechen in vielen Fällen nicht den Erfordernissen bevölkerungsweiter Forschung. Sie unterscheiden im Allgemeinen nicht zwischen Studien, in denen klinisch relevante Informationen über die Teilnehmer gewonnen werden sollen, und den Studien, die für Fragestellungen der allgemeinen Gesundheitsversorgung von Bedeutung sind und lediglich mit geringfügigen physischen, psychischen oder sozialen Risiken für die Teilnehmer verbunden sind. Eine undifferenzierte Übertragung individueller Erfahrungen mit Diskriminierung und Stigmatisierung auf Public Health Genetics könnte, wie Wright und Zimmern befürchten, möglicherweise bevölkerungsbezo- 455u Public Health Genetics: Eine Übersicht gene Studien und Maßnahmen zum Nutzen für die Bevölkerung erschweren oder verhindern (Wright Clayton 2000; Zimmern und Cook 2000). Wie unter anderem von Clayton et al. vorgeschlagen wird, sollte bei der Untersuchung eines krankheitsrelevanten Gens zwischen Mutationen mit einem hohen Erkrankungsrisiko, die in hohem Maße deterministisch sind, und genetischen Suszeptibilitäten unterschieden werden. Die Untersuchung letzterer dient der Identifizierung allgemein verbreiteter Allele, die weder notwendig noch ausreichend für die Entwicklung von Krankheitssymptomen sind (Clayton et al. 1995). Khoury schließt daraus, dass es zwischen genetischen Studien zur Untersuchung Public Health Genetics relevanter Erkrankungen und anderen Public Health Forschungsprojekten keine prinzipiellen Unterschiede gibt. Zudem wird in einer wachsenden Zahl von Stellungnahmen die Gleichbehandlung genetischer Daten mit anderen medizinischer Daten in den Richtlinien für den Datenschutz und für die Forschung empfohlen (French und Moore 2003). Eine intensive Auseinandersetzung mit diesen Fragen unter der Public Health Genetics Perspektive steht jedoch erst am Anfang (Beskow et al. 2001a). Angesichts der enormen Anstrengungen der Forschung, der Geschichte der Eugenik und anderer missbräuchlicher Verwendung genetischer Informationen besteht die Verpflichtungen derjenigen, die für die Sammlung und Verwendung genetischer Daten verantwortlich sind, gegenüber denjenigen, die an genetischen Forschungen und anderen Maßnahmen teilnehmen, Richtlinien zu ihrem Schutz zu definieren (Beskow et al. 2001a). Der Schutz der Privatsphäre und der Diskriminierung sind wohlbegründet. Dennoch können sie ebenso ungerecht und unpraktikabel sein. Public Health (Genetics) versteht sich als Dienstleistung für die Öffentlichkeit. Aus der Perspektive der Gemeinschaft vertritt Public Health (Genetics) die Bedürfnisse und Interessen sowohl der Gesellschaft wie auch des Einzelnen bei der Sicherstellung von Gesundheit. Die Public Health Perspektive hebt die Abhängigkeiten zwischen einzelnen Individuen und der Gesellschaft hervor. Daher begründet eine Public Health Ethik die Begrenzung individueller Freiheiten mit einem bevölkerungsbezogenen Interesse an der Vermeidung von Krankheit und der Sicherstellung von Gesundheit (Hodge 2004) und t456 Genetik in Public Health Te i l 2 / 2 0 0 7 kann damit im Widerspruch zu individualethischen Grundsätzen stehen. Dennoch will Public Health (Genetics) die Rechte, Interessen und die Freiheit des Einzelnen beachten und die Menschenrechte berücksichtigen (Jennings 2003). Die Public Health Ethik erfordert eine Auseinandersetzung mit philosophischen, theologischen und bioethischen Konzepten und Wertvorstellungen im Hinblick auf die Rolle von Public Health (Genetics) im Spannungsfeld individueller und gesellschaftlicher Interessen. 31 Public Health Genetics stellt die Berücksichtigung dieser unterschiedlichen Konzepte bei der Integration der Genetik in Public Health durch die Einbeziehung der unterschiedlichen Professionen sicher und fördert den gesellschaftlichen Diskurs. 32 6.7.Entwicklung von Richtlinien und Entscheidungskriterien: Health Technology Assessment Der Einfluss der Genetik auf die Medizin, die Gesundheitsversorgung und die Gesellschaft wird nach Einschätzung von zahlreichen Public Health Experten unvermeidlich sein (Zimmern und Cook 2000). Der rasche Zuwachs an genomischer Information, an Gentechnologie und Technologien der Informationsverarbeitung haben zu immer größeren Möglichkeiten des Einsatzes molekulargenetischer Tests bei komplexen Erkrankungen geführt. Vor allem die genetisch-epidemiologische Forschung, die Erstellung und Nutzung von Biobanken sowie die Integration dieser Tests in medizinische Anwendungsbereiche werfen Fragen über die Relevanz eines einzelnen Tests für die Prävention und Therapie einer Erkrankung auf und über die Fähigkeit des Gesundheitssystems, den angemessenen Einsatz sicherzustellen. Es besteht die Tendenz, Forschungsergebnisse der Humangenetik unmittelbar in der Medizin einzusetzen, bevor eine umfassende, nach standardisierten Verfahren durchgeführte Bewertung stattgefunden hat. Um eine Qualitätssicherung in der Genetik zu gewährleisten, sollten umfangreiche technische Daten gesammelt sowie Risiko-NutzenAbwägungen vorgenommen werden. Die Auswertung der relevanten Daten sollten durch verschiedene wissenschaftliche Disziplinen erfolgen. Die 31 Einen Überblick über die umfangreichen ethischen, rechtlichen und sozialen Konfliktfelder gibt die Zusammenstellung der School of Public Health Genetics der University of Michigan http:// www.sph.umich.edu/genomics/media/subpage_autogen/PublicHealthELSI.pdf (30.03.2004) 32 Auf eine ausführliche Erörterung ethischer Fragen unter den Aspekten von Public Health Genetics wird an dieser Stelle verzichtet und verwiesen auf die Public und auf das Kapitel “Public Health GenEthik“ von Dabrock und Schröder in diesem Band. 457u Public Health Genetics: Eine Übersicht Integration der Bewertung in den Prozess der Entscheidung sollte ebenfalls Gegenstand der Untersuchung sein (Blancquaert 2001). Für Teilbereiche genetischer Anwendungsmöglichkeiten, vor allem zu Fragen der Verwendung genetischer Tests, wurden bereits Folgeabschätzungen und Bewertungen vorgenommen und haben zu einer Fülle von Regulierungen geführt. Die Technikfolgenabschätzung und die Entscheidungsfindung im Hinblick auf die Genotypisierung großer Patienten- und Bevölkerungsgruppen steht jedoch noch aus (Paul 2003). Hierfür bietet sich das Health Technology Assessment (HTA) an. 33 Die zentrale Aufgabe von HTA besteht in der Bereitstellung von Informationen zur Willensbildung und Entscheidungsfindung auf verschiedenen Ebenen des Gesundheitswesens. HTA ist die umfassende und systematische Bewertung neuer oder bereits auf dem Markt befindlicher Technologien der medizinischen Versorgung hinsichtlich ihrer physikalischen, biologischen, vor allem aber medizinischen, sozialen und finanziellen Wirkungen im Rahmen einer strukturierten Analyse. Dabei wird der Begriff „Technologie“ sehr breit gefasst und beinhaltet Medikamente, Medizinprodukte, Prozeduren, Supportsysteme sowie Organisationssysteme, in denen eine Technologie innerhalb der gesundheitlichen Versorgung angewendet wird (Kunz 2000). HTA will nicht nur die wissenschaftlich-technischen Aspekte einer medizinischen Technologie erfassen und bewerten, sondern darüber hinaus auch die ethischen und sozialen Folgen berücksichtigen (Droste et al. 2003). Ziel ist die Bereitstellung entscheidungsrelevanter Informationen auf verschiedenen Ebenen der Steuerung des Gesundheitswesens, d.h. von Informationen, die auf den aktuellen und insbesondere auch politischen Entscheidungsbedarf zugeschnitten sind. Durch die Komplexität, die Geschwindigkeit des Erkenntniszuwachses und der Verfügbarkeit neuer Methoden für die medizinische Anwendung und die gesellschaftspolitische und soziale Relevanz der Genetik sind ethische und soziale Herausforderungen entstanden, denen die Mehrzahl der gegenwärtig durchgeführten Untersuchungen kaum gerecht werden. Dabei sind es vorrangig zwei Probleme, die den derzeitigen Einsatz von HTA in Public Health Genetics limitieren (Brand 2002): 1. fehlende Zeitnähe der 33 Auf die umfangreiche Literatur kann hier nicht eingegangen werden. Es sei jedoch hingewiesen auf z.B. Battista und Hodge (1999), Perleth (1998) und Chan und Topfer (2000). Ein Beispiel für eine HTA-Institution für HTA-Genetik und Richtlinienentwicklung ist die kanadische Institution AETMIS http://www.aetmis.gouv.qc.ca; Links zu HTA-Einrichtungen zahlreicher Länder finden sich unter http://www.nlm.nih.gov/nichsr/ehta/htalinks.html (30.3.2004). t458 Genetik in Public Health Te i l 2 / 2 0 0 7 HTA-Berichterstellung und 2. mangelnde Integration von ethischen und gesellschaftlichen Aspekten in HTA-Berichten. So dauert die Erstellung eines HTA-Berichtes u.a. aufgrund der systematischen Literaturbeschaffung, der Synthese der verfügbaren Informationen und der Peer-Review-Verfahren durchschnittlich 1-2 Jahre. Die Verfahren zur Einschätzungen von Chancen und Risiken können dadurch die Dynamik durch neues biomedizinisches Wissen, technologische Innovation oder sich wandelnde Anforderungen in Medizin, Wissenschaft und Gesellschaft nicht berücksichtigen. Die daraus hervorgehenden Regulierungen z.B. in Form von Leitlinien und Gesetzen schreiben daher einen Status quo eines bestimmten technischen Entwicklungsstandes fest (Paul und Roses 2003). Um als politisches Entscheidungsinstrument eingesetzt zu werden, muss ein HTA jedoch innerhalb von Wochen bis wenigen Monaten valide und entscheidungsrelevante Informationen liefern können. Die Auswertung zahlreicher HTA-Berichte, die sich mit der Bewertung genetischer Tests im Hinblick auf die Anwendung in der medizinischen Versorgung bzw. für Screening-Programme befassen, ergibt, dass eine Bewertung ethischer und sozialer Fragen kaum stattfindet (Lühmann et al. 2004). Es mangelt an einem einheitlichen Verfahren, das die Dimensionen wie ethische und gesellschaftliche Implikationen, die sich dem quantifizierenden Kalkül weitgehend entziehen, berücksichtigt. Dadurch besteht die Gefahr, dass Werteentscheidungen in ihren ethischen und gesellschaftlichen Konsequenzen – auch im Hinblick auf gesundheitspolitische Zielkonflikte – nicht explizit und normative Vorgaben nicht transparent werden. Eine Public Health Genetics-HTA wird die angenommenen Ziele von Forschungs- und Entwicklungsprojekten im Hinblick auf ihre Folgen für Gesundheit und Gesellschaft einer normativen Analyse unterziehen. Dazu sollte vor allem bei der Beurteilung, ob die Aufnahme genetischer Methoden in den Leistungskatalog gesellschaftlich gewünscht und konsensfähig ist, eine Beteiligung der breiten Öffentlichkeit an der Diskussion und an Entscheidungsprozessen angestrebt werden. 7. Schlussbetrachtung Infolge der rasch voranschreitenden Genomforschung wachsen die Informationen über genetische Suszeptibilitäten und Krankheitsrisiken mit enormer Geschwindigkeit an. Damit verbunden sind komplexe ethische, rechtliche und soziale Fragen (Juengst 1995, NHGRI 1996) 459u Public Health Genetics: Eine Übersicht Public Health Genetics könnte mit seinem disziplinübergreifenden Ansatz sowie seinem hohem wissenschaftlichen Innovationspotenzial eine bedeutende Rolle zukommen, auch in Deutschland die Chancen der Genetik für eine bevölkerungsbezogene Prävention und Gesundheitssicherung sowie zur Beratung und Entwicklung von Richtlinien in Politik- und Praxis beizutragen. Auch in Deutschland bestehen Überlegungen zu untersuchen, wie die Genetik in bevölkerungsbezogene Fragestellungen zur Verbesserung der Gesundheitsversorgung und der Gesundheitsförderung einbezogen kann. Doch gibt es auf Seiten der Vertreter von Public Health in Deutschland erhebliche Vorbehalte gegenüber Public Health Genetics (Kälble 2004). Das Bundesministerium für Bildung und Forschung (BMBF) hat bereits 2001 den Bedarf für eine Forschung zur Entwicklung leistungsfähiger Methoden zur Identifizierung von Genkombinationen, die zu einem erhöhten Krankheitsrisiko beitragen, erkannt und stellt die Förderung dementsprechender Projekte in Aussicht. Dabei wird die Notwendigkeit einer Vernetzung verschiedener Disziplinen sowie die internationale Kooperationen betont. Begleitend wird es Studien zu ethischen Aspekten neuer medizinischer Möglichkeiten fördern (BMBF 2001). Der Aufgabe, Regelungen zu entwickeln, wie die Erkenntnisse und Techniken der Genomforschung zum Nutzen der Gesellschaft angewendet werden können, werden sich also auch in Deutschland die in der Gesundheitsversorgung Tätigen und die Verantwortlichen für die Gestaltung des Gesundheitssystems verstärkt stellen müssen. Die Genetik kann als Teil des Komplexes „Biomedizin“ gesehen werden, die in neue ethische Grenzbereiche des Gesundheitswesens führt (Winter und Fuchs 2000). Dieser hat aus gesellschaftlicher Sicht auch in Deutschland einen hohen regulatorischen Bedarf entwickelt. Als Gründe dafür führt Winter an n n n n n gestiegene Fülle und Wirksamkeit der Methoden einhergehende höhere abzuwägende Risiken zunehmende Arbeitsteiligkeit (interdisziplinäre, interprofessionelle Teams) Erfordernis des zwischenstaatlichen Abgleichs öffentlich gestiegenes Bewusstsein gegenüber Gesundheitsforschungs- und Anwendungsproblemen n Regulationen als vertrauensbildende und – wo erfolgreich – qualitätssichernde Maßnahmen n Genetik als Herausforderung für das Selbstverständnis des Menschen. t460 Genetik in Public Health Te i l 2 / 2 0 0 7 Da wissenschaftliche Forschung durch wachsende Spezialisierung und zunehmende Differenzierung gekennzeichnet ist, die Wirklichkeit hingegen, auf die sich die Forschung richtet, vielschichtig und komplex ist und sich eben gerade nicht in Disziplinen einteilen lässt, können viele Fragen der Forschung nicht aus den einzelnen Fächern heraus beantwortet werden, sondern sie verlangen vielmehr die Zusammenarbeit zwischen den Disziplinen (Winter 2003). Dieses trifft in besonderer Art und Weise für Public Health Genetics als eine disziplinübergreifende Aufgabe mit entsprechender Politikund Praxisnähe sowie hohem wissenschaftlichen Innovationspotenzial zu. Durch die Integration von Public Health Genetics in die Public Health Wissenschaften können die fachlichen Kompetenzen und die Methoden zur Verfügung gestellt werden, um die Bedeutung prädiktiver genetischer Tests, den Erfolg präventiver Strategien sowie die ethischer Fragen zu untersuchen. Dabei zeichnen sich folgende Schwerpunkte ab: (1) Schaffung einer epidemiologische Datenbasis zur Untersuchung der Einflüsse genetischer Faktoren und der Bedeutung von Gen-Umwelt-Interaktionen in Bezug auf die in der Bevölkerung verbreiteten Erkrankungen, (2) Entwicklung von Richtlinien vor allem durch die Forschung zur Identifizierung und Analyse ökonomischer, sozialer und psychologischer Auswirkungen genetischer Fortschritte, (3) Implementierung von Verfahren zur Qualitätssicherung genetischer Tests und des Versorgungsangebotes auf der politischen Ebene, (4) Schaffung von Informations- und Kommunikationsplattformen für die Intensivierung der Beteiligung von Public Health (Genetics) Wissenschaftlern und Praktikern sowie der Öffentlichkeit an Diskussions- und Entscheidungsprozessen. Die Herstellung von Transparenz und eine den Fortschritt der HumangenomTechnik und der Erkenntnisse begleitende Forschung ist angesichts der Ausweitung genetischer Forschung eine essenzielle Aufgabe von Public Health Genetics, um die Kenntnisse über die Erkenntnisfortschritte der Genomforschung zu verbessern (Burton 2003, Brand et al. 2004). Public Health Wissenschaftler können dazu beitragen, die “Öffentlichkeit” mit der “Wissenschaft“ durch die Organisation einer qualifizierten Kommunikation zwischen Forschungsorganisationen, Berufsgruppen, Einrichtungen des öffentlichen Gesundheitsdienstes und den Vertretern gesellschaftlicher Interessen zu verbinden, um die Zusammenarbeit zu fördern und die Interessen der Gemeinschaft und des Individuums auszugleichen (Khoury et al. 2000). 461u Public Health Genetics: Eine Übersicht Die Erfahrungen aus den USA und Großbritannien haben gezeigt, dass der Aufbau von Public Health Genetics in diesen Ländern insbesondere dadurch so erfolgreich war, da die Fragestellungen und Aufgaben von Public Health Genetics nicht nur von Beginn an interdisziplinär analysiert, sondern in der Folgezeit auch entsprechend in Politik und Praxis institutionalisiert wurden. So wurde und wird hier in überregionalen interdisziplinären Forschergruppen nicht nur die Reichweite von Public Health Genetics für die Gesundheitsversorgung und -sicherstellung analysiert, sondern darüber hinaus wurde durch die Institutionalisierung in Strukturen des Öffentlichen Gesundheitswesens und Gesundheitssystems Public Health Genetics nachhaltig gesichert. Literatur Abramson JH, Kark SL (1983): Community-oriented primary care: Meaning and scope. In Community oriented primary care new directions for health services. Washington DC: National Academy Press, 21-59 American Society of Human Genetics (ASHG) (1996): Statement on informed consent for genetic research. American Journal of Human Genetics 59, 471-474 The Human Genome Project Implications for Human Genetics (ASHG) (1991): ASHG Human Genome Committee Report. American Journal of Human Genetics 49 , 687-691 Association of State and Territorial Health Officers (ASTHO) (2001a): Framework for Public Health Genetics Policies and Practices in State and Local Public Health Agencies. [http://genomicstoolkit.org/download/ASTHO_Framework.pdf] (30.03.2004) Austin MA, Peyser PA, Khoury MJ (2000): The interface of genetic and Public Health Research and educational challenges. Annual Reviews of Public Health. 21, 81-99 Austin MA, Harding S, McElroy C (2003): Genebanks a comparison of eight proposed international genetic databases. Community Geneics. 6 (1), 37-45 t462 Genetik in Public Health Te i l 2 / 2 0 0 7 Battista NR, Hodge MJ (1999): The evoloving paradigme of health technology assessment reflections for the millenium. Journal de l‘Association médicale canadienne. 160 (10), 164-167 Beskow LM, Burke W, Merz JF, et al. (2001a): Informed Consent for Population-Based Research Involving Genetics. Journal of the American Medical Association. 286 (18), 2315-2.1 Beskow LM, Khoury MJ, Baker TG, et al. (2001b): The Integration of Genomics into Public Health Research, Policy and Practice in the United States. Community Genetics. 4 (2001b), S. 2-11 Blancquaert I, De Langavant L, Bouchard L et al. (2001): Oversight Mechanisms for Technology Transfer in Molecular Genetics – Meeting the Challenge. ISUMA Canadian Journal of Policy Research Volume 2 (3) Brand A (2001): Genetik und Public Health. Public Health Forum 30, 2-4 Brand A (2002): Health Technology Assessment als Basis einer Prioritätensetzung. In: Fozouni B, Güntert B (Hrsg.): Prioritätensetzung im deutschen Gesundheitswesen. Berlin: Logos Verlag, 158-163 Bundesministerium für Bildung und Forschung (BMBF) (2001) (Hrsg.): Gesundheitsforschung. Forschung am Menschen - Programm der Bundesregierung. Referat für Öffentlichkeitsarbeit. Bonn. Burke W (2002): Genetic Testing. New England Journal of Medicine. 347 (23), 1867-1875 Burris S, Gostin LO, Tress D (2000): Public Health surveillance of genetic information Ethical and legal responses to social risk. In: Khoury MJ, Burke W, Thompson E (Hrsg.): Genetics and Public Health in the 21st Century. New York: Oxford: University Press Burton H (2003): Adressing Genetics Delivering Health. A strategy for advancing thedissemination and application of genetics knowledge throughout our healthprofessions. The Public Health Genetics Unit of the Cambridge, Genetic Knowledge Park, [www.phgu.org.uk] 21.02.2005 Cao A(2000): Genetic Screening and Genetic Couselling in ß-Thalassemia. International Journal of Hematology 76, Suppl.II, 105-113 463u Public Health Genetics: Eine Übersicht Chan L, Topfer L (2000): Health technology assessment on the Net a guide to Internet sources of information. [http://www.ahfmr.ab.ca, http://www. ihe.ab.ca] (30.03.2004) Centers for Disease Control and Prevention (CDC) (1997): Translating human genetics into public health action. A strategic plan. Draft. Centers for Disease Control and Prevention, Office of Genomics and Disease Prevention. Genomics and Population Health (2004): United States, 2003. Atlanta.[http://www.cdc.gov/genomics/activities/ogdp/2003.htm] (30.03.2004) Chadwick R, Berg K (2001): Solidarity and Equity new ethical frameworks for genetics databases. Nature Reviews Genetics. 2, 318-322 Chan L, Topfer L (2000): Health technology assessment on the Net a guide to Internet sources of information. [http://www.ahfmr.ab.ca, http://www. ihe.ab.ca] (30.03.2004) Clayton EW, Steinberg KK, Khoury MJ, et al. (1995): Informed consent for genetic research on stored tissue samples. Journal of the American Medical Association 274 , 1786-1792 Coughlin SS, Beauchamp TL (Hrsg.) (1996): Ethics and Epidemiology. New York: Oxford University Press Dorman JS, Mattison DR (2000): Epidemiology, molecular biology, and public health. in: Khoury MJ, Burke W, Thompson E (Hrsg.): Genetics and Public Health in the 21st Century. New York: Oxford University Press Droste S, Gerhardus A, Kollek R (Hrsg.) (2003): Methoden zur Erfassung ethischer Aspekte und gesellschaftlicher Wertvorstellungen in Kurz-HTABerichten – eine internationale Bestandsaufnahme. HTA-Schriftenreihe, Band 9. Köln: Rüther, Dauben, Warda Elsworth DL, Manolio TA (1999): The Emerging Importance of Genetics in Epidemiology Research I. Basic Concepts. in: Human Genetics and Laboratory Technology. Annual Epidemiology. 9, 1-16 t464 Genetik in Public Health Te i l 2 / 2 0 0 7 Eser A, Lutterotti M, Sporken P (Hrsg.) (1999): Lexikon Medizin, Ethik, Recht. Freiburg: Herder European Commission (2004): Ethical, legal and social aspects of genetic tests: research, development and clinical applications. European Commission Expert Group. Brüssel. [http://europa.eu.int/comm/research/ conferences/2004/genetic/report_en.htm] (30.06.2004) Fineman RM, Lochner Doyle DF (2000): Public Health needs assessment for state-based genetic services delivery. in: Khoury MJ, Burke W, Thompson E (Hrsg.): Genetics and Public Health in the 21st Century. New York: Oxford University Press French ME, Moore JH (2003): Harnessing Genetics to Prevent Disease & Promote Health. Washington, DC; Partnership for Prevention. [http:// www.prevent.org/ publications/GeneticsReport.pdf] (30.03.2004) Fry A, Campbell H, Gudmundsdottir H, et al. (1999): GP`s views on their role in cancer genetics services and current practices. Family Practice 16, 468-457. Gesellschaft für Humangenetik e.V (GfH) (1996): Positionspapier der Gesellschaft für Humangenetik e.V. Medizinische Genetik. 8, 125-131 Godard B, Schmittke J, Cassiman JJ, et al. (2003): Data storage and DNAbanking for biomedical research Informes consent, confidentiality, quality issues, ownership, return of benefits. A professional perspective. EUROGAPP Project 1999-2000, European Society of Human Genetics (ESHG). European Journal of Human Genetics. 11, Suppl 2, 88 -122 Gwinn M, Khoury MJ (2002): Research Priorities for Public Health Sciences in the Post-Genomic Era. Genetics in Medicine 4, 410 - 411 Henn W (2006): Die Bedeutung genetischer Mutationen und ihrer Diagnostik für Prävention und Therapie multifaktoriell bedingter Krankheiten. In: Brand A, Schröder P, Bora A, et al. (Hrsg.): für die ZiF-Task Force „Public Health Genetics“: Genetik in Public Health. Bielefeld: Landesinstitut für den Öffentlichen Gesundheitsdienst NRW (lögd) Hodge JG Jr (2004): Ethical issues concerning genetic testing and screening in public health. American Journal of Medical Genetics. 125C (1), 6670 465u Public Health Genetics: Eine Übersicht Human Genetics Commission (HGC) (2002): Inside Information. Balancing interests in the use of genetic data. London [http://www.hgc.gov.uk/ insideinformation/index.htm#report] (30.3.2004) Human Genetics Commission (HGC) (2003): Genes direct. Ensuring the effective oversight of genetic tests supplied directly to the public. London [http://www.hgc.gov.uk/genesdirect/] (30.03.2004) Holtzman NA, Watson MS (Hrsg.) (1998): Promoting Safe and Effective Genetic Testing in the United States. Final Report of the Task Force on Genetic Testing. Baltimore MD: Johns Hopkins University Press Holtzman NA, Marteau TM (2000): Will Genetics Revolutionize Medicine? New England Journal of Medicine. 343, 141-144 Institute of Medicine (IOM) (1988): Committee for the Study of the Future of Public Health, Division of Health Care Services. Washington DC: National Academy Press Institute of Medicine (IOM) (2005): Implications of Genomics for Public Health: Workshop Summary. Board on Health Promotion and Disease Prevention. Washington, DC: National Academic Press. Jennings B (2003): INTRODUCTION: A Strategy for Discussing Ethical Issues in Public Health. In: Jennings B., Kahn J, Mastroianni A, et al. (Hrsg.): Ethics and Public Health: Model Curriculum. [http://www.asph. org/document.cfm?page=782] (30.3.2004) Juengst ET (1995): „Prevention” and the goals of genetic medicine. Human Gene Therapy 12, 1595-605. Kälble K (2004): Public Health Genetics. In: ZiF-Mitteilungen 2/2004, 714 Khoury MJ (2004): Foreword. In: Centers for Disease Control and Prevention, Office of Genomics and Disease Prevention: Genomics and Population Health: United States 2003. Atlanta[http://www.cdc.gov/ genomics] (30.3.2004) t466 Genetik in Public Health Te i l 2 / 2 0 0 7 Khoury MJ (2003a): Genomics Research in the 21st Century: From the Test Tube to Population Health. Testimony of Muin Khoury, M.D., Ph.D.Director, Office of Genomics and Disease Prevention, CDC, Before the Subcommittee on Health Committee on Energy and Commerce United States House of Representatives May 22[http://www.cdc.gov/ washington/testimony/In5222003169.htm] (21.2.05) Khoury MJ, Beaty TH, Cohen BH (1993): Fundamentals of Genetic Epidemiology. New York: Oxford University Press Khoury MJ, Burke W, Thomson EJ (2000): Genetics and public health. A framework for the integration of humang genetics into public health practice. In: Khoury MJ, Burke W, Thompson E (Eds): Genetics and Public Health in the 21st Century. New York: Oxford University Press Khoury MJ, Thrasher JF, Burke W, et al. (2002): Challenges in communicating genetics - a public health approach. Genetics in Medicine. 2 (3),, 198-202 Khoury MJ, McCabe LL, McCabe ERB (2003): Population Screening in the Age of Genomc Medicine. New England Journal of Medicine. 348 (1), 50-58 Khoury MJ, Little J, Burke W (2004): Human Genome Epidemiology: Scope and Strategies. In: Khoury MJ, Little J, Burke W (Hrsg): Human Genome Epidemiology. A Scientific Foundation for Using Genetic Information to Improve Health and Prevent Disease. New York: Oxford University Press Knottnerus JA (2003): Community Genetics and Community Medicine. Family Practice. 5, 601-606 Kretzman JP, McKnight JL (1993): Building Communities from Inside Out. Chicago/Evanston. [http://www.northwestern.edu/ipr/publications/community/introd-building.html] (30.03.2004) Kunz R, Ollenschläger G, Raspe H, et al. (Hrsg.) (2000): Lehrbuch Evidenzbasierte Medizin in Klinik und Praxis. Köln: Deutscher ÄrzteVerlag Last JM (1995): A dictionary of epidemiology. New York: Oxford University Press 3. Aufl. 467u Public Health Genetics: Eine Übersicht Lingappa J, Lindgren ML (2004): Genomics and Acute Public Health Investigations. In: Centers for Disease Control and Prevention, Office of Genomics and Disease Prevention: Genomics and Population Health: United States 2003. Atlanta. [http://www.cdc.gov/genomics] (30.3.2004) Link G (2002): Nutzen-Schaden-Abwägung. Deutsches Ärzteblatt 99 (15), A-991 / B-821 / C-769 Lühmann D, Bartel C, Raspe H (2006): Ethische Aspekte und gesellschaftliche Wertvorstellungen in HTA-Berichten zu genetischen Testverfahren. In: Brand A, Schröder P, Bora A, et al. (Hrsg.): für die ZiF-Task Force „Public Health Genetics“: Genetik in Public Health. Bielefeld: Landesinstitut für den Öffentlichen Gesundheitsdienst NRW (lögd) Modell B, Kuliev A (1998): The History of Community Genetics. The Contribution of the Haemoglobin Disorders. Community Genetics. 1, 3-11 Moon JD (1998): Communitarianism. In: Reich WT (Hrsg.): Encyclopedia of Applied Ethics 1. San Diego: Academic Press Nationaler Ethikrat (2004): Biobanken für die Forschung. Stellungnahmen. Berlin, 17.03.2004. [http://www.ethikrat.org/themen/pdf/Stellungnahme_ Biobanken_04-03-17.pdf] (30.03.2004) National Human Genome Research Institute (NHGRI) (1968): Societal concerns of the „new genetics“. [http://www.ornl.gov/sci/techresources/ Human_Genome/publicat/judicature/box1.html] (30.3.2004) National Human Genome Research Institute (NHGRI) (1996): “NHGRI Report of the Joint NIH/DOE Committee to Evaluate the Ethical, Legal, and Social Implications Program of the Human Genome Project 1996” [http://www.genome.gov/10000477] (30.03.2004) Omenn GS (2000): Genetics in public health: Historical perspectives and current challenges and opportunities. In: Khoury MJ, Burke W, Thompson E (Hrsg.): Genetics and Public Health in the 21st Century. New York: Oxford University Press Paul NW (2003): Auswirkungen der Molekularen Medizin auf Gesundheit und Gesellschaft. Stabsabteilung der Friedrich-Ebert-Stiftung. Bonn t468 Genetik in Public Health Te i l 2 / 2 0 0 7 Paul NW, Roses AD (2003): Pharmacogenetics and Pharmacogenomics. Recent Developments, Their Clinical Relevance and Some Ethical, Social and Legal Implications. Journal of Molecular Medicine. 81, 135140 Paul NW, Ganten G (2003): Die Zukunft der molekularen Medizin. In: Honnefelder L, et al. (Hrsg.): Das genetische Wissen und die Zukunft des Menschen. Berlin: de Gruyter Peltonen L, McKusick VA (2001): Genomics and Medicine. Dissecting Human Disease in the Postgenomic Era. Science 291, 1224-1229 Perleth M (1998): Health Technology Assessment. In: Schwartz FW, Badura B, Busse R et al. (Hrsg.): Das Public Health Buch – Gesundheit und Gesundheitswesen. München: Elsevier Schröder D, Williams G (2002): DNA-Banken und Treuhandschaft. Ethik in der Medizin. 14, 84-95 Ten Kate LP (1998): Editorial. Community Genetics. 1, 1-2 Ten Kate LP (2000): Community genetics in The Netherlands. In: Khoury MJ, Burke W, Thompson E (Hrsg.): Genetics and Public Health in the 21st Century. New York: Oxford University Press The Royal College of General Practitioners North West England Faculty of The Royal College of General Practitioners (1998). Genetics in Primary Care: A report from the faculty GeneticsGroup. Occasional Paper 77. London Teutsch SM, Churchill RE (1994): Principles and Practice of Public Health Surveillance. Oxford University Press Washington State Board of Health (2002): Genetic Privacy, Discrimination, and Research in Washington State: Findings, Conclusions, and Recommendations of the Washington State Board of Health Genetics Task Force. October 2002 [http://www.doh.wa.gov/SBOH/Priorities/Genetics/genetics.htm] (30.04.2004) 469u Public Health Genetics: Eine Übersicht World Health Organization (WHO (1963)): The Human Genetics Programme: A brief History. [http://www.who.int/genomics/history/en/] (30.03.2004) World Health Organization (WHO) (1985):Community approaches on hereditary diseases. Report of a WHO Advisory Group on hereditary diseases. Geneva 3.-5.October 1985. Unpublished Document HMG/ AG/85.10. Hereditary Diseases Programme. WHO World Health Organization (WHO) (1997): Fifty years of WHO in the Western Pacific Region. Report of the Regional Director to the Regional Committee for the Western Pacific. Chapter 7. [http://www.wpro.who. int/public/policy/50TH/Ch_07.html] (30.03.2004) World Health Organization (WHO) (1998): Proposed International Guidelines on Ethical Issues in Medical Genetics.[http://whqlibdoc.who. int/hq/1998/WHO_HGN_GL_ETH_98.1.pdf] (30.03.2004) World Health Organization (WHO): Genomics and World Health. Geneva 2002 World Health Organization (WHO) (2003): The World Health Report 2003 – shaping the future. Geneva Wright AF, Carothers AD, Pirastu M (1999): Population Choice in mapping genes for complex diseases. Nature Genetics. 23, 397-404 Wright Clayton E (2000): Genetics, public health, and the law. In: Khoury MJ, Burke W, Thompson E (Hrsg.): Genetics and Public Health in the 21st Century. New York: Oxford University Press Zimmern R (2002): Public Health Genetics Unit. In: Institute of Public Health. Review 2000 -2002. University of Cambridge. Sept. 2002, 21. [http://www.iph.cam.ac.uk/review/phgu.pdf] (30.03.2004) Zimmern R, Cook C (2000): The Nuffield Trust Genetics Scenario Project. Genetics and Health. Policy issues for genetic science and their implications for health and health services. London: The Nuffield Trust t470 Genetik in Public Health III. Genetik in Public Health Te i l 1 / 2 0 0 7 Risikoabschätzung, Risikomanagement und Risikokommunikation in Public Health Genomics Angela Brand, Helmut Brand 471u t472 Genetik in Public Health Te i l 1 / 2 0 0 7 Inhalt III. Genetik in Public Health Risikoabschätzung, Risikomanagement und Risikokommunikation in Public Health Genomics 1. Beitrag von molekularer Medizin und genetischer Epidemiologie zu Public Health........................................ 474 2. Abschätzung, Management und Kommunikation von Risiko...................................................................... 478 3. Lebensstil und Krankheiten im Fokus von Prävention und Versorgung ............................................................. 485 4. Sicherstellung von präziseren, frühzeitigeren und nebenwirkungsärmeren Präventionsmaßnahmen . ............... 486 5. Schlussfolgerung............................................................. 488 Literatur.............................................................................. 489 473u Risiko: Abschätzung, Management, Kommunikation 1. Beitrag von molekularer Medizin und genetischer Epidemiologie zu Public Health Momentan entwickelt sich die Medizin in rasantem Tempo von ihrer morphologischen und phänotypischen Orientierung hin zu einer molekularen und genotypischen Orientierung, wodurch neben der Diagnose die Prognose und Prädiktion zu immer wichtigeren Aussagegrößen werden (Brand et al. 2004). Bereits Mitte der 1980er Jahre wurde mit der Kartierung des menschlichen Genoms begonnen. Zahlreiche Gene konnten mit Hilfe der Positionsklonierung entdeckt und Mutationen für genetisch bedingte Erkrankungen identifiziert werden. Dazu zählten vor allem die monogen bedingten Erbkrankheiten aber auch die komplexen, multifaktoriell bedingten Erkrankungen wie HerzKreislauf-Krankheiten, Diabetes mellitus, Krebserkrankungen oder Asthma. Nachdem die gesamte DNA-Sequenz verfügbar ist, können nun neue Gene mit Hilfe der sequenzbasierten Suche wesentlich schneller entdeckt werden (Peltonen & McKusick 2001). Darüber hinaus ermöglichen die neuen Technologien, genetische Veränderungen auf der Ebene der funktionalen Einheiten der Gene, den Proteinen, zu untersuchen und die Bedeutung der Umweltfaktoren wie chemischer, physikalischer oder infektiöser Agenzien und Noxen, der Ernährung oder des Verhaltens für die Entstehung von Krankheiten besser zu verstehen. Die Fortschritte der Humangenomforschung werden zunehmend in die Medizin integriert und beginnen bereits heute, das Verständnis von Krankheit und Gesundheit zu verändern. Die Vorstellung, dass die meisten, wenn nicht alle Krankheiten durch genetische Faktoren zumindest mit bedingt sind, ist jedoch nicht neu. Und auch die systematische Erforschung genetischer Krankheitsursachen begann bereits mit der Zytogenetik Ende der 1950er und der Kartierung von Genen auf den Chromosomen in den späten 1960er Jahren. In Folge der Weiterentwicklung genetischer Forschungsmethoden und wachsender Erkenntnisse wird Krankheit heute zunehmend als Ergebnis eines komplexen Interagierens von umwelt- und verhaltensrelevanten Faktoren mit individuellen genetischen Prädispositionen verstanden (Khoury et al. 2000). Die Erforschung komplexer Erkrankungen erfordert daher nicht nur die Untersuchung von Variationen eines oder mehrerer Gene und deren Produkte, sondern darüber hinaus die Beobachtung von Veränderungen während der Entwicklung, der Reifung und des Alterns unter den Einflüssen von Umweltfaktoren auf die physiologische Matrix aus unterschiedlichen Genprodukten. So beschäftigt sich der auf der Kenntnis der Gensequenz aufbauende Forschungsansatz der „postgenome t474 Genetik in Public Health Te i l 1 / 2 0 0 7 era“ mit der Untersuchung des gesamten Genoms, seiner Funktionen und Wechselwirkungen mit biologisch wirksamen Umweltfaktoren. Für Public Health sind in diesem Zusammenhang insbesondere diejenigen neuen bzw. weiterentwickelten technischen Möglichkeiten relevant, mit deren Hilfe die unterschiedlichsten Bedingungen für häufige Erkrankungen wie Krebsoder Infektionskrankheiten umfassend untersucht werden können, um neue Erkenntnisse über komplexe Gen-Gen- und Gen-Umwelt-Interaktionen zu gewinnen (Ellsworth & O’Donnell 2004). In Anbetracht der Komplexität und Plastizität genomischer Prozesse bestehen Ziele und Möglichkeiten der medizinischen Genomforschung derzeit darin, ein erweitertes Verständnis von denjenigen Prozessen zu erlangen, die daran beteiligt sind, dass Menschen krank werden, bzw. nicht Krankheiten zu untersuchen, sondern die gemeinsamen molekularen Ursachen von Krankheit überhaupt. Die Genetik wird also zunehmend als Teil der Zell- und Molekularbiologie, der einen Beitrag zu allen körperlichen Erscheinungsformen und Erkrankungen leistet, gesehen und der in Zukunft die reduktionistischen Ansätze der medizinischen Forschung um die molekularmedizinische Forschung ergänzen wird. Durch ein wachsendes Verständnis für eine genetisch bedingte Variabilität wird ein Krankheitsmodell entstehen, das biologische Erkenntnisse über Genotyp-Phänotyp-Beziehungen, nämlich die zeit- und entwicklungsabhängigen Interaktionen zwischen möglichen genetischen und Umweltfaktoren, mit einbezieht. Damit geht die Genetik von einer Spezialwissenschaft für eine kleine Gruppe seltener, monogener Erkrankungen über zu einer Wissenschaft, die Beiträge zu den häufigsten polygenetischen Krankheiten leistet und damit für die Gesundheitsversorgung der Bevölkerung von Interesse ist. Hier hat die genetische Epidemiologie, die beim Auftreten von Krankheiten in menschlichen Populationen die Rolle genetischer Faktoren, deren Interaktion untereinander und ihr Verhältnis zu Umweltfaktoren untersucht, eine Schlüsselkompetenz. Als relativ junges Forschungsgebiet hat sie ihren Ursprung insbesondere in den Mendel’schen Vererbungsmodellen und der Populationsgenetik. Letztere verfolgt wiederum das Ziel, mathematische Eigenschaften von Genen in Populationen zu untersuchen bzw. Faktoren, die die genetische Zusammensetzung einer Population bestimmen, zu untersuchen. Ihre Entwicklung ergab sich nicht zuletzt aus dem Humanen Genomprojekt (HUGO), das Ende der 1980er Jahre begann und primär das Ziel der Sequenzierung des menschlichen Genoms verfolgte. Dabei galt es, alle Gene zu lokalisieren und zu identifizieren mit dem weiterreichenden Ziel, deren funktionelle Bedeutung und Zusammenhänge zu verstehen. Hierbei ist zu berücksichtigen, dass es 475u Risiko: Abschätzung, Management, Kommunikation sich bei den untersuchten Kollektiven üblicherweise um Populationen mit bestimmten Abhängigkeitsstrukturen, wie z.B. Familien handelt. Die zunehmende Verzahnung von Genetik und Epidemiologie wurde durch die rasanten Entwicklungen in der Molekularbiologie unterstützt. Dabei gilt es, suszeptible Individuen möglichst frühzeitig zu identifizieren und dadurch gezielt zu Primär- und Sekundärprävention beizutragen. Ein weiteres, langfristiges, allerdings außerhalb des unmittelbaren Einsatzgebietes der genetischen Epidemiologie liegendes Ziel besteht darin, durch individuelle, bzw. risikostratifizierte Therapien, die auf genetische und andere persönliche Attribute zugeschnitten sind, den Heilungserfolg zu verbessern. Anders als die molekulare Epidemiologie, die sich ganz allgemein mit erblichen und erworbenen Veränderungen auf molekularer Ebene befasst, hat die genetische Epidemiologie ihren Fokus auf hereditären, d.h. erblichen Mechanismen, wie z.B. Keimbahnmutationen und setzt neben Bevölkerungsauch Familienstudien ein. Durch ihren häufig populationsbezogenen Ansatz erreicht die genetische Epidemiologie eine gewisse Bevölkerungsrepräsentativität. Sie liefert die methodische Basis zur Untersuchung des Gen-Merkmal-Zusammenhangs und bietet die Möglichkeit, Interaktionen zwischen Genen sowie zwischen Genen und Umwelteinflüssen zu untersuchen. Neben der funktionalen Analyse von Genen untersucht sie die Rolle von Genen in komplexen Funktionszusammenhängen, beispielsweise bei polygenetischen oder multifaktoriellen Erkrankungen. Die genetische Epidemiologie hat im bereits erwähnten Humanen Genomprojekt insbesondere durch das Verfahren der Kopplungsanalyse eine zentrale Rolle gespielt. Man kann festhalten, dass die genetische Epidemiologie einerseits der Wegbereiter für die Bioinformatik war, indem sie die Identifikation und Lokalisation von Genen unterstützt, andererseits ist es möglich, die mit Hilfe von bioinformatischen Methoden gewonnenen Erkenntnisse im Rahmen (genetisch)-epidemiologischer Studien zu verifizieren sowie weitergehend zu untersuchen (Little 2004). Die genetische Epidemiologie besitzt somit einerseits einen Fokus auf genetischen Mechanismen. Andererseits berücksichtigt sie jedoch auch exogene Faktoren, wie z.B. Umwelteinflüsse, Lebensstilfaktoren und soziale Determinanten. Dies ist nicht nur möglich, sondern geradezu zwingend, insbesondere bei den sog. „Zivilisationskrankheiten“ wie Übergewicht oder Lungenkrebs mit bedeutsamer exogener Komponente. Die Rolle der genetischen Epidemiologie ist darin zu sehen, dass sie einen Beitrag zur Erklärung der komplexen Zusammenhänge leistet, insbesondere dort, wo die Erklärung durch bekannte Faktoren unzureichend ist. t476 Genetik in Public Health Te i l 1 / 2 0 0 7 Man hofft, durch die genetische Epidemiologie mit Hilfe genetischer Tests verbesserte Vorhersagen über das individuelle bzw. stratifizierte Risiko für eine Erkrankung treffen zu können. Da an einer komplexen, multifaktoriellen Erkrankung in der Regel Mutationen mehrerer Gene beteiligt sind, die bei Betroffenen in unterschiedlicher Kombination zu einem klinischen Phänotyp führen, kann die Auswirkung derselben Gene auf die Erkrankung zwischen Familien sehr unterschiedlich sein. So kann ein seltenes Gen in der einen Familie erheblich zu der Erkrankung beitragen, während der Effekt bei anderen Betroffenen eher gering ist. In diesem Zusammenhang wurde der Begriff „Quantitative Trait Loci“ (QTL) geprägt. QTLs werden häufig als genetische Suszeptibilitäten bezeichnet, wenn sie ein erhöhtes, jedoch nicht exakt bestimmbares Risiko für eine Krankheit bedingen. So ist beispielsweise die Zunahme krankhaften Übergewichts zum einen die Folge sich verändernder Lebensgewohnheiten wie Bewegungsarmut und Ernährungsbedingungen (hohes Nahrungsangebot, fettreiche Ernährung), die zu einer gestörten Energiebilanz führen (Hebebrand et al. 20005). Zum anderen werden QTLGene erst dann exprimiert, wenn die Ernährung fettreich ist und tragen auch erst dann zu einer erhöhten Lipidkonzentration im Blut bei. Darüber hinaus gibt es Hinweise auf weitere modulierende genetische Einflüsse wie etwa die Beobachtung, dass gewichtsmindernde Maßnahmen wie Diät oder Sport individuell unterschiedlich wirksam sind. Es ist zwar richtig, dass die Forschung noch lange im Grundlagenbereich verharren wird. Und richtig ist auch, dass die Forschung entgegen der früheren linearen Erwartung „ein Gen verursacht eine Krankheit“ auf hochkomplexe Krankheitsätiologien aufmerksam geworden ist, die eben dadurch gekennzeichnet sind, dass es neben wenigen hochpenetranten monogenetischen Erkrankungen zahlreiche polygen und exogen verursachte Krankheiten gibt, wobei zudem auch noch unterschiedliche Umwelteinflüsse unterschiedlich wirken können. Daraus folgt, dass durch die Wahrnehmung solcher komplexer Krankheitsverursachungen Prognose und Prädiktion in der Regel den Status von unsicheren Wahrscheinlichkeitsaussagen behalten wird (Holtzman & Marteau 2000). Dennoch wird nach derzeitiger wissenschaftlicher Einschätzung die Beachtung von genetischer probabilistischer wie auch deterministischer Prädiktion das Verständnis von Gesundheit und Krankheit und den individuellen wie sozialen Umgang mit diesen Lebensführungsphänomenen nachhaltig prägen und verändern. So entsteht der kulturell noch unbekannte Status des „healthy ill“ und erzeugt zunächst einmal Unsicherheit. Vor diesem Hintergrund stellt sich sowohl im Hinblick auf Schutzansprüche als auch im Hinblick auf medizinische und rechtliche Handlungsoptionen die drängende 477u Risiko: Abschätzung, Management, Kommunikation Frage, ob genetisches Wissen gegenüber allen anderen Informationen von besonderer Qualität oder Risikobehaftetheit ist (Murray 1997). 2. Abschätzung, Management und Kommunikation von Risiko Insbesondere Umwelt- und Gesundheitsrisiken sind in der heutigen Gesellschaft immer wieder Gegenstand kontroverser Diskussionen. Täglich wird in den Massenmedien über neue wissenschaftliche Erkenntnisse zu Gesundheits- und Umweltrisiken, über neue Möglichkeiten zur individuellen Risikoprävention oder über Kontroversen zwischen verschiedenen Akteuren über den Umgang mit solchen Risiken berichtet. Die individuelle und subjektive Beurteilung der Risiken durch die Betroffenen bzw. die gesellschaftlichen Akteure erlangt hierdurch zunehmend zentrale Bedeutung. Die Epidemiologie als eine Basisdisziplin von Public Health spricht nicht allein von Gesundheitsrisiken, sondern vielmehr von einzelnen Risikofaktoren. Sie definiert sie als Struktureigenschaften einer definierten Population, die eine interpretationsfähige bzw. interpretationsbedürftige Differenz im Vergleich zu einer anderen Population erklären. Entscheidend ist, dass hierfür eine hinreichende Evidenz oder auch Beweise im Sinne von Kausalitäten vorliegen müssen. Wissenschaftliche Forschung identifiziert aber nicht nur neue Risiken und reagiert auf sie adäquat, sondern sie schafft durch ihre Arbeit selbst neue Perspektiven. So ist die Wirklichkeit der Risiken nicht mehr rein wissenschaftlich, sondern auch sozial konstruiert, und die Risiken sind dann real, wenn sie als möglich wahrgenommen werden. Was wiederum als Risiko betrachtet und wie es bewertet wird, hängt ganz entscheidend von Einstellungen, Werten, Interessen und dem Wissen des Betrachters ab (Brand 1999). Die an Konflikten über die unterschiedliche Interpretation von Risiken beteiligten Interessengruppen beziehen sich dabei vor allem auf Aussagen, die die eigene Position bestätigen, – sei es in Bezug auf die mit einer Innovation verknüpften (Gesundheits)risiken oder deren Relativierung. Die Veröffentlichung widersprüchlicher Aussagen verstärkt die allgemeine Unsicherheit in der Öffentlichkeit bei der Interpretation und Bewertung von Risiken. Doch während man beim naturwissenschaftlichen Zugang zur Risikobewertung die subjektive, individuelle Wahrnehmung von Risiken nicht berücksichtigt und auch nicht berücksichtigen sollte, ist dies in der t478 Genetik in Public Health Te i l 1 / 2 0 0 7 gesellschaftlichen Risikobewertung ein wichtiger Faktor. Dementsprechend ist beispielsweise der Risikobegriff der Natur- und Ingenieurwissenschaften formal-normativ sowie wirkungs- und schadensorientiert und setzt umfassende Kenntnis über Wirkungs- und Kausalketten voraus (Jung 2003). In der Realität ist diese umfassende Kenntnis häufig weder vorhanden, noch werden bestehende Unsicherheiten und Ungewissheiten in ausreichendem Maß berücksichtigt. Auf europäischer Ebene jedoch hat die Europäische Union dieses bereits realisiert und den Umgang mit Unsicherheiten in Form des „precautionary principle“ geregelt. Ungewissheiten und Unsicherheiten gegenüber steht der Begriff der Sicherheit, der sich selbst wiederum nur über die Relation zur Unsicherheit und zum Schadensbegriff erklärt. Der rechtliche Risikobegriff beispielsweise wird durch die Trias Gefahr, Risiko und Restrisiko bestimmt. Einerseits ist somit der rechtliche Risikobegriff enger gefasst als der naturwissenschaftliche. Andererseits ist er aber auch weiter gefasst, da er zur Abgrenzung zum Restrisiko Abwägungen zur Ungewissheit notwendig macht. Ganz anders in der Systemtheorie der Gesellschaftswissenschaften: Hier wird der Risikobegriff in Abgrenzung zum Begriff Gefahr beschrieben. Die Abgrenzung Risiko und Gefahr bedingt ihrerseits diejenige zwischen Entscheider und Betroffenen. Entscheider rechnen sich selbst die Folgen der Entscheidung und somit des Einlassens auf Risiken, d.h. auf Unsicherheiten und mögliche zukünftige Schäden, zu. Betroffenheiten hingegen entstehen, wenn die Folgen des Einlassens auf Unsicherheiten nicht auf das eigene, sondern auf fremdes Entscheiden basieren. Da die Betroffenen an diesem nicht selbst mitgewirkt haben, nehmen sie das mögliche Eintreten von Schäden als Gefahr wahr. Es wird deutlich, dass ein methodischer Zugang zur Bewertung von Risiken immer von Modellannahmen ausgeht. Im Rahmen der Gesundheitsversorgung führt die Beschreibung der physischen, psychischen und sozialen Belastung im Sinne von Risikofaktoren zu einem sehr komplexen Modell. Es stehen nicht einzelne Risikofaktoren mit ihren Konsequenzen im Vordergrund, sondern Risikofaktorenkonstellat ionen, die in ihrem Zusammenwirken als Faktorenbündel Gesundheit bzw. Wohlbefinden beeinträchtigen können. Insbesondere die Berücksichtigung genetischer Informationen wird dabei eine der wichtigsten zukünftigen Herausforderungen sein. Im Hinblick auf PHG lassen sich zwei Ansätze zum Umgang mit genetischer Information im Sinne von Risiken unterscheiden: Erstens die Betrachtung 479u Risiko: Abschätzung, Management, Kommunikation und Bewertung einer „Person at risk“ oder einer „Population at risk“ und zweitens die Bewertung der Risiken und Chancen einer genetischen Intervention bzw. genetischen Technologie. Eine systematische Bewertung sowohl des genetischen Risikos (im Sinne eines modulierenden Faktors in einer Kausalkette) einer Person oder einer Population als auch einer genetischen Intervention bzw. Technologie kann durch die Public Health Trias (IoM 1988), die in Teilen dem sog. Policy Action Cycle entspricht, gewährleistet werden. Sie beinhaltet ein dreistufiges Vorgehen mit den Schritten Assessment (Beschreibung eines Status quo und seine systematische Analyse einschließlich Surveillance, Bedarfsfeststellung, Trendprognose: Welches Problem haben wir? Wie schätzen wir dieses Problem ein? Welche Konsequenzen ergeben sich daraus?), Policy Development (Entwicklung geeigneter Strategien, Handlungsoptionen und Gestaltungsmöglichkeiten: Welche alternativen Lösungswege gibt es unter welchen Zielvorstellungen? Welche Handlungsoptionen stehen zur Verfügung? Wie lässt sich eine gewählte Alternative effektiv und effizient verwirklichen?) und Assurance (Mittel und Wege zur Sicherstellung der Umsetzung der ausgewählten Strategie in Politik und Praxis: Wer macht was einschließlich Management, Implementierung, Evaluation und Information? Welche Institutionen und Akteure sind beteiligt? Welche strukturellen Bedingungen bzw. welche Rahmenbedingungen müssen auf welchen Ebenen sichergestellt werden?). Alle drei Schritte zusammen umfassen wiederum ein systematisches Risikomanagement. Überträgt man die Public Health-Trias auf das genetische Risiko eines Individuums oder einer Population, was dem genannten ersten Ansatz im Umgang mit genetischer Information entspricht, so beinhaltet hier das Risiko-Assessment in erster Linie quantitative Risikoabschätzungen, die insbesondere auf Daten und Erkenntnissen der genetischen Epidemiologie beruhen. Aspekte und Charakteristika dieser Risikoabschätzung sind: n Gefahrenidentifikation (hier kann genetisches Risiko als Risiko, aber auch als Chance sowohl im protektiven Sinne wie etwa bei Infektionskrankheiten, als auch als Ressource wie etwa hinsichtlich einer selbstbestimmten Lebensführung gesehen werden) n Dosis-Wirkungsabschätzung (hier Gen-Gen- und Gen-UmweltInteraktionen) n Expositionsabschätzung (hier insbesondere auch der Bereich der Epigenetik mit der Frage, wie sich starke Umweltreize auf das menschliche Genom auswirken unter sowohl „worst case“ als auch „best case“ Annahmen) t480 Genetik in Public Health Te i l 1 / 2 0 0 7 n Ungewissheitsanalyse (dies beinhaltet nicht nur den Umgang mit Ungewissheiten, sondern oftmals auch missverständliche Interpretation von Ergebnissen als tatsächlich erhöhtes Risiko anstelle einer plausiblen Risikoeinordnung) n genetische Suszeptibilitäten (beispielsweise im Hinblick auf Infektionskrankheiten, Noxen (Toxicogenomics), Nahrungsmittel (Nutrigenomics) oder Arzneimittel (Pharmacogenomics)) n genetische Dispositionen (prädiktive deterministische Risiken und prädiktive probabilistische Risiken) n genetische (monogener) Erbkrankheiten n genetisches Screening (z.B. Neugeborenen-Screening auf der Bevölkerungsebene oder Diabetes-Screening auf der Individualebene) n Populationsgenetik (z.B. Hardy-Weinberg-Gesetze) Es wird deutlich, dass das derzeitige Risiko-Assessment genetischer Risiken eines Individuums oder einer definierten Population zu kurz greift. Da es nahezu ausschließlich eine quantitative Risikoabschätzung beinhaltet, gilt es, zu prüfen, ob diese Dimension zukünftig nicht um eine qualtitative Risikoanalyse ergänzt werden muss, in deren Mittelpunkt Fragen der Exzeptionalität genetischer Information stehen. Denn was unterscheidet einen genetischen Risikofaktor von einem Umweltrisiko? Unterscheiden sich die beiden Risiken überhaupt? Denn einerseits impliziert ein genetisches Risiko im Gegensatz zum Umweltrisiko ein biologisches Schicksal, das das Individuum selbst nicht kontrollieren kann, andererseits kennt man in der Medizin beispielsweise schon immer den „essentiellen Bluthochdruck“, der als ein dauerhaft erhöhter Blutdruck definiert ist, dessen Ursache man jedoch nicht kennt. Entstehen neue Krankheitsentitäten? Wo genau – wenn überhaupt – liegen also die Unterschiede? Zur Beantwortung dieser Frage bedarf es neben der genetischen Epidemiologie weiterer Disziplinen wie etwa der Sozialethik oder der Psychologie. Policy Development im Kontext genetischer individueller oder populationsbezogener Risiken bedeutet auf der Individualebene, Handlungsoptionen nicht primär zur Reduzierung oder gar Vermeidung genetischer Risiken, sondern vielmehr zum Umgang mit genetischen Risiken aufzuzeigen (Beskow et al. 2001). Auf der Individualebene sind hier verschiedenste Hochrisiko- und Niedrigrisikostrategien denkbar. So sind Beispiele für individuelle Hochrisikostrategien die (äußerst kontrovers diskutierte) prophylaktische Organentfernung beim Brustkrebs, der (ebenfalls sehr kontrovers diskutierte) induzierte Abort im Rahmen der Pränataldiagnostik, intrapränatale Operationen bei angeborenen Herzfehlern oder der Verzicht auf Nachkommen bei familiärer Belastung, aber auch der gezielte Einsatz 481u Risiko: Abschätzung, Management, Kommunikation von Pharmaka oder die Vermeidung von Suszeptibilitätsrisiken durch beispielsweise den Verzicht auf bestimmte Nahrungsmittel oder das Vermeiden spezifischer Expositionen und Noxen am Arbeitsplatz. Beispiele für individuelle Niedrigrisikostrategien sind gezielte Verhaltensstrategien bei den multifaktoriell bedingten Volkskrankheiten wie etwa Bewegung bei Übergewicht. Auf der Populationsebene bedeutet Policy Development, sowohl Handlungsoptionen zur Reduzierung und ggf. Vermeidung genetischer Risiken aufzuzeigen (z.B. Folsäuregaben zur Reduktion von Neuralrohrdefekten) als auch die Bevölkerung zum kompetenten Umgang mit genetischen Risiken zu befähigen. Darüber hinaus bedeutet es zudem, die Rahmenbedingungen, d.h. Verhältnisprävention, zum Schutz des Einzelnen sicherzustellen. Als geeignetes Steuerungsinstrument des Policy Development bietet sich sowohl auf der individuellen als auch auf der Bevölkerungsebene die Risikokommunikation an. Hier liegen insbesondere in Deutschland fundierte Erfahrungen aus anderen Bereichen wie dem Umweltbereich vor. Dennoch ist zu prüfen, ob es spezifische Anforderungen an eine Risikokommunikation genetischer Risiken im Hinblick auf Kontrollierbarkeit, Akzeptanz, Präferenzen, „needs“ und „values“ etc. gibt: Wie ist beispielsweise die Akzeptanz und Motivation zu Verhaltensprävention bei Individuen mit genetischen Suszeptibilitäten? Assurance im Kontext genetischer individueller oder populationsbezogener Risiken bedeutet auf der Individualebene, für Hochrisikogruppen den Zugang zum Medizin- und Kliniksetting zu sichern. So muss geprüft werden, ob für diese Gruppe adäquate und ausreichende humangenetische Beratungs- und ärztliche Betreuungsangebote vorhanden sind. Für die Niedrigrisikogruppe muss hingegen untersucht werden, ob sie Zugang zu gezielten Präventionsangeboten sowohl im ambulanten Sektor als auch auf im öffentlichen Gesundheitswesen auf kommunaler Ebene haben. Darüber hinaus ist es Aufgabe der nach Landesrecht zuständigen Stellen und Bundesbehörden wie der Bundeszentrale für gesundheitliche Aufklärung (BZgA) im Rahmen ihrer Zuständigkeit die Gesamtbevölkerung über Chancen und Risiken genetischer Informationen aufzuklären, und somit zu einer Versachlichung der Diskussion beizutragen. Treten genetische Veränderungen überzufällig gehäuft auf wie etwa nach dem Reaktorunfall im Kernkraftwerk Tschernobyl am 26.04.1986 (Sperling et al. 1994), so ist schnelles politisches Handeln vorrangig im Sinne einer Risikoreduzierung oder im Sinne einer Verhältnisprävention (insbesondere bei nicht reduzierbaren Risiken) durch die Sicherstellung struktureller und t482 Genetik in Public Health Te i l 1 / 2 0 0 7 rechtlicher Rahmenbedingungen gefordert. So ist in diesen Fällen zu prüfen, welche Konsequenzen sich hieraus für den Arbeits- oder Versicherungsmarkt ergeben oder worin die Verantwortlichkeiten der öffentlichen Hand liegen. Häufig in der Bevölkerung vorkommende niedrige genetische Risiken hingegen rechtfertigen entweder ein bevöllkerungsbezogenes Screening (Rose 1992; Burke et al. 2001), oder sie erfordern explizit eben keinen Handlungsbedarf. Darüber hinaus deutet sich bereits zum jetzigen Zeitpunkt an, dass probabilistisches Screening sich von der Populations- auf die Individualebene verschiebt und damit von staatlicher Verantwortung auf die Eigenverantwortung des Individuums. Überträgt man die Public Health-Trias nun auf das Risiko genetischer Interventionen bzw. Technologien, was dem genannten zweiten Ansatz im Umgang mit genetischer Information entspricht, so ist hier das RisikoAssessment in erster Linie gleich zu setzen mit Health Technology Assessment (HTA). Die Etablierung von HTA in einem Land kann mittlerweile als Indikator für ein evidenzbasiertes Gesundheitssystem gelten. In den letzten Jahren hat sich das Spektrum an medizinischen Leistungen, Diagnoseverfahren und Behandlungsmöglichkeiten erheblich erweitert. Es hat zunächst eine Ausweitung des Angebots an Arzneimitteln und Medizinprodukten gegeben. Neben Fragen wie dem Nutzen neuer medizinischer Technologien und neuen Indikationen für bereits in der Routineversorgung etablierten Verfahren gewinnen zunehmend Fragestellungen aus dem Bereich der Gendiagnostik, Gentherapie, Organtransplantation und Reproduktionsmedizin an Bedeutung. Hierdurch hat es einen Innovationsschub mit gesellschaftlichen Kontroversen und der Frage, was die ethischen und sozialen Konsequenzen dieser „Errungenschaften“ sind, gegeben. HTA bewertet umfassend in Form einer strukturierten und systematischen Analyse – basierend auf den Konzepten von „Evidence-based Medicine“ und „Evidence-based Healthcare“ – neue und sich anbahnende oder bereits auf dem Markt befindliche Technologien der Gesundheitsversorgung aus verschiedensten Perspektiven, – und zwar hinsichtlich der mit der Technologie verbundenen Chancen und Risiken. Diese umfassen u.a. soziale, ökonomische, rechtliche, ethische und biologische Aspekte der Technologie sowie darüber hinaus auch hemmende und fördernde Faktoren hinsichtlich der Implementation der Technologie (einschließlich nativem Assessment und politischer Realitäten). Dazu gehören aber auch Faktoren wie Präferenzen, Wertvorstellungen, Akzeptanz etc. Es handelt sich bei dieser Methodik somit um eine ganzheitliche und multiprofessionelle Betrachtungsweise. Ziel ist die Bereitstellung entscheidungsrelevanter Informationen auf verschiedenen Ebenen der Steuerung des Gesundheitswesens, d.h. von Informationen, die 483u Risiko: Abschätzung, Management, Kommunikation auf den aktuellen und insbesondere auch politischen Entscheidungsbedarf zugeschnitten sind. In Deutschland entwickelte sich HTA in den letzten Jahren aus der Public Health-Forschung heraus. Sie ist jedoch nicht neu: die Technikfolgenabschätzung, „Medical Technology Assessment“ und schließlich „New Medical Technology Assessment“ sind Vorläufer. Parallel zu HTA entwickelten sich zudem die sozioökonomische Evaluation im Rahmen der Ökonomie und ELSI („Ethical, Legal, Social Implications“) im Rahmen des Humangenom-Projektes. Obwohl sich die Methoden überschneiden, setzen sie dennoch unterschiedliche Akzente in ihren Fragestellungen und Zielsetzungen. HTA als die am weitesten reichende und politiknächste Methode eignet sich als Basis einer Prioritätensetzung im Gesundheitswesen und wird dementsprechend bereits international im „policy making“ eingesetzt. Trotz einiger Schwächen eignet sich HTA – wie es insbesondere aus den Erfahrungen aus Kanada, Andalusien und Österreich deutlich wird – als systematisches Bewertungsinstrument genom-basierten Wissens und genombasierter Technologien, was nicht heißt, dass es hier nicht der Optimierung der Methodik bedarf. Policy Development im Kontext genetischer Interventionen bzw. Technologien berührt die Frage der Marktsteuerung: Gibt es Kriterien und gute Gründe dafür, dass eine entsprechende Technologie “vom Markt genommen“ werden darf und muss? Wenn ja, von welchem Markt? Wenn nein, gibt es alternative Handlungsoptionen bzw. Handlungskorridore hinsichtlich der Anwendung der Technologie wie etwa Akkreditierungsmöglichkeiten, die von den unterschiedlichen Präferenzen möglicher Konsequenzen ausgehen? Assurance im Kontext genetischer Interventionen bzw. Technologien umfasst Maßnahmen des Verbraucherschutzes hinsichtlich Marktzulassung und Versachlichung von Informationen sowie die Sicherstellung alternativer Handlungskorridore („decision-trees“) in Politik und Praxis hinsichtlich des Einsatzes dieser genetischen Technologien. Es ist zu prüfen, ob genetisches Wissen weitere Regulierungen bzw. Sonderregelungen wie etwa ein explizites Gentestgesetz erforderlich macht, oder ob nicht die derzeitigen Strukturen und Rahmenbedingungen wie etwa zum Verbraucherschutz oder Datenschutz ausreichend sind und ggf. lediglich eine (Neu)Zuordnung bzw. Überprüfung von Zuständigkeiten und Verantwortlichkeiten der verschiedensten Akteure und Institutionen des Öffentlichen Gesundheitswesens auf Bundes-, Länder- und kommunaler Ebene erfolgen muss. t484 Genetik in Public Health Te i l 1 / 2 0 0 7 3. Lebensstil und Krankheiten im Fokus von Prävention und Versorgung An Präventionsansätze, die auf genetische Informationen bauen, sind in den letzten Jahren große Erwartungen geknüpft worden. Vielfach wurden Visionen von enthusiastischen Protagonisten des Humangenomforschu ngsprojekts ausgegeben, wie beispielsweise von Francis Collins, der zu Präventionsansätzen sagt: „ A physician will give an 18-year-old patient a physical exam that includes a test of his or her DNA for hundreds of diseases with known genetic components. …The physician will be able to tell the patient whether the risk is high, low, or average for a given condition and to make life-style recommendations based upon known risks. There will be personalized schemes for a new kind of preventive medicine and I think that it will prove very appealing“ (Breo 1993). Ob Empfehlungen zur Änderung des allgemeinen Lebensstils aufgrund von Gentests tatsächlich verfolgt werden, kann man bisher noch nicht sicher sagen. Wenig erfolgreich scheint die individuelle Reduzierung von Tabakkonsum zu gelingen, wenn ein erhöhtes Risiko, an Lungenkrebs zu erkranken, festgestellt wird. Positive Beispiele gibt es allerdings auch, wenn z.B. ein identifiziertes familiäres Risiko an Dickdarmkrebs zu erkranken, zu weiteren Früherkennungsmaßnahmen geführt hat. Verbesserungen der Präventionsmöglichkeiten und Präventionsprogramme erhofft man sich auch bei infektiösen Krankheiten – was in unserer Gesellschaft aber vor allem in Entwicklungsländern ein großes Potenzial darstellt. Beispiele sind hier rekombinante Vakzine und biotechnologische Ansätze für sexuell übertragbare Krankheiten (STDs). Ein weites Spektrum an rekombinanten Vakzinen soll u.a. die Impfung gegen Malaria verbessern, indem sicherere und günstiger herzustellende Impfstoffe entwickelt werden. Im Zusammenhang mit STDs haben Frauen bisher keine Möglichkeiten, sich ohne Einwilligung ihres Geschlechtspartners – sprich durch Nutzung eines Kondoms – vor Geschlechtskrankheiten zu schützen. Dies ist besonders in Entwicklungsländern relevant. Biotechnologische Ansätze für Vakzine, vaginale Mikrobizide und Blocker von viralen Rezeptoren (bspw. CCR5), die die Frau schützen können, werden derzeit entwickelt (Daar 2002). 485u Risiko: Abschätzung, Management, Kommunikation 4. Sicherstellung von präziseren, frühzeitigeren und nebenwirkungsärmeren Präventionsmaßnahmen Entsprechend einer Stratifizierung der Bevölkerung in drei Subpopulationen kristallisieren sich für die multifaktoriell bedingten Erkrankungen individuellere Präventionsstrategien im Sinne von drei Präventionsansätzen heraus (Khoury 1996): 1. „clinical prevention strategy“ (medizinische bzw. primäre, sekundäre und tertiäre Prävention) bei Subpopulationen, bei denen im Hinblick auf die attributiven Risiken bzw. Genetik-Umwelt-Interaktionen der Einfluss der Genetik größer als der Einfluss der Umwelt ist 2. „environmental prevention strategy“ (Verhältnisprävention) und „behavior prevention strategy“ (Verhaltensprävention) bei Subpopulationen, bei denen im Hinblick auf die attributiven Risiken bzw. Genetik-UmweltInteraktionen der Einfluss der Umwelt größer als der Einfluss der Genetik ist 3. Mix sämtlicher Präventionsstrategien (medizinische, Verhaltens- und Verhältnisprävention) bei Subpopulationen, bei denen im Hinblick auf die attributiven Risiken bzw. Genetik-Umwelt-Interaktionen der Einfluss der Umwelt annährend gleich groß wie der Einfluss der Genetik ist. Mit großer Wahrscheinlichkeit werden Menschen und Menschengruppen demnächst durch die Anwendung von Chip-Technologien Prognosewerte über Krankheitsanfälligkeiten bzw. Suszeptibilitäten erhalten (Baird 2000). Technisch ist dies machbar, und im Internet sind bereits derartige Angebote weitestgehend unkontrolliert für Endanwender verfügbar. Eine wissenschaftlich fundierte Annäherung an das Thema erfordert jedoch, abseits von einem sich gegenwärtig abzeichnenden „Marktmodell“, zunächst Suszeptibilitäten auf der Basis genetischer Varianz systematisch zu validieren und für epidemiologische Studien nutzbar zu machen. Hierzu können nationale oder zumindest regionale Biobanken das geeignete Instrumentarium sein. Sensible Daten und Proben können zum Zwecke von Gesundheitssystem- und Versorgungsforschung in unterschiedlichsten Anonymisierungs- und Pseudonymisierungsgraden, in aggregierter Form oder unter Anwendung von Treuhändermodellen gespeichert werden, so dass Rückschlüsse auf individuelle Gesundheitsrisiken nicht oder nur in ausdrücklich vom Individuum erwünschter und durch informierte Einwilligung dokumentierter Weise erfolgen können. Hierzu liegen in Deutschland bereits Erfahrungen aus den Krebsregistern der Länder sowie aus den Datenschutzmodellen der vom BMBF geförderten Telematikplattform für t486 Genetik in Public Health Te i l 1 / 2 0 0 7 Medizinische Forschungsnetze (TMF) vor. Wenn es gelingt, spezifische Risikogruppen in größeren Populationen auf der Basis gesicherter genetischepidemiologischer Daten zuverlässig zu identifizieren und zu stratifizieren, können Präventionsempfehlungen an betroffene Individuen und Bevölkeru ngssubpopulationen aus den ermittelten, gespeicherten und ausgewerteten Daten resultieren. Will man die derzeitig durchgeführten Präventionsmaßnahmen im Öffentlichen Gesundheitswesen in Deutschland im Hinblick auf die Integration genom-basierten Wissens analysieren, so muss man zunächst die verschiedenen Aufgaben und Kompetenzen von Bundes-, Länder- und kommunaler Ebene berücksichtigen. Auf der Bundesebene werden entsprechende Gesetze vorbereitet (s. z.B. Diskussionsentwurf des Gendiagnostikgesetzes) und dann in das Parlament eingebracht. Die Ausführung der Gesetze und Verordnungen des Bundes sowie die Verabschiedung eigener Gesetze erfolgen auf Länderebene. Und auf der kommunalen Ebene sind es insbesondere die Gesundheitsämter und freien Träger, die öffentlich-rechtliches Handeln in den Feldern Gesundheitsschutz bzw. Gesundheitsförderung und Prävention repräsentieren. So muss es auf der Bundesebene vor allem darum gehen, Infrastrukturen aufzubauen, um Erkenntnisse der Prävention für das Gemeinwohl nutzbar zu machen. Ein Beispiel hierfür ist die bereits erfolgte Implementierung und Anwendung der Methode Health Technology Assessment. Ein weiteres Beispiel ist das Sicherstellen von Rahmenbedingungen für bundesweite Maßnahmen (z.B. im Arzneimittelbereich oder im Bereich des Infektionsschutzes). Auf der Länderebene ist beispielsweise der Aufbau von flächendeckenden und bevölkerungsbezogenen Dokumentationen im Sinne von „Krankheitsregistern“ (wie z.B. Fehlbildungsregistern, Krebsregistern) ein geeignetes Instrumentarium, um das Ausmaß und die Sinnhaftigkeit von Interventionen wie etwa Präventionsmaßnahmen zu prüfen und dabei auch regionale Besonderheiten und Differenzen aufzudecken. Auf der kommunalen Ebene geht es vorrangig um Aufklärung und Edukation. So muss Prävention vermehrt öffentlich thematisiert und diskutiert werden. Das bedeutet für das Öffentliche Gesundheitswesen zunächst, dass es die Bevölkerung adäquat informieren muss. Doch die Diskussion in diesem Bereich darf nicht auf der Expertenebene stehen bleiben, sondern sie muss als gesamtgesellschaftlicher Diskurs in die Bevölkerung hinein getragen werden und sie mit einbeziehen. Dieses entspricht auch dem sozialethischen 487u Risiko: Abschätzung, Management, Kommunikation Kriterium der Befähigungsgerechtigkeit (Dabrock 2006) oder gesundheitspolitischen Ansätzen wie Bürgerorientierung, Gesundheitsmündigkeit („Health Literacy“) und „Empowernment“ der Bürger (Schröder 2004). 5. Schlussfolgerung Wollen Gesundheitsforschung und Public Health weiterhin durch effektives und verantwortliches Handeln glaubhaft sein, so sind sie gut beraten, schon zum jetzigen Zeitpunkt genom-basiertes Wissen in sämtliche bisherige Ansätze, Fragestellungen und Aufgaben systematisch zu integrieren (Bosch 2006; Brand et al. 2006; Brand 205; IoM 2005; Burke et al. 2006). t488 Genetik in Public Health Te i l 1 / 2 0 0 7 Literatur Baird PA (2000): Identification of genetic susceptibility to common diseases: the case for regulation. Perspectives Biol Med 45:516-528 Bellagio Statement (2005): Genome-based Research and Population Health. Report of an expert workshop held at the Rockefeller Foundation Study and Conference Center, Bellagio, Italy, 14-20 April 2005 Beskow LM, Khoury MJ, Baker TG, Thrasher JF (2001): The Integration of Genomics into Public Health Research, Policy and Practice in the United States. Community Genet 4: 2-11 Bosch X (2006): Group Ponders Genomics and Public Health. JAMA 295:1762 Brand A (1999): Screening auf genetische Erkrankungen: Pro und Contra. In: Schwinger E, Dudenhausen JW (Hrsg.) Nichtdirektive humangenetische Beratung: Molekulare Medizin und genetische Beratung. Die Medizinische Verlagsgesellschaft Umwelt & Medizin mbH, Frankfurt/M.: 36-47 Brand A (2005): Public health and genetics – a dangerous combination? View-point section. European J of Public Health 15:113-116 Brand A, Dabrock P, Paul N, Schröder P (2004): Gesundheitssicherung im Zeitalter der Genomforschung – Diskussion, Aktivitäten und Institutionalisierung von Public Health Genetics in Deutschland. Gutachtenreihe Bio- und Gentechnologie, Friedrich-Ebert-Stiftung: 362 Brand A, Schröder P, Brand H, Zimmern R (2006): Getting Ready for the Future: Integration of Genomics into Public Health Research, Policy and Practice in Europe and Globally. Community Genet 9: 67-71 Breo DL (1993): Altered Fates – Counseling Families with Inherited Breast Cancer. JAMA 269: 2017-2022 Burke W, Coughlin SS, Lee NC, Weed DL, Khoury MJ (2001): Application of Population Screening Principles to Genetic Screening for Adult-Onset Conditions. Genetic Testing 5(3):201-211 489u Risiko: Abschätzung, Management, Kommunikation Burke W, Khoury M, Stewart A, Zimmern R for the Bellagio Group (2006): The path from genome-based research to population health: Development of an international public health genomics network. Genetics in Medicine 8:451-458 Daar AS (2002): Top 10 biotechnologies for improving health in developing countries. Nature Genetics 32: 229-232 Dabrock P (2006): Public Health Genetics and Social Justice. Community Genet 9: 34-39 Ellsworth DL, O’Donnell CJ (2004): Emerging Genomic Technologies and Analytic Methods for Population- and Clinic-Based Research. In: Khoury MJ, Little J, Burke W (Eds.) Human Genome Epidemiology. A Scientific Foundation for Using Genetic Information to Improve Health and Prevent Disease. Oxford University Press, Oxford New York Tokyo: 17-37 Hebebrand J, Dabrock P, Lingenfelder M, Mand E, Rief W, Voit W (2004): Ist Adipositas eine Krankheit? - Interdisziplinäre Perspektiven. Deutsches Ärzteblatt 101:A2468-2474 Holtzman NA, Marteau TM (2000) Will Genetics Revolutionize Medicine? NEJM 343:141-144 IoM (Institute of Medicine) (1988): The Future of Public Health. Division of Health Care Services. Committee for the Study of the Future of Public Health. National Academy Press, Washington D.C.: 7-8 IoM (Institute of Medicine): 2005 Implications of Genomics for Public Health. Workshop Summary. National Academies Press, Washington D.C.:1-67 Jung T (2003): Der Risikobegriff in Wissenschaft und Gesellschaft. Bundesgesundheitsblatt 46: 542-548 Khoury MJ (1996): From Genes to Public Health: The Applications of Genetic Technology in Disease Prevention. Am J Public Health 86:17171722 t490 Genetik in Public Health Te i l 1 / 2 0 0 7 Khoury MJ, Burke W, Thomson E (2000): Genetics in Public Health: A Framework for the Ingegration of Human Genetics into Public Health Practice. In: Khoury MJ, Burke W, Thomson EJ (Eds.) Genetics and Public Health in the 21st Century. Using Genetic Information to Improve Health and Prevent Disease. Oxford University Press, Oxford New York Tokyo: 3-23 Little J (2004): Reporting and Review of the Human Genome Epidemiology Studies. In: Khoury MJ, Little J, Burke W (Eds.) Human Genome Epidemiology. A Scientific Foundation for Using Genetic Information to Improve Health and Prevent Disease. Oxford University Press, Oxford New York Tokyo: 168-192 Murray T (1997): Genetic Exceptionalism and ‚Future Diaries’: Is Genetic Information Different from Other Medical Information? In: Rothstein M (Ed.) Genetic Secrets: Protecting Privacy and Confidentiality in the Genetic Era. Yale University Press, New Haven: 60-73 Peltonen L, McKusick VA (2001): Genomics and Medicine: Dissecting Human Disease in the Postgenomic Era. Science 291: 1224-1229 Rose G (1992): The Strategy of Preventive Medicine. Oxford University Press, Oxford New York Tokyo: 73-75 Schröder P (2004): Gendiagnostische Gerechtigkeit. Eine ethische Studie über die Herausforderungen postnataler genetischer Prädiktion. LIT Verlag, Münster Hamburg London: 1-437 Sperling K, Pelz J, Wegner RD, Dörries A, Grüters A, Mikkelsen M (1994): Significant increase in trisomy 21 in Berlin nine months after the Chernobyl reactor accident: temporal correlation or causal relation. BMJ 309:158-162 491u t492 IV. Ethik und Policy Genetik in Public Health Te i l 2 / 2 0 0 7 Genetik, Gesundheit und Gesellschaft: Anmerkungen zu Geschichte, Theorie und Ethik einer schwierigen Beziehung Norbert W. Paul 493u t494 Genetik in Public Health Te i l 2 / 2 0 0 7 Inhalt IV. Ethik und Policy Genetik, Gesundheit und Gesellschaft: Anmerkungen zu Geschichte, Theorie und Ethik einer schwierigen Beziehung Prolog . ............................................................................ 496 1. Die Invasion der "Omics": Über den schwierigen Weg von der genetischen Grundlagenforschung zur Molekularen Medizin...................................................... 498 2 Genetisches Risiko, Prognose, Prävention........................... 502 3. Ethische Aspekte der Prädiktion und Prävention in der Molekularen Medizin . .............................................. 505 Literatur.............................................................................. 508 495u Genetik, Gesundheit und Gesellschaft Prolog Der Wandel der Medizin hin zu einer „Molekularen Medizin“ wirkt sich bereits heute – vor seinem eigentlichen Vollzug – grundlegend auf unser Verständnis von Gesundheit und Krankheit aus. Konkrete Folgen dieser seit längerem in der breiten Öffentlichkeit diskutierten Trans­formation der Medizin sollen im folgenden ausgehend von historisch gewachsenen, kontingenten Kontexten sowie auf der Basis konzeptueller Grundlagen der Molekularen Medizin thematisiert werden. Dies geschieht, um die Chancen und Risiken von Entwicklungen im Schnittfeld von Genetik, Gesundheit und Gesellschaft einer rationalen Einschätzung zuzuführen. Es ist offenkundig, dass ein zentrales Thema dieses Beitrages die prädiktive Diagnostik sein muss. Insbesondere das Verhältnis von Prädiktion auf der Basis genetischer Varianz oder Prädisposition zur Verhältnis- oder Verhaltensprävention ist dabei von Interesse. Wieso ist dies so? Prädiktive genetische Diagnostik ist sowohl in der wissenschaftlichen als auch in der öffentlichen Wahrnehmung ein Bereich, der zur Entwicklung völlig neuer Strategien des Umgangs mit Gesundheit und Krankheit führen kann. Auch wenn sich bereits seit einigen Jahren klar abzeichnet, dass einfache Korrelationen von Phänotypen mit Genotypen nicht haltbar sind, können erweiterte Verfahren der Molekularen Diagnostik heute bereits detaillierte Auskunft über individuelle Gesundheitsrisiken und Prädispositionen geben. Die immer weiter reichenden Möglichkeiten prädiktiver Diagnostik werfen dabei zwangsläufig die Frage nach neuen, molekularen Optionen der Intervention und Prävention auf. Dies gilt sowohl für den individuellen klinischen Fall wie auch für den Bereich der öffentlichen Gesundheits­ vorsorge. Im folgenden werden daher ausgehend von einer systematischen Beschreibung des aktuellen Wandels der Medizin prädiktive und präventive Optionen analysiert. Ihre möglichen Konsequenzen für unser Verständnis von, sowie unseren Umgang mit, Krankheit und Gesundheit werden dabei kritisch hinterfragt. Dem entsprechend wird in drei aufeinander bezogenen Schritten vorgegangen. Zunächst wird der gegenwärtige Stand der Wissenschaft vor dem Hintergrund klinischer Umsetzbarkeit (Applicability) skizziert (Paul, Fangerau et al. 2004; ten Have 1995). Im hier vorgestellten Beitrag kann dies nur steckbriefartig und unter Vernachlässigung von Differenzierungen erfolgen, die für eine eingehende Analyse wünschenswert und notwendig wären. Dies gilt insbesondere für die historische Dimension des Themas. Molekulare Medizin ist keineswegs voraussetzungslos und ihre wissenschaftlichen Wurzeln reichen bis zum Anfang des 20. Jahrhunderts zurück t496 Genetik in Public Health Te i l 2 / 2 0 0 7 – etwa zu den Arbeiten über Zelldifferenzierung und Reproduktion zwischen 1890 und 1920 von Jacques Loeb und Alexis Carrel (Paul, Fangerau et al. 2004; Pauly 1987; Pauly 2000; Turney 1995). Die Anwendung genetischer Modelle auf Fragestellungen der individuellen und öffentlichen Gesundheit hat ebenfalls höchst wechselhafte, teils extreme historische Phasen durchlaufen und schwingt – teils implizit teils explizit – in den in der Gegenwart im Zusammenhang mit Verfahren der Molekularen Medizin geführten Wertdebatten mit (Bittner 1936; Boveri 1914; Rous 1911). Schließlich ist das Konzept der Molekularen Medizin ganz wesentlich aus einer Emanzipationsbewegung von Konzepten einer so genannten „ReformEugenik“ in den 1950er und 1960er Jahren entstanden (Lederberg 1961; Lederberg 1962). Auf die andernorts erfolgte (Paul 2003), notwendige Rekonstruktion des historisch kontingenten Handlungsraumes, in den die gegenwärtige Auseinandersetzung mit Möglichkeiten und Gefahren der Molekularen Medizin unauflöslich eingebunden ist, wird im folgenden also lediglich verwiesen, ohne näher darauf einzugehen. Der zweite Teil des Textes befasst sich mit dem Konzept des genetischen Risikos vor dem Hintergrund von Prädiktion und Prävention. Vor allem die Frage, auf welche Weise der genetische Risikobegriff unsere Wahrnehmung von Gesundheit und Krankheit verändert, und wie sich dies auf Menschen im Umfeld medizinischen Entscheidens und Handelns auswirkt, wird hier näher untersucht. Auch hier kann auf historische Vorbedingungen, theoretische Konzepte und Vorannahmen sowie normativ-ethischer Reflexionen, die das Thema entscheidend beeinflussen, nur implizit oder aber gar nicht eingegangen werden. Vor allem die Diskussion des historisch gewachsenen Handlungs- und Problemraumes einer neuen „Public Health Genetics“ (Khoury 1999; Khoury, Burke et al. 2000) als Antwort auf zumindest einige Herausforderungen im Bereich öffentlicher Gesundheitssicherung wird aufgrund des Übersichtscharakters dieses Textes nicht so ausführlich erfolgen, wie es angesichts der gesellschaftlichen und normativen Tragweite des Themas wünschenswert wäre. Im dritten und abschließenden Teil dieses Beitrags erfolgt die Diskussion ausgewählter normativer Fragestellungen, wie sie sich zwangsläufig im Schnittbereich von genetischer Prädiktion, Prävention und Gesellschaft ergeben. Auch hier wird das Bild eher in groben Pinselstrichen gezeichnet und so versteht sich der Abschnitt vor allem als Anstoß zur weiteren Diskussion – speziell mit dem Ziel der Überwindung gängiger Vorurteile und Missverständnisse in der jüngeren Diskussion ethischer Fragestellungen in Zusammenhang mit der Anwendung molekulargenetischer Verfahren im Bereich der öffentlichen Gesundheit. Dies gilt unter anderem für die 497u Genetik, Gesundheit und Gesellschaft unsäglichen Folgen, die die Feuilletonisierung von an sich wichtigen sozialethischen Fragestellungen für eine rationale normative Debatte gezeitigt hat – unter anderem abzulesen an der geräuschvoll im Blätterwald geführten, so genannten „Sloterdijk-Debatte“ im Anschluss an die Elmauer Rede von P. Sloterdijk. Siehe aber auch die kritische Würdigung der häufig anzutreffenden „Anti-Haltung“ bei (Labisch 2002; Paul 2003; Paul & Labisch 2002). 1. Die Invasion der "Omics": Über den schwierigen Weg von der genetischen Grundlagenforschung zur Molekularen Medizin Die molekularbiologische Grundlagenforschung und die sich aus ihr ergebenden Ansätze für neue diagnostische und therapeutische Optionen befinden sich in unablässiger Differenzierung. In ihrem kleinen Buch „Logische Propädeutik oder Vorschule des vernünftigen Re­dens“ weisen die Philosophen Wilhelm Kamlah und Paul Lorenzen darauf hin, dass Er­kenntnis proportional von der Klarheit der Begriffe abhängig ist. Ins­be­ son­dere bei den großen Themen und Streitfragen, die im Zusammenhang mit der häufig so be­zeichneten „molekulargenetischen Revolution der Medizin“ disku­tiert werden, herrscht momentan in Wissenschaft und Öffentlich­keit eine Sprache vor, in der semantische Sorgfalt seltener an­zu­treffen ist, als se­man­tische Schlamperei. Daher soll im folgenden kurz die Frage ge­klärt werden, wo­von hier die Rede ist. Was ist Molekulare Medizin (Paul 2001; Paul 2001; Paul 2002; Paul 2003; Paul 2003; Paul & Ganten 2003)? Es besteht im großen und ganzen Einigkeit darüber, dass Erkenntnisse und Ver­fahren der Molekulargenetik den wesentlichen Anstoß zum gegenwärtigen Wandel der Medizin geben. Das Schlagwort, das in diesem Zusammenhang immer wie­der auftaucht, heißt genotyporientierte Medizin im Gegensatz zu einer am Phänotyp orientieren Medizin (Ganten & Ruckpaul 2002). Was also ist Genomik, welche Rahmen­be­dingungen für die Molekulare Medizin, und hier insbesondere für die molekulare Prä­­diktion und Prävention, werden durch sie geschaffen? Wir wissen, dass das ultimative Ziel des internationalen Human Genome Project (HGP) die Identifikation und Charakterisierung der kompletten Sequenz des men­sch­lichen Erbgutes, des so genannten Genoms war. Seit etwa zwei Jahren wissen wir zu­dem, dass sich aus den ca. 3 × 109 Basenpaaren (bp) ca. 35.000 Gene heraus­kristalli­sieren, die essentielle genetische Ausstattung des menschliche Genoms und damit un­serer biologischen t498 Genetik in Public Health Te i l 2 / 2 0 0 7 Verfasstheit sind (Aparicio 2000; Ewing & Green 2000). Diese Gene zu identifizieren war – wie ge­sagt – Ergebnis eines mit großem personellen, finanziellen und technologischem Auf­­wand durchgeführten Projekts. Mit den vorläufigen Ergebnissen des Human Genome Project verfügen wir jedoch über nicht mehr – und nicht weniger – als eine erste sequentielle, genetische und physische Karte eines menschlichen „Durchschnitts-“ oder „Modell-Genoms“, das sich aus einer Vielzahl von analysierten und statistisch miteinander in Beziehung gesetzten, in­di­viduellen Genomabschnitten zusammensetzt. Wir alle kennen aus Fach- und Tages­presse die Nachrichten über die im Zuge des Projekts rapide gestiegene Zahl der genetischen Entdeckungen. Im Jahre 1990 waren 1772 menschliche Gene identi­fiziert und spezifischen Chromosomen oder Regionen auf dem Genom zugeordnet. Im September 1996 betrug diese Zahl bereits 3868 Gene. Bereits im Juni 1996 waren 62 menschliche Gene in Beziehung zur menschlichen Erkrankungen gesetzt, durch neue rekombinante Technologien isoliert und in weiten Teilen als Klone oder DNA-Sequenzen der Wissenschaft allgemein zugänglich gemacht worden (Emilien, Ponchon et al. 2000). Heute wächst diese Zahl täglich. All diese Resultate sind letztlich darauf zurückzuführen, dass etwa 1976, als die ersten menschlichen Gene kloniert wurden (Shine, Seeburg et al. 1977), molekulargenetische Verfahren zunächst die Humangenetik und dann die gesamte biomedizinische Forschungslandschaft grundlegend veränderten (Lenoir 1999; Lenoir & Hays 2000). Transgene Methoden begannen etwa 10 Jahre später, um 1986, zum Standard zu werden. Seit Mitte der 1990er Jahre hat sich als weitere, inzwischen zum Standardrepertoire der Genomforschung gehörende technologische Plattform die Genomik in silico, also die auf Informationstechnologien basierte, bio-informatische Forschung mit extensivem „data-mining“ entwickelt (Bassett, Boguski et al. 1997; Bassett, Eisen et al. 1999; Raem, Braun et al. 2000). Im großen und ganzen sind es dabei zwei Ansätze der Genomik – die strukturelle und die funktionale Genomik – zu unterscheiden. Als initiale Phase der Analyse kann die strukturelle Genomik verstanden werden. Ihr Endpunkt ist – wie bereits erwähnt – die Konstruktion hochauflösender sequentieller, genetischer und physischer Genkarten. Nach der ersten Stufe des Human Genome Project konzentriert sich dieser Ansatz gegenwärtig vermehrt auf einzelne Genotypen, also auf die genetische Ausstattung von Individuen und ihre Varianz bzw. genetischen Polymorphismen (SNPs) (McKusick 1997). Es muss deutlich hervorgehoben werden, dass sich das Projekt damit immer noch im Bereich des Datensammelns bewegt. Biologisch-medizinische 499u Genetik, Gesundheit und Gesellschaft Erklärungsmodelle oder gar klinische relevante Theorien können allenfalls Nebenprodukte dieses Ansatzes sein. Neben der strukturellen Genom-Analyse existiert die funktionale Genomik. Sie stützt sich auf eine große Bibliothek sogenannter “teilsequenzierter cDNA-Klone“. Durch eine Kombination der Daten aus dem Human Genome Project mit den Informationen aus Klon-Bibliotheken kann systematisch nach Genen gesucht werden, die interessante Funktionen aufweisen. Daher stammt der Begriff der „funktionalen Genomik“. Klonierte Gene und ihre korrespondierenden DNA-Sequenzen stellen den Werkzeugkasten für eine umfassende Charakterisierung von Mustern der Genexpression im gesamten genetischen Inventar des Menschen zur Verfügung. Darüber hinaus lassen sie die systematische Erforschung der funktionalen Eigenschaften von Genprodukten – also Proteinen – zu. Funktionale Genomik ruht damit zwar auf der Basis der strukturellen Genomik, läutet aber zugleich eine neue Phase des Human Genome Project ein, in der der Übergang vom know-that zum know-how stattfinden soll. Bereits heute scheint klar, dass auch die funktionale Genomik in ihrer Reichweite für klinische Fragestellung beschränkt ist. Der Umstand, dass die meisten Krankheiten keinem einfachen Muster der Vererbung folgen, gepaart mit der Erkenntnis, dass die funktionale genetische Ausstattung von ca. 35.000 Genen bei weitem nicht die Zahl und Funktion der im menschlichen Organismus angetroffenen Proteine erklären kann, stellen eine bedeutende Herausforderung an genetische Erklärungsmodelle von Krankheit und genetischer Prädisposition dar. Der Schlüssel zur Molekularen Medizin scheint im Reich der Proteine verborgen, in das wir gerade mit ersten zaghaften Schritten eines neuen Ansatzes, der Proteomik (Jollès & Jörnvall 2000; Peltonen & McKusick 2001; Pennington & Dunn 2001), aufbrechen. Die Funktionen und das Zusammenspiel derjenigen Gene zu erklären, die biologische Abläufe im menschlichen Organismus steuern ist das Projekt der Proteomik; eine Projekt, das sich als weitaus ehrgeiziger und schwieriger darstellen dürfte als bisherige Ansätze, das es aber zu bewältigen gilt, soll der Übergang zur Molekularen Medizin gelingen. Gegenwärtig befinden wir uns daher in einer Phase, in der – wie in der Geschichte der Medizin schon häufiger beobachtet – ein neues wissenschaftlich‑technologisches Konzept im Bereich klinischer Anwendung noch weitgehend konsequenzlos geblieben ist. Da jedoch die wissenschaftlichen und technologischen Rahmenbedingungen der Molekularen Medizin bereits jetzt bekannt sind, ist die Debatte über gesellschaftliche Konzequenzen der Entwicklung in vollem Gange. Dies eröffnet uns die Chance, über die t500 Genetik in Public Health Te i l 2 / 2 0 0 7 angestrebten Ziele, die Chance und Risiken neuer Konzepte und Verfahren intensiv nachzudenken. Was bedeutet das Wissen der strukturellen und funktionalen Genomik also im Hinblick auf molekulare Prädiktion und Prävention? Die Prädiktion individueller Gesundheitsrisiken und sich daraus ableitende Prävention und Intervention haben gegenwärtig bereits tief reichende Auswirkungen auf die medizinische Praxis und auf das Befinden Betroffener Einzelner, auch wenn die Molekulare Medizin als solche noch nicht vollständig umgesetzt ist. Chancen und Risiken molekularer Prädiktion – etwa im Bereich der Risikodiagnistik des weiblichen Brustkrebs oder aber der Suszeptilbilitätstestung für die Wahrscheinlichket einer später manifest werdenden Alzheimer’schen Erkrankung – werden entsprechend auf breiter Basis in Medizin, Ethik und Gesellschaft diskutiert. Ein anderes Thema findet hingegen kaum Beachtung: Die Auswirkung innovativer Ansätze der Molekularen Medizin zur Prädiktion und Prävention im Bereich öffentlicher – also populationsbezogener – Gesundheitsrisiken. Dies liegt sicherlich zu einem guten Teil an historisch gewachsenen Rahmenbedingungen. In unserem Land besteht vor dem Hintergrund der NSMedizin eine berechtigte Scheu, Fragen der öffentlichen Gesundheitssicherung mit Fragen der Genetik zu verknüpfen – sei es auch nur im Rahmen von Debatten um die Zukunft der Medizin. Dabei scheint es angesichts der demographischen und epidemiologischen Entwicklung un­aus­weichlich, sich mit den Themen „Molekulare Prädiktion“ und „Molekulare Prävention“ auch im Hinblick auf Fragen der öffentlichen Gesundheit zu befassen. In einer zunehmend alternden Gesellschaft mit einem raschen Anwachsen chronischdegenerativer Erkrankungen ist absehbar, wann Versorgungsleistungen im Sinne einer kurativen Medizin von präventiven Leistungen zumindest flankiert werden müssen, um bei wachsendem Kostendruck ein Mindestmaß an Verteilungs- und Ermöglichungsgerechtigkeit im Gesundheitssystem wahren zu können. Die Tendenz, dabei im Sinne der Ermöglichungsgerechtigkeit dem Individuum mehr Eigenverantwortung für die eigene Gesundheit abzuverlangen, weist zudem auf ein weiteres, wenig beachtetes Phänomen hin: Die Trennung zwischen individueller und öffentlicher Gesundheitsfürsorge wird angesichts der Gesamtsituation des Versorgungssystems (Labisch & Paul 1998) immer unschärfer (Khoury, Burke et al. 2000). Ein Beispiel soll im folgenden dazu dienen, das Problemfeld zu umreißen. Es handelt von der Bestimmung genetischer Prädispositionen für den weiblichen Brustkrebs und von Optionen der Brustkrebsprävention (Croyle, Achilles et al. 1997). 501u Genetik, Gesundheit und Gesellschaft 2. Genetisches Risiko, Prognose, Prävention In gegenwärtigen Kontroversen wird unter prädiktiver Diagnostik vor allem die auf ein Individuum bezogene Ermittlung genetisch bedingter Krankheitsrisiken verstanden. Gerade diese oft missverständlich als Individualisierung der Medizin bezeichnete Analyse frequenter Wahrscheinlichkeiten mit Aussicht auf die Vorhersage der persönlichen Gesundheitsrisiken eines einzelnen Patienten sowie auf eine nachfolgend maßgeschneiderte Strategie der Prävention und – falls nötig – auch Intervention, wird als Vorteil der zukünftigen Molekularen Medizin gesehen (Collins 1997; Collins 1998; Collins 1999). Die genetische ‚Risikodiagnostik’ ist jedoch in den letzten Jahren zum Brennpunkt einer emotional geführten Auseinandersetzung zwischen Wissenschaftlern, Medizinern, Patienten­ vertretern und der Industrie geworden (Poe 1999; White 1999). Dies liegt vor allem an einem zweiten Missverständnis, das sich in der Deutung des Risikobegriff ergibt. Das allgemeine Konzept „Risiko“ hat in der Medizin und insbesondere im öffentlichen Gesundheitswesen eine zentrale Funktion und bezieht sich auf die statistische Wahrscheinlichkeit, mit der innerhalb einer Population ein unerwünschtes Ereignis – also etwa eine bestimmte Erkrankung – auftritt. Es fällt hier nicht schwer, den probabilistischen Charakter des Risikonkonzepts zu sehen. Das Konzept des genetischen Risikos ist hingegen weder in seiner Bedeutung für den individuellen Patienten, noch in seiner Bedeutung für Fragen der öffentlichen Gesundheit hinreichend geklärt. Auch Aussagen über genetische Risiken sind in der heutigen Form probabilistisch. Häufig wird genetisches Risiko jedoch als technische, quantitative, kalkulierbare Größe zur Angabe eines individuellen, relativen Risikos behandelt (Koenig, Greely et al. 1998; Koenig & Silverberg 1999). In diesem Sinne wurde eine statistische Beziehung zwischen Mutationen in zwei Genen, die BRCA1 und BRCA2 genannt werden, und weiblichem Brustkrebs hergestellt. Die meisten der 8% bis 10% Brustkrebserkrankungen, die als erblich gelten, werden auf Mutationen in diesen zwei Genen zurückgeführt. Ein kommerzieller Test für BRCA1/2-Veränderungen steht routinemäßig zur Verfügung und wird in den USA auf breiter Ebene angewendet. Die genetische Diagnostik dieser Disposition (also des genetischen Risikos an Brustkrebs zu erkranken) wurde so zu einem der am weitesten verbreiteten Tests für eine Erkrankung, die im Erwachsenenalter manifest wird (Croyle, Achilles et al. 1997). Gleichzeitig fand die Umdefinition eines Krankheitsbildes statt, das noch nicht allzu lange als molekulargenetisch bedingt gilt (Paul 2000). Es wird heute angenommen, dass eine Mutation in den Genen BRCA1 oder BRCA2 dazu führt, dass das Risiko einer Frau innerhalb ihrer Lebensspanne t502 Genetik in Public Health Te i l 2 / 2 0 0 7 an Brustkrebs zu erkranken um 70% bis 85% (je nach Literatur) erhöht ist. Darüber hinaus besteht insbesondere bei Mutationen des BRCA1-Gens auch ein erhöhtes statistisches Risiko an Ovarial-Karzinomen zu erkranken. Unglücklicher Weise kann eine genetisch untersuchte Frau, die statistisch in die Gruppe von Personen mit erhöhtem Erkrankungsrisiko fällt, wenig dafür tun, den Ausbruch des Krebs zu verhindern oder ihm vorzubeugen – dramatische Eingriffe wie eine präventive chirurgische Entfernung der Brust einmal ausgenommen. Selbst die US-amerikanische Euphorie bezüglich des Präparates Tamoxifen, das nur in ganz speziellen Fällen als präventive Chemotherapie geeignet scheint und erhebliche Nebenwirkungen haben kann, ist mittlerweile wieder abgeebbt (Jordan 1994; Jordan 1999; Kuschel, Lux et al. 2000; Poe 1999; White 1999). Gegenwärtig stellen die regelmäßige Selbstuntersuchung sowie die Mammographie die einzigen routinemäßig zur Verfügung stehenden Methoden zur Früherkennung bestehender Brustkrebserkrankungen dar. Dabei ist der Übergang zu konventionellen, life-style bezogenen Strategien der Krankheitsprävention im Rahmen von Public Health geradezu zwangsläufig durch das Fehlen kausaler „molekularer“ Behandlungsoptionen vorbestimmt. Die Verfügbarkeit molekulargenetischer Erklärungen hat also de facto nichts an der Beherrschbarkeit des Risikos geändert. Daraus folgt eine erste These: Die Verfügbarkeit von molekulargenetischen Erklärungen und genetischen Tests sagt noch nichts über deren präventiven Nutzen für den Patienten aus. Der Nutzen der Prädiktion kann sogar durch das Fehlen entsprechender individueller Prävention in Frage gestellt werden. Hier besteht eine wesentliche Aufgabe von Public Health, auf öffentliche Gesundheit ausgerichtete und für spezifische Risikogruppen angepasste Alternativen der Verhaltens- und Verhältnisprävention zu entwickeln. Es ist nicht von der Hand zu weisen, dass der genetische Risikobegriff bereits jetzt zu Veränderungen in der Wahrnehmung von Krankheit und Körperlichkeit geführt hat. Oft wird dabei übersehen, dass sich Krankheitsrisiken aus vielerlei Quellen speisen. So gibt es äußere, externe Risiken – etwa Umweltrisiken durch das Vorhandensein chemischer oder toxischer Stoffe – auf deren Vorhandensein das Individuum nur wenig oder auch gar keinen Einfluss nehmen kann. Andere Risiken ergeben sich auf einer Ebene, über die das Individuum bis zu einem gewissen Grade Kontrolle ausübt. Beispiele für solche Lifestyle-bezogenen Risiken wären etwa Fehlernährung und mangelnde körperliche Betätigung. Genetische Risiken bilden nun neben den äußeren Risiken und den Lifestyle-bezogenen Risiken eine neue Gruppe, die „embodied risks“ oder im Individuum verkörperte Risiken genannt werden (Kavanagh & Broom 1998; Kavanagh 1999). 503u Genetik, Gesundheit und Gesellschaft Bezogen auf Brustkrebserkrankungen muss gefragt werden, wie Frauen ein Risiko verstehen und behandeln, das dem Augenschein nach buchstäblich in ihnen, in ihren Genen liegt, das sich ihrer Kontrolle entzieht und das sie möglicherweise bereits an nachfolgende Generationen weitergegeben haben? Prädiktive Tests sind damit niemals einfach eine Frage des Wissenszuwachses und verbesserter Kontrolle über Krankheiten. Sie führen vielmehr zur langfristigen Lebensänderung betroffener Individuen. Fast immer bringt dies einen Verlust an Autonomie mit sich, ohne gleichzeitig mit den sozialen Privilegien zu entschädigen, die Kranken und Patienten zugesprochen werden. Letztendlich ist durch die weite Verfügbarkeit genetischer Tests eine neue Risikowahrnehmung in weiten Teilen der Bevölkerung zu erwarten. Laienwahrnehmungen sind dabei noch immer stark vom dem bis vor einigen Jahren propagierten genetischen Determinismus gezeichnet. Dass Krankheit trotz genetischer Faktoren als multifaktorielles Geschehen und soziales Phänomen anzusehen ist, wird nur selten beachtet. Unglücklicherweise entzieht sich das so verstandene genetische Risiko weitgehend sozialen Risiko-Diskursen und Strategien der Risiko-Bewältigung, die sich in bezug auf Umgebungs- und Lifestyle-Risken längst herausgebildet haben. So überrascht es nicht, wenn sich gegenwärtig auf der Basis der weiten Wahrnehmung des Themas „Genetisches Risiko“ ein Trend zur Individualisierung von Risiken und zur Subjektivierung des Umgangs mit Risiken abzeichnet, in dem sich die rationale Kategorie des Risikos in eine irrationale, deswegen aber nicht minder sozial relevante, wandelt. Eine zweite These könnte daher lauten: Das Konzept des genetischen Risikos führt auf sozialer Ebene zu Lebensänderungen, die nicht der wissenschaftlichen Rationalität folgen und immer einen Verlust an Autonomie mit sich bringen. Dabei bestehen Strategien zur Risikobewältigung allein im Sektor der populationsbezogenen Prävention. Es gilt daher, diese an die Bedürfnisse eines veränderten Risiko-Diskurses anzupassen und im Sinne einer auf spezifische Subpopulationen zugeschnittenen Aufklärung umzusetzen. Man könnte argumentieren, dass die eben geschilderten Probleme lediglich einen temporären Mangel an Wissen widerspiegeln. Unsere gegenwärtige Unfähigkeit auf der Basis molekulargenetischen Wissens angemessen zu handeln wäre dann nicht das Hauptproblem, sondern ein notwendiges Durchgangs­stadium auf dem Weg zur Molekularen Medizin, die letztlich die Beherrschbarkeit genetischer Varianz und der eventuell mit ihr verbundenen gesundheitlichen Nachteile mit sich bringen wird. Eine solche Haltung impliziert aber, der Fortschritt der Wissenschaft werde für jedes genetische Risiko eine klar definierte, kausale Prävention oder Therapie ohne nennenswerte Belastung des Patienten mit sich bringen. Eine Hoffnung, die auf t504 Genetik in Public Health Te i l 2 / 2 0 0 7 einem nachgerade naiv-deterministischen Fortschrittsdenken basiert und die man in Kenntnis der Geschichte der Medizin nicht teilen können wird. 3. Ethische Aspekte der Prädiktion und Prävention in der Molekularen Medizin Da der Großteil der genetischen Information prädiktiv und probabilistisch ist, gilt es Mechanismen zu schaffen durch die sichergestellt werden kann, dass in der breiten Bevölkerung genetische Information immer nur als Wahrs cheinlichkeitsaussage wahrgenommen wird, die keine Grundlage für soziale Repression bilden darf. Es ist unklar, wie dies geschehen kann. Einigung scheint allein darüber zu bestehen, genetische Prädiktion auf solche Tests zu beschränken, die medizinisch relevante Aussagen erlauben und die Basis für weitere diagnostische, therapeutische oder präventive Indikationen bilden. Die Entscheidung darüber, was als diagnostische, präventive oder therapeutische Indikation verstanden wird, ist in einzelnen Ländern in Abhängigkeit ihrer historisch gewachsenen kulturellen, sozialen, politischen und rechtlichen Normen jedoch sehr unterschiedlich. Insgesamt verspüren Ärztinnen und Ärzte immer häufiger den Druck, ihren Patienten Tests anzubieten, die Aussagen über das Risiko zukünftiger Erkrankungen zulassen. Dies geschieht durchaus im Sinne einer gesundheitlichen Eigenverantwortung, wie sie etwa Verhaltensprävention vor dem Hintergrund der Ermöglichungsgerechtigk eit einfordern würde. Die Praxis der Brustkrebsrisiko-Diagnostik oder die Diskussion um ein genetisches Screening möglicher Prädispositonen für die Alzheimersche Krankheit ist hierfür beredtes Beispiel (Garber, Offit et al. 1997; Koenig & Silverberg 1999). Je öfter genetischen Prädispositionen mit klinischen Krankheitsbildern korreliert werden, desto drängender werden Fragen der Vertraulichkeit von patienten­bezogenen Daten sowie der informierten Einwilligung in Tests (Council of Europe 1992; Reilly, Boshar et al. 1997). Dies scheint insbesondere bei der Analyse und Speicherung genotyp-bezogener Daten großer Bevölkerungsteile zuzutreffen, die eine der wesentlichen Voraussetzungen für Ansätze im Bereich der öffentlichen Gesundheitssicherung bildet. Auch dies ist ein Umstand, der nicht gerne zur Sprache gebracht wird. Wissenschaftlicher und wirtschaftlicher Enthusiasmus für eine molekulare Revolution der Medizin haben – nicht ganz unberechtigt – zu Besorgnis bezüglich möglicher Gefahren und Risken der unbedachten Umsetzung neuer Konzepte geführt. Diese Besorgnis hat nicht zuletzt zum internationalen Aufschwung der Bioethik beigetragen. Diese befasst sich heute vor 505u Genetik, Gesundheit und Gesellschaft allem mit Fragen der Regulierung und Bedingungen der Einführung neuer Verfahrensweisen. Damit ist Bioethik angesichts des rasanten Tempos der Produktion neuen Wissens und neuer Technologien häufig zur ethischen Reflexion post factum verdammt. In dieser Situation scheint eine grundlegende Auseinandersetzung mit den möglichen Richtungen und Zielen der Molekularen Medizin drängender denn je. Die Möglichkeit zu wissen, wer welche Gene für welche Krankheit oder Disposition trägt, die Möglichkeit Patientengruppen nach Genotypen zu segmentieren, wirft fundamentale ethische, soziale und rechtliche Fragen auf, die nicht allein durch die Beachtung ethischer Prinzipien beigelegt werden können, sondern nach einer Neuorientierung verlangen (Knoppers & Chadwick 1994). Dies wird sehr klar, wenn man eine rezente Debatte zur molekularen Prävention näher betrachtet. In dieser Debatte wurden zwei neue Formen der Prävention benannt. Die erste Form wurde als phänotypischen Prävention beschrieben (Juengst 1995). Sie strebt die Vermeidung von Gesundheitsschäden und Todesfällen in Personengruppen mit einem spezifischen Genotyp an. Diese Form der Prävention ist zwar neu – jedoch nicht in einem grundsätzlichen Sinne. Die Beziehung potentiell schädlicher, mutagener oder genotoxischer Umweltfaktoren mit menschlicher genetischer Varianz wird als Ausgangspunkt für Strategien genommen, in denen es a) um die Veränderung der schädlichen Umweltfaktoren und b) um eine Unterbrechung der schädlichen Interaktion von Umwelt und Genotyp etwa durch eine Veränderung des Genotyps geht. Hier ist nicht nur eine grundlegende Auseinandersetzung mit Problemen der genetischen Diskriminierung vonnöten, es sollte darüber hinaus deutlich sein, dass eine Debatte um die Rolle der Medizin erfolgen muss, in der es gilt, zu unterscheiden, in wieweit Eingriffe in das menschliche Erbgut eine Möglichkeit zur Prävention darstellen, oder inwieweit es sich hier bereits um einen Ansatz zur biologischen Verbesserung des Menschen – in anderen Worten: zur positiven Eugenik – handelt. Diese Diskussion scheint umso notwendiger, als in Erweiterung der phänotypischen Prävention darüber nachgedacht wird, ob, und wenn ja, welche Rolle einer genotypischen Prävention zukommen würde, die es sich zum Ziel setzt, die Weitergabe risiko- oder krankheitsbezogener genetischer Eigenschaften von einer Generation auf die nächste zu unterbrechen, und zwar durch Beratung in der Familienplanung, genetisches Screening von Merkmalsträgern, pränatale Diagnostik, Abtreibung und – in ferner Zukunft – durch genetische Eingriffe in die menschliche Keimbahn (Khoury, Burke et al. 2000; Stock 2002; Stock & Campbell 2000). Damit würde ein Szenario fortgesponnen, das Gregory Stock erstaunlicher Weise im Sinne einer positiven Vision formuliert hat: t506 Genetik in Public Health Te i l 2 / 2 0 0 7 „Ultimately, we will have to face the question lying at the heart of the emerging international debate about the application of molecular genetics to humans: How far are we willing to go in reshaping the human body and psyche? The future medicine will not be so much about still fighting the same diseases that have plagued humans for centuries, but much more a question of a more meaningful human design.” (Stock & Campbell 2000) Sicherlich stellen Molekulare Optionen der Prädiktion und Prävention eine Chance für die signifikante Verbesserung der Gesundheitssicherung und letztlich für die Sicherung der Verteilungs- und Ermöglichungsgerechtigkei t in unserem solidarisch organisierten Gesundheitssystem dar. Andererseits birgt die Redefinition von Gesundheit und Krankheit all diejenigen Risiken in sich, die mit einem Wandel von sozialen Kategorien und Wertbegriffen – in diesem Falle Gesundheit, Krankheit und Körperverständnis – einhergehen (Paul 2002). Dies zu sehen und entsprechend zu handeln ist die zentrale Verantwortung all derer, die im Sinne der Verbesserung und Erhaltung der menschlichen Gesundheit neues Wissen der molekularen Medizin im Bereich der öffentlichen Gesundheit als „Public Health Genetics“ nutzen wollen. 507u Genetik, Gesundheit und Gesellschaft Literatur Aparicio SaJR (2000): How to Count.Human Genes. Nature Genetics 25, 129-130. Bassett DEJ, Boguski MS, Spencer F, et al. (1997): Genome CrossReferencing and XREFdb: Implications for the Identification and Analysis of Genes Mutated in Human Disease. Nature Genetics 15, 339-343. Bassett DEJ, Eisen MB, Boguski MS (1999): Gene Expression Informatics— It’s All in Your Mine. Nature Genetics 21, 51-55. Bittner JJ (1936): Some Possible Effects of Nursing on the Mammary Gland Tumor Incidence in Mice. Science 84, 162. Boveri T (1914): Zur Frage der Entstehung maligner Tumoren. ed. Jena. Collins FS (1997): Preparing Health Professionals For the Genetic Revolution [editorial]. JAMA 278,. 1285-1286. Collins FS (1998): Genetics: Not Just Somewhere But At the Very Center of Medicine. Genetics in Medicine. Collins FS (1999): Shattuck Lecture - Medical and Societal Consequences of the Human Genome Project. New England Journal of Medicine 341(1), 28-37. Council of Europe (1992): Recommendation No. R (92) 3 of the Committee of Ministers to Member States on Genetic Testing and Screening for Health Care Purposes. International Digest of Health Legislation; 43284. Croyle RT, Achilles JS, Lerman C (1997): Psychologic Aspects of Cancer Genetic Testing. Cancer 80 (S3),569-575. Emilien G, Ponchon M, Caldas C, et al. (2000): Impact of Genomics on Drug Discovery and Clinical Medicine. Quarterly Journal of Medicine 93(7): 391-423. Ewing B, Green P (2000): Analysis of Expressed Sequence Tags Indicates 35,000 Human Genes. Nature Genetics 25, 232-234. t508 Genetik in Public Health Te i l 2 / 2 0 0 7 Ganten D, Ruckpaul K (Hrsg.) (2002): Grundlagen der Molekularen Medizin. Berlin: Springer. Garber JE, Offit K, Olopade OIF, et al. (1997): The American Society of Clinical Oncology Position on Genetic Testing. Cancer 80(S3), 632634. Jollès P, Jörnvall H (Hrsg.)(2000): Proteomics in Functional Genomics: Protein Structure Analysis. Basel: Birkhäuser Verlag. Jordan VC (Hrsg.) (1994): Long-Term Tamoxifen Treatment for Breast Cancer. Madison: University of Wisconsin Press. Jordan VC (Hrsg.) (1999): Tamoxifen for the Treatment and Prevention of Breast Cancer. New York: Melville Prr Juengst ET (1995): ‚Prevention‘ and the Goals of Genetic Medicine. Human Gene Therapy 6, 1595-1605. Kavanagh A, Broom D (1998): Embodied Risk: My Body, Myself? Social Science and Medicine 46, 437-444. Kavanagh JJ (Hrsg.) (1999): Breast Cancer. Malden: Blackwell Science. Khoury MJ (1999): Human Genome Epidemiology (HuGE): Translating Advances in Human Genetics into Population-based Data for Medicine and Public Health. Genetics in Medicine 1, 71-73. Khoury MJ, Burke W, Thomson EJ (Hrsg.) (2000): Genetics and Public Health in the 21st Century. Using Genetic Information to Improve Health and Prevent Disease. New York: Oxford University Press. Khoury MJ, Burke W, Thomson EJ (2000): Genetics and Public Health: A Framework for the Integration of Human Genetics into Public Health Practice. In: Khoury MJ, Burke W, Thomson EJ (Hrsg.): Genetics and Public Health in the 21st Century: Using Genetic Information to Improve Health and Prevent Disease. New York: Oxford University Press, 3-23. Knoppers BM, Chadwick R (1994): The Human Genome Project: Under an International Ethical Microscope. Science 265, 2035-2036. 509u Genetik, Gesundheit und Gesellschaft Koenig BA, Greely HT, Mcconnell LM, et al. (1998): Genetic Testing for BRCA1 and BRCA2: Recommendations of the Stanford Program in Genomics, Ethics, and Society. Breast Cancer Working Group. Journal of Womens Health 7(5), 531-545. Koenig BA, Silverberg HL (1999): Understanding Probabilistic Risk in Predisposition Genetic Testing for Alzheimer Disease. Genetic Testing 3(1), 55-63. Kuschel B, Lux MP, Goecke TO, et al. (2000): Prevention and Therapy for BRCA1/2 Mutation Carriers and Women at High Risk for Breast and Ovarian Cancer. European Journal of Cancer Prevention 9(3), 139-150. Labisch A (2002): Health in the Era of Molecular Medicine: A Historical Perspective. In: Gimmler A, Lenk C, Aumüller G (Hrsg.): Health and Quality of Life: Philosophical, Medical, and Cultural Aspects. Münster: Lit, 199-217. Labisch A, Paul NW (1998): Medizin (zum Problemstand). In: Korff W, (Hrsg.): Lexikon der Bioethik Bd 2. Gütersloh: Gütersloher Verlag.Haus, 631-642. Lederberg J (1961): Unpublished Typescript: The Joseph P. Kennedy jr. Laboratories for Molecular Medicine: Grant Proposal 1st of December 1961. In: Palo Alto (Hrsg.): Stanford. Lederberg J (1962): Unpublished Typescript: Program in Molecular Neurobiology: Submission to National Institute for Neurological Diseases and Blindness, 8/30/62, NB04270-01. In: Stanford University(Hrsg.): Stanford. Lenoir T(1999): Shaping Biomedicine as an Information Science. In: Bowden ME, Hahn TB, Williams RV (Hrsg.): Proceedings of the 1998 Conference on the History and Heritage of Science Information Systems. Medford: New Jersey, 27-45 Lenoir T, Hays M (2000): The Manhattan Project for Biomedicine. In: Sloan PR (Hrsg.): Controlling Our Destinies: Historical, Philosophical, Ethical, and Theological Perspectives on the Human Genome Project. South Bend: University of Notre Dame Press, 19-46. t510 Genetik in Public Health Te i l 2 / 2 0 0 7 McKusick VA (1997): Genomics: Structural and Functional Studies of Genomes. Genomics 45(2), 244-249. Paul NW (2000): Die molekulargenetische Interpretation des Krebs: Ein Paradigma, seine Entwicklung und einige Konsequenzen / The Molecular Interpretation of Cancer: A Paradigm, a Story, Some Consequences. In: Eckart W (Hrsg.): 100 Years of Organized Cancer Research. Stuttgart: Thieme, 95-100. Paul NW (2001): Anticipating Molecular Medicine: Smooth Transition from Biomedical Science to Clinical Practice? American Family Physician 63(9), 1704-1706. Paul NW (2001): Das Genom, die molekulare Medizin und der Wandel ärztlichen Entscheidens und Handelns. In: Bartmann FJ, Pecnik H, Sachau R (Hrsg.): Das rechte Maß der Medizin. Vom Arztsein in einer technisierten Welt. Hamburg: ebv, 39-51. Paul NW (2002): Genes, Information, Volatile Bodies. In: Gimmler A, Lenk C, Aumüller G (Hrsg.): Health and Quality of Life. Philosophical, Medical, and Cultural Aspects. Münster: Lit, 187-198. Paul N: (2002): Molekulare Prädiktion: Ein Weg zur Molekularen Prävention? In: Gostomzyk JG (Hrsg.): Innovative Aspekte in der Prävention. München: Landeszentrale für Gesundheit, 39-61. Paul NW (2003): Auswirkungen der Molekularen Medizin auf Gesundheit und Gesellschaft. Bonn: Friedrich Ebert Stiftung. Paul NW (2003): Erwartungen und Ängste der Gesellschaft gegenüber der Genomforschung. In: Bender HG, Dall P (Hrsg.): 54. Kongress der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe. Berlin: Springer, 445-447. Paul NW (2003): Genetische Intervention - Genetische Prävention Genetisches Design? Zu Entwicklung, Optionen und Konsequenzen der Molekularen Medizin. In: Andel M, et al. (Hrsg.): Moderne Biologie: Möglichkeiten und Risiken, Hoffnung und Bedrohung. Praha: Tigis, 77-85. 511u Genetik, Gesundheit und Gesellschaft Paul NW (2003): Making Molecular Medicine: Historical, Theoretical, and Ethical Dimensions. Düsseldorf: Medizinische Fakultät der HeinrichHeine-Universität, Habilitationsschrift. Paul NW, Fangerau H, Roots I (2004): Taking Ethical Issues in Pharmacogenetics to the Rough Ground: Research and Clinical Application in the Field of Psychiatry (submitted). Journal of Medical Ethics. Paul NW, Ganten D (2003): Zur Zukunft der Molekularen Medizin. In: Honnefelder, et al. (Hrsg.): Das genetische Wissen und die Zukunft des Menschen. Berlin: De Gruyter, 103-114. Paul NW, Labisch A (2002): Health is a Crossroad: Natur und Gesellschaft, Individuum und Gemeinschaft in der öffentlichen Gesundheitssicherung. Das Gesundheitswesen 64, 614-622. Pauly PJ (1987): Controlling Life: Jacques Loeb and the Engineering Ideal in Biology. New York: Oxford University Press. Pauly PJ (2000): Biologists and the Promise of American Life: From Meriwether Lewis to Alfred Kinsey. New Jersey: Princeton University Press. Peltonen L, Mckusick VA (2001): Dissecting Human Disease in the Postgenomic Era. Science 291, 1224-1229. Pennington SR, Dunn MJ (Hrsg.) (2001): Proteomics: From Protein Sequence to Function. Oxford: Springer. Poe A (1999): Cancer Prevention or Drug Promotion? Journalists Mishandle the Tamoxifen Story. International Journal of Health Services 29(3), 57-61. Raem AM, Braun RW, Fenger H, et al. (2000): Gen-Medizin: Eine Bestandsaufnahme. Heidelberg: Springer. Reilly PR, Boshar MF, Holtzman SH (1997): Ethical Issues in Genetic Research: Disclosure and Informed Consent. Nature Genetics 15, 1620. t512 Genetik in Public Health Te i l 2 / 2 0 0 7 Rous P (1911): Transmission of a Malignant New Growth by Means of a Cell-Free Filtrate. Journal of the American Medical Association 56, 198. Shine J, Seeburg PH, Martial J, et al. (1977): Construction and Analysis of Recombinant DNA for Human Chorionic Somatomammotropin. Nature 270, 494-499. Stock G (2002): Redesigning Humans: Our Inevitable Genetic Future. Boston: Houghton Mifflin: Stock G, Campbell J (Hrsg.) (2000): Engineering the Human Germline: An Exploration of the Science and Ethics of Altering the Genes We Pass to Our Children. Oxford: Oxford University Press. Stock G, Campbell J (2000): Introduction. In: Stock G, Campbell J, (Hrsg.): Engineering the Human Germline: An Exploration of the Science and Ethics of Altering the Genes We Pass to Our Children. Oxford: Oxford University Press, 3-6. Ten Have H (1995): Medical Technology Assessment and Ethics - Ambivalent Relations. Hastings Center Report 25 (5), 13-19. Turney J (1995): Life in the Laboratory: Public Responses to Experimental Biology. Public Understanding of Science 4, 153-176. White IN (1999): The Tamoxifen Dilemma. Carcinogenesis 20 (7),11531160. 513u t514 IV. Ethik und Policy Genetik in Public Health Te i l 2 / 2 0 0 7 Ethik der Public Health Genetik Peter Dabrock, Peter Schröder 515u Inhalt IV. Ethik und Policy Ethik der Public Health Genetik t516 1. 1.1. 1.2. 1.3. 1.4. 1.5. Medizinische und gesellschaftliche Herausforderungen durch Genetik und Public Health Genetik...................... 518 Auf dem Weg zur molekularen Medizin........................ 518 Auf dem Weg zur Public Health Genetik . .................... 518 Scheitern eindeutiger Handlungsstrategien aufgrund komplexer Risikokommunikation................................... 519 Ängste und Befürchtungen gegenüber der molekularen Medizin................................................................... 519 Spezifische Konfliktfelder von Public Health Genetik....... 520 2. 2.1. 2.2. Zur Notwendigkeit einer gesellschaftliche Debatte über Public Health Genetik ........................................ 521 „Man kann nicht nicht antworten“................................ 521 Befähigung als notwendige Bedingung der gesellschaftlichen Debatte um Public Health Genetik....... 522 3. 3.1. 3.2. 3.3. 3.4. 3.5. Ethische Grundprinzipien............................................ 523 Menschenwürde ....................................................... 523 Die sozialethische und zivilgesellschaftliche Grundunterscheidung zwischen Rechtem und Gutem............... 525 Zur Anwendung der Grundunterscheidung im Blick auf Public Health Genetik.................................... 527 Mittlere Axiome......................................................... 528 Normative Implikate für Public Health Genetik aus der individuumsbezogenen Humangenetik ................... 532 4. 4.1. 4.2. 4.3. 4.4. Public Health Genetik und soziale Gerechtigkeit ........... 542 Auszuschließende soziale Verpflichtungsrelationen in der „sozialen Demokratie in den Formen des Rechtsstaats“............................................................. 543 Decent minimum statt minimales Minimum..................... 544 Chancengleichheit als erste Präzisierung des decent minimum........................................................ 545 Befähigung als Maßangabe für das decent minimum der Chancengleichheit.................................. 546 Genetik in Public Health 5. 5.1. 5.2. Sozialethische Perspektiven auf Public Health Genetik.... 548 Keine Exzeptionalität, aber Spezifität genetischen Wissens................................................................... 548 Konsequenzen des Befähigungsgerechtigkeitsansatzes für den Umgang mit Public Health Genetik.......... 549 6. Priorisierungsregel beim Grundkonflikt Autonomierespekt vs. Gemeinwohl(-pflichtigkeit)........................... 552 7. Ausblick................................................................... 554 Te i l 2 / 2 0 0 7 Literatur.............................................................................. 555 517u Ethik der Public Health Genetik 1. Medizinische und gesellschaftliche Herausforderungen durch Genetik und Public Health Genetik 1.1.Auf dem Weg zur molekularen Medizin Die Medizin entwickelt sich in rasantem Tempo von ihrer morphologischen und phänotypischen Orientierung hin zu einer molekularen und genotypischen Orientierung (vgl. WHO 2002; Paul 2004; Feuerstein, Kollek, Uhlemann 2002; siehe auch Paul in diesem Band). Neben der Diagnose werden die Prognose und Prädiktion zu immer wichtigeren Aussagegrößen. Richtig ist zwar, dass die Forschung noch lange im Grundlagenbereich verharren wird, dass sie entgegen früheren linearen Erwartungen („ein Gen verursacht eine Krankheit“) auf hochkomplexe Krankheitsätiologien aufmerksam geworden ist (neben wenigen hochpenetranten monogenetischen Erkrankungen gibt es zahlreiche polygen und polymorph verursachte Krankheiten, wobei zudem unterschiedliche Umwelteinflüsse unterschiedlich wirken können (vgl. Henn und Schreiber in diesem Band). Daraus folgt, dass durch die Wahrnehmung solcher komplexer Krankheitsverursachungen Prognose und Prädiktion immer nur Wahrscheinlichkeitsgrößen sein werden. Dennoch werden nach derzeitiger Einschätzung diese Prädiktionen das Verständnis von Gesundheit und Krankheit und den individuellen wie sozialen Umgang mit diesen Lebensführungsphänomenen nachhaltig prägen und verändern. 1.2.Auf dem Weg zur Public Health Genetik Nicht nur auf der individuumsbezogenen Ebene, sondern auch auf der Ebene der gesellschaftlichen Gesundheitsversorgung deuten sich – wenn auch noch sehr schemenhaft – präzisere, schnellere, wirksamere, nebenwirkungsärmere Präventions-, Diagnose- und Therapiemöglichkeiten für Einzelne wie für bestimmte Patientenkollektive und bestimmten Umwelteinflüssen ausgesetzten Personen(-kreise) an (French & Moore 2003; Kollek, Feuerstein & Schmedders 2004). Wahrscheinlich werden Menschen und Menschengruppen demnächst durch bestimmte Chip-Technologien Prognosewerte über Krankheitsanfälligkeiten erhalten. Sensible Daten können zum Zwecke von Gesundheitssystem- und Versorgungsforschung in unterschiedlichsten Formen von Biobanken gespeichert werden. Präventionsempfehlungen an betroffene Individuen und Bevölkerungssubpopulation können mit den ermittelten, gespeicherten und ausgewerteten Daten einhergehen. Diese mögliche Integration genetischen Wissens in die Aufgaben von Public Health, also in die öffentliche Sorge um die Gesundheit aller durch öffentliche oder öffentlich beauftragte Organisationen, nennt man Public Health Genetik. t518 Genetik in Public Health Te i l 2 / 2 0 0 7 1.3.Scheitern eindeutiger Handlungsstrategien aufgrund komplexer Risikokommunikation Die in anderen Technikfeldern bewährte Technikfolgenabschätzung (Bora 1999; Grunwald 2003) gerät dort, wo sie nicht nur an technischen, sondern auch an sozialen Folgen der Implementation von Genetik in Klinik und Gesundheitsversorgung interessiert ist, auf dünnen Boden. Denn das Verständnis von Risikokommunikation (vgl. Luhmann 1991; Japp 2000) wird in Zeit-, Sach- und Sozialdimension gleich massiv herausgefordert. So ist noch spekulativ, wann es zu nachhaltigen medizinischen und Gesundheitsversorgungseffekten durch Genetik kommt, so ist noch nicht sachlich und pragmatisch geklärt, wie weit genetische Grundlagenforschung in die medizinische Genetik umgesetzt wird und wie man von humangenetischer Diagnostik zur prädiktiven Genetik und von dort zu individuums- bzw. kollektivbezogenen Handlungsstrategien kommt. Schließlich sind auf der sozialen Ebene die Risiken der Kommunikation zwischen Experten und Laien zu berücksichtigen. Vermittlung, Einsicht und Legitimität können derzeit (nur) aufgrund von Wahrscheinlichkeiten getroffen werden – ob Befürworter oder Gegner dieser Entwicklung, niemand hat eine Alternative. In moraltheoretischer Tradition ist nur dort die vorsichtigere Alternative zu wählen (Tutiorismus), wo hohe Güter auf dem Spiel stehen, die nicht durch Missbrauchseindämmung geschützt werden können. 1.4.Ängste und Befürchtungen gegenüber der molekularen Medizin Aufgrund der komplexen Risikostruktur genetischer Informationen trifft diese insbesondere in Deutschland vor dem Hintergrund der hiesigen Geschichte auf geballte Zurückhaltung, Angst und Skepsis. So wird von nicht wenigen befürchtet, dass die zum Großteil keineswegs Sicherheiten, sondern nur Wahrscheinlichkeiten kommunizierende prädiktive Medizin zur Gefährdung der Privatsphäre, zu Stigmatisierungen und Diskriminierungen auf unterschiedlichsten Ebenen, in unterschiedlichsten Szenarien und gegenüber unterschiedlichsten Gruppen führen kann. Befürchtungen betreffen Arbeits- und Versicherungsverhältnisse wie die Reproduktion, die immer mehr von vermeintlichen „Perfektionsansprüchen“ geleitet werden könnte, wiewohl die überwältigende Zahl von Erkrankungen nicht unmittelbar nur genetisch, sondern immer auch und überwiegend durch Umwelt- und Verhaltenseinflüsse bedingt ist. Aufgrund dieses prädiktiven Drucks sehen manche in der „Genetisierung“ der Gesellschaft eine neue, besonders perfide Form von biopolitischer Sozialdisziplinierung nicht nur des Körpers, sondern auch unserer individu- 519u Ethik der Public Health Genetik ellen Lebensweisen wie unseres sozialen Miteinanders auf die Gesellschaft zukommen.1 Andere sehen in einem nach ihrer Auffassung obsoleten genetischen Determinismus eine Hemmschwelle für eine breite gesellschaftliche Akzeptanz möglicherweise zukünftiger Entwicklungen, die zu Überregulation führen und so medizinischen, ökonomischen und Public Health-Fortschritt gefährden. 1.5.Spezifische Konfliktfelder von Public Health Genetik Neben den vielfach diskutierten, vornehmlich individuumsbezogenen Problemaspekten (vgl. 3.5) künftiger angewandter Genetik (Schutz der Privatsphäre, Vertraulichkeit, informed consent, Schutz vor Diskriminierung und Stigmatisierung) transportiert Public Health Genetik weitere spezifische gesellschaftliche Herausforderungen, die alle um den möglichen Konflikt zwischen individuumsbezogenem Autonomierespekt und gesellschaftlichen Gesamtnutzen oder Gemeinwohl gruppiert sind. Im Einzelnen gehören (Michigan Center for Genomics & Public Health o.J.) zu den Konfliktfeldern die folgenden: der spezifisch populationsbezogene Fokus gegenüber dem individualisierenden der traditionellen humangentischen Medizin, der mögliche Vorrang eines kollektiven Wohlfahrtsgedankens gegenüber der individuellen Autonomie, die mögliche Diskriminierung von Populationen, eine drohende Ausweitung gesundheitlicher Ungleichheiten, der Streit um Verteilungsgerechtigkeit, die mögliche Begrenzung des Prinzips der informierten Zustimmung, der Streit um die Güter „individueller Schutz der Privatsphäre“ vs. „Gruppenrechte“, neue strategische Herausforderungen für die Gesundheitsversorgung, die Beachtung von kulturellen und rechtlichen Besonderheiten, wenn bestimmte Gruppen untersucht werden, die Entwicklung von Kriterien öffentlicher Debatten, eine Ethik unterschiedlicher Präventionsstrategien, das Abwägen der sozialen Vor- und Nachteile von Public Health Genetik, die Bewahrung der Umwelt, das Verhältnis von Zwang und Freiwilligkeit und der Gegensatz von genotypischer vs. phänotypischer Prävention. 1 t520 Insofern diese meistens von Foucault beeinflussten Sozialtheorien die gesamte Moderne unter solchen machtorientierten Diskurspraktiken sehen und im Grunde nie einen konstruktiven Ausweg formulieren (Lemke 2000; Lösch 2001), nehmen sie bisweilen den Gestus einer geschlossenen Theorie ein. Positiv gewendet: so richtig es ist, auf implizite Machtmuster in Diskurspraktiken zu achten, so sehr muss man sich bewusst sein, dass es nicht um die Verhinderung, sondern nur um die Kultivierung von Macht bspw. durch Transparenz, Zeit- und Kompetenzbeschränkung etc. gehen kann; meistens stellen die protestkommunikativen Kritiker von Biotechnologie und -politik jedoch nur ihre Kritik am vermeintlichen biopolitischen Syndrom vor, ohne darauf aufmerksam zu machen, dass auch ihre Position nicht machtfrei und diskursiv disziplinierend daher kommt. Genetik in Public Health Te i l 2 / 2 0 0 7 2. Zur Notwendigkeit einer gesellschaftliche Debatte über Public Health Genetik 2.1.„Man kann nicht nicht antworten“ Will man nicht einem kulturpessimistischen oder technikfeindlichen Fatalismus folgen, der aufgrund seiner Protest- und Verweigerungshaltung meistens nur denen in die Hand spielt, die möglichst weit ihre ökonomischen Interessen durchsetzen wollen2, dann muss der soziale Umgang mit individuumsbezogener wie Public Health bezogener Genetik in der Gesellschaft eingeübt und gestaltet werden. Dazu wird man zuvörderst fragen müssen, welche Vorstellungen von gutem und gerechtem Leben auch in Zukunft prägend sein sollen. Gesellschaftliche Debatten sind von Nöten, in denen im Vollzug deutlich wird, dass eine verantwortliche Zukunftsorientierung einen kritischen Blick zurück voraussetzt. Auf diese Weise kann aus den Quellen des Selbst und der Kulturen geschöpft werden, indem aus in ähnlichen Kontexten begangenen Fehlern gelernt wird und bewährte Muster aufgegriffen werden, um den kommenden Herausforderungen nicht haltlos gegenüber zu stehen. Allerdings geht in der Regel ein solches Sich-Einlassen auf neue Situationen auch einher mit dem Eingeständnis, dass Bewährtes durch neue Ansprüche seinerseits verändert wird, dass Gefundenes von daher neu erfunden werden muss. Schmerzhafte Prozesse von Verlust lassen sich selbst beim Rückgriff auf Bewährtes kaum vermeiden. Die in Deutschland nicht nur, aber auch aufgrund geschichtlicher Erfahrung besonders ausgeprägte Skepsis gegenüber den Entwicklungen der molekularen Medizin mag sich u.a. eben auch aus dieser Verlustangst heraus erklären. Angesichts der Reserve gegenüber den Risiken des molekulargenetischen Fortschritts (vgl. 1.3-1.5) muss man sich aber ebenso Rechenschaft darüber ablegen, dass nicht nur Handlungen, sondern auch Unterlassungen verantwortet werden müssen. Neue Herausforderungen können nicht nicht beantwortet werden. Auch die Unterlassung ist eine Antwort auf Herausforderung. Nun scheint es intuitiv so, dass Unterlassungsgebote weniger dramatisch wirken als Handlungsverbote. Schließlich hat die Forschung bisher kaum Anwendungen auf der klinischen oder Public Health-Ebene aufweisen können. Aus diesem Umstand kann man leicht ein Argument gegen die ohne Zweifel kostenintensive Grundlagenforschung zimmern und bei prognostizierten Risiken daraus gemäß dem Grundsatz, im Zweifel die sichere Variante zu wählen, ein Unterlassungsgebot folgern. 2 Dieses Ziel ist im Übrigen nur dann unanständig, wenn elementare Güter anderer verletzt werden. 521u Ethik der Public Health Genetik Solch eine Reserve gegenüber der Forschung stellt zunächst ein Einstellungsmuster dar, das sich in Deutschland kulturell verdichtet findet. Diesseits berechtigter ethischer Reserven ist allerdings zu beachten, dass es nun einmal ein Grundprinzip echter Grundlagenforschung darstellt, dass das Ergebnis noch nicht im Vorhinein feststeht. Wenn mittel- und langfristige Prognosen erfolgreiche Entwicklungen, die nach heutiger Einschätzung zwar ethisch bedenklich, aber nicht völlig verwerflich sind, als nicht völlig utopisch erscheinen lassen, gilt es zudem ehrlich und selbstkritisch im Gedankenexperiment zu fragen, ob man diese Errungenschaften auch im Falle ihres Nutzens noch ablehnen würde. Die Medizinethik sieht in solchem potentiellem moralischen Trittbrettfahrertum zu Recht ein ethisches Problem und diskutiert es unter dem Stichwort der Komplizenschaft (vgl. Kissell 1999). 2.2.Befähigung als notwendige Bedingung der gesellschaftlichen Debatte um Public Health Genetik Gerade weil die Forschung noch nicht anwendungsfähige Ergebnisse bereitstellt, kann die Gelegenheit genutzt werden, in aller Ruhe eine öffentliche Debatte über sachliche, soziale und zeitliche Chancen und Risiken der Gentechnik zu führen. Selten ergab sich in der neueren Technikgeschichte eine derartige Gelegenheit, technische Entwicklungen bereits so frühzeitig in ihrem Wohl und Wehe zu diskutieren und zu bewerten. So sehr Emotionen dabei eine Rolle spielen dürfen, so wenig dürfen sie die Debatte vorrangig prägen. Deshalb muss Wert darauf gelegt werden, dass diese Diskussionen durch Bildung und Förderung auf unterschiedlichsten Ebenen intensiv vorbereitet werden. Man mag an der Effizienz solcher öffentlicher Diskurse zweifeln. Ihr prognostiziertes Ergebnis erscheint ferner unter Berücksichtigung vorhandener Erhebungen empirischer Sozialforschung durchaus offen. Dass durch die verschiedenen Formen öffentlicher Debatten überhaupt eine Öffentlichkeit entsteht, und sei sie unvermeidlich medial vermittelt und unter solchen Bedingungen immer vielfältigen Interessen und Beeinflussungen ausgesetzt, ist ein gesellschaftlicher Wert in sich. Deshalb erscheint nicht ein bestimmtes Ergebnis sozialethisch geboten, sehr wohl aber eine öffentlich geförderte oder gewährte Bereitstellung von Foren, die solche Debatten wirklich und nicht nur formal ermöglichen. Durchaus kontroverse Meinungsbildung erweist sich nämlich als öffentliches Gut einer zivilgesellschaftlich gebundenen, rechtsstaatlichen Demokratie. t522 Genetik in Public Health Te i l 2 / 2 0 0 7 3. Ethische Grundprinzipien Weil Public Health Genetik eine öffentliche Aufgabe des freiheitlich demokratischen Rechtsstaats darstellt, dessen Grundlagen nicht suspendiert werden dürfen und sollen, muss die ethische Reflexion mit den allgemeinen ethischen und rechtlichen Normierungen öffentlichen Zusammenlebens beginnen. Dabei decken sich manche mit den aus der individuumsbezogenen Humangenetik bekannten Problemen, anderen mit den normativen Implikaten aus den allgemeinen Verfahrensregeln von Screeningverfahren; darüber hinaus ergeben sich spezifische normativ-ethische Herausforderungen aus dem geschilderten Aufgabenprofil von Public Health Genetik. 3.1.Menschenwürde In bioethischen Debatten wird die Menschenwürde zunehmend als ethische und rechtliche Zentralkategorie eingeschätzt (Deutscher Bundestag 2002). Dies gilt seit langem in Deutschland so, wird aber zunehmend als ein europäisches Spezifikum gegenüber dem amerikanischen Bioethikdiskurs betrachtet (Häyry 2003). Aber auch dort gewinnt die Konzeption zusehends an Bedeutung (The Report of the President’s Council 2002). Gerade ihr zunehmender Gebrauch in Fragen des Lebensanfangs (Gebrauch von Embryonen zu Forschungszwecken, Schwangerschaftsabbruch) und des Lebensendes (Hirntodkriterium und Sterbehilfe) verdeutlicht jedoch die begrenzte Wirkung der Menschenwürde-Konzeption. So wird die relativ unstrittige Frage danach, was Menschenwürde meint, in der Bioethik zunehmend verdrängt durch die überaus strittige Vorfrage, wem Menschenwürde zukommt. Mit den neurologischen, reproduktionsmedizinischen und gentechnischen Möglichkeiten verschwimmen nämlich die traditionellen, exakten Extensionsangaben für das Menschenwürde-Konzept. In Frageform formuliert: Ist ein Hirntoter ein Toter oder ein Sterbender, kommt ihm Menschenwürde zu? Wäre dann nicht aber zumindest bei der Organtransplantation, die derzeit ja noch vom Hirntodkriterium abhängt, die erweiterte Zustimmungslösung, ganz zu schweigen von der Informationsoder der Widerspruchslösung, eine Würde-Verletzung und damit ethisch abzulehnen? Will man aber diese Konsequenz ziehen? Oder man stelle die Kardinalfrage zum Lebensbeginn: Ab wann ist der Mensch ein Mensch? Gibt es einen so offensichtlichen Einschnitt, dass man – in der einprägsamen Formulierung von Robert Spaemann, der diesen Einschnitt bekanntermaßen kategorisch ablehnt – einen Übergang von einem Etwas zu einem Jemand konstatieren könnte (Spaemann 1996)? Sind Embryonen Würde-Träger oder nicht? Ab wann jedoch wären sie es, wenn sie es nicht von Anfang an wären? Aber was ist der Anfang? 523u Ethik der Public Health Genetik In Fragen von Public Health Genetik ist dem in der Regel nicht so. Auf diesem Feld der Integration genetischen Wissens in Public Health-Ziele kann auf die ursprüngliche, wenig umstrittene verfassungsrechtliche und fundamentalethische Intension von Menschenwürde zurückgegriffen werden. In diesen Perspektiven versteht man unter Menschenwürde das, was die Menschen einander keineswegs verletzten dürfen, anders formuliert, was jedem, und zwar jedem einzelnen Menschen in seinen Sein und Mitsein wesentlich ist, was ihm unbedingt, unverlierbar, unauslöschlich, unantastbar zu gelten hat (Dabrock et al. 2004; Geier, Schröder 2003). Trotz unterschiedlicher religiöser, theologischer, philosophischer oder weltanschaulicher Begründung kann man dann mit hohem Geltungsanspruch behaupten, dass es die Würde eines Menschen verletzt, wenn wir ihn oder sie demütigen, ihn oder sie verzwecklichen, ihn wie eine Sache behandeln und ihn oder sie als jemand misshandeln. In dieser nach Günter Dürig als „Objekt-Formel“ bezeichneten Definition wird der Sinn der Menschenwürde erstrangig ex negativo, abwehrrechtlich bestimmt. Auf diese Weise entfaltet sie auch vordringlich ihre normative Kraft im Bereich „Public Health Genetik“. Konkret heißt dies, dass aus der jedem Menschen zukommenden Menschenwürde (Art. 1 Abs. 1 GG) und dem daraus abgeleiteten allgemeinen Persönlichkeitsrecht (Art. 2 Abs. 1 GG) jedem Menschen das Recht auf informationelle Selbstbestimmung zugesprochen wird (Bundesärztekammer 2003). Das schließt das Recht auf Wissen ebenso ein wie das Recht auf Nichtwissen. Im Zeitalter des molekulargenetischen Wissens ergeben sich aus diesem formalen Recht jedoch spezifische ethische Konflikte und Kollisionen (Schröder 2004). Wenn das in Deutschland (noch) nicht in Kraft getretene Menschenrechts übereinkommen zur Biomedizin des Europarates in Art. 11 jede Form von Diskriminierung einer Person aufgrund ihres genetisches Erbes verbietet und zudem in Art. 12 prädiktive genetische Tests nur zu Gesundheitszwecken und für gesundheitsbezogene Forschung erlaubt, dann werden hier ebenfalls auch ohne explizite Nennung des Würde-Axioms die Grundwerte des Instrumentalisierungs- und Demütigungsverbot verteidigt. Allerdings liegt auch hier der Konflikt erst in der konkreten Identifikation der Situationen und Kriterien, wann Gesundheitszwecke erfüllt sind oder wann Forschung gesundheitsbezogen ist. Ob im Sinne eines signifikanten gesellschaftlichen Gesamtnutzens Tests oder Forschung in das allgemeine Persönlichkeitsrecht eines Einzelnen auch nur in engsten Grenzen eingreifen dürfen, wird seit längerem in Deutschland am Beispiel der fremdnützigen Forschung an Nichteinwilligen hochkontrovers diskutiert und immer wieder mit Hinweis auf die NS-Vergangenheit mehrheitlich abgelehnt. Sollte dieser moralische Heroismus zum nachhaltigen Schaden der Betroffenen selbst führen, wird t524 Genetik in Public Health Te i l 2 / 2 0 0 7 man auch diese Unterlassungen verantworten müssen. So wird wie so häufig im Bereich der Bioethik deutlich, dass ihr eine gewisse kritische Selbstaufklärung über ihre eigenen Kommunikationen gut täte. Deshalb folgen wenige Grundsatzüberlegungen über Leitunterscheidungen angewandter Ethiken, die für Normierungen und Bewertungen von Public Health Genetik relevant erscheinen. 3.2.Die sozialethische und zivilgesellschaftliche Grundunterscheidung zwischen Rechtem und Gutem Ob bestimmte Techniken oder Verfahren sozial verantwortet werden können, hängt von unterschiedlichen Bedingungen ab. Dies gilt auch für die ethische Einschätzung der möglichen Integration von Genetik in Public Health. Auf der rechtlichen und ethischen Grundlage des Menschenwürde-Axioms und neben den noch näher darzulegenden allgemeinen und spezifischen Health Technology Assessment-Kriterien sind spezielle Kriterien angewandter Ethik zu beachten. In der pluralistischen und funktional ausdifferenzierten Gesellschaft kann man nicht davon ausgehen, dass ein allgemeiner breiter Konsens in Fragen nach Zielen und Präferenzen individueller und kollektiver Lebensführungen herrscht. Weil aber das Zusammenleben dennoch die gemeinsame Anerkennung elementarer Werte und Regeln voraussetzt, hat sich in der politischen Philosophie die Unterscheidung zwischen Rechtem und Gutem etabliert (Rawls 1975; Forst 1994; Mack 2002; Gosepath 2004). (Juristische und ethische) Normen des Rechten bringen zum Ausdruck, was sich Menschen mehr oder minder notwendig schulden bzw. zugestehen müssen, wollen sie auch ohne gemeinsame Ziele friedlich nebeneinander leben. Ihre Anerkennung ist daher sowohl dem Würde-Axiom wie dem Stabilitätsgrundsatz einer Gesellschaft verpflichtet. Über das moralisch Gerechte hinaus kann das juristisch Rechte die zu einer Zeit gültigen Normen mit Zwang einklagen. Vorstellungen des Guten dagegen formulieren Werte und Ziele von Individuen und gesellschaftlichen Gruppen. Akzeptiert man diese in der Geschichte des liberalen, demokratischen Rechtsstaates halbwegs bewährte Grundunterscheidung, dann lassen sich für die Bewertung sozialethischer Konfliktfälle, zu denen auch die Abwägung der Chancen und Risiken von Public Health Genetik zählt, verschiedene Regeln ableiten: n Im Konfliktfall unterschiedlicher Auffassungen gibt es einen Vorrang des Rechten vor dem Guten. 525u Ethik der Public Health Genetik n Freiheit gilt so lange wie sie die Freiheit des / der Anderen nicht gefährdet. n Gegenüber Ansprüchen partikularer Gemeinschaftsgüter, die nicht allgemein verbindlich sind, ist zunächst die negative Freiheit jedes Einzelnen zu schützen. n Gebote und Verbote sind rechtfertigungspflichtig, sofern sie nicht unmittelbar einsichtig freiheitsgefährdende Handlungen verhindern sollen. n Wegen des Vorranges der negativen Freiheit besitzen Unterlassungsgebote einen Vorrang vor zum aktiven Handeln auffordernden Handlungsgeboten. n Missbrauchseinschränkung im Einzelfall ist einem allgemeinen Verbot vorzuziehen. n Rechtfertigungspflichtig ist seit der Neuzeit bewährterweise nicht das rechtmäßig erworbene Eigentum, sondern die damit keineswegs ausgeschlossene Redistribution zum Zwecke der Wohlfahrtssteigerung der Gemeinschaft oder einzelner Mitglieder der Gemeinschaft. Sozialtheoretisch bedarf diese Grundunterscheidung zwischen Rechtem und Gutem mit den daraus abgeleiteten Regeln jedoch einer ergänzenden Betrachtung (Mack 2002): Auch wenn Rechtes und Gutes unterschieden werden müssen, so lassen sie sich nicht messerscharf trennen. Was in der einen gesellschaftlichen Formation bereits als Gutes angenommen wird, wird in anderen noch unter das Gerechte gefasst. Staatsziele oder Begriffe wie Solidarität, Nachhaltigkeit oder angemessene Grundversorgung verdeutlichen, dass es zwischen dem unbedingt Einklagbaren einerseits und nur wertbasierten Zielen und Bindungen andererseits Zwischenstufen gibt. Entsprechend kennt die politische Theorie solche Verpflichtungen, die jedoch eine Wertdimension beinhalten. Man spricht von einer „schwachen Theorie des Guten“, von Grundgütern oder Konditionalgütern. Martha Nussbaum zählt dazu (keineswegs mit dem Anspruch, eine erschöpfende Liste zu präsentieren) die Fähigkeiten, nicht frühzeitig sterben zu müssen, sich guter Gesundheit zu erfreuen, die Vermeidung unnötigen Schmerzes, die Nutzung der eigenen Sinne und Gedanken, Bindungen einzugehen, Vorstellungen des Guten zu entwickeln, soziale und umweltbezogene Beziehungen einzugehen, zu lachen, zu spielen, Freude zu empfinden, selbstbestimmt zu leben (Nussbaum 1999). Für das zivilgesellschaftliche Leben ist diese Einsicht in die Grauzone zwischen Rechtem und Gutem deshalb von enormer Bedeutung, weil sie einen gestaltungsnotwendigen wie gestaltungsfähigen Spielraum lässt. Über ihn werden in der Gesellschaft Deliberationen geführt mit dem Ziel der Einigung oder zumindest Prüfung, welche gesellschaftlichen Grundwerte als verbindlich anzusehen sind. In solchen Diskursen wird bspw. von kontroversen t526 Genetik in Public Health Te i l 2 / 2 0 0 7 Ausgangspunkten darüber nachgedacht, welcher Umgang mit Behinderung und Behinderten, mit sozial Schwächeren, mit Geschlechterrollen oder mit Familienbildern die gegenwärtige oder die zukünftige Gesellschaft prägen soll. Findet sich ein halbwegs robuster Konsens, ist ein intensives Bemühen um entsprechende Umsetzungsstrategien zu seiner Implementierung angeraten, weil das dahinter stehende Ziel mehrheitlich gewollt ist. 3.3.Zur Anwendung der Grundunterscheidung im Blick auf Public Health Genetik Die allgemeinen Überlegungen zum Verhältnis von Rechtem und Gutem erhalten im Bereich von Public Health Genetik eine unverkennbare soziale Sprengkraft. Auf der einen Seite werden im Bereich privatwirtschaftlicher Unternehmungen zahlreiche z.T. nicht valide oder wenig aussagekräftige Verfahren (z.B. Gentests) solange zugelassen oder zumindest im globalen Kontext nicht verhindert werden können, wie ihnen nicht grobe Fahrlässigkeit, unlauterer Wettbewerb oder Sittenwidrigkeit nachgewiesen werden kann. Durch entsprechende Marketingkampagnen werden Menschen beeinflusst, möglicherweise werden sie verunsichert oder ihnen wird – was noch fataler ist – falsche Sicherheit vermittelt. Solange aber diese vermeintlichen Informationen nicht gegen die angesprochenen rechtlichen und sittlichen Minimalbedingungen verstoßen, ist jede einengende Regelung des freien Marktes in der Beweislast. Auf der anderen Seite, die hier vornehmlich interessiert, müssen öffentlich verantwortete und empfohlene genmedizinische Maßnahmen sehr wohl auf ihre Performabilität, soziale Akzeptanz und ethische und rechtliche Richtigkeit befragt werden können. Insofern die Entwicklungen von Angebot und Nachfrage auf dem freien Markt ihrerseits Einfluss auf die möglicherweise überzogenen Erwartungen der Bürger an öffentliche Gesundheitsversorgungen haben werden, kommt der öffentlich geförderten Gesundheitsmündigkeit (health literacy) im Umgang mit genetischer Information eine enorme Bedeutung zu (Sass 2003; siehe auch Sass in diesem Band). Gerade angesichts der noch so unsicheren, schwer prognostizierbaren Entwicklungen besteht durchaus ein ethisch gebotener, öffentlicher Bildungsauftrag von Public Health Genetik darin, die Bürger zur eigenverantwortlichen Entscheidung überhaupt erst zu befähigen. Über das Gut öffentlicher Debatten hinaus (vgl. 2.3) geht es bei der Befähigung in diesem Fall darum, eine gerechte Bedingung zur Verfolgung eigener Vorstellungen von Gutem bereitzustellen. Daher mag auf der Schwelle von Rechtem und Gutem in solchen, von unterschiedlichen Vorstellungen des Guten geprägten Debatten darüber kontrovers debattiert werden, 527u Ethik der Public Health Genetik n ob durch Public Health Genetik das Verständnis der Gesellschaft von Solidarität, Freiheit und Gleichheit im Umgang mit Gesundheit und Krankheit verändert wird, n ob durch die Berücksichtigung eines genetischen Risikobegriffs das Verhältnis von Solidarität und Eigenverantwortung in der Sozialpolitik neu bestimmt werden muss, n ob wir uns von daher immer mehr zu einer Gesellschaft ungleicher Risikogruppen entwickeln und wie diese neue mögliche Ungleichheit operationalisiert werden soll. In jedem Fall ist bei geplanten rechtlichen Regulierungen der Vorrang des Rechten vor dem Guten zu berücksichtigen. Zugleich darf nicht aus dem Auge verloren werden, dass das Rechte in ethischer Perspektive nur dann das Gerechte bleibt, wenn es den Bürgerinnen und Bürgern (und nicht nur einflussreichen Lobbygruppen) die Möglichkeit bietet, auf die jeweilige kulturelle Gestaltung des Rechten Einfluss zu nehmen. Diese Einflussnahme setzt ihrerseits die Möglichkeit der Informationsgewinnung wie Kommunikationsbefähigung voraus. 3.4.Mittlere Axiome Auf der rechtsstaatlichen Schwelle von Rechtem und Gutem benötigt man auf der Suche nach einem gesellschaftlichen overlapping consensus kriteriale Mindestbedingungen. Neben der Menschenwürde-Konzeption und der formalen Grundunterscheidung von Rechtem und Guten dienen dabei vor allem die sogenannten Mittleren Prinzipien. Sie artikulieren Standards der Bestimmung des Gerechten, das bei unterschiedlichen Vorstellungen des Guten vorausgesetzt werden muss, wenn man gesellschaftlich bioethische Konfliktfelder zu gestalten sucht. Entsprechend hat auch eine Ethik für Public Health Genetik sie zu berücksichtigen. Bis in die zweite Hälfte des letzten Jahrhunderts gab es kaum methodologische Bemühungen zu ergründen, was (bio-)medizinische Ethik oder Ethik des Gesundheitswesens sein oder wie sie betrieben werden sollte. Ethische Kodizes wurden innerhalb der medizinischen und pflegerischen Professionen erstellt. Generaliter ging es darum, die Gesundheit des Patienten zu fördern und gesundheitlichen Schaden zu minimieren. Durch publik gewordene moralische Vergehen in der medizinischen Forschung (z.B. die Tuskeegee Syphilis Studie, ganz zu schweigen von den Verbrechen nationalsozialistischer „Forscher“ im Dritten Reich) wachgerüttelt, begann eine explizite systematische Auseinandersetzung mit ethischen Grundlagen für Medizin und biomedizinische Forschung. Eine zentrale interdisziplinäre Kommission, die 1974 gebildet wurde, um der gesteigerten Nachfrage t528 Genetik in Public Health Te i l 2 / 2 0 0 7 nach ethischer Leitung zu entsprechen, war die US-amerikanische National Commission for the Protection of Human Subjects of Biomedical and Behavioral Research. In dieser Kommission kristallisierte sich der Wunsch heraus, eine allgemeinverständliche gemeinsame Sprache für Ethik der medizinischen Forschung zu finden. In Prinzipien fand man Vokabular, das dieser Anforderung gerecht werden kann. Der bei der Erstellung des Abschlussberichts – der später als The Belmont Report bekannt wurde – federführende Philosoph dieser Kommission war Tom Beauchamp. Beauchamps Arbeit für die Kommission verlief parallel zu seiner universitären Zusammenarbeit mit James Childress. Als Ergebnisse wurden kurz hintereinander der Belmont Report (1978) mit den Prinzipien „respect for persons“, „beneficence“ und „justice“ und die erste Auflage des von Beauchamp und Childress geschriebenen Buchs Principles of Biomedical Ethics (1979) veröffentlicht. In diesem Buch wird „respect for persons“ zuerst als „autonomy“ und später als „respect for autonomy“ interpretiert und als zusätzliches Prinzip zu „beneficence“ und „justice“ noch „nonmaleficence“ geführt. Principles of Biomedical Ethics liegt derweil in der fünften Auflage vor (Beauchamp, Childress 2001) und gehört zu den einflussreichsten bioethischen Werken, das neben seiner akademischen Wirkung auch als praktisches Lehrbuch explizite Anwendung und Zuspruch erfährt. Die in diesem Buch zuerst so explizierten Prinzipien prägen seitdem bioethische Diskurse und dienen auch als Instrumentarium in Bewertungen von Public Health und Public Health Genetik relevanten Berichten (Droste / Gerhardus / Kollek 2003; siehe auch Lühmann / Bartel / Raspe in diesem Band). Häufig wird der Ansatz allerdings auch auf die Nennung der vier Prinzipien reduziert. An diesen Aspekt knüpft Kritik an, mit der sich auseinandersetzen muss, wer politikberatende Berichte, die sich auf mittlere Prinzipien stützen, verfasst. Bernard Gert, K. Danner Clouser und Charles Culver bemängeln beispielsweise eine in der Praxis häufig beobachtete dogmatische Akzeptanz und unreflektierte Anwendung der vier Prinzipien. Ihnen erscheinen Beauchamp und Childress’ Prinzipien lediglich wie Checklisten, unfundierte Faustregeln oder sogar nur Erinnerungshilfen, da ihrem Ansatz keine umfassende ethische Theorie zugrunde liegt (Gert, Culver & Clouser 1997). Prinzipiismus („principlism“) ist ein Ansatz, definieren Gert et al., der Prinzipien in den Mittelpunkt stellt, ohne eine Theorie vorzuweisen, aus der diese abgeleitet werden. Hier wird einem Anthologie Syndrom stattgegeben, in dem die Prinzipien unverbunden nebeneinander stehen, wodurch moralisches Denken undeutlich dargestellt und die Anwendbarkeit von Prinzipien unmöglich wird. 529u Ethik der Public Health Genetik Beauchamp und Childress argumentieren, dass man bioethische Prinzipien nicht allein aus einer Theorie generieren kann. Für sie ist es eindeutig, dass eine prinzipielle Übereinstimmung über ethische Normen auf der Generalisierungsstufe von Prinzipien geschehen kann, unbesehen möglicher Hintergrundtheorien, die ohnehin erst nachträglich von den Theoretikern konstruiert werden, um ihre moralische, prinzipielle Überzeugung zu rekonstruieren. Dass sich Menschen auf Prinzipien einigen können, postulieren Beauchamp und Childress, ist aufgrund der Normen der „common morality“ möglich, die man sich wie eine „initial shared data base” aller Menschen vorstellen muss. Letztlich ist es auch für den Bereich der „public policies“ – und so auch für das konkrete Anliegen, moralische Eckpunkte für die Implementierung von Genetik in die Zielvorstellungen von Public Health festzusetzen – nur notwendig, dass man eine Übereinstimmung über Prinzipien hat und nicht über die Hintergrundtheorien. Insofern ist für Beauchamp und Childress diese mittlere Axiomatik für die Anwendung durchaus ausreichend und eine vielversprechende Ausgangsbasis, die zudem eine weltanschauliche Offenheit in Bezug auf ethische Begründungen respektiert. Dass Beauchamp und Childress Prinzipien fokussieren, liegt also an ihrer Überzeugung, dass Prinzipien auf einem abstrakten Niveau die generellsten und umfassendsten moralischen Normen darstellen. Prinzipien sind für Beauchamp und Childress prima facie gültig. Das bedeutet, dass sie nicht absolut gelten, sondern abgewogen werden können. Wenn aber kein gewichtiger Grund dagegen spricht, gelten sie. Mit dieser moralpragmatischen Regel wird natürlich keine moraltheoretische Begründung geliefert, aber in heuristischer und genealogischer Perspektive die Beweislastigkeitsfrage moralischer Bewertung, aber auch die Frage nach der semantischen Füllung der jeweiligen mittleren Prinzipien gestellt. Ihre Prinzipiengruppe stellt einen Rahmen dar, innerhalb dessen man moralische Probleme identifizieren und über diese reflektieren kann. Dieser Rahmen aus prima facie Prinzipien ist inhaltlich noch nicht besonders gehaltvoll. Diese Prinzipien sind noch „dünn“ und an sich nicht fähig, die moralisch relevanten partikularen Nuancen konkreter Umstände kontextsensibel zu adressieren. Es können zwei Strategien angewandt werden, um Prinzipien stärker oder „dicker“ zu machen: „balancing“ und „specification“. „Specification“ bedeutet, den Geltungsbereich der jeweiligen Norm zu verfeinern. Und „balancing“ meint eine Gewichtung der Normen. Im „balancing“ werden die Normen, die nur ein relatives Gewicht haben, gegeneinander abgewogen. Diese Konfliktlösungsstrategie ist besonders zentral für die Erörterung von Einzelfällen. Spezifikation sehen Beauchamp und Childress hingegen als besser geeignet für die Entwicklung von politischen Handlungsstrategien, t530 Genetik in Public Health Te i l 2 / 2 0 0 7 weil hier aus den abstrakteren Normen – also beispielsweise den vier Prinzipien – Regeln konkretisiert werden. Die Spezifikation muss so geschehen, dass sie mit den anderen Normen noch kohärent ist. Hierbei werden möglicherweise konfligierende Normen so lange ausdifferenziert, bis der konkrete Konflikt gelöst ist. In einzelnen Fällen würde also ein spezifiziertes Prinzip in seiner Ausformulierung die anderen Prinzipien mit berücksichtigen – beispielsweise indem diese das Prinzip flankieren oder „in check“ halten. Die Spezifikation von Prinzipien ist nach Ansicht von Beauchamp und Childress besonders geeignet, um Leitlinien zu erstellen, weil hier generelle Normen für konkrete Konfliktfelder ausdifferenziert werden. Von europäischen Kritikern wird angemerkt, dass andere Prinzipien, die besonders in Europa gewachsen sind – wie bspw. Solidarität oder Verletzlichkeit – und auch Tugenden bei Beauchamp und Childress nicht hinreichend berücksichtigt werden bzw. anstelle von Prinzipien fokussiert werden sollten. Letztlich, so scheint es, obliegt es aber auch einer Interpretation der Prinzipien, was diese jeweils bedeuten (je nach Interpretation resp. Spezifikation können Solidarität und „justice“ oder Verletzlichkeit und „beneficence“ synonym gebraucht werden). Eine sic et non Entscheidung, entweder auf „europäische“ Prinzipien oder die von Beauchamp und Childress zu rekurrieren, wäre ein Dogma der gegenseitigen Ausschließlichkeit, das für Fortschritt im bioethischen Diskurs wenig hilfreich ist (Häyry 2003). In jedem Fall darf der Rekurs auf mittlere Prinzipien nicht darüber hinweg täuschen, dass die Gesellschaft als ganze sowie durch ihre Bürger, Bürgergruppen, aber auch Interessensverbände vor der Aufgabe steht, den hinter den mittleren Prinzipien stehenden moralischen Vorstellungen wie wohlüberlegten moralischen Urteilen konkretes Leben einzuhauchen. Zu dieser anzuerkennenden Lebendigkeit gehört dann aber auch die Anerkenntnis, dass bisweilen trotz „specification“ und „balancing“ der einzelnen Prinzipien es zwischen ihnen zu tief greifenden Konflikten kommen kann (Leist 1998, 768; Dabrock 2002; Dabrock 2005). Dennoch helfen die so verstandenen mittleren Prinzipien, im Dickicht angewandter Ethik zur nicht unerheblichen Vorklärung, einen „overlapping consensus“ in einer pluralen Gesellschaft zu finden. Zu ihrem neuzeitlichen Kern zählt dabei vor allem der Autonomierespekt. Entsprechend verwundert seine Bedeutung für Public Health Genetik nicht. 531u Ethik der Public Health Genetik 3.5.Normative Implikate für Public Health Genetik aus der individuumsbezogenen Humangenetik 3.5.1. Autonomierespekt durch Informed Consent? Mit der Betonung auf „Autonomie“ und Autonomierespekt wurde ein medizinethisches Anliegen verfolgt, das in der Etablierung des Instruments des „informed consent“ in medizinischer Praxis und Forschung eine ihrer wichtigsten Ausprägungen hat. Das Ziel des „informed consents“ ist es, Patienten oder Probanden über Verfahren und Risiken von medizinischen Interventionen hinreichend zu informieren, damit diese wohlinformiert einer Behandlung oder einem Versuch, dessen Chancen und Risiken sie mit Hilfe eines Arztes abschätzen können, aufgeklärt zustimmen. Nach einer informierten Zustimmung soll diese Entscheidung als aufgeklärt und selbstbestimmt, als freiwillig angesehen werden können. Die dahinter liegende Idee ist es, die Fähigkeit zur Selbstbestimmung („Autonomie“) der Person zu respektieren und mit diesem Modell dem Wandel einer paternalistischen Arztethik zu einer die Würde des Patienten/Probanden respektierenden Ethik zu vollziehen. Man könnte die Notwendigkeit, einen „informed consent“ vor substantiellen Interventionen einzuholen, als eine Spezifikation des AutonomierespektPrinzips beschreiben. Bedingungen für einen sinnvollen und effektiven „informed consent“ sind die Fähigkeiten des betreffenden Probanden oder Patienten, die Reichweite eigener Entscheidungen absehen und die Möglichkeit freiwillig entscheiden zu können. Der Arzt muss in einem Aufklärungsgespräch die Informationen offen legen und erklären, die für die geplante Intervention relevant sind – wobei diese Relevanz sicherlich von Arzt zu Arzt verschieden interpretiert wird: Ab welcher Wahrscheinlichkeit sind Risiken wichtig zu kommunizieren? Welche Informationen verunsichern den Patienten so sehr, dass der therapeutische Nutzen einer Intervention fragwürdig wird? Ferner sollte der Arzt, so wird oft gefordert, dem Patienten einen Plan vorschlagen, wie in seinem Fall vorzugehen ist. Dies ist im therapeutischen Arzt-Patienten Verhältnis sicherlich von anderer Bedeutung als im Verhältnis von Forscher zu Proband. Die dem Patienten bzw. Probanden gegebenen Informationen müssen sodann von diesem verstanden werden, soll ein gültiger „informed consent“ stattfinden. Nur dann kann der Patient oder Proband sich autonom für die Intervention entscheiden, den behandelnden Arzt oder Forscher autorisieren und so letztlich die informierte Zustimmung geben (Beauchamp & Childress 2001; Faden & Beauchamp t532 Genetik in Public Health Te i l 2 / 2 0 0 7 1986, S. 235ff). Hier sind Elemente beschrieben, die – wenn sie erfüllt werden – einen „validen“ „informed consent“ darstellen. Ob diese Validität zumindest im therapeutischen Verhältnis immer erreicht wird, darf bezweifelt werden, befindet sich doch ein Patient oft in großer Not und möchte dem Arzt einfach vertrauen. „Machen Sie, was Sie tun würden, wenn Sie an meiner Stelle wären!“ ist vermutlich ein oft gehörter Satz, weil das Vertrauen in die Kunst des Arztes integratives Element der Arzt-Patient Beziehung ist. Trost, Selbstvertrauen und klare Handlungsanweisungen durch den Arzt sind häufig wichtige und gesuchte Kommunikationsformen. Aber es gibt auch Kritik am „informed consent“, der man sich für eine mögliche Nutzung eines „informed consent“ in Public Health Genetik stellen muss. Der „informed consent“ erscheint für Kritiker vielmehr wie ein ritualisierter Vertrauensbeweis des Patienten gegenüber dem Arzt als eine wirkliche, faktische Einwilligung nach Aufklärung (vgl. die Diskussion in Tauber 2003). Gesunde Personen treffen Vereinbarung eher in der Sprache der „Verträge“. Warum sollten gesunde Personen, die in Interaktion treten, also nicht „informed contracts“ etablieren, statt sich des Instruments des „informed consent“ zu bedienen? Der „informed consent“ etabliert einen stillschweigenden (Behandlungs-)Vertrag. Warum diesen nicht explizieren? In der genetischen Forschung treffen sich häufig Gesunde, die ein partnerschaftliches Abkommen schließen können. Natürlich muss ein „informed contract“ die auf für einen „informed consent“ grundlegenden Bedingungen wie Freiwilligkeit und Offenlegung aller relevanter Informationen erfüllen. Bietet ein „informed consent“ zumeist nur die Möglichkeit der Aufklärung und Zustimmung (O’Neill 2002), also der Wahl eines „Alles oder Nichts“, liegt es im Wesen eines Vertrags, Details festzulegen und gegebenenfalls sogar auszuhandeln. Da die Probanden solcher genetischer Studien oft gesund sind, bietet sich für diese mehr Zeit zur Reflexion und freien Entscheidung. Individuell könnte ausgemacht werden, ob Spender über mögliche genetische Ergebnisse, die individuell für sie interessant sein könnten, informiert werden. Auch hat der „informed consent“ selten die Möglichkeit eingeräumt, dass es Möglichkeiten gibt, die in der Forschung gewonnenen Gewebe und Daten für verschiedene, auch noch nicht festgelegte Zwecke über längere Zeiträume zu speichern und zu verwenden. Diesem Aspekt, dass man gewisse Gewebeproben schon aus frühen, alten Studien besitzt, aber nicht weiß, wie oder ob man diese nutzen darf, weil speziell hierfür kein „informed consent“ 533u Ethik der Public Health Genetik vorliegt, kann man in einem Kontraktmodell besser begegnen. Der mögliche Nutzen, der sich für Proband und seine Familie aus der Forschung ergeben würde, ist bisher selten im „informed consent“ berücksichtigt worden (Sass 2001; siehe auch Sass in diesem Band). Die beiden Vertragspartner können die Verträge individuell gestalten. In den Verträgen können sie festlegen, ob oder was Probanden wissen möchten oder ob von den Probanden Interaktion der Forscher in der weiteren Familien gewünscht wird oder nicht. In einem Vertrag können beide Seiten ihre Rechte und Pflichten besonders gut definieren. 3.5.2. Autonomierespekt durch Vertraulichkeit 3.5.2.1. Datenschutz, Schweigepflicht Im Bewusstsein, dass eine „Schweigepflicht des Arztes“ besteht (rechtlich festgeschrieben in § 203 StGB), geben sich die meisten Patienten heutzutage zufrieden, um ein vertrauensvolles und offenes Verhältnis zu ihrem Arzt zu pflegen. In der Regel haben sie keine Angst, dass sie stigmatisiert oder gesellschaftlich gar ausgeschlossen werden, wenn sie wegen tabuisierter Krankheit oder Symptome (zum Beispiel Hämorrhoiden, Verletzung aufgrund ungewöhnlicher sexueller Praktiken oder Fußpilz) bei ihrem Arzt waren. Dass die gewonnenen und dokumentierten Informationen, seien sie direkt gesundheitsbezogen oder familiär-sozialer Natur, dabei das intime Verhältnis von Patient und Arzt verlassen, wird oftmals übersehen. Praxismitarbeiter, Apotheker, weitere Ärzte und Pflegepersonal erhalten Einblick in diese Informationen, wenngleich sie die Informationen auch vertraulich handhaben sollen. Für Macklin hat die Annahme, dass genetische Informationen vertraulich behandelt werden sollen, zwei Grundlagen. Eine Grundlage findet diese Annahme darin, dass in westlichen Kulturkreisen die Privatsphäre geachtet wird. So ist es relativ unproblematisch, wenn der Arzt intime Fragen stellt. Die zweite Grundlage dieser Annahme sieht Macklin in der Rolle des Arztes und des Zwecks des Arztbesuchs, dem Patienten zu helfen, also dem Prinzip „beneficence“ zu folgen (Macklin 1992). Es scheint entsprechend nicht unplausibel zu folgern, dass die Schweigepflicht des Arztes und der Datenschutz, so wie es für bisherige medizinische Informationen galt, auch für genetische Informationen aufrecht erhalten wird – und andere Personen einschließt, die die Ergebnisse genetischer Diagnostik erfahren (beispielsweise Labormitarbeiter). Diese Personengruppen können ggf. auch explizit in den Personenkreis aufgenommen werden, den § 203 StGB festschreibt (Deutscher Bundestag 2002). t534 Genetik in Public Health Te i l 2 / 2 0 0 7 Ärztliche Schweigepflicht und Datenschutz müssen vermutlich für den Bereich der genetischen Intervention nicht strenger reguliert werden als bei anderen medizinischen Interventionen. Datenschutz, Schweigepflicht und Respektierung der Privatsphäre allein können aber nicht die Lösung aller Informationsprobleme für die Konfliktbereiche der genetischen Information sein (Schröder 2004). Einige Herausforderungen werden im Folgenden gezeigt. 3.5.2.2. Datenübermittlung zu Partnern und Verwandten Die Schweigepflichtproblematik ist ein Thema der Bioethik seit den frühen Tagen dieser Disziplin. Prominent diskutiert wurde der „Tarasoff Fall“, in dem der Student Prosenjit Poddar seine Kommilitonin Tatiana Tarasoff nach Vorankündigung bei seinem Psychologen Lawrence Moore, der Tarasoff nicht warnte, tötete. Schweigepflicht, Datenschutz und medizinische Informationen treffen im familiären Kontext, der für die Genetik als Lehre von der Vererbung natürlich von besonderer Wichtigkeit ist, in verschiedenen Konfliktfeldern zusammen. Soll ein Hausarzt einer unwissenden Ehefrau sagen, dass sich ihr Ehemann mit HIV infiziert hat? Wo ist die Grenze der Vertraulichkeit medizinischer Informationen? Wann ist das Potential der Drittschädigung so groß, dass diese Informationen weitergegeben werden müssen und gegen das Selbstbestimmungsrecht der einzelnen Person verstoßen werden kann? Dass dies nur im äußersten Einzelfall geschehen kann, ist allein deshalb offensichtlich, weil ansonsten das notwendige Vertrauensverhältnis von Patient zu Arzt unterwandert und ausgehöhlt würde und ganze gesundheitssystemische Institutionen in Frage gestellt würden. Dass diese Weitergabe von Informationen noch nicht gerechtfertigt ist, wenn es darum geht, im Einzelfall einem Betrieb oder einer Versicherung bessere Bilanzen zu verheißen, scheint plausibel. Es gibt empirische Hinweise, dass im Bereich der genetischen Prädiktion Betroffene dazu tendieren, ihr genetisches Wissen generell den anderen Familienmitgliedern mitzuteilen (Smith, Croyle 1995). Somit kann Information innerhalb der Familie als Stigmatisierungs- und Diskriminierun gsgrundlage dienen. Ein Verweis auf die Möglichkeit, den Status „einfach“ nicht weiter zu sagen, scheint eher für Ausnahmefälle zuzutreffen. Auch ist es im Einzelfall durchaus sinnvoll – ja vielleicht sogar moralisch geboten –, anderen Familienmitgliedern von einem genetischen Status zu erzählen, damit diese entscheiden können, wie sie mit ihrem persönlichen Risiko umgehen. Vielleicht können aufgrund der Informationen Präventionsmaßnahmen folgen oder Lebenspläne geändert werden. 535u Ethik der Public Health Genetik Mit der Möglichkeit der genetischen Prädiktion wird es entsprechend auch Problemsituationen im Zusammenhang mit der Schweigepflicht geben. Eine Motivation für eine Person, ihr Wissen über ihre Prädisposition nicht an relevante Verwandte weiter zu geben, kann die Angst vor Exklusion, Vorwürfen, Stigmatisierung und Diskriminierung innerhalb der Familie sein. Eine Frage in diesem Kontext ist dabei, wann es geboten erscheint, seine „Privatsphäre“ mit anderen zu teilen. Zimmerli beantwortet diese Frage wie folgt: „It is quite obvious that every human being has a moral right to preserve his/her genetic privacy, at least to the same extent as he/she has the right to preserve his/her social privacy. However, it is equally obvious that nobody should be entitled to claim genetic privacy if somebody else, and/or a higher value, would be seriously endangered by it. On the basis of this we already see that genetic privacy is not an unconditionally defendable ‚categoric’ good. Given, for example, that knowledge about the genetic constitution of a given person could help to protect other people, or to prevent the person concerned from committing criminal acts, it would not be sufficient to claim individual genetic privacy.“ (Zimmerli 1990, S. 96; HiO) Konfliktfälle können auftreten, wenn der behandelnde Arzt oder Berater erkennt, dass gegen die Interessen eines Verwandten oder Partners vehement verstoßen werden. Soll der Arzt jemandem sagen, dass er im Risiko zu einer Krankheit steht, die man gegebenenfalls positiv beeinflussen kann? Dürfen Kinder testen, wenn Eltern ihren Status nicht wissen wollen? Abgesehen von den plausiblen moralischen Ausführungen, die Zimmerli darstellte, stellt sich die Frage, wie diese Konflikte rechtlich gelöst werden können. Hier besteht Diskussions- und Handlungsbedarf, denn diese Konfliktfälle von Schweigepflicht auf der einen Seite und Schadensverbot und Chancengleichheit auf der anderen Seite werden sehr häufig in Stellungnahmen oder „Policy Papieren“ nicht berücksichtigt. Hier hat der Schweizer Gesetzvorentwurf „Bundesgesetz über genetische Untersuchungen beim Menschen“ eine Differenzierung und institutionelle Möglichkeit explizit berücksichtigt, wie mit solchen Konfliktfällen umgegangen werden kann. Es wird vorgesehen, dass Ärzte in Konfliktsituationen eine Entbindung vom Berufsgeheimnis bei einer kantonalen Behörde beantragen können, um überwiegende Interessen von Verwandten oder (Ehe-)Partnern zu wahren. Die Behörde hat die Möglichkeit, eine Expertenkommission zur Beratung zu hören (Die Bundesversammlung der Schweizerischen Eidgenossenschaft 2002). t536 Genetik in Public Health Te i l 2 / 2 0 0 7 3.5.2.3. Datenübermittlung zu Versicherungen und Arbeitgebern – Das Beispiel gendiagnostischer Prädiktion Wenn sich Gendiagnostik bevölkerungsbezogen ausweitet, werden Konflikte mit Versicherungen und in der Arbeitswelt virulent. Die Initiative „1000 Fragen“ hat im Zusammenhang mit postnataler genetischer Prädiktion eine Frage zum Versicherungswesen auf einem Plakatmotiv dargestellt. Die Frage, die M.S. aus Wetzlar zugeordnet wird, lautet: „Will ich alles wissen oder nur meine Versicherung?“3 Der Versicherer will – so versichern uns Versicherer (vgl. Artikel von Wandl in diesem Band) – nicht unbedingt alles wissen (und wenn er wollte, dürfte er auch nicht alles wissen). Der Versicherer will nur wissen, was der Versicherungsnehmer auch weiß, um eine faire Wissensparität zu bekommen. Da der Versicherer aber nicht immer wissen kann, was der Versicherungsnehmer weiß, ergeben sich Probleme. Wer selbst nichts über seinen genetischen Status wissen will, muss eventuell in Kauf nehmen, eine Versicherung nicht oder nur mit Risikoausschluss zu bekommen. Diese Einschränkungen gelten aber nicht nur für Gentests im Kontext der Versicherungen, sondern auch bei der Risikobewertung eines Versicherungsbewerbers für Cholesterinspiegel, Bluthochdruck und für die versicherungsmathematische Einschätzung anderer Risikofaktoren (von Beruf bis Lebensstil). Dies erscheint solange mit einem gerechten Versicherungssystem vereinbar, solange eine Grund(ver)sicherung jedem Menschen garantiert ist, die ihm eine Freisetzung der Handlungsfähigkeit und „Befähigung zu einer längerfristig integral-eigenverantwortlichen Lebensführung zum Zwecke der Teilnahmemöglichkeit an sozialer Kommunikation“ (Dabrock 2001, S. 206; HiO) ermöglicht. So wäre die Nutzung von Gendiagnostik beziehungsweise die Einbeziehung ihrer Ergebnisse in die medizinische Risikofaktorenabschätzung der privatwirtschaftlichen Versicherer gerechtigkeitstheoretisch zulässig, solange eine Sozialversicherung beziehungsweise gesicherte Privatversicherung Befähigung absichert. Im Bereich der Arbeitswelt ist nach weiterer Verbreitung prädiktiver Gendiagnostik folgendes Szenario denkbar: Ein Bewerber legt ein Gesundheitszeugnis vor, aus dem hervorgeht, dass er für keine spätmanifesten Krankheiten oder Suszeptibilitäten prädispositioniert ist oder dass er andere „gute Gene“ hat. Ein Mitbewerber will aber kein solches Zeugnis vorlegen. Wie sollte der Arbeitgeber mit einer solchen Situation umgehen (dürfen)? Der Arbeitsplatz, um den sich die Bewerber bemühen, bedeutet kein Sicherheitsrisiko bei einem Krankheitsschub oder -ausbruch. Es ist auch 3 http://www.1000fragen.de/index.php?mo=4&pt=3&pi=25 537u Ethik der Public Health Genetik kein Beruf, in dem man mit bestimmten arbeitsplatzspezifischen Stoffen, die bei bestimmten Menschen krankheitswertige Reaktionen hervorrufen können, in Berührung kommt. In einem solchen Fall darf der Arbeitgeber wohl nicht verlangen, seine Arbeitnehmer zu testen, oder gendiagnostische Informationen, die vom Arbeitnehmer vorgebracht werden, verwenden. Eine Möglichkeit wäre, dem Arbeitnehmer mit dem Gesundheitszeugnis gesetzlich zu verbieten, dieses vorzuzeigen, wohingegen der Arzt, der den Arbeitnehmer auf seine Eignung untersucht, später nur seine arbeitsplatzspezifische Eignung überprüft. Dem Amts- oder Betriebsarzt kommt daher in Zukunft wohl generell eine neue, besondere Verantwortung zu: Er muss wissen, ob relevante Prädispositionen – um die er vom Arbeitnehmer weiß – ein berufsbezogenes Sicherheits- oder Gesundheitsrisiko ausmachen. Ist dies der Fall, kann er dem Arbeitgeber die Einstellung nicht empfehlen; der Arbeitnehmer sollte aber die Chance erhalten, durch einen Gentest eine mögliche Nichtbetroffenheit nachzuweisen, durch die das Wissen um das familiäre Risiko gegenstandslos wird. Sollte das Ergebnis negativ ausfallen, die Person aber trotzdem aufgrund dieses „Gesundheitsrisikos“ nicht eingestellt werden, läge hier eine klare Diskriminierung vor. In dieser Hinsicht ist diese Untersuchungsmethode nur eine Weiterführung bisheriger Methoden. In Fällen dagegen, in denen kein Gesundheits- oder Sicherheitsrisiko an dem zur Disposition stehenden Arbeitsplatz besteht, muss der Betriebsarzt das Wissen um die Prädisposition des Bewerbers für sich behalten und kann „grünes Licht“ für die Einstellung geben. Die Gesundheitsinformationen, die der Betriebsarzt gewonnen hat, müssen vor dem Arbeitgeber vertraulich behandelt werden. Vergessen werden darf aber nicht, dass für Arbeitnehmer Gendiagnostik vor der Einstellung prinzipiell auch Chancen darstellen kann: „Insgesamt können genetische Analysen bei sinnvollem Einsatz eine wertvolle Hilfe für die Berufs- und Lebensplanung sein.“ (Hennen et al. 2001, HiO) Ein Beispiel wäre, wenn vor der Wahl der Lehre festgestellt werden kann, dass jemand empfindlich auf Stoffe reagiert, mit denen er in dem angestrebten Beruf unweigerlich zu tun hat (Beispiel: Bäckerasthma). Ein allgemeines „Screening“ des Arbeitnehmers auf alle spätmanifesten und multifaktoriellen Krankheiten, die testbar sind, ist im Interesse des Arbeitnehmers nicht sinnvoll. Hier sollten die Interessen des Arbeitnehmers die des Arbeitgebers überwiegen, da ersterer innerhalb des Arbeitsverhältnisses zumeist in einer schwächeren Position ist. Der Arbeitgeber trägt so weiterhin wie bisher das Risiko der Erkrankung seines Arbeitnehmers (wie auch durch Unfall etc.). Sollte der Arbeitnehmer vor seiner Einstellung von einer genetischen Prädisposition wissen, sollte er vielleicht sogar lügen dürfen, t538 Genetik in Public Health Te i l 2 / 2 0 0 7 wenn das Wissen nicht für den betreffenden Arbeitsplatz in Bezug auf Dritte relevant ist (z.B. größeres Unfallrisiko). Zusammenfassend formuliert: Gleiche Chancen muss es für die geben, die für einen Arbeitsplatz gleich qualifiziert sind, unbesehen ihrer allgemeinen gesundheitlichen (probabilistischen) Zukunft – aber nicht unbesehen möglicher arbeitsplatzspezifischer Suszeptibilitäten, die krankheitswertige Auswirkungen für den Arbeitnehmer haben können, oder wenn durch genetische Prädispositionen ein Sicherheitsrisiko besteht. 3.5.3. Verfahrenselemente 3.5.3.1. Arztvorbehalt vs. Arztoption? Vermutlich werden, auch um Public Health Ziele zu verfolgen, Gentests weitere Verbreitung finden. Dabei wird von einigen Personen und Institutionen gefordert, einen Arztvorbehalt für Gentests zu etablieren. Ein Arztvorbehalt, der auch von der Deutschen Forschungsgemeinschaft als unentbehrlich erachtet wird, bedeutet, einen Gentest nur bei ärztlicher Indikation „flankiert durch eine Verschreibungspflicht“ (Taupitz 2000, S. 38; vgl. Deutsche Forschungsgemeinschaft 2003). als zulässig zu sehen. Dadurch soll gewährleistet werden, dass die Ratsuchenden fachkundige Beratung und Interpretation der Ergebnisse bekommen. Auch die Bundesärztekammer votiert für einen Arztvorbehalt. Sie argumentiert mit dem Hinweis, dass genetische Prädiktion kein eindeutiges Wissen liefert und deshalb fachkundiger Interpretation bedarf (Bundesärztekammer 2003, S. 1298). Aber es gibt natürlich auch Einwände gegen einen Arztvorbehalt, die im Folgenden den Vorteilen gegenüber gestellt werden sollen. „Als Einwände gegen einen Arztvorbehalt werden diskutiert: n Eingriff in das allgemeine Persönlichkeitsrecht von Testwilligen n Die Ausführung des Rechts auf Wissen von Menschen wird eingeschränkt n Ärztinnen und Ärzte werden berechtigt, Befunde zu erheben, die per definitionem medizinisch irrelevant sind n Einschränkung der Berufsfreiheit derjenigen, die genetische Analysen inklusive Beratung ohne ärztliche Approbation anbieten wollen Als Vorteile eines Arztvorbehaltes sind zu bewerten: n Beschränkung der Durchführung von Gentests auf das etablierte System der medizinischen Versorgung 539u Ethik der Public Health Genetik n Qualitätssicherung n Der Einzelne wird davor geschützt, mit den Ergebnissen von Gentests unsachgemäß umzugehen (Unterstützung der Selbstbestimmung des Individuums) n Daten fallen unter das Arztgeheimnis n Verhinderung eines ‚freien Testmarktes’“ (Geisler 2001, HiO) Der dritte Einwand scheint wenig plausibel. Ärzten ist es bereits zu Recht gestattet, „medizinisch irrelevante“ Befunde zu erheben beziehungsweise medizinisch irrelevante Handlungen durchzuführen. Als Beispiel sei hier das Polieren von Zähnen genannt. Es erscheint überzeugender, wenn bestimmte „per definitionem medizinisch irrelevant[e]“ Leistungen besser von Ärzten durchgeführt werden als von niemandem oder von „Quacksalbern“ oder „Scharlatanen.“ Der vierte Einwand ist sehr schwach, weil es auch andere Handlungen gibt, die Nicht-Ärzten verboten sind. Die ersten beiden Einwände hingegen sind gravierender; sie sind allerdings grundlegend identisch: Es geht hier um die Einschränkung der Selbstbestimmung des mündigen Bürgers. Diese Einwände würden dann unterminiert, wenn jeder Bürger bei Ärzten niederschwellig und günstig Gentests durchführen könnte: Entweder sie sind medizinisch indiziert und werden sogar von der Krankenversicherung bezahlt, oder sie werden wie individuelle Gesundheitsleistungen (IGEL) gehandhabt respektive von einer möglichen individuellen privaten (Zusatz‑)Versicherung abgedeckt. Bei einem solchen Modell kommt der Ratsuchende, der die Möglichkeit hat, jede Prädisposition, die testbar ist, zu testen, in den Genuss der Vorteile eines Arztvorbehalts, die Geisler in Punkten zwei bis vier nennt. Eine Schwierigkeit des Arztvorbehalts ist, dass er nicht praktikabel sein beziehungsweise vom Internetmarkt unterminiert werden könnte – vor allem dann, wenn bei einem virtuellen medizinischen Tourismus ausländische Angebote über das Internet auch von deutschen Bürgern bequem genutzt werden können. Diese Unterminierungspraxis könnte allerdings wiederum unterminiert werden, indem man nahezu alle möglichen Tests, also auch die „lifestyle-Tests“, einfach und kostengünstig – beziehungsweise kostenlos bei medizinischer Indikation – beim Arzt bekommt; zumindest eine Beratung, die losgekoppelt von dem käuflichen Erwerb eines Tests ist. Dadurch ist zumindest auch ein sachgemäßeres Verständnis durch die Interpretation des Arztes gegeben, sofern dieser dafür ausgebildet ist. Die krankheitsbezogenen Gentests sollten ohnehin in die grundlegenden medizinischen Versorgungsleistungen aufgenommen werden (beziehungsweise dort bleiben). Wenn sich ein Arztvorbehalt durchsetzt, muss also t540 Genetik in Public Health Te i l 2 / 2 0 0 7 zugleich gesichert sein, dass alle gesundheitsbezogenen Gentests von der gesetzlichen Krankenversicherung abgesichert werden beziehungsweise dies zum Basispaket von privaten Krankenversicherungen gehören sollte und ferner auch nicht solidarisch finanzierte Gentests über den Arzt oder Berater – gegen eigene Bezahlung – erfolgen können, damit sachgemäße Interpretation gewährleistet bleibt. Jedoch liegt dem Arztvorbehalt ein Wertungswiderspruch zugrunde, der sich auf die Mündigkeit des Ratsuchenden bezieht. Mit gleicher Begründung des Arztvorbehalts dürften nämlich auch Schwangerschaftstest, Blutdruckmessgeräte oder ähnliches nicht in Apotheken, Supermärkten und Drogerien verkauft werden, weil diese viele Eigenschaften mit prädiktiven Gentests teilen. Auch wenn ihre Ergebnisse nicht so interpretationsoffen sind, so können sie doch falsch sein (zum Beispiel durch falsche Anwendung) und gerade Schwangerschaftstests können einzelnen (beispielsweise jungen Teenagern) nahezu „fatales Wissen“ liefern, das ebenfalls mehrere Menschen anbelangt. Wenn also problematisch am Arztvorbehalt ist, dass er die Möglichkeit des mündigen Ratsuchenden nicht genügend respektiert und für ihn nur unter Inkaufnahme eines Wertungswiderspruchs argumentiert werden kann, könnte dann ein eingeschränkter Markt mit Zertifizierungsmethoden eine Option sein. Zertifizierte Gentests könnten außerhalb der Arzt- oder Beraterpraxen verkauft oder angeboten werden; zum Beispiel in Apotheken, wo Bürger bereits Blutdruck, Gewicht, Blutzucker etc. messen lassen können. Hier könnte eine „Drogerien-“ oder „Apothekenpflicht“ gelten. Dies könnte beispielsweise für Tests gelten, die zwar krankheitswertige Aussagen, aber kein „fatales Wissen“ (wie beispielsweise ein Test auf die Huntingtonsche Krankheit) liefern können – wie dies im Zusammenhang mit den für Public Health Genetik besonders relevanten multifaktoriellen Volkskrankheiten der Fall ist – und deren Ergebnis und dessen Implikationen leicht verständlich für den Laien sind (sofern solche Tests dereinst verfügbar würden). Wenn ein Test, den der Bürger beispielsweise in einer Apotheke durchführt, positiv ist, kann er dies außerdem – genau wie bei diagnostiziertem Bluthochdruck, hohem Blutzucker oder nach festgestellter Schwangerschaft – zum Anlass nehmen, einen Arzt aufzusuchen. Diese zertifizierten Tests, die man dann in Apotheken und/oder Drogerien erwerben könnte, müssten aber nicht wahrgenommen werden und würden vermutlich weniger nachgefragt werden, wenn es weiterhin die Arztoption gibt, die bedeutet, dass alle Gentests niederschwellig über den Arzt zugänglich sind – eine Arztoption wäre also wie ein Arztvorbehalt mit der kleinen 541u Ethik der Public Health Genetik Einschränkung, dass zertifizierte Gentests, die kein fatales Wissen liefern können, auch anders erwerbbar sind. 3.5.3.2. Was bedeutet Bindung an Gesundheitszwecke für Public Health Genetik? Die Verfügbarkeit genetischer Diagnostik könnte ferner, wie bereits angesprochen, über eine Bindung von Gendiagnostik an Gesundheitszwecke reguliert werden. Bedeutet Bindung an Gesundheitszwecke oder medizinische Zwecke jedoch, nur solche Gentests zu erlauben, die therapeutische oder präventive Maßnahmen nach sich ziehen lassen können, wäre dies wenig plausibel. In dem Fall könnten zum Beispiel außer im Bezug auf Familienplanung keine Tests auf die Huntingtonsche Krankheit zugelassen werden. Gentests auf die Huntingtonsche Krankheit können aber individuell sehr sinnvoll sein, auch um fernab der Familienplanung die eigene Lebensplanung beeinflussen zu können. Und Personen, die schon mit einem solchen familiären Schicksal belastet sind, sollten nicht hier auch noch bevormundet oder gezwungen werden, ihren Wunsch zu pathologisieren, damit ihm Folge geleistet werden kann. Überzeugender ist es, nur diejenigen Tests solidarisch zu finanzieren, die aussagekräftig sind und gesundheitlichen Nutzen mit sich bringen und etwas weitläufiger auch die Lebensplanung beeinflussen können. 4. Public Health Genetik und soziale Gerechtigkeit In den bisherigen eher auf die Schutz- und Entfaltungsmöglichkeiten des Einzelnen zielenden Ausführungen wurde schon mehrfach vom ethischen Kriterium der Befähigung zur eigenverantwortlichen Lebensführung ausgegangen. Spätestens an dem Punkt, an dem deutlich wird, dass diesem individuumsbezogenen Anspruchsmaß immer auch ein gesellschaftliches Verpflichtungsmaß entspricht, muss sich die Blickrichtung hinwenden zur sozialtheoretischen Begründung des Befähigungskriteriums aus dem sozialethischen Grundkriterium der Gerechtigkeit. Damit bekommt ein weiteres der mittleren Prinzipien für die Ethik von Public Health Genetik materielle Konturen. Dass Gerechtigkeit bei der Gestaltung von Public Health Genetik prägend sein muss, lässt sich durch einen einfachen Syllogismus zeigen: „Gerechtigkeit ist die höchste Tugend sozialer Institutionen.“ (Rawls 1975, S. 17). So steht es auf der ersten Seite eines der einflussreichsten Werke der neueren Philosophiegeschichte: der voluminösen Theorie der Gerechtigkeit von John Rawls. Public Health Genetik meint – wie erwähnt – die Integration genetischen Wissens in Public Health. Public Health zielt auf die öffentliche Sorge um die Gesundheit aller und wird von öffentlichen oder paraöffentlichen Institutionen verantwortet. Deshalb muss Public Health Genetik wie t542 Genetik in Public Health Te i l 2 / 2 0 0 7 Public Health sich mit der ersten Tugend sozialer Institutionen, der sozialen Gerechtigkeit auseinandersetzen. Entsprechend diesem Syllogismus wird erst die Entfaltung des mittleren Prinzips „Gerechtigkeit“ durch das schon mehrfach erwähnte, aber noch nicht hinreichend begründete Maß der Befähigung dargestellt, um anschließend zu zeigen, wie sich dieses auf die Fragen der Genetik in der öffentlichen Gesundheitsversorgung auswirkt. 4.1.Auszuschließende soziale Verpflichtungsrelationen in der „sozialen Demokratie in den Formen des Rechtsstaats“ Weil die „soziale Demokratie in den Formen des Rechtsstaats“ (BVerfGE 5, 85/198) keine weltanschauliche Werte- und Lebensdeutungsgemeinschaft bildet, sondern weil der moderne Rechtsstaat zunächst nur die Freiheit des einen gegen die Freiheit des anderen zu schützen hat, können in seinem Rahmen moralisch-perfektionistische oder umfassende Programme wie beispielsweise eine bestimmte gesundheitsförderliche Lebensweise nicht verallgemeinert werden. Zudem können pauschale Ansprüche auf strikte soziale Gleichheit auch nicht vor dem eigentumstheoretischen Axiom der Neuzeit bestehen; schließlich implizieren solche Forderungen, sollen sie sozialrechtlich durchgesetzt werden, zwangsbewehrte Umverteilungsstrategien und damit Eingriffe in Eigentum und Freiheit der Bessergestellten. Zudem widersprechen sie dem allgemeinen Gleichheitsgrundsatz, der ja festlegt, dass Gleiches gleich und folglich Ungleiches ungleich zu behandeln ist. Dabei stünden sie ferner kontrovers zum Solidaritätsgrundgedanken, dass der Kranke und nicht der Gesunde der Hilfe (vgl. Mk 2, 17) und folglich ersterer eines größeren Anteiles an möglichen Umverteilungen oder gemeinsamen Ressourcen bedarf. Aber auch andere sozialethischen Alternativkandidaten halten der Prüfung für die Bestimmung sozialer Verpflichtungsrelationen nicht stand: Reine Nutzentheorien können ausgeschlossen werden, weil sie die Suche nach dem Guten nicht mit der Achtung der Rechte jedes Einzelnen verknüpfen (Höffe 1987). Insofern das Verständnis von Wohlergehen stark von subjektiven Empfindungen abhängt, sind darauf aufbauende Theorien nicht verallgemeinerungsfähig (Pauer-Studer 2000) und insofern für die pragmatische Ausgestaltung sozialer Gerechtigkeit unbrauchbar. Radikale Freiheitstheorien blenden die politische Notwendigkeit ab, grundlegende Rechte für jede Person anzuerkennen; sie leben a) theoretisch vom Abgrenzungsgestus gegenüber einem verzeichneten Egalitarismus, der eben nicht eine strikte, sondern nur eine Chancengleichheit zu erreichen sucht, b) politisch-pragmatisch von der Missachtung des Umstandes, dass auf breiter Basis öffentliche Gelder öffentliche Güter (Forschung etc.) investiert 543u Ethik der Public Health Genetik wurden, deren Erträge nach dieser Theorie nun rein marktwirtschaftlich abgeschöpft werden sollen. Das ist jedoch eine so nicht zu akzeptierende Ursprungsvergessenheit. 4.2.Decent minimum statt minimales Minimum Wenn eine im weltweiten Maßstab betrachtet als halbwegs wohlgeordnet und stabil zu charakterisierende Gesellschaft unter den Rahmenbedingungen des modernen, freiheitlich-liberalen, demokratischen, und auch das sei nicht vergessen: sozialen Rechtsstaats gerecht sein will (und sei es unter dem Nutzengesichtspunkt der Bewahrung ihrer Stabilität), dann kann sie das inhaltliche Maß der sozialen Gerechtigkeit nicht als minimales Minimum festlegen (verfassungsrechtlich definiert als Existenzminimum gemäß Art. 1 + 2 GG). Vielmehr muss sie sich um ein decent minimum, ein anständiges Minimum bemühen. Was ein decent minimum auszeichnet, wird zwar gesellschaftlich debattiert und mag sich von Gesellschaftsformation zu Gesellschaftsformation aufgrund seiner konstitutiven Kontextgebundenheit unterscheiden. Seine Bestimmung muss sich jedoch zumindest an den gesellschaftlich vorhandenen Konditionalgütern orientieren. Zu ihnen zählen materielle ebenso wie ideelle Güter wie z.B. Achtung und Anerkennung. Eine Bereitstellung von solchen Konditionalgütern darf sich begründungstheoretisch nicht nur aus politischer Solidarität oder aus der Wohltätigkeit von Bessergestellten ableiten, sondern erfüllt das begründungstheoretisch höher stehende Kriterium eines gerechten Anspruchs. Gegen die minimalistische Variante und für das anständige Mindestmaß sprechen moralische Intuitionen und diverse ethische wie sittlich-politische Rechtfertigungsstrategien: Eklatante Ungleichheiten, die die einen überproportional übervorteilen, während die anderen von fast allen Formen sozialer Kooperation ausgeschlossen würden, führen bei vielen Menschen (zumindest im Nahbereich) zu Protest- oder Empörungsreaktionen. Ein (mehr oder minder) ausgeprägter Sinn für Ungerechtigkeit scheint sich in fast allen bei der Wahrnehmung extremer Ungerechtigkeiten zu regen. Internationale Menschenrechtsabkommen, die inzwischen schon als globales, auf jeden Fall als europäisches Ethos gelten können, leiten aus der allen Menschen zugesprochenen Menschenwürde nicht nur bürgerliche Freiheit, politische und rechtliche Gleichheit, sondern auch das Recht auf Teilhabemöglichkeit am gesellschaftlichen Leben ab. Laut der in vielen Kulturen sich findenden Goldenen Regel als auch insbesondere ihrer moraltheoretischen Vertiefung im kategorischen Imperativ sind solche Handlungen und Entscheidungen zu verallgemeinern, die in jedem Menschen einen Selbstzweck sehen, dem mit innerem Respekt zu begegnen ist. Auch mit vertragstheoretischen Gedankenexperimenten lässt sich weniger emphatisch rechtfertigen, dass t544 Genetik in Public Health Te i l 2 / 2 0 0 7 auch gemäß eigennützigem Kalkül Anderen Lebenschancen zur Verfügung gestellt werden müssen. Selbst die minimalistische Anspruchstheorie der Gerechtigkeit, die nur das als gerecht betrachtet, was unter Beachtung fairer Verfahren angeeignet oder übertragen wurde, ist so auslegbar, dass zur fairen Prozeduralität die Befähigung zur Aneignung und Übertragung zählt. 4.3.Chancengleichheit als erste Präzisierung des decent minimum Bei der Bestimmung des decent minimum spielt der Verursachungshintergrund ebenso eine Rolle wie der Zweck und das Maß der Zuteilung: Insofern das decent minimum eines liberalen-demokratischen Rechtsstaats zunächst impliziert, dass Autonomierespekt Vorrang vor Umverteilung nach sich ziehenden Gleichheitsansprüchen besitzt, erscheinen vielen (jenseits eines minimalen Minimum) nur solche Ungleichheitsfolgen in der Gesellschaft kompensationsfähig und können als Pflichtgrund für eine Redistribution der Bessergestellten angesehen werden, die aus einer nicht verschuldeten Konstellation resultieren. (Über private Absicherungen und Versicherungen ist damit nichts ausgesagt.) Im Nachgang zu dieser Weichenstellung ist allerdings wiederum strittig, ob das Nichtverschuldungsprinzip nur für gesellschaftlich bedingte Ungleichheiten gilt oder auch schon bei natürlichen Ungleichheiten greift, sofern diese eine bedeutende gesellschaftliche Ungleichheit bewirken (Buchanan et al. 2000; dazu Dabrock 2003). Interessant an dieser Differenz ist die Wahrnehmung der bis heute in den unterschiedlichen Positionen transportierten Menschenbilder. In der nur an gesellschaftlichen Ungleichheiten orientierten Position, dem social structural view, zählt erstrangig nur der kooperationsfähige Mensch. Die Ungleichheit noch nicht oder insbesondere nicht mehr kooperationsfähiger Personen wird eher aus Klugheits- oder Solidaritäts-, denn aus originären Gerechtigkeitsgründen korrigiert, kompensiert oder nivelliert. Im brute luck view, der Position, die jede Form von Ungleichheit, sofern sie nur nicht selbstverschuldet ist, für korrekturbedürftig hält, wird das Menschenbild nicht so sehr vom Gedanken der Kooperationsfähigkeit, sondern grundlegender von realer Kommunikationsfähigkeit bestimmt. Wenn als Hintergrund das Nichtverschuldensprinzip als Bedingung für Umverteilungen gelten mag, so bleibt nach Ablehnung von Nutzen, strikter Gleichheit, Wohlfahrtsgleichheit und radikaler Freiheit als Zweck und Maß des Ungleichheitsausgleichs das im Übrigen von vielen intuitiv akzeptierte Maß der Chancengleichheit. Bei seiner Bestimmung kann es nicht nur aufgrund der Differenz von social structural view und brute luck 545u Ethik der Public Health Genetik view zu Divergenzen kommen, auch seine in die Debatte eingebrachten Subkriterien von Ressourcengleichheit, Wohlfahrtschancengleichheit oder Fähigkeitengleichheit sind kaum mehr als Schlagworte, weil sie zwar meistens von einem bestimmten Autor oder einer bestimmten Autorin konzipiert und begründet wurden, aber jeweils eigene Füllungen erlauben. Von daher muss man jeweils ausführen, was man darunter versteht. Allen Formen eines fair equality of opportunity-Ansatzes ist gemeinsam: Sie anerkennen eine Beschränkung und ein Ziel und intendieren so weder eine Versklavung der Talentierten noch knüpft sie eine Eigenverantwortlichkeit lähmende, engmaschige soziale Hängematte. 4.4.Befähigung als Maßangabe für das decent minimum der Chancengleichheit Dem hier vertretenen Modell des Fähigkeiten-Ansatzes (CapabilitiesApproach) (Sen 1999; Nussbaum 1999; Pauer-Studer 2000) geht es um die Inklusion der einzelnen Individuen in die Gesellschaft (Dabrock 2004). Unter Berücksichtigung der notwendigen Bedingung des Würde-Axioms entfaltet er den nicht nur qua Wohltätigkeit gewährten, sondern gerechterweise einklagbaren Anspruch auf soziale Grundgüter (capabilities) nach dem Kriterium, ob mit ihrer Hilfe ein Individuum zur längerfristigen, integral-leiblichen, eigenverantwortlichen Teilnahme an interpersoneller Kommunikation (functioning) befähigt wird. Seine Legitimation zieht dieses Gerechtigkeitsverständnis daraus, dass die grundlegenden Achtungs- und Menschenrechtsindikatoren ‚Würde’ und ‚Freiheit’ solange abstrakt-leere Konzeptionen bleiben, solange sie nicht eine auf die jeweilige Gesellschaft bezogene Befähigung zur realen und nicht nur formalen Freiheit gewähren. Weil der Capabilities-Approach diese reale Freiheit als gerechtigkeitstheoretisches Leitkriterium wählt, fällt er auch nicht in die Normalismusfalle (Waldenfels 1998). D.h.: Er versucht nicht nur, dafür Sorge zu tragen, dass Defizite eines normal competitors in sozialer Kooperation ausgeglichen werden, sondern er fragt auch, wie die Fähigkeiten jedes Individuums möglichst effektiv gefördert werden können – allerdings nicht mit dem Ziel seines subjektiven Wohlergehens, sondern nur zum Zweck der Bereitstellung dessen tragfähiger Bedingungen, nämlich der Teilnahmemöglichkeit an interpersoneller Kommunikation. (Schließlich kann niemand zur Teilnahme an der Gesellschaft gezwungen werden.) Soziale Gerechtigkeit gegenüber einem Behinderten muss sich entsprechend in höherer gesellschaftlicher Zuwendung als gegenüber Nichtbehinderten ausdrücken, sofern er diese zum genannten Zwecke benötigt. Gegen mögliche Missverständnisse sei betont: Geht es um Bedingungen, soziale Kommunikation aufnehmen und pflegen zu können, dann sind keineswegs – wie möglicherweise denkbar – schwerst geistig Behinderte aus diesem Kriterium ausgeschlossen. Sie t546 Genetik in Public Health Te i l 2 / 2 0 0 7 haben nur andere Formen von Kommunikation! Um auf diese Vielfalt im Kommunikationsverständnis hinzuweisen, wird der hier vertretene Ansatz über das Kriterium integral-eigenverantwortlicher Lebensführung definiert. Trifft zudem die so genannte Wilkinson-These zumindest indirekt (Wilkinson 2001) zu, nach der in solchen Gesellschaften, die eine vergleichsweise hohe gesellschaftliche Stratifikation aufweisen, eine größere gesundheitliche Ungleichheit zu beklagen ist als in solchen, die von weniger Ungleichheiten gekennzeichnet sind, kann man von diesem Effekt bei der Zuteilung sozialer Ressourcen (und das heißt möglicherweise auch solcher für genetische Maßnahmen in Public Health) nicht abstrahieren. D.h.: Zwar ist Freiheit das eigentliche Ziel von Ethik und demokratischem Rechtsstaat, aber durch die Wilkinson-These wird der intrinsische Wertcharakter von Gleichheit zumindest gegenüber der neueren Egalitarismus-Kritik rehabilitiert (Krebs 2000). Diese bezweifelt, dass Gleichheit, die immer eine Relation zwischen zwei Vergleichsobjekten aufbaut, eine sozialethisch oder -politisch legitime Forderung darstellt. Im Umkehrschluss hält sie nur einen menschenrechtlich begründeten absoluten Standard an Lebensbedingungen für einklagbar. Demgegenüber gibt die Wilkinson-These zu bedenken, dass zumindest mit Bezug zur Gesundheit die soziale Relationen berücksichtigende Chancengleichheit sehr wohl eine intrinsisch moralische Bedeutung besitzt. Nicht als moralisches Endziel wie die Freiheit, aber sehr wohl als moralisches und nicht nur außermoralisches Mittel zu diesem Ziel kann man die Gleichheit bewerten, wenn denn Gesundheit ein konditionales Gut ist und die Verteilung dieses Gutes in der Gesellschaft nicht völlig unabhängig davon ist, wie es um die gesellschaftliche Stratifikation in dieser Gesellschaft bestellt ist. Inhaltlich umfasst die freiheitsfunktionale Ausgestaltung des CapabilitiesApproach auch die Problemstellung der jüngsten Debatte im Feld der sozialen Gerechtigkeit. In ihr wird debattiert, ob soziale Gerechtigkeit monozentrisch vom Prinzip der Anerkennung (Honneth) oder bifokal vom Doppelprinzip ‚Umverteilung und Anerkennung’ (Fraser) begründet werden soll (Fraser & Honneth 2003). Abgesehen davon, dass der recognition-Ansatz von Honneth unter einen Begriff drei sehr divergente Formen sozial bezeugter Achtung (Liebe, Recht, Leistung) bringen soll, die Selbstvertrauen, Selbstachtung und Selbstwertgefühl des Individuums stärken, unterläuft er die bewährte modernitätstypische Unterscheidung zwischen Rechtem und Guten (vgl. Gosepath 2004). So richtig es ist, dass jeder Mensch diese Formen der Anerkennung benötigt, so wenig kann er sie vom (generalisierten) Anderen einfordern. Da aber nur der generalisierte Andere (und nicht der konkrete Andere) derjenige ist, an den (symbolisch) gesellschaftliche Forderungen gestellt werden 547u Ethik der Public Health Genetik können, kann die reine Anerkennungstheorie bestenfalls auf die Ebene der schwachen Theorie des Guten reduziert als Begründungselement sozialer Gerechtigkeit fungieren. Zu Recht hat Nancy Fraser hervorgehoben, dass Teilhabemöglichkeit nicht nur über die soziokulturelle Verdrängungs-, sondern auch über ökonomische Verdinglichungsmechanismen gestört oder gar verhindert wird. Damit bestätigt sie die freiheitsfunktionale Gesamtintention des Capabilities-Approach. Sie kann dabei zwischen diesem Grundprinzip und die sozialen Grundgüter nochmals eine Zwischenebene einziehen, die die aggregatorische Zusammenstellung der Güterliste von Nussbaum systematisch ordnen und so aufdecken kann, durch welche Mechanismen diese Güter gefährdet werden. Diese präzisierende Differenzsensibilität kann ebenso wie das Grundprinzip der Befähigung für die sozialethische Fragen von Public Health Genetik genutzt werden. 5. Sozialethische Perspektiven auf Public Health Genetik Ob man die dargestellten allgemeinethischen und sozialethischen Kriterien auf die molekulare Medizin im Allgemeinen wie Public Health Genetik im Besonderen anwenden kann, hängt entscheidend davon ab, wie man genetisches Wissen einschätzt. Hält man es für exzeptionell, müssen verschärfte oder andere Kriterien gesucht werden. Erachtet man es für nicht exzeptionell, kann auf die dargestellten Unterscheidungen zurückgegriffen werden. Deshalb stellt sich die prinzipielle Frage: Ist genetisches Wissen exzeptionell einzuschätzen? (Murray 1997) 5.1.Keine Exzeptionalität, aber Spezifität genetischen Wissens Ohne Zweifel zeichnet sich genetisches Wissen durch Besonderheiten wie lange und (je nach Form) sehr genaue Voraussagekraft aus. Es ist zudem durch seine Bedeutung für reproduktive Entscheidungen wie die Schlussmöglichkeit auf familiäre Charakteristika von symbolischer und sozialer Sprengkraft. Aus den genannten Gründen wie kurzfristigen Nutzenerwägungen von Versicherungen und Arbeitgebern wie unter der Erinnerung an die menschenverachtende Praxis der Eugenik der ersten Hälfte des 20. Jahrhunderts, die in den Gräueltaten der Nazis ihren schrecklichen Höhepunkt fand, wie unter kultureller Fortwirkung eines kruden genetischen Determinismus und Reduktionismus ist genetisches Wissen zudem mit Stigmatisierungs- und Diskriminierungsängsten verbunden. All das spricht für die Besonderheit genetischen Wissens. Eine Exzeptionalität, die zudem einen Sonderweg im Umgang mit genetischen Daten gegenüber t548 Genetik in Public Health Te i l 2 / 2 0 0 7 anderen medizinischen Verfahren rechtfertigen könnte, leitet sich aus den genannten Gründen nicht ab. Lange Vorhersagekraft, Bedeutung für reproduktive Entscheidungen und familiäres Wissen, Stigmatisierungspotential trifft mal mehr, mal weniger auch auf andere medizinische und nicht medizinische Lebensbedingungen zu. Allein die Dichte der Aspekte und die sich daraus ergebende mögliche kumulative Wirkung lässt die Charakterisierung der molekularen Medizin als eines für die Persönlichkeitsrechte der einzelnen Gesellschaftsmitglieder wie ganzer Gruppen hochsensiblen Bereichs zu. Gegen die Exzeptionalitätsthese spricht auch die Einsicht in die komplexe Interaktion zwischen Genom, intraorganismischen Prozessen und Umwelt. Wie sollen medizinisch und rechtlich im Umgang mit Krankheit und kranken Menschen genetische von anderen Informationen lupenrein getrennt werden? Neben der Schwierigkeit der Abgrenzung handelt man sich den Vorwurf ein, Betroffene ohne (explizite) genetische Komponente rechtlich weniger zu schützen als solche, die eine genetische Komponente nachweisen können. Genau dieser (dann notwendige) Nachweis kann entweder eine gesellschaftliche Diskriminierung und Stigmatisierung bestätigen und möglicherweise aufgrund des Neides angesichts besseren Schutzes noch verstärken. Wer von daher die Separierung genetischen Wissens von anderen medizinischen Informationen und sei es zum Zwecke der Verhinderung einer fortschreitenden (vermeintlichen) „Medikalisierung“, „Genetisierung“ oder „Molekularisierung“ der Gesellschaft will, verfällt selbst einem genetischen Reduktionismus, den er zu bekämpfen sucht. Statt also genetisches Wissen exzeptionell zu behandeln, sollte man es als einen, wenn auch hochsensiblen Faktor medizinischen Wissens, als einen Baustein im (so) gewünschten Diagnose- und Therapieprozess auf der Individuumsebene und von öffentlichen Gesundheitsmaßnahmen auf der Public Health Ebene begreifen. 5.2.Konsequenzen des Befähigungsgerechtigkeitsansatzes für den Umgang mit Public Health Genetik 5.2.1. Formale und materiale Rahmenbedingungen außerhalb der Gerechtigkeitsfrage Wenn es in Public Health Genetik um die Integration eines nicht exzeptionellen, aber spezifischen, nämlich genetischen Wissens in die Aufgabenbestimmung von Public Health geht, dann sind neben der Berücksichtigung der genannten ethischen Grundwerte der Würde, der sich daraus ableitenden informationellen Selbstbestimmung wie der zu ihrer Gewährleistung nötigen Datenschutz- und Vertraulichkeitsregeln und vor der Entfaltung des Befähigungskriteriums sozialer Gerechtigkeit noch die Qualitäts- und Effizienzkriterien des HTA-Assessment zu beachten. Weil in Zeiten knapper Ressourcen der nicht zielgerichtete Einsatz der (als) 549u Ethik der Public Health Genetik vorhanden(en definierten) Mittel die Knappheit verschärft und damit selbst zu einem Gerechtigkeitsproblem wird, müssen nicht nur in ökonomischer Perspektive, sondern auch in ethischer die Ressourcen, die für Public Health Genetik zur Verfügung stehen, effizient und effektiv eingesetzt werden. Die Überprüfung auf Effektivität und Effizienz schließt neben Prozess, Struktur- und Ergebnisqualitätssicherung die Frage nach analytischer und klinischer Validität und Reliabilität, nach Sensitivität und Spezifität, nach positivem prädiktivem und negativem Wert ein wie insbesondere im Blick auf Tests und Screeningverfahren die bekannten WHO-Kriterien von Wilson und Junger (Wilson & Junger 1968). Nach ihnen ist über das Gesagte hinaus zu prüfen, ob eine große Relevanz der Erkrankung vorhanden, angemessene Behandlungsmöglichkeiten verfügbar sind, eine Infrastruktur für Diagnostik und Behandlung genutzt werden kann, ein Latenz- oder ein frühes symptomatisches Stadium erkennbar sind, eine hohe Akzeptanz des Screenings angenommen werden kann, ein bekannter Krankheitsverlauf vorausgesetzt wird, eine einheitliche und eindeutige Definition der Zielgruppe erfolgt, ein kostengünstiges Screening in Relation zu möglichen medizinischen Gesamtkosten implementiert, sowie eine Kontinuität des Screeningprogramms gewährleistet werden kann. Obwohl in den hier genannten Rahmenbedingungen (wie bspw. durch die Utilitätskriterien) bereits ethische Fragestellungen angerissen werden, kann man sie unter Berücksichtigung des Befähigungsgerechtigkeitsansatzes noch weiter entfalten. 5.2.2. Entfaltung gemäß Anerkennung und Umverteilung Wenn man nach Nancy Fraser das Kriterium der Befähigung zur Teilnahmemöglichkeit an Kommunikation nochmals unter dem Aspekt von Umverteilung und Anerkennung entfalten kann, dann bedeutet dies: Fokussiert man sich auf den Aspekt der Anerkennung, so sind (wie schon auf der Ebene des allgemeinen Individuumsschutzes gegenüber genetischem Wissen) Stigmatisierung und Diskriminierung zu vermeiden. Das schließt aber unter Beachtung des allgemeinen Gleichheitsgrundsatzes auch ein, dass genetisches Wissen, da es nichts exzeptionell anderes als andere brisante Informationen beinhaltet, gleichwertig mit diesen zu betrachten ist. Wenn deshalb andere Informationen aus der Vergangenheit im Lebensversicherungs- und Berufsbereich zur jeweiligen Risikokalkulation oder zur Anstellungsfähigkeit herangezogen werden, ist (vorerst) nicht einzusehen, warum dies nicht auch für genetisches Wissen gelten sollte. Abzulehnen und rechtlich zu verhindern ist dagegen ein Zwang zum Gentest allein zum Zwecke der jeweiligen Vertragsabschlüsse. Nochmals anders t550 Genetik in Public Health Te i l 2 / 2 0 0 7 verhält es sich im Krankenversicherungsschutz, der jedem eine umfangreiche Grundversorgung gewähren sollte, weil Gesundheit ein konditionales Lebensgut darstellt. Deshalb muss der Kontrahierungszwang zumindest soweit gehen, dass das genannte decent minimum gewährt wird – unabhängig von Informationen aus bereits bekannten genetischen Tests. Neben der Vermeidung von Stigmatisierung und Diskriminierung, die auch gegenüber ganzen Bevölkerungsgruppen gelten muss, zielt die Befähigungsgerechtigkeit auf Umverteilung. Wenn das Maß einer gerechten Gesundheitsversorgung an der alters- und konstitutionsbedingten, integralen Teilnahmefähigkeit an sozialer Kommunikation festgemacht wird, ist nicht einzusehen, warum genetische Maßnahmen, sofern sie diesem Ziel dienen und den unter 3.2.1 skizzierten Kriterien genügen, von diesem Umverteilungskriterium ausgeschlossen werden sollten. Diese sind dann nochmals mit dem (auf objektiven, subjektiven und sozialen Dimensionen aufruhenden) jeweiligen kulturellen Verständnis von Krankheit und Gesundheit und deren modalen Aspekten wie Tragbarkeit, Dringlichkeit, Beeinflussbarkeit, Konsumferne abzugleichen. Sollten Public Health Genetik Maßnahmen wie andere krankheitsverhindernde und gesundheitsfördernde Maßnahmen bewertet werden können (und nicht einem genetischen Exzeptionalismus unterliegen), dann erhalten sie zudem durch die angesprochene Wilkinson-These eine weitere Bedeutung. Wollte man sie (sofern sie den anderen Effizienz-, Qualitäts- und Ethikkriterien genügen) nicht unter Maßnahmen des decent minimum fassen, könnte die gesundheitliche Ungleichheit in einer Gesellschaft weiter zunehmen. 5.2.3. Begleitendes Gerechtigkeitsnetzwerk Das an kommunikativer Freiheit orientierte Kriterium der Befähigungsgerechtigkeit wird auch dann nachhaltig in Public Health Genetik pragmatisch umgesetzt werden können, wenn es seinerseits durch ein Netzwerk aus diversen anderen Gerechtigkeitselementen gestärkt wird. Zugleich wird so dem Trug der einfachen Lösung entgegen gesteuert. Solche ergänzenden Gerechtigkeitsaspekte sind (vgl. Dabrock 2003): n Beteiligungs- und Verfahrensgerechtigkeit, insofern sie Partizipation und Transparenz fördern, selbst wenn sie vordergründig betrachtet Entscheidungsprozesse verlangsamen; n Generationengerechtigkeit, weil angesichts knapper Ressourcen die Chancengleichheit zukünftiger Generationen, die nicht gefragt wurden, ob sie ins Dasein kommen wollten, zur Disposition steht; 551u Ethik der Public Health Genetik n Kompensationsgerechtigkeit, weil man diejenigen, die bei möglichen Priorisierungsentscheidungen posteriorisiert wurden, nicht ins Nichts fallen lassen darf; n Leistungsgerechtigkeit, weil gesundheitsbewusstes Verhalten auf der Patientenseite und gute Medizin auf der ärztlichen Seite nicht unberücksichtigt bleiben dürfen. 6. Priorisierungsregel beim Grundkonflikt Autonomierespekt vs. Gemeinwohl (-pflichtigkeit) Wenn gleichzeitig individuumsbezogene Schutzstandards, die für Public Health Genetik Maßnahmen zutreffen müssen, und eine gerechte Verteilung gesellschaftlicher Güter, die unter Knappheitsbedingungen effizient einzusetzen sind, greifen sollen, kann es zum Konflikt zwischen Autonomierespekt und Gemeinwohl (und daraus abgeleiteter Gemeinwohlpflichtigkeit) kommen. Wie hoch ist bspw. der Verpflichtungsgrad, an Screeningverfahren teilzunehmen, wie hoch der, seine Daten für Biobanken zur Verfügung zu stellen? Über die anfänglich angesprochene selbstkritische Frage nach eigener oder fremder free-rider-Mentalität hinaus lässt sich cum grano salis unter Beachtung der möglichen Kollision der genannten moralischen und rechtlichen Güter von Autonomierespekt und Gemeinwohl(-pflichtigkeit) folgende Bewertungstendenz bzw. folgendes sozialethisches Stufenmodell einführen (vgl. Brand, Dabrock, Gibis 2003). Es trägt zudem dem allgemeinen Umstand Rechnung, dass im Allgemeinen Bewertungsfragen nicht einfach mit ‚Ja’ oder ‚Nein’ zu beantworten sind: Erfüllt eine Public Health Genetik Maßnahme die eingeführten Effizienz- und Effektivitätskriterien wie Validität, Reliabilität und Spezifität, lässt sich bei begrenztem Aufwand ein hoher individueller Nutzen im Sinne von Vermeidung einer schweren Krankheit und Förderung der individuellen Entwicklungsmöglichkeit sowie ein hoher gesellschaftlicher Nutzen im Sinne der Vermeidung hoher Kosten, die durch verzögerte Diagnosestellung, inadäquate Therapien durch Fehldiagnosen etc auftreten würden, erzielen, und muss man zudem nicht mit einer gesellschaftlichen Stigmatisierung der Betroffenen rechnen, so besteht ein hoher sozialethischer Verpflichtungsgrad. Dieser Verpflichtungsgrad entfaltet sich nach zwei Seiten. Sofern die genannten Kriterien zutreffen, ist zum einen die öffentliche Gesundheitsversorgung zur Bereitstellung und damit gleichzeitig auch zur Sicherstellung dieser Public Health Genetik Maßnahmen verpflichtet – nicht zuletzt auch, um einer Entsolidarisierung entgegen zu wirken. Zum anderen besteht in diesen Fällen auch seitens der betroffenen Individuen angesichts des eher geringen Schadens für sie wie ihre Familie (Eingriff in die formale Selbstbestimmung; mini- t552 Genetik in Public Health Te i l 2 / 2 0 0 7 male Diskriminierungstendenz), aber der hohen ökonomischen Folgen bei Nichtteilnahme eine hohe moralische Verpflichtung zur Teilnahme an der entsprechenden Maßnahme. Obwohl die Teilnahme unter den genannten Bedingungen als ein moralisch-sittlicher Imperativ zu lesen ist, bedeutet dies nicht, ihn notwendigerweise unmittelbar in einen rechtlichen Zwang zu transformieren. Angesichts der bewährten Sinnhaftigkeit einer auf negativer Freiheit und „informed contract“ aufbauenden Rechtskultur kann man darüber nachdenken, auf der rechtlichen Ebene das Prinzip der Freiwilligkeit zu wahren und sich dabei dennoch nicht allein auf die standardisierte nondirektive Beratung zu beschränken. Dass hier nicht einfach ethische Ableitungen greifen, sondern die jeweilige gesellschaftliche Einstellung beachtet werden muss, hängt damit zusammen, dass moralische Fragen im sittlich-politischen Diskurs nicht einfach deduktiv zu handhaben sind, sondern mit kulturellen Standards abgeglichen werden müssen. Denn nur so kann die neben der moraltheoretischen Geltung ebenso wichtige Akzeptanz und Reproduzierbarkeit sittlicher Urteile gewahrt werden. Aus dem so als Metaregel zu Interpretierenden ist umgekehrt aber genauso eindeutig zu schließen: Wo die genannten Rahmenbedingungen schwächer werden, sinkt der Verpflichtungsgrad zur Teilnahme an genetischen Gesundheitsversorgun gsmaßnahmen, entsprechend sollte die Beratung nondirektiver durchgeführt werden. Umgekehrt formuliert: Die Ablehnung der Teilnahme wird moralisch weniger begründungspflichtig. Im Übrigen stellt sich die gesundheitsökonomische und damit auch gerechtigkeitspraktische Frage, ob bei Public Health Genetik Maßnahmen überhaupt der hohe Beratungsstandard, wie er aus der medizinischen Humangenetik bekannt ist, aufrecht erhalten werden kann. Sollte dies, was wahrscheinlich ist, kaum möglich sein, wird man zur Festlegung des Beratungsumfangs neben den ökonomischen Zwängen vor allem die jeweils betroffene Eingriffstiefe in die informationelle Selbstbestimmung berücksichtigen müssen. Die vorgeschlagene Priorisierungsregel transportiert keineswegs einen in der weltanschaulich pluralen Gesellschaft inakzeptablen Gesundheitspatern alismus. Das Gegenteil trifft zu: Erst durch die Sicherstellung elementarer Bedingungen (sog. konditionaler Güter) sind verschiedene mögliche Formen des gelingenden Lebens überhaupt realisierbar. Ohne Beachtung dieser primären Grundgüter bleibt ihrerseits die Rede von der Freiheit leer und kann zu Ungunsten der Benachteiligten ausgelegt werden, insofern diese unter einer rein formalen Freiheitsideologie, aber fehlender Gewährung von Chancengleichheit ihre Freiheit realiter nicht ausgestalten können. Diese 553u Ethik der Public Health Genetik reale Freiheit wählt der hier als Grundnorm zuvor eingeführte Befähigungsgerechtigkeitsansatz. Zählt man die Verhältnisbestimmung von Gemeinwohl und Eigennutz zu dem ethischen Problemkomplex: „Autonomierespekt vs. Gemeinwohl“, dann ist hierin auch die Frage nach einem direkten oder indirekten benefitsharing einzelner Teilnehmer oder teilnehmender (Sub-)Populationen an Public Health Genetik Maßnahmen zu thematisieren (Nationaler Ethikrat 2004). Wenn aus Biobanken oder pharmakogenetischen Forschungen ein wissenschaftlicher oder finanzieller benefit erwächst, so könnten die Teilnehmer direkt, indirekt oder überhaupt nicht beteiligt werden. Letztere Variante müsste sich dem Vorwurf der Ausbeutung stellen, erstere sieht sich dem Verdacht ausgesetzt, über ökonomische Anreizstrukturen biopolitischer Sozialdisziplinierung (s. Kap. 1.4.) Vorschub zu leisten. Sollte diese Variante des direkten benefits für den Probanden allerdings gewollt sein, böte sich mit dem „informed contract“ ein Instrument, das die Verteilung der benefits im Einzelfall rechtsgültig festschreibt. Bei der mittleren Variante ist zu überlegen, wie (bei allem drohenden trade-off) ein möglichst effektiver und gerechter Weg jenseits von Ausbeutung und Sozialdisziplinierung zu finden ist. Als Faustregel könnte gelten: Nicht Einzelne, sondern dem öffentlichen Gesundheitswesen, dem die Einzelnen zugehören, sollten wissenschaftliche und finanzielle benefits angerechnet werden. Das jeweilige Maß gehört ebenso in die politische Deliberation (unter Beachtung von echten Partizipationsrechten) wie auch deliberativ zu klären ist, ob die benefits dem Gesundheitssystem global zufließen sollen oder solchen weiteren Forschungs- oder Umsetzungsprojekten zu gute kommt, die nahe bei denen angesiedelt sind, in denen die Erträge erzielt wurden. Während man die letztere Möglichkeit generaliter als eine problematische, weil falsche Anreize setzende Strategie einordnen zu gewillt ist, wird man im speziellen bei orphan-drug-Fragen oder umwelt- oder arbeitsmedizinischen Fragestellungen nochmals diese Möglichkeit nicht prinzipiell ausschließen wollen. 7. Ausblick Bringt man das Dargestellte auf den (metaphorischen) Punkt, mag man an die Liedzeile „Bleibt alles anders“ von Herbert Grönemeyer denken. Auf der einen Seite bleibt alles anders. Man kann bei der ethischen Bewertung von Public Health Genetik auf bewährte ethische Kriterien und Urteilsmuster und auf aus bestimmten geschichtlichen Traditionen kommende Vorstellungen über das Menschsein zurückgreifen. Dennoch bleibt alles anders. D.h.: t554 Genetik in Public Health Te i l 2 / 2 0 0 7 Es kommt oder es kann kommen durch die Entwicklung der Genetik und ihrer möglichen Anwendung auf Public Health zu einer Intensivierung von Konflikten, die die Anwendung dieser althergebrachten ethischen Kriterien noch einmal vor neue Herausforderungen stellt. Inhaltlich im Blick auf das hier Vorgetragene präzisiert: Weil sich auf die Genetik teils überzogene Hoffnungen, teils übertriebene Ängste richten, erscheint der Fähigkeitenansatz durch die konstitutive Integration der Bildungsdimension als eine sinnvolle normativ-ethische Konzeption, um die (zumindest ökonomisch nicht mehr aufzuhaltende) Integration genetischer Maßnahmen in die Gesundheitsversorgung kritisch, aber auch konstruktiv begleiten zu können. Literatur Beauchamp TL, Childress F (2001): Principles of Biomedical Ethics. New York: Oxford University Press. 5. Aufl. Bora A (1999): Rechtliches Risikomanagement. Form, Funktion und Leistungsfähigkeit des Rechts in der Risikogesellschaft. Berlin: Duncker & Humblot. Brand A, Dabrock P, Gibis B (2003): Neugeborenen-Screening auf angeborene Stoffwechselstörungen und Endokrinopathien – aktuelle ethische Fragen aus unterschiedlichen Perspektiven. In: Dörries, A et al. (Hrsg.): Das Kind als Patient - Ethische Konflikte zwischen Kindeswohl und Kindeswille. Jahrestagung der Akademie für Ethik in der Medizin e.V. Tutzing 2002. Frankfurt/M.: Campus, 217-233. Bundesärztekammer (2003): Richtlinien zur prädiktiven genetischen Diagnostik. Deutsches Ärzteblatt 100, 1297-1305. Buchanan A, Brock DW, Daniels N, et al. (2000): From Chance to Choice: Genetics and Justice. Cambridge: Cambridge University Press. Dabrock P (2001): Capability-Approach und Decent Minimum. Befähigungsgerechtigkeit als Kriterium möglicher Priorisierung im Gesundheitswesen. Zeitschrift für Evangelische Ethik 46, 202-215. Dabrock P (2002): Zum Status angewandter Ethik in Auseinandersetzung mit Niklas Luhmann. In: Jähnichen T, et al. (Hrsg.): Flexible Welten. Münster: Lit, 11-42. 555u Ethik der Public Health Genetik Dabrock P (2003): Genetik und soziale Gerechtigkeit. Systematische Überlegungen im Gespräch mit ‚From Chance to Choice’. In: Dabrock P, et al. (Hrsg.): Kriterien der Gerechtigkeit. Gütersloh: Gütersloher Verlagshaus, 192-214. Dabrock, Peter (2003): „Menschenbilder und Verteilungsgerechtigkeit im Gesundheitswesen. Perspektiven theologischer Sozialethik.“ Deutsche Medizinische Wochenschrift 128, 210-213. Dabrock P (2004): Inklusion und soziale Gerechtigkeit. Eine theologisch-sozialethische Such­bewegung zwischen Rawls und Luhmann. In: Schüle A, et al. (Hrsg.): Luhmann und die Theologie. Darmstadt: Wiss. Buchgesellschaft. Dabrock P (2005): Weniger kann mehr sein. Die bereichernde Belastung des Sinns für Ungerechtigkeit im ethischen Theoriemodell des weiten Überlegungsgleichgewichts. In: Gabriel K, Kruip G (Hrsg.): Sinn für Ungerechtigkeit. Münster: LIT. Dabrock P, Klinnert L, Schardien S (2004): Menschenwürde und Lebensschutz. Herausforderungen theologischer Bioethik. Gütersloh: Gütersloher Verlagshaus. Deutscher Bundestag (2002): Schlussbericht der Enquete-Kommission Recht und Ethik der modernen Medizin. Berlin. Deutsche Forschungsgemeinschaft (2003): Prädiktive genetische Diagnostik. Wissenschaftliche Grundlagen, praktische Umsetzung und soziale Implementierung. Stellungnahme der Senatskommission für Grundsatz­ fragen der Genforschung. Bonn. Droste S, Gerhardus A, Kollek R (2003): Methoden zur Erfassung ethischer Aspekte und gesellschaftlicher Wertvorstellungen in Kurz-HTABerichten – eine internationale Bestandsaufnahme. Köln: Deutschen Institut für Medizinische Dokumentation und Information (DIMDI). Faden RR, Beauchamp TL (1986): A History and Theory of Informed Consent. New York: Oxford University Press. Feuerstein G, Kollek R, Uhlemann T (2002): Gentechnik und Krankenversicherung. Neue Leistungs­angebote im Gesundheitssystem. Baden-Baden: Nomos. t556 Genetik in Public Health Te i l 2 / 2 0 0 7 Forst R (1994): Kontexte der Gerechtigkeit. Politische Philosophie jenseits von Liberalismus und Kommunitarismus. Frankfurt/M.: Suhrkamp. Fraser N, Honneth A (2003): Umverteilung oder Anerkennung. Eine politisch-philosophische Kontroverse. Frankfurt/M.: Suhrkamp. French ME, Moore JB (2003): Harnessing Genetics to Prevent Disease and Promote Health. Washington: Partnership for Prevention. Geier M, Schröder P (2003): The Concept of Human Dignity in Biomedical Law. In: Sándor J, den Exter AP (Hrsg.): Frontiers of European Health Law: A Multidisciplinary Approach. Delft: Erasmus University PressDocVision, 146-182. Geisler LS (2001): Der Mensch als gläserner Patient. Referat anlässlich der 4. Fachtagung Gesund in eigener Verantwortung? Patientenrechte in der Diskussion 28./29. September. Dresden. Gert B, Clouser D, Culver C (1997): Bioethics: A Return to Fundamentals. New York: Oxford University Press. Gosepath S (2004): Gleiche Gerechtigkeit. Grundlagen eines liberalen Egalitarismus. Frankfurt/M.: Suhrkamp. Grunwald A (Hrsg.) (2003): Technikgestaltung zwischen Wunsch und Wirklichkeit. Berlin: Springer. Hennen L, Petermann T, Sauter A (2001): Das genetische Orakel. Prognosen und Diagnosen durch Gentests – eine aktuelle Bilanz. Berlin: Edition Sigma. Häyry M (2003): European Values in Bioethics: Why, What, and How to Be Used? Theoretical Medicine 24, 199-214. Höffe O (1987): Politische Gerechtigkeit. Grundlegung einer kritischen Philosophie von Recht und Staat. Frankfurt/M: Suhrkamp. Japp KP (2000): Risiko. Bielefeld: Transcipt. Kissell JL (1999): Complicity in Thought and Language: Toleration of Wrong. Journal of Medical Humanities 20, 49-6.0 557u Ethik der Public Health Genetik Kollek R, Feuerstein G, Schmedders M (2004): Pharmakogenetik: Implikationen für Patienten und Gesundheitswesen. Baden-Baden: Nomos. Krebs A (Hrsg.) (2000): Gleichheit oder Freiheit. Texte der neuen Egalitarismuskritik. Frankfurt/M.: Suhrkamp. Leist A (1998): Angewandte Ethik zwischen theoretischem Anspruch und sozialer Funktion. Deutsche Zeitschrift für Philosophie 5, 753-777. Lemke T (2000): Die Regierung der Risiken. Von der Eugenik zur genetischen Gouvernementalität. In: Bröcking U, et al. (Hrsg.): Gouvernementalität. Studien zur Ökonomisierung des Sozialen. Frankfurt/M.: Suhrkamp, 227-264. Lösch A (2001): Genomprojekt und Moderne. Soziologische Analysen des bioethischen Diskurses. Frankfurt/M.: Campus. Luhmann N (1991): Soziologie des Risikos. Berlin: de Gruyter. Mack E (2002): Gerechtigkeit und gutes Leben. Christliche Ethik im politischen Diskurs. Paderborn: Schönigh. Macklin R (1992): Privacy and Control of Genetic Information. In: Annas G, Sherman E (Hrsg.): Gene Mapping. Using Law and Ethics as Guides. New York: Oxford University Press, 157-172. Michigan Center for Genomics & Public Health (o.J.): Ethical, Legal and Social Issues in Public Health Genetics (PHELSI). Key Points, URL: http://www.sph.umich.edu/genomics/media/subpage_autogen/PHELSI. pdf. (abgelesen 22.08.2004). Murray, Thomas (1997): Genetic Exceptionalism and ‘Future Diaries’: Is Genetic Information Different from Other Medical Information? In: Rothstein, Mark (Hrsg.): Genetic Secrets: Protecting Privacy and Confidentiality in the Genetic Era. New Haven: Yale University Press, 60-73. Nationaler Ethikrat (2004): Biobanken für die Forschung. Stellungnahme. Berlin: Nationaler Ethikrat. t558 Genetik in Public Health Te i l 2 / 2 0 0 7 Nussbaum MC (1999): Gerechtigkeit oder Das gute Leben. Frankfurt: Suhrkamp. O’Neill O (2002): Autonomy and Trust in Bioethics. Cambridge: Cambridge University Press. Pauer-Studer H (2000): Autonom Leben. Reflexionen über Freiheit und Gleichheit. Frankfurt: Suhrkamp. Paul NW (2004): Auswirkungen der Molekularen Medizin auf Gesundheit und Gesellschaft. Gutachten Bio- und Gentechnologie für die Friedrich Ebert Stiftung. Berlin: Friedrich-Ebert-Stiftung. Rawls J (1975): Eine Theorie der Gerechtigkeit. Frankfurt/M.: Suhrkamp. Rawls J (1998): Politischer Liberalismus. Frankfurt/M.: Suhrkamp. Sass HM (2001): A Contract Model for Genetic Research and Health Care for Individuals and Families. Eubios Journal of Asian and International Bioethics 11, 130-132. Sass HM (2003): Patienten- und Bürgeraufklärung über genetische Risikofaktoren. In: Sass HM, Schröder P (Hrsg.): Patientenaufklärung bei genetischem Risiko. Münster: LIT, 42-55. Schröder P (2004): Gendiagnostische Gerechtigkeit. Münster: LIT. Schweizerischer Bundesrat: Botschaft zum Bundesgesetz über genetische Untersuchungen beim Menschen. 11. September 2002. http://www.ofj.admin.ch/themen/genomanalyse/bot-genom-d.pdf (Homepage zuletzt überprüft am 28. November 2003). Sen A (1999): Development as Freedom. New York: Anchor Books. Spaemann R (1996): Personen. Versuche über den Unterschied zwischen etwas und jemand. Stuttgart: Klett-Cotta. Smith K, Croyle RT (1995): Attitudes toward Genetic Testing for Colon Cancer Risk. American Journal of Public Health 85, 1435-1438. Tauber AI (2003): Sick Autonomy. Perspectives in Biology and Medicine 46(4), 484-495. 559u Ethik der Public Health Genetik Taupitz J (2000): Genetische Diagnostik und Versicherungsrecht. Karlsruhe: Verlag Versicherungswirtschaft. The Report of the President’s Council on Bioethics (2002): Human cloning and human dignity. New York: PublicAffairs. Waldenfels B (1998): Grenzen der Normalisierung. Studien zur Phänomenologie des Fremden 2. Frankfurt/M.: Suhrkamp. WHO (2002): Genomics and the World Health. Report of the Advisory Comitee on Health Research. Genf: WHO. Wilkinson RG (2001): Kranke Gesellschaften. Soziales Gleichgewicht und Gesundheit. Wien: Springer. Wilson JMG, Jungner G (1968): Principles and practice of screening for disease. Public Health Papers 34. World Health Organization (WHO) Geneva. Zimmerli W (1990): Who has the right to know the genetic constitution of a particular person? In: Chadwick D, et al. (Hrsg.): Human Genetic Information: Science, Law, and Ethics. Chichester: John Wiley & Sons, 93-102. t560 IV. Ethik und Policy Genetik in Public Health Te i l 2 / 2 0 0 7 Genitic knowledge reduces health risk and promotes health care competence Hans-Martin Sass 561u t562 Genetik in Public Health Te i l 2 / 2 0 0 7 Inhalt IV. Ethik und Policy Genitic knowledge reduces health risk and promotes health care competence 1. Genetic knowledge allows for health risk factor ecudcation............................................................ 564 2. Carrier wellness and family health care ............................ 566 3. Informational property rights and data availability.............. 568 4. Contractual choice and the ethics of genetik research.......... 570 5. Informed contracts handling individual and communal values............................................................ 572 Literature............................................................................. 576 563u Health Care Competence Better information allows for better risk management, more knowledge and experience allow for more competent decision making. New knowledge in human genetics and subsequent professional and personal knowledge in prediction and prevention allow for individualized and personal health care, health promotion, and the prudent management of health risk. Principles, methods and goals of traditional public health need to make use of progress in molecular genetics and associated dramatically improved clinical knowledge in pharmacogenetics, predictive and preventive medicine. New knowledge needs to be put to work in individualized drug prescription, in medical health risk prediction and prevention, and in lay health literacy promotion. International bioethical and clinical literature discusses probable conflicts between issues of privacy, informational property rights, of the impact of genetics on public health, of medical benefits in prescribing individualized and efficacious drugs, and of informing and advising individuals on prevention and health care based on individual genetic profiles. New concepts of caring for health and implementing wellness are already developing outside of traditional public health institutions and sickness treatment facilities. In these developing shifts, special attention needs to be given (a) to cultural and bioethical traditions in accepting genetic screening, (b) to the morality of pharmacological and clinical genetic research, (c) to the promotion of individualized medical treatment and health care competence, and (d) to an already visible cultural shift from treating ‚disease‘ towards protecting ‚health‘ and improving and enhancing ‚wellness‘. New genetic information and its translation and transformation into individual health literacy might fulfill an ancient dream of humankind to ‚control how your genes affect your health‘, as a recent New York Times bestseller (Roizen 1999) puts it. 1. Genetic knowledge allows for health risk factor ecudcation New knowledge in science and technology and new professional and personal applications of new knowledge require value assessment together with technology assessment. Breakthroughs in modern medicine did not come accidentally, they were sought after not for reasons of curiosity but for the sake of the ‚patient‘s good‘ (aegroti salus) in Western medicine and in the performance of humaneness (‚ren‘) in Chinese medical tradition by skillful and honest physicians and health care workers. New knowledge in human genetics and pharmacogenetics will have a great impact on future predictive and preventive health care services, on individualized and more efficacious drug development and prescription, on lay health education on individualized health risk management and health protection and enhancement, on the t564 Genetik in Public Health Te i l 2 / 2 0 0 7 interfaces of physical exercise, nutrition, medication, and prudent lifestyle management. As scientific knowledge has changed rapidly, transfer of knowledge and a revised understanding of health and disease have to follow. Traditional concepts of health have become obsolete, so have the health policies based on outdated models of health. Health cannot simply be understood anymore as ‚a state of complete physical, mental and social wellbeing and not merely the absence of disease or infirmity‘, as the WHO defines, rather as a process of challenge and response, a process of balancing, which needs understanding, protection, and management by the individual person. Health is not just a status; rather the balanced result of health-literate and risk-competent care of one‘s own physical, emotional, and social wellbeing and wellfeeling, achieved in competent understanding, modification and enhancement of individual genetic, social and environmental properties, with the support of health care professionals and through equal access health care services, including information, predictive and preventive medicine. The WHO definition of health seems to have outlived its usefulness as we need a re-evaluation and a re-prioritizing of traditional principles of care, confidentiality, beneficence, informed consent, and harm within physician‘s ethics and in lay health care competence and ethics. Long neglected patient‘s ethics and health care ethics of the lay has to become a prime topic for bioethics research, education and application in the clinical, primary care and public health care settings. Also, we will have to focus on modified principles such as duty to inform, duty to be told and to know, health education, health literacy, health care competence, informed request, informed contract, and the ethics of data availability. The new challenges to health care are challenges in health care education of health care experts and of individual citizens, their families and communities. New models of communicationin-trust and cooperation-in-trust between the experts and the lay need to be developed as, in the words of Ni Peimin, health care is ‚not a matter of biology alone‘, but ‚a never ending journey towards the highest perfection of human being‘ (Ni 1999, p.42). Such a notion of caring for health was not only part of the Confucian tradition. There is a long tradition of dietetics, i.e. lay prudence in healthy lifestyle in European thought (Hartmann 2003). Traditional concepts and maxims of health care rather than disease management seem to have been replaced by an unfortunate repair mentality in health care matters, due to great successes in diagnosis and therapy. But recent cultural trends and individual attitudes towards health and wellness, barely recognized by sickness fund providers 565u Health Care Competence and sickness treatment centers (wrongly called health care centers) indicate a growing interest by citizens in prediction and prevention, and in ‚health‘ as a concept wider than medical treatment of disease, as related to wellness, to good life and good long life. Mushrooming e-health sites for the healthy lay confirm and document changes in attitudes of educated citizen, healthy or not, and an emancipation of the lay from vast areas of professional tutelage by medical experts. In the US and many other countries more people visit health related websites daily than visit doctors or hospitals, - this trend is growing (Schröder 2002; Sass 2004c; Sass & Zhai 2004). Rapidly growing interest and competence of citizens in e-health and wellness will have to change the parameters of public health institutions and their service. Genetic knowledge allows for emancipation of health care and the implementation of health care rights as the right of the individual to care for her or his health (Sass 1991). Subsequently, public health needs a re-arrangement of health care financing via a new mix of public-private contributions based on a model of partnership and the respect for personal choice in matters of lifestyle, wellness, life and health (Sass 1987; 2003b) 2. Carrier wellness and family health care New diagnostic knowledge in human genetics and pharmacogenetics make responsibility-sharing with citizens as future patients or actual patients possible. Based on Western and Eastern traditions of responsibility and selfdetermination within the individual‘s cultural environment, the obligation to know about one‘s genetic heritage and its advantages and disadvantages, its risks and uncertainties is a precondition for living a self-determined, riskcompetent educated life and for enjoying fullest possible individual quality of life. This would require a duty to inform, to educate, to counsel, and to support for the health care experts, a right to be told, and - in those cases, where others are not impacted negatively by individual self-determination - a right to follow or to refuse to follow health care advice. There does not seem to be an obligation to tell, if diagnostic findings cannot result in advice or prescription; but one could make the argument that even in these cases of interventional futility citizens have the right to request information anyway, if they want to know (Kielstein 2002; Sass 2003a; Tao 2002). There is a right to know and an obligation to tell, if health risks are present or predictable. There is, however, only a moral, not a legal obligation to follow health care advice; this obligation becomes more pressing if health care costs are shared in solidarity. t566 Genetik in Public Health Te i l 2 / 2 0 0 7 As genetic diagnosis provides potentially important information for family members in regard to health risk, health status, potentially helpful preventive measures and information essential for individual self-determination and quality of life decisions, each and every person diagnosed will need to consider her or his responsibilities towards family. In Western cultures, emphasis is put on privacy of patients or those diagnosed, while even during transitional periods of Asian professional and family cultures there is a high responsibility towards family, filial love, parental love, different forms of love within the wider family. As not only severe genetic disorders, a higher than average risk of hypertension, forms of cancer, metabolic disorders may run in families, information about these risk factors would be extremely important to carriers, so they seek frequent checkups and advice or might use preventive strategies to reduce impact or postpone onset. Interactive family health care ethics still have to be developed, able to adequately deal with issues of family ethics (Kielstein 2002; Sass 2003a). Also, family relations will be influenced by new sources of - unfounded - guilt-feelings, shame, accusations, self-denials, maybe divorce, suicide, and the breakup of families and familial relations. The golden rule must be to not hide behind traditional attitudes towards secrecy and privacy, but to openly and aggressively inform, educate, teach and support dialogue and discourse in families and in society. It should be done, however, not against the grain of traditional familial forms of communication and cooperation or against the will of the diagnosed carrier, but in seeking her or his support and in making the best use of sometimes dormant principles of family responsibility and solidarity. In complex issues of family ethics, privacy, disclosure, right not to know, and duty to know, diagnosed carriers would be the prime moral agents to make educated and responsible choices (a) to disclose, (b) to refuse disclosure of all or some information, and (c) to postpone hard choices in informing family members. There will be hard cases, where information might be lifesaving to family members who might be carriers. WHO proposed guidelines (1999) on ethical issues in medical genetics suggest to rather violate the principle of confidentiality in favor of informing and consulting family members; but guidelines of national organizations differ from such a stern position. Additional, responsible parenthood in the future might include decisions whether or not (a) to have children at all, (b) to have prenatal testing and eventually elected abortion following positive testing, or (c) to do nothing and set trust into future breakthroughs in medical treatment of yet not treatable disorders. Public health ethics and bioethics have to discuss a new principle: data availability within a well protected and individually contracted framework of data protection and privacy. 567u Health Care Competence 3. Informational property rights and data availability The principle of data availability calls for implementation by individual health care cards. Since the discovery of blood types, reliable diagnosis of blood types, typing and screening for blood types has become an essential part of emergency medicine and surgery and has saved directly or indirectly millions of lives. No one, 100 years ago, has made the point that privacy issues should prevent blood typing, nor does anyone today (Sass 2001a; 2001b; 2003a). It is well known that we do not differ only in types of blood but in many other individual properties, such as in cytochrome P450 isoforms, controlling drug metabolism, causing non-efficacy, side-effects, even death, in some types of metabolizers. In hypertension treatment, calcium antagonists are metabolized by the 3A enzyme in the cytochrome P450 isoform system, while beta blockers are metabolized by 2D6, a switch from one to the other without proper drug metabolizing tests would be clinical and ethical malpractice; P450-2D6 enzymes metabolizing codeine for palliative care is absent in 7% of Caucasians, resulting in total non-efficacy in those individuals; P450-2C19 metabolizing diazepam and other neuropharmaca is absent in 15% to 30% of Asians, who therefore would require much lower dosages than established in controlled clinical trials on Caucasians [www. drug-interactions.com]. When individual pharmacogenetic profiles for medication-typing can be established the same way we easily can establish individual profiles in blood-typing, personalized drug delivery is possible and ethically required (Paul 2003; Lindpainter 2003). The fears that genotyping for drug metabolism will lead to discrimination are not convincing, they are theoretical, ethically unfounded. Blood typing did not lead to discrimination, even though some individuals have bloodtypes which are more rare, at least in certain populations, and therefore might have less access to blood replacement. Blood profiles and medication profiles do not describe disorders, i.e. an individual aberration from a generic image, rather they constitute different types, variations, none of which is the ‚normal‘ one. We have a model of variation, not one of order and disorder. It would have been a crime against humanity and an inexcusable wrong towards all fellow humans who would have died and would die of their lives could not be saved by blood transfusion based on proper bloodtyping. In drug metabolism as in every metabolic property the concept of normal versus disorder is wrong, as there is no normalcy, only differences in expression and action. Genotyping for drug compatibility causes no significant other ethical concerns than those associated with blood typing: clinical reliability of typing procedures, equal access to typing services, no t568 Genetik in Public Health Te i l 2 / 2 0 0 7 (medication prescribing) intervention prior to typing. The new scenario of metabolism typing has consequences for the traditional and accepted bioethical setup of vaccine development, clinical trials, prescription procedures, and nutrition advice. Therefore it should be considered unethical to not include genotyping into drug development and to establish efficacy, dosage, and side-effects for major types of metabolizers based on cytochrome P450 isoform properties and composition. Individuals have a civil right to information about their individual proteonomic and enzymatic properties for metabolizing drugs and nutrition. This informational right would best be served by providing inexpensive individual Drug and Nutrition Cards and access to information and education; also those drug-and-nutrition-chips need to become the golden standard in drug prescription based on metabolizer-type clinical research (Sass 2004a). As we individually differ in more than enzymes and protein metabolism, it would only be consequent to provide citizens with individual Health Care Cards containing information on individual genetic or acquired properties, abilities, disabilities and disorders such as risk of hypertension or diabetes. Data availability is the precondition for good diagnosis and prognosis, and subsequently for prevention and treatment. Personal data, including data on health and health care are the informational property of the individual. In other areas of life we share these informational properties with others for our own benefit convenience, such as with credit card providers, supermarkets, libraries, online-merchants, and insurers of various kind. Of course, we rightly worry about protection of private data; we have laws and regulations protecting private data which work most of the time; we accept these risks as we balance risk with benefit. Individual rights on individual health information should not be treated differently than other informational property rights. Citizens are informational property owners of data concerning individual health status and health care. It is in their best interest to have Health Care Cards and to share information with professionals in a protected framework as data availability becomes an important feature within a new model of data protection. Health care professionals cannot provide quality service if denied access to information necessary for providing safe and efficacious service. It would be extremely difficult to argue that those who do not share personal health status data with professionals can ever request those services or will get best possible service. If data are not stored and be made available, rather being generated every time anew, then costs will skyrocket without additional benefit and therefore those who do not entrust personal data to individual Health Care Cards should accept the higher costs of more 569u Health Care Competence expensive procedures. As far as the principle of solidarity is concerned, data availability is not only a prerequisite for good health care, it is also a potential factor to reduce costs. 4. Contractual choice and the ethics of genetik research Finally, reforms are necessary in clinical trials and human experimentation based on new challenges and opportunities particularly in genetic research, DNA-sampling and DNA-storing. It is my thesis that the traditional softpaternalism principle of informed consent has to be replaced by the principle of informed contract, detailing for researchers and probandi or patients rights and obligations, liberating probandi and patients from their passive role of just consenting to a more adequate position of being a partner. In particular, issues of research in drug metabolism, DNA-sampling, and diseasespecific research cannot be justified without taking into account the probable benefits to the patient or her or his families. Modern medical research will find quite a lot of information about pedigree and family members, which cannot be taken care of by the concept of individual consent only by those who participate in the research. For genotyping in highly defined populations of patients suffering from certain subgroups of cancer or other diseases and receiving specific medication, it has been debated whether traditional models of informed consent would be enough for multipurpose longterm DNA-banking. It probably means to overburden the informed consent principle in dealing efficiently with DNAbanking and the probable benefits to the patients and their families. Giving just informed consent to draw blood for unspecified research might not be in the interest of the patient, even though such a consent might benefit the research and other patients in the future. Informed consent forms rarely address issues of multipurpose screening and longterm storage. It has been suggested that for genotyping only specific informed consent should be requested and that further use should be covered by new specific re-consent. On the other hand generic consent forms - in particular for prenatal and newborn screening - were proposed, but others criticized such an approach as lowering the standards of informed consent. As the probability of benefits in cross-purpose genotyping and of future yet to be specified re-testing and new-testing is of great moral importance for the individual patient, patient groups and the progress of clinical research, one should work with a contract model, describing the obligation of the t570 Genetik in Public Health Te i l 2 / 2 0 0 7 researchers to inform the patient on all or some of their findings and establish a contract spelling out the obligations towards the patient and her or his family: ‚We ask you to sign a contract for genetic testing on information and properties which might or might not be associated with your disease and how they are associated with it; this might take along time and we might look for information we don‘t know yet. We make it our legal obligation to inform about any finding which might benefit your treatment and which might be beneficial to members of your family. Also, at any given time, you or your representative has the right to cancel this contract and to request that your biological properties be destroyed. If you want to share in possible financial gain associated with this particular research, we will provide you with a separate contract‘ (Sass 1998; 2001a; 2001b; Sass 2004a). Within the contract, patients or their legal representatives must be informed on standard data-protection. In order to solve complex issues of privacy and disclosure, the right not to know, and the duty to know, the contract must provide, that patients can make their own choices (a) for mandating disclosure of individual predictive, preventive, or therapeutic knowledge, (b) for refusal of all or some information, and (c) for postponing such a decision for later based on then existing individual circumstances or clinical results. The moral issues of informing and protecting family members similarly will have to be addressed within the contract by allowing the patient to choose among a number of procedures by which family members of various degree may or not be involved, informed, or invited. It is time to replace an outdated informed consent model totally or in part and replace it by a contract model in which stakeholders such as probands, researchers and sponsors delineate moral and legal contractual rights and obligations. Some informed consent forms include already features of informed contracts (cf. Sass 2001a), but WHO and the European Forum for Good Clinical Practice have not yet addressed these issues or come up with proposals for reform. An excellent example on how the ethics of diagnostic research is changing towards a more appropriate appreciation of individual and family health care competence and decision making as partners in research is a statement by HUGO of November 2002 on choices in data availability within a firm model of data protection and privacy protection: ‚The choices and privacy of individuals, families and communities should be respected: (a) choices may be with regard to: donation, storage and use of samples and the information derived therefrom (e.g. specific, related or other uses subject to authorization by an ethics committee, etc). Informed consent may include notification of uses (actual or future), or opting out, or, in same cases, blanket consent. (b) Mechanisms should be established to ensure respect for such 571u Health Care Competence choices. (c) Participants should be informed about the degree of identifiability of their data (e.g. coded, anonymized, aggregate, etc) and the security mechanisms in place to ensure confidentiality. (d) Participants should be told that samples or the information derived therefrom may be shared with other researchers including those from other countries, with commercial entities and through publication and availability on the WEB‘ (HUGO 2003). 5. Informed contracts handling individual and communal values Modern medicine, recognizing the principle of autonomy and self-determination as a most basic human and civil right, allows for clinical research and medical treatment only, of the proband or patient has given free and informed consent based on individual concepts of risk, benefit, values, fear, and hopes. Global recognition of the informed-consent principle correlates to the vision of universal human rights, as expressed by the United Nations Declaration in 1948 and being a fruit of the processes of enlightment and emancipation since the European age of Reason. If immediate medical treatment is required in order to save life, the informed consent principle cannot be used as life and survival of patients is the higher principle, the highest order. Good as it looks in principle, there are quite a number of well-documented cases where the informed consent principle does not work or is used in an abusive and exploitative manner: 1.) If people do not clearly understand risks and benefits associated with research and treatment, oral or written consent is void. 2.) If people feel an ‚obligation‘ to sign forms, such consent is not given freely. 3.) If researchers cannot or do not adequately inform probands or physicians their patients, signed forms are a smokescreen only to hide that true informed consent is not given; however the legal requirements seem to be satisfied. In general, the informed-consent principle has been developed at a certain historic time under specific post-enlightment cultural conditions. It is a very useful tool to protect vulnerable persons from abuse; properly used it is the best tool available to protect human dignity and civil rights. However, even if no abuse is intended, there seem to be cultural obstacles associated with its rigid implementation under the maxim ‚one size fits all‘. We see already standard deviations, exemptions and modifications form the general rule: 1.) consent for minors is given by their ethical and/or legal representatives, mostly the parents. 2.) competent adults may designate another person to give consent on their behalf, either immediately or under certain conditions in the future. 3.) The consent required from psychiatric patients is related t572 Genetik in Public Health Te i l 2 / 2 0 0 7 to their particular disease and situation at a given time; however, there are well developed treatment contracts signed by patients and their caretakers for possible future situations known to and experienced by the patient [Sass 2003A]. Other cultures, even though they might be in transition being more and more influenced by post-enlightment European cultures of individualistic ethics, still have a strong sense of family ethics and family decision making for the good of the individual family member, thus traditionally giving consent for the good of an individual family member as family consent. The individualistic European model is seen as an intrusion into a different trust-and-responsibility structure and, if used, only legalistically and without any cultural or ethical authority and validity. Family consent is not without risk. It might be the elder male or female head of the smaller or larger family accepting responsibility for his or her relatives, and been trusted by them to make those decisions, even far-reaching ones such as marriage, education, job training. Some individuals or branches of the family might not trust the proxy decision maker; elders might violate the trust they are endowed with. These are the situations which have led to the rise of emancipation and enlightment in the Age of Reason. But there are still families and communities around for whom the model of an individual person making autonomous decisions by herself and for herself alone, is considered unethical, not supported by culture and values, actually decadent and perverse. In order to implement some of the visions and goals of the ‚informed consent‘ principle it might be helpful to at least work with a formula of ‚informed consent plus X‘, X being different supportive features depending on the special cultural and traditional attitudes and modes of decision making (Sass 2001a). Moral or social communities quite often address ethical issues by community consent, even though individuals are subjects under risk. In Western civilization, religious orders and closely controlled religious groups obey and consent to decisions made by their superiors. The fact that different cultural and moral communities have different values, wishes, hopes, and fears, is well used when making proxy decisions in medicine for incompetent persons. Schools of communitarian ethics place great emphasis on supporting and respecting communal values. Ethics committees in pluralistic societies include neighborhood representatives or representatives from religious or moral or social communities to which the incompetent persons belongs. If a village or province community widely and strongly shares religious, cultural and moral convictions, then most like individual preferences for participation in medical research or for medical treatment would be similar. 573u Health Care Competence Also, if this is a part of the specific culture, decisions would made by elders, wise men or women, elected or accepted otherwise. Researchers required to inform and educate and to gain consent, would be well advised to use the existing trust-and-responsibility structure for information and education and for contracting with the community and/or families and/or individuals (Zhai 2002; Tao 2002). Benefits for the community, for the families, and the individuals should be spelled out in detail. In the case of DNA sampling contacts should be made some time before DNA is sampled, and definitely a long time afterwards information and health care education services should be contracted and provided. The larger and the more complex the community is, the more risky will be a communitarian approach and the more features have to be developed and supported to protect dissenting individuals and groups. There might be situations of communities in cultural transition or under indoctrinating and exploiting elders or oligarchic groups, where the communitarian approach to protect vulnerable individuals and families will not work and cannot work (Sass 2001a, 2004a). It is only common sense to recognize that probands expect ‚something‘ in return for their participation; this ‚something‘ can be personal recognition, personal attention, individual or general health care advice, better hygiene, fresh water or nursing care for the community. Recent CIOMS guidelines for medical research in ‚populations and communities with limited resources‘ recommend: ‚the sponsor and the investigator must make every effort to ensure that: the research is responsive to the health needs and the priorities of the population or community in which it is to be carried out; and any intervention or product developed, or knowledge generated, will be made reasonable available for the benefit of that population or community‘ (CIOMS 2002, p.51). The Nuffield Council on Bioethics (2002, p.116) suggests ‚that sponsors of research should require that the development of local expertise in healthcare is an integral component of research proposals. Consideration should be given to the extent to which any strengthening of local healthcare facilities can be done in such a way that the changes are sustainable in the local context once the research is over.‘ Given the diversity of individual and collective cultures in decision making, one size of consent does not fit all. It seems to be clear, that the classical model of informed consent has outlived its useful life as a general standard for all, for each and every personal, familial, communitarian, cultural or legal situation. Where the basic cultural attitudes and legal preconditions are not in place to make the classical form of informed consent the preferred and most useful tool, it cannot be made a requirement that medical experts first of all change cultures and attitudes and then proceed with their medical work. It t574 Genetik in Public Health Te i l 2 / 2 0 0 7 is also not acceptable that medical experts turn a blind eye on the missing of essential prerequisites for making informed consent work. Everyone has to work on implementing human rights and free decision making by competent and risk-literate adults; this task cannot be put on the physicians alone. Also, there might be true ethical situations where coherent trust-and-responsibility structures within families or communities are well developed, by cultural or religious tradition and in the history of ideas supported and proven to working well in quite a number of cases. In those situations it would be culturally and ethically insensitive and counterproductive to destroy a working network of trust, hope, responsibility, and reliability in order to replace it by a model developed under different cultural and historical conditions. Models of contract rather than one-sided still soft-paternalistic consent might work better in all situations. Additionally, all culturally sensitive models, respecting human dignity in protecting choices made on the basis of personal convictions and visions would need ‚escape clauses‘ or ‚conscience clauses‘ allowing each and every individual to decide for herself or himself on the basis of individual self determination about her or his place in a moral community and in regard to community values and decision making. Great emphasis has to be laid on developing culturally sensitive tools and procedures for those who do want to make their own choices, even though values and attitudes in their community or family suggest otherwise. As genes are individually different, so are individual challenges and individual choices. Progress in human genetics offers new dimensions of health literacy, health promotion, risk factor management and wellness for the individual citizen; it is a challenge for public health professionals and public health institutions to provide citizens with adequate service, guidance and governance in the new age of e-health, environmental health, and lifestyle health. 575u Health Care Competence Literatur Council for International Organiszations of Medical Science (CIOMS) (2002): International Ethical Guidelines for Biomedical Research involving Human Subjects. Geneve. Fan R (1997): Self-determination vs. family-determination: two uncommensurable principles of autonomy. Bioethics 11(3/4), 309-322. Hartmann F (2003): Kranke als Gehilfen ihrer Aerzte. Bochum: Zentrum für Medizinische Ethik. Human Genome Organisation (HUGO) (2003): Statement on Genetic Screening (November 2002). Eubios J Asian Intern Bioethics 133. Kielstein R, Sass HM (2002): Genetics in Kidney Disease. How much do we want to know? Am J Kidney Disease 39, 637-652. Lindpainter K (2003): Pharmacogenetics and the future of medical practice. J Molec Med 81 (special issue), 141-153. Ni Peimin (1999): Confucian virtues and personal health. Fan R (Hrsg.): Confucian Bioethics. London: Kluwer, 27-44. Nuffield Council on Bioethics (2002): The Ethics of Research related to Healthcare in Developing Countries. London: Nuffield Council. Paul NW, Roses AD (2003): Pharmacogenetics and pharmacogenomics: recent developments, their clinical relevance and some ethical, social and legal implications. J Molec Med 81, 135-140. Roizen MF (1999): Realage. Are you as young as you can be? New York: Harper Collins. Sass HM (1988): National health care systems: concurring conflicts Sass HM, Massey RU (Hrsg.): Health Care Systems. Dordrecht: Kluwer, 1536. Sass HM (1991): My right to care for my health. Bole TJ, Bondeson WB (Hrsg.): Rights to Health Care. Dordrecht: Kluwer, 243-255. t576 Genetik in Public Health Te i l 2 / 2 0 0 7 Sass HM (1995): Some Cultural and Ethical Reflections on Moleculargenetic Risk Assessment. Proceedings of the International Bioethics Committee 1994, vol. II, Paris: UNESCO. Sass HM (1998): Genotyping in Clinical Trials: Towards a Principle of Informed Request. Journal of Medicine and Philosophy 23, 288-296. Sass HM (2001a): A Contract Model for Genetic Research and Health Care for Individuals and Families. Eubios 11(5), 130-132. Sass HM (2001b): Brauchen wir neue klinisch-ethische Modelle in der medizinischen Forschung? Wien Klin Wochenschr 113(22), 863-866. Sass HM (2002): Medical technologies and universal ethics in transcultural perspective. Engelhardt HT, Rasmussen L (Hrsg.): Bioethics and Moral Content. National Traditions of Health Care Morality. Dordrecht: Kluwer 2002, 49-75. Sass HM (2003a): Bürger- und Patientenaufklärung bei genetischem Risiko. Sass HM, Schröder P (Hrsg.): Patientenaufklärung bei genetischem Risiko. Münster: Lit, 41-56. Sass HM (2003b): New options for health care policy and health status insurance: citizens as customers. Croatian Med J 44(5), 562-567. Sass HM (2004a): Angewandte Ethik in der Pharmaforschung. Bochum: Zentrum für Medizinische Ethik 38. Sass HM (2004b): Asian and Western Bioethics - Converging, conflicting, competing? Eubios J Asian Intern Bioethics 14(1), 13-22. Sass HM (2004c): E-Health, Health Promotion, and Wellness in Cyberspace. Eubios J Asian Intern Bioethics 5. Sass HM, Zhai XM (2004): E-Health. A yet to be recognized issue in medicine and medical ethics. Eubios 14(4), 147-148. Schröder P (2002): Vom Sprechzimmer ins Internetcafé: Medizinische Informationen und ärztliche Beratung im 21. Jahrhundert. Bochum: Zentrum für Medizinische Ethik. 577u Health Care Competence Tao J (2002): Autonomy and care: a Chinese approach to the art of informed consent. Proceedings of the IV Asian Conference on Bioethics, Nov 2002, Seoul: National University Seoul. 265 [abstract] World Health Organization (1998): Proposed International Guidelines on ethical issues in medical genetics and medical services Geneva: WHO [doc.ref. who/hgn/gl/eth/98.1] Zhai X (2002): Informed consent in medical research. Proceedings of the IV Asian Conference on Bioethics. Nov 2002, Seoul: National University Seoul, 6 [abstract] t578 IV. Ethik und Policy Genetik in Public Health Te i l 2 / 2 0 0 7 How to Get the Message Through? Peter Metraux 579u t580 Genetik in Public Health Te i l 2 / 2 0 0 7 Inhalt IV. Ethik und Policy How to Get the Message Through?......................................... 582 Literature............................................................................. 590 581u How to Get the Message Through? On May 1st 2003 the American President George W. Bush announced on the aircraft carrier Abraham Lincoln: „Major combat operations in Iraq have ended“ (New York Times, May 2, 2002). Some days later the „Program on International Policy Attitudes“ at the University of Maryland conducted a poll. One of the questions was: „Is it your impression, that Iraq did (or did not) use chemical or biological weapons in the war that just ended?“ 22% of the respondents said that it had (Kull et al. 2003, p.5). Mid-June an ABC/Washington-Post-poll asked the question even more precisely: „Do you believe that Iraq did or did not use chemical or biological weapons against U.S. troops during the war earlier this year?“ This time even 24% said that they thought it had. (Kull et al. 2003, p.5) The American media had covered the war in Iraq for weeks and months around the clock without ever claiming anything like this. Some media reminded only, that Saddam Hussein had used poison gas against the Kurds – 15 years earlier – and that maybe he was in possession of chemical weapons that he could use against American soldiers. „How to get the message through?“ is the title I chose for this paper. And with „through“ I don‘t mean through to the small group of especially interested, but to the demoscopic majority which forms the so called „public opinion“ that finally decisively influences politics. Because politicians desperately relay on polls. The previous example is extreme, sure – but it shows: The publics‘ perception of reality may be completely distorted by powerful filters and obstacles. And actually that is also true when it comes to communicating facts and developments in genetics. When health professionals try to make their findings or concerns public, they often will be disappointed or irritated at the result of their efforts. Their messages of course are not so frightening as reports on the war in Iraq. But the public may still take them in only fragmentarily and connect them with unintentional conclusions. Or even worse: The public may not take them in at all. And as the world is perceived through the media, what is not communicated does simply not exist. Therefore, it may be helpful, to outline some of the factors, that influence the messages one wish to get to the public. First of all: The daily amount of the worldwide produced information is so huge, that only a tiny fraction of it finds its way into the mainstream media. t582 Genetik in Public Health Te i l 2 / 2 0 0 7 (I‘m not talking here about specialized medical and scientific journals but about the newspapers, radio and TV programs that want to reach a wide public.) There are powerful filters selecting the information which is made public. The most powerful ones are the news agencies. They are literally ruling the world of communication. And they mainly select on one single criterion: what sells best. Meanwhile, this criterion has become one of the most decisive ones for most of the media. Let‘s take an example: One of the scientists‘ favorite pets in studying genetics is an animal with the charming name C. elegans. This worm became a media-star five years ago, when it was sequenced as the first multicellular. Then it was being promoted as having similarities with human beings. Finally C. elegans won the Nobel Prize. Or maybe its promoter Sidney Brenner won it. And the New York Times even wrote an editorial in its honor – entitled „Ode to a Worm“ (New York Times, Oct.9, 2002). Those are stories that sell: Discoveries combined with „human touch“. Meanwhile the community of C. elegans researchers has expanded to over one thousand. When scanning the Internet one can land more than 170.000 – C. elegans-hits, and there are even C. elegans-Conferences around the world. But the media coverage has been shrinking since, despite a lot of additional and important insights this tiny animal has given us so far. (The 170.000 Internet hits I mentioned are mostly publications inside the scientific community.) The reason for the worm’s way back from stardom to a kind of wallflower status was that it had become sort of normal to get research-results relating to C. elegans. And normality isn‘t news worthy. The media want the extraordinary. So a new attractive combination of factors was necessary to bring the worm back into the spotlight. This happened when researchers recently discovered a gene related to drunkenness in this poor creature – a discovery with maybe promising prospects for treating alcoholism in human beings. In view of the widespread phenomenon of drunkenness in our societies our tiny worm now has a chance to become a shining star again. A journalist from a news agency had a good nose for this story and wrote it with the necessary ingredients: „McIntire, the researcher, can now spot a soused worm about as well as a highway patrol-trooper can spot a drunken driver. He and other scientists dosed hundreds of thousands of worms with enough alcohol that they would be too drunk to drive legally – if they were human....“ (Assosiated Press, Dec. 11, 2003). 583u How to Get the Message Through? The discovery of McIntire and his colleagues was published first in the scientific journal „Cell“. There the article had the title: „A Central Role of the BK Potassium Channel in Behavioral Responses to Ethanol in C. elegans“ (Davies et al. 2003). It is evident that a report written in this scientific manner couldn‘t make headlines. But with the „translation“ into popular language, the worm made it back into most of the US mainstream media. I would like to give another recent example of this human-touch element which is making the news prime time suitable: „The first gene linked directly to heart attacks has been isolated from an extended Iowa family that has been plagued for generations with rampant coronary artery disease.“ Then the report I refer to tells that the great-grandfather of that family gave the initial spark for the research: „Don Steffensen, 74 ... told researchers about his family in hopes they could find a way to stem the deadly heart attacks that had plagued the family for decades“ (Associated Press, Dec. 4, 2003). Worms who are so drunken that they could not drive cars if they were human beings. A great-grandfather who helps researchers detect a defect gene that may cause heart disease. Those embroidering elements are helpful to push research results from specialized publications into the mainstream media. Scientists themselves often could promote their work much better if they would find ways to link the substance of their research with this kind of soft news. One may like it or not: The trend in the mainstream media increasingly goes towards infotainment. As Neil Postman predicted nearly 20 years ago in his book „Amusing Ourselves to Death“ (Postman 1985): Under the spreading laws of private television the public discourse is transformed into an adjunct of showbusiness.And health professionals have to toe the line, if they are eager to bring their message through to a broader public. Otherwise they will only make it into specialized reports in newspaper supplements or late evening documentaries. And there they will reach a a very limited public. To make their way to a broader public perception, reports on health issues have to take another hurdle: the length.The trend in the media goes mercilessly towards shorter and shorter bits. This makes it more and more difficult to transport complex messages. The compression of a 40-page-report to a 20-sentence-story in a newspaper is a barbarian act. And to reduce it to four sentences in a radio-news report is literally an act of mutilation. t584 Genetik in Public Health Te i l 2 / 2 0 0 7 Let‘s return to the Iowa family with the defect gene: The original report mentioned that more studies need to be done to determine whether or not this gene plays a role in heart disease among people outside of the family which inherited the mutation. Additionally the researcher is quoted saying that everybody in this widespread Iowa family with the gene mutation is destined to have the heart disease. He even goes so far to predict: „We‘re not talking about an increased risk. If you‘re not run over by a truck or get another disease first, you‘re going to have a heart attack.“ It is important to consider whether this additional information finds it‘s way into a 10-sentence newspaper-story. This can give the bare news a direction. Which would finally help shape the picture of genetics in the public opinion. One has to be aware, that every journalistic reduction process is subjective. It consists in a series of decisions for or against something. So there is no objectivity in the news business. The old Anglo-Saxon saying „comment is free but facts are sacred“ is not realistic. Now: What finally is communicated in the media depends on the journalist who is doing the reduction work. It depends on his personal view. And it depends also on his competence. And here, unfortunately, I have to say, that with shrinking budgets of time and money the quality of editorial adaptations of scientific material is shrinking. The media staff increasingly consists of generalists. And in the TV business eloquence and good looks sometimes are even more important than journalistic skills. So here again, the input of health professionals is crucial. They should literally be able to slip to a certain degree into an editors‘ skin: By deliberately composing summaries or by helping interlocutors find the important questions, they can direct the reduction process to a certain degree. I think everybody has watched this type of TV or radio interviews, where the interviewer asks three rather irrelevant questions and then says: „Thank you, Sir or Madam, we are running out of time.“ I have to mention another law of modern mass communication. There is a journalistic obsession around the world: everything has to be the latest news. News in the sense of happening now. It can be a real event like the discovery of an important gene, for instance, or the UN-debate on the ban of human cloning. But it also can be a news set artificially to get the medias‘ attention. Press conferences for instance are such agenda setting tools. With a press conference one can focus on a development which otherwise would pass unnoticed. It‘s always to upgrade a trend into a news-event. And that is what the media like: the news.Scientists may want to use this journalistic obses- 585u How to Get the Message Through? sion too in order to boost their messages. But they can even go a step further in their communication strategy. The media like the spectacular. A master in attracting global media attention by spectacular actions is Greenpeace. In the field of genomics Jeremy Rifkin chose this approach when he filed for a patent in 1997 for a method of cloning various types of embryo cells to produce chimeras. He and Steward Newman took this step not with the idea to really get the copyright. They mainly intended get broader media attention and provoke a public and legal debate over this direction of genetic research.The „Gene Shop“ experiment (Thum, Stollorz 2004) in Germany also was one of this attempts to draw attention to a special aspect of genetics by launching a witty happening. In mass communication there is a phenomenon one can maybe describe with the catastrophe theory in mathematics: There is no linear increase in media coverage with increasing importance of genetic news. At a certain level there is a sudden rise in attention. It‘s like a dam-burst: all media pounce on the event, there is a multiplying effect with repetitions, analysis, discussions and all sorts of experts giving their view. One of this type of breakthroughs in genetics was, when Dolly the sheep entered the scene. Cloning suddenly became a top topic. And the sheep gave scientists an opportunity to develop their views on different subjects of genetics to a broad public, to people who without Dollys‘ help never would have watched or read about it. But while many health related gene discoveries (as the ones linked to drunkenness or heart disease mentioned earlier) were given mostly positive media attention, cloning was from early on overshadowed by severe concerns about the potential misuse of this technology. There were not only fantasies but also founded fears, because some scientists declared from the very beginning that they intended to clone human beings. For example Richard Seed, Panos Zavos or Severino Antinori. When then just one day after Christmas in 2002 a sect called Realians claimed the birth of a human clone, a sect that believes we all descend from space aliens, then reality and science fiction definitively began to merge. This all the more because the announcement of the birth of Eve – as they named the baby – was given during a press conference in a Hotel in Hollywood. Not the big Hollywood in Los Angeles but the small one in Florida. Not an A movie, one could scoff at, but one of the B or C category. t586 Genetik in Public Health Te i l 2 / 2 0 0 7 Nevertheless, the Miami Herald for instance – one of the big and serious USnewspapers – dedicated almost the whole front page and two inside-pages to this event. „Science fact or fiction?“ the newspaper titled (The Miami Herald, Dec. 28, 2002). But quoted scientists didn‘t say it was simply a hoax. They voiced there skepticism and asked for proof. They also expressed moral concerns. Instead of downplaying the event, the Herald grasped the opportunity to communicate the basics of genetic engineering, the history of cloning, the political and legal perspectives and the difference between reproductive and therapeutic goals. Big news like the birth of Dolly or the clone baby Eve found its way into the media without help. This can be used as a bandwagon to direct the public attention to subjects, that otherwise would be lost in the daily media noise. However, the window of opportunity is very narrow. If health professionals want to benefit from it, they have to react quickly and be ready for interviews right away. It‘s like jumping on a moving train. If you miss it, it is gone. That‘s one of the very disturbing mechanisms in mass communication, this narrow window in time. What is big news today is old hat tomorrow. If we now look at the total reports on genetics in the media we first will realize, that they make up only a small fraction of all the news published or broadcasted. In 2003 for instance, a simple murder case – the murder of a pregnant women named Lacy Peterson – this murder case had much more coverage in the US TV-shows than all topics linked to genomics together. When we then consider what aspects are reported from the genomics field we will realize that there are severe disproportions. I don‘t have statistics quantifying the coverage of the different topics. But when I watch the media my impression is: Current social issues or information which are clinically relevant today are underrepresented. On the other hand reports with a futuristic touch are overplayed. Cloning it top. And science fiction is near. Perhaps we should say: „Science fiction becomes reality.“ Even if the earlier mentioned clone baby Eve is fake, even then human cloning may be impending. Early in 2004 South Korean scientists reported having created human embryos through cloning – not for reproduction, but a breakthrough anyway (New York Times, Febr. 12, 2004). So it makes quite sense, when, in a typical American anticipation, a Californian Company offers protection against unwanted doubling – protection through DNA copyright. The president of the company thinks: „A lot of people are going to want to clone people they admire“ (Crump 587u How to Get the Message Through? 2001). For celebrities worried they might fall victim of DNA-thieves, the DNA-Copyright-Institute in San Francisco is offering to store their DNA fingerprint and provide copyright and legal protection. I tried to find out if celebrities such as Michael Jackson or Britney Spears are already using this service, which was founded 2 1/2 year ago under loud media fuss. But I did not get a response to my email. However, the DNA-instituts‘ merchandising is working perfectly: I got the „DNA copyright“ hat I ordered without any problem for $15.99. Let‘s go back to the communication process. Getting the message through to the media is only half the way. The readers, listeners and viewers have yet to take note of it – and understand it properly.Here one should have no illusion. We all are bombarded with information. We take this in randomly and fragmentarily and voluntarily and only when we have time. When we are not especially interested in a subject we read just the headlines – if at all – and we zap through TV channels. So, unless we are personally or professionally motivated – and I think that‘s only a small minority of the population – without this motivation our knowledge of genetics will be very limited, incoherent and inconsistent. Inconsistent because the signals we get are often contradictory, not only the interpretations but also the scientific facts. For instance: Did Dolly die of premature aging because the sheep was cloned from an adult animal? Mostly I heard and read: Yes. But then I recently bumped into a TV-discussion, where a professor of molecular biology from Princeton University said: That‘s nonsense, all DNA from an adult person is old, sperms and eggs are old too (Silver 2003). So: What shall I think about Dollys‘ aging? The problem with the media and the way they are perceived, is, that very often contradictions are not resolved. I hear yes and I hear no – and nobody does the synthesis. (Among other things that is a consequence of the media‘s shrinking budgets of money and time I mentioned earlier.) And as people mostly don‘t do homework to fill in gaps or put together the puzzle, they remain with fragments of information. The additional input then comes from fictional TV-series like Emergency Room or from movies and novels.Or – even more important – the opinionforming process is influenced by persons and organizations which play an important role in someones‘ life: by medical staff, especially family doctors, by political parties, by schoolteachers or by religious groups. They may not t588 Genetik in Public Health Te i l 2 / 2 0 0 7 exactly provide details for a better understanding of the different aspects in genomics. But they probably give the guidance for judgments: whether a development is good or bad and whether it should be supported or disapproved. And – unfortunately – information gaps pretty often are filled with yellow-press junk. So, to give an extreme example, an American supermarket tabloid for instance, called „Weekly World News“, publishes all sort of bizarre and wild stories – also on genetics. Once I read a two-page article claiming that in a top secret memo to president Bush former CIA director Tenet had warned against a Hitler-clone cooperating with Osama Bin Laden – a clone created by the Soviet Union in possession of a frozen tissue sample from the Nazi Dictator (Weekly World News, Nov. 18, 2003). That‘s trash, of course, but it is written in a tabloid with a circulation of more than 400.000 and an estimated readership of about two Million – for which people are willing to pay two dollars. Such stories may help shape a completely distorted perception of genetic engineering in a lot of people. But remember that more than 20% of Americans believe that Saddam Hussein had used weapons of mass destruction against US soldiers in the current Iraq war. 589u How to Get the Message Through? Literatur Associated Press, e.g. MSNBC, Dec.11, 2003. Associated Press, e.g. abcNews, Dec. 4, 2003. Crump A (2001): President of the DNA Copyright Institute cited in: New Scientist, Aug. 25 http://www.eurekalert.org/pub_releases/2001-08/nscc082201.php (14.08.2006) Davies AG, Pierce-Shimomura JT, Kim H et al. (2003): A central role of the BK potassium channel in behavioral responses to ethanol in C. elegans. Cell 115(6): 655-666. Kull S, Ramsay C, Lewis E (2003): Misperceptions, the Media and the Iraq War. Political Science Quarterly, Vol 118( 4), 5. Lee Silver, Professor of molecular biology and public affairs at Prinecton University, in a Debate on Apr. 3, 2003, at the College of Communication at the University of Boston on „Shold Human Cloning be Banned?” . http://www.bu.edu/com/jo/news_clone.html New York Times, Febr. 12, 2004. New York Times, Oct. 9, 2002. New York Times, May 2, 2002. Postman, Neil (1985): Amusing Ourselves to Death. New York: Penguin. The Miami Herald, Dec. 28, 2002. Thum A, Stollorz V: „The Gene Shop – A Social Experiment“, Presentation held at the „International Symposium“ on „Public Health Genetics“ in Bielefeld, Febr.19th 2004. Weekly World News, Nov. 18, 2003, 24f. t590 IV. Ethik und Policy Genetik in Public Health Te i l 2 / 2 0 0 7 Gentests: Besonderheiten in der Versicherungswirtschaft Ursula Wandl 591u t592 Genetik in Public Health Te i l 2 / 2 0 0 7 Inhalt IV. Ethik und Policy Gentests: Besonderheiten in der Versicherungswirtschaft 1. Risiken: im Zentrum der Versicherungen.............................. 594 2. Das genetische Risiko....................................................... 594 3. Gentests......................................................................... 595 4. Prädiktive genetische Tests................................................ 596 5. Ängste vor dem medizinischen Fortschritt............................ 597 6. Zusammenfassung............................................................ 599 Literatur.............................................................................. 599 593u G e n t e s t s : B e s o n d e r h e i t e n i n d e r Ve r s i c h e r u n g s w i r t s c h a f t 1. Risiken: im Zentrum der Versicherungen Seit es Versicherungen gibt, hat sich am Versicherungsprinzip nichts geändert. Interessierte Versicherungsnehmer fragen eine Versicherung, ob diese ein definiertes Risiko deckt, etwa das Todesfallrisiko. Der Versicherer analysiert das Risiko und kalkuliert eine entsprechende Prämie. Gleichartige Risiken werden dann in einem Pool zusammengefasst. So werden idealerweise die wenigen Leistungsfälle durch jene Versicherte ausgeglichen, die glücklicherweise nicht zum Leistungsfall werden. Selbstverständlich hat sich auch die Versicherungstechnik im Laufe der Zeit entwickelt: von einer zu Beginn des letzten Jahrhunderts sehr groben Risikoeinschätzung hin zu einer heute wesentlich individuelleren und akkurateren Einstufung. Dank neuer Therapien und auf Grund der verbesserten medizinischen Diagnostik sind ehemals unversicherbare medizinische Risiken heute versicherbar. Auch sichern heute zahlreiche neue Sozialwie auch Privat-Versicherungsprodukte unterschiedliche Risiken ab, zum Beispiel Unfall, Leben, Berufsunfähigkeit, Dread Disease. Für diese das Gesundheitsrisiko abdeckenden Versicherungsprodukte wird zum Zeitpunkt des Versicherungsantrags der Gesundheitszustand des Antragstellers eingeschätzt. Im Gegensatz zu den gesetzlichen Versicherungen, denen das Solidaritätsprinzip zu Grunde liegt, ist in der privaten Versicherungswirtschaft das Einzelrisiko von Belang. Dabei werden nicht wie in der Sozialversicherung alle Risiken in einem einzigen Pool vereint, vielmehr werden vergleichbare Risiken in Risikogruppen zusammengefasst. Diese Risikogruppen spiegeln die unterschiedlichen Prämienkategorien wider. Dabei setzt sich das Einzelrisiko aus dem medizinischen Risiko, dem Umfang und der finanziellen Komponente der Risikoabdeckung zusammen. Wird ein erhöhtes Mortalitätsrisiko durch eine bereits bestehende Krankheit festgestellt, kann die betreffende Person in eine höhere Risikogruppe aufgenommen werden. Es wird eine entsprechend höhere Prämie kalkuliert. Der Versicherungsge sellschaft wie auch dem Versicherungsnehmer steht es frei, das jeweilige Risiko zu diesen Bedingungen zu versichern oder nicht. 2. Das genetische Risiko Die Entschlüsselung des menschlichen Genoms hat zu einem besseren Verständnis von Krankheitsentstehung und Diagnose geführt. Diese Konsequenzen haben eine Diskussion über die Versicherbarkeit von Individuen entfacht. t594 Genetik in Public Health Te i l 2 / 2 0 0 7 Die Erforschung des menschlichen Genoms lieferte innerhalb sehr kurzer Zeit viele neue Ergebnisse. Einige Erkrankungen sind nachweislich auf eine genetische Komponente zurückzuführen. Die Identifikation wichtiger Gene und ihrer Funktionen hilft, die molekularen Mechanismen von Erkrankungen zu verstehen. Diese Informationen dienen als Basis für die Entwicklung von neuen Medikamenten und Behandlungsmethoden. Es wird jedoch dauern, bis dieses Wissen in die klinische Praxis umgesetzt sein wird. Anders verhält es sich in der Diagnostik: Die Etablierung von diagnostischen, also prädiktiven Gentests schreitet rasch voran. Sie sind zwischenzeitlich auch in den Mittelpunkt der sozialen, politischen und wirtschaftlichen Wahrnehmung geraten. Denn die Vielfalt der Möglichkeiten, die der medizinische Fortschritt eröffnet, wirft ethische, rechtliche und gesundheitsökonomische Fragen auf. Über sie zu entscheiden schafft wiederum Unsicherheiten, da aussagekräftige Erfahrungswerte noch fehlen. 3. Gentests Die Erkenntnis, dass genetische Veränderungen Krankheiten hervorrufen, hat zu neuen diagnostischen Methoden geführt – den Gentests. Hierbei wird menschliche DNS analysiert. Auf Grund dieser Analysen sind Aussagen über Abweichungen möglich, die auf bestimmte Krankheiten bezogen werden können. Veranlagungen für gewisse Erkrankungen können so frühzeitig erkannt (prädiktive Gentests) und bereits bestehende Krankheiten besser verstanden und klassifiziert, sowie mit einer effektiveren, maßgeschneiderten Therapie behandelt werden (diagnostische Gentests). Bisher sind nur wenige Veränderungen des menschlichen Genoms bekannt, die isoliert eine Erkrankung verursachen. Bei diesen so genannten monogenetischen Erkrankungen wie Chorea Huntington und familiärer Adenomatosis polyposis gibt ein verändertes Gen den Ausschlag für den Erkrankungsphänotypus. Die meisten dieser monogenetischen Erkrankungen sind nicht oder nur unzureichend therapierbar. Die häufigsten Erkrankungen, etwa Asthma, Diabetes oder Schizophrenie, sind multigenetisch und multifaktoriell; Umweltfaktoren spielen neben der Veranlagung eine Rolle. In diesen Fällen mag ein genetischer Test zwar ein erhöhtes Risiko anzeigen, doch das Auftreten der Erkrankung hängt von vielen weiteren Faktoren ab und ist daher nur bedingt vorhersehbar. Gab es 1990 rund 100 Gentests, sind es heute bereits über 1.000. Sie werden untergliedert in klinischen Gebrauch und Relevanz (Burke 2002). 595u G e n t e s t s : B e s o n d e r h e i t e n i n d e r Ve r s i c h e r u n g s w i r t s c h a f t n n n n n n Genträgertests (z. B. Thalassämie) Präimplantations- und Pränataltests (z. B. Down-Syndrom) Neugeborenenscreening (z. B. Phenylketonurie) diagnostische Tests (z. B. hereditäre Hämochromatose) prädiktive genetische Tests (z. B. Chorea Huntington) pharmakogenetische Tests (z. B. Alpha-Adducin) 4. Prädiktive genetische Tests Die molekulargenetische Diagnostik ist heute aus dem klinischen Alltag nicht mehr wegzudenken. Mit ihrer Hilfe werden Erkrankungen nachvollzogen und geklärt. Anders in der Versicherungswirtschaft; hier steht diese Art der Diagnostik nicht im Mittelpunkt der Diskussion. Denn erkrankte Antragsteller werden abhängig von Klinik, Therapie und Prognose auf Versicherbarkeit eingeschätzt. Der medizinische Nutzen prädiktiver Gentests ist noch unklar, Kosten und Effektivität werden kontrovers diskutiert. Ihre Anwendung zur Erkennung zukünftiger Erkrankungen bei präsymptomatischen, also gesund wirkenden Patienten scheint im klinischen Bereich viel versprechend zu sein. Kennt man die Veranlagung für eine bestimmte Erkrankungen, kann ihr Eintritt durch entsprechende Maßnahmen verzögert oder gar verhindert werden; Beispiele sind Fettstoffwechselstörungen sowie Diabetes mellitus Typ II. In diesem Zusammenhang steht die wesentliche Frage, ob sich die Aussage auf Grund eines prädiktiven Gentests überhaupt von der anderer medizinischer Tests unterscheidet. Ein vor kurzem veröffentlichter Artikel kommt zu dem Schluss, dass prädiktive Gentests vergleichbar sind mit anderen prädiktiven Labortests und sie deshalb im klinischen Alltag mit denselben Standards bewertet werden sollten; beide Testverfahren sind nicht invasiv und identifizieren Personen mit einem vergleichbar erhöhten Krankheitsoder Mortalitätsrisiko (Green, Botkin 2003). Die klinische Vorgehensweise ist ähnlich, der behandelnde Arzt bespricht vor dem Test die präventiven sowie die therapeutischen Möglichkeiten und deren Nutzen mit den Patienten. Auch J. Taupitz gelangt – aus dem juristischen Blickwinkel – zu der Auffassung, dass genetische Tests vom „Odium des Besonderen“ befreit werden sollten (Taupitz 2003). Bei prädiktiven Gentests wird nicht der Kranke, sondern der Gesunde untersucht und beraten. Auf Grund des aus einem Test gewonnenen Wissens können Ängste und Befürchtungen im Hinblick auf den Umgang und die Verwendung erwachsen. Die Versicherungswirtschaft ist mit diesen t596 Genetik in Public Health Te i l 2 / 2 0 0 7 Problemen konfrontiert. Denn ihre Aufgabe ist es, individuelle Vorsorge verantwortungsvoll zu gestalten und individuelle Lebenslagen sachgerecht abzusichern. Das Wissen, dass in Zukunft eine Erkrankung droht, die therapeutisch derzeit nicht zu beeinflussen ist, kann bei dem Betroffenen zu großen psychischen und sozialen Problemen führen. Nicht nur eine tief greifende Veränderung der Lebensperspektive ist Folge eines positiven prädiktiven Gentests bei fehlenden Behandlungskonzepten. Auch Mitglieder der Familie werden belastet. In diesem Spannungsfeld müssen daher bestimmte Voraussetzungen erfüllt werden: strenge Indikation, schriftliche Einwilligung zur Aufklärung, qualifizierte genetische Beratung vor und nach dem Gentest, Recht auf Nichtwissen und zuverlässiger umfassender Datenschutz. Die genaue Festlegung von Patientenrechten und die Frage, wie sie garantiert werden können, spielen hierbei eine wesentliche ethische Rolle. Für die deutsche Privatversicherungswirtschaft ist es selbstverständlich, das Recht auf Nicht-Wissen ihrer Kunden zu akzeptieren. Deshalb haben die deutschen Versicherer stets erklärt, prädiktive Gentests nicht zur Voraussetzung von Vertragsabschlüssen zu machen – und zwar ausnahmslos. Da es für eine risikogerechte Kalkulation der Prämien notwendig ist, vor Vertragsabschluss über die gleichen Kenntnisse zu verfügen wie der Versicherungsnehmer, haben die Versicherer sich zu einem Kompromiss bereit erklärt: Nach Gentests, die vor Vertragsabschluss durchgeführt wurden, wird bis zu einer Lebensversicherung über 250.000 Euro weder gefragt, noch wird das Ergebnis verwendet. Diese Position hat dennoch ein Unbehagen in weiten Kreisen der Politik nicht restlos beseitigen können. Zurück bleibt die unbegründete Befürchtung, Antragstellern könnte wegen der Anzeigepflicht eines genetisch bedingten Krankheitsrisikos der Vertragsabschluss verweigert werden. 5. Ängste vor dem medizinischen Fortschritt Den meisten Versicherungsnehmern sind die tieferen wissenschaftlichen Zusammenhänge von Mensch und Genetik nicht gänzlich klar. Mit Sorgen betrachtet wird der medizinische Fortschritt, insbesondere im Bereich der humangenetischen Forschung und deren Folgen. Schlagworte wie „gläserner Mensch“ und „Mensch nach Maß“ machen die Runde. Zahlreiche Mythen ranken sich um die Perspektiven prädiktiver Gentests, die genaue Aussagen zum Ausbruch von Krankheiten heute noch gesunder Menschen möglich machen. Daran ändern seriöse Aussagen von Experten wenig, die versichern, 597u G e n t e s t s : B e s o n d e r h e i t e n i n d e r Ve r s i c h e r u n g s w i r t s c h a f t der Mensch sei mehr als die Summe seiner Gene. Viele Menschen überschätzen die Vorhersehbarkeit auf Grund von genetischen Tests. Nur ganz wenige Tests können eine zukünftige Krankheit mit Sicherheit voraussagen. Ohnehin sind die meisten genetisch bedingten Veränderungen vom Zusammenspiel mehrerer genetischer Faktoren sowie von Umwelt und Lebensstil abhängig. Die Geschwindigkeit des wissenschaftlichen Fortschritts, der Zugang des Einzelnen zu informationsverbreitenden Medien, verbunden mit einer großen Skepsis gegenüber Wissenschaft, hat zu einer ganzen Reihe von Ängsten geführt, zum Beispiel vor sozialem Ausschluss, Diskriminierung oder Ausschluss von Bank- und Versicherungsgeschäften. Diskussionen um das Ausmaß der möglichen Eingriffe in den Verlauf menschlichen Lebens verändern das Werteverständnis unserer Gesellschaft nachhaltig. Die Europäische Akademie richtete eine Projektgruppe ein, die sich mit der Frage beschäftigte, ob der Einsatz genetischer Tests im Versicherungswesen zulässig sei. Dabei konzentrierten sich die Überlegungen der Projektgruppe auf den Markt für Lebensversicherungen. Mitglieder der interdisziplinären Projektgruppen waren Wissenschaftler aus Humangenetik, Gesundheitsökonomie, Medizin, Medizinrecht, Philosophie. Auf der Grundlage ihrer Arbeiten formulierten die Mitglieder der Projektgruppe eine Empfehlung: „Für den Markt privater Lebens- und Krankenversicherungen sehen die Autoren unter der Voraussetzung, dass angemessener Wettbewerb herrscht, derzeit keinen zusätzlichen Regelungsbedarf hinsichtlich der Erhebung und Verwendung genetischer Information. Abzulehnen sind insbesondere gesetzliche Bestimmungen, die es dem Versicherer verwehren, die Weitergabe von Kenntnissen über risikorelevante genetische Dispositionen vom Versicherungsinteressenten zu verlangen, über die dieser bereits verfügt (Bayrische Rückversicherung AG 2000). Die deutschen Versicherer haben sich veranlasst gesehen, den Sorgen der Bevölkerung entgegenzutreten und Ängste abzubauen, dass genetisch getestete Menschen mit einem Erkrankungsrisiko vom Versicherungsschutz ausgeschlossen seien. Daher hat die Versicherungswirtschaft eine zunächst bis zum Jahr 2006 befristete Verpflichtung abgegeben, in der sie auf die Durchführung freiwilliger prädiktiver Gentests verzichtet (Freiwillige Selb stverpflichtungserklärung der Mitgliedsunternehmen des Gesamtverbandes der Deutschen Versicherungswirtschaft e.V. 2000). t598 Genetik in Public Health Te i l 2 / 2 0 0 7 6. Zusammenfassung Gentests sind eine konkrete Methode, das Risiko eines Menschen festzustellen, genetisch bedingt zu erkranken. Gentests sind in einigen klinischen Disziplinen bereits in Anwendung. Bevor ein solcher Test allgemein eingesetzt wird, müssen seine Auswirkungen geprüft und sein Nutzen ermittelt werden. Wird der Einsatz von Gentests im klinischen Alltag befürwortet, sollten sie wie andere vergleichbare medizinische Tests gehandhabt werden. Die uneinheitliche Bewertung von genetischen Tests und ihre Definition würden nennenswert erleichtert werden, was wiederum zu einer besseren Akzeptanz in der breiten Öffentlichkeit führen würde. Die praktische Erfahrung mit Gentests wird künftig die großen Befürchtungen und Unsicherheiten, die durch noch unzulängliche Information hervorgerufen werden, ausräumen. Literatur Bayerische Rückversicherung Aktiengesellschaft, München (Hrsg.) (2000): Fachreihe der Bayerischen Rück: (Humangenetisches Symposium Nr. 29) [http://www.gdv.de/fachservice/15807.htm.] Burke W (2002): Genetic Testing. New England Journal of Medicine 347, 1867–1875 Green MJ, Botkin JR (2003): Genetic exceptionalism in Medicine: Clarifying the differencesbetween genetic and nongenetic tests. Annals of Internal Medicine 138, 571–575 Taupitz J (2000): Genetische Diagnostik und Versicherungsrecht - 4 Thesen. Versicherungsmedizin 3, 147–148 599u t600 Genetik in Public Health V. Autoren/Herausgeberverzeichnis Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n Public Health 601u Autoren/Herausgeberverzeichnis Dr. Carmen Bartel Institut für Sozialmedizin Universitätsklinikum Schleswig-Holstein, Campus Lübeck Beckergrube 43/47 23552 Lübeck Prof. Dr. Alfons Bora Institut für Wissenschafts- und Technikforschung (IWT) Fakultät für Soziologie Universität Bielefeld Postfach 100131 33501 Bielefeld Prof. Dr. Angela Brand MPH Deutsches Zentrum Public Health Genomics (DZPHG) Fachhochschule Bielefeld Kurt-Schumacher-Strasse 6 33615 Bielefeld Dr. Helmut Brand MSc Landesinstitut für den Öffentlichen Gesundheitsdienst NRW (lögd) Westerfeldstraße 35/37 33611 Bielefeld Dr. Katja Bromen MPH European Commission Health and Consumer Protection Directorate-General (DG SANCO) Unit C7- Risk Assessment B-1049 Bruxelles Prof. Dr. Peter Dabrock M.A. Juniorprofessur für Sozialethik (Bioethik) Fachbereich Evangelische Theologie Philipps-Universität Marburg Lahntor 3 35037 Marburg t602 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Prof. Dr. Wolfram Henn Institut für Humangenetik der Universität des Saarlandes Universitätskliniken, Bau 68 66421 Homburg/Saar Dr. Karl Kälble Abteilung für Medizinische Soziologie Albert-Ludwigs-Universität Freiburg Hebelstr. 29 79104 Freiburg Dr. Dagmar Lühmann Institut für Sozialmedizin Universitätsklinikum Schleswig-Holstein, Campus Lübeck Beckergrube 43/47 23552 Lübeck Peter Metraux (†)1 6538 Collins Ave Miami Beach, FL 33141 USA Dr. Hermann Neus Behörde für Wissenschaft und Gesundheit Abteilung Verbraucherschutz Fachabteilung Gesundheit und Umwelt (G25) Billstraße 80 20539 Hamburg 1 Peter Metraux ist während der Erstellung dieses Bandes verstorben. Die Mitglieder der ZiF-Kooperationsgruppe „Public Health Genetics“ und die Teilnehmer des internationalen Symposiums „Public Health Genetics – Risks and Challenges“ werden den renommierten schweizerischen Rundfunkjournalisten als kritischen Zuhörer, inspirierenden Beitragenden und menschlich herausragende Persönlichkeit in Erinnerung behalten. 603u Autoren/Herausgeberverzeichnis Prof. Dr. Notburga Ott Lehrstuhl Sozialpolitik und öffentliche Wirtschaft Fakultät für Sozialwissenschaft GCFW/04 Ruhr-Universität Bochum 44780 Bochum Prof. Dr. Norbert W. Paul M.A. Institut für Geschichte, Theorie und Ethik der Medizin der Johannes Gutenberg-Universität Am Pulverturm 13 55131 Mainz Prof. Dr. Dr. Heiner Raspe Institut für Sozialmedizin Universitätsklinikum Schleswig-Holstein, Campus Lübeck Beckergrube 43/47 23552 Lübeck Prof. Dr. Hans-Martin Sass Zentrum für Medizinische Ethik Ruhr Universität Bochum D- 44780 Bochum Prof. Dr. Stefan Schreiber Universitätsklinikum Schleswig-Holstein Christian-Albrechts-Universität zu Kiel Schittenhelmstrasse 12 24105 Kiel Dr. Peter Schröder Landesinstitut für den Öffentlichen Gesundheitsdienst NRW (lögd) Westerfeldstraße 35/37 33611 Bielefeld t604 Genetik in Public Health Te i l 2 : I n t e g r a t i o n v o n G e n e t i k i n P u b l i c H e a l t h Prof. Dr. Ipke Wachsmuth Geschäftsführender Direktor Zentrum für interdisziplinäre Forschung (ZiF) Wellenberg 1 33615 Bielefeld PD Dr. Ursula Wandl Medical Director Swiss Re Germany AG 85773 Unterföhring bei München Dr. Christa Wewetzer Zentrum für Gesundheitsethik (ZfG) an der Evangelischen Akademie Loccum Knochenhauerstr. 33 30159 Hannover 605u t606 Westerfeldstraße 35/37 33611 Bielefeld Fax 05221 8007-200 [email protected] www.loegd.nrw.de Genetik in Public Health • Teil 2: Integration von Genetik in Public Health Landesinstitut für den Öffentlichen Gesundheitsdienst des Landes Nordrhein-Westfalen Genetik in Public Health Teil 2: Integration von Genetik in Public Health Wissenschaftliche Reihe 24 www.loegd.nrw.de