Übungsblatt 11
Werbung
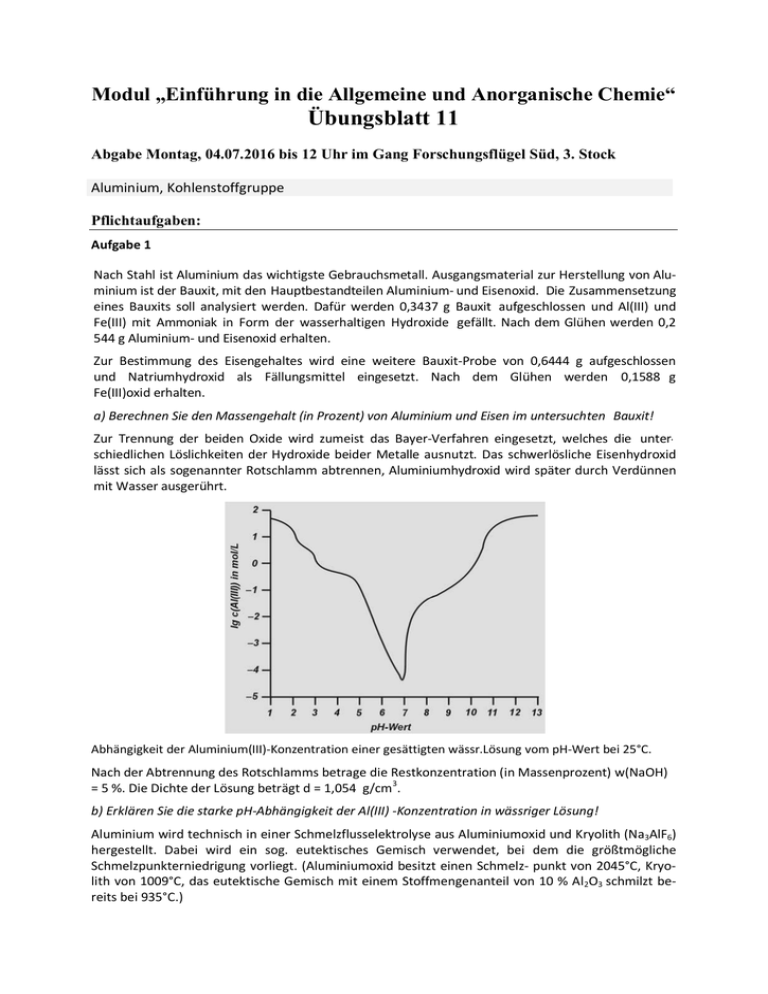
Modul „Einführung in die Allgemeine und Anorganische Chemie“ Übungsblatt 11 Abgabe Montag, 04.07.2016 bis 12 Uhr im Gang Forschungsflügel Süd, 3. Stock Aluminium, Kohlenstoffgruppe Pflichtaufgaben: Aufgabe 1 Nach Stahl ist Aluminium das wichtigste Gebrauchsmetall. Ausgangsmaterial zur Herstellung von Aluminium ist der Bauxit, mit den Hauptbestandteilen Aluminium- und Eisenoxid. Die Zusammensetzung eines Bauxits soll analysiert werden. Dafür werden 0,3437 g Bauxit aufgeschlossen und Al(III) und Fe(III) mit Ammoniak in Form der wasserhaltigen Hydroxide gefällt. Nach dem Glühen werden 0,2 544 g Aluminium- und Eisenoxid erhalten. Zur Bestimmung des Eisengehaltes wird eine weitere Bauxit-Probe von 0,6444 g aufgeschlossen und Natriumhydroxid als Fällungsmittel eingesetzt. Nach dem Glühen werden 0,1588 g Fe(III)oxid erhalten. a) Berechnen Sie den Massengehalt (in Prozent) von Aluminium und Eisen im untersuchten Bauxit! Zur Trennung der beiden Oxide wird zumeist das Bayer-Verfahren eingesetzt, welches die unterschiedlichen Löslichkeiten der Hydroxide beider Metalle ausnutzt. Das schwerlösliche Eisenhydroxid lässt sich als sogenannter Rotschlamm abtrennen, Aluminiumhydroxid wird später durch Verdünnen mit Wasser ausgerührt. Abhängigkeit der Aluminium(III)-Konzentration einer gesättigten wässr.Lösung vom pH-Wert bei 25°C. Nach der Abtrennung des Rotschlamms betrage die Restkonzentration (in Massenprozent) w(NaOH) = 5 %. Die Dichte der Lösung beträgt d = 1,054 g/cm 3. b) Erklären Sie die starke pH-Abhängigkeit der Al(III) -Konzentration in wässriger Lösung! Aluminium wird technisch in einer Schmelzflusselektrolyse aus Aluminiumoxid und Kryolith (Na3AlF6) hergestellt. Dabei wird ein sog. eutektisches Gemisch verwendet, bei dem die größtmögliche Schmelzpunkterniedrigung vorliegt. (Aluminiumoxid besitzt einen Schmelz- punkt von 2045°C, Kryolith von 1009°C, das eutektische Gemisch mit einem Stoffmengenanteil von 10 % Al2O3 schmilzt bereits bei 935°C.) Wenn analoge Gallium(III)-Salze in Wasser gelöst werden, bildet sich zunächst eine klare Lösung. Dann fällt jedoch langsam ein weißer Niederschlag von GaO(OH) aus. c) Stellen Sie eine vollständige Reaktionsgleichung für den Vorgang auf und schlagen Sie eine Möglichkeit vor, wie das Gallium(III)-Ion in Lösung gehalten werden kann. Die Abhängigkeit der Schmelztemperaturen von den Stoffmengenkonzentrationen der Bestandteile einer binären Mischung kann für einen konstanten Druck in einem Schmelzdiagramm dargestellt werden. Mit Hilfe des Gibbsschen Phasengesetzes (Zahl der Phasen + Zahl der Freiheitsgrade = Zahl der Bestandteile +2) lässt sich für jeden Punkt im Diagramm bestimmen, wie viele Parameter ohne eine Änderung im System variiert werden können. Schmelzdiagramm für das System Aluminiumoxid/Kryolith d) Bestimmen Sie für die eingezeichneten Punkte 1, 2, 3 und 4 die Freiheitsgrade nach der Gibbs-schen Phasenregel. Aluminium(III)chlorid besitzt einen Schmelzpunkt von nur 192,4°C. Dennoch wird weitgehend darauf verzichtet AlCl3 für die elektrochemische Gewinnung zu verwenden. d) Geben Sie eine Begründung! Aluminiumoxid reagiert bei hohen Temperaturen mit Kohlenstoff zu Aluminiumcarbid. Aluminiumcarbid liefert bei der Hydrolyse u.a. ein Gas. Hf0 in kJ/mol Al4C3 (s) - 129,2 H2O (l) - 285,83 Gas bei der Hydrolyse - Al(OH)3(s) - 2567,0 74,8 S 0 inJ/(mol·K) 105 69,91 186,26 140,2 e) Formulieren Sie die Bildungsgleichung von Aluminiumcarbid sowie die Reaktionsgleichung der Hydrolyse (mit der Formel für das entstehende Gas)! Berechnen Sie die Gleichgewichtskonstante der Hydrolysereaktion bei 25°C. Auf welche Seite liegt das Gleichgewicht der Reaktion? f) Welche Masse Aluminiumcarbid wird benötigt, um 100 L des bei der Hydrolyse entstehenden Gases zu erzeugen (p = 1013 hPa, T = 298 K)? Auch Interkalations (oder Einlagerungs-) verbindungen von Graphit lassen sich formal zu den Carbiden zählen. Viele Elektronendonatoren, wie Alkali-, Erdalkali- oder Lanthanoidmetalle lagern sich in eine Graphitmatrix mit unterschiedlicher Stöchiometrie ein. Die Abbildung zeigt die Elementarzelle einer Kalium- Kohlenstoff-Interkalationsverbindung. Elementarzelle einer Interkalationsverbindung von Kalium in Graphit aus zwei unterschiedlichen Perspektiven (die schwarz gefärbten Atome befinden sich teilweise in benachbarten Elementarzellen, große Atome: Kalium, kleine Atome: Kohlenstoff) g) Bestimmen Sie die Summenformel der dargestellten Verbindung. Das Oxid von Aluminium findet sich in Form von Korund in zahlreichen natürlichen Lagerstätten. Der farblose Korund ist die fünfthärteste Substanz, die man kennt, und wird daher als Polier- und Schleifmittel eingesetzt. In der Kristallstruktur bilden die O2--Ionen eine hexagonal-dichteste Kugelpackung, die Al3+-Kationen besetzen 2/3 der Oktaederlücken. 1/3 der Oktaederlücken bleibt – in geordneter Weise – unbesetzt. h) Berechnen Sie die Gitterenergie von Korund (M = 4.17; 0 = 8,854 ×10 12 F m 1 = 8,854 ×10 12C2J 1m 1; d(Al-O) = 1.914 x 10-10 m) und zeichnen Sie die Elementarzelle von Korund in einer Projektion auf entlang der c-Achse in Schnitten bei z = 0, 1/6, 2/6, 3/6, 4/6, 5/6 und 6/6. Warum erfolgt die Besetzung der Oktaederlücken in geordneter Weise, obwohl eine statistische Besetzung aus entropischen Gründen wesentlich günstiger erscheint (Hinweis: Betrachten Sie den Verlauf der Coulomb-Potentialkurve und die attraktiven und repulsiven Wechselwirkungen zwischen den Al3+ und O2- Ionen). Der Austausch von wenigen Prozent Aluminium-Kationen gegen andere Metallionen führt zu intensiv gefärbten Edelsteinen: So enthält der rote Rubin Chrom(III)-Kationen, der blaue Saphir Eisen(II)- und Ti(IV)-Kationen. i) Geben Sie eine mögliche Erklärung für die Farblosigkeit von Korund. Woher kommt die Farbe beim Saphir? Das grüne Chrom(III)oxid und das rotbraune Eisen(III)oxid (Hämatit) besitzen ebenfalls eine Korundstruktur. Auch hier sind Chrom(III)- und Fe(II)-Ionen für die Farbe verantwortlich. j) Warum unterscheiden sich die Farben von Chrom(III)oxid und Rubin sowie Hämatit und Saphir? Aufgabe 2 Halogensilane werden häufig als Ausgangssubstanzen für die Synthese anderer, Silicium enthaltender Stoffe benutzt. Die Hydrolyse von Dimethyldichlorsilan führt zu einem Reaktionsgemisch, aus dem die Verbindungen A und B isoliert werden können. Diese beiden Verbindungen sind nicht chiral und enthalten keine Hydroxylgruppen. Ihre molaren Massen werden mit 220 g/mol für A und 300 g/mol für B abgeschätzt. Erhitzt man jede der beiden Verbindungen mit einer Spur von konz. H2SO4, entsteht in beiden Fällen die gleiche hydrophobe, zähflüssige, chemisch inerte Flüssigkeit C. a) Geben Sie die Strukturformeln für A, B und C an. b) Welches Zwischenprodukt wird bei der Bildung von A und B gebildet? c) Geben Sie den Grund an, warum C sowohl aus A als auch aus B gebildet wird. Geben Sie ein abgestimmtes Reaktionsschema für die Bildung von C aus A bzw. B an. Aufgabe 3 a) Skizzieren Sie den Aufbau von Insel-, Ketten, Band- und Schichtsilikaten. Gegen Sie jeweils ein Beispiel an. Silicium lässt sich in Silikaten durch andere Elemente wie Aluminium ersetzen. b) Welche Verbindungen leiten sich aus diesem Ersatz ab? Beschreiben Sie den Aufbau und die Struktur der Verbindungsklasse. Das Mineral Paragonit mit der Summenformel NaAl3Si3O10(OH)2 kristallisiert in einem monoklinen Kristallsystem. Das Bild einer monoklinen Elementarzelle ist wie folgt: Für Paragonit ergab die Röntgenstrukturanalyse a = 5,13 Å b = 8,89 Å c = 19,00 Å = 95°. [1 Å = 0,1 nm] Die Dichte von Paragonit beträgt d = 2,9 g/cm3. Die oben angegebenen Größen a, b und c sind tatsächliche Längen zwischen verschiedenen symmetrieäquivalenten parallelen Ebenen von Anionen und/oder Kationen im Kristall. Die Röntgenquelle emittiere Strahlen der Wellenlänge 1,54 Å. c) Unter welchem Winkel tritt für den Ebenenabstand a (5,13 Å) Beugung 1.Ordnung auf? d) Leiten Sie eine Formel für das Volumen der monoklinen Zelle als Funktion der Größen a, b, c und b ab. e) Berechnen Sie unter Verwendung der obigen Daten die Anzahl der Aluminiumatome bzw. -ionen) in einer Elementarzelle von Paragonit. f) In welche Gruppe von Silicaten ist Paragonit einzuordnen? g) Ist Paragonit eine Säure oder eine Base? Welche Arten von Säure/Base-Eigenschaften sind für Silicate vom Typ des Paragonits möglich? Welche Säure- bzw. Basestärke ist zu erwarten? Erläutern Sie Ihre Aussage anhand einer Strichformel. Aufgabe 4 Bei Kondensationsreaktionen reagieren zwei Spezies zu einer neuen unter der Abspaltung von Wasser. Zumeist sind diese Reaktionen reversibel, die Lage des Gleichgewichts wird, je nach Reaktion, durch verschiedene Faktoren beeinflusst. Das bekannteste Beispiel, das Sie kennen, ist das Chromat/Dichromat-Gleichgewicht. Hier beeinflusst der pH-Wert die Lage des Gleichgewichts. a) Formulieren Sie das Gleichgewicht von Chromat/Dichromat. Geben Sie an, welche Spezies vorwiegend im sauren, welche im basischen Milieu anzutreffen ist. Über welche Zwischenstufe verläuft diese pH-Wert abhängige Kondensation? Zeichnen Sie eine Strukturformelgleichung, die die Kondensationsreaktion verdeutlicht. Auch die Herstellung von Siliconen beruht auf Kondensationsreaktionen. Ausgangsstoffe sind Chlormethan (CH3Cl) und Silicium, die unter Kupferkatalyse und erhöhter Temperatur zu Methylchlorsilanen umgesetzt werden (Müller/Rochow-Verfahren). Es entstehen neben 3 – 4 % (CH3)HSiCl2 drei Hauptprodukte A, B und C, die als Edukte für die Siliconherstellung dienen können. b) Benennen Sie die drei Hauptprodukte A, B und C und formulieren Sie die Gleichungen ihrer Bildungsreaktionen! Methylchlorsilane reagieren mit Wasser unter der Bildung von Silanolen, welche dann weiter zu Polysiloxanen ("Siliconen") kondensieren können. c) Formulieren Sie die Reaktion von A, B und C mit Wasser. Aus welchem Grund verlaufen diese Reaktionen nahezu quantitativ? d) Bei welcher Verbindung A, B oder C sollte kein Polymer ausgebildet werden können, für welche der drei Verbindungen ist der höchste Vernetztungsgrad möglich? Auch bei den Phosphorsäuren existieren eine Vielzahl von Polyphosphorsäuren (z. B. H n+2PnO3n+1, HnPnO3n), die durch Kondensationsreaktionen von Phosphorsäuren entstehen. Analytisch lassen sie sich durch potenziometrische Titrationen mit einer pH-Elektrode gegen Natronlauge unterscheiden. e) Erklären Sie anhand einer Strukturformelzeichnung von H5P3O10, H6P4O13 sowie H3P3O9 warum eine derartige Unterscheidung möglich ist. Die Bildung von Anhydriden lässt sich auch als Kondensationsreaktion auffassen. Beim Entwässern von Schwefelsäure mit Phosphorpentoxid oder durch Erhitzen von Natriumhydrogensulfat lässt sich das Anhydrid der Schwefelsäure, ein weißer Feststoff, erhalten. f) Welche Verbindung ist das Anhydrid der Schwefelsäure? Zeichnen Sie eine Strukturformel dieses weißen Feststoffs. Viele Metalle bilden in wässriger Lösung mehrkernige Komplexe (d. h. Komplexe mit mehreren Metallzentren) aus, deren Entstehung durch den pH-Wert beeinflusst werden kann. Sn(II)-oxid verhält sich amphoter und löst sich in wässrigen Säuren oder Alkalien unter der Ausbildung unterschiedlicher Komplex-Ionen. Ein wichtiger Hydroxido-Komplex ist [Sn(OH)3]– . g) Zeichnen Sie die Lewis-Formel von [Sn(OH)3]– und ermitteln Sie die Molekülgestalt nach dem VSEPR-Modell. Formulieren Sie ausgehend von diesem Komplex-Anion die Bildung einer mehrkernigen Zinn(II)-Spezies. Kondensationsreaktionen sind nicht immer mit der Abgabe von Wasser verbunden. Auch beispielsweise Schwefelwasserstoff kann bei Kondensationsreaktionen freigesetzt werden. h) Aus welchen wasserstoffhaltigen Arsensulfid-Spezies bilden sich durch "SchwefelwasserstoffKondensation" Arsen(III)- und Arsen(V)-sulfid? Formulieren Sie die Reaktionsgleichungen!











