Klausur zu den Übungen AAC I Name: am 6. Februar 2009
Werbung
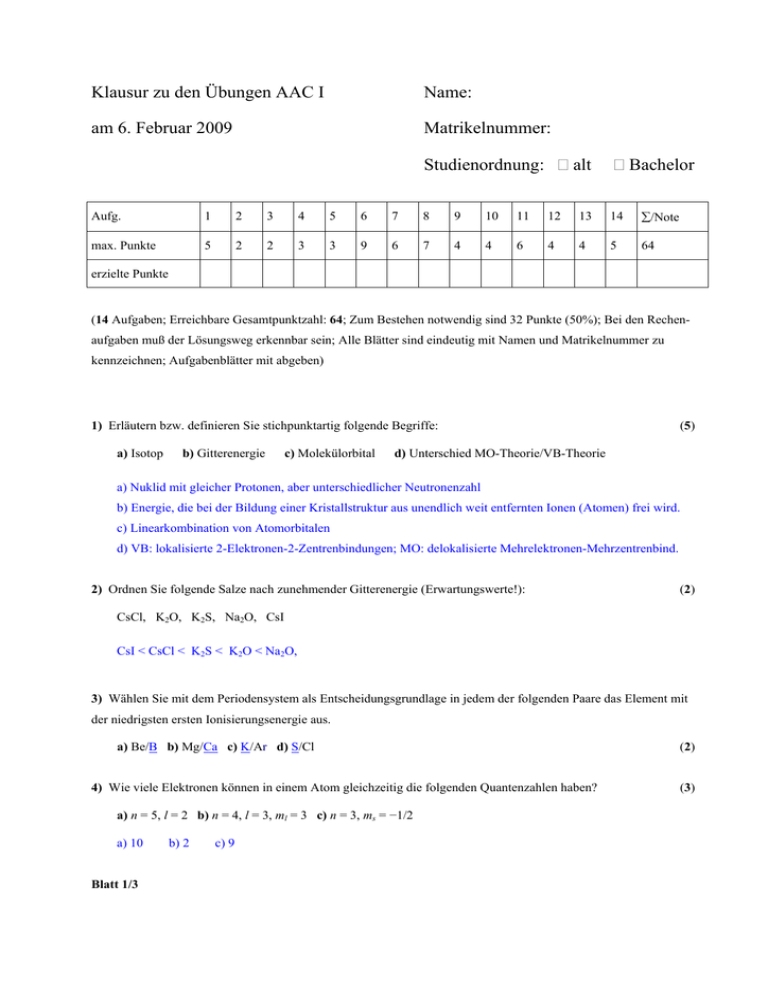
Klausur zu den Übungen AAC I
Name:
am 6. Februar 2009
Matrikelnummer:
Studienordnung:
alt
Bachelor
Aufg.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
∑/Note
max. Punkte
5
2
2
3
3
9
6
7
4
4
6
4
4
5
64
erzielte Punkte
(14 Aufgaben; Erreichbare Gesamtpunktzahl: 64; Zum Bestehen notwendig sind 32 Punkte (50%); Bei den Rechenaufgaben muß der Lösungsweg erkennbar sein; Alle Blätter sind eindeutig mit Namen und Matrikelnummer zu
kennzeichnen; Aufgabenblätter mit abgeben)
1) Erläutern bzw. definieren Sie stichpunktartig folgende Begriffe:
a) Isotop
b) Gitterenergie
c) Molekülorbital
(5)
d) Unterschied MO-Theorie/VB-Theorie
a) Nuklid mit gleicher Protonen, aber unterschiedlicher Neutronenzahl
b) Energie, die bei der Bildung einer Kristallstruktur aus unendlich weit entfernten Ionen (Atomen) frei wird.
c) Linearkombination von Atomorbitalen
d) VB: lokalisierte 2-Elektronen-2-Zentrenbindungen; MO: delokalisierte Mehrelektronen-Mehrzentrenbind.
2) Ordnen Sie folgende Salze nach zunehmender Gitterenergie (Erwartungswerte!):
(2)
CsCl, K2O, K2S, Na2O, CsI
CsI < CsCl < K2S < K2O < Na2O,
3) Wählen Sie mit dem Periodensystem als Entscheidungsgrundlage in jedem der folgenden Paare das Element mit
der niedrigsten ersten Ionisierungsenergie aus.
a) Be/B b) Mg/Ca c) K/Ar d) S/Cl
4) Wie viele Elektronen können in einem Atom gleichzeitig die folgenden Quantenzahlen haben?
a) n = 5, l = 2 b) n = 4, l = 3, ml = 3 c) n = 3, ms = −1/2
a) 10
Blatt 1/3
b) 2
c) 9
(2)
(3)
5) Skizzieren Sie die räumliche Gestalt folgender Orbitale. Bezeichnen Sie die Koordinatenachsen und geben Sie
jeweils das Vorzeichen der Wellenfunktion an.
(3):
y
a) px
x
z
y
b) dyz
y
x
c) dx2−y2
6) Vervollständigen Sie die folgenden Reaktionen, gleichen Sie sie aus und bestimmen Sie das Oxidations- und das
Reduktionsmittel.
a) 2 MnO4– + 10 Cl– + 16 H3O+
b) 3 Br2 + 6 OH
–
–
2 Mn2+ + 5 Cl2 + 24 H2O
–
5 Br + BrO3 + 3 H2O
2–
c) 3 H2C2O4 + Cr2O7 + 8 H3O
+
3+
2 Cr + 6 CO2 + 15 H2O
(OM: MnO4–, RM: Cl–)
(3)
(Disproport., OM/RM: Br2)
(3)
2–
(OM: Cr2O7 , RM: H2C2O4)
(3)
7) Schreiben Sie für jedes der folgenden Moleküle oder Ionen eine einzelne Lewis-Strukturformel auf, welche die
Oktettregel erfüllt, und berechnen Sie die Oxidationszahlen und Formalladungen für alle Atome.
a) N2O
b) BF4–
c) NO2– d) HClO4 e) N2O3 f) S2O72–
(6)
s. Lehrbücher
8) Bestimmen Sie für folgende Moleküle oder Ionen (jeweils in der Gasphase) mit Hilfe des VSEPR-Konzepts die
Molekülgestalt und die Geometrie der Elektronenpaare:
Geometrie EP
(7)
a) PbBr2
b) AsF6–
c) ClF3
d) I3–
e) XeO4
trig. planar
oktaedrisch
trig. bipyr.
trig. bipyr.
tetraedrisch
oktaedrisch
oktaedrisch
T-förmig
linear
tetraedrisch
quadrat. pyr. T-förmig
Molekülgestalt gewinkelt
f) XeOF4 g) XeOF2
trig. bipyr.
9) Zeichnen Sie das MO-Diagramm (Energieschema mit Bezeichnung der einzelnen Orbitale) von N2. Wie groß ist
die Bindungsordnung und wie ändert sich diese beim Hinzufügen bzw. Wegnehmen eines Elektrons.
MO-Diagramm s. Lehrbücher
Bindungsordnungen: N2 (3) N2− (2,5) N2+ (2,5)
(4)
10) Bei Ausgrabungen einer steinzeitlichen Behausung wurden Holzreste entdeckt und mit Hilfe der Radiokarbonmethode datiert. Sie zeigen eine Aktivität von 8,9 Zerfällen·min–1·g–1· C. Wie alt sind die Holzreste, wenn die
Aktivität von frisch gefällten Bäumen 16500 Zerfälle·min–1·kg–1· C beträgt?
t1/2 (14C)= 5730 a; t1/2 = ln 2 / k; ln (N0/N) = k t
(4)
5103 Jahre
11) Berechnen Sie folgende pH-Werte:
a) Lösung von 5,00 g NH3 in 600 ml Wasser. {pKB(Ammoniak) = 4,74}
Mittelstarke Base NH3
→ pH = 14 – ½ pKB + ½ log [NH3]
mit [NH3] = 0,489 mol/l
→ pH = 11,47
b) Mischung aus 0,741 g Calciumhydroxid und 250 ml verdünnter Salzsäure (c(HCl) = 0,1 mol/l)
(2)
(2)
250 ml Salzsäure (Starke Säure, c = 0,1 mol/l) enthalten 0,025 mol H3O+
0,741 g = 0,01 mol Ca(OH)2 (Starke Base) enthalten 0,02 mol OH–
nach Neutralisation verbleiben 0,005 mol H3O+ in 250 ml Lösung
→ c(H3O+) = 0,02 mol/l
→ pH = 1,70
c) Puffermischung aus 400 ml verdünnter Ameisensäure (c = 0,5 mol/l) und 300 ml
Natriumformiatlösung (c = 0,5 mol/l), nach Zugabe von 0,05 mol NaOH. {pKS(Ameisensäure) = 3,75}
(2)
400 ml verd. Ameisensäure (c = 0,5 mol/l) enthalten 0,2 mol HFor
300 ml Natriumformiatlsg. (c = 0,5 mol/l) enthalten 0,15 mol NaFor
nach Zugabe von 0,05 mol NaOH. bilden sich 0,2 – 0,05 = 0,15 mol HFor und 0,15 + 0,05 = 0,2 mol NaFor
Puffergleichung (c-unabhängig!): pH = pKS + log{c(NaFor)/c(HFor)}
→ pH = 3,87
12) Betrachten Sie folgendes Gleichgewicht:
H2O(g) + C(s)
CO(g) + H2(g)
mit ΔH0(298K) = +131 kJ/mol
Dieses sog. Wassergas-Gleichgewicht kann zur Synthese von Wasserstoff verwendet werden.
Welches sind die besten Reaktionsbedingungen für einen möglichst hohen Anteil an Wasserstoff?
i) 900°C und 1 bar
Blatt 2/3
ii) 900°C und 100 bar iii) 1000°C und 1 bar
iv) 1000°C und 100 bar
(4)
13) Zeichnen Sie jeweils die möglichen Isomere
a) oktaedrisches MX2Y4
trans
(2)
cis
b) trigonal-bipyramidales MX2Y3
(2)
14) Welche Stöchiometrie AxByCz besitzt das Salz mit der unten abgebildeten Elementarzelle?
(5)
Geben Sie außerdem für alle Ionensorten die Koordinationszahl
(Zahl der nächsten Nachbarn) an.
A
B
Stöchiometrie ABC3
Koordinationszahlen: A (12), B (6), C (2)
C
Periodensystem der Elemente mit Angabe der auf 12C = 12,0000
bezogenen Atommassen
Blatt 3/3
Viel Erfolg beim Lösen der Aufgaben!











