rutherford atomhülle
Werbung

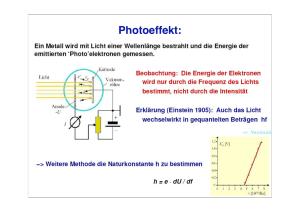
Vorlesung Physik für Pharmazeuten PPh - 11 Optik &Atomphysik 09.07.2007 und 16.07.2007 Der Hertzsche Dipol Der Hertzér Original Aufbau Höchste Frequenzen lassen sich bei kleinsten Werten von L und C erzielen. Reduktion des Schwingkreises zum Stab -> Hertz’scher Dipol Versuch Dipolstrahlung Licht als Welle Polarisation (transversale Welle) Interferenz (Überlagerung von Wellen) Beugung (Huygenssches Prinzip) Spektrum elektromagnetischer Wellen: Versuch Lichtgeschwindigkeit Polarisation Ein senkrecht zum Sendedipol ausgerichteter Empfangsdipol nimmt keine Strahlungsenergie auf. Die Strahlung ist polarisiert. Polarisationsrichtung des Lichts Orientierung des Polarisators. E B ϕ Die Transmission der EM Welle hängt vom Polarisationswinkel ϕ ab. el. Feldvektor Intensität: ET = E 0 ⋅ cos(ϕ ) IT = I0 ⋅ cos (ϕ ) 2 Mikrowellen-Polarisatoren Michaelson-Interferometer Huygens-Fresnel'sches Prinzip Jeder von einer Welle erregte Punkt wird selbst zum Ausgangspunkt einer neuen Kreis-/Kugelwelle. Gitterspektrometer 2d sin ϑ = mλ m = 1,2,... λ = m⋅ N ∆λ N : Anzahl Gitterstreifen m : Ordnung Anwendung: Gitterspektrometer Benzol Auflösung eines Gitterspektrometers: Wann kann man 2 Peaks noch voneinander trennen? Xylol Beugung an einer kreisrunden Öffnung ϕ D Lage des ersten Beugungsminimums ϕ min = 1,22 ⋅ λ D Auflösungsbegrenzung durch Beugung: Für zwei selbstleuchtende Objekte ist der kleinste auflösbare Abstand ∆x : ∆xmin 0.61⋅ λ = n ⋅ sin α Wobei λ die Wellenlänge und n sinα die numerische Apertur ist. (α: Öffnungswinkel der Linse) Röntgenstrahlung beschleunigte Ladungen elektromagnetische Strahlung Interferenz von Röntgenstrahlen an Kristallen Pulverdiffraktion 2 2 1 ⎛h⎞ ⎛k ⎞ ⎛ l ⎞ =⎜ ⎟ +⎜ ⎟ +⎜ ⎟ d hkl ⎝ a ⎠ ⎝ b ⎠ ⎝ c ⎠ 2 dhkl : Netzebenenabstand h,k,l : Millersche Indizes Röntgenstrukturanalyse Röntgenlicht Probe: Proteinkristall Berechnung Strahlungsabsorption/ Beersches Gesetz Licht transportiert Energie: Die Intensität I gibt die transportierte Energie pro Zeit- und Flächeneinheit an. [W/m2] In absorbierenden Medien wird die Lichtintensität abgeschwächt. x ∆I = −α ⋅ I ⋅ ∆x Iein Iaus I(x) = ? dI = −α ⋅ I dx I(x) = Ieine −α ⋅x α: Extinktionskoeffizient [1/m] In Lösungen ist α proportional der Konzentration. (Spektrometer) Wärmestrahlung Definition: Das Emissionsvermögen E eines Körpers ist die pro Flächeneinheit abgestrahlte Leistung [W/m2]. Das Absorptionsvermögen A ist der Bruchteil der von einem Körper absorbierten Strahlung (A=1, alle Leistung, die einfällt wird absorbiert, ‘schwarzer Körper’, A<1 ‘grauer Körper’) 2 Platten im Temperaturgleichgewicht: I II e E AI=1 AII<1 E e= AII Kirchhoffsches Strahlungsgesetz: Das Verhältnis von Emissions- zu Absorptions-vermögen ist für alle Körper gleich und zwar dem Emissionvermögen e eines schwarzen Strahlers. Wärmestrahlung - Plancksches Strahlungsgesetz: Wärmestrahlung - Plancksches Strahlungsgesetz: P = A⋅σ ⋅ T 4 −8 σ = 5,67 ⋅10 W 2 4 m K σ: Stefan-Boltzmann Konstante Die kosmische Hintergrundstrahlung: Das Echo des Urknalls Photoeffekt: Wellen- und Photonencharakter: Wellencharakter massiver Teilchen: Materiewellen - Es ist eine Grundeigenschaft von Materie, daß sie sowohl Wellen- als auch Teilcheneigenschaften besitzt. - Nach de Broglie ist die Wellenlänge eines Teilchens gegeben durch: h λ= p de Broglie Wellenlänge p: Impuls des Teilchens h: Plancksches Wirkungsquantum = 6,6*10-34 Js Elektronenbeugung an Lochblende Elektronen Mikroskop λ= h h = p mv (de Broglie Beziehung) Elektronenbeschleunigung 1 2 mv 2 = e ⋅ U 2e ⋅ U v= me 1.23 λ [nm] = U [V ] z.B. 100keV λ~3pm Die Wellenfunktion von Teilchen Die Aufenthaltswahrscheinlichkeitsdichte eines Teilchens ist gleich dem Betragsquadrat seiner normierten Wellenfunktion: 2 P( x) = Ψnorm = Ψ *Ψ Ausbreitung eines Wellenpakets Wellencharakter massiver Teilchen: Der Tunneleffekt Das Linienspektrum von Wasserstoff n2 λ = 364,6nm ⋅ 2 n −1 Balmerserie n=1,2,3... Termschema Spezialfall von der Rydberg-Ritz Formel ⎛1 1⎞ = R ⋅ Z ⋅ ⎜⎜ − ⎟⎟ λ ⎝ na ne ⎠ 1 E photon R=10,9µm-1 Rydberg-Konstante 2 ⎛1 1⎞ = h ⋅ν = Rhc ⋅ Z ⋅ ⎜⎜ − ⎟⎟ ⎝ na ne ⎠ 2 Rutherford'sches Streuexperiment • Der Radius des Atomkerns: 10-15 m (= 1 Femtometer = 1 fm) • Vgl. Radius der Atomhülle: 10-10 m (0.1 nm) Thomson Modell Rutherford Modell Der e/m Versuch von Thomson Fadenstrahlrohr (Wehnelt-Rohr) U: Beschleunigungsspannung Ablenkung im elektr. Feld Ablenkung im Magnetfeld Lorentzkraft=Zentripetalkraft Kreisbahn mit : e 2U = 2 2 m r ⋅B Thomson me = 9.1·10-31 kg Bohrschen Postulate In einem Atom bewegt sich ein Elektron nach den Gesetzen der klassischen Mechanik auf diskreten Kreisbahnen mit Energien En. (Quantelung der Energie) Die Bewegung des Elektrons erfolgt strahlungslos. Beim Übergang des Elektrons von einem stationärem Zustand mit Energie Ea in einen stationären Zustand mit niedrigerer Energie Ee wird ein Photon der Frequenz, v=(Ea-Ee)/h emittiert. Der Drehimpuls eines Elektrons in einem stationären Zustand nimmt nur die diskreten Werte an, wobei n eine natürliche Zahl ist. (Quantelung des Drehimpulses) nh mvr = = nh 2π 2π ⋅ rn = n ⋅ λe mit mv=h/λ hν Ea Eb Das Bohrsche Atommodell erklärt die Linien des Wasserstoff 1 m ⋅ e4 1 En = − 2 2 2 = −13,6 eV 2 8 ⋅ ε0 n ⋅ h n Der Franck-Hertz Versuch Anregung des ersten Energieniveaus von Quecksilber durch Elektronen e- Hg e- eHg Die Elektronen werden durch Va beschleunigt und nach der Anode durch eine Gegenspannung abgebremst. ∆E = E1 − E0 hν = hc λ = 4.9eV Quantenphänomene : Welle-Teilchen Dualismus Wellen zeigen Teilcheneigenschaften Energie : Impuls : Eγ = h ⋅ν = hω pγ = Eγ c Teilchen zeigen Wellencharakter E = h ⋅ν = mc 2 p=h λ Drehimpuls : Lγ = h 2π Einstein Gl. De Broglie-Beziehung In einem Experiment werden niemals Wellen- und Teilcheneigenschaften gleichzeitig nachgewiesen. Komplementaritätsprinzip (Niels Bohr 1927) 1 ∆x ⋅ ∆p ≥ h 2 1 ∆E ⋅ ∆t ≥ h 2 Heisenbergsche Unschärferelation : Ionisierungsenergien Energie die nötig ist das äußerste Elektron aus der Atomhülle zu entfernen Das Periodensystem Das Wasserstoffatom Anwendung der Schrödingergleichung auf das Wasserstoffproblem (Elektron im Coulombfeld eines Protons) Quantenzahlen des Wasserstoffatoms: n=1,2,3... l=0,1,2,...n-1 m=-l,-l+1,...+l Termschema des Wasserstoff: Bei Emission und Absorption von Strahlung gilt die Auswahlregel ∆l = ±1 Darstellung des Bahndrehimpulses Ψ 2 Elektronendichteverteilung des Wasserstoffatoms Grundzustand, n=1 Zustände n=2 Rutherford'sches Streuexperiment • Der Radius des Atomkerns: 10-15 m (= 1 Femtometer = 1 fm) • Vgl. Radius der Atomhülle: 10-10 m (0.1 nm) Thomson Modell Rutherford Modell Atomkerne p n p n 4 Die Atomkerne bestehen aus Z Protonen und N Neutronen, zusammen aus A = Z + N 'Nukleonen' Atomkern des 2 H N>Z A ZX "Nuklide" A: Kernmassenzahl Z: Kernladungszahl Isotope : Nuklide mit Z=const. N=Z • Ladung des Neutrons = 0, mn = 1.6750·10-27 kg • Ladung des Protons = 1 Elementarladung, Masse mp = 1.6723·10-27 kg Bindungsenergien der Atomkerne Äquivalenz von Masse und Energie E = m ⋅ c2 (1u ) ⋅ c 2 = 931,5 MeV Die Masse eines Kerns ist geringer als die Summe der Massen seiner Nukleonen (ca. 1%). mK < Z ⋅ m p + ( A − Z ) ⋅ mn Der sog. “Massendefekt” ∆m steckt in der Bindungsenergie, EB. mK ⋅ c 2 = Z ⋅ m p ⋅ c 2 + ( A − Z ) ⋅ mn ⋅ c 2 − EB Mittlere Bindungsenergie pro Nukleon [MeV] Kernspaltung und Kernfusion Kernspaltungs-Reaktion n + 235 92 U → X + Y + z ⋅ n + ∆E 1 0 th Massenzahl A Radioaktivität Radioakive Kerne senden α−, β− und γ−Strahlung aus, welche als ionisierende Strahlung im Geiger-Müller Zahlrohr nachweisbar ist. Natürliche Radioaktivität Zerfallsreihe des Thoriums weitere Zerfallsreihen : Uran-Radium Reihe Actinium Reihe Neptunium Reihe („ausgestorben“) α-Zerfall A Z A-4 X M Z-2 XT