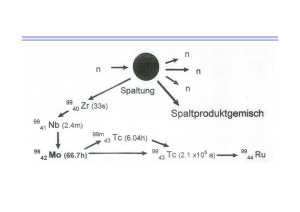
Department of Psychiatry
Werbung

Doz. Mag pharm Dr rer nat Markus Mitterhauser Inhaltsverzeichnis 1 GRUNDLAGEN............................................................................................................................................ 1 1.1 GRUNDLAGEN DER RADIOPHARMAZIE:...................................................................................................... 1 Anforderungen an Radiopharmaka................................................................................................................. 1 1.2 HERSTELLUNG DER RADIONUKLIDE .......................................................................................................... 2 1.2.1 Generatornuklide ............................................................................................................................ 2 1.2.2 Beschleunigernuklide ...................................................................................................................... 3 1.3 QUALITÄTSKONTROLLE DER RADIOPHARMAKA ........................................................................................ 4 1.3.1 Mikrobiologische Untersuchungen ................................................................................................. 5 1.3.2 HPLC .............................................................................................................................................. 6 1.3.3 DC ................................................................................................................................................... 6 1.3.4 GC ................................................................................................................................................... 6 1.3.5 pH und Osmolalität......................................................................................................................... 6 1.4 GESETZLICHE GRUNDLAGEN ..................................................................................................................... 7 1.5 GRUNDPRINZIPIEN DER ANREICHERUNG VON RADIOPHARMAKA .............................................................. 8 1.6 EINFLUSS DES RADIONUKLIDS AUF DIE BIOKINETIK DES MOLEKÜLS ....................................................... 10 2 TECHNETIUM........................................................................................................................................... 11 2.1 GESCHICHTLICHES, VORKOMMEN ........................................................................................................... 11 Herstellung von 99Mo-Molybdän................................................................................................................... 11 Der 99Mo/99mTc-Technetium Generator ........................................................................................................ 12 Reinheitskriterien (Europäische Pharmakopöe)........................................................................................... 12 Chemie des Technetium ................................................................................................................................ 12 Wichtigste 99mTc-Radiopharmaka für die nuklearmedizinische Diagnostik.................................................. 13 3 SCHILDDRÜSE.......................................................................................................................................... 14 4 KNOCHEN.................................................................................................................................................. 14 Anwendungsgebiete: ..................................................................................................................................... 15 Theorien zum Mechanismus der Aufnahme der Polyphosphonate am Knochen:......................................... 16 5 NIERE.......................................................................................................................................................... 17 Radiopharmaka für die dynamische Nierenuntersuchung............................................................................ 17 Captopril-RNG.............................................................................................................................................. 17 Radiopharmakafür die statische Nierenuntersuchung.................................................................................. 19 Einsatzgebiet ................................................................................................................................................. 19 6 HERZ ........................................................................................................................................................... 20 Radiopharmaka konventionell ...................................................................................................................... 20 Einsatzgebiete ............................................................................................................................................... 20 PET Radiopharmaka..................................................................................................................................... 21 Hypoxie-Marker: [18F]-MISO....................................................................................................................... 21 7 LUNGE ........................................................................................................................................................ 22 Radiopharmaka Perfusion ............................................................................................................................ 22 Radiopharmaka Ventilation .......................................................................................................................... 23 Einsatzgebiete ............................................................................................................................................... 23 8 HIRN ............................................................................................................................................................ 23 Allgemeines ................................................................................................................................................... 23 Bluthirnschrankentracer ............................................................................................................................... 24 Flusstracer .................................................................................................................................................... 24 Metabolische Tracer ..................................................................................................................................... 24 Rezeptorliganden .......................................................................................................................................... 26 Schlussbemerkung......................................................................................................................................... 28 9 DAS SENTINEL LYMPH NODE KONZEPT......................................................................................... 29 Radiopharmaka............................................................................................................................................. 30 Was sind Kolloide ......................................................................................................................................... 30 2 Patentblau ..................................................................................................................................................... 31 Einsatzgebiete ............................................................................................................................................... 31 10 TUMOR................................................................................................................................................. 31 Allgemeines ................................................................................................................................................... 31 Radiopharmaka............................................................................................................................................. 32 11 ENTZÜNDUNG/INFEKTION ............................................................................................................ 33 Allgemeines ................................................................................................................................................... 33 Radiopharmaka............................................................................................................................................. 34 Anwendungsbereiche .................................................................................................................................... 36 12 THERAPIE ........................................................................................................................................... 36 Grundlagen ................................................................................................................................................... 36 Radiopharmaka............................................................................................................................................. 36 Die Auswahl der geeigneten Radionuklide ................................................................................................... 38 Radiosynoviorthese ....................................................................................................................................... 38 13 PET ........................................................................................................................................................ 40 Grundlagen ................................................................................................................................................... 40 Zyklotron ....................................................................................................................................................... 41 Wichtigste Radiopharmaka und Anwendungen ............................................................................................ 41 14 QUELLEN UND WEITERFÜHRENDE LITERATUR................................................................... 46 Internet.......................................................................................................................................................... 46 Bücher ........................................................................................................................................................... 48 Ausgewählte Fachartikel............................................................................................................................... 48 3 1 Grundlagen Die Vorlesung hat zum Ziel, die folgenden Punkte etwas genauer zu beleuchten: • Herstellung von Radiopharmaka • Welches Radiopharmakon wird wofür verwendet? • Qualitätskontrolle von Radiopharmaka • Was passiert im Patienten / was sieht man - Radiopharmakologie? Bereiche der Radiopharmazie: • Radiopharmazeutische Chemie • „echte Radiopharmazie“ • Radiopharmakologie • Radiopharmazeutische Technologie • Verfahrenstechnik 1.1 Grundlagen der Radiopharmazie: Ein Radiopharmakon besteht aus: Radionuklid mit geeigneten physikalischen Daten für die externe Messung + Molekül (Ligand) mit geeigneter Pharmakokinetik für hohe Anreicherung im Zielorgan Nur in wenigen Fällen werden Radionuklide direkt als Ionen eines radioaktiven Elementes in Form einer sterilen Radionuklid-Lösung oder als Gas verwendet. Beispiele dafür sind 131I als Na-Iodid, 99mTc als Na- Pertechnetat, 201Tl als Thalliumchlorid oder die radioaktiven Gase 133 Xe und 81mKr. Anforderungen an Radiopharmaka • • • • Zerfallsstrahlen außerhalb des Körpers messbar (keine oder nur geringe Absorption) Visualisierung realer Stoffwechselprozesse Wahl geeigneter Nuklide als Tracer Markierung darf das Verhalten des Tracers im Körper nicht ändern 1 • • • • 1.2 Erhaltung physiologischer Konzentrationen der Stoffwechselsubstanzen geringe Strahlenbelastung relativ kurze Halbwertszeiten Kosten-Nutzen-Relation Herstellung der Radionuklide Natürlich vorkommende radioaktive Isotope haben zu lange Halbwertszeiten, daher sind sie für die nuklearmedizinische Bildgebung uninteressant. Stattdessen werden künstliche Radionuklide verwendet. 1.2.1 Generatornuklide Generatorsysteme umgehen das Problem, dass kurzlebige Radionuklide nicht in einem entfernten Kernreaktor oder Beschleuniger hergestellt und dann zum Anwendungsort transportiert werden können, indem sie ein Muternuklid mit großer Halbwertszeit als Quelle verwenden, die das gewünschte Tochternuklid fortwährend nachproduziert. Das bedeutet, dass nach einer Elution (auch Melken genannt) der Radionuklidgenerator (auch Kuh genannt) sich regeneriert, dass sich also das bei weitem kürzerlebige Tochternuklid nach einer gewissen Zeit wiederum ansammelt. Die maximale Aktivität des Tochternuklids steht dann nach der Zeit tmax zur Verfügung t max = λ 1 ⋅ ln 2 λ2 − λ1 λ1 wobei λ1 und λ2 die Zerfallskonstanten von Mutter- und Tochternuklid sind und λ 1 << λ 2 . Abbildung 1 zeigt den typischen Aktivitätsverlauf eines 99Mo-99mTc-Generators bei täglicher Elution. Die obere Linie zeigt den Zerfall des 99Mo, welcher die maximal eluierbare Aktivität bestimmt. Die darunterliegenden Kurven stellen die nachwachsende Aktivität des 99mTc dar. Verlauf der Mo-99 bzw. Tc-99m-Aktivität in einem 8 GBq-Generator bei täglicher Elution Folgende Bedingungen gelten für ein praktikables Generatorsystem: • Halbwertszeit der Mutter >> Halbwertszeit der Tochter • die chemische Form der Muttersubstanz darf sich durch die (wiederholte) Elution des Generators nicht verändern, • das eluierte Tochternuklid muss eine hohe radiochemische Reinheit besitzen und sollte möglichst unverändert zur Markierung eingesetzt werden können und 2 • die Trennung von Mutter und Tochter soll rasch und einfach durchführbar sein. Wann braucht man Generatoren zur Radionuklidproduktion? • Wenn man die gewünschten Radionuklide auf Grund ihrer geringen Halbwertszeit nicht verschicken kann, die Mutternuklide aber eine wesentlich größere Halbwertszeit besitzen. • Wenn man Radionuklide direkt vor Ort ohne großen Platzbedarf herstellen möchte. • Wenn man ein billiges System benötigt, das mehrmals verwendet werden kann. Ein Generatorsystem besteht im Prinzip aus einer kleinen Glassäule, die mit einem Ionenaustauscher (Matrix) gefüllt ist, an welchem das Mutternuklid absorbiert ist. Dort wächst das Tochternuklid auf Grund des radioaktiven Gleichgewichts ständig nach, sodass beide Nuklide, Mutter und Tochter, an der Matrix fixiert sind. Die Säule ist durch eine ausreichend dicke Bleiwandung abgeschirmt. Die Trennung erfolgt auf Grund der unterschiedlichen chemischen oder physikalischen Form von Mutter und Tochter. Beispielsweise liegt das beim 81Rb/81mKr-Generator entstehende Tochternuklid gasförmig vor, sodass die Trennung durch die verschiedenen Aggregatzustände quasi wie von selbst erfolgt. Beim 99Mo/99mTc-Generator liegt das Molybdän-99 als bivalentes Molybdat-Ion (MoO42-) vor, das Technetium-99m hingegen als monovalentes Pertechnetat (TcO4-). Da die Trennsäule in diesem Fall mit einer Anionentauschermatrix befüllt ist, kann der Ladungsunterschied zur Trennung genutzt werden. Die Elution erfolgt dann zumeist durch Aufsetzen eines evakuierten Injektionsfläschchens und die daraus resultierende Sogwirkung oder durch Anlegen eines äußeren Drucks an das Vorratsgefäß des Eluenten. Bei manchen Trennsystemen ist es zur vollständigen Elution der Tochter von der Matrix notwendig, große Volumina an Eluens einzusetzen, sodass in der Folge eine Konzentrierungseinheit angeschlossen werden muss. Dabei wird das Eluat über eine oder mehrere MiniChromatographiesäulen geleitet, wobei das Tochternuklid retentiert und in der Folge mit einem kleineren Volumen an Flüssigkeit wieder eluiert werden kann. Da in diesem Fall lediglich eine Volumenreduktion und keine Trennleistung von Nöten ist, können sehr kleine Chromatographie-Kartuschen verwendet werden. Ein Beispiel für einen solchen Typ ist der 188 W/188Re-Generator, der zur quantitativen Elution des Perrhenats (ReO4-) ca. 30 ml Eluens benötigt. Elutionsmittel Luftfilter steriles Elutionsgefäß Bleiabschirmun g Matrix mit Mutternukli Schema eines Generators 1.2.2 Beschleunigernuklide Zur Herstellung neutronenarmer Radionuklide bedient man sich eines Teilchenbeschleunigers. Bei Zyklotronen und sogenannten Negativionenmaschinen werden im allgemeinen 1H- oder 2H-, also negative Wasserstoff oder Deuterium-Ionen in einem 3 hochfrequenten Wechselfeld entlang einer Spiralbahn beschleunigt, die Elektronen an einer Stripperfolie abgestreift und die resultierenden Protonen oder Deuteronen als gebündelter Strahl in einen Targetbehälter geleitet. Dieser enthält das zu beschießende Material, welches fest, flüssig oder gasförmig vorliegen kann. Je nach Wirkungsquerschnitt der Reaktion genügen wenige MeV Beschleunigerleistung (1016 MeV) oder ist ein großes Hochleistungszyklotron (bis zu 75 MeV) erforderlich. Die prädominanten Kernreaktionen sind dabei (p,n) und (p,α) bzw. (d,n) und (d,α). Durch Verwendung von isotopisch reinen Ausgangsmaterialien sind sehr hohe spezifische Aktivitäten erzielbar. Auf diese Weise lassen sich jedenfalls in Abhängigkeit vom Targetmaterial eine Vielzahl von Nukliden erzeugen, unter anderem auch die sogenannten PET-Nuklide. Positronenstrahler β+-emittierende Teilchen sind die Grundvoraussetzung für die Anwendung in der PET. Tabelle 6 fasst die wichtigsten Positronenstrahler in der Medizin, deren Herstellung, Halbwertszeit und Anwendungen zusammen. Ein Zyklotron für medizinische Zwecke liefert typischerweise 16,5 MeV für Protonen und wegen der doppelten Masse des Deuteriums, bei gleicher Ladung die Hälfte an Beschleunigungsenergie, also ca. 8 MeV, für Deuteronen. Nuklid F-18 1.3 Herstellung 1) 2) 18 22 O (p,n) 18F (F-) Ne (d,α) 18F (F2) Halbwertszeit 109,6 min markierte Verbindungen FDG (Glucose), FET (Tyrosin), FLT (Thymidin), FDOPA, 5-FU (Uracil), ... Methionin, Acetat, Flumazenil, Metomidat, CO, ... C-11 14 N (p, α) 11C 20,4 min N-13 16 O (p,α) 13N 9,9 min Ammoniak O-15 14 N (d,n) 15O 2,0 min Wasser, O2 Br-76 76 Se (p,n) 76Br 16,2 h BUDR, BFU (Uracil) Qualitätskontrolle der Radiopharmaka Da es sich um die Herstellung eines (radioaktiv markierten) Arzneimittels handelt, ist eine Endformulierung und Sterilfiltration unter aseptischen Bedingungen unbedingt notwendig. Dabei dient die Formulierung der Einstellung der physikalischen Parameter der Lösung, also pH-Wert und Osmolalität, möglichst nahe an die physiologischen Bedingungen im menschlichen Blut, um eine Abwehrreaktion des Körpers bei intra-venöser Applikation auf Grund einer zu starken Abweichung von den üblichen Werten zu vermeiden. Da der pH-Wert des Blutes ca. 7,4 beträgt, sollte der pH-Wert der gebrauchsfertigen Lösung zwischen 4,5 und 8,5 liegen. Als blut-isoton bezeichnet man Lösungen mit einer Osmolalität von 276 mosmol/kg. Bei Radiopharmaka wird eine Osmolalität von 210-360 mosmol/kg akzeptiert. Natürlich muss die Formulierung auch die Einhaltung aller anderer Grenzwerte insbesondere jener für Lösungsmittelrückstände oder anderer nicht-radioaktiver Verunreinigungen gewährleisten. Üblicherweise wird die Arzneimittellösung daher mit einem bestimmten Volumen von Phosphat-gepufferter Kochsalzlösung (PBS), welche zuvor auf pH 7,4 eingestellt wurde, oder reiner Kochsalzlösung (0,9% oder 3%) versetzt. Die endformulierte Lösung muss zur 4 Gewährleistung von Keim- und Partikelfreiheit unter aseptischen Bedingungen – innerhalb einer Laminar-Air-Flow-Zelle, Reinraumklasse A, innerhalb eines Raumes der Reinraumklasse D – sterilfiltriert werden. 1.3.1 Mikrobiologische Untersuchungen Da die Durchführung der Endotoxin- und Sterilitätsbestimmung längere Zeit in Anspruch nimmt (einige Stunden bzw. 3 Wochen), ist es laut Europäischem Arzneibuch in der Monographie für Radioaktive Arzneimittel gestattet, diese Bestimmungen erst nach Freigabe der jeweiligen Charge durchzuführen, womit sie eigentlich eher eine In-Prozesskontrolle darstellen, als ein tatsächlicher Bestandteil der Qualitätskontrolle sind. Endotoxine sind Membranbestandteile gram-negativer Bakterien und repräsentieren die weitaus größte Gruppe an pyrogenen, also fiebererzeugenden Stoffe. Da die Gesamtheit an Pyrogenen, welche eigentlich zu bestimmen wäre, nur durch den Kaninchen-Fieber-Test quantifizierbar wäre und dieser aus ethischen und praktischen Gründen für Routinebestimmungen nicht mehr verwendet werden soll, wird stattdessen die vorhandene Endotoxinkonzentration erhoben. Dafür wird der sogenannte LAL-Test (Limulus Amoebozyten Lysat-Test) eingesetzt: einer genau festgelegten Menge an Blutkörperchen des Pfeilschwanzkrebses wird ein Aliquot der Probe zugesetzt. Abhängig von der vorhandenen Menge an Endotoxinen tritt eine Koagulation auf, welche durch verschiedene Messtechniken (z.B. spektrometrisch) quantifiziert werden kann. Darstellung des Pfeilschwanzkrebses (Limulus polyphemus) Der Grad des „Clottens“ ist ein Maß für die Endotoxinkonzentration. Laut der allgemeinen Monographie über Bakterienendotoxine im Europäischen Arzneibuch sind für intravenöse Applikationen von Radiopharmaka maximal 2,5 I.U. an Endotoxinen pro kg Körpergewicht pro Stunde zulässig. Dabei steht I.U. für international unit und 1 I.U. an Endotoxinen entspricht genau 0,1 ng Endotoxin von Escherichia coli Stamm 6 (EC-6). Zur Feststellung einer eventuellen Verkeimung des Endproduktes wird ein Aliquot der Lösung entweder direkt auf ein Nährmedium aufgebracht (Direktbeschickungsmethode) oder durch einen Membranfilter (Porengröße: 0,45 µm) gesaugt und sodann dieser Filter auf das passende Nährmedium aufgelegt. Durch Inkubation über mindestens 14 Tage hinweg können bei 30-35°C bakterielle Kontaminationen und bei 20-25°C Pilzsporen detektiert werden. Selbstverständlich ist genauestens darauf zu achten, dass auch während der Probenpräparation eine Kontamination im Nachhinein auf jeden Fall vermeiden wird. Die höchstzulässige Verkeimungsrate beträgt laut Arzneibuch 10-6, also eine verkeimte Probe in 1.000.000 Proben. 5 1.3.2 HPLC Die High-Performance-Liquid-Chromatography (HPLC) dient der Bestimmung der radiochemischen und chemischen Reinheit des Radiopharmakons. Dazu ist zusätzlich zum herkömmlichen Aufbau (Pumpe – manueller Injektor – Säule – UV-Detektor – PC) ein in Serie geschalteter Radioaktivitätsdetektor für PET-Nuklide notwendig. Dieser besteht aus einem Natriumiodid-Kristall in Bleiabschirmung, über den die Probenleitung nach Durchlaufen des UV-Detektors geführt wird, und einer Photomultiplierröhre zur Signalverstärkung. Die Vorgaben des Arzneibuches für die radiochemische Reinheit besagen, dass mindestens 90% der Peakflächen zum Produktpeak gehören müssen und dass keine der radioaktiven Verunreinigungen mehr als 5% ausmachen darf. Da bei Fluor-18 markierten Radiopharmaka eine Kontamination mit [18F]Fluorid nicht oder nur unvollständig mittels der gängigen HPLC-Assays detektiert werden kann, ist dafür zusätzlich eine dünnschichtchromatographische Untersuchung durchzuführen. 1.3.3 DC Zur Quantifizierung des [18F]Fluorid-Gehalts ist es notwendig, zusätzlich zur RP-HPLC eine Dünnschichtchromatographie durchzuführen, um die radiochemische Reinheit des Produktes genau ermitteln zu können. Als stationäre Phase wird in der Regel Kieselgel 60 auf Aluminium-Folie als Träger verwendet; als Laufmittel kann ein Acetonitril/Wasser-Gemisch (50/50, v/v) zum Einsatz kommen. Nach dem Trocknen der DC-Platte wird eine Auswertung im Autoradiographen vorgenommen, wobei das [18F]Fluorid einen Rf-Wert von 0-0,1 zeigt, während alle anderen radioaktiven Komponenten eine Wanderungsstrecke aufweisen. Die prozentuellen Anteile der Peaks werden sodann mit der vorhandenen Auswertesoftware unter Berücksichtigung einer Hintergrundkorrektur berechnet. Eine weitere dünnschichtchromatographische Untersuchung im Rahmen der Qualitätskontrolle von [18F]-markierten Radiopharmaka wird zur Bestimmung des Restgehalts an Kryptofix K2.2.2. durchgeführt. Dazu wird – wie in der Monographie für [18F]FDG beschrieben – ebenfalls eine Kieselgel-Platte (Silica Gel 60 F254, Merck) mit 2 µl Probe und je 2 µl an Referenzstandardlösungen zu 50 und 200 ppm beschickt und sodann mit einer Mischung aus Methanol/Ammoniak (90/10, v/v) entwickelt. Zur Detektion dient eine Iodkammer (DC-Trog mit gesättigter I2-Atmosphäre). 1.3.4 GC Die Gaschromatographie dient der Bestimmung der Lösungsmittelrückstände. Folgende Grenzwerte müssen für die möglichen Kontaminantien eingehalten werden: Acetonitril DMF DMSO Ethanol 410 ppm 880 ppm 5000 ppm (0,5%) 5000 ppm (0,5%) 1.3.5 pH und Osmolalität Es müssen der pH-Wert und die Osmolalität der Lösung möglichst nahe an den Werten des menschlichen Blutes liegen. Daher sollte der pH-Wert der gebrauchsfertigen Lösung zwischen 5,5 und 8,5 und die Osmo zwischen 210 und 360 mosmol/kg (Blut: 276 mosmol/kg) liegen. Der pH-Wert wird dabei entsprechend der Arzneibuchvorschrift mit der Glaselektrode unter Berücksichtigung der Temperaturabhängigkeit bestimmt. Die Osmolalität kann durch Messung der Gefrierpunktserniedrigung oder einer anderen entsprechenden kolligativen Eigenschaft erhalten werden. 6 1.4 Gesetzliche Grundlagen Radiopharmaka unterliegen in Österreich dem Arzneimittelgesetz: § 1 (11) "Radioaktive Arzneimittel'' sind Arzneimittel, die in gebrauchsfertiger Form ein oder mehrere für medizinische Zwecke aufgenommene Radionuklide (radioaktive Isotope) enthalten. (12) "Generator'' ist ein System mit einem festen Mutterradionuklid, auf dessen Grundlage ein Tochterradionuklid erzeugt wird, das durch Elution oder ein anderes Verfahren herausgelöst und in einem radioaktiven Arzneimittel verwendet wird. (13) "Kit'' ist eine Zubereitung, die - normalerweise vor ihrer Verabreichung - in den endgültigen radioaktiven Arzneimitteln neu gebildet oder mit Radionukliden verbunden wird. (14) "Vorstufe'' ist ein anderes, für die Radiomarkierung eines anderen Stoffes vor der Verabreichung hergestelltes Radionuklid. Bezüglich Abgabe und Inverkehrbringung gelten dieselben gesetzlichen Rahmenbedingungen wie für nicht- radioaktive Arzneimittel: § 3. Es ist verboten, Arzneimittel in Verkehr zu bringen, bei denen es nach dem jeweiligen Stand der wissenschaftlichen Erkenntnisse und nach den praktischen Erfahrungen nicht als gesichert erscheint, dass sie bei bestimmungsgemäßem Gebrauch keine schädliche Wirkung haben, die über ein nach den Erkenntnissen der medizinischen Wissenschaft vertretbares Maß hinausgeht. § 4. (1) Es ist verboten, Arzneimittel herzustellen oder in Verkehr zu bringen, die in ihrer Qualität dem jeweiligen Stand der Wissenschaft nicht entsprechen. (2) Arzneimittel entsprechen in ihrer Qualität dem jeweiligen Stand der Wissenschaft insbesondere dann nicht, wenn sie 1. den Qualitätsanforderungen des Arzneibuches im Sinne des § 1 des Arzneibuchgesetzes, BGBl. Nr. 195/1980, oder den Qualitätsanforderungen des Arzneibuches einer anderen Vertragspartei des Europäischen Wirtschaftsraumes, 2. den Qualitätsanforderungen anderer Arzneibücher, deren Standard dem des Arzneibuches im Sinne des § 1 Arzneibuchgesetz gleichgehalten werden kann, sofern keine Normen nach Z 1 bestehen, 3. sonstigen hiefür bestehenden international anerkannten Mindestnormen, sofern keine Normen nach Z 1 und 2 bestehen, oder 4. den vom Hersteller selbst gemäß dem jeweiligen Stand der Wissenschaft festgelegten Normen, sofern keine Normen nach Z 1 bis 3 bestehen, nicht entsprechen. Prinzipiell dürfen radioaktive Arzneimittel auch nur an Bereiche abgegeben werden, welche eine Bewilligung für den Umgang mit radioaktiven Stoffen haben. Außerdem gilt für die Herstellung folgendes: § 62. (1) Soweit es geboten ist, um die für die Gesundheit und das Leben von Mensch oder Tier erforderliche Beschaffenheit der Arzneimittel und die Versorgung mit Arzneimitteln zu gewährleisten, hat der Bundesminister für Gesundheit und Frauen durch Verordnung Betriebsordnungen für Betriebe, die Arzneimittel herstellen, kontrollieren oder in Verkehr bringen, zu erlassen. (2) Nicht als Betriebe im Sinne des Abs. 1 gelten 1. Apotheken, … 2. nuklearmedizinische Institutionen oder Laboratorien, die radioaktive Arzneimittel ausschließlich zum Zwecke der unmittelbaren Anwendung am Patienten herstellen oder diese Arzneimittel an Inhaber einer Bewilligung für den Umgang mit radioaktiven Stoffen gemäß dem Strahlenschutzgesetz abgeben, sowie 3. Sanitätseinrichtungen des Bundesheeres, … Es sind auch im Rahmen des Arzneibuches in der allgemeinen Monographie Radiopharmaka Qualitätsnormen festgelegt, ebenso gibt es bereits eine Reihe offizineller Radiopharmaka: Nuklid [125I] [13N] [51Cr] [57Co] [58Co] [57Co] [58Co] [18F] [67Ga] [111In] [111In] Name Albumin-Injektionslösung vom Menschen Ammoniak-Injektionslösung Chromedetat-Injektionslösung Cyanocobalamin-Kapseln Cyanocobalamin-Kapseln Cyanocobalamin-Lösung Cyanocobalamin-Lösung Fludesoxyglucose-Injektionslösung Galliumcitrat-Injektionslösung Indium-(III)-chlorid-Injektionslösung Indiumoxinat-Injektionslösung Buch Seite 4.02 3475 995 996 997 999 998 1000 1003 1006 1007 1009 7 [111In] [123I] [131I] [131I] [131I] [15O] [81mKr] [11C] [11C] [1-11C] [51Cr] [123I] [131I] [123I] [131I] [131I] [99mTc] [99mTc] [32P] [11C] [15O] [89Sr] [99mTc] [99mTc] [99mTc] [99mTc] [99mTc] [99mTc] [99mTc] [99mTc] [99mTc] [99mTc] [99mTc] [99mTc] [99mTc] [99mTc] [99mTc] [201Tl] [3H] [15O] [133Xe] 1.5 Indium-Pentetat-Injektionslösung Iobenguan-Injektionslösung Iobenguan-Injektionslösung für diagnostische Zwecke Iobenguan-Injektionslösung für therapeutische Zwecke Iodmethylnorcholesterol-Injektionslösung Kohlenmonoxid Krypton zur Inhalation 5-(Methyl) Flumazenil-Injektionslösung L-(5-Methyl) Methionin-Injektionslösung Natriumacetat-Injektionslösung Natriumchromat-Lösung sterile Natriumiodhippurat-Injektionslösung Natriumiodhippurat-Injektionslösung Natriumiodid-Injektionslösung Natriumiodid-Kapseln für diagnostische Zwecke Natriumiodid-Lösung Natriumpertechnetat-Injektionslösung aus Kernspaltprodukten Natriumpertechnetat-Injektionslösung nicht aus Kernspaltprodukten Natriumphosphat-Injektionslösung Racloprid-(methoxy)-Injektionslösung Sauerstoff Strontiumchlorid-Injektionslösung Technetium-Albumin-Injektionslösung Technetium-Etifenin-Injektionslösung Technetium-Exametazim-Injektionslösung Technetium-Gluconat-Injektionslösung Technetium-Macrosalb-Injektionslösung Technetium-Medronat-Injektionslösung Technetium-Mertiatid-Injektionslösung Technetium-Mikosphären-Injektionslösung Technetium-Pentetat-Injektionslösung Technetium-Rheniumsulfid-Injektionslösung Technetium-Schwefel-Injektionslösung Technetium-Sestamibi-Injektionslösung Technetium-Succimer-Injektionslösung Technetium-Zinndiphosphat-Injektionslösung Technetium-Zinn-Kolloid-Injektionslösung Thalliumchlorid-Injektionslösung Tritiiertes-Wasser-Injektionslösung Wasser-Injektionslösung Xenon-Injektionslösung 4.07 4.05 4.08 4.09 4.06 4.03 4.03 4.06 4.06 1010 1011 1013 1014 1015 1016 1018 5639 1019 4639 1022 1023 1024 5917 5918 5023 1029 1031 1032 3803 1033 1035 1036 1038 3803 1039 1041 1042 1044 1045 1047 1048 1050 5024 1051 1052 1054 5026 1058 1056 1059 Grundprinzipien der Anreicherung von Radiopharmaka 8 Aktiver Transport z.B. Jodid (NaJ) Schilddrüsenszintigraphie o-Jodhippursäure Nierenuntersuchung (ERPF) Tl-201 Myokarddurchblutung Sequestrierung*, Phagozytose** z.B. * Hitzegeschädigte Erythrozyten Milzszintigraphie ** Kolloid; mikroaggregiertes Serumalbumin RES von Leber, Milz, KM, SN Austausch, Diffusion z.B. Polyphosphat Knochenszintigraphie Aerosol Lungenventilation Gase Durchblutung Ventilation 9 Kompartiment, Verteilungsysteme z.B. Serumalbumin, Erythrozyten Blutraum Kapillarblockade z.B. Makroaggregiertes Serumalbumin, Mikrosphären Lungenperfusion 1.6 Einfluss des Radionuklids auf die Biokinetik des Moleküls 11 18 C Unveränderte Verbindungen („authentic labelling“) F F- statt H-, OHFR- statt R-, H- 123 I I- statt H-, OH-, CH3- 99m Tc Metallkomplexe über Linker Æ neue Verbindungen Zunehmende Änderung der physiologischen Eigenschaften Zunehmende Verfügbarkeit des Radionuklids 10 Leider steht, wie an dieser Grafik ersichtlich, die Verfügbarkeit eines Radionuklids in reziprokem Verhältnis zur Veränderung des Moleküls. Je leichter verfügbar ein Radionuklid ist, desto stärker verändert es die Kinetik des Radioliganden. Die Größe des Substituenten und somit das Ausmaß der Beeinflussung der Biokinetik des Moleküls ist auch an der nächsten Grafik ersichtlich: 2 Technetium 2.1 Geschichtliches, Vorkommen Technetium (griechisch technetos für künstlich) wurde 1937 in Palermo von Emilio Segrè und Carlo Perrier entdeckt. Anfang 1937 erhielt Segrè eine mit Deuteronen bombardierte Molybdän-folie (Deflektor aus einem Zyklotron der University of California, Berkeley, USA) von Ernest Lawrence, dem Erfinder des Zyklotrons, aus dem Segrè und Perrier das durch radioaktive Umwandlung gebildete neue Element isolierten. Als erstes künstlich hergestelltes Element erhielt es den Namen Technetium. Technetium kann im Kilogramm-Maßstab als Uran-Spaltprodukt hergestellt werden. In Pechblende aus Katanga, Afrika, konnte Technetium spektrografisch als Zerfallsprodukt des Urans nachgewiesen werden. Herstellung Herstellung von 99Mo-Molybdän 1) Bestrahlung von metallischem 98Mo oder des Trioxyds Mo2O3 mit thermischen Neutronen im Reaktor: 98Mo (n, g) 99Mo Zur Erhöhung der Ausbeute kann auch angereichertes Mo2O3 verwendet werden, doch liegen die Kosten für angereichertes Targetmaterial sehr hoch. Der Nachteil dieser Methode liegt in der geringen spezifischen Aktivität von Mo (< 300GBq/g Mo). Der Vorteil dieser Methode liegt in der leichten Isolierung von 99Mo und dem geringen radioaktiven Abfall. 11 2) Bestrahlung von 235U mit thermischen Neutronen: 235U (n, f) 99Mo Hier sind Vorteil und Nachteil gerade umgekehrt: Hohe spezifische Aktivität (> 300 TBq/g Mo), aber schwierige Aufarbeitung mit viel radioaktivem Abfall. Der 99Mo/99mTc-Technetium Generator Der 99Mo/99mTc-Generator stellt das bedeutendste Generatorsystem dar, das die Anwendung von 99mTc und seiner Verbindungen in jeder nuklearmedizinischen Abteilung ermöglicht. 99 Mo zerfällt durch Beta-Übergänge in den metastabilen Zwischenkern 99mTc, der unter Gamma-Emission in das langlebige Radionuklid 99Tc übergeht. Die Halbwertszeit von 99mTc beträgt 6 h, die des Beta-Strahlers 99Tc 2,1 x 105 a. 99m Tc wird als Natrium-Pertechnetat (Tc(VII)O4-) mit physiologischer Kochsalzlösung vom Generator eluiert und eignet sich nach Reduktion für die Herstellung von 99mTcRadiopharmaka. 99mTc liegt im Eluat in sehr geringer Konzentration vor, 1mCi = 2 x 10-10 g. Die Lösung ist jedoch nicht trägerfrei, da auch 99Tc vorliegt, das sowohl durch den Zerfall des Mutternuklids als auch des Tochternuklids entsteht. Reinheitskriterien (Europäische Pharmakopöe) Aktivität 90 - 110 % der deklarierten Technetium-99m-Radioaktivität zum Kalibrierungszeitpunkt Radiochemische Reinheit: TcO4 - : > 95 % Chemische Reinheit: Al3+: < 20 mg/ml, pH 4 - 8 Sterilität / Apyrogenität: steril Radionukleare Reinheit Radionuklid Zerfallsart Grenzwert 99 (ß- und γ-Strahlung) (ß- und γ-Strahlung) (ß- und γ-Strahlung) (reine ß- Strahlung) (reine ß- Strahlung) 1 x 10-1 % 5 x 10-3 % 5 x 10-3 % 6 x 10-5 % 6 x 10-6 % 1 x 10-7 % 1 x 10-2 % Mo I 103 Ru 89 Sr 90 Sr Alpha-Strahler andere Gammastrahler 131 Chemie des Technetium Stabile Oxidationsstufen sind Tc(VII) und Tc(IV). Die restlichen Wertigkeiten liegen nur in Form von Komplexverbindungen vor. Vor allem die niedrig-wertigen Oxidationsstufen zeigen große Tendenz zur Komplexbildung mit verschiedenen Liganden. 5- und 6-wertiges Technetium disproportioniert leicht in die 4- und 7-wertige Oxidationsstufe: 3 Tc5+ Æ 2 Tc4+ + Tc7+ 3 Tc6+ Æ Tc4+ + 2 Tc7+ 12 (TcCl6)2- ist nur in konz. HCl beständig, in wässriger Lösung bildet sich durch Hydrolyse leicht das Dioxidhydrat TcO2 x X H2O, das als Kolloid vorliegt. Hydratisiertes Tc-Oxid tritt auch bei Reduktion mit Zinn(II)-Salzen auf und ist daher bei markierten 99mTcRadiopharmaka eine häufige kolliodale Verunreinigung. Die Herstellung von 99mTc-Radiopharmaka wird durch so genannte Kits sehr vereinfacht. Darunter versteht man Markierungseinheiten, die sämtliche, für die Markierung erforderlichen Bestandteile in lyophilisierter Form enthalten, sodass die Markierung kurz vor Gebrauch durch Zugabe einer sterilen Pertechnetatlösung erfolgen kann. Die Trennung in eine vorgefertigte, inaktive Komponente wurde durch die Verwendung von Zinn(II)-Salzen möglich, die 99mTcO4- auch im schwach sauren pH-Bereich reduzieren, wodurch Markierungen mit 99mTc wesentlich vereinfacht wurden. Allerdings sind Zinn(II)Verbindungen feuchtigkeits-empfindlich und leicht oxidierbar (Hydrolyse zu SnO und Oxidation zu SnO2), daher werden Kits unter Stickstoff-Zufuhr abgefüllt. Durch Flutung des Lyophilisators mit Stickstoff bleiben sie lange Zeit ohne Verlust an Reduktionswirkung haltbar. Die Reduktionsstufe hängt dabei vom Liganden ab. In neutraler oder saurer Lösung und ohne zusätzliche Liganden geht Tc(VII) mit SnCl2 direkt in Tc(IV) über (d.h. TcO2 x X H2O; für X wird oft 2 geschrieben): 2 Tc7+ + 3 Sn2+ Æ 2 Tc4+ + 3 Sn4+ 2 TcO4- + 3 Sn2+ + 6 H2O Æ 2 TcO2 x 2 H2O + 3 SnO2 + 4 H+ In alkalischer Lösung findet nur die Oxidation des Sn(II) Salzes (oft ist es Chlorid oder Tartrat) und Reduktion des Wassers (Bildung von H2) statt. Die Qualitätsprüfung am inaktiven Reaktionsgemisch kann ohne Zeitdruck erfolgen, wodurch ein hohes Maß an Ökonomie und Sicherheit erreicht wird. Sämtliche in Verwendung stehenden 99mTc-Radiopharmaka werden mit Hilfe dieser inaktiven Kits kurz vor Gebrauch hergestellt. Da die Herstellung der Kits außerdem durch die pharmazeutische Industrie erfolgt, liegt auch die Dokumentation für eine effektive Qualitätskontrolle beim Erzeuger. Wichtigste 99mTc-Radiopharmaka für die nuklearmedizinische Diagnostik Na-Pertechnetat-Lösung (Generator-Eluat) Darstellung der Schilddrüse und der Speicheldrüsen HSA-Mikroaggregate Leber / Milz-Szintigraphie HSA-Millimikrosphären Knochenmark-Szintigraphie Antimonsulfid-Kolloid Szintigraphie von Lymphbahnen HSA-Millimikrosphären (Aerosol) Inhalations-Szintigraphie, Bestimmung der mukoziliären Clearance HSA-Makroaggregate Lungenperfusions-Szintigraphie HSA-Mikrosphären Regionale Perfusions-Szintigraphie, vor allem der Lunge, Diagnose der Lungenembolie, Bestimmung des Shunt-Volumens arterio-venöser Shunts, Bestimmung der Magenmotilität Alkylisonitril-Komplexe (MIBI) (2-Methoxy-isobutyl-isonitril) Myokard-Szintigraphie 13 HMPAO-Komplex (Ceretec) (Hexamethyl-propylenaminoxim) Regionale Hirnperfusion Phosphonat-Komplexe (Hydroxy-ethylen-diphosphonat) (HEDP) (Methylen-diphosponat) (MDP) Knochenszintigraphie zur Darstellung eines erhöhten Umsatzes Komplexe mit DTPA und MAG 3 (Diethylen-triamin-pentaacetat) (Mercaptoacetyl-triglycine) Nierenfunktionsszintigraphie Bestimmung der glomerulären Filtration Tubuläre Clearance Dimercaptobernsteinsäure (DMSA) Szintigraphische Darstellung der Nieren Iminoessigsäure-Derivate (HIDA) 3 Choleszintigraphie, Bestimmung der hepatobilären Funktion Schilddrüse Tc-99m-TcO4 (ähnlicher Ionenradius wie Jod) Aufnahme über Na-Jodid Symporter Symporter („trapping) wird jedoch nicht metabolisiert I-123 NaI (Zyklotronprodukt, nicht immer verfügbar und teuer) „trapping“ und “Organifikation“ I-131 NaI (Partikelstrahlung, vornehmlich zur Therapie)„trapping“ und „Organifikation“ 99mTc-Pertechnetat hat die Jodisotope (123I, 131I) weitgehend in der SD-Diagnostik abgelöst. Da 99mTcO4- ein vergleichbares Ionenvolumen wie das Jodid-Anion hat, wird es zwar über den Jodid-Aufnahmemechanismus in die Schilddrüse aufgenommen, aber nicht weiter in die Schilddrüsenhormone eingebaut. Die 99mTc-Aufnahme korreliert eng genug mit der Jodid-Clearence, so dass der 99mTcuptake (Quantifizierung der 99mTc-Aufnahme in Prozent applizierter Aktivität) als Maß der Jodavidität der Schilddrüse benutzt werden kann. Daraus ergeben sich die Indikationen für die Schilddrüsen-Szintigraphie: • • • Alle Knoten > 1 – 1,5 cm (DD Autonomes Adenom, SD-Ca, Metastasen) Schilddrüsenvolumen > 40 ml, Alter > 40 J (Latente) Hyperthyreose und V.a. Autonomie 4 Knochen Bei fast allen Erkrankungen des Skelettsystems können mit der Skelettszintigraphie die Krankheitsprozesse lokalisiert (Ganzkörper, z.B. Metastasensuche) bzw. ihre Aktivität (Entzündung, Therapiekontrolle) bestimmt werden. Die hohe Sensitivität, aber auch die niedrige Spezifität dieser Methode beruhen darauf, dass die meisten Erkrankungen des Knochens zu einer Erhöhung des Knochenstoffwechsels führen, d.h. Metastasen, Frakturen, 14 Osteomyelitis, Arthritis, degenerative Veränderungen stellen sich als knochenstoffwechselaktive Prozesse dar. Befunde, die sich nicht durch die Grunderkrankung oder spezielle Verteilungsmuster erklären, müssen radiologisch weiter abgeklärt werden. Dabei muss berücksichtigt werden, dass funktionelle Umbauprozesse (Szintigraphie) erst zu strukturellen Veränderungen (Röntgenbild) führen. Das Szintigramm kann schon positiv sein, wenn sich im Röntgenbild noch keine Auffälligkeiten zeigen. Führen Erkrankungen des Knochens nicht zu einer Steigerung, sondern zu einer Reduzierung des Knochenstoffwechsels, sinkt die Sensitivität der Skelettszintigraphie. Der Prozess lässt sich als negativer Kontrast („cold lesion“) schlechter gegenüber der Umgebung abgrenzen. Reine Osteolysen sind charakteristisch für das Plasmozytom, bei dem eine Skelettszintigraphie in der Regel nicht sinnvoll ist. Anwendungsgebiete: • • • • • • • Primäre Knochentumore Knochenmetastasen Rheuma Arthrosen Infektionen – Entzündungen Endoprothesenlockerungen Osteolytische Aspekte Die Knochenszintigraphie kann mit zwei Substanzklassen durchgeführt werden: [99mTc]-Polyphosphonate [18F]-Fluorid Es lagern sich die Bisphosphonate, jene Substanzgruppe, welche große Ähnlichkeit mit den nuklearmedizinisch verwendeten Polyphosphonaten haben, an die Calcium-Atome des Hydroxyapatits an und binden zangenartige Komplexe. Die Struktur einiger Polyphosphonate sind in der Folge abgebildet. Deutlich an den Strukturen lässt sich die Vielzahl der Phosphatgruppen erkennen. Jedoch haben analytische Methoden zur Struktur dieser Substanzgruppe erkennen lassen, dass die Anordnung der Liganden von der Präparationsmethode abhängig ist. Besonderen Einfluss nimmt das Verhältnis zwischen dem Reduktionsmittel Zinn-II-Chlorid und Ligand. So ist etwa eine tri- bis tetramerische Struktur beim HEDP möglich sowie eine hexamerischkugelige Struktur im Falle des MDP! 15 [99mTc]-MDP: kugelige Anordnung, wobei 6 Tc-Atome mit 6 MDP-Einheiten binden. links: Re-HEDP mit hoher Sn/Ligand ratio – tetramere Anordnung rechts: Re-HEDP mit niedriger Sn/Ligand ratio – trimere Anordnung Diese beiden Beispiele klären, warum man bei [99mTc]-markierten Bisphosphonaten eigentlich von Polyphosphonaten zu sprechen hat. Den auf Stoffmengen basierenden Polyphosphonaten steht die PET mit [18F]-Fluorid gegenüber. Im falle des Fluorid handelt es sich wohl um klaren Einbau in den Hydroxyapatit in Austausch mit Hydroxy-Gruppen des Apatits (Ca10(PO4)6(OH)2) zum Fluoroapatit (Ca10(PO4)6(OH)F). In der Literatur gibt es einige wenige Arbeiten, welche [18F]-Fluorid mit [99mTc]-MDP vergleichen, und alle kommen zu dem Schluss, dass beide Methoden vergleichbar sind, jedoch aufgrund des wesentlich höheren Auflösungsvermögens die PET die zwar teurere aber als besser einzustufende Methode ist. Theorien zum Mechanismus der Aufnahme der Polyphosphonate am Knochen: Adsorption an der Knochenoberfläche Einbau in die Knochenmatrix (Hydroxyapatit und amorphes Calciumphosphat) Einbau in den organischen Teil der Knochen Einbau in Osteoblasten 16 5 Niere Radiopharmaka für die dynamische Nierenuntersuchung Als Tracer werden bevorzugt die tubulär sezernierte Substanzen [99mTc]-MAG3 (Mercapto acetylglycylglycylglycin) oder [123I]-Hippuran verwendet. Etwa 55% der MAG3-Menge und 80-90% der Hippuran-Menge im Plasma wird während einer Passage durch die Niere extrahiert. Ebenfalls für die dRNG verwendet wird [99mTc]DTPA (Diethylentriamino-pentaessigsäure), welche ausschließlich glomerulär filtriert wird. (siehe auch nächstes Bild) Captopril-RNG Bei Nierenarterienstenosen wird die Minderdurchblutung von Barorezeptoren in den afferenten Arteriolen des Glomerulums registriert und von der Niere mit einer vermehrten 17 Reninausschüttung beantwortet, was zu einer Konstriktion der efferenten Gefäße und damit zur Steigerung des Blutdrucks im Glomerulum führt. Häufig wird dadurch ein hinreichender Filtrationsdruck mit einer im Normbereich liegenden GFR erreicht. Durch Gabe eines ACEHemmers wie Captopril kann die Konstriktion des vas efferens verhindert werden. Bei der dRNG mit und ohne ACE-Hemmer ergeben sich bei hämodynamisch wirksamer Nierenarterienstenose signifikante Änderungen der GFR des betroffenen Organs und bei einseitiger Erkrankung eine deutliche Verschiebung der Seitenanteile. Bei Verwendung von Hippuran oder MAG3 erfolgt unter ACE-Hemmung eine Verlängerung der Eliminationshalbwertszeit. Skizze eines Glomerulus Schema der Wirkung von Renin und die ACE-Hemmung durch Captopril Anwendungen • • Abklärung von Durch- und Abflussstörungen Abklärung von Transplantdurchblutung 18 Radiopharmakafür die statische Nierenuntersuchung Ein Radiopharmakon für die statische Nierenszintigraphie muss über längere Zeit in der Niere gespeichert und darf nur zu einem geringen Teil ins Nierenbeckenkelchsystem ausgeschieden werden. Deshalb kommen nierenaffine Substanzen zum Einsatz, die im proximalen oder distalen Tubulusepithel gespeichert werden. Von Tc-99m markierbaren Substanzen weist das DMSA (dimercaptosuccinic acid = Dimercaptobernsteinsäure) mit 85% die höchste Anreicherung in der Nierenrinde auf. Die folgenden Strukturformeln zeigen, dass selbst bei Verwendung desselben DMSA Liganden in Abhängigkeit der Reaktionsbedingungen (pH!) unterschiedliche Komplexausrichtungen und Oxidationsstufen mit anderen Einsatzgebieten möglich sind. Die unten gezeigten Strukturen finden für die Tumor-Szintigraphie Anwendung!!!! Einsatzgebiet Abbildung des funktionsfähigen Nierenparenchyms durch szintigraphischen Nachweis der Akkumulation markierter nierenaffiner Substanzen bei Hypoplasien, Dystopien, Schrumpfnieren, Wandernieren, Dysplasien, Verschmelzungsnieren, Narben, Entzündungen und raumfordernden Prozessen. Das Szintigramm ist eine Darstellung des funktionsfähigen Parenchyms. Es lassen sich Lage, Größe und Form der Nieren beurteilen sowie Bezirke verminderter bzw. fehlender Funktion abgrenzen. Die Anreicherung entspricht dem Anteil an der tubulären Clearance; es besteht eine sehr gute Korrelation zu den mit der RNG bestimmten Seitenverhältnissen. 19 6 Herz Radiopharmaka konventionell [99mTc]-MIBI und [99mTc]-Tetrofosmin, lipophile Kationen, reichern sich nach i.v.-Injektion wegen ihres großen negativen transmembralen Potentials vorwiegend an den Mitochondrienoberflächen an. Das Verteilungsmuster ist hierbei abhängig von der regionalen Durchblutung des Myokards mit verminderter Anreicherung in schlechter perfundierten Arealen. Die Substanz zeigt auch bei Absinken der Konzentration im Blut keinen nennenswerten Auswascheffekt. Das Kaliumanalog Tl-201 hingegen reichert sich ähnlich wie Kalium im Myokard (4-6 %) und in anderer beanspruchter Muskulatur an, wahrscheinlich aktiv über das Na-K-ATPaseSystem. Da Thallium nicht fest in den Muskelzellen gebunden ist, kommt es hier bei sinkender Blutkonzentration wieder zu einem Auswaschen der Aktivität aus dem Muskel. Kurz nach Applikation zeigen gut perfundierte Areale eine starke Anreicherung, während ischämische Bezirke erst langsam Aktivität akkumulieren. Fällt die Blutkonzentration, kommt es zu einem Ausstrom eines Teils der Aktivität aus dem besser perfundierten Myokard, wohingegen die ischämischen Anteile durch den schlechten Blutaustausch und den geringen Konzentrationsgradienten ihre Aktivität nur langsam wieder abgeben. Szintigraphisch kommt es durch diesen Effekt nach einigen Stunden zu einer allmählichen Umverteilung im Anreicherungsmuster zugunsten der minderdurchbluteten Areale, der sogenannten Redistribution. Ein entscheidender Nachteil von Tl-201 gegenüber Tc-99m-markierten Verbindungen sind die ungünstigeren Zerfallseigenschaften (lange Halbwertszeit, genutzte Ka-Strahlung hat zu geringe Energie (Schwächung) und mehrere Linien. Da das zu einer sehr viel höheren Strahlenexposition führt, können nur relativ kleine Aktivitätsmengen verabreicht werden. Verwertbare Bilder bei der Myokardszintigraphie mit Tl-201 müssen mit der mit Abstand höchsten Strahlenexposition aller Untersuchungen in der nuklearmedizinischen Diagnostik erkauft werden. Daher wird heute bei der wichtigsten Indikation zur Myokardszintigraphie in der Regel eher MIBI der Vorzug gegeben. Einsatzgebiete • • • • • KHK bei mehreren Stenosen: welche ist hämodynamisch wichtig Ischämie Vitalität des Myocards Perfusionszustand des Myocards 20 PET Radiopharmaka Für Perfusionsuntersuchungen wird vornehmlich 13NH3, eingesetzt. der kurzen Halbwertzeit (10 bMinuten) die Nähe eines Zyklotrons. 13 NH3 erfordert wegen N-13-Ammoniak liefert visuell befundbare Perfusionsbilder, die myokardiale Traceraufnahme ist jedoch energieabhängig. Niedrige Perfusionsraten werden mit diesem Radiopharmakon – wie auch mit Rubidium-82 – überschätzt, hohe hingegen unterschätzt. Trotz dieser Limitation ist 13NH3 derzeit das Radiopharmakon der Wahl für klinische PETUntersuchungen, eine Quantifizierung des Blutflusses kann mit den genannten Einschränkungen erfolgen. Die PET mit Fluor-18-Fluorodeoxyglucose (FDG) gilt derzeit als Goldstandard der nuklearkardiologischen Vitalitätsdiagnostik – d.h. der Differenzierung einer Narbe von minderperfundiertem, aber vitalem Myokard. FDG wird wie Glukose über Glukosetransporter in den Myozyten aufgenommen und durch die zelluläre Hexokinase phosphoryliert, kann jedoch anschließend nicht weiter verstoffwechselt werden und akkumuliert so in vitalen Myozyten. Das nächste Schema zeigt den Mechanismus der Anreicherung des FDG in Zellen. Das FDG wird in Analogie zur Glucose in die Zellen aufgenommen. Verantwortlich dafür ist die Exprimierung bestimmter Glucose-Transporter namens Glut 1-5. In unterschiedlichem Ausmaß sind selbige in unterschiedlichen Zellen – je nach Glucosebedarf – ausgeprägt. Krebs-Zyklus 18 Hypoxie-Marker: [ F]-MISO Ursprünglich wurde Misonidazol aus der Gruppe der Nitroimidazole als Radiosensitizer entwickelt. Es wird in hypoxische Tumorzellen aufgenommen und sensibilisiert die Zelle für 21 ionisierende Strahlung. Untersuchungen an Tumorzellmodellen haben genaueren Aufschluss über den Metabolismus des Misonidazols in der Zelle gegeben: Misonidazol verteilt sich schnell im Körperwasser und wird antiproportional zum Sauerstoffgehalt in lebensfähige, nicht nekrotische Zellen aufgenommen. Angenommen wird, dass die lipophile Substanz durch die Zellmembran diffundiert und dort die Nitrogruppe von ubiquitär vorkommenden Enzymen reduziert wird (siehe Schema). Ist ausreichend Sauerstoff vorhanden, wird diesem bevorzugt das überzählige Elektron zu einem Superoxidanion abgegeben. Dabei wird in einem ,,futile cycle" das Misonidazol regeneriert und kann wieder aus der Zelle herausdiffundieren. In hypoxischem Gewebe fehlt der Elektronakzeptor und das Nitroradikal bindet kovalent an intrazelluläre Makromoleküle wie RNA, Proteine und DNA und bleibt dann irreversibel in der Zelle getrappt. Nekrotische Zellen haben vermutlich die Fähigkeit zur enzymatischen Reduktion und auch die sarkolemmale Integrität verloren. Daher tritt in diesen Zellen das Phänomen des ,,trapping" nicht auf. 7 Lunge Radiopharmaka Perfusion Die Alveolen sind sehr klein mit Durchmessern zwischen 1 und 9 µm. Daher bedient man sich bei der Perfusionsszintigraphie einer Kapillarblockierungsmethode mit Kolloiden geeigneten Durchmessers: • • • • Hauptbestandteile: Humanalbuminpartikel ~ 5 Mio Partikelgröße: 10 - 90 µm, pro Untersuchung werden um 500’000 Partikel intravenös gespritzt, welche zu reversiblen Mikroembolien führen biologische T1/2 beträgt etwa 5 h. 22 Radiopharmaka Ventilation Aerosol: Tc-99m-DTPA ist das bevorzugte Radiopharmakon. Mittlerer aerodynamischer Durchmesser (AMD) 0,45 µm, maximaler Partikeldurchmesser 2 µm. Technegas: AMD < 0,01 mm. Üblicherweise werden 900-1300 MBq Tc-99m-DTPA in den Radio-AerosolGenerator gegeben, wovon der Patient etwa 20 bis 40 MBq in den Lungen deponiert. Die Herstellung des Aerosols erfolgt entweder durch direkte Verneblung oder über die so genannte Graphittiegelmethode. Bei dieser Methode wird eine konzentrierte Menge [99mTc]DTPA in einem Graphittiegel unter 2500°C zur Eindampfung gebracht, wobei diskrete, [99mTc]-markierte Kohlenstoffcluster von definierte Teilchengröße entstehen (5nm). Diese geringe Partikelgröße zeichnet diese Methode gegenüber der Verneblermethode aus, da dort die Teilchengröße bis zu 600nm betragen kann. Xenon-133 Die übliche Aktivität beträgt 200-750 MBq, bei Kindern 10-12 MBq/kg, das Minimum 100 bis 125 MBq. Krypton-81m Krypton-81m wird aus einem Rb-81/ Kr-81m-Generator gewonnen. Die übliche applizierte Aktivität beträgt 40-400 MBq. Einsatzgebiete Der große Vorzug der Lungenperfusionsszintigraphie gegenüber anderen Verfahren liegt in ihrem hohen negativen Voraussagewert: ein normales Perfusionsszintigramm schließt eine Lungenembolie aus. Die Lungenembolie führt durch Obstruktion des Gefäßes zu einem regionalen, typischerweise keilförmigen Perfusionsausfall. Perfusionsausfälle sind jedoch vieldeutig und können auch durch Tumore, Narben, Schwarten und Ergüsse hervorgerufen werden. Mit der kombinierten Ventilations-/Perfusions-Szintigraphie kann zwischen primärer (Gefäßverschluss) und sekundärer Perfusionsstörung differenziert werden: Primäre Perfusionsstörung: Perfusionsausfall +, Ventilationsstörung - (mismatch) Gefäßobstruktion: Lungenembolie Gefäßkompression: Bronchial-Ca, mediastinale Lymphknoten, Aortenaneurysma Gefäßobliteration: Lungenfibrose, nach Radiatio Sekundäre Perfusionsstörung: Perfusionsausfall +, Ventilationsstörung + (match) Atemwegsobstruktion: Tumor, COPD, Bronchitis, Schleimpfropf, Parenchymschädigung, -verdrängung: Tumor, COPD, Atelektase, Pneumonie, Schwarte, Bulla, Erguss 8 Hirn Allgemeines Die letzten Jahre sahen eine außerordentlich intensive Entwicklung von Radiopharmaka, insbesondere auf dem Gebiet der Rezeptorliganden. Besonders für die PET wurden viele neue Radiopharmaka vorgeschlagen. Der größte Teil ist allerdings über eine Forschungsanwendung nicht hinausgekommen. Einige wenige sind etabliert und haben zum Teil zur Entwicklung von entsprechenden Liganden für die Single Photon Emissionstomographie (SPET) geführt. Ich beschränke mich auf die Beschreibung von in der klinischen Praxis angewandten Radiopharmaka für Hirnuntersuchungen mit PET und SPET, eingeteilt nach ihrer Funktion. 23 Bluthirnschrankentracer Die Bluthirnschranke verhindert die Passage von polaren (hydrophilen) Substanzen vom Blut ins Gehirn, wenn diese nicht durch sehr selektive Transportsysteme eingeschleust werden (z.B. Glukose). [99mTc]TcO4-, eines der ältesten Radiopharmazeutika: Nach i.v. Injektion ist es zu 75 % an Plasmaproteine gebunden, zeigt Blutvolumen und allenfalls verletzte Bluthirnschranke, verlangt Blockierung von Choroid Plexus, deshalb nicht mehr in Gebrauch. [99mTc]-DTPA: Die Plasma-Clearance hat eine Halbwertszeit von ca. 70 min. Wird auch zum Feststellen des Gehirntodes verwendet! Weitere Möglichkeiten sind [201Tl]-Thalliumchlorid und [67Ga]-Galliumzitrat. [99mTc]-Sestamibi, [99mTc]-Tetrofosmin ebenso wie [201Tl]-Thalliumchlorid wird primär für die Herzperfusion eingesetzt. Wird aber auch eingesetzt zur Darstellung von Gehirntumoren, die die Bluthirnschranke verletzt haben (Bindung an die negativen Teilpotentiale an der Mitochondrienoberfläche). Flusstracer Lipophile Substanzen können die Bluthirnschranke passieren. Bei hoher Lipophilie (log P > 3) nimmt dieser Effekt wieder ab, meistens wegen zu großer Bindungsaffinität an Plasmaproteine. [133Xe]-Xenon ist ein frei diffundierendes Edelgas. Es passiert Zellmembranen und wird frei ausgetauscht zwischen Blut und Gewebe. [123I]-IMP und [123I]-HIPDM: Beide Substanzen sind lipophil und passieren die Bluthirnschranke leicht. Für 123I-IMP beträgt die "First pass"-Extraktion fast 100 %. Die maximale Aufnahme im Gehirn ist etwa 7 % der injizierten Dosis. Der Mechanismus der Retention ist noch nicht geklärt. Beim [123I]-HIPDM erfolgt die Retention aufgrund einer pHÄnderung. Im Blut mit pH 7,4 ist die Verbindung neutral. Der intrazelluläre pH im Gehirn beträgt 7,1 und HIPDM wird positiv geladen und deshalb zurückgehalten. Die Aufnahme im Gehirn beträgt etwa 4-5 % der injizierten Dosis. [99mTc]-HMPAO ist ein lipophiler Tc-Komplex, der problemlos die Bluthirnschranke passiert. Er wird im Innern der Zelle in einen hydrophilen Komplex umgewandelt, der in der Zelle bleibt. Die maximale Gehirnaufnahme beträgt etwa 5 % der injizierten Dosis und wird nach einer Minute erreicht. Der am weitesten verbreitete PET-Flusstracer ist H215O. H215O diffundiert frei in das Gehirn und die anderen Organe. Nach etwa 10 min wird ein Gleichgewicht der Aktivitätsverteilung erreicht. Metabolische Tracer Die Zahl und Art der möglichen metabolischen Tracer im Gehirn ist gegeben durch die natürlichen metabolischen Abläufe. Es sind ausschließlich PET-Tracer. Bis heute haben sich noch keine entsprechenden SPET-Tracer in der Klinik etabliert. [15O]-O2: [15O]-O2 wird im Blut an Hämoglobin gebunden wie unmarkierter Sauerstoff. In metabolisch aktivem Gewebe wird der Sauerstoff zur Oxidation verwendet, wobei frei diffusibles H215O gebildet wird. [18F]-2-FDG: Der Energie-Metabolismus im Gehirn basiert ausschließlich auf der GlukoseOxidation. Der wichtigste Tracer bleibt deshalb die 2-FDG, vor dem O2. 2-FDG wird wie Glukose durch die Bluthirnschranke transportiert und intrazellulär mit Hexokinase zu FDG-6-phosphat phosphoryliert. Allerdings wird 24 dieser Metabolit nicht weiter abgebaut und bleibt gefangen. 2-FDG kann heute mit Automaten zuverlässig und mit hoher Reinheit (ohne die störende Mannose) hergestellt werden. [18F]-6-FDOPA: Der Vorläufer 6-FDOPA passiert die Bluthirnschranke und wird im dopaminergen System decarboxyliert zu 6-F-Dopamin (siehe Schema nächst Seite). Deshalb kann mit 6-FDOPA vor allem der Dopaminpool bestimmt werden und daraus Rückschlüsse auf die präsynaptische dopaminerge Funktion gezogen werden. Direkte Quantifizierung über klinische Modelle ist wegen des peripheren Metabolismus von 6-FDOPA nicht ohne Korrekturen der Inputfunktion möglich. Die Herstellung von 6-FDOPA ist bis heute eher aufwendig und wird noch dauernd verbessert. [11C]-Methionin: Für Tumorstudien ist die Quantifizierung der Proteinsynthese-Rate von großer Bedeutung. Unter mehreren markierten Aminosäuren ist [11C]-Methionin sehr verbreitet für Tumorstudien. Die Methylgruppe von [11C]-Methionin wird an verschiedene Methyl-Akzeptor-Moleküle transferiert. Andererseits kann [11C]-Methionin auch für das Studium des Aminosäure-Transportes durch die Bluthirnschranke verwendet werden. Das Schema soll den Methionin-Kreislauf in der Zelle zeigen: 25 Rezeptorliganden Radioliganden müssen, um für die Charakterisierung von Gehirnrezeptoren tauglich zu sein, verschiedene Bedingungen erfüllen: - Hohe spezifische Aktivität (> 4 TBq/mmol): Da die Gehirngewebe sehr kleine Rezeptorkonzentrationen aufweisen (~ 10-12M/g), muss die entsprechende Ligandkonzentration klein genug sein, um eine Übersättigung zu vermeiden. Kleine Substanzmengen und (für die Messung) genügend hohe Radioaktivität bedeuten hohe spezifische Aktivität. - Überwinden der Bluthirnschranke: Die Moleküle müssen eine gewisse Lipophilie aufweisen, können dadurch aber auch in der Lunge extrahiert werden. Weiter darf die Bindung der Radioliganden an Plasmaproteine nicht zu hoch sein. - Hohe Affinität für die Rezeptoren (KD~10-9M): Eine niedrigere Affinität bedeutet normalerweise ein schlechteres Verhältnis der spezifischen zur unspezifischen Bindung am Rezeptor. Affinitätsbestimmung (meist in vitro): Radioliganden sättigen mit zunehmender Konzentration die Rezeptorbindung oder werden mit einem Überschuss von nicht radioaktiven Liganden wieder verdrängt. - Möglichst geringer Metabolismus im Gehirngewebe: Will man die gemessene Ligandkonzentration mit der Rezeptordichte korrelieren, muss gewährleistet sein, dass die gemessene Radioaktivität direkt proportional zu den an die Rezeptoren gebundenen Radioliganden ist. Metabolische Reaktionen im Gehirn führen zu zusätzlichen Parametern, die schwierig zu messen sind und deshalb umfangreiche, oft nicht reproduzierbare Korrekturen nötig machen. - Pharmakologisch intaktes Verhalten: Es muss gewährleistet sein, dass der exogene Radioligand in seinem pharmakokinetischen Verhalten dem natürlichen Neurotransmitter entspricht, um diesen auch wirklich zu repräsentieren. Wie schon in der Einleitung erwähnt, gibt es auf diesem Gebiet außerordentlich viele Substanzen, die auf ihre Eignung als Rezeptorliganden untersucht werden. Die aus meiner Sicht für einen klinischen Einsatz am weitesten Abgeklärten sind im Folgenden aufgelistet. Benzodiazepin-System Die Benzodiazepin-Rezeptoren des zentralen Typs (CT) sind mit den GABAA-Rezeptoren vergesellschaftet. Deren Chloridkanal-Steuerungsfunktion wird durch die Benzodiazepin26 Rezeptoren moduliert. Bis heute hat sich erst ein Ligandtyp für die CT-BenzodiazepinRezeptoren bewährt - das [123I]-Iomazenil für SPET und das [11C]-Flumazenil für PET. [123I]-Iomazenil ist etwas lipophiler und zeigt eine langsamere Aufnahmekinetik als [11C]-Flumazenil. Für letzteres liegt die maximale Aufnahme im Cortex bei 5 - 10 min, gefolgt von einer Eliminationsphase mit 35 min Halbwertszeit. Für [123I]-Iomazenil wird erst nach 60 min ein Plateau erreicht, die Elimination erfolgt mit einer Halbwertszeit von etwa 230 min. Die unspezifische Bindung ist außerordentlich gering (< 10 %), und im Gehirn werden keine Metabolite festgestellt. Flumazenil Dopaminerges System Das dopaminerge System des Gehirns liegt in einer gut definierten Region im Corpus Striatum, bestehend aus dem Putamen und Candate Nukleus. Entsprechend der Bedeutung dieses Systems werden sehr viele Rezeptorliganden getestet. Am meisten Liganden wurden bis jetzt für die D2-Rezeptoren entwickelt. Der am meisten verbreitete ist der reversible und hoch selektive D2-Rezeptor-Ligand [11C]-Racloprid. Die maximale Anreicherung wird nach 15 min gemessen, das maximale Verhältnis von Striatum zu Cerebellum beträgt etwa 4. Das analoge SPET-Radiopharmakon ist [123I]-IBZM. Die Aufnahme scheint ähnlich schnell zu sein, das maximale Plateau des Verhältnisses Basal-Ganglien/Frontaler Cortex wird zwischen 90 und 150 min erreicht. Unspezifische Bindung ist nicht vernachlässigbar und muss durch geeignete Subtraktionsmethoden korrigiert werden. Racloprid IBZM Sämtliche auf der chemischen Struktur der Tropane aufbauende Radiopharmaka sind für den Dopamin-Transporter (DAT) anwendbar. Es handelt sich um Substanzen, die sich von Cocain ableiten und sehr hohe Affinität zum DAT haben. Der Anwendungsbereich liegt ebenso wie beim [18F]-6-DOPA vorwiegend in der Diagnosefindung des Erkrankungskreises rund um Mb. Parkinson. Als einziger bisher funktionierender Tc-99m markierter Hirn-Rezeptorligand befindet sich derzeit [99mTc]-Trodat auf dem Markt. 27 Das visualisierte dopaminerge System Schlussbemerkung Der Nuklearmediziner verfügt heute über eine Palette von Hirn-Radiopharmaka, die ihn in die Lage versetzen, einen wesentlichen Teil von klinischen Fragestellungen mit Hilfe funktioneller Emissionstomographie zu beantworten. Im Vergleich von SPET- und PET-Radiopharmaka ist noch eine spürbare Lücke bei den metabolischen SPET-Tracern zu beklagen. Die starke Forschungstätigkeit auf dem Gebiete der Hirn-Radiopharmaka lässt noch eine wesentliche Erweiterung für die Zukunft erhoffen. 28 9 Das Sentinel Lymph Node Konzept 29 Radiopharmaka Alle verwendeten Präparate werden mit 99m Technetium radioaktiv markiert! Als besonders erfolgreich haben sich Kolloide aus humanem Serumalbumin erwiesen, ebenso sind Antimonsulfid- und Zinnsulfid-Kolloide in Verwendung. Es zeigt sich klare Abhängigkeit des Spreitungsverhaltens des Radiokolloides sowohl von der Partikelgröße als auch von Applikationsart und –ort. Die Applikation kann intradermal, subcutan oder peritumoral erfolgen. Ebenso kann die Applikation im selben Quadranten oder in einem anderen Quadranten des Tumors erfolgen. Was sind Kolloide Kolloide (zu griech. kólla 'Leim'), Stoffe, die besonders fein verteilt sind und deren Teilchen sich oft wie Moleküle verhalten, aber doch groß genug sind, um an ihren Grenzflächen Eigenschaften direkter Partikel zu zeigen. Kolloide können fest, flüssig oder gasförmig in einem anderen Stoff (dem Dispersionsmittel) verteilt sein, z.B. in Seifenlaugen und Lacken. Die Kolloidchemie, die die Eigenschaften kolloiddisperser Systeme untersucht, ist ein selbständiges Gebiet innerhalb der physikalischen Chemie. Größenverhältnisse Photo eines Kolloids 30 Patentblau Zusätzlich lässt sich eine Farbstoffmethode additiv zur szintigraphischen Technik einsetzen und das visuell Aufsuchen des SN erleichtern. Als Farbstoff ist in Deutschland Patentblau zugelassen. Die Farbstoffmethode ist eine rein intraoperative Methode und daher für eine kurzfristige Planung geeignet. Injiziert werden 2–5 ml. Einsatzgebiete Bei fortgeschrittenen Krebserkrankungen sind häufig auch Lymphknoten befallen. Ob dies tatsächlich bereits der Fall ist, kann man aber meist nicht mit Sicherheit sagen, daher lautete die Grundempfehlung an Ärzte bei Krebs in fortgeschrittenen Stadien bisher: Vorsichtshalber alle Lymphknoten in der Umgebung des Tumors entfernen. Entfernt man z. B. bei fortgeschrittenem Brustkrebs sämtliche Lymphknoten in den Achselhöhlen, kommt es zu dauerhaften Lymphabflussstörungen und in der Folge zu Ödemen in den Armen. Um solches Leid zu vermeiden, wurde das so genannte SLND-Verfahren (Sentinel-Lymph NodeDissection) entwickelt. Angenommen, ein bösartiger Hautkrebstumor befindet sich auf dem Bauch eines Patienten in der Verbindungslinie zwischen Leiste und Bauchnabel und ist tiefer als einen Millimeter in die Haut eingewachsen, so dass ein erhöhtes Metastasierungsrisiko besteht. In diesem Fall ist es wichtig zu wissen, ob die drainierende Station tatsächlich wie zu erwarten die nahliegende Leiste oder womöglich sogar die auf der anderen Seite ist. Um dies herauszufinden umspritzt der Arzt den Tumor vor der Entfernung mit Technetium 99Kolloiden. Das Radiokolloid wird nun in Richtung des ersten drainierenden Lymphknotens ausgeschwemmt, so dass dieser – ein einziger unter den unzähligen Knoten in der Leistengegend – radioaktiv markiert ist. Mithilfe einer Gammasonde intraoperativ oder einer Gammakamera präoperativ gelingt es, den Lymphknoten zu finden, der als erster eine Drainagefunktion für das befallene Hautareal übernimmt. Falls überhaupt eine Metastasierung in den Knoten hinein passiert, wird dieser Knoten zuerst befallen sein. Ist der betreffende Knoten entdeckt, nimmt der Arzt ihn heraus und lässt ihn mikroskopisch untersuchen. Stellt sich dabei ein Befall des Knotens heraus, ist davon auszugehen, dass auch andere Knoten befallen sein könnten. In diesem Fall wird der Patient aufwändigere und mit Nebenwirkungen behaftete Operationen über sich ergehen lassen müssen. 10 Tumor Allgemeines Die Tumordiagnose ist genauso vielfältig wie die Tumore selbst. Daher gestaltet sich die Szintigraphie auch dementsprechend schwierig. Geeignete Radiopharmaka nützen entweder den unterschiedlichen Stoffwechsel oder die unterschiedliche Ausprägung von Oberflächenrezeptoren oder Antigenen. Ebenso kann ein Enzym überexprimiert sein oder einfach die bei Tumoren häufig höhere Dichte an Mitochondrien genutzt werden. Mit Tumoren einhergehen können auch Unterschiede im apoptotischen Verhalten oder häufig sind Tumore auch hypoxisch. Die nuklearmedizinischen Fragestellungen richten sich nun nach Metastasensuche oder bei bekannten Metastasen die Primumsuche, Therapiekontrolle, Staging von Tumoren, Zuordnung von Metastasen bei unterschiedlichen Prima, DD TumoreEntzündungen und einfach die Nachsorge nach erfolgten Therapien. 31 Radiopharmaka Galliumszintigraphie Radiopharmakon: [67Ga]-Citrat. Gallium bindet an Transferrin und Laktoferrin, stellt damit die Verteilung der Transferrinrezeptoren dar. [99mTc]-MIBI-Tumorszintigraphie Tc-MIBI ist ein Perfusionsmarker (s. Myokardszintigraphie) und wird an die Mitochondrienmembran über das Membranpotential gebunden. Es wird jedoch auch aus den Zellen wieder mit einem Transportprotein (Glykoprotein P) ausgeschieden. [201Tl]-Thallium-Tumorszintigraphie Thallium-201 ist ein Perfusions- und Vitalitätsmarker (s. Myokardszintigraphie) und wird als Kalium-Analogon in die Zellen über die Na-K-Pumpe aufgenommen. Untersuchungsablauf: unmittelbar nach Injektion planare Aufnahmen des Abdomens und der interessierenden Regionen, danach SPECT und Ganzkörper. Bei Gehirntumoren frühes (Perfusion) und spätes (Malignitätsgrad) SPECT. Immunszintigraphie Radiopharmaka: Tc-99m markierte monoklonale Antikörper oder deren Fragmente Der markierte Antikörper bindet an sein Antigen (z. B. CEA). [99mTc]-Tc(V)-DMSA-Szintigraphie (siehe Kapitel 5) Bei C-Zellkarzinom, HNO-Tumore. Der Uptakemechanismus ist leider bisher ungeklärt. Somatostatinrezeptorszintigraphie Für GEP-Tumore (z. B. Gastrinom, Karzinoid), neuroendokrine Tumore (z. B. Phäochromozytom (MIBG!), Paragangliom, Glomustumor), manche Gehirntumore. Radiopharmakon: [111In]-Indium oder [99mTc]-Technetium-markierte Octreotide. Das Somatostatin-Analogon Octreotid bindet an die Somatostatinrezeptoren. [123I]-MIBG-Szintigraphie Für neuroendokrine Tumore (z. B. Phäochromozytom, Paragangliom, Neuroblastom, z. T. Karzinoid), Prüfung der Möglichkeit einer Therapie mit I-131 MIBG. MIBG ist ein Adrenalin-Analogon und wird über den neuronalen spezifischen Uptake 1 in die präsynaptischen Vesikel aufgenommen. MIBG wird im Gegensatz zu Adrenalin und Noradrenalin nicht über die MAO und COMT abgebaut. PET Aufgrund der extrem hohen Ortsauflösung spielt die PET in der Tumorsuche eine starke Rolle. Das bei weitem am häufigsten angewendete Radiopharmakon hierbei ist das [18F]-FDG (siehe Kapitel HERZ). Neben dem Energiestoffwechsel mittels FDG sind auch Anwendungen zu folgenden Punkten vielfach in der nuklearmedizinischen Fachschaft vorgestellt und diskutiert worden: • • • • • • • Aktiver Transport Neurotransmission Multidrug Resistance Hypoxie Apoptose Angiogenese Genexpression (Gentherapie-Monitoring) 32 • tumorassoziierte Antigene und Rezeptoren Peptide Sehr erfolgreich ist die Entwicklung von Radiopharmaka für die onkologische Diagnostik und Therapie, die auf Neuropeptiden und deren Rezeptoren basiert. Diverse neuroendokrine Tumore mit schlechter Prognose sind über markierte Neuropeptide erfassbar. So werden gegenwärtig neben den intensiv beforschten Somatostatin-Derivaten weitere markierte Peptide wie Analoga des Bombesins, Gastrins/Cholecystokinins und Neurotensins entwickelt und präklinisch oder klinisch getestet. RGD-Peptide (Arg-Gly-Asp: R-G-D als Zelladhäsionssequenz) mit ihrem Bindungsvermögen an Rezeptoren neu geformter Blutgefäße sind eine weitere wichtige Peptidklasse. Der Grundvorgang ist die spezifische Reaktion zwischen markiertem Peptid und membranständigem Rezeptor mit anschließender Internalisierung des Peptids. Damit wird Radioaktivität in der Tumorzelle angereichert. Die Kriterien für ein gutes Peptid-basiertes Radiopharmakon sind teilweise schwer zu erfüllen. Einerseits müssen die äußerst kurzlebigen Peptide gegenüber Plasmapeptidasen stabilisiert werden, doch dies darf nicht auf Kosten einer hohen Bindungsaffinität und -selektivität gehen. Außerdem lässt die Strukturoptimierung zur Vermeidung einer tubulären Reabsorption und Akkumulation von radioaktiven Metaboliten bislang zu wünschen übrig. Durch Co-Infusion der Aminosäuren Lysin und Arginin wird die Nierendosis bis zu 50 Prozent gesenkt. Auch die Ankopplung eines Zuckers oder eines anderen hydrophilen Restes an das Peptid verbessert die Pharmakokinetik. Bei der Entwicklung von SomatostatinAnaloga führte eine Verkürzung und Stabilisierung des Moleküls zum Octreotid und weiteren Varianten, die über ankondensierte Chelatbildner mit diagnostischen und therapeutischen Radionukliden markiert werden können. Trotz der notwendigen Manipulationen lässt sich eine hohe Affinität und Subtypspezifität bei der Ankopplung des Chelatbildners und bei der Metallbindung bewahren. Obwohl vorherrschend, ist der Somatostatin-Rezeptorsubtyp sst2 nicht zwangsweise in den Tumoren vorhanden oder bleibt bei dessen Entwicklung nicht erhalten, so dass über einen Cocktail von subtypspezifischen Radiopharmaka oder ein nicht differenzierendes markiertes Peptid nachgedacht wird. 11 Entzündung/Infektion Allgemeines Im Prinzip können fast alle nicht körpereigenen Einflüsse Entzündungen verursachen, zum Beispiel Viren, Mikroorganismen, Bakterien, Protozoen, Pilze, Parasiten, Allergene, physikalische Reize, chemische Reize. Man unterscheidet auch zwischen akuten und chronischen Entzündungen, wobei chronisch entzündliche Veränderungen nicht unbedingt diagnostiziert werden. 33 Prozesse der Entzündung Radiopharmaka [111In]-Indium-Oxin markierte Eigenleukozyten Es handelt sich um die nuklearmedizinische Standardmethode zur Lokalisierung von Entzündungsherden. Der Indium-111-Oxin-Komplex ist lipophil, dringt in (vom Patienten separierte) Leukozyten ein und markiert sie so dauerhaft. Die Markierung ist unspezifisch, d.h. nicht nur Granulozyten, Monozyten und Lymphozyten werden markiert, sondern auch Erythrozyten, Plättchen und Serumproteine. Deshalb ist der Erhalt einer möglichst reinen Leukozytensuspension vor Zugabe des Radiopharmakons wichtig. Diese Prozedur hat jedoch neben dem Aufwand auch den Nachteil einer möglichen Alteration des in-vivo Verhaltens der Leukozyten (erkennbar an einer erhöhten Lungen- und Milzsequestration). Daher muss der Tracer spätestens 3 Stunden nach Blutentnahme über eine großlumige Kanüle reinjiziert werden. Physiologischerweise reichert sich der Tracer entsprechend dem Leukozytenpool in der Leber (ca. 30%), der Milz (ca. 30%), im Knochenmark (ca. 34%) und im übrigen Körper (v.a. Lunge) an. Anreicherungen in einem Entzündungsherd (z.B. Abszess) bis zu 10% sind möglich. Generell sollte aufgrund der relativ ungünstigen mess-physikalischen Eigenschaften von 111-Indium sowie der vergleichsweise hohen Strahlenexposition das Verfahren nur dort zum Einsatz kommen, wo es nicht durch eine Szintigraphie mit Tc99m-markierten Antikörpern gegen Granulozyten ersetzt werden kann. Es handelt sich dabei vor allem um Fragestellungen, bei denen die lange Halbwertszeit von In-111, die stabile Verbindung, oder die physiologische Tracerverteilung zum Tragen kommen. [99mTc]-Antigranulozyten-Antikörper 34 Dieses Verfahren dient wie die 111-Indium-Leukozytenszintigraphie dem Nachweis von Entzündungsherden. Es sollte aufgrund der geeigneteren physikalischen Eigenschaften von Tc-99m sowie der geringeren Strahlenexposition jedoch wann immer möglich den Vorzug erhalten. Die Vorteile der Methode kommen vor allem bei Fragestellungen zum Tragen wo eine hohe Auflösung gefragt ist. Das Prinzip besteht in der Markierung von aus der Maus stammenden Antikörpern, die gegen ein unspezifisches Antigen auf Granulozyten gerichtet sind. Allerdings binden nach Injektion nur ca. 10% des Tracers an zirkulierende Granulozyten. Der Rest zirkuliert frei oder bindet an sessile Zellen v.a. im Knochenmark. Ein positiver Befund kommt somit nicht nur durch den Nachweis einer Granulozytenakkumulation durch die Bindung des Tracers zustande, sondern auch durch dessen unspezifische Exsudation in z.B. einen Infektherd. Dies kann einerseits die Sensitivität erhöhen, andererseits die Spezifiät erniedrigen. Insgesamt liegen Sensitivität bzw. Spezifität im Nachweis von Entzündungs-herden etwa wie bei der Indium-111-LeukozytenSzintigraphie. Physiologisch verteilt sich der Tracer v.a. im Knochenmark (ca. 55%), in Leber, Milz und im übrigen Körper (auch Lunge). Der Tracer wird über die Nieren ins harnableitende System sowie geringer auch über die Magen-Darm-Schleimhaut ausgeschieden. Ein verfahrensspezifisches Problem liegt in der möglichen Bildung von AntiMaus-Antikörpern nach einer Untersuchung. Zumindest innerhalb von 6 Monaten sollte daher eine etwaige Wiederholungsuntersuchung mit Indium-111-Leukozyten durchgeführt werden, um das Auftreten einer anaphylaktischen Reaktion zu verhindern. [99mTc]-Polyphosphonate Bei der Skelettszintigraphie wird die Aktivitätsverteilung in Weichteilen, Knochen und Gelenken nach i.v. Applikation von osteotropen Radiopharmaka mit einer Gamma-Kamera dargestellt. Es werden Technetium-99m markierte Phosphonate verwendet. Diese Anlagerung erreicht 2–5 Stunden nach Applikation einen für die Skelettszintigraphie aussagefähigen Kontrast zwischen Knochen und Weichteilen/Untergrund. Die Anreicherung ist abhängig von der regionalen Knochen-perfusion, dem Knochenstoffwechsel (Osteoblasten) und der Adsorption an der Apatitmatrix. Bei der häufigsten Frage nach dem Vorhandensein von „Knochenmetastasen“ beschränkt man sich vor allem auf eine Ganzkörperdarstellung 2–5 Stunden nach i.v. Applikation des Radio-pharmakons. Bei rheumatologischen Fragestellungen wird in der Regel eine „Mehrphasen-szintigraphie“ durchgeführt. Dabei macht man sich zunutze, dass i.v. applizierte Radiopharmaka zunächst im Blut zirkulieren (erst arteriell, dann kapillär/venös), und sich dann in einem bestimmten Organ/Organsystem anreichern (z.B. im Falle von Tc-99m-MDP in das Skelett). Man unterscheidet folgende Phasen (p.i. = post injectionem): – 0–60 s p.i.: Perfusionsphase (Einstromphase, arterielle Phase), – 2–5 min p.i. Blutpoolphase (kapillare/venöse Phase, Weichteilphase), – 2–5 h p.i. Knochenstoffwechselphase Bei bestimmten Fragestellungen kann auch eine Spätaufnahme 24h nach Applikation des Radiopharmakons angefertigt werden (z.B. bei Differenzierung alte versus frische Wirbelkörperfraktur). Nimmt man eine bestimmte Körperregion (z.B. Hände) mit einer Gamma-Kamera in allen drei Phasen auf, bezeichnet man dies als „Drei-PhasenSkelettszintigraphie“. Da nur einmal Aktivität appliziert wird, kann auch in nur einer Körperregion, deren Größe durch das Gesichtsfeld der Gamma-Kamera limitiert ist (Großfeld-Kamera ca. 60 x 40 cm), der arterielle Einstrom (Perfusion) mit einer dynamischen Szintigraphie (zum Beispiel 12 Bilder á 5 s) erfasst werden. Die Blutpoolphase erlaubt Aussagen über die entzündliche (Weichteil-) Komponente („Arthritis“), die Knochenstoffwechselphase über länger dauernde knöcherne Prozesse („Arthrose“). Es werden auch 35 z.B. periartikuläre Verkalkungen erfasst werden (z.B. bei Implantatmaterial/Prothesen). Ist eine semiquantitative Auswertung der Szintigramme (z.B. Rechts-Links-Quotienten) zur Charakterisierung gefragt, z.B. um die Floridität einer Kniegelenksanreicherung zu bestimmen, können am Bildschirm die Impulszahlen einer frei wählbaren (einzuzeichnenden Knie-) Region ermittelt werden. Dieses Vorgehen wird auch als „ROI-Technik“ bezeichnet („region of interest technique“) und ist für intraindividuelle Verlaufsbeurteilungen hilfreich. [99mTc]-Infecton, [18F]-Ciprofloxacin Beide genannte Radiopharmaka stehen in der Phase der Erprobung und deren Anwendbarkeit sowie Mechanismen sind umstritten. Das Antibiotikum Ciprofloxacin baut sich als GyraseHemmstoff in die Bakterien-DNA ein und hemmt dort die Transkription. Dadurch erklärt sich die bakteriostatische Wirkung. Trotz der evaluierten hohen Affinität der Leitsubstanz konnte echter spezifischer Uptake in Bakterien beider markierten Substanzen trotz intensiver Studien noch nicht nachgewiesen werden. Daher ist trotz hoher Fallzahl in der humanen Anwendung speziell des Technetium-99m markierten Ciprofloxacins bei der Interpretation der Ergebnisse Vorsicht geboten. Anwendungsbereiche • • • • • • • Fokussuche bei Fieber unklarer Genese Gefäßprotheseninfektion Weichteilinfektion Periphere, akute Osteomyelitis (akute) abdominelle Entzündungen Endokarditis (selten) Knochenmarkdarstellung (Frühaufnahmen) insbesondere bei V. a. Metastasen im Markraum oder primären Knochenmarkerkrankungen (bei dieser Indikation ist evt. 99m Tc-Nanocoll vorzuziehen) 12 Therapie Grundlagen Da der Ort eines Primärtumors genau lokalisiert werden kann, kann dessen Behandlung durch lokale Methoden wie Chirurgie oder externe Strahlentherapie erfolgen. Bei der metastasierenden Erkrankung werden die völlig chaotisch wachsenden Tumorzellen über Blut oder andere Körperflüssigkeiten abgeschwemmt und wachsen an neuen Orten weiter. Kleine Tumorzellhaufen können klinisch nicht gefunden werden, erst ab einer bestimmten Größe (5mm Durchmesser) werden sie überhaupt erfassbar. Deshalb muss in diesen Fällen die Behandlungsmethode systemisch sein, d.h. die Tumortherapeutika müssen über die Blutbahnen zu den (zum Teil nicht sichtbaren) Metastasen gelangen. Dies ist das Gebiet der Chemotherapie und der gezielten Radionuklidtherapie. Radiopharmaka Erfolgreich hat sich seit den 50er Jahren die Therapie von bestimmten Schilddrüsenkarzinomen mit [131I]-Iodid erwiesen. Auf Grund des spezifischen Stoffwechsels wird Iodid nur in der Schilddrüse stark angereichert, weil dort die iodhaltigen Schilddrüsenhormone 36 aufgebaut werden. Das so aufgenommene 131I- zerstört mit seiner therapeutischen ßStrahlung (siehe später) die entsprechenden Zellen. Seither gab es nur wenig weitere Radiotherapeutika, die erfolgreich in der klinischen Routine eingesetzt werden konnten. So ist Ende der 80er Jahre unter anderen das [131I]-mIBG (für meta-Iodbenzyguanidin), das speziell von Neuroblastom- und Phäochromozytomtumoren aufgenommen wird, dazugekommen. In den 90er Jahren schließlich wurden verschiedene Präparate (die Phosponate [186Re]-HEDP und [153Sm]-EDTMP und das [89Sr]-chlorid) eingeführt, die auf Grund ihrer Eigenschaften in die Knochen eingebaut werden. Diese werden zur nachhaltigen Schmerzbekämpfung von Knochenmetastasen eingesetzt, können aber keine Heilung bewirken. Die Anzahl der gefundenen Radiotherapeutika blieb also insgesamt enttäuschend klein, obwohl doch das Prinzip der Radionuklidtherapie so bestechend ist. Ein Problem war zunächst das Finden von spezifisch tumorfindenden Molekülen. Da schien sich mit der Möglichkeit der Herstellung von murinen Antikörpern, die an bestimmte Oberflächenproteine sog. Antigene von Zellen andocken, vor etwa zwanzig Jahren das ideale Vehikel zum Transport von therapeutischen Radionukliden gefunden zu haben. Doch erfüllten sich die Hoffnungen zunächst nicht, viele Forscher wandten sich wieder andern Forschungsthemen zu. Einige Gruppen, wie auch wir selber, sahen das Potential der Radio-immunokonjugat nach wie vor positiv und begannen die Probleme anzugehen. Es ging um höhere Sensitivität und Spezifität, um stabile Markierungsmethoden mit 131I, um Applikationsstrategien, um den Ersatz von murinen Antikörpern durch chimäre und humanisierte usw. Der entscheidende Parameter bezüglich Effektivität der Radionuklidtherapie ist das Radioaktivitätsverhältnis Tumor/Nicht-Tumor und die damit erreichbare Tumordosis bzw. die damit verbundene kritische (noch unschädliche) Dosis für die gesunden Organe. Weitere z. T. offenen Fragen betreffen die Immunogenizität des verwendeten Vehikels oder die physikalischen Charakteristiken des Radionuklids. Um die angesprochenen Probleme anzugehen, ist es vielleicht vorteilhaft, das Gesamtgebiet Radiotherapeutika in drei Teilgebiete zu zerlegen und einzeln zu betrachten. Es sind dies erstens die Fragen um das Therapienuklid und die dazu nötigen Chelatoren, zweitens die Frage des richtigen Vehikels und schließlich drittens die geeignete Verbindung zwischen Radionuklid und Vehikel (siehe folgende Abbildung). Bei jeder Änderung eines Teilaspektes müssen wieder die Auswirkungen auf das Verhalten des Gesamtmoleküls geprüft werden. Das "optimale" Radiotherapeutikum ist ein zwischen biologischen und physikalischen Ansprüchen sorgfältig austariertes und stabil verbundenes Paar Radionuklid-Vehikel. 37 Die Auswahl der geeigneten Radionuklide Von primärer Bedeutung für die Wahl eines geeigneten Therapienuklides (für ein bestimmtes Vehikel) ist die Art der Strahlung, das Verhältnis von eindringender/nichteindringender Strahlung, die physikalische Halbwertzeit (T1/2), die Stabilität von allfälligen Tochternukliden und von praktischer Bedeutung, die Produktionsmöglichkeiten. Die therapeutisch wirksame Strahlung ist durch einen hohen LET (Linearen Energie Transfer) gekennzeichnet. Die Eindringtiefe im Gewebe wird durch die Strahlungsenergie und den LET bestimmt. Mögliche geeignete Strahlenarten sind ß--Strahlen, Auger-, Konversionselektronen und alphaStrahlen. Die alpha-Strahler sind auch sehr potente Zellkiller, allerdings darf der Abstand zum Zellkern 50 mm nicht überschreiten. Das heißt auch für beide Strahlenarten, dass wenig "Kreuzfeuer" möglich ist und ihre Verteilung sehr homogen sein muss. Eine kleine Heterogenität, d. h. nicht abgetötete Tumorzellen, ist für die Tumorheilung fatal. ß-Strahler anderseits haben eine sehr homogene Dosisverteilung, sogar wenn sie heterogen verteilt sind. Je nach ß-Energie variiert die Tumorgröße, welche optimal kuriert werden kann, zwischen 3 mm für 131I und 3 cm für 90Y. Hohe b-Strahlungsenergien wie bei 90Y führen auch zu hohen Knochenmarkdosen, deshalb könnten tiefere b-Energien wie z.B. bei 67Cu Vorteile bringen. Die stark durchdringende gamma-Strahlung (kleiner LET!) ist zwar für diagnostische Zwecke sehr geeignet, therapeutisch trägt sie nichts zur Tumordosis, aber erheblich zur Gesamtkörperdosis bei (z.B. im Knochenmark). Deshalb ist auch 131I (g bei 360 keV mit 82 % Zerfallsanteil) kein besonders geeignetes Therapienuklid. Ist das Tochternuklid auch radioaktiv (bei 212At sind es 211Po und 207Bi) könnte das zur ungewollten und unkontrollierbaren Bestrahlung von Nichttumorgewebe führen. Schließlich ist zu beachten, dass die Targetstrukturen von Tumorzellen, an welche die biologischen Vehikel andocken, nur in beschränkter Zahl vorhanden sind. Um also eine möglichst hohe Tumordosis zu erreichen ist es wichtig, dass möglichst viele Vehikel mit radioaktiven Nukliden versehen sind, d.h. die Therapienuklide trägerfrei oder mit hoher spezifischer Aktivität (Radioaktivität/Masse) erzeugt werden können. Die Herstellung der Therapienuklide erfolgt durch Bestrahlung geeigneter inaktiver Nuklide (sogenannter Targets) mit Protonen oder Neutronen. Dazu sind entsprechende Großmaschinen wie Protonenbeschleuniger oder Neutronenquellen (z.B. Reaktor) nötig. Die in den Targets produzierten Radionuklide schließlich müssen durch geeignete Verfahren isoliert werden. Radiosynoviorthese Die Radiosynoviorthese stellt eine wirksame Methode zur Behandlung entzündlicher Gelenkerkrankungen (Arthritis) dar und kommt seit über zwei Jahrzehnten zur Anwendung. In das erkrankte Gelenk wird durch eine einfache Punktion ein radioaktiver Stoff injiziert (gespritzt): - große Gelenke (Kniegelenk): Yttrium-90 - mittlere Gelenke (Schulter-, Ellbogen-, Hand-, Hüft-, Sprunggelenke u. a.): Rhenium-186 - kleine Gelenke (Finger- u. Zehengelenke): Erbium-169 Diese Radionuklide werden an Kolloide (siehe Kapitel 9) gebunden und weisen eine sehr kurze Reichweite im Gewebe von ½ bis ca. 4 Millimeter auf. Die Strahlung entfaltet ihre Wirkung vorwiegend am Zielort der entzündlich veränderten Gelenkschleimhaut, die umliegenden Gewebe, Knochen, Gelenkkapsel und Knorpel werden geschont. 38 Therapienuklide mit den physikalischen Eigenschaften Nach der Injektion in das Gelenk kommt es zu einer gleichmäßigen Verteilung in der Gelenkflüssigkeit. Die Radiopharmaka werden von den oberflächlichen Zellen der entzündlich veränderten Gelenkschleimhaut aufgenommen. Aufgrund der oberflächlichen Aufnahme des Radiopharmakons und der geringen Eindringtiefe der Strahlung entfaltet die Strahlung die Wirkung an der Oberfläche der entzündlich veränderten Gelenkschleimhaut, dem erwünschte Zielort; die umliegenden Gewebe, Knochen, Gelenkkapsel und Knorpel, werden geschont. Im Zeitverlauf kommt es zu einer allmählichen lederartigen Verschorfung der Schleimhautoberfläche (Fibrosierung) mit Abnahme der Schleimhautschwellung. Dabei werden feinste Kanälchen verschlossen, aus denen Ergussflüssigkeit ins Gelenk drang und auch die feinsten Nervenendigungen ausgeschaltet, so dass der Schmerz vermindert oder beseitigt und die Gelenkfunktion verbessert wird. Die Wirkung tritt nach und nach ein, manchmal schon nach wenigen Tagen, in manchen Fällen auch erst nach Wochen oder Monaten. Die endgültige Wirkung lässt sich aber erst nach etwa sechs Monaten beurteilen. 39 Therapieziel Verbesserung der Lebensqualität: Schmerzlinderung Rückbildung der Gelenkentzündung Verbesserung der Beweglichkeit Erhalt der Gelenkfunktion Reduzierung der Medikamenteneinnahme Indikationen für die Radiosynoviorthese Chronische entzündliche Gelenkerkrankungen bei: 13 Erkrankungen des rheumatischen Formenkreis: rheumatoide Arthritis (nach 6 Monaten Basistherapie), Psoriasis-Arthritis, Mb. Bechterew Aktivierte Arthrosen Mono-, Oligo- und Polyarthritis, Gelenkendoprothese mit rezidivierenden Ergüssen Hämarthrosis bei der Hämophilie, Lyme Arthritis (Borreliose) Wiederholung nach Radiosynoviorthese nach 6 Monaten (Ausnahme bei ausgeprägter Synovitis nach 3 Monaten zur Dosisaufsättigung) bei unzureichendem Effekt Im Einzelfall: palliative Therapie bei fortgeschrittenem Stadium der Arthrose PET Grundlagen Positronenstrahler sind Atomkerne, die relativ zu ihrem Neutronengehalt einen Protonenüberschuss besitzen. Sie zerfallen unter Emission eines Positrons und eines Neutrinos zu einem stabilen Nuklid. Das Neutrino entweicht von seinem Entstehungsort ohne weitere Wechselwirkungen. Das Positron wird jedoch 0,2-2,6 mm von seinem Entstehungsort entfernt durch Streuprozesse nahezu abgebremst. Kommt es beinahe zur Ruhe, bildet es mit einem Elektron aus seinem Umfeld ein Positronium, welches allerdings nur eine sehr kurze Lebensdauer hat. In einem nachfolgenden Prozess, der als Annihilation bezeichnet wird, wandeln sich die Massen von Positron und Elektron in Energie um. Es entstehen je zwei Quanten mit einer Energie von jeweils 511 keV, die aufgrund des Impuls- und Energieerhaltungssatzes unter einem Winkel von nahezu 180° emittiert werden. Soll der Zerfall von Positronenstrahlern gemessen werden, geschieht das durch den Nachweis der beiden bei der Annihilation entstehenden Vernichtungsquanten. Positronenvernichtung 40 Zyklotron Schema und Funktionsweise eines Zyklotrons Bild des ersten Zyklotrons, gebaut von Ernest Lawrence 1930 Ein Zyklotron besteht aus zwei Dipolmagneten, die in der Abbildung über- und unterhalb der gestrichelten Kreislinie angebracht sind. Zwischen den Magneten befinden sich zwei Dförmige- Elektroden, eine Ionenquelle und ein Deflektor. Die Dipolmagnete erzeugen ein möglichst homogenes, senkrecht zur Zeichenebene stehendes Magnetfeld. Im Spalt zwischen den Magneten befindet sich die Ionenquelle, hier werden die zu beschleu-nigenden Teilchen erzeugt. Sie werden durch eine an den Dees anliegende Wechselspannung beschleunigt. Die Frequenz der Wechselspannung muss so gewählt werden, dass beim Durchfliegen des Spalts die Dees so gepolt sind, dass die Teilchen durch das dort herrschende elektrische Feld beschleunigt werden. Auf Grund der höheren Geschwindigkeit, die die Teilchen nun besitzen, wird der Bahnradius größer. Die Zeit zwischen zwei Spaltdurchläufen bleibt dabei immer exakt dieselbe, so dass das Zyklotron mit einer konstanten Wechselspannungsfrequenz betrieben werden kann. Am Rand des Zyklotrons ist ein Deflektor angebracht. An ihn kann eine Spannung angelegt werden, um den Strahl aus dem Magnetfeld zu lenken. Das klassische Zyklotron wurde zur Beschleunigung von Protonen, Deuterium und a-Teilchen verwendet. Wichtigste Radiopharmaka und Anwendungen [18F]-2-Fluor-2-Deoxyglukose Zur Glukoseverbrauchs-Bestimmung bei degenerativen und dementiellen Erkrankungen des ZNS, bei cerebrovaskulären Erkrankungen, zur Identifikation epileptischer Foci, Glukoseverbrauchsbestimmung des Herzens bei KHK, für Vitalitätsbestimmungen nach Infarkten und nach Herztransplantation, bei Verdacht auf Tumorerkrankungen und zur Beurteilung der Vitalität von Tumorgewebe unter Therapie. 41 [18F]-6-Fluoro-L-DOPA Untersuchung der präsynaptischen dopaminergen Function in vivo in Patienten mit klinischen Symptomen motordegenerativer Veränderungen sowie bei neuroendokrinen und GISTumoren sowie Apudomen. [18F]-Fluorid Quantifizierung des Knochen Metabolismus und der Perfusion als Untersuchung zur Therapie -Kontrolle nach Knochentransplantation. Hochauflösende und hochempfindliche Methode zur Aufspürung von Knochenmetastasen bei Tumordiagnosen. [18F]-Fluortyrosin, [18F]-Fluoroethyltyrosin Zur Bestimmung des Malignitätsgrades von Tumoren aller Art vor allem im Gehirn. Kopf/Hals- und im Thorax-Bereich; zur Differentialdiagnose von Läsionen; zur Therapiekontrolle von Tumorerkrankungen während Zytostatika- bzw. Strahlentherapie. Fluorthyrosin FET [18F]-Fluoroalkylspiperon, [18F]-Fallypride Zur Bestimmung der postsynaptischen D2 Rezeptor-Dichte striataler Hirnstrukturen bei neuronalen Erkrankungen, vor allem bei motordegenerativen Erkrankungen, wie M. Parkinson und bei Schizophrenie und ähnlichen psychiatrischen Erkrankungen. Zur Einstellung optimaler Therapiedosen bei Behandlung mit Butyrophenon- Derivaten. Fallypride 18 [ F]Fluorurazil Zur Beurteilung der Therapieaussichten von Tumoren mit Fluorurazil. 42 [18F]-FMISO Zur Darstellung hypoxischer Regionen in neurodegenerativen Erkrankungen, bei Infarkten und zur Darstellung der Therapieresponse bei Tumoren. [18F]-FE@TO, [11C]-MTO, [11C]-ETO (Etomidate-Analoga) Zur Dignitätsbeurteilung adrenocorticaler Raumforderungen, welche zu einer Überexprimierung der 11-ß-Hydroxylase führen. FE@TO 18 ETO 11 [ F]-FE@FMZ, [ C]-FMZ (Flumazenil-Analoga) GABAA-Rezeptor-Antagonist, zur Darstellung der Dichte der zentralen GABA-Rezeptoren bei Epilepsie und anderen neurologischen und psychiatrischen Fragestellungen. FMZ FE@FMZ 18 [ F]-Fluorothymidin Liefert Informationen über die Hochregulierung der Thymidinkinase 1 in Tumorzellen. Da die Thymidinkinase 1 direkt mit der Proliferation von Tumorzellen korreliert, stellt [18F]FLT ein wichtiges onkologisches Radiopharmakon dar, das sowohl für die Diagnostik von Tumoren als auch für die Therapiekontrolle der Strahlen- und Chemotherapie eine wichtige Rolle spielt. [18F]-Fluorcholin Der Mechanismus erklärt sich durch den Einbau des Cholins in die PhosphatidylcholinStrukturen der Zellwände. Da höhere Proliferation in Tumoren – aber auch in Entzündungen – mit höherer Zellwandsynthese einhergeht wird dieses Cholin-Analogon verstärkt aufgenommen. 43 [15O]-Wasser, [15O]-Kohlendioxid, [15O]-Butanol Zur quantitativen Bestimmung des Blutflusses in verschiedenen Organen, vor allem dem Gehirn, dem Herzen, der Leber und der peripheren Muskulatur. Zur Bestimmung des Perfusionszustandes von Tumoren Zur Messung des extravaskulären Lungenwassers. [13N]-Ammoniak Zur Bestimmung des regionalen Blutflusses des Herzens. Zur Perfusionsmessung an Tumoren. [11C]-L-Methionin Zur Bestimmung des Malignitätsgrades von Tumoren aller Art vor allem im Gehirn; Kopf/ Hals- und im Thorax-Bereich; zur Differentialdiagnose von Läsionen; zur Therapiekontrolle von Tumorerkrankungen (s. [18F]-FET). [11C]-Methylspiperon, [11C]-Racloprid Zur Bestimmung der postsynaptischen D2 Rezeptor-Dichte striataler Hirnstrukturen neuronalen Erkrankungen, vor allem bei motordegenerativen Erkrankungen, wie Parkinson und bei Schizophrenie und ähnlichen psychiatrischen Erkrankungen. Einstellung der medikamentösen Therapie bei Behandlung dieser Krankheiten Neuroleptika. bei M. Zur mit Raclopride [18F]-FE@CIT, [11C]-ß-CIT Ligand mit hoher Affinität zum Dopamin-Transporter. Verwendet zur Darstellung neurodegenerativer Erkrankungen wie Mb. Parkinson oder Ch. Huntington für sowie psychiatrische Fragestellungen. [11C]-Acetat Zur Bestimmung der regionalen Sauerstoffverbrauchsrate des Herzens und in letzter Zeit zunehmende Bedeutung als Tracer für die Dignitätsbeurteilung urogenitaler Tumore. [11C]-WAY 100635 Der wohl fortschrittlichste und am schwierigsten zu synthetisierende Tracer mit hoher Bindungsaffinität zum 5HT1A-Rezeptor. Unterschiede in der Dichte dieses Rezeptors sind 44 assoziiert mit Panik, Angst, Phobien, Depression, Epilepsie und beteiligt an fast allen Abweichungen im ZNS. 45 14 Quellen und weiterführende Literatur Internet Grundlagen http://www.alra.de/GdB_1102.pdf http://www.schilddruesenerkrankungen.at/downloads/Nukmed_Broschuere_korr4_fin al_210604.pdf http://64.233.183.104/search?q=cache:3hz1BJLqLNsJ:www.ruhr-uni-bochum.de/ radio-nuk-kkh/Studenten/Skripte/Vorlesungsskript%2520 Nuklearmedizin.pdf+ radiopharmazie+tumor&hl=de http://zrw.web.psi.ch/files/Kapitel_01_02.pdf Technetium http://homepages.fh-giessen.de/~hg6331/add_bm/kurs_nukl.html http://64.233.183.104/search?q=cache:3hz1BJLqLNsJ:www.ruhr-uni-bochum.de/ radio-nuk-kkh/Studenten/Skripte/Vorlesungsskript%2520 Nuklearmedizin.pdf+ radiopharmazie+tumor&hl=de http://zrw.web.psi.ch/files/Kapitel_01_02.pdf http://zrw.web.psi.ch/files/Kapitel_02_02.pdf Schilddrüse http://homepages.fh-giessen.de/~hg6331/add_bm/kurs_nukl.html http://www.schilddruesenerkrankungen.at/downloads/Nukmed_Broschuere_korr4_fin al_210604.pdf http://www.akh-wien.ac.at/nuklear/downloads/curriculumblock10 seminarnuklearmedizin.pdf http://64.233.183.104/search?q=cache:3hz1BJLqLNsJ:www.ruhr-uni-bochum.de/ radio-nuk-kkh/Studenten/Skripte/Vorlesungsskript%2520 Nuklearmedizin.pdf+ radiopharmazie+tumor&hl=de Herz http://homepages.fh-giessen.de/~hg6331/add_bm/kurs_nukl.html http://www.schilddruesenerkrankungen.at/downloads/Nukmed_Broschuere_korr4_fin al_210604.pdf http://www.klinik.uni-wuerzburg.de/deutsch/Einrichtungen/Kliniken ,%20Institute%20und%20Abteilungen/Klinik%20und%20Poliklinik%20f%FCr%20N uklearmedizin/Studium%20und%20Lehre/Kursus%20der%20Nuklearmedizin/Herz/c ontent.html?anchor=kdn_herz_ischaemie#kdn_herz_ischaemie http://zrw.web.psi.ch/files/Kapitel_03_02.pdf Niere http://homepages.fh-giessen.de/~hg6331/add_bm/kurs_nukl.html http://www.schilddruesenerkrankungen.at/downloads/Nukmed_Broschuere_korr4_fin al_210604.pdf http://www.klinik.uni-wuerzburg.de/deutsch/Einrichtungen/Kliniken ,%20Institute%20und%20Abteilungen/Klinik%20und%20Poliklinik%20f%FCr%20N uklearmedizin/Studium%20und%20Lehre/Kursus%20der%20Nuklearmedizin/Herz/c ontent.html?anchor=kdn_herz_ischaemie#kdn_herz_ischaemie http://64.233.183.104/search?q=cache:3hz1BJLqLNsJ:www.ruhr-uni-bochum.de/ radio-nuk-kkh/Studenten/Skripte/Vorlesungsskript %2520Nuklearmedizin.pdf+ radiopharmazie+tumor&hl=de Lunge http://homepages.fh-giessen.de/~hg6331/add_bm/kurs_nukl.html 46 http://www.schilddruesenerkrankungen.at/downloads/Nukmed_Broschuere_korr4_fin al_210604.pdf Hirn http://homepages.fh-giessen.de/~hg6331/add_bm/kurs_nukl.html http://www.schilddruesenerkrankungen.at/downloads/Nukmed_Broschuere_korr4_fin al_210604.pdf http://zrw.web.psi.ch/files/Kapitel_05_02.pdf Knochen http://www.onkodin.de/zms/content/e106/e26876/e26877/index_ger.html http://www.med.uni-marburg.de/stpg/ukm/lb/nuklearmed/nukleus/radiopharmaka.html http://www.enuk.de/was.htm http://homepages.fh-giessen.de/~hg6331/add_bm/kurs_nukl.html http://www.kup.at/kup/pdf/248.pdf http://www.schilddruesenerkrankungen.at/downloads/Nukmed_Broschuere_korr4_fin al_210604.pdf http://64.233.183.104/search?q=cache:3hz1BJLqLNsJ:www.ruhr-uni-bochum.de/ radio-nuk-kkh/Studenten/Skripte/ Vorlesungsskript%2520 Nuklearmedizin.pdf+ radiopharmazie+tumor&hl=de Sentinel Lymphknoten http://www.ruhr-uni-bochum.de/pressemitteilungen-2001/msg00001.html http://www.azw.co.at/akas/rtakademie/diplomarbeiten2002/pfefferle.PDF http://www.springerlink.com/media/NP330RYQXR2KV7TKUW1H/Contributions/Y/ F/A/L/YFALLA14FCNG0DD5.pdf Tumor http://www.nuklearmedizin.klinikum.uni-erlangen.de/e94/e98/e228/index_ger.html http://www.pharmazeutische-zeitung.de/pza/2003-32/titel.htm http://www.hoerr-pet.de/legende.html http://zrw.web.psi.ch/files/Kapitel_07_02.pdf Therapie http://www.chimia.ch/issues/toc/0011/Schubiger.pdf http://www.tu-dresden.de/mednukl/pdf/radiosynoviorthese.pdf Entzündung, Infektion http://zrw.web.psi.ch/files/Kapitel_04_02.pdf http://www.ogn.at/information/patienten/50189995630d10513.html http://www.nuk.med.tu-muenchen.de/fachinfo/pdf/entzuendung.pdf http://www.thieme-connect.com/ejournals/html/nuklmed/doi/10.1055/s-2004816256#N65897 http://www.thieme-connect.com/ejournals/pdf/dmw/doi/10.1055/s-2002-34064.pdf http://www.iaea.org/Publications/Booklets/CombatInfection/combatinfection.pdf PET http://www.students.informatik.uni-luebeck.de/zhb/ediss54.pdf http://www.weltderphysik.de/themen/mehr/biologie/pet/ http://www.bayern.de/lfu/strahlen/radioaktiv/umgang/liste_pet_radiopharmaka.pdf http://www.abx.de/chemicals/xxl-product-list.html http://jnm.snmjournals.org/cgi/content/full/43/3/292/F1 Hämatologie http://www.nuklearmedizin.org/Blutungsszintigraphie.htm http://www.charite.de/nuklearmedizin/pat_scon2_11.html http://www.akh-wien.ac.at/nuklear/downloads/curriculumblock10vorlesung.pdf 47 Bücher Receptor Binding Techniques. Humana Press, 1999. Mary Keen. Medical Pharmacology at a Glance. Blackwell Publishing Series. M.J. Neal. Neuroscience at a Glance. Blackwell Publishing Series. Roger Barker, Stephen Barasi. Visualisation of Receptors in Situ: Applications of Radioligand Binding. CRC press. Emmanuel Moyse, Slavica Krantic. The Pathophysiologic Basis of Nuclear Medicine. Springer Verlag. A. Elgazzar. Nuclear and Radiochemistry: Fundamentals and Applications. Wiley-VCH. Karl Heinrich Lieser. Synthesis and Applications of Isotopically Labelled Compounds. Wiley VCH. U. Pleiss, R. Voges. Molecular Nuclear Medicine: The Challenge of Genomics and Proteomics to Clinical Practice. Springer Verlag. L. E. Feinendegen, W. W. Shreeve, W. C. Eckelman, Y.-W. Bahk, H. N. Wagner. Pharmaceuticals in Medical Imaging. Macmillan Publishing Company. Dennis p. Swanson, Henry M. Chilton, James H. Thrall. Handbook of Radiopharmaceuticals: Radiochemistry and Applications. Wiley VCH. Michael J. Welch, Carol S. Redvanly. Radiopharmaceuticals in Nuclear Pharmacy and Nuclear Medicine. American Pharmacists Association. Richard J. Kowalsky, Steven W. Falen. Ausgewählte Fachartikel 1. 2. 3. 4. 5. 6. 7. 8. 9. 18 F-Fluorodeoxyglucose-positron emission tomography: A new explorative perspective Experimental Gerontology, Volume 38, Issue 4, April 2003, Pages 463-470 M. Schirmer, K. T. Calamia, M. Wenger, A. Klauser, C. Salvarani and R. Moncayo 18 F-labeled radiopharmaceuticals for PET in oncology, excluding FDG Nuclear Medicine and Biology, Volume 27, Issue 2, February 2000, Pages 103-112 L. Varagnolo, M. P. M. Stokkel, U. Mazzi and E. K. J. Pauwels Basic science: nuclear medicine in skeletal imaging Current Orthopaedics, Volume 19, Issue 1, February 2005, Pages 34-39 Michele Calleja, Adeeb Alam, David Wilson and Kevin Bradley Cardiological applications of nuclear medicine The Lancet, Volume 354, Issue 9179, 21 August 1999, Pages 661-666 M Schwaiger and J Melin Cerebral localization, then and now NeuroImage, Volume 20, Supplement 1, November 2003, Pages S2-S7 John C. Marshall and Gereon R. Fink Clinical imaging of cancer metastasis European Journal of Cancer, Volume 36, Issue 13, August 2000, Pages 1661-1670 R. M. Glasspool and T. R. J. Evans Functional imaging of intratumoral hypoxia Molecular Imaging & Biology, Volume 6, Issue 5, September-October 2004, Pages 291-305 Serene S. Foo, David F. Abbott, Nathan Lawrentschuk and Andrew M. Scott Functional neuroimaging in psychiatry International Congress Series, Volume 1247, December 2002, Pages 651-661 Konrad Maurer, David Prvulovic, Friedhelm E. Zanella and David E. J. Linden In vivo detection of apoptotic cell death: A necessary measurement for evaluating therapy for myocarditis, ischemia, and heart failure Journal of Nuclear Cardiology, Volume 6, Issue 5, September-October 1999, Pages 531-539 Francis Blankenberg, Jagat Narula and H. William Strauss 48 10. In vivo imaging of neurotransmitter systems in neuropsychiatry Clinical Neuroscience Research, Volume 1, Issues 1-2, January 2001, Pages 35-45 Dean F. Wong and James Robert Bra i 11. Nuclear medicine and the heart: A concise review Applied Radiology, Volume 26, Issue 10, October 1997, Pages 10-22 Vaseem U. Chengazi and Robert E. O'Mara 12. Nuclear medicine and the heart: A concise review Applied Radiology, Volume 26, Issue 10, October 1997, Pages 10-22 Vaseem U. Chengazi and Robert E. O'Mara 13. Nuclear medicine imaging to predict response to radiotherapy: a review International Journal of Radiation Oncology*Biology*Physics, Volume 55, Issue 1, 1 January 2003, Pages 5-15 Christophe Van de Wiele, Christophe Lahorte, Wim Oyen, Otto Boerman, Ingeborg Goethals, Guido Slegers and Rudi Andre Dierckx 14. Nuclear medicine in cancer diagnosis The Lancet, Volume 354, Issue 9181, 4 September 1999, Pages 853-857 Janet F Eary 15. Nuclear medicine in neurology and psychiatry The Lancet, Volume 354, Issue 9184, 25 September 1999, Pages 1107-1111 Durval C Costa, Lyn Spilowsky and Peter J Ell 16. Nuclear medicine in the detection, staging and treatment of gastrointestinal carcinoid tumours Best Practice & Research Clinical Endocrinology & Metabolism, Volume 19, Issue 2, June 2005, Pages 265-276 Kjell Öberg and Barbro Eriksson 17. Parkinson's disease: in vivo assessment of disease progression using positron emission tomography Molecular Brain Research, Volume 134, Issue 1, 24 March 2005, Pages 24-33 Wing Lok Au, John R. Adams, André R. Troiano and A. Jon Stoessl 18. PET for in vivo pharmacokinetic and pharmacodynamic measurements European Journal of Cancer, Volume 38, Issue 16, November 2002, Pages 2094-2107 N. Gupta, P. M. Price and E. O. Aboagye 19. Positron emission tomography as a tool for translational research in oncology Molecular Imaging & Biology, Volume 6, Issue 4, July-August 2004, Pages 214-224 Alexander Stahl, Hinrich Wieder, Morand Piert, Hans-Jürgen Wester, Reingard Senekowitsch-Schmidtke and Markus Schwaiger 20. Positron emission tomography in clinical neurology Molecular Imaging & Biology, Volume 6, Issue 4, July-August 2004, Pages 239-269 Karl Herholz and W. -D. Heiss 21. Positron emission tomography: a review of basic principles, scanner design and performance, and current systems Seminars in Nuclear Medicine, Volume 34, Issue 2, April 2004, Pages 87-111 Pat Zanzonico 22. Radionuclide therapy The Lancet, Volume 354, Issue 9182, 11 September 1999, Pages 931-935 Jean-Francois Chatal and Cornelis A Hoefnagel 23. Radiopharmaceuticals for the palliation of painful bone metastases—a systematic review Radiotherapy and Oncology, In Press, Corrected Proof, Available online 10 May 2005, Glenn Bauman, Manya Charette, Robert Reid, Jinka Sathya 24. Response to radiation Seminars in Radiation Oncology, Volume 14, Issue 4, October 2004, Pages 322-325 K.E. Rosenzweig, J.L. Fox and P. Giraud 25. Structural overview of technetium compounds (1993–1999) Coordination Chemistry Reviews, Volume 214, Issue 1, 1 April 2001, Pages 43-90 Giuliano Bandoli, Alessandro Dolmella, Marina Porchia, Fiorenzo Refosco and Francesco Tisato 26. Technetium-99m-labeled receptor-specific small-molecule radiopharmaceuticals: Recent developments and encouraging results Nuclear Medicine and Biology, Volume 24, Issue 6, August 1997, Pages 485-498 Roy K. Hom and John A. Katzenellenbogen 27. The scintillating future of nuclear medicine: General nuclear medicine: pulmonary International Congress Series, Volume 1228, February 2002, Pages 139-154 Kazuyoshi Suga 49 28. Update on detection of sentinel lymph nodes in patients with breast cancer Seminars in Nuclear Medicine, Volume 35, Issue 2, April 2005, Pages 116-128 John N. Aarsvold and Naomi P. Alazraki 29. Use of cyclotrons in medicine Radiation Physics and Chemistry, Volume 71, Issues 3-4, October-November 2004, Pages 917-926 S. M. Qaim 30. Using imaging biomarkers to accelerate drug development and clinical rials Drug Discovery Today, Volume 10, Issue 4, 15 February 2005, Pages 259-266 Homer H. Pien, Alan J. Fischman, James H. Thrall and A. Gregory Sorensen 31. What does positron emission tomography offer oncology? European Journal of Cancer, Volume 36, Issue 16, October 2000, Pages 2028-2035 H. Anderson and P. Price 50