Sorption von hydrophoben organischen Verbindungen an gelösten
Werbung

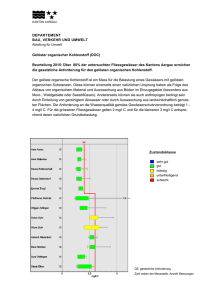
- Einleitung - Sorption von hydrophoben organischen Verbindungen an gelösten Huminstoffen - Mechanismus der Sorption an Huminstoffen - Quantifizierung von Sorptionsgleichgewichten - Experimentelle Methoden zur Bestimmung von Sorptionskoeffizienten an gelösten Huminstoffen - Empirische Modelle zur Vorausberechnung von Sorptionskoeffizienten - Beziehungen zwischen dem Sorptionsverhalten und den strukturellen Eigenschaften von Huminstoffen - Einfluß von gelösten Huminstoffen auf die Biokonzentration und Toxizität hydrophober Verbindungen - Einfluß von gelösten Huminstoffen auf die Biokonzentration - Einfluß von gelösten Huminstoffen auf die Toxizität von hydrophoben Verbindungen - Zusammenfassung - Literaturverzeichnis - Material und Methoden - Verwendete Huminstoffe - Bestimmung von KDOC-Werten mit Hilfe der SPME - Erläuterungen zu den einzelnen Versuchsreihen - Vergleich des Sorptionsverhaltens unterschiedlicher Sorptive - Vergleich des Sorptionsverhaltens von Huminstoffen unterschiedlicher Herkunft Einleitung Natürliche Huminstoffe (HS) bilden den größten Pool an organischem Kohlenstoff in der Welt. Sie sind sowohl in der organischen Substanz von Böden und Sedimenten als auch in gelöster Form in Oberflächen-, Poren- und Grundwässern enthalten. Gelöste Huminstoffe bilden mit einem Anteil von 60-80% die Hauptfraktion des gelösten organischen Kohlenstoffs (DOC) in natürlichen Wässern. Etwa 10% des DOC entfallen auf identifizierbare Substanzen wie Aminosäuren, Kohlenhydrate und Fettsäuren. Den Rest stellt polyionisches polymeres Material dar, das durch XADHarze adsorbiert wird, jedoch nicht in die Kategorie der Huminstoffe fällt. Huminstoffe sind organische Makromoleküle, die durch biotische Ab- und Umbauprozesse aus abgestorbenem tierischen und pflanzlichen Material gebildet werden. Sie besitzen keine einheitliche Struktur. Allgemein können sie als polyphenolische Verbindungen mit einer Vielzahl an Carboxylgruppen und eingebauten Kohlenhydrat- und Peptidresten charakterisiert werden. Gelöste Huminstoffe werden nach ihrer Adsorbierbarkeit an XAD-Harzen und ihrer Löslichkeit in Säuren in Humin- und Fulvosäuren unterteilt. Huminsäuren bilden eine stärker hydrophobe, Fulvinsäuren eine stärker hydrophile Fraktion der Huminstoffe. Da Huminstoffe sowohl eine Vielzahl an funktionellen Gruppen als auch hydrophobe Bereiche besitzen, sind sie in der Lage Wechselwirkungen mit verschiedenen Schadstoffklassen einzugehen. So können sie sowohl Metallionen komplexieren, als auch organische Verbindungen durch Sorption und Reaktion binden. Das Sorptionsvermögen von gelösten Huminstoffen ist insbesondere gegenüber hydrophoben organischen Verbindungen ausgeprägt. Hierzu zählen viele umweltrelevante Chemikalien, wie beispielsweise die polyzyklischen aromatischen Kohlenwasserstoffe (PAK), die polychlorierten Dibenzodioxine (PCDD) und -furane (PCDF), die polychlorierten Biphenyle (PCB) und viele Pestizide (z.B. DDT, Lindan oder die Pyrethroide). Sorptionsprozesse an Huminstoffen können maßgeblich den Transport und das Verhalten von Xenobiotica in der Umwelt beeinflussen. Während die Sorption an den partikulären Huminstoffen in Böden oder Sedimenten eine Rückhaltung des Schadstoffs am Kontaminationsort bewirkt, führt die Sorption an gelösten Huminstoffen in Poren-, Grund- und Oberflächenwässern zu einer erhöhten scheinbaren Wasserlöslichkeit und damit zu einer verstärkten Ausbreitung von hydrophoben Schadstoffen. Weitere Auswirkungen der Wechselwirkungen von Xenobiotika mit gelösten Huminstoffe sind die Reduzierung der Verflüchtigung, die Erhöhung der Photolysegeschwindigkeit sowie die Veränderung der Bioverfügbarkeit und Toxizität von organischen Verbindungen. Um das Verhalten von neuen Wirkstoffen oder von bereits in die Umwelt eingetragenen Schadstoffen abschätzen zu können, ist es deshalb notwendig, die Wechselwirkungen mit den ubiquitären Huminstoffen zu verstehen und im nächsten Schritt diese mit Hilfe geeigneter Modelle beschreiben zu können. Während für die partikuläre organische Substanz in Böden und Sedimenten eine Reihe von Modellen zur Vorausberechnung von Sorptionskoeffizienten organischer Verbindungen vorgeschlagen wurden und sich in der Diskussion befinden, ist diese Aufgabe für die gelöste organische Substanz bisher nur in wenigen Arbeiten aufgegriffen worden. Die Ursachen hierfür sind vielfältig. Gelöste Huminstoffe verschiedener Herkunft unterscheiden sich wesentlich stärker in ihrem Sorptionsverhalten, als Böden verschiedener Herkunft. Eine einheitliche Behandlung der Sorption an der gelösten organischen Substanz verschiedenen Ursprungs, wie sie für Böden und Sedimente im Rahmen vernünftiger Fehlergrenzen möglich ist, erscheint für gelöste Huminstoffe deshalb nicht zulässig. Zum anderen ist die Frage nach der mechanistischen Basis für derartige Modelle noch unzureichend geklärt. Die Vorstellungen reichen von einer Verteilung des Sorptivs zwischen Wasser und micellartigen Strukturen innerhalb der gelösten Huminstoffe, bis hin zu spezifischen Wechselwirkungen des Sorptivs mit definierten Sorptionsplätzen des Huminstoffs. Als Ausgangspunkt wie auch als Überprüfungskriterium für jedes Modell sind experimentell bestimmte Sorptionskoeffizienten für eine möglichst große Zahl an Verbindungen unerläßlich. Die Bestimmung von Sorptionskoeffizienten an gelösten Huminstoffen stellt jedoch eine anspruchsvolle analytische Aufgabe dar und die verwendeten Methoden werden hinsichtlich ihrer Richtigkeit teilweise immer noch kontrovers diskutiert. In der vorliegenden Arbeit wird der derzeitige Kenntnisstand zu den erläuterten Problemen bei der Modellierung von Sorptionsprozessen an gelösten Huminstoffen zusammengefaßt, wobei neben der Literatur auch Ergebnisse eigener experimenteller Arbeiten einfließen sollen. Auf dieser Grundlage soll die Literatur zum Einfluß gelöster Huminstoffe auf die Biokonzentration und Toxizität von hydrophoben organischen Verbindungen erörtert werden. Zusammenfassung Die Sorptionskoeffizienten von hydrophoben organischen Verbindungen an gelösten Huminstoffen werden durch die chemischen Eigenschaften des Sorptivs und die Qualität der organischen Substanz bestimmt. Während empirische KDoc-Kow-Korrelationen substanzklassenspezifisch sind, gelingt es mit Hilfe des Löslichkeitsparamterkonzeptes Sorptionskoeffizienten von hydrophoben organischen Verbindungen ganz unterschiedlicher Stoffgruppen (PAK, nichtkondensierte Arene, PCB, Alkane) gut und mit einer einheitlichen, theoretisch begründeten Gleichung vorauszuberechnen. Der Erfolg des modifizierten FloryHuggins-Konzeptes ist darin zu sehen, daß beide Triebkräfte der hydrophoben Sorption - die Unvereinbarkeit zwischen Wasser und hydrophobem Sorptiv und die Affinität zwischen Sorptiv und Sorbens explizit berücksichtigt werden. Die untersuchten Huminstoffe unterschiedlicher Herkunft, die eine natürliche aquatische Humin- und Fulvosäure, verschiedene aus Böden extrahierte Huminsäuren, anthropogene Humin- und Fulvosäuren aus dem Wasser und dem Sediment einer Schwelwasserdeponie sowie eine kommerzielle Huminsäure umfaßten, wiesen deutliche Unterschiede in ihrem Sorptionspotential auf. Der Sorptionskoeffizient für ein gegebenes Sorptiv variierte um bis zu eine Größenordnung innerhalb der verschiedenen Huminstoffe. Die Gegenüberstellung von Sorptionseigenschaften und Strukturparametern der Huminstoffe unterschiedlichen Ursprungs ergab, daß die Sorption von PAK durch eine geringe Polarität und eine hohe Aromatizität des Huminstoffs gefördert wird. Mit Hilfe einer Zweiprameterkorrelation unter Verwendung des Extinktionskoeffizienten bei 280 nm und des H/O-Elementverhältnisses konnte das Sorptionspotential der Huminstoffe unterschiedlicher Herkunft überraschend gut beschrieben werden. Dieses Ergebnis spricht zum einen für einen ähnlichen Mechanismus der Sorption von PAK an Huminstoffen ungeachtet deren unterschiedliche Herkunft. Gleichzeitig liefert es einen Hinweis dafür, daß die für die Sorption von PAK verantwortlichen Bereiche in Huminstoffen durch aromatische Strukturen gebildet werden und das Sorptionspotential eines Huminstoffs durch deren Anteil sowie Substitutionsgrad bestimmt wird. Es bleibt zu prüfen, ob eine derartige Beziehung auch für hydrophobe Verbindungen anderer Stoffklassen gültig ist. Um der Frage nachzugehen, ob zwischen PAK und den aromatischen Strukturen in Huminstoffen spezifische zwischenmolekulare Wechselwirkungen vorliegen, wurde überprüft, ob die Sorptionskoffizienten für PAK an einer Huminsäure mit hoher Aromatizität (Roth-HA) hinlänglich mit Hilfe eines Löslichkeitsparameterkonzeptes beschrieben werden können. Als Referenzsorptive zur Bestimmung des Löslichkeitsparameters der Huminsäure wurden die Sorptionskoeffizienten von nAlkanen verwendet, da diese ausschließlich zu unspezifischen Wechselwirkungen befähigt sind. Die Übereinstimmung zwischen den experimentell bestimmten Sorptionskoeffizienten der PAK und den anhand des Löslichkeitsparameterkonzeptes berechneten Werten zeigt, daß die Affinität zwischen PAK und Huminstoffen auf der Basis unspezifischer zwischenmolekularer Wechselwirkungen erklärt werden kann und spricht gegen einen signifikanten Beitrag von spezifischen Wechselwirkungen, wie Charge-Transfer-Wechselwirkungen, zur Sorption von PAK an Huminstoffen. Gelöste Huminstoffe können die Biokonzentration von organischen Schadstoffen in Organismen signifikant erniedrigen. Als Ursache für diesen Effekt wird im Allgemeinen die Sorption der Verbindungen an die gelösten Huminstoffe angesehen, die zu Komplexen führt, die zu groß und/oder zu polar sind, um durch die Organismen aufgenommen zu werden. Das Ausmaß der Erniedrigung der Biokonzentration wird hauptsächlich durch die Konzentration der gelösten Huminstoffe aber auch durch deren Qualität bestimmt und ist von dem Sorptionskoeffizienten der Verbindung abhängig. Eine signifikante Beeinflussung der Bioverfügbarkeit ist für stark hydrophobe Verbindungen bereits bei niedrigen, umweltrelevanten DOC-Konzentrationen zu erwarten. In einigen Untersuchungen führte die Anwesenheit von DOM auch zu einer Erhöhung der Biokonzentration, jedoch nur bei geringen DOC-Konzentrationen. Für den Effekt der Erhöhung der Biokonzentration in Gegenwart von DOM gibt es in der Literatur bisher keine einheitliche Erklärung. Die Verringerung der Biokonzentration von organischen Schadstoffen in Gegenwart von gelösten Huminstoffen hat generell eine Erniedrigung ihrer Toxizität zur Folge. Dies kommt in erhöhten EC50-Werten in Gegenwart von gelösten Huminstoffen gegenüber DOC-freien Kontrollen in akuten Toxizitätstests zum Ausdruck. Neben der Verringerung der Bioverfügbarkeit können weitere Wirkungen von DOM die Toxizität von organischen Verbindungen beeinflussen. Ein Beispiel dafür ist die Umsetzung organischer Verbindungen mit reaktiven Spezies, die bei photolytischen Reaktionen von Huminstoffen gebildet werden können. Dabei können sowohl weniger als auch stärker toxische Folgeprodukte entstehen.