Aufgaben - chem.uni-potsdam
Werbung

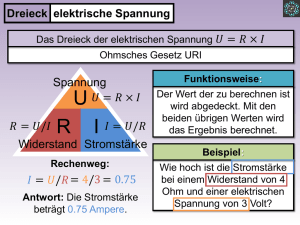
Universität Potsdam Professur für Physikalische Chemie Grundpraktikum Physikalische Chemie Dr. B. Kallies, 28.02.2001 Zersetzungsspannung Sie untersuchen die Elektrolyse von Salzsäure und von Iodwasserstoffsäure in Gegenwart von Salzsäure an Platinelektroden. Der Versuch soll einen Eindruck vermitteln, welchen Einfluß chemische Veränderungen an den Elektroden (chemische Polarisation) auf den Ablauf von Elektrolysen haben. Aufgaben Bestimmen Sie experimentell die Stromstärke I als Funktion der Spannung U bei konstanter Temperatur für 1.0 M Salzsäure und für 1.0 M Salzsäure mit Zusätzen von 0.25 bzw. 0.75 g KI. Ermitteln Sie die Stromstärke-Spannungskurven die Zersetzungsspannungen UZ für die verwendeten Lösungen Grundlagen des Versuchs Bei der Aufnahme von I-U-Kurven müßte man bei Gültigkeit des Ohmschen Gesetzes Geraden erhalten (I = U/R, R = Widerstand des Elektrolyten). Dieses Ergebnis erhält man jedoch nur, wenn sich die Elektroden während der Elektrolyse chemisch nicht verändern. Im allgemeinen sind die Verhältnisse in der Elektrochemie komplizierter, und man erhält nur in begrenzten Bereichen von Stromstärke und Spannung eine Gerade. Von besonderer Bedeutung sind Veränderungen an den Elektroden durch die Elektrolyseprodukte. So wird der Verlauf der Elektrolyse von Salzsäure bei Verwendung von Platinelektroden wesentlich dadurch beeinflußt, daß die Elektroden durch das Beladen mit Elektrolyseprodukten polarisiert werden. Sie werden damit zu verschiedenen Polen einer galvanischen Kette. Die Platinanode z.B. adsorbiert das bei der Elektrolyse entstehende Chlor und wird zur Katode in der Zelle H2(Pt)/HCl/Cl2(Pt): Elektrode: Elektrodenreaktion: Elektrodenpotential: (Pt)H2/H+ 2 H+ + 2 e- → H2 U° = 0 V Cl-/Cl2(Pt) Cl2 + 2 e- → 2 ClU° = 1.36 V Die Polarisationsspannung (Zellspannung) beträgt bei 298 K: U = 1.36 V + 0.0295 V ⋅ lg p Cl 2 ⋅ p H 2 2 2 a Cl − ⋅a H+ = 1.36 V + 0.0295 V ⋅ lg p Cl 2 ⋅ p H 2 c 4HCl ⋅ f ± (1) und ist der angelegten Spannung entgegengerichtet. Jede Erhöhung der angelegten Spannung wird durch eine Erhöhung der Polarisationsspannung kompensiert. Die resultierende Spannung und die Stromstärke sind deshalb nahezu Null. Die Stromstärke steigt erst dann, wenn der Gasdruck an den Elektroden den Außendruck erreicht und die Gase als Blasen entweichen können. Die Zersetzung des Elektrolyten beginnt. Ist die Aktivität der Salzsäure mit der Konzentration von 1 M bekannt und nimmt man als Außendruck den Standarddruck (1 bar) an, so läßt sich die Zellspannung der galvanischen Kette über Gleichung (1) aus Standardelektrodenpotentialen berechnen. Es ergibt sich mit f± = 0.81 für 1 M HCl eine Zellspannung von 1.35 V. Überschreitet die angelegte Spannung die Zellspannung, beobachtet man die Elektrolyse der Salzsäure. Dieser theoretische Wert stimmt mit dem experimentell zu erwartenden Wert nur überein, wenn Überspan1 nungen an den Elektroden vermieden werden. Deshalb ist die Katode, an der sich der Wasserstoff abscheidet, mit Platinmohr überzogen und relativ großflächig. So erreicht man eine geringe Stromdichte und kann die sonst bemerkbare Überspannung des Wasserstoffs vernachlässigen. Den typischen Verlauf einer I-U-Kurve zeigt Abb. 1. I Grenzstrom d Reststrom Uz1 Uz2 U Abb. 1: Polarogramm Die geringe Strommenge, die vor Erreichen der Zersetzungsspannung fließt (Reststrom), wird dadurch verursacht, daß winzige Mengen der abgeschiedenen Gase von den Elektroden wegdiffundieren oder sich im Wasser lösen. Dieser Verlust von Elektrolyseprodukten an den Elektroden wird durch adäquate Entladung von H+ und Cl- ausgeglichen, wodurch ein geringer Stromfluß gemessen wird. Nach Erreichen der Zersetzungsspannung entspricht die I-U-Kurve dem Ohmschen Gesetz, die Stromstärke steigt proportional zur resultierenden Spannung (angelegte Spannung minus Polarisationsspannung). Bei höheren Spannungen kann eine weitere Abweichung von Ohmschen Gesetz auftreten. Ist die Spannung so groß, daß alle zu den Elektroden gelangenden Teilchen entladen werden können, und ist der Transport dieser Teilchen zu den Elektroden diffusionsbestimmt, dann wird die Diffusionsgeschwindigkeit zum die Stromstärke begrenzenden Faktor. Da die Diffusionsgeschwindigkeit nur vom Konzentrationsgefälle in unmittelbarer Elektrodenumgebung abhängt und dieses Konzentrationsgefälle z.B. durch Rühren konstant gehalten werden kann, wird auch die gemessene Stromstärke trotz Erhöhung der Spannung konstant bleiben (Grenzstrom). Befinden sich in der Lösung mehrere Ionenarten, kann die Stromstärke wieder steigen, wenn die Abscheidungsspannung einer weiteren Ionenart erreicht wird. In diesen Fällen erhält man treppenartige I-U-Kurven (Polarogramme). Aus der Stufenhöhe d kann man die Konzentration der betreffenden Ionenart durch Vergleich bestimmen; aus der Lage der Stufe zur Spannungsachse gewinnt man Aussagen über die Ionenart selbst. Die Polarographie (Aufnahme von I-U-Kurven) stellt daher eine analytische Methode zur qualitativen und quantitativen Analyse dar. Vorbereitungsfragen 1. Leiten Sie Gleichung (1) her! 2. Erläutern Sie die Begriffe Katode und Anode für den Fall einer galvanischen Zelle und einer Elektrolysezelle! 3. Begründen Sie mit Hilfe der Gleichung (1), daß bei |U| < |UZ| eine Erhöhung der angelegten Spannung eine Erhöhung der Zellspanung zur Folge hat! 4. Erläutern Sie den Begriff "Zersetzungsspannung"! Wie kann man die Zersetzungsspannung graphisch und numerisch ermitteln? 5. Zeigen Sie mit Hilfe der Gleichung (1), a) unter welchen Bedingungen die Zersetzungsspannung von HCl genau 1.36 V beträgt, b) wie sich die Zersetzungsspannung ändert, wenn im Verlauf der Elektrolyse die Salzsäureaktivität sinkt, z.B. von 1 auf 0.1! 2 6. Warum ist es nicht möglich, Salzsäure in wäßriger Lösung durch Elektrolyse restlos zu zersetzen? 7. Informieren Sie sich anhand von Tabellen, bei welchem Spannungswert die Zersetzungsspannung von Iodwasserstoffsäure etwa zu erwarten ist! 8. Wie müßte sich der erhöhte Zusatz von KI in der 3. Meßreihe auf die I-U-Kurve auswirken? 9. Welche Aktivität hat die 1.0 M Salzsäure? 10. Berechnen Sie die Konzentration der Iodid-Ionen zu Beginn der 2. Meßreihe! Versuchsdurchführung a) Geräte Konstantspannungsquelle Gleichstrom Digitalmultimeter (Stromstärkemessung, Gleichstrom) Magnetrührwerk mit Stativ, Stativklemmen 2 Platinelektroden 100-ml-Meßzylinder 150-ml-Becherglas b) Reagenzien 1.00 M HCl, festes KI c) Arbeitsablauf Bauen Sie die erforderliche Schaltung auf (siehe Abb. 2)! Die Platinspitze ist als Anode (+) zu schalten. Stellen Sie die Fein- und Grobregler für die Spannung auf Minimum, die für die Stromstärke auf Maximum! Am Digitalmultimeter wird ein Meßbereich von 200 mA Gleichstrom eingestellt. - Konstantspannungsquelle Multimeter Magnetrührwerk Abb. 2: Versuchsaufbau - - - Geben Sie 75 ml 1.0 M HCl in das Becherglas und stellen Sie das Rührwerk an! Schalten Sie die Spannungsquelle ein! Nehmen Sie die I-U-Kurve bis 1.8 V auf, indem Sie mittels Fein- und Grobregler die Spannung in Schritten von 0.1 V erhöhen! Nach jeder Spannungseinstellung wartet man etwa 30 s und liest erst dann die Stromstärke ab. Wenn die Stromstärke anzusteigen beginnt, wird die Spannung jeweils um 0.05 V verändert. Für die 2. Meßreihe füllen Sie das Becherglas mit 75 ml frischer 1.0 M HCl. Fügen Sie zu dieser Lösung 0.25 g KI hinzu! Nehmen Sie die I-U-Kurve bis zu einer Spannung von 1.8 V auf, wobei Sie U in Schritten von 0.05 V erhöhen! Nach beendeter 2. Meßreihe geben Sie zur gleichen Lösung nochmals 0.5 g KI und nehmen Sie erneut eine I-U-Kurve auf! 3 - Im Bereich des Grenzstromes stellen Sie den Rührer ab und überzeugen sich davon, daß die Stromstärke merklich von der Rührgeschwindigkeit abhängt. Nach Ende einer Messung spülen Sie die Platinelektroden mit Wasser ab. Achten Sie darauf, mit Platinmohr beschichtete Elektroden nicht zu berühren! d) Meßprotokoll 1.0 M HCl U in V I in mA 0 0.1 ... 1.0 M HCl + 0.25 g KI U in V I in mA 0 0.05 ... 1.0 M HCl + 0.75 g KI U in V I in mA 0 0.05 ... e) Arbeitsschutz Bei der Elektrolyse von HCl entsteht H2 und Cl2. Chlorgas ist in erhöhter Konzentration giftig. Eine äquimolare Mischung aus Wasserstoff und Chlor ist explosiv. Diese Verhältnisse werden im Versuch bei sachgemäßer Ausführung nicht erreicht. Betreiben Sie die Apparatur nicht unbeaufsichtigt und länger als nötig bei Spannungen über 2 V! Auswertung Übertragen Sie die Meßwerte auf zwei Bogen Millimeterpapier, wobei Sie die Werte aus den beiden Meßreihen mit KI-Zusatz in ein Diagramm zeichnen! Ermitteln Sie durch Extrapolation die Zersetzungsspannungen von HCl und HI in den einzelnen Meßreihen! Bei Verwendung eines Computers können Sie die Extrapolationen über lineare Regressionen einzelner Teile der I-U-Kurve ausführen. Diskussion der Ergebnisse Vergleichen Sie die experimentell ermittelten Zersetzungsspannungen mit den Tabellenwerten für die Zellspannungen der gebildeten galvanischen Ketten und begründen Sie Abweichungen! Gehen Sie auf Ursachen beobachteter Unterschiede der Zersetzungsspannung von HCl in den drei Meßreihen ein! Welchen Einfluß haben Ableseungenauigkeiten auf die Werte der Zersetzungsspannung? Überlegen Sie, ob Temperatur- und Luftdruckschwankungen einen Einfluß haben! 4