Temperaturkurve Wasser
Werbung
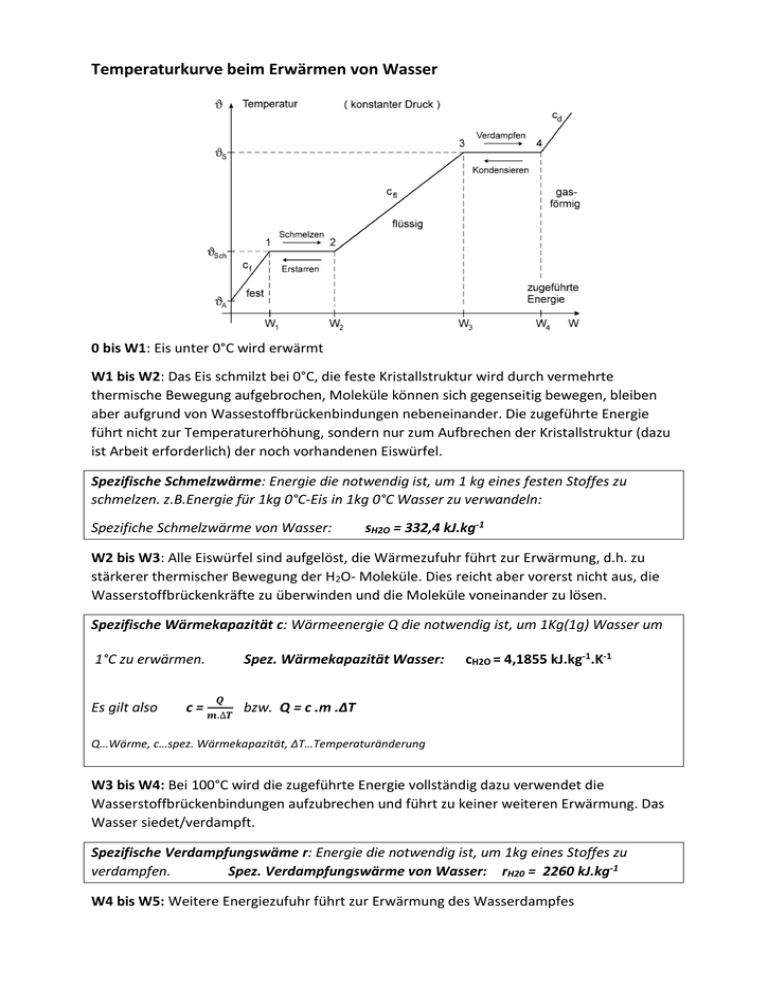
Temperaturkurve beim Erwärmen von Wasser 0 bis W1: Eis unter 0°C wird erwärmt W1 bis W2: Das Eis schmilzt bei 0°C, die feste Kristallstruktur wird durch vermehrte thermische Bewegung aufgebrochen, Moleküle können sich gegenseitig bewegen, bleiben aber aufgrund von Wassestoffbrückenbindungen nebeneinander. Die zugeführte Energie führt nicht zur Temperaturerhöhung, sondern nur zum Aufbrechen der Kristallstruktur (dazu ist Arbeit erforderlich) der noch vorhandenen Eiswürfel. Spezifische Schmelzwärme: Energie die notwendig ist, um 1 kg eines festen Stoffes zu schmelzen. z.B.Energie für 1kg 0°C-Eis in 1kg 0°C Wasser zu verwandeln: Spezifiche Schmelzwärme von Wasser: sH2O = 332,4 kJ.kg-1 W2 bis W3: Alle Eiswürfel sind aufgelöst, die Wärmezufuhr führt zur Erwärmung, d.h. zu stärkerer thermischer Bewegung der H2O- Moleküle. Dies reicht aber vorerst nicht aus, die Wasserstoffbrückenkräfte zu überwinden und die Moleküle voneinander zu lösen. Spezifische Wärmekapazität c: Wärmeenergie Q die notwendig ist, um 1Kg(1g) Wasser um 1°C zu erwärmen. Es gilt also Spez. Wärmekapazität Wasser: cH2O = 4,1855 kJ.kg-1.K-1 𝑸 c = 𝒎.∆𝑻 bzw. Q = c .m .ΔT Q…Wärme, c…spez. Wärmekapazität, ΔT…Temperaturänderung W3 bis W4: Bei 100°C wird die zugeführte Energie vollständig dazu verwendet die Wasserstoffbrückenbindungen aufzubrechen und führt zu keiner weiteren Erwärmung. Das Wasser siedet/verdampft. Spezifische Verdampfungswäme r: Energie die notwendig ist, um 1kg eines Stoffes zu verdampfen. Spez. Verdampfungswärme von Wasser: rH20 = 2260 kJ.kg-1 W4 bis W5: Weitere Energiezufuhr führt zur Erwärmung des Wasserdampfes