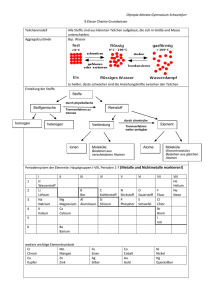
Valenzelektronen
Werbung
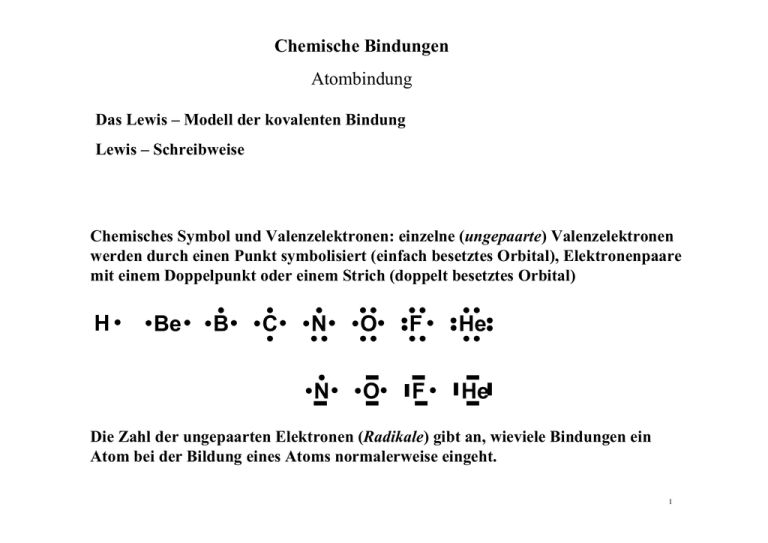
Chemische Bindungen Atombindung Das Lewis – Modell der kovalenten Bindung Lewis – Schreibweise Chemisches Symbol und Valenzelektronen: einzelne (ungepaarte) Valenzelektronen werden durch einen Punkt symbolisiert (einfach besetztes Orbital), Elektronenpaare mit einem Doppelpunkt oder einem Strich (doppelt besetztes Orbital) H Be B C N O F He N O F He Die Zahl der ungepaarten Elektronen (Radikale) gibt an, wieviele Bindungen ein Atom bei der Bildung eines Atoms normalerweise eingeht. 1 Chemische Bindungen Atombindung Das Lewis – Modell der kovalenten Bindung Bildung von Molekülen (Einfachbindungen) Aus jeweils einem ungepaarten Elektron eines Atoms bildet sich ein gemeinsames Elektronenpaar als Molekülorbital zwischen den Atomen Beispiel: F + F F F Valenzstrich Alle Atome sind bestrebt, die Edelgaskonfiguration in der äußersten Schale (Valenzschale) zu erreichen. D. h. diese Schale mit 8 Elektronen zu besetzten. Oktettregel (Ausnahme Wasserstoff) Die bindenden Valenzelektronen werden beiden Atomen zugerechnet. 2 Chemische Bindungen Atombindung Probleme der Theorie von Lewis •Keine Aussage wie negative Elektronen den Zusammenhalt zwischen zwei Atomen bewirken. •Keine Aussage über das Verhalten von Nebengruppenelementen da diese mehr als 8 Valenzelektronen haben. •Kein Hinweis auf räumliche Strukturen der Moleküle. 3 Das quantenmechanische Atommodell Elektronenkonfiguration von Mehrelektronensystemen Bei schwereren Atomen bleibt die Besetzung der inneren Schalen immer gleich. Diese Rumpfelektronen werden nicht angegeben, da sie die chemischen Eigenschaften eines Elements nur gering beeinflussen. Es werden nur die Elektronen der unvollständig besetzten äußeren Schale angegeben. Diese werden als Valenzelektronen bezeichnet. z. B. Elektronenkonfiguration des Uranatoms: [Rn] 7s² 6d1 5f4 4 Grundlagen des Periodensystems der Elemente Ordnungsprinzip im Periodensystem In einer Gruppe sind die Elemente mit der gleichen Anzahl an Valenzelektronen zusammengefasst. Elemente einer Gruppe zeigen untereinander eine nahe chemische Verwandtschaft. Man unterscheidet zwischen Hauptgruppen und Nebengruppen. In einer Periode des PSE sind die Elemente nach steigender Anzahl an Valenzelektronen angeordnet, beginnend mit der Valenzelektronenzahl s1 und endend mit der Edelgaskonfiguration. 5 Grundlagen des Periodensystems der Elemente Periodizität der Eigenschaften Wertigkeit Die Wertigkeit gibt an, wie viele Fluor oder Wasserstoffatome ein Atom oder Ion eines Elements theoretisch binden oder ersetzen kann. Die Wertigkeit wird hauptsächlich von der Valenzelektronenkonfiguration der Elemente bestimmt und auch als Valenz bezeichnet. Hauptgruppe I II III IV V VI VII Wertigkeit XeO4 7 I2O7 6 TeO3 5 Sb2O5 4 SnO2 3 In2O5 2 1 VIII SrO Rb2O 6 Grundlagen des Periodensystems der Elemente Periodizität der Eigenschaften f – Block Elemente Die f – Block Elemente haben die allgemeine Valenzelektronenkonfiguration ns², (n1)d1, (n-2)f1 bis f14. Sie folgen den Elementen Lanthan bzw. Actinium in der 6. und 7. Periode des PSE und werden Lanthanoide genannt. 7