Exelon® Lösung - FachInfo
Werbung

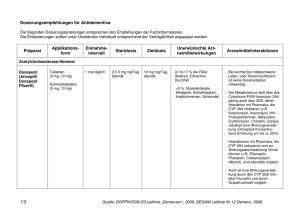
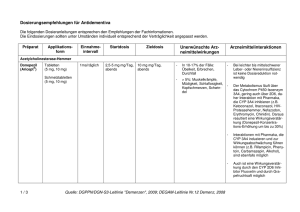
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SmPC) Exelon® Lösung 1. Bezeichnung des Arzneimittels Exelon® 2 mg/ml Lösung zum Einnehmen 2. Qualitative und quantitative Zusammensetzung Jeder ml enthält Rivastigmin[(R,R)-tartrat] (Rivastigminhydrogentartrat) entsprechend 2 mg Rivastigmin. Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1. 3. Darreichungsform Lösung zum Einnehmen Klare, gelbe Lösung 4. Klinische Angaben 4.1 Anwendungsgebiete Zur symptomatischen Behandlung der leichten bis mittelschweren Alzheimer-Demenz. Zur symptomatischen Behandlung der leichten bis mittelschweren Demenz bei Patienten mit idiopathischem ParkinsonSyndrom. 4.2 Dosierung und Art der Anwendung Die Behandlung ist durch einen Arzt zu beginnen und zu überwachen, der Erfahrung in der Diagnose und Therapie der Alzheimer-Demenz oder der Parkinson-Demenz besitzt. Die Diagnose ist nach den derzeit gültigen Richtlinien zu stellen. Eine Therapie mit Rivastigmin darf nur begonnen werden, wenn eine Bezugsperson zur Verfügung steht, die regelmäßig die Medikamenteneinnahme des Patienten überwacht. Dosierung Rivastigmin Lösung zum Einnehmen sollte zweimal täglich, mit dem Frühstück und dem Abendessen, eingenommen werden. Die verordnete Menge an Lösung muss mit der beigefügten Dosierpipette aus der Flasche entnommen werden. Aus der Dosierpipette kann Rivastigmin Lösung zum Einnehmen direkt eingenommen werden. Gleiche mg-Dosen Rivastigmin Lösung zum Einnehmen und Rivastigmin Hartkapseln können gegeneinander ausgetauscht werden. November 2015 MS 12/15 V 008 Anfangsdosis 1,5 mg zweimal täglich. Dosistitration Die Anfangsdosis beträgt 1,5 mg zweimal täglich. Wenn diese Dosis nach mindestens zweiwöchiger Behandlung gut vertragen wird, kann die Dosis auf 3 mg zweimal täglich erhöht werden. Bei guter Verträglichkeit können weitere Dosissteigerungen auf 4,5 mg und dann 6 mg zweimal täglich erfolgen, wobei die Abstände zwischen den Dosissteigerungen mindestens zwei Wochen betragen sollen. Falls während der Behandlung Nebenwirkungen (z. B. Übelkeit, Erbrechen, Bauchschmerzen, Appetitlosigkeit), Gewichtsverlust oder bei Patienten mit Parkinson-Demenz eine Verschlechterung extrapyramidalmotorischer Symptome (z. B. des Tremors) beobachtet werden, können eine oder mehrere Einzelgaben ausgelassen werden. 006141-17713 Bestehen die Nebenwirkungen trotzdem weiter, sollte vorübergehend auf die zuvor gut vertragene Dosierung zurückgegangen oder die Behandlung abgebrochen werden. Erhaltungsdosis Die wirksame Dosis beträgt 3 bis 6 mg zweimal täglich; für eine optimale Therapie sollten die Patienten die individuell höchste, noch gut verträgliche Dosis erhalten. Die empfohlene Höchstdosis liegt bei 6 mg zweimal täglich. Die Erhaltungstherapie kann solange fortgeführt werden, wie der Patient daraus einen therapeutischen Nutzen zieht. Daher sollte der klinische Nutzen von Rivastigmin regelmäßig beurteilt werden, insbesondere bei Patienten, die mit weniger als 3 mg zweimal täglich behandelt werden. Wenn sich nach dreimonatiger Behandlung mit der Erhaltungsdosis die Progression der Demenzsymptomatik nicht günstig entwickelt hat, sollte die Behandlung abgebrochen werden. Eine Beendigung der Therapie ist auch in Betracht zu ziehen, wenn ein therapeutischer Nutzen nicht mehr nachweisbar ist. Das Ansprechen auf Rivastigmin kann nicht für jeden Einzelfall vorhergesagt werden. Bei Parkinson-Patienten mit mittelschwerer Demenz wurde jedoch ein größerer Behandlungseffekt gesehen, ebenso bei Parkinson-Patienten mit visuellen Halluzinationen (siehe Abschnitt 5.1). Der Erfolg der Behandlung wurde in placebokontrollierten Studien nicht über 6 Monate hinaus untersucht. Wiederaufnahme der Behandlung Wenn die Behandlung länger als drei Tage unterbrochen wurde, sollte sie mit einer Dosis von zweimal täglich 1,5 mg wieder aufgenommen werden. Anschließend sollte die Dosistitration wie oben angegeben erfolgen. Nieren- und Leberinsuffizienz Bei Patienten mit einer leicht bis mittelschwer eingeschränkten Nieren- oder Leberfunktion ist keine Dosisanpassung erforderlich. Aufgrund der erhöhten Plasmaspiegel in diesen Patientengruppen sollten jedoch die Empfehlungen zur Dosistitration nach individueller Verträglichkeit genau eingehalten werden, da bei Patienten mit klinisch signifikanten Nieren- oder Leberfunktionsstörungen verstärkt dosisabhängige Nebenwirkungen auftreten können. Patienten mit schwerer Leberinsuffizienz wurden nicht untersucht. Exelon orale Lösung kann jedoch bei dieser Patientengruppe unter engmaschiger Überwachung angewendet werden (siehe Abschnitte 4.4 und 5.2). Kinder und Jugendliche Es gibt im Anwendungsgebiet AlzheimerDemenz keinen relevanten Nutzen von Exelon bei Kindern und Jugendlichen. 4.3 Gegenanzeigen Dieses Arzneimittel darf nicht angewendet werden bei Patienten mit bekannter Überempfindlichkeit gegen den Wirkstoff Rivastigmin, gegen andere Carbamat-Derivate oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile. Vorgeschichte mit Reaktionen an der Anwendungsstelle als Hinweis auf eine allergische Kontaktdermatitis mit RivastigminPflastern (siehe Abschnitt 4.4). 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Das Auftreten und die Schwere von Nebenwirkungen nehmen in der Regel mit höheren Dosen zu. Wenn die Behandlung länger als drei Tage unterbrochen wurde, sollte sie mit einer Dosis von zweimal täglich 1,5 mg wieder aufgenommen werden, um möglicherweise auftretende Nebenwirkungen (z. B. Erbrechen) zu vermindern. Es können durch Rivastigmin-Pflaster an der Anwendungsstelle Hautreaktionen auftreten, die üblicherweise in milder oder mäßiger Intensität verlaufen. Diese Reaktionen alleine sind noch kein Anzeichen für eine Sensibilisierung. Allerdings kann die Anwendung von Rivastigmin-Pflastern zu einer allergischen Kontaktdermatitis führen. Eine allergische Kontaktdermatitis sollte in Betracht gezogen werden, wenn sich die Reaktionen an der Anwendungsstelle über die Pflastergröße hinaus ausdehnen, wenn es Anzeichen für eine intensive lokale Reaktion gibt (z. B. eine sich vergrößernde Hautrötung, Ödeme, Hautknötchen, Bläschenbildung) und wenn sich die Symptome nicht innerhalb von 48 Stunden nach Entfernung des Pflasters signifikant bessern. In diesen Fällen soll die Behandlung abgebrochen werden (siehe Abschnitt 4.3). Patienten, die eine Reaktion an der Anwendungsstelle entwickeln, welche auf eine allergische Kontaktdermatitis mit Rivastigmin-Pflastern hindeutet, und die dennoch einer Rivastigmin-Behandlung bedürfen, sollten nur nach einem negativen Allergietest und unter enger medizinischer Überwachung auf eine orale Rivastigmin-Behandlung umgestellt werden. Es ist möglich, dass manche Patienten, die durch die Anwendung von Rivastigmin-Pflastern gegenüber Rivastigmin sensibilisiert sind, Rivastigmin in keiner Darreichungsform anwenden können. Es gibt seltene Berichte nach Markteinführung über Patienten mit allergischer Dermatitis (disseminiert) nach Verabreichung von Rivastigmin, unabhängig von der Art der Anwendung (oral, transdermal). In diesen Fällen sollte die Behandlung abgebrochen werden (siehe Abschnitt 4.3). Patienten und Pflegepersonal sollten entsprechend instruiert werden. Dosistitration: Kurz nach einer Dosissteigerung wurden Nebenwirkungen beobachtet, wie z. B. Bluthochdruck und Halluzinationen bei Patienten mit Alzheimer-Demenz bzw. eine Verschlechterung extrapyramidalmotorischer Symptome, insbesondere des Tremors, bei Patienten mit Parkinson-Demenz. Diese Nebenwirkungen können nach einer Dosisreduktion zurückgehen. In anderen Fällen wurde Exelon abgesetzt (siehe Abschnitt 4.8). Gastrointestinale Störungen wie Übelkeit, Erbrechen und Diarrhö sind dosisabhängig und können besonders zu Beginn der The1 Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SmPC) Exelon® Lösung rapie und/oder bei Dosissteigerung auftreten (siehe Abschnitt 4.8). Diese Nebenwirkungen treten häufiger bei Frauen auf. Patienten, die Krankheitszeichen oder Symptome einer Dehydration nach anhaltendem Erbrechen oder Durchfall zeigen, können mit intravenöser Flüssigkeitsgabe und Dosisreduktion oder Absetzen des Arzneimittels versorgt werden, wenn die Dehydration erkannt und sofort behandelt wird. Eine Dehydration kann schwere Folgen nach sich ziehen. Patienten mit Alzheimer-Erkrankung verlieren möglicherweise an Gewicht. Cholinesteraseinhibitoren, darunter auch Rivastigmin, wurden mit dem Gewichtsverlust bei diesen Patienten in Zusammenhang gebracht. Während der Behandlung sollte das Gewicht der Patienten überwacht werden. Im Falle von schwerem Erbrechen unter Behandlung mit Rivastigmin muss eine entsprechende Dosisanpassung erfolgen, wie in Abschnitt 4.2 beschrieben. Einige Fälle von schwerem Erbrechen waren mit einer Ösophagusruptur verbunden (siehe Abschnitt 4.8). Solche Fälle scheinen insbesondere nach Dosissteigerung oder unter hohen Dosen von Rivastigmin aufzutreten. Rivastigmin kann Bradykardie verursachen, die einen Risikofaktor für das Auftreten von Torsade de Pointes darstellt, vor allem bei Patienten mit Risikofaktoren. Vorsicht ist geboten bei Patienten mit einem erhöhten Risiko für die Entwicklung von Torsade de Pointes; wie zum Beispiel solche mit nicht kompensierter Herzinsuffizienz, kürzlichem Herzinfarkt, Bradyarrhythmien, einer Prädisposition zu Hypokaliämien oder Hypomagnesiämien oder mit Begleitmedikation, die bekannterweise zu einer QT-Verlängerung und/oder Torsade de Pointes führt (siehe Abschnitt 4.5 und 4.8). Rivastigmin ist bei Patienten mit Sick-Sinus-Syndrom oder Reizleitungsstörungen (sinuatrialer Block, atrioventrikulärer Block) mit Vorsicht anzuwenden (siehe Abschnitt 4.8). Rivastigmin kann die Magensäuresekretion erhöhen. Patienten mit floriden Magenoder Zwölffingerdarmgeschwüren oder mit einer Prädisposition für solche Erkrankungen sind mit Vorsicht zu behandeln. Cholinesterasehemmer sind bei Patienten mit Asthma oder obstruktiven Lungenerkrankungen in der Vorgeschichte nur mit Vorsicht anzuwenden. Cholinomimetika können Harnstauung und Krampfanfälle auslösen oder verstärken. Vorsicht ist geboten, wenn Patienten mit einer Neigung zu solchen Erkrankungen behandelt werden. Einer der Hilfsstoffe in Exelon Lösung zum Einnehmen ist Natriumbenzoat. Benzoesäure kann leicht reizend auf Haut, Augen und Schleimhäute wirken. Die Anwendung von Rivastigmin bei Patienten mit schweren Formen von AlzheimerDemenz oder Parkinson-Demenz, anderen Formen von Demenz oder anderen Formen von Gedächtnisstörungen (z. B. altersbedingter kognitiver Abbau) wurde nicht unter2 sucht. Deshalb wird bei diesen Patientengruppen die Anwendung nicht empfohlen. Wie andere Cholinomimetika kann Rivastigmin extrapyramidale Symptome verschlimmern oder hervorrufen. Eine Verschlechterung des Zustandes (u. a. Bradykinesie, Dyskinesie, abnormaler Gang) und ein vermehrtes Auftreten oder eine Verstärkung des Tremors wurden bei Patienten mit Parkinson-Demenz beobachtet (siehe Abschnitt 4.8). Dies führte in einigen Fällen zum Absetzen von Rivastigmin (z. B. Absetzen wegen Tremors bei 1,7 % der Patienten unter Rivastigmin gegenüber 0 % unter Placebo). Eine Überwachung dieser Nebenwirkungen wird empfohlen. Besondere Patientengruppen Bei Patienten mit klinisch signifikanten Nieren- oder Leberfunktionsstörungen können verstärkt Nebenwirkungen auftreten (siehe Abschnitte 4.2 und 5.2). Die Empfehlungen zur Dosistitration nach individueller Verträglichkeit müssen genau eingehalten werden. Patienten mit schwerer Leberinsuffizienz wurden nicht untersucht. Exelon kann in dieser Patientenpopulation angewendet werden, eine engmaschige Überwachung ist erforderlich. Bei Patienten mit einem Körpergewicht unter 50 kg können verstärkt Nebenwirkungen auftreten, und ein Therapieabbruch wegen Nebenwirkungen ist wahrscheinlicher. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Aufgrund seiner Hemmwirkung auf die Cholinesterase kann Rivastigmin während einer Anästhesie die Wirkungen von Muskelrelaxanzien vom Succinylcholintyp verstärken. Vorsicht ist geboten bei der Auswahl von Anästhetika. Mögliche Dosisanpassungen oder eine zeitweilige Unterbrechung der Behandlung können gegebenenfalls in Betracht gezogen werden. Aufgrund seiner pharmakodynamischen Wirkungen und möglicher additiver Effekte sollte Rivastigmin nicht zusammen mit anderen Cholinomimetika gegeben werden. Ein Einfluss von Rivastigmin auf die Wirkung von Anticholinergika kann nicht ausgeschlossen werden (z. B. Oxybutynin, Tolterodin). Es wurde über additive Effekte berichtet, die bei kombiniertem Gebrauch von verschiedenen Betablockern (einschließlich Atenolol) und Rivastigmin zu Bradykardie führen (die möglicherweise eine Synkope zur Folge haben kann). Kardiovaskuläre Betablocker werden mit dem höchsten Risiko assoziiert, es wurde in diesem Zusammenhang aber auch über Patienten berichtet, die andere Betablocker verwenden. Es ist daher Vorsicht geboten, wenn Rivastigmin zusammen mit Betablockern und auch mit anderen Bradykardie-auslösenden Mitteln (z. B. Klasse-III-Antiarrhythmika, Kalziumkanalantagonisten, Digitalis-Glykosid, Pilocarpin) angewendet wird. Da Bradykardie ein Risikofaktor für das Auftreten von Torsade de Pointes ist, sollte die Kombination von Rivastigmin mit anderen Torsade de Pointes-induzierenden Arznei- mitteln, wie Antipsychotika z. B. einige Phenothiazine (Chlorpromazin, Levomepromazin), Benzamide (Sulpirid, Sultoprid, Amisulprid, Tiaprid, Veraliprid), Pimozid, Haloperidol, Droperidol, Cisaprid, Citalopram, Diphemanil, Erythromycin i.v., Halofantrin, Mizolastin, Methadon, Pentamidin und Moxifloxacin, mit Vorsicht beobachtet werden und es könnte eine klinische Überwachung (EKG) ebenfalls erforderlich sein. In Studien an gesunden Probanden wurden keine pharmakokinetischen Wechselwirkungen zwischen Rivastigmin und Digoxin, Warfarin, Diazepam oder Fluoxetin beobachtet. Die unter Warfarin verlängerte Prothrombinzeit wird von Rivastigmin nicht beeinflusst. Nach gleichzeitiger Gabe von Digoxin und Rivastigmin wurden keine unerwünschten Wirkungen auf die kardiale Erregungsleitung beobachtet. Aufgrund der Art des Abbaus im Körper erscheinen metabolische Arzneimittelwechselwirkungen unwahrscheinlich, obwohl Rivastigmin möglicherweise den durch Butyrylcholinesterase vermittelten Abbau anderer Arzneimittel hemmt. 4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft Bei trächtigen Tieren überschritten Rivastigmin und/oder dessen Metaboliten die Plazentaschranke. Es ist nicht bekannt, ob dies für Menschen zutrifft. Es liegen keine klinischen Daten über exponierte Schwangere vor. In peri-/postnatalen Studien an Ratten wurde eine verlängerte Tragzeit beobachtet. Rivastigmin darf nicht während der Schwangerschaft verwendet werden, es sei denn, dies ist eindeutig erforderlich. Stillzeit Bei Tieren wird Rivastigmin mit der Muttermilch ausgeschieden. Es ist nicht bekannt, ob Rivastigmin beim Menschen in die Muttermilch übertritt; daher dürfen Patientinnen während einer Behandlung mit Rivastigmin nicht stillen. Fertilität Bei Ratten wurden durch Rivastigmin keine Beeinträchtigungen der Fertilität oder Reproduktionsleistung beobachtet (siehe Abschnitt 5.3). Es sind keine Auswirkungen von Rivastigmin auf die Fertilität von Menschen bekannt. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Die Alzheimer-Krankheit kann allmählich zu einer Beeinträchtigung der Verkehrstüchtigkeit und der Fähigkeit zum Bedienen von Maschinen führen. Weiterhin kann Rivastigmin Schwindel und Somnolenz hervorrufen, insbesondere zu Beginn der Behandlung oder bei Dosiserhöhung. Folglich hat Rivastigmin geringen oder mäßigen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Die Fähigkeit von mit Rivastigmin behandelten Demenz-Patienten zur aktiven Teilnahme am Straßenverkehr und zum Bedienen komplizierter Maschinen ist daher regelmäßig vom behandelnden Arzt zu überprüfen. 006141-17713 Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SmPC) Exelon® Lösung Tabelle 1 4.8 Nebenwirkungen Infektionen und parasitäre Erkrankungen Sehr selten Zusammenfassung des Sicherheitsprofils Die am häufigsten berichteten Nebenwirkungen sind gastrointestinaler Art, wie Übelkeit (38 %) und Erbrechen (23 %), insbesondere während der Titrationsphase. Weibliche Patienten zeigten sich in den klinischen Studien empfindlicher in Bezug auf gastrointestinale Nebenwirkungen und Gewichtsverlust als männliche. Harnwegsinfektionen Stoffwechsel- und Ernährungsstörungen Sehr häufig Häufig Nicht bekannt Appetitlosigkeit Verminderter Appetit Dehydration Psychiatrische Erkrankungen Häufig Häufig Häufig Häufig Gelegentlich Gelegentlich Sehr selten Nicht bekannt Albträume Agitiertheit Verwirrtheit Angstgefühle Schlaflosigkeit Depression Halluzinationen Aggression, Ruhelosigkeit Erkrankungen des Nervensystems Sehr häufig Häufig Häufig Häufig Gelegentlich Selten Sehr selten Schwindel Kopfschmerzen Somnolenz Tremor Synkopen Krampfanfälle Extrapyramidale Symptome (einschließlich Verschlechterung einer Parkinson-Erkrankung) Herzerkrankungen Selten Sehr selten Nicht bekannt Angina pectoris Herzrhythmusstörungen (z. B. Bradykardie, AV-Block, Vorhofflimmern und Tachykardie) Sick-Sinus-Syndrom Gefäßerkrankungen Sehr selten Bluthochdruck Erkrankungen des Gastrointestinaltrakts Sehr häufig Sehr häufig Sehr häufig Häufig Selten Sehr selten Sehr selten Nicht bekannt Übelkeit Erbrechen Durchfall Bauchschmerzen und Dyspepsie Magen- und Duodenalulcera Gastrointestinale Blutungen Pankreatitis Einige Fälle von schwerem Erbrechen waren mit einer Ösophagusruptur verbunden (siehe Abschnitt 4.4) Leber- und Gallenerkrankungen Gelegentlich Nicht bekannt Erhöhte Leberfunktionswerte Hepatitis Erkrankungen der Haut und des Unterhautzellgewebes Häufig Selten Nicht bekannt Hyperhidrose Hautausschlag Pruritus, allergische Dermatitis (disseminiert) November 2015 MS 12/15 V 008 Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Häufig Häufig Gelegentlich Müdigkeit und Asthenie Unwohlsein Stürze Untersuchungen Häufig Gewichtsverlust Tabelle 2 Stoffwechsel- und Ernährungsstörungen Häufig Häufig Die in der Tabelle 1 aufgeführten Nebenwirkungen sind bei Patienten mit AlzheimerDemenz aufgetreten, die mit Exelon behandelt wurden. Folgende weitere Nebenwirkungen wurden mit Exelon transdermalen Pflastern beobachtet: Delir, Fieber, verminderter Appetit, Harninkontinenz (häufig), psychomotorische Überaktivität (gelegentlich), Erythem, Urtikaria, Hautbläschen, allergische Dermatitis (nicht bekannt). Tabelle 2 auf den Seiten 3 und 4 zeigt die Nebenwirkungen aus klinischen Studien, die bei Patienten mit Parkinson-Demenz berichtet wurden, die mit Exelon Kapseln behandelt wurden. Folgende weitere Nebenwirkung wurde in einer Studie an Patienten mit ParkinsonDemenz beobachtet, die mit Exelon transdermalen Pflastern behandelt wurden: Agitiertheit (häufig). In Tabelle 3 auf Seite 4 sind die Anzahl und der Prozentsatz an Patienten aus der klinischen Studie über 24 Wochen mit Exelon an Patienten mit Parkinson-Demenz aufgelistet, bei denen vorher definierte Nebenwirkungen auftraten, die eine Verschlechterung der Parkinson-Symptomatik widerspiegeln können. Meldung des Verdachts auf Nebenwirkungen Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, KurtGeorg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de, anzuzeigen. 4.9 Überdosierung Verminderter Appetit Dehydration Fortsetzung auf Seite 4 006141-17713 Tabellarische Auflistung der Nebenwirkungen Die Nebenwirkungen in Tabelle 1 und Tabelle 2 sind gemäß MedDRA Systemorganklassen und Häufigkeitskategorien aufgelistet. Die Häufigkeitskategorien entsprechen folgender Konvention: Sehr häufig (≥ 1/10); häufig (≥ 1/100, < 1/10); gelegentlich (≥ 1/1.000, < 1/100); selten (≥ 1/10.000, < 1/1.000); sehr selten (< 1/10.000) und nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar). Symptome In den meisten Fällen unbeabsichtigter Überdosierung traten keine klinischen Anzeichen oder Symptome auf, und fast alle Patienten setzten die Behandlung mit Riva3 Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SmPC) Exelon® Lösung stigmin 24 Stunden nach der Überdosierung fort. Fortsetzung Tabelle 2 Psychiatrische Erkrankungen Häufig Häufig Häufig Häufig Häufig Nicht bekannt Schlaflosigkeit Angstgefühle Ruhelosigkeit Visuelle Halluzination Depression Aggression Es wurde eine cholinerge Toxizität mit muskarinischen Symptomen berichtet, die mit moderaten Vergiftungserscheinungen wie Miosis, Hitzegefühl, Verdauungsstörungen einschließlich Bauchschmerzen, Übelkeit, Erbrechen und Durchfall, Bradykardie, Bronchospasmus und erhöhter Bronchialsekretionen, Hyperhidrose, unfreiwilligem Wasserlassen und/oder Stuhlgang, Tränenfluss, Hypotonie und vermehrtem Speichelfluss einherging. Erkrankungen des Nervensystems Sehr häufig Häufig Häufig Häufig Häufig Häufig Häufig Häufig Häufig Gelegentlich Tremor Schwindel Somnolenz Kopfschmerzen Parkinson-Erkrankung (Verschlechterung) Bradykinesie Dyskinesie Hypokinesie Zahnradphänomen Dystonie In schwereren Fällen können nikotinerge Effekte entwickelt werden, wie Muskelschwäche, Faszikulationen, Krampfanfälle und Atemstillstand mit möglichem tödlichen Ausgang. Darüber hinaus gab es nach der Markteinführung Fälle von Schwindel, Tremor, Kopfschmerzen, Schläfrigkeit, Verwirrtheit, Bluthochdruck, Halluzinationen und Unwohlsein. Herzerkrankungen Häufig Gelegentlich Gelegentlich Nicht bekannt Bradykardie Vorhofflimmern AV-Block Sick-Sinus-Syndrom Behandlung Da Rivastigmin eine Plasmahalbwertszeit von etwa 1 Stunde hat und die Acetylcholinesterase über einen Zeitraum von etwa 9 Stunden hemmt, wird für den Fall einer asymptomatischen Überdosierung empfohlen, in den folgenden 24 Stunden die weitere Einnahme von Rivastigmin auszusetzen. Bei Überdosierung mit schwerer Übelkeit und Erbrechen ist die Gabe von Antiemetika zu erwägen. Ggf. sollte bei anderen unerwünschten Wirkungen symptomatisch behandelt werden. Gefäßerkrankungen Häufig Gelegentlich Hypertonie Hypotonie Erkrankungen des Gastrointestinaltrakts Sehr häufig Sehr häufig Häufig Häufig Häufig Übelkeit Erbrechen Durchfall Bauchschmerzen und Dyspepsie Gesteigerte Speicheldrüsensekretion Leber- und Gallenerkrankungen Nicht bekannt Bei massiver Überdosierung kann Atropin verabreicht werden. Initial werden 0,03 mg/kg Atropinsulfat intravenös empfohlen; weitere Dosen sollten nach der klinischen Reaktion bemessen werden. Die Verwendung von Scopolamin als Antidot ist nicht zu empfehlen. Hepatitis Erkrankungen der Haut und des Unterhautzellgewebes Häufig Nicht bekannt Hyperhidrose Allergische Dermatitis (disseminiert) Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Sehr häufig Häufig Häufig Häufig 5. Pharmakologische Eigenschaften Stürze Müdigkeit und Asthenie Gangstörungen Parkinsongang 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Psychoanaleptika, Cholinesterasehemmer, ATCCode: N06DA03 Tabelle 3 4 Vordefinierte Nebenwirkungen, die bei Demenz-Patienten mit Parkinson-Syndrom eine Verschlechterung der Parkinson-Symptomatik widerspiegeln können Exelon n (%) Placebo n (%) Gesamtzahl untersuchter Patienten Gesamtzahl Patienten mit vorher definiertem(n) Ereignis(sen) 362 (100) 99 (27,3) 179 (100) 28 (15,6) Tremor Sturz Parkinson-Erkrankung (Verschlechterung) Gesteigerte Speicheldrüsensekretion Dyskinesie Parkinsonismus Hypokinesie Bewegungsstörung Bradykinesie Dystonie Abnormer Gang Muskelstarre Gleichgewichtsstörung Skelettmuskelsteife Rigor Motorische Störung 37 (10,2) 21 (5,8) 12 (3,3) 5 (1,4) 5 (1,4) 8 (2,2) 1 (0,3) 1 (0,3) 9 (2,5) 3 (0,8) 5 (1,4) 1 (0,3) 3 (0,8) 3 (0,8) 1 (0,3) 1 (0,3) 7 (3,9) 11 (6,1) 2 (1,1) 0 1 (0,6) 1 (0,6) 0 0 3 (1,7) 1 (0,6) 0 0 2 (1,1) 0 0 0 Rivastigmin ist ein Hemmstoff der Acetylund Butyrylcholinesterase vom CarbamatTyp, von dem angenommen wird, dass er die cholinerge Neurotransmission durch Verlangsamung des Abbaus von Acetylcholin fördert, welches von funktionell intakten cholinergen Neuronen freigesetzt wird. Aus diesem Grund kann Rivastigmin die bei der Demenz in Zusammenhang mit AlzheimerKrankheit und Parkinson-Erkrankung auftretenden cholinerg vermittelten kognitiven Defizite günstig beeinflussen. Rivastigmin geht mit seinen Zielenzymen eine kovalente Bindung ein, wodurch die Enzyme vorübergehend inaktiviert werden. Eine orale Dosis von 3 mg setzt bei gesunden jungen männlichen Freiwilligen die Acetylcholinesterase(AChE)-Aktivität im Liquor innerhalb der ersten 1,5 Stunden nach Einnahme um etwa 40 % herab. Etwa 9 Stunden nach Erreichen des maximalen Hemmeffektes kehrt die Aktivität des Enzyms auf die Ausgangswerte zurück. Bei Patienten mit Alzheimer-Krankheit war die Hemmung der 006141-17713 Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SmPC) Exelon® Lösung Tabelle 4 Patienten, die klinisch signifikant ansprachen (%) Intent-To-Treat Bewertungsskala ADAS-Cog: Verbesserung um mindestens 4 Punkte Last Observation Carried Forward Placebo n = 472 Rivastigmin 6 – 12 mg n = 379 12 25*** 12 Rivastigmin 6 – 12 mg n = 473 Placebo 21*** n = 444 CIBIC-Plus: Verbesserung 29*** 18 32*** 19 PDS: Verbesserung um mindestens 10 % 26*** 17 30*** 18 Mindestens 4 Punkte Verbesserung im ADAS-Cog ohne Verschlechterung im CIBIC-Plus und im PDS 10* 6 12** 6 * p < 0,05, ** p < 0,01, *** p < 0,001 Tabelle 5 Demenz in Zusammenhang mit Parkinson-Erkrankung ITT + RDO Population Mittlerer Ausgangswert ± SD Mittlere Veränderung nach 24 Wochen ± SD Adjustierter Behandlungsunterschied p-Wert im Vergleich zu Placebo ITT – LOCF Population Mittlerer Ausgangswert ± SD Mittlere Veränderung nach 24 Wochen ± SD Adjustierter Behandlungsunterschied p-Wert im Vergleich zu Placebo ADAS-Cog Exelon ADAS-Cog Placebo (n = 329) 23,8 ± 10,2 (n = 161) 24,3 ± 10,5 (n = 329) n/a (n = 165) n/a 2,1 ± 8,2 – 0,7 ± 7,5 3,8 ± 1,4 4,3 ± 1,5 2,881 < 0,0011 (n = 287) (n = 154) 24,0 ± 10,3 24,5 ± 10,6 2,5 ± 8,4 – 0,8 ± 7,5 3,541 < 0,0011 ADCS-CGIC ADCS-CGIC Exelon Placebo n/a 0,0072 (n = 289) (n = 158) n/a n/a 3,7 ± 1,4 4,3 ± 1,5 n/a < 0,0012 1 ANCOVA mit den Faktoren Behandlung und Land und dem Ausgangswert von ADAS-Cog als einer Kovariablen; eine positive Veränderung zeigt eine Verbesserung an. 2 zur Vereinfachung sind die Mittelwerte angegeben, die Analyse der kategorialen Variablen wurde unter Verwendung des van Elteren-Tests durchgeführt. ITT: Intent-To-Treat; RDO: Retrieved Drop Outs; LOCF: Last Observation Carried Forward November 2015 MS 12/15 V 008 AChE im Liquor durch Rivastigmin bis zur höchsten untersuchten Dosis von zweimal 6 mg pro Tag dosisabhängig. Die Hemmung der Butyrylcholinesterase-Aktivität im Liquor von 14 mit Rivastigmin behandelten Alzheimer-Patienten war ähnlich der bei AChE. Klinische Studien bei Alzheimer-Demenz Die Wirksamkeit von Rivastigmin wurde mit Hilfe von drei voneinander unabhängigen Messverfahren für verschiedene Beobachtungsebenen während eines sechsmonatigen Behandlungszeitraums nachgewiesen. Zu diesen Messverfahren zählen ADAS-Cog (Alzheimer’s Disease Assessment Scale – Cognitive subscale, ein leistungsbezogenes Instrument zur Messung der kognitiven Fähigkeit), CIBIC-Plus (Clinician’s Interview Based Impression of Change-Plus, eine zusammenfassende globale Bewertung des Patienten durch den Arzt unter Einbeziehung der Angaben der Betreuungsperson) und PDS (Progressive Deterioration Scale, eine von der Betreuungsperson vorgenommene Bewertung der Aktivitäten des täglichen Lebens wie persönliche Hygiene, Nahrungsaufnahme, korrektes Bekleiden, Haushaltsarbeiten wie z. B. Einkaufen, Erhalt der 006141-17713 Orientierungsfähigkeit ebenso wie die Erledigung von Geldangelegenheiten usw.). Die untersuchten Patienten hatten einen MMSE-Wert (Mini-Mental State Examination) von 10 bis 24. Für diejenigen Patienten, die klinisch relevant auf die Behandlung ansprachen, sind die Ergebnisse aus den zwei Studien mit variabler Dosis von den insgesamt drei pivotalen multizentrischen Studien über 26 Wochen an Patienten mit leichter bis mittelschwerer Alzheimer-Demenz in Tabelle 4 aufgeführt. Eine klinisch relevante Verbesserung wurde in diesen Studien a priori als mindestens 4 Punkte Verbesserung im ADAS-Cog, eine Verbesserung im CIBICPlus oder eine mindestens 10%ige Verbesserung im PDS definiert. Zusätzlich ist in der gleichen Tabelle noch eine nachträglich vorgenommene Definition der Responderkriterien in Bezug auf die Wirksamkeit angegeben. Diese sekundäre Definition der Wirksamkeit erforderte eine Verbesserung um 4 Punkte oder mehr im ADAS-Cog, keine Verschlechterung im CIBIC-Plus und keine Verschlechterung im PDS. Nach dieser Definition betrug die tat- sächliche mittlere Tagesdosis 9,3 mg bei den Respondern in der mit 6 – 12 mg behandelten Gruppe. Es muss beachtet werden, dass die in dieser Indikation verwendeten Skalen variieren und ein direkter Vergleich der Ergebnisse für verschiedene Wirkstoffe nicht möglich ist. Klinische Studien bei Parkinson-Demenz Die Wirksamkeit von Rivastigmin bei Parkinson-Demenz wurde in einer multizentrischen, doppelblinden, placebokontrollierten Hauptstudie über 24 Wochen und deren offener Erweiterungsphase über 24 Wochen nachgewiesen. Die an dieser Studie beteiligten Patienten hatten einen MMSEWert (Mini-Mental State Examination) von 10 bis 24. Die Wirksamkeit wurde unter Verwendung von zwei unabhängigen Skalen ermittelt, welche während einer 6-monatigen Behandlungszeit in regelmäßigen Abständen gemessen wurden, wie in Tabelle 5 aufgeführt: der ADAS-Cog als Maß für die kognitiven Fähigkeiten und die globale Bewertung ADCS-CGIC (Alzheimer’s Disease Cooperative Study-Clinicians Global Impression of Change). Obwohl ein Behandlungserfolg in der Gesamtpopulation der Studie nachgewiesen wurde, legen die Daten nahe, dass in der Untergruppe der Patienten mit mittelschwerer Parkinson-Demenz ein größerer Behandlungserfolg im Vergleich zu Placebo auftrat. Ebenso wurde bei Patienten mit visuellen Halluzinationen ein größerer Behandlungserfolg beobachtet (siehe Tabelle 6 auf Seite 6). Die Europäische Arzneimittel-Agentur hat für Exelon eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in allen pädiatrischen Altersklassen in der Behandlung der Alzheimer-Demenz und in der Behandlung der Demenz bei Patienten mit idiopathischer Parkinson-Erkrankung gewährt (siehe Abschnitt 4.2 bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen). 5.2 Pharmakokinetische Eigenschaften Resorption Rivastigmin wird rasch und vollständig resorbiert. Maximale Plasmakonzentrationen werden nach etwa einer Stunde erreicht. Als Folge der Wechselwirkung von Rivastigmin mit dem Zielenzym steigt die Bioverfügbarkeit ungefähr um einen Faktor von 1,5 stärker an, als sich aufgrund einer entsprechenden Dosiserhöhung erwarten ließe. Die absolute Bioverfügbarkeit nach einer Dosis von 3 mg beträgt etwa 36 % ± 13 %. Die Einnahme von Rivastigmin Lösung zum Einnehmen mit einer Mahlzeit verzögert die Resorption (tmax) um 74 Minuten, vermindert den Cmax-Wert um 43 % und erhöht den AUC-Wert um etwa 9 %. Verteilung Die Proteinbindung von Rivastigmin liegt bei etwa 40 %. Es passiert die Blut-Hirnschranke leicht und hat ein scheinbares Verteilungsvolumen im Bereich von 1,8 bis 2,7 l/kg. Biotransformation Rivastigmin wird, hauptsächlich über eine durch Cholinesterase vermittelte Hydrolyse, 5 Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SmPC) Exelon® Lösung Tabelle 6 Demenz in Zusammenhang mit Parkinson-Erkrankung ADAS-Cog ADAS-Cog Exelon Placebo Patienten mit visuellen Halluzinationen ADAS-Cog ADAS-Cog Exelon Placebo Patienten ohne visuelle Halluzinationen ITT + RDO Population (n = 107) 25,4 ± 9,9 (n = 60) 27,4 ± 10,4 (n = 220) 23,1 ± 10,4 (n = 101) 22,5 ± 10,1 1,0 ± 9,2 – 2,1 ± 8,3 2,6 ± 7,6 0,1 ± 6,9 Mittlerer Ausgangswert ± SD Mittlere Veränderung nach 24 Wochen ± SD Adjustierter Behandlungsunterschied p-Wert im Vergleich zu Placebo ITT + RDO Population Mittlerer Ausgangswert ± SD Mittlere Veränderung nach 24 Wochen ± SD Adjustierter Behandlungsunterschied p-Wert im Vergleich zu Placebo 4,271 0,0021 2,091 0,0151 Patienten mit mittelschwerer Demenz (MMSE 10 – 17) Patienten mit leichter Demenz (MMSE 18 – 24) (n = 87) 32,6 ± 10,4 (n = 44) 33,7 ± 10,3 (n = 237) 20,6 ± 7,9 (n = 115) 20,7 ± 7,9 2,6 ± 9,4 – 1,8 ± 7,2 1,9 ± 7,7 – 0,2 ± 7,5 4,731 2,141 0,0021 0,0101 1 ANCOVA mit den Faktoren Behandlung und Land und dem Ausgangswert von ADAS-Cog als einer Kovariablen; eine positive Veränderung zeigt eine Verbesserung an. ITT: Intent-To-Treat; RDO: Retrieved Drop Outs rasch und weitgehend zu seinem decarbamylierten Metaboliten abgebaut (Halbwertszeit im Plasma etwa 1 Stunde). Dieser Metabolit verfügt in vitro über eine minimale Hemmwirkung gegenüber Acetylcholinesterase (unter 10 %). In-vitro-Ergebnisse lassen keine pharmakokinetische Interaktion mit Arzneimitteln erwarten, die durch die folgenden CytochromIsoenzyme metabolisiert werden: CYP1A2, CYP2D6, CYP3A4/5, CYP2E1, CYP2C9, CYP2C8, CYP2C19 oder CYP2B6. Tierexperimentelle Untersuchungen zeigen nur eine sehr geringe Beteiligung der wichtigsten Cytochrom-P450-Isoenzyme an der Metabolisierung von Rivastigmin. Die Gesamtplasma-Clearance von Rivastigmin beträgt etwa 130 l/Std. nach einer intravenösen Dosis von 0,2 mg und nahm nach einer intravenösen Dosis von 2,7 mg auf 70 l/Std. ab. Elimination Im Urin wird kein unverändertes Rivastigmin gefunden; die Metaboliten werden hauptsächlich über die Niere ausgeschieden. Nach Gabe von 14C-Rivastigmin erfolgt die renale Elimination rasch und fast vollständig (> 90 %) innerhalb von 24 Stunden. Weniger als 1 % der verabreichten Dosis wird mit den Fäzes ausgeschieden. Bei Patienten mit Alzheimer-Krankheit kommt es weder zu einer Akkumulation von Rivastigmin noch seines decarbamylierten Metaboliten. 6 Patienten im Alter zwischen 50 und 92 Jahren keine altersabhängige Veränderung der Bioverfügbarkeit. Eingeschränkte Leberfunktion Bei Patienten mit leichter bis mittelschwerer Leberinsuffizienz war die Cmax von Rivastigmin etwa 60 % höher und die AUC mehr als doppelt so hoch wie bei gesunden Probanden. Eingeschränkte Nierenfunktion Im Vergleich zu gesunden Probanden waren Cmax und AUC von Rivastigmin bei Patienten mit mäßiger Einschränkung der Nierenfunktion mehr als doppelt so hoch; bei Patienten mit schwerer Einschränkung der Nierenfunktion traten jedoch keine Veränderungen von Cmax und AUC von Rivastigmin auf. und seinen Metaboliten niedriger als beim Menschen war. Bezogen auf die Körperoberfläche entsprach die Exposition mit Rivastigmin und seinen Metaboliten in etwa der nach Gabe der empfohlenen maximalen Tagesdosis von 12 mg beim Menschen; beim Vergleich der Dosierungen erhielten die Tiere ca. das 6-Fache der maximalen humantherapeutischen Dosis. Bei Tieren überschreitet Rivastigmin die Plazentaschranke und wird mit der Milch ausgeschieden. Studien per os an trächtigen Ratten und Kaninchen zeigten für Rivastigmin kein teratogenes Potenzial. In Studien per os mit männlichen und weiblichen Ratten wurden durch Rivastigmin keine Beeinträchtigungen der Fertilität oder Reproduktionsleistung beobachtet, weder bei der Elterngeneration noch bei den Nachkommen. In einer Kaninchen-Studie wurde ein Potenzial für eine leichte Augen/Mukosa-Reizung identifiziert. 6. Pharmazeutische Angaben 6.1 Liste der sonstigen Bestandteile Natriumbenzoat Citronensäure Natriumcitrat Chinolingelb (E 104) Gereinigtes Wasser 6.2 Inkompatibilitäten Nicht zutreffend. 6.3 Dauer der Haltbarkeit 3 Jahre Exelon Lösung zum Einnehmen soll innerhalb eines Monats nach Anbruch der Flasche aufgebraucht werden. 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht über 30 °C lagern. Nicht im Kühlschrank lagern oder einfrieren. Aufrecht stehend aufbewahren. 5.3 Präklinische Daten zur Sicherheit In Studien zur Toxizität nach wiederholter Gabe bei Ratten, Mäusen und Hunden wurden stark übersteigerte pharmakologische Wirkungen beobachtet. Organspezifische Toxizität trat nicht auf. Aufgrund der hohen Empfindlichkeit der verwendeten Tierspezies gegenüber cholinerger Stimulation konnten in den Tierstudien keine Sicherheitsabstände zur Exposition beim Menschen ermittelt werden. Eine pharmakokinetische Populationsanalyse hat gezeigt, dass bei Patienten mit Alzheimer-Krankheit (n = 75 Raucher und 549 Nichtraucher) der Konsum von Nikotin die orale Rivastigmin-Clearance nach Einnahme oraler Rivastigmin-Kapsel-Dosen von bis zu 12 mg/Tag um 23 % erhöht. Rivastigmin erwies sich in einer Reihe von Standardtests in vitro und in vivo als nicht mutagen, außer in einem Chromosomenaberrationstest an menschlichen peripheren Lymphozyten in Dosen, die um das 104-Fache höher lagen als die maximal in der Klinik angewendeten Dosen. Der Invivo-Micronucleus-Test fiel negativ aus. Auch der Hauptmetabolit NAP226-90 zeigte kein genotoxisches Potenzial. Ältere Patienten Obwohl die Bioverfügbarkeit von Rivastigmin bei älteren Probanden höher ist als bei jüngeren, zeigten Studien mit Alzheimer- In Studien bei Ratten und Mäusen wurden bei der maximalen tolerierten Dosis keine Hinweise auf Kanzerogenität gefunden, wenn auch die Exposition mit Rivastigmin 6.5 Art und Inhalt des Behältnisses Braunglasflasche (hydrolytische Klasse III) mit kindergesichertem Verschluss, Steigrohr und selbstzentrierendem Stopfen. Flasche mit 50 ml oder 120 ml. Die Packung der Lösung zum Einnehmen enthält eine Dosierpipette in einem Plastikbehälter. 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung Die verordnete Menge Lösung muss mit der beigefügten Dosierpipette aus der Flasche entnommen werden. 7. Inhaber der Zulassung Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Vereinigtes Königreich 8. Zulassungsnummern EU/1/98/066/013 EU/1/98/066/018 006141-17713 Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SmPC) Exelon® Lösung 9. Datum der Erteilung der Zulassung/ Verlängerung der Zulassung Datum der Erteilung der Zulassung: 12. Mai 1998 Datum der letzten Verlängerung der Zulassung: 12. Mai 2008 10. Stand der Information November 2015 Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar. 11. Verkaufsabgrenzung Verschreibungspflichtig 12. Kontaktadresse in Deutschland Novartis Pharma GmbH 90327 Nürnberg Hausadresse: Roonstraße 25 90429 Nürnberg Telefon: (09 11) 273-0 Telefax: (09 11) 273-12 653 Internet/E-Mail: www.novartis.de Info-Service: November 2015 MS 12/15 V 008 Telefon: (0 18 02) 23 23 00 (0,06 € pro Anruf aus dem deutschen Festnetz; max. 0,42 € pro Minute aus dem deutschen Mobilfunknetz) Telefax: (09 11) 273-12 160 Zentrale Anforderung an: Rote Liste Service GmbH Fachinfo-Service Mainzer Landstraße 55 60329 Frankfurt 006141-17713 7