hoch ansteckende fieberkrankheiten in afrika: eu
Werbung

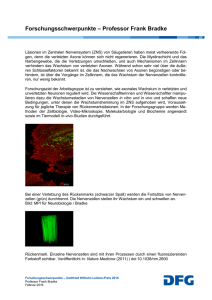
Nr. 056, 10. April 2017 Parkinson: Dem Absterben von Nervenzellen auf der Spur Wissenschaftler des Exzellenzclusters CNMPB an der UMG liefern neue Einblicke in die Parkinson‘sche Erkrankung und studieren den Einfluss verschiedener Faktoren auf die Toxizität des alpha-Synuklein-Proteins. Forschungsergebnisse veröffentlicht in BRAIN und PLoSBIOL. (cnmpb/umg) Das Absterben von Nervenzellen gilt als die Ursache für die Parkinson’sche Erkrankung. Doch die genauen molekularen Vorgänge, die dazu führen, sind bisher noch wenig verstanden. Warum erkranken manche Menschen im Alter, während andere verschont bleiben? Wieso haben Diabetiker ein erhöhtes Risiko, an Parkinson zu erkranken? Eine Schlüsselrolle im Geschehen, das zum Absterben von Nervenzellen und damit zur Entstehung der Parkinson‘schen Erkrankung führt, spielt das Protein alphaSynuklein. Eine außergewöhnliche Ansammlung von Verklumpungen (Aggregaten) des Proteins alpha-Synuklein in den Nervenzellen findet sich in den Gehirnen von Betroffenen. Das Phänomen ist so etwas wie ein „Markenzeichen“ der Parkinson‘schen Erkrankung. Nach bisherigen Erkenntnissen können Verklumpungen des alpha-Synukleins stark toxisch wirken und so das Absterben von Dopamin- Senior-Autor der Publikation: Prof. Dr. Tiago F. Outeiro, Direktor der Abteilung Experimentelle Neurodegeneration an der Universitätsmedizin Göttingen (UMG). Foto: CNMPB produzierenden Nervenzellen in der Substantia nigra bewirken, der für motorische Fähigkeiten zuständigen Gehirnregion. Doch entwickeln nicht alle Menschen, bei denen alpha-Synuklein-Ansammlungen zu finden sind, eine Parkinson‘sche Erkrankung. Auf welche Weise das alpha-Synuklein das Sterben von Nervenzellen und damit die Krankheit auslöst, ist noch unklar. Ein Ziel der Parkinson-Forschung ist daher die Identifizierung von Faktoren, die die Eigenschaften des Proteins alpha-Synuklein verändern können. Wissenschaftler am Göttinger Exzellenzcluster und des DFG-Forschungszentrum für Mikroskopie im Nanometerbereich und Molekularphysiologie des Gehirns (CNMPB) der Universitätsmedizin Göttingen (UMG) und Kollegen haben nun zwei ausgewählte Faktoren daraufhin untersucht, ob und auf welche Weise sie das alpha-Synuklein beeinflussen: das als ein Hauptregulator des Alterungsprozesses bekannte Sirtuin 2 Protein sowie den Prozess der „Glykation“, das Anhängen bestimmter Zuckerreste. Ihre Ergebnisse zeigen, dass diese mit dem Alterungsprozess beziehungsweise mit Diabetes assoziierten Faktoren auf ganz unterschiedliche molekulare Weise die Toxizität des alpha-Synuklein Proteins fördern oder gar erhöhen können. Beide Faktoren – 1/4 der Prozess der Glykation sowie das Protein Sirtuin 2 – könnten mögliche neue Ansatzpunkte für die Erforschung innovativer Therapieansätze bei Parkinson und anderen Erkrankungen aus der Familie der Synukleinopathien sein, deren Ursache im Absterben von Nervenzellen liegt. FORSCHUNGSERGEBNISSE IM DETAIL GLYKATION: WIE ZUCKERRESTE NERVENZELLEN TÖTEN Glykation ist ein Prozess, bei dem Proteine während ihrer normalen Lebenszeit durch Anhängung bestimmter Zuckerreste etikettiert werden. Für Nervenzellen kann dies allerdings tödlich enden. Die Göttinger Parkinsonforscher können jetzt belegen, dass das Anhängen bestimmter Zuckerreste die Toxizität von alpha-Synuklein signifikant erhöht. In Zusammenarbeit mit Prof. Dr. Markus Zweckstetter vom Max-Planck-Institut für biophysikalische Chemie in Göttingen und einigen anderen Kollegen weltweit, fand das Forscherteam um Prof. Dr. Tiago Outeiro, Direktor der Abteilung Experimentelle Neurodegeneration der UMG, heraus, dass der Vorgang der Glykation die Form von alpha-Synuklein und dadurch das normale Verhalten in Zellen beeinträchtigt. Dies führt zu einer Anhäufung (Akkumulierung) von toxischen Varianten des Proteins. Der Einsatz von Molekülen, die die Glykation durch Blockierung der schädigenden Zuckerreste unterbinden, reduzierte die toxischen Effekte des alpha-Synukleins. Die Forschungsergebnisse sind in der Fachzeitschrift BRAIN veröffentlicht. Originalpublikation: Miranda HV, Szego EM, Oliveira LM, Breda C, Darendelioglu E, Machado de Oliveira R, Ferreira DG, Gomes MA, Rott R, Oliveira M, Munari F, Enguita FJ, Simões T, Ferreira Rodrigues E, Heinrich M, Martins IC, Zamolo I, Riess O, Cordeiro C, Ponces-Freire A, Lashuel HA, Correia Santos N, Vaqueiro Lopes L, Xiang W, Jovin TM, Penque D, Engelender S, Zweckstetter M, Klucken J, Giorgini F, QuintasA, Outeiro TF (2017) Glycation potentiates α-synuclein-associated neurodegeneration in synucleinopathies. BRAIN-2016-01133.R3. Epub. DOI: https://doi.org/10.1093/brain/awx056 SIRTUIN 2 PROTEIN: WIE EIN ALTERUNGSPROZESS-REGULATOR NERVENZELLEN TÖTET Das Protein Sirtuin 2 gilt als ein Hauptregulator des Alterungsprozesses und ist mit zunehmendem Alter vermehrt im Gehirn zu finden. Dass Sirtuin 2 Einfluss auf die Verklumpung (Aggregation) und die Toxizität von alpha-Synuklein ausübt, konnte das Göttinger Forscherteam um Prof. Dr. Outeiro bereits klären. Weitere Untersuchungen 2/4 haben nun das molekulare Zusammenspiel von alpha-Synuklein und Sirtuin 2 näher beleuchtet: Sirtuin 2 agiert direkt mit dem alpha-Synuklein Protein und entfernt dabei eine Acetylgruppe in einer bestimmten Region des Proteins. Diese chemische Veränderung fördert die Verklumpung von alpha-Synuklein und erhöht so die Toxizität des Proteins. Im Parkinsonmodell konnten positive Effekte durch Reduzierung der Sirtuin 2 Mengen erzielt und die neuropathologischen Prozesse abgemildert werden. Die Forschungsergebnisse sind in der wissenschaftlichen Fachzeitschrift PLoS Biol veröffentlicht. „Unsere Erkenntnisse rücken solche Strategien in den Fokus, die auf eine Abnahme der Aktivität des Sirtuin 2 Proteins abzielen. Sie könnten als neue mögliche therapeutische Wege für die Therapie der Parkinson Erkrankung und anderer Synukleinopathien in Frage kommen", sagt Prof. Dr. Outeiro, Senior-Autor der Publikation. Originalpublikation: Machado de Oliveira R, Miranda HV, Francelle L, Pinho R, Szego E, Martinho R, Munari F, Lázaro DF, Moniot S, Guerreiro P, Fonseca L, Marijanovic Z, Antas P, Gerhardt E, Enguita FJ, Fauvet B, Penque D, Pais TF, Tong Q, Becker S, Kügler S, Lashuel HA, Steegborn C, Zweckstetter M, Outeiro TF (2017) The mechanism of Sirtuin 2-mediated exacerbation of alpha-synuclein toxicity in models of Parkinson’s disease. PLoS BIOL, 15(3): e2000374. doi: 10.1371/journal.pbio.2000374. Prof. Dr. Tiago F. Outeiro ist Direktor der Abteilung Experimentelle Neurodegeneration an der Universitätsmedizin Göttingen. Zudem ist er Mitglied des Göttinger Exzellenzclusters und DFG-Forschungszentrums für Mikroskopie im Nanometerbereich und Molekularphysiologie des Gehirns (CNMPB). Seine Forschungsarbeit konzentriert sich auf die Entschlüsselung der grundlegenden molekularen Mechanismen, die bei neurodegenerativen Prozessen in Krankheiten, wie Parkinson, Huntington oder der Alzheimer Erkrankung, eine Rolle spielen. WEITERE INFORMATIONEN: Universitätsmedizin Göttingen, Georg-August-Universität Abteilung Experimentelle Neurodegeneration Prof. Dr. Tiago F. Outeiro Telefon 0551 / 39-13544, [email protected] www.neurodegeneration.uni-goettingen.de 3/4 CNMPB – Mikroskopie im Nanometerbereich und Molekularphysiologie des Gehirns Exzellenzcluster 171 – DFG-Forschungszentrum 103 Dr. Heike Conrad Wissenschaftliche Programmkoordination, Presse & Öffentlichkeitsarbeit Humboldtallee 23, 37073 Göttingen Telefon 0551 / 39-7065, [email protected] www.cnmpb.de 4/4