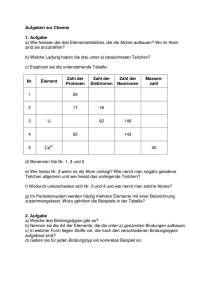
1. Geben Sie die Verhältnisformel von folgenden Verbindungen an
Werbung

1. Geben Sie die Verhältnisformel von folgenden Verbindungen an (8P): a) Magnesiumiodid MgI2 b) Indium(III)chlorid InCl3 c) Calciumoxid CaO d) Kaliumphosphat K3PO4 2. Bei normaler Mischkost ohne künstliche Zusätze nimmt ein Mensch ca. 60 mmol Glutamat in Form von Mononatriumglutamat oder ähnlichen Salzen sowie als Baustein natürlicher Proteine zu sich. Für die folgende Berechnung verwenden Sie der Einfachheit halber ausschließlich Mononatriumglutamat. Eine Instant-Nudelprodukt (z.B. „Mi Goreng“ der Firma Indomie) enthält ca. 100 mg Mononatriumglutamat als Geschmacksverstärker pro 100 g Zubereitung. Die Portionsgröße beträgt 160 g. a) Berechnen Sie die molare Masse von Mononatriumglutamat. (3P) M(Mononatriumgluatamt) = 5 x M(C) + 8 x M(H) + 1 x M(N) + 4 x M(O) = 169,13 g/mol b) Setzen Sie die Masse von Mononatriumglutamat in einer Portion Instant-Produkt in Relation zum natürlich aufgenommenen Glutamat. Geben Sie den Gewichtsanteil in Prozent an. (3P) n(natürliche Aufnahme) = 60 mmol = 0,06 mol Eine Portion des Instant-Produkts enthält ca. 1,6% der Glutamatmenge, die auf natürliche Weise aufgenommen wird. 3. (9P) a) Wie viele Protonen besitzt das O2--Ion? 8 b) Wie viele Elektronen besitzt das Li+-Ion insgesamt? 2 c) Nennen Sie eine häufige Kristallstruktur von reinen Metallen. hexagonal dichteste Kugelpackung ODER kubisch dichteste Kugelpackung ODER kubisch raumzentrierte/flächenzentrierte Kugelpackung d) Nennen Sie die Koordinationszahl sowie die Zähnigkeit des Liganden im folgenden Komplex: Koordinationszahl: 6 Zähnigkeit des Liganden: 6 e) Wie kann man abschätzen, ob zwei Elemente eine kovalente oder ionische Bindung eingehen? Durch den Vergleich der Elektronegativität. Große Differenz führt zu einer Ionenbindung; kleine Differenz führt zu einer kovalenten Bindung. f) Geben sie den Winkel zwischen zwei sp-Hybridorbitalen an. 180° 4. Bei folgender Redoxreaktion fehlen die Stöchiometrie-Faktoren: ? HNO3 + ? Cu --> ? NO + ? Cu(NO3)2 + ? H2O a) Geben Sie die Oxidations- und Reduktionsteilgleichungen an (mit korrekter Stöchiometrie) (4P) Oxidation: Cu Cu2+ + 2 e- |·3 Reduktion: 4 HNO3 + 3 e- NO + 3 NO3- + 2 H2O |·2 b) Ergänzen Sie die Stöchiometrie-Faktoren in der Gesamtgleichung (4P) 8 HNO3 + 3 Cu 2 NO + 3 Cu(NO3)2 + 4 H2O 5. a) Berechnen Sie die pH-Werte folgender Lösungen (4P) 0,2 mol/L HNO3 0,0005 mol/L Ba(OH)2 Achtung es liegt eine zweiwertige Base vor! mit b) Sie mischen 500 mL 1 mol/L Ammoniak mit 500 mL 0,2 mol/L Salzsäure. Geben Sie die Reaktionsgleichung an. Der pKB-Wert von Ammoniak beträgt 4,75. Welchen pH-Wert hat die entstehende Lösung? (5P) NH3 + HCl → NH4Cl Aufgrund der oben beschriebenen Reaktion liegen nach dem Mischen in 1 L vor: 0,1 mol Ammoniumchlorid (NH4Cl) --> c = 0,1 mol/L 0,4 mol Ammoniak (NH3) bleiben übrig --> c = 0,4 mol/L Die vorliegende Lösung ist ein basischer Puffer, deshalb muss für die pH-Wert-Berechnung die Henderson-Hasselbalch-Gleichung verwendet werden. 6. a) Was kann die Ursache sein, wenn eine Reaktion NICHT abläuft? Geben Sie sowohl eine thermodynamische als auch einen kinetische Begründung (max. 2 Sätze oder Formeln!) (4P) Thermodynamik: die Änderung der Gibbs-Energie ist positiv (endergone Reaktion), so dass das Gleichgewicht der Reaktion auf der Seite der Edukte liegt. Kinetik: Die Aktivierungsenergie der Reaktion ist zu hoch, so dass die Reaktion unendlich langsam abläuft b) Was beschreibt die Enthalpie? (2,5P) Die Enthalpie H beschreibt den Energiegehalt von Materie bezüglich chemischer Bindungen und zwischenmolekularen Wechselwirkungen. c) Geben Sie zwei konkrete Beispiele für Prozesse, bei denen die Entropie größer wird. (2P) Beispiele ... - Das Schmelzen eines Feststoffes - Die Verbrennung von Benzin; die Teilchenzahl erhöht sich und die Produkte sind gasförmig) - Das Mischen von mischbaren Substanzen, z.B. Kaffee und Milch 7. Es werden Atmosphärendruck und Raumtemperatur angenommen. Ordnen Sie den gezeigten Substanzen die folgenden Eigenschaften zu: duktil (1), spröde (1), flüssig (1), fest (8), gasförmig (1), amorph (1), hydrophil (4), lipophil (4), amphiphil (1), farbig (2) Die Zahl in Klammern gibt an, wie oft eine entsprechende Eigenschaft zugeordnet werden soll. (12P) a) - lipophil - fest - farbig b) Natriumiodid - hydrophil - fest - spröde c) - lipophil - gasförmig d) - lipophil - fest - amorph e) - lipophil - flüssig f) - hydrophil - fest g) - hydrophil - fest - farbig h) Kalium - fest - duktil i) - hydrophil - fest j) - amphiphil - fest 8. Markieren Sie den Hybridisierungszustand der Kohlenstoffatome (sp, sp2 oder sp3) in der vorliegenden Verbindung. (6P; 1/3 Punkt Abzug für jede falsche Bezeichnung, negative Punktzahl gibt es aber nicht, es wird zum Schluss auf halbe Punkte aufgerundet) Histrionicotoxin: Gift des Pfeilgiftfrosches 9. Ordnen Sie die folgenden Verbindungen nach Säurestärke und begründen Sie Ihre Entscheidung. (8P) Begründung: Im Wesentlichen sind zwei Faktoren entscheidend: a) Die Polarität der X-H-Bindung b) Die Mesomeriestabilisierung des nach Proton-Abstraktion entstehenden Anions 1) Salpetersäure Nach Abgabe des Protons können drei mesomere Grenzstrukturen formuliert werden. Die Polarität der OH-Bindung wird durch den –I-Effekt der NO3-Gruppe verstärkt. 2) Trifluoressigsäure Die Polarität der OH-Bindung wird durch den –I-Effekt der drei Fluoratome verstärkt. Das entstehende Anion kann nur noch durch zwei mesomere Grenzstrukturen beschrieben werden. 3) Ameisensäure Keine Effekte, höchstens minimaler +I-Effekt durch das Wassertoffatom an der Carboxylgruppe. 4) Pivalinsäure (2,2-Dimethylpropansäure) +I-Effekt der drei Methylgruppen am C2 (tert-Butylgruppe). Die Polarität der OH-Bindung wird durch den +I-Effekt dieser Gruppe abgeschwächt. 10. a) Geben Sie die Verbindungsklasse der folgenden Moleküle an. (7,5P) 11. Die folgende Reaktion wurde weder in Vorlesung noch Übung behandelt. Aufgrund ihrer Erfahrungen mit anderen polaren Reaktionen können Sie jedoch den Verlauf vorhersagen. (6P) a) Kennzeichnen Sie positive und negative Partialladungen im Molekül mit δ+ und δb) Beschreiben Sie den Reaktionsmechanismus (Pfeile für Elektronenbewegungen und evtl. Zwischenstufen) c) Geben Sie das/die Produkt/e an. (Tip: Es ist eine Carbonylgruppe enthalten) d) Welcher Reaktionstyp liegt vor? Additionsreaktion Anstatt des griechieschen Buchstabends wurde dp und dm aus technischen Gründen verwendet. 12. Geben Sie die fehlenden Edukte oder Produkte sowie den Reaktionstyp bei folgenden Reaktionen an. Es kann auch sein, dass keine Reaktion stattfindet (schreiben Sie „keine Reaktion“). (12P) a) Eliminierung (Dehydratisierung) b) Kondensation c) Addition d) KEINE REAKTION! e) KEINE REAKTION! f) Eliminierung g) (Poly)Kondensation h) nucleophile Substitution