Übungen zur Vorlesung Anorganische und Allgemeine Chemie für
Werbung
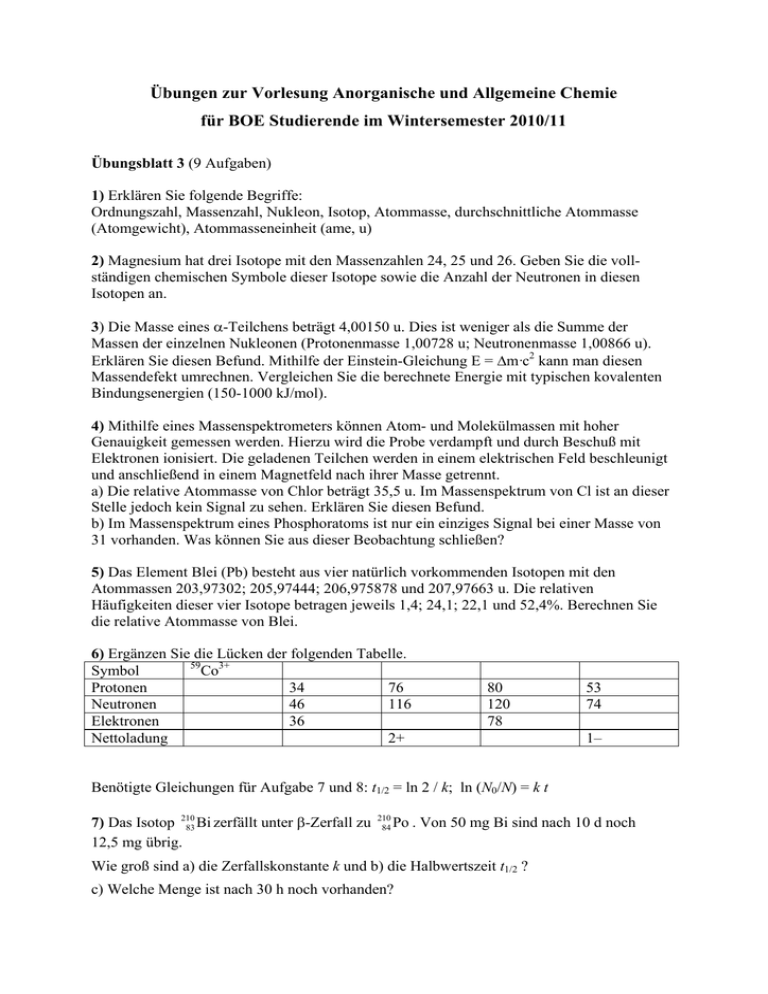
Übungen zur Vorlesung Anorganische und Allgemeine Chemie für BOE Studierende im Wintersemester 2010/11 Übungsblatt 3 (9 Aufgaben) 1) Erklären Sie folgende Begriffe: Ordnungszahl, Massenzahl, Nukleon, Isotop, Atommasse, durchschnittliche Atommasse (Atomgewicht), Atommasseneinheit (ame, u) 2) Magnesium hat drei Isotope mit den Massenzahlen 24, 25 und 26. Geben Sie die vollständigen chemischen Symbole dieser Isotope sowie die Anzahl der Neutronen in diesen Isotopen an. 3) Die Masse eines α-Teilchens beträgt 4,00150 u. Dies ist weniger als die Summe der Massen der einzelnen Nukleonen (Protonenmasse 1,00728 u; Neutronenmasse 1,00866 u). Erklären Sie diesen Befund. Mithilfe der Einstein-Gleichung E = Δm·c2 kann man diesen Massendefekt umrechnen. Vergleichen Sie die berechnete Energie mit typischen kovalenten Bindungsenergien (150-1000 kJ/mol). 4) Mithilfe eines Massenspektrometers können Atom- und Molekülmassen mit hoher Genauigkeit gemessen werden. Hierzu wird die Probe verdampft und durch Beschuß mit Elektronen ionisiert. Die geladenen Teilchen werden in einem elektrischen Feld beschleunigt und anschließend in einem Magnetfeld nach ihrer Masse getrennt. a) Die relative Atommasse von Chlor beträgt 35,5 u. Im Massenspektrum von Cl ist an dieser Stelle jedoch kein Signal zu sehen. Erklären Sie diesen Befund. b) Im Massenspektrum eines Phosphoratoms ist nur ein einziges Signal bei einer Masse von 31 vorhanden. Was können Sie aus dieser Beobachtung schließen? 5) Das Element Blei (Pb) besteht aus vier natürlich vorkommenden Isotopen mit den Atommassen 203,97302; 205,97444; 206,975878 und 207,97663 u. Die relativen Häufigkeiten dieser vier Isotope betragen jeweils 1,4; 24,1; 22,1 und 52,4%. Berechnen Sie die relative Atommasse von Blei. 6) Ergänzen Sie die Lücken der folgenden Tabelle. 59 Symbol Co3+ Protonen 34 76 Neutronen 46 116 Elektronen 36 Nettoladung 2+ 80 120 78 53 74 1– Benötigte Gleichungen für Aufgabe 7 und 8: t1/2 = ln 2 / k; ln (N0/N) = k t 7) Das Isotop 210 83 Bi zerfällt unter β-Zerfall zu 12,5 mg übrig. 210 84 Po . Von 50 mg Bi sind nach 10 d noch Wie groß sind a) die Zerfallskonstante k und b) die Halbwertszeit t1/2 ? c) Welche Menge ist nach 30 h noch vorhanden? 8) Die Radiokarbonmethode zur Datierung kohlenstoffhaltiger Materialien wurde 1947 von W. F. Libby entwickelt, der dafür 1960 den Nobelpreis erhielt. a) Erklären Sie das dieser Altersbestimmung zugrunde liegende Prinzip. b) Wie wird das erforderliche Isotop 14C (t1/2 = 5730 a) natürlich gebildet? c) Warum können Gegenstände, die älter als etwa 50000 Jahre sind mit dieser Methode nicht mehr zuverlässig datiert werden? d) Bei Ausgrabungen einer steinzeitlichen Höhle wurden Kohlenstoffreste in einer Feuerstelle entdeckt, die eine Aktivität von 3,4 Zerfällen/min/g C zeigen. Wann wurde hier zuletzt gekocht, wenn die Aktivität von frisch hergestellter Holzkohle 16 Zerfälle/min/g beträgt? 9) Berechnen Sie mit Hilfe des Born-Haber-Kreisprozesses und den folgenden Angaben die Gitterenergie von Calciumoxid. Bildungsenthalpie von CaO: –636 kJ/mol Sublimationsentalpie von Ca: 192 kJ/mol 1. und 2. Ionisierungsenthalpie von Ca: 590 und 1145 kJ/mol Dissoziationsenthalpie von O2-Molekülen: 494 kJ/mol 1. und 2. Elektronenaffinität von O-Atomen: –141 und 845 kJ/mol