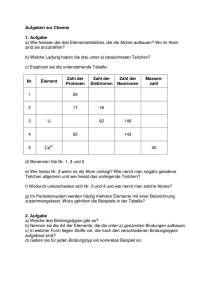
Übersicht über wesentliche Begriffe,Größen und Konstanten
Werbung
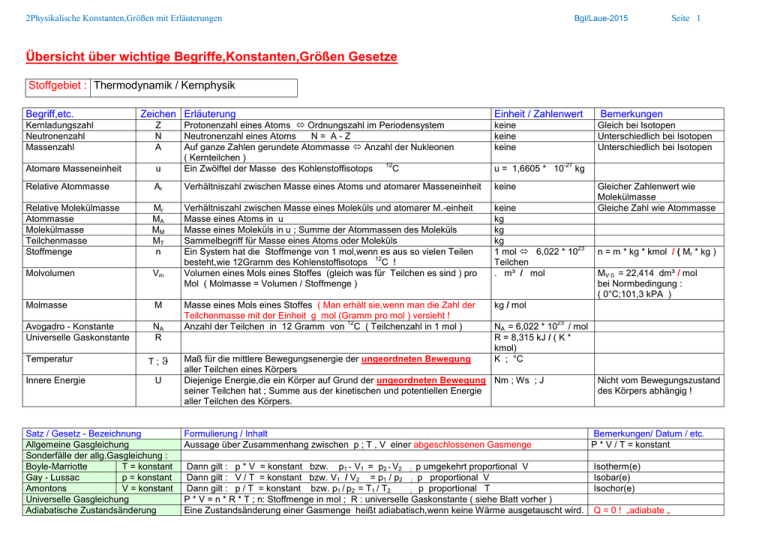
2Physikalische Konstanten,Größen mit Erläuterungen Bgl/Laue-2015 Seite 1 Übersicht über wichtige Begriffe,Konstanten,Größen Gesetze Stoffgebiet : Thermodynamik / Kernphysik Begriff,etc. Zeichen Erläuterung Einheit / Zahlenwert keine keine keine u Protonenzahl eines Atoms Ordnungszahl im Periodensystem Neutronenzahl eines Atoms N= A-Z Auf ganze Zahlen gerundete Atommasse Anzahl der Nukleonen ( Kernteilchen ) 12 Ein Zwölftel der Masse des Kohlenstoffisotops C Relative Atommasse Ar Verhältniszahl zwischen Masse eines Atoms und atomarer Masseneinheit keine Relative Molekülmasse Atommasse Molekülmasse Teilchenmasse Stoffmenge Mr MA MM MT n Molvolumen Vm Verhältniszahl zwischen Masse eines Moleküls und atomarer M.-einheit Masse eines Atoms in u Masse eines Moleküls in u ; Summe der Atommassen des Moleküls Sammelbegriff für Masse eines Atoms oder Moleküls Ein System hat die Stoffmenge von 1 mol,wenn es aus so vielen Teilen 12 besteht,wie 12Gramm des Kohlenstoffisotops C ! Volumen eines Mols eines Stoffes (gleich was für Teilchen es sind ) pro Mol ( Molmasse = Volumen / Stoffmenge ) keine kg kg kg 23 1 mol 6,022 * 10 Teilchen . m³ / mol Molmasse M kg / mol Avogadro - Konstante Universelle Gaskonstante NA R Masse eines Mols eines Stoffes ( Man erhält sie,wenn man die Zahl der Teilchenmasse mit der Einheit g mol (Gramm pro mol ) versieht ! 12 Anzahl der Teilchen in 12 Gramm von C ( Teilchenzahl in 1 mol ) Kernladungszahl Neutronenzahl Massenzahl Z N A Atomare Masseneinheit Temperatur Innere Energie T; U Satz / Gesetz - Bezeichnung Allgemeine Gasgleichung Sonderfälle der allg.Gasgleichung : Boyle-Marriotte T = konstant Gay - Lussac p = konstant Amontons V = konstant Universelle Gasgleichung Adiabatische Zustandsänderung Bemerkungen Gleich bei Isotopen Unterschiedlich bei Isotopen Unterschiedlich bei Isotopen -27 u = 1,6605 * 10 kg Gleicher Zahlenwert wie Molekülmasse Gleiche Zahl wie Atommasse n = m * kg * kmol / ( Mr * kg ) MV 0 = 22,414 dm³ / mol bei Normbedingung : ( 0°C;101,3 kPA ) 23 NA = 6,022 * 10 / mol R = 8,315 kJ / ( K * kmol) K ; °C Maß für die mittlere Bewegungsenergie der ungeordneten Bewegung aller Teilchen eines Körpers Diejenige Energie,die ein Körper auf Grund der ungeordneten Bewegung Nm ; Ws ; J seiner Teilchen hat ; Summe aus der kinetischen und potentiellen Energie aller Teilchen des Körpers. Nicht vom Bewegungszustand des Körpers abhängig ! Formulierung / Inhalt Aussage über Zusammenhang zwischen p ; T , V einer abgeschlossenen Gasmenge Bemerkungen/ Datum / etc. P * V / T = konstant Dann gilt : p * V = konstant bzw. p1 * V1 = p2 * V2 ; p umgekehrt proportional V Dann gilt : V / T = konstant bzw. V1 / V2 = p1 / p2 ; p proportional V Dann gilt : p / T = konstant bzw. p1 / p2 = T1 / T2 ; p proportional T P * V = n * R * T ; n: Stoffmenge in mol ; R : universelle Gaskonstante ( siehe Blatt vorher ) Eine Zustandsänderung einer Gasmenge heißt adiabatisch,wenn keine Wärme ausgetauscht wird. Isotherm(e) Isobar(e) Isochor(e) Q = 0 ! „adiabate „ 2Physikalische Konstanten,Größen mit Erläuterungen Satz / Gesetz - Bezeichnung I . Hauptsatz der Thermodynamik U = Q + W Bgl/Laue-2015 Formulierung / Inhalt Die Änderung der inneren Energie ist gleich der Summe aus der Wärmemenge,die zugeführt (abgegeben ) wird und der Arbeit die am System ( vom System ) geleistet wird ! Seite 2 Bemerkungen/ Datum / etc. W positiv : am System wird... W negativ : vom System wird... 3. Hauptsatz der Thermodynamik Wärme geht von selbst nur von einem System höherer Temperatur zu einem System niederer Temperatur. Es ist unmöglich ein perpetuum mobile 2.Art zu konstruieren ( Maschine entzieht ,periodisch arbeitend , einem Körper Wärme und gibt mechanische Arbeit ab) Es ist nicht möglich einen Körper bis zum absoluten Nullpunkt abzukühlen Begriff System Man unterscheidet (siehe unten ) : -abgeschlossenes System - geschlossenes System - offenes System Erläuterung Bemerkung Begrenzter Teil des Universums ,welchen man genauer betrachtet; kann aus verschiedenen Modellbegriff Dingen bestehen ; der Rest bildet die Umgebung Kein Stofftransport u.Energietransport über Systemgrenzen ,keine Wechselwirkung mit Umgebung 100 % -ig nicht möglich Kein Stofftransport ; aber Energietransport über Systemgrenzen erlaubt Stoff – und Energietransport über Systemgrenzen erlaubt 2.Hauptsatz der Thermodynamik -verschiedene Formulierungen-