Elektrolyse von Wasser
Werbung
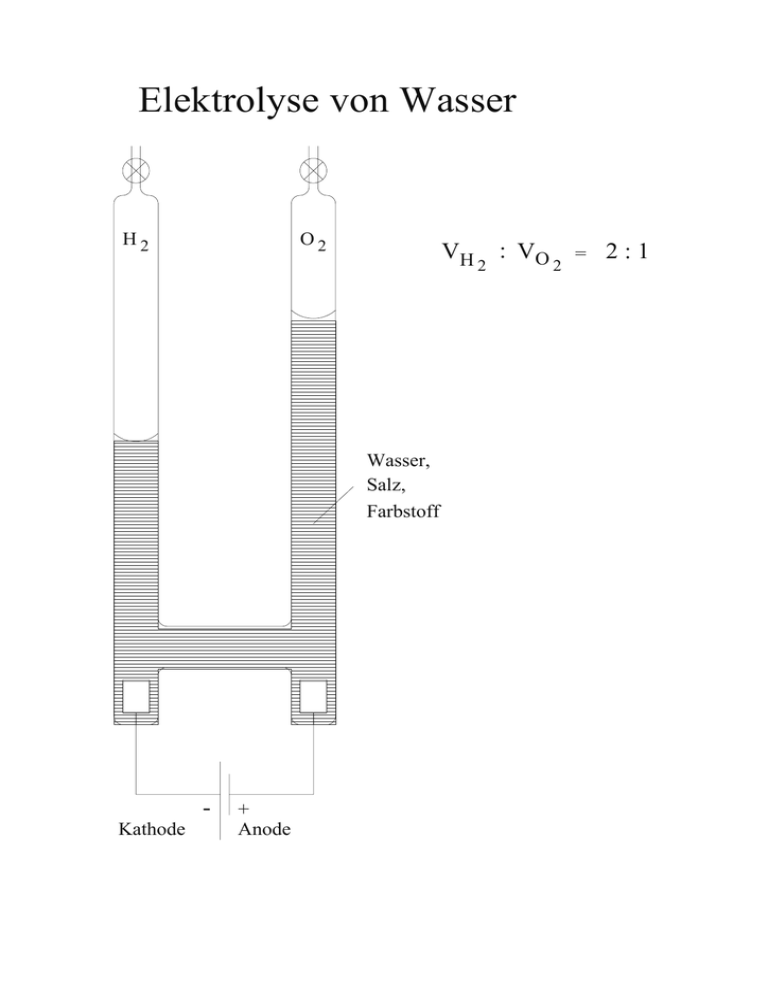
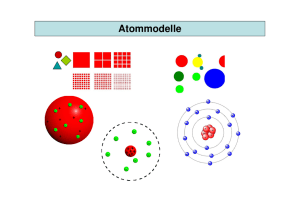
Elektrolyse von Wasser H2 O2 VH Wasser, Salz, Farbstoff Kathode + Anode 2 : VO 2 = 2:1 Aufbau, Größe und Masse der Atome Subatomare Teilchen Masse/g Ladung/C Elektron 9,1096⋅10-28 -1,602⋅10-19 Proton 1,6726⋅10-24 Neutron 1,6750⋅10-24 +1,602⋅10-19 0 Elementarladung e = 1,602⋅10-19 C Symbol e p n Experiment von Rutherford Blei Goldfolie, 5µm dick 0,1 % 99,9 % Radium a -Teilchen Folgerung: Die α-Teilchen müssen sehr klein sein Die Atome bestehen im wesentlichen aus leerem Raum Die Hauptmasse des Atoms muss sich in einem winzigen Volumen befinden Aufbau und Größe der Atome Durchmesser des Atomkerns: etwa 0,01 pm Durchmesser des Atoms: etwa 100-200 pm Der Atomkern enthält die Protonen und Neutronen Der Atomkern enthält 99,95% der Atommasse Zahl der Elementarteilchen in Atomen Bei neutralen Atomen muss gelten: Zahl der Protonen = Zahl der Elektronen. Dafür hat man auch den Begriff der Ordnungszahl Z eingeführt. Z = Zahl der Protonen = Zahl der Elektronen Unter der Massenzahl MZ versteht man die Zahl der schweren Teilchen im Atomkern. MZ = Np + Nn Raster-Tunnel-Elektronenmikroskopie ~4nm Silicium 111-Oberfläche Aufbau einiger Elemente Element Wasserstoff Helium Lithium Beylllium Z 1 2 3 4 Symbol H He Li Be MZ 1 4 7 9 Nn 0 2 4 5 Isotope: Elemente mit unterschiedlicher Neutronenzahl bei gleichem Z. und 235 92 U 238 92 U Isotope unterscheiden sich in ihren chemischen Eigenschaften kaum. Ausnahme: normaler Wasserstoff, Nn = 0 Deuterium, Nn = 1 Tritium, Nn = 2 Masse der Atome, Stoffmenge Atome weisen Massen von etwa 10-23 g auf. Das ist zu klein für praktische Anwendungen. Man hat daher den Begriff der Stoffmenge eingeführt. Unter einer Stoffmenge versteht man eine bestimmte und sehr große Zahl von Teilchen: Es sind so viele Teilchen, wie sich in 12 g des Kohlenstoffisotops 12C befinden. Wie viel Teilchen sind das? 6,022⋅1023 Teilchen Diese Zahl wird auch als Avogadro-Konstante bezeichnet. NA = 6,022⋅1023 /mol Anwendung der Größe „Stoffmenge” Symbol n, Einheit mol In Tabellen (Periodensystem) findet man Angaben darüber, welche Masse 1 mol des betreffenden Elements aufweist. Diese Größe wird als Molare Masse M bezeichnet. Beispiele: Kohlenstoff 12 C: M = 12 g/mol natürlich vorkommender Kohlenstoff besteht aus 99% 12C und 1% 13C: M = 12,01 g/mol Sauerstoff: M = 16,00 g/mol Chlor: M = 35,45 g/mol besteht aus 35Cl und 37Cl Anwendung der Größe „Stoffmenge” Molare Masse von Verbindungen Verbindung AiBj: M = iMA + jMB Berechnung der Stoffmenge bei gegebener Masse m=nM --> n = m/M Berechnung der Zahl der Teilchen N = n NA Bestimmung der Avogadro-Konstante - Bestimmung der Dichte ρ eines festen Elements - Bestimmung der Atomabstände a im Kristall - Die molare Masse M ist bekannt Volumen eines Mols: VM = M / ρ Mit den Abständen a wird daraus die Zahl der Atome in VM bestimmt Das ist die Avogadro-Konstante NA Aufbau der Elektronenhülle von Atomen - Mechanische Untersuchungen sind zu grob - Untersuchung mit Licht - Absorption von Licht - Emission von Licht Für unseren Zweck: Licht ist ein Strom von Photonen Energie eines Photons: E = h ν Geschwindigkeit: c = λν Plancksches Wirkungsquantum: h = 6,626⋅10-34 Js Vakuumlichtgeschwindigkeit: c = 2,998⋅108 m/s Klassisches Bild vom Wasserstoffatom Das Elektron bewegt sich auf einer Kreisbahn um das Proton e p r Zentrifugalkraft und elektrostatische Anziehung sind gleich groß Die Energie des H-Atoms setzt sich aus der kinetischen und elektrostatischen Energie zusammen Die Energie steigt kontinuierlich mit dem Radius Das H-Atom müsste weißes Licht emittieren Lichtemission einer Glühlampe rot grün blau Lampe Linse Spalt Gitter Primärstrahl blau grün rot Lichtemission von Wasserstoff in einer Glimmentladung türkis rot 656,7 blau 434,5 486,1 Primärstrahl türkis blau 434,5 486,1 rot 656,7 Bohrsches Atommodell E=- me 8e 2 o 4 h 2 1 n 2 n = 1, 2, 3, ...; Quantenzahl (Hauptquantenzahl) 0 n = unendlich n=3 angeregte Zustände n=2 E n=1 Grundzustand Emission von Licht ∆E = me 8 e 2 o 4 h 1 2 n 2 2 1 e 2 1 n = 1: Emission im UV 2 n = 2: Emission im sichtbaren Bereich 2 (Balmer Serie) = hν