R. Dörner: Einführung in die Struktur der Materie
Werbung

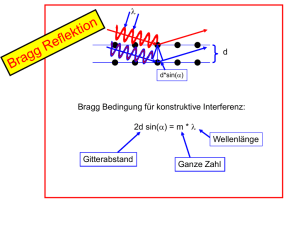
Dieses File enthält Material das in der Vorlesung Einführung in die Strukture der Materie – Atomphysik diskutiert wurde Dozent: Prof. Dr. Reinhard Dörner Universität Frankfurt [email protected] Homepage zu Vorlesung: http://hsbpc1.ikf.physik.uni-frankfurt.de/ folgen Sie dem link -> lectures/seminars -> doerner Zentrale Unterschiede von klassicher und quantenmechnischer Sicht: Klassische Theorien Quantenmechanik (Newtonsche Mechanik, Maxwell Elektrodynamik) •Deterministisch aus maximaler Beobachtung eindeutig auf Zukunft und Vergangenheit schliessen •Indeterministisch nur Wahrscheinlichkeitsaussagen •Teilchen: Orts&Impuls&Zeit Punkte •Teilchen: Wellenfunktion •Realität lokal •Realität nichtlokal d.h. räumlich entfernte Teilchen sind nur über auch weit entferne Teilchen sind verschränkt Kräfte verknüpft, Lichtgeschwindigkeit •Kontinuierlich: Energie und Drehimpuls kann jeden Wert annehmen •Gequantelt: Energie und Drehimpuls habe oft nur diskrete Werte „Those who are not shocked when they first come across quantum mechanics cannot possibly have understood it.“ Niels Bohr I do not like it, and I am sorry I ever had anything to do with it. Erwin Schrödinger, speaking of quantum mechanics I think it is safe to say that no one understands quantum mechanics. Richard Feynman Lord Ernest Rutherford (1927): „Anyone who expects a source of power from tranformations of atoms is taking moonshine“ 1: Einleitung: Atomphysik und Quantenmechanik haben a) weitreichende Implikationen für unser Weltbild b) Immense technische Bedeutung 2. Historischer Rückblick 2.1 Atomtheorie seit den Griechen = unteilbar Leukip (ca 440vChr.) und Schüler Demokrit (469-370v.Chr.) http://www.utm.edu/research/iep/d/democrit.htm Die Dinge können nicht unendlich geteilt werden (vgl. Pudding vs Sand) sondern es gibt kleinste, unteilbare Träger der Eigenschaften, zwischen ihnen ist LEERER Raum, die Vielfalt der Welt kommt aus der Zusammensetzung unendlich vieler Atome“. Alle Änderung ist Änderung der der Anordnung und der Zusammensetzung. Platon (427-347vChr) „Platonische Körper“ vier Grundelemente Feuer Luft Wasser Erde verschiedenen geometrischen Objekten zugeordnet. Aristoteles (384-322v.Chr.): keine Atome, kontinuierlicher, Materie erfüllter Raum. Christliches Mittelalter: Atomismus als zu materialistisch abgelehnt (lebende Wesen aus Atomen zusammengesetzt statt Gottes Ebenbild) 18tes und 19tes Jahrhundert vielfältige Hinweise aus der Chemie = unteilbar Leukip (ca 440vChr.) und Schüler Demokrit (469-370v.Chr.) Platonische Körper Problem: Atome kann (konnte) man nicht sehen, daher immer Interpretation! -> Wissen aus einem Netz von Beobachtungen und Modellen „Beobachtungen“ sind nicht modellunabhängig Immanuel Kant: "Gedanken ohne Inhalte sind leer, Anschauungen ohne Begriffe sind blind" Empirie – Theorie „Beobachtung“ - Modell Problem: Atome kann (konnte) man nicht sehen, daher immer Interpretation! -> Wissen aus einem Netz von Beobachtungen und Modellen Beobachtungen sind nicht Modellunabhängig Beispiel: Wilhelm Ostwald (Chemie Nobelpreis 1909) and Ernst Mach 1908 Chemie Lehrbuch Einleitung gegen Atomismus Beobachtung: Sorgfältiges Wiegen, ganzzahliges Massenverhältnis z.B. Wasser aus Sauerstoff und Wasserstoff 1:8 Dalton 1803 Atomhypothese: 1808: „A New System of Chemical Philosophy“ „Das Wesen der chemischen Umwandlung besteht in der Vereinigung und Trennung von Atomen“ •Chemisch Elemente bestehen aus kleinsten Teilchen, die man chemisch nicht weiter zerlegen kann •Atome desselben Elementes sind in Qualität, Größe und Masse gleich •Verbindungen zwischen „Molekülen“: Ganzahliges Massenverhältnis des Atome. Joseph Louis Gay-Lussac (1808): Bei Gasen: Nicht nur Gewichte sondern auch Volumina verhalten sich wie kleine ganze Zahlen: 1 Volumen N2 + 1 Volumen O2 -> 2 Volumina NO Avogadro 1811: Gleiche Volumina verschiedener Gase enthalten gleich viele Moleküle Michael Faraday (1791-1867): 1833 Atomistik der Elektrizität Elektrolyse: abgeschiedene Menge des Materials proportional zur Ladungsmenge Michael Faraday (1791-1867): 1833 Atomistik der Elektrizität Elektrolyse: abgeschiedene Menge des Materials proportional zur Ladungsmenge . 2.2. Die Avogadro Konstante (das MOL) Definition: atomare Masseneinheit 1 amu = 1/12 der 12C Masse = 1.66055 10-27kg 1mol ist die Stoffmenge, die ebenso viele Teilchen (Atome oder Moleküle) enhält, wie 12g 12C. 1mol H2 = 2g Wasserstoff 1mol He = 4g Helium 1mol H2O=18g Wasser Avogadro-Konstante (=Loschmidt Zahl): Atome/Moleküle in 1 Mol Stoffmenge NA = 6.0221367 1023 1/mol 1 Mol ideales Gas bei p=1013hPa, T=00C nimmt 22,4141 Liter Volumen ein Stoffunabhängig dank Definition des mols (p*V=NA k T k=Boltzmann Konstante z.B. Aus Boltzmann Geschwindigkeitsverteilung Genaue Bestimmung von NA aus Kristallen: 1. Bestimme das Molvolumen durch Wiegung (welches Volumen nimmt 1 mol gewogener Einkristall ein) Vmol Volumen das 1 mol Stoffmenge einnimmt 2. Bestimme welches Volumen ein Teilchen einnimmt durch Röntgenbeugung Bragg siehe nächste Seite NA = Vmol / VTeilchen Wägung& Verdrängungsmessung Bragg Reflektion Röntgenbeugung an Kristallen Max von Laue Nobelpreis 1914 1914-1919 1. Lehrstuhl für Theoretische Physik in Frankfurt http://www.physik.uni-frankfurt.de/paf/paf24.html http://www.nobel.se Nach diesem ersten Erfolg war auch SOMMERFELD überzeugt und unterstützte die weiteren, verbesserten Experimente. SOMMERFELD teilte die Resultate der Bayerischen Akademie der Wissenschaften am 8. Juni 1912 mit, und LAUE referierte am 14. Juni auf der Sitzung der Physikalischen Gesellschaft in Berlin. PLANCK berichtet 25 Jahre später über jene denkwürdige Sitzung: "Als Herr v. LAUE nach der theoretischen Einleitung die erste Aufnahme zeigte, die den Durchgang eines Strahlenbündels durch ein ziemlich willkürlich orientiertes Stück von triklinem Kupfervitriol darstellte - man sah auf der photographischen Platte neben der zentralen Durchstoßungsstelle der Primärstrahlen ein paar kleine sonderbare Flecken -, da schauten die Zuhörer gespannt und erwartungsvoll, aber doch wohl nicht ganz überzeugt auf das Lichtbild an der Tafel. Aber als nun jene Figur 5 sichtbar wurde, das erste typische LAUEdiagramm, welches die Strahlung durch einen genau zur Richtung der Primärstrahlung orientierten Kristall regulärer Zinkblende wiedergab mit ihren regelmäßig und sauber in verschiedenen Abständen vom Zentrum angeordneten Interferenzpunkten, da ging ein allgemeines "ah" durch die Versammlung. Ein jeder von uns fühlte, daß hier eine große Tat vollbracht war". Aus: v. Laue Nobelvortrag s. http://www.nobel.se d d*sin() Bragg Bedingung für konstruktive Interferenz: 2d sin() = m * Wellenlänge Gitterabstand Ganze Zahl Braggsches Drehwinkel Verfahren: Monochromatischer Strahl & Einkristall Laue Verfahren: Polichromatischer Strahl an Einkristall Debye-Scherrer Verfahren: Monochromatisches Licht, Polykristall (biete alle Ebenen an) 3: Kann man Atome sehen???? NEIN: „sehen“ Teilchen>/2 Sichtbares Licht 5 10-7m Atom: 10-10 m 3.1: Wie gross sind Atome VORSICHT: Atome haben keine genaue Grösse, keine Kugeln mit festem Rand -> QM Wellenfunktion 3.1.1. Bestimmung aus dem Kovolumen: Ideale Gasgleichung 2 Näherungen: keine Kräfte, Punktteilchen Van der Waals Gleichung der REALEN GASE (p + a/V2 ) (V – b) = RT “Binnendruck” “Kovolumen” (4faches des Volumens, das die Atome einnehmen 3.1.2. Röntgenbeugung an Kristallen (Bragg, s.o.) 3.1.3. Über Gasstreuung: Wirkungsquerschnitt (Folie) 3.2 Licht von (einzelnen) Atomen (Falle) 3.3 Spuren von Atomen (Nebelkammer) 3.4 Abtasten (Rastertunnelmikroskop) 3. Kann man Atome sehen???? ATOM