Lösung 1 - Uni Marburg
Werbung

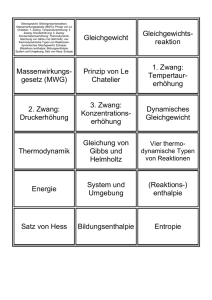
Übung zum chemischen Praktikum für Studierende der Biologie und Medizin Übung Nr. 1, 18.04.11 / 19.04.11 Lösung 1. Proteine sind Biopolymere, welche aus langen Ketten von Aminosäuren bestehen. a) Zeichnen Sie die Valenzstrichformeln von drei proteinogenen Aminosäuren Ihrer Wahl. (Lösung: siehe Power-Point-Präsentation: Struktur von Proteinen) b) Zeichnen Sie die Valenzstrichforlmel der Aminosäure Alanin in der unnatürlichen D-Konfiguration. 2. a) Was ist eine Peptidbindung? Eine Amidbindung zwischen einer Carboxylgruppe und einer Aminogruppe zweier Aminosäuren. b) Zeichnen Sie die Valenzstrichformel des Tripeptids Cystein-Glycin-Tryptophan (Cys-Gly-Try). Tripeptid aus L-Cystein, Glycin und L-Tryptophan O H2N O H N N H OH O HS NH 3. Was beschreibt die … a) Primärstruktur b) Sekundärstruktur c) Tertiärstruktur d) Quartärstruktur eines Proteins. Erklären Sie anhand von Skizzen. (Lösung: siehe Power-Point-Präsentation: Struktur von Proteinen) 4. Welche Teile des menschlichen Körpers bestehen zum größten Teil aus Proteinen? Nennen Sie drei Beispiele. (Lösung: siehe Power-Point-Präsentation: Struktur von Proteinen) 5. Sie lösen Ammoniumnitrat in Wasser. Der Lösungsvorgang ist endotherm, deshalb wird die Lösung kalt. a) Enthalten die ionischen Bindungen im Kristallgitter oder die Bindungen der Ionen-WasserKomplexe mehr Energie? b) Wieso läuft dieser Prozess trotzdem freiwillig ab? a) Die ionischen Bindungen im Kristallgitter sind hier energetisch sehr günstig (energiearm; niedrige Enthalpie). Um die Bindungen zu lösen, muss viel Energie aufgebracht werden und zwar mehr als bei der Koordination von Wassermolekülen an die Ionen im Lösungsprozess wieder frei wird. Die IonenWasser-Komplexe enthalten somit mehr Energie (höhere Enthalpie) als das Kristallgitter. Die benötigte Energie wird dem Lösungsmittel Wasser in Form von Wärme entzogen. Es wird kalt. b) Ob ein Prozess freiwillig abläuft hängt von der Änderung der freien Enthalpie ΔG ab. Ein Prozess läuft freiwillig ab, wenn ΔG negativ ist (exergoner Prozess). Die freie Enthalpie setzt sich aus Enthalpie und Entropie zusammen. Wenn die Änderung der Enthalpie ΔH wie im oben beschriebenen Fall positiv ist, dann muss die Änderung der Entropie ebenfalls positiv sein, so dass die freie Enthalpie negativ wird. Positives ΔS = Zunahme der Entropie = Zunahme der Unordnung. Dies ist beim Auflösen eines hochgeordneten Kristallgitters der Fall. ΔG = ΔH – T · ΔS Zusammengefasst: Endotherme Prozesse können dann freiwillig ablaufen, wenn sie durch eine stark zunehmende Entropie überkompensiert werden. 6. Sie geben 5 mL Cyclohexan (Dichte = 0.65 g/cm3) und 75 mL Wasser (Dichte = 1 g/cm3) in einen 100 mL Scheidetrichter. Sie schütteln kräftig und lassen den Trichter dann für 1 Minute stehen. a) Was passiert? Es findet Entmischung statt, da Cyclohexan sehr unpolar ist, während Wasser stark polar ist. Die schmale obere Phase besteht aus Cyclohexan, da Cyclohexan Cyclohexan die geringere Dichte aufweist. b) Sie geben 100 mgg des intensiv roten Provitamins (und auch Lebensmittelfarbstoffs) β-Carotin hinzu. Sie schütteln wieder kräftig und lassen für eine Minute stehen. Beschreiben Sie was sie sehen. Betakarotin: Antw.: Das β-Carotin-Molekül Molekül enthält keinerlei Heteroatome, die aufgrund von Elektronegativitätsdifferenzen Dipolmomente aufbauen könnten. Es ist sehr unpolar. Deshalb löst es sich ausschließlich in der ebenfalls unpolaren Cyclohexan-Phase Cyclohexan Phase (Prinzip: Gleiches löst lö sich in Gleichem). Im Scheidetrichter erscheint die obere Cyclohexanphase stark rot. Das Wasser bleibt farblos. c) Sie geben 100 mg der folgenden Verbindung hinzu: Br N Sie schütteln erneut. Was beobachten Sie? Antw.: Das gezeigte Molekül ist ein Tensid. Es enthält einen stark polaren ionischen Teil und eine lange unpolare Alkylkette. Es ist deshalb amphiphil, d.h. sowohl hydrophil als auch liphophil. In Wasser kann es Mizellen bilden. Die polare Kopfgruppe zeigt zum Wasser Wasser und die unpolaren Alkylketten lagern sich im Inneren der Mizelle zusammen. Im unpolaren Zentrum der Mizellen können andere unpolare Stoffe wie zum Beispiel Cyclohexan oder β-Carotin Carotin eingeschlossen werden. Nach dem Schütteln des Scheidetrichters findet keine Entmischung der Phasen mehr statt. Sie erhalten eine einzige schwach rote (rosa) Phase. Schematische Darstellung einer Mizelle aus Tensidmolekülen in Wasser, welche im Kern eine unpolare Substanz einschließt. 7. Sie betrachten die chemische Reaktion folgender Esterbildung: a) Diese Reaktion ist reversibel. Wovon hängt ab, wie schnell die Hin- bzw. die Rückreaktion abläuft? Nennen Sie fünf Parameter. b) Wann liegt ein chemisches Gleichgewicht vor? c) Nehmen wir an bei den gewählten Reaktionsbedingungen sei die Gleichgewichtskonstante 4 und sie haben Essigsäure und Ethanol in gleichen Mengen zugegeben. Wie viel Prozent Essigsäure können bei dieser Reaktion maximal zu Essigsäureethylester umgesetzt werden? Hilfe: Verwenden Sie das Massenwirkungsgesetz. Überlegen Sie welche Konzentrationen Sie (ä) gleichsetzen können. = 100 ∙ (ä)!(ä) Massenwirkungsgesetz für diese Reaktion: #($%äℎ'() ∙ #()*) "= #($%ä) ∙ #($ℎ*() Essigsäure und Ethanol werden in gleichen Mengen eingesetzt #($%ä) = #($ℎ*() Aufgrund der Stöchiometrie der Reaktionsgleichung folgt außerdem, dass #($%äℎ'() = #()*) Somit vereinfacht sich das Massenwirkungsgesetz. Wird noch K = 4 eingesetzt erhält man: 4= #($%äℎ'(), #($%ä), #($%äℎ'(), = 4 ∙ #($%ä), |√ #($%äℎ'() = 2 ∙ #($%ä) (ä) = 100 ∙ (ä)!(ä) = 2 ∙ #($%ä) 2 = 100 ∙ = 66.7% 2 ∙ #($%ä) + #($%ä) 3 d) Sie entfernen während der Reaktion das entstehende Wasser durch einen Wasserabscheider aus dem chemischen Gleichgewicht, so dass Sie die Wasserkonzentration auf einem 100stel der Essigsäureethylesterkonzentration halten können. Welche Ausbeute können Sie jetzt erreichen? Im Massenwirkungsgesetz können c(Essigsäureethylester) und c(Wasser) nicht mehr gleichgesetzt werden. #($%äℎ'() ∙ #()*) = 4 ∙ #($%ä), 4 Es gilt statt dessen #()*) = 455 ∙ #($%äℎ'() Wird dieser Beziehung in obige Formel eingesetzt erhält man #($%äℎ'(), ∙ 1 = 4 ∙ #($ä), 100 #($%äℎ'(), = 400 ∙ #($ä), #($%äℎ'() = 20 ∙ #($%ä) Ausbeute = 95% |√ 8. Die Enthalpie- und Entropieänderung während einer Reaktion bestimmt die Änderung der freien Energie (∆7 = ∆8 − : ∙ ∆;). Die Lage des Gleichgewichts hängt unmittelbar mit der Änderung der ?∆@ freien Energie zusammen über ∆7 = −< ∙ : ∙ ln(") bzw. " = AB . Es liegt eine Reaktion vor mit ΔH = - 3000 J/mol und ΔS = - 10 J/(mol·K). Die Temperatur beträgt 240 K (-33 °C). Die allgemeine Gaskonstante beträgt R = 8,3145 J/(mol·K). a) Wie hoch ist die Gleichgewichtskonstante? Liegt das Gleichgewicht auf Seite der Edukte oder Produkte? ∆7 = ∆8 − : ∙ ∆; = −3000 "= G E(EF55 ) HI G J,L4MN ∙,M5O HI∙O C C C − 240" ∙ −10 = −600 D( D( ∙ " D( = 1,35 Antw.: Die Gleichgewichtskonstante ist größer als 1. Daher liegt das Gleichgewicht auf der Seite der Produkte. b) Sie erhöhen die Temperatur auf 350 K (77 °C). Wie ändert sich die Gleichgewichtskonstante? Liegt das Gleichgewicht auf Seite der Edukte oder Produkte? ∆7 = ∆8 − : ∙ ∆; = −3000 "= G E(N55 ) HI G J,L4MNHI∙O∙LN5O C C C − 350" ∙ −10 = +500 D( D( D( = 0,84 Antw.: Die Gleichgewichtskonstante ist kleiner als 1. Daher liegt das Gleichgewicht auf der Seite der Edukte. 9. Hängt es von der Enthalpieänderung, Entropieänderung oder beiden ab, in welche Richtung sich das chemische Gleichgewicht bei Temperaturveränderungen verschiebt? Begründen Sie anhand der ?∆@ Formeln ∆7 = ∆8 − : ∙ ∆; und " = AB . Setzt Formel für die freie Enthalpie in die Formel für die Gleichgewichtskonstante ein, so ist zu erkennen, dass nur die Enthalpieänderung entscheidend ist für die Temperaturabhängigkeit der Gleichgewichtskonstante. "= E∆R!S∙∆T US = E∆R ∆T ! US U ΔH < 0; exotherme Reaktion Quotient E∆R US ist positiv ?∆V ∆W Temperaturerhöhung Quotient wird weniger positiv Exponent in Formel AB ! A wird kleiner Gleichgewichtskonstante K wird kleiner Verschiebung des Gleichgewichts Richtung Edukte ΔH > 0; endotherme Reaktion Quotient E∆R US ist negativ ?∆V ∆W Temperaturerhöhung Quotient wird weniger negativ Exponent in Formel AB ! A wird größer Gleichgewichtskonstante K wird größer Verschiebung des Gleichgewichts Richtung Produkte 10. Wann und wieso sind manche chemische Reaktionen nicht reversibel? Erklären Sie anhand eines Energiediagrammes mit Aktivierungsenergien. (Erklärung aus technischen Gründen ohne Diagramm.) Hier gibt es zwei Erklärungsansätze: 1) Die freie Enthalpie der Produkte ist sehr viel kleiner als die freie Enthalpie der Edukte. Die Änderung der freien Enthalpie ist somit stark negativ (ΔG << 0). Daraus folgt für die Gleichgewichtskonstante K, dass sie extrem groß ist (K >> 1). Praktisch bedeutet das, dass das Gleichgewicht fast vollständig auf der Seite der Produkte liegt. 2) Die Rückreaktion kann nicht nach dem gleichen Mechanismus ablaufen wie die Hinreaktion (die Gründe können vielfältig sein und sollte an dieser Stelle nicht diskutiert werden). Der Mechanismus der Rückreaktion enthält einen Reaktionschritt mit einer extrem hohen Aktivierungsenergie, welche unter den gegebenen Bedingungen nicht überwunden werden kann. Es findet ausschließlich die Hinreaktion statt.