37 - Medi
Werbung

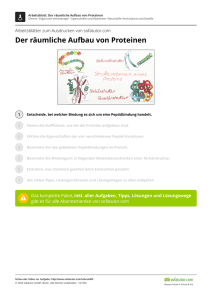
2.1 Peptidbindung 2 Peptide Fragen in den letzten 10 Examen: 8 Peptide entstehen durch Knüpfung von Peptidbindungen zwischen Aminosäuren. Sind auf diese Weise bis zu zehn Aminosäuren miteinander verbunden, spricht man von Oligopeptiden, zwischen zehn und 100 Aminosäuren von Polypeptiden und ab 100 Aminosäuren von Proteinen. Während die Proteine und Enzyme in den Kapiteln 3 und 4 besprochen werden, befasst sich dieser Abschnitt also mit der Struktur und Funktion der prüfungsrelevanten kleineren Peptide. Die durch Peptidbindungen miteinander verknüpften α-C-Atome bilden das Rückgrat des Proteins, aus dem die Seitenketten wie kleine Ästchen hervorstehen und dem Protein seine charakteristischen Eigenschaften verleihen. 2.1 Peptidbindung Reagieren die Aminogruppe einer Aminosäure und die Carboxylgruppe einer anderen Aminosäure unter Abspaltung von Wasser miteinander, entsteht eine Peptidbindung. Das Reaktionsgleichgewicht liegt dabei auf der linken Seite (Seite der Edukte), sodass der Aufbau der Peptidbindung – z. B. in der Translation – nur unter Energieaufwand möglich ist. Die hydrolytische Spaltung der Peptidbindung läuft dagegen freiwillig ab (enzymkatalysiert). Die Verknüpfung der Peptidbindung erfolgt am Ribosom durch Verbindung der freien NH2 Gruppe von Aminosäure 2 mit der veresterten Carboxylgruppe von Aminosäure 1. In dieser Abfolge von Aminosäuren (Sequenz = Primärstruktur, s. a. 3.2.1, S. 45), die durch Peptidbindungen miteinander verknüpft sind, verfügt die erste Aminosäure der Polypeptidkette noch über ihre vollständige Aminogruppe (NH2), da diese nicht an einer Peptidbindung beteiligt ist. Man bezeichnet dieses Ende der Kette als das N-terminale Ende. Analog dazu besitzt die letzte Aminosäure noch die vollständige Carboxylgruppe (COOH). Dieses Ende heißt deshalb C-terminales Ende. Durch Spaltung unter Wasseraufnahme (Hy­ drolyse) lässt sich die Peptidbindung zwischen den Aminosäuren (durch Peptidasen) wieder spalten. Ein Beispiel hierfür sind Serinproteasen, die mit ihrer OH-Gruppe das C-Atom der zu spaltenden Peptidbindung angreift (nukleophil). Da die Atome, die an der Peptidbindung beteiligt sind, in einer Ebene liegen, ist die Peptidbindung NICHT frei drehbar. Ursache hierfür ist eine Elektronenverschiebung: Die Elektronen wandern vom Stickstoff weg und zur C-NBindung hin, wodurch die Peptidbindung den Charakter einer partiellen Doppelbindung er- 2 C-terminales Ende O C H 3N + C H O– H H + N H COO– C R2 R1 H2O H H 2O H 3N + O H COO– C N C C H H R2 R1 N-terminales Ende AS 1 Abb. 50: Peptidbindung www.medi-learn.de AS 2 Peptid medi-learn.de/6-bc2-50­ 37