Multiple-choice Test (Uni
Werbung

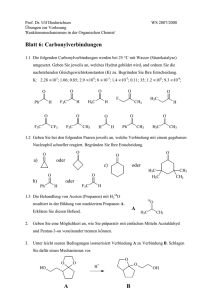
Abschluss-Klausur des Praktikums Arzneistoffsynthese 3. Semester (22. Feb. ’02, WiSe01/02) Name: ............................................................... Matrikelnr.: .................................... (Bekanntgabe der Ergebnisse erfolgt ausschließlich über die Matrikelnummer) Erreichte Punktzahl: ........... Unterschrift: .................................................... bestanden Maximal erreichbare Punktzahl: 50 nicht bestanden (50% sind zum Bestehen erforderlich) Mit Bleistift oder roter Tinte geschriebene Antworten werden in der Regel nicht gewertet! Im Falle eines Täuschungsversuchs gilt die Klausur als nicht bestanden! 1. Welche Substanz wird aus folgender Verbindung durch Erwärmen in verdünnter Natronlauge erhalten? (2 P.) O O O (A) 4-Phenyl-2-butanon (B) Methylbenzylketon (C) Propiophenon (D) 3-Phenyl-2-butanon (E) 1-Phenyl-3-pentanon 2. Welche Aussage über sekundäre Alkohole trifft zu? (2 P.) (A) Sekundäre Alkohole lassen sich zu Aldehyden oxidieren. (B) Sekundäre Alkohole entstehen bei der Umsetzung von aromatischen Aldehyden mit Grignard-Reagenzien. (C) Aus sekundären Alkoholen entstehen bei Eliminierungsreaktionen stabilere Carbeniumionen als aus tertiären Alkoholen. (D) Ester sekundärer Alkohole lassen sich nicht durch Säuren hydrolysieren. (E) Die Etherbildung nach Williamson erfolgt bei sekundären Alkoholen leichter als bei tertiären. 3. Bei welcher dieser Verbindungen ist die Enolisierungstendenz am deutlichsten ausgesprägt? (2 P.) O O H3C O H3C O O (D) 4. R O O O O (C) (B) (A) O O CH3 CH3 H3C (E) Welche Aussage trifft nicht zu? – Folgende Moleküle bzw. Ionen besitzen aromatischen Charakter: (2 P.) (A) Cyclopropenyl-Kation (B) Cyclobutadien (C) Cyclopentadienyl-Anion (D) Cycloheptatrienyl-Kation (E) Thiophen 5. Welche Aussage über Acetessigsäureethylester trifft nicht zu? (2 P.) (A) Seine Darstellung erfolgt über eine Claisen-Reaktion. (B) Die Enol-Form ist das ausschließlich vorliegende Tautomere. (C) Zwischen enolischem Hydroxyl und Estercarbonylgruppe bildet sich eine Wasserstoff-Brücke. (D) Mit Phenylhydrazin erfolgt Ringschluss zu einem Pyrazolinon. (E) Mit Na-ethylat entsteht ein resonanzstabilisiertes Anion. 6. Ordnen Sie die folgenden Alkohole nach zunehmender OH-Acidität. Geben Sie stichwortartig eine Begründung für Ihre Wahl. (3 P.) OH OH OH Cl Cl Cl OH OH Cl Cl Cl A B C D E 7. Ordnen Sie die folgenden Verbindungen nach steigender Reaktivität in einer elektrophilen aromatischen Substitution und markieren Sie je eine bevorzugte Substitutionsposition. Begründen Sie Ihre Wahl der Reaktivitätenreihenfolge in Stichpunkten. (3 P.) OH O Cl O CH3 O ONa OCH3 O A B C D E 8. Welches der angegebenen Produkte in den folgenden Reaktionen stellt jeweils das Hauptprodukt dar? Begründen Sie Ihre Wahl in Stichworten. (5 P.) a) O O H N N H 1 + 1 Cl 1 Äq. HCl N N H H N N O b) R H3C N R N + N R CH3 N CH3 N N c) O O MgCl + d) HO O O OH LiAlH4 e) OH OH S O OH SO2 O Cl -200C O SO2 OH 9. Die Wittig-Reaktion ist eine wichtige Methode zur Einführung exocyclischer Doppelbindungen. (4 P.) a) Skizzieren Sie den Mechanismus der Ylid-Bildung von Propylchlorid mit Triphenylphosphan. b) Skizzieren Sie den Reaktionsmechanismus der Wittig-Reaktion mit dem Ylid aus a) und Cyclohexanon. Benennen Sie die wichtigsten Zwischenstufen. c) Nennen Sie zwei weitere Verbindungen, die Kohlenstoff als nukleophiles Zentrum enthalten. 10. Eine Verbindung mit der Summenformel C5H6S zeigt im 1H-NMR folgende Signale: (5 P.) Chemische Verschiebung Multiplizität 7.03 Duplett 6.87 Duplett vom Duplett 6.72 Duplett 2.48 Singulett a) Um welche Substanz handelt es sich? b) Ordnen Sie die Signale grob den jeweiligen Protonen der Verbindung zu. Berücksichtigen Sie dabei das Aufspaltungsmuster der Signale. c) In welchem Intensitätenverhältnis stehen die Signale zueinander? 11. Die leicht zugängliche Verbindung 1 soll in einer dreistufigen Reaktionsfolge in Molekül 2 umgewandelt werden. Formulieren Sie den Syntheseweg (ohne Mechanismen). (3 P.) N O2N N HO 1 2 12. Acetaldehyd reagiert mit Propionaldehyd unter Basenkatalyse in einer Aldoladdition. (5 P.) a) Geben Sie die Strukturformeln aller entstehenden Aldole an. b) Skizzieren Sie den Reaktionsmechanismus für eins dieser Produkte. c) Nach welchem Mechanismus verläuft die sich meist einer Aldoladdition anschließende Wasserabspaltung? d) Zeichnen Sie zwei weitere Verbindungen, die CH-Acidität, aber keine Carbonylgruppe aufweisen. 13. Geben Sie für folgende Reaktionen die anderen Reaktionsteilnehmer, -bedingungen und, wenn möglich, den Namen der jeweiligen Reaktion an. (6 P.) a) N N O H b) O NH2 NH2 c) O d) 1. O OH e) O O 2. N H O N(CH3)2 14. Die retrosynthetische Analyse des Diuretikums Cyclothiazid 1 zeigt, dass dieses in eine Verbindung 2 und den Aldehyd 3 zerlegt werden kann. Der Aldehyd 3 kann wiederum auf eine Verbindung 4 und einen weiteren Aldehyd 5 zurückgeführt werden. (4 P.) Cl H N NH2SO2 S O 2 NH O + 1 H O 4 3 + H O 5 a) Geben Sie die Strukturen der Verbindungen 2 und 4 an. b) Zeichnen und beschreiben Sie in wenigen Worten den Mechanismus, der während der Synthese des Aldehyds 3 aus Verbindung 4 und dem Aldehyd 5 unter Erwärmung stattfindet. Lassen Sie dabei die mögliche Entstehung von Enantiound Diastereomeren außer acht. 15. Das nachfolgende Formelschema zeigt Ihnen den letzten Schritt der Synthese des AT1-Rezeptorantagonisten Losartan. (2 P.) Cl Cl N HO N HO N N N N N N NH a) Welches Reagens wird zum Aufbau des Tetrazolringes benötigt? b) Welchem Reaktionstypus ist der Mechanismus des Ringschlusses zuzuordnen?
![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)