Organische Chemie
Werbung

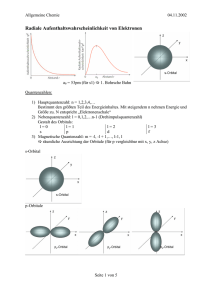
OCI_folie1 Proteine DNA, RNA Enzyme Makromoleküle Peptide Nucleotide niedermolekulare Kohlenhydrate Fette Systeme polymere Werkstoffe und Materialien Supramolekulare Chemie: zwischenmolekulare Wechselwirkungen molekulare Erkennung Arzneimittel Pflanzenschutz Synthetische Oligo- und Polymere Waschmittel Hygiene Organische Synthese Medizin Bio-Wissenschaften Strukturchemie Physik Reaktionsaufklärung Katalyse Organische Chemie Energie Farbstoffe Chemie der Kohlenstoffverbindungen Rohstoffe: Rohstoffe: Erdöl,Erdgas, Erdgas,Kohle Kohle Erdöl, nachwachsendeRohstoffe Rohstoffe nachwachsende OCI_folie2 Bohrsche Atommodel (Edelgaskonformation) 1. Schale: max. 2 Elektronen 2He 2. Schale: max. 8 Elektronen 10Ne 3. Schale: max. 8 (bzw. 18) Elektronen 18Ar u.s.w. Die Elektronen auf der äußeren, nicht abgeschlossenen Schale sind Valenzelektronen. 1. Ionenpaar-Bindung Li F - 1e+ 1e- Li+ F (-) (He) Elektrostatische Anziehung (Ne) OCI_folie3 Ionenpaar-Bindung: nur zwischen Elementen (oder Elementgruppen) mit relativ niedriger Ionisierungsenergie (IP) und relativ großer Elektronenaffinität (EA) IP - erforderliche Energie zur Abspaltung eines Elektrons (Vorzeichen (+) in [kcal/mol]) EA - bei der Aufnahme eines Elektrons frei werdende Energie (Vorzeichen (-) in [kcal/mol]) Li Li+ + e(-) : IP = +124; F + e(-) F (-) Na+ + e(-) : IP = +119 Na : EA = -80; Cl + e(-) Cl (-) : EA = -83 jedoch: B B3+ + 3 e(-) : IP = +870; C B und C C4+ + 4 e(-) : IP = +1480 kleine Elektronenaffinität Kovalente Bindung (Elektronenpaar-Bindung H + H H H; H F ≡ H F ; N F F F + F N ≡ N N ; 6 Valenzelektronen hoch reaktiv H C ≡ CH2 H Methylen 1 cal = 4.187 J OCI_folie4 Offene Fragen, die mit der einfachen Valenztheorie nicht zu beantworten sind: a. Bindungswinkel: H H O H H S O H O C H N H H O S H H H O O C H H 90° 104° 180° b. N H H H 107° C H 109° Reaktivität: H H H C C H≡ H H H H H C 109° H H C ; H Ethan: wenig reaktiv c. H H C H H H H H C H H C H≡ H H C C 121° Ethen: C C-Doppelbindung reaktiv magnetische Eigenschaften von molekularem Sauerstoff: O2 O + O O O ≡ O O erwartet wird O=O-Doppelbindung mit abgeschlossenen Valenzschalen (alle Elektronen sind gepaart) ⇒ diamagnetisch. Experimentell finded man jedoch: Paramagnetismus: Es gibt ungepaarte Elektronen O O (Diradikal-Struktur) H OCI_folie5 Atomorbitale werden charakterisiert durch: Hauptquantenzahl n bestimmt die Lage der Hauptenergieniveaus; die Gesamtzahl der Knotenebenen beträgt: n-1 Neben- oder Orbitalquantenzahl l bestimmt die Lage der Unterenergieniveaus; die Zahl der nichtsphärischen Knotenebenen beträgt: l = 0, 1,...., n-1 l = 0 ⇒ s-Orbital l = 1 ⇒ p-Orbital l = 2 ⇒ d-Orbital Magnetische Quantenzahl m Aufspaltung der p- und d-Orbitale im Magnetfeld: m = +l,....,0, ...., -l p-Orbitale m = +1, 0, -1 d-Orbitale m = +2, +1, 0, -1, -2 Spinquantenzahl s = +½, -½ Aufspaltung der Energieneveaus durch den Eigendrehimpuls des Elektrons im Magnetfeld (Goudsmit und Uhlenbeck) OCI_folie6 OCI_folie7 Orbital-Energieschema (Aufbauprinzip) E 4p 3d 4s 3p 3s 2p 2s 1s OCI_folie8 Pauli- Prinzip (Pauli-Verbot) In einem Orbital, das durch die Quantenzahlen n, l, m charakterisiert ist, kann man nur zwei Elektronen mit den Spinquantenzahlen s = +½ und s = -½ unterbringen. Beispiel: Elektronenkonfiguration von Helium He [1s2] 1s n l m s 1. Elektron 1 0 0 +½ 2. Elektron 1 0 0 -½ Hund´sche Regel Energiegleiche Orbitale werden zunächst jeweils mit einem Elektron besetzt ehe eine Doppelbesetzung eines Orbitals erfolgt. Dabei haben die einsamen Elektronen in verschiedenen Orbitalen parallelen Spin. OCI_folie9 Elektronenkonfigurationen 1s H [1s] He [1s2] Li [1s2, 2s] Be [1s2, 2s2] B [1s2, 2s2, 2p] C [1s2, 2s2, 2p2] N [1s2, 2s2, 2p3] O [1s2, 2s2, 2p4] F [1s2, 2s2, 2p5] Ne [1s2, 2s2, 2p6] 2s 2px 2py 2pz OCI_folie10 Orbitaldiagramm von H2 Orbitaldiagramm von He2 OCI_folie11 OCI_folie12 Energieschema für den Kohlenstoff 2p 2s 1s C [1s2, 2s, 2p3] Promotions- 100 kcal/mol energie = 419 KJ/mol angeregter Zustand C [1s2, 2s2, 2p2] 2p 2s 2 ∗ EC-H 4 ∗ EC-H 1s Grundzustand CH2 EC-H = 99 kcal/mol = 415 KJ/mol ∆E ∆E = 98 kcal/mol = 410 KJ/mol 1 cal = 4.187 Joule CH4 OCI_folie13 Grundzustand angeregter Zustand Be [1s2, 2s2] Be [1s2, 2s 2p] 0 - bindig 2 – bindig B [1s2, 2s2 2p] B [1s2, 2s 2p2] 1 - bindig 3 – bindig C [1s2, 2s2 2p2] C [1s2, 2s 2p3] 2 - bindig 4 – bindig N [1s2, 2s2 2p3] N [1s2, 2s 2p3, 3s] 3 - bindig 5 – bindig OCI_folie14 sp3- Hybrid – Orbitale: Jedes Mischorbital besteht aus ¼ s- und ¾ p-Orbital Tetraeder-Geometrie ideale Tetraeder-Geometrie ⇒ CH4, CF4, CCl4 Kleine Abweichungen findet man bei nicht symmetrisch substituierten Verbindungen. Beispiele: HCCl3 H3C-OH H2CCl2 Chloroform Methanol Dichlormethan (Trichlormethan) OCI_folie15 Freie Drehbarkeit um die C-C-Bindung sp3 sp3 H H H C C H H Η Η ≡ Η H Ethan: Η Η Η ≡ Η Η Η Η Η ΗΗ Η Η Η NewmanProjektion SägebockProjektion Η Η ekliptische bzw. verdeckte Konformation (nicht stabil) Gestraffte Konformation Η ΗΗ ΗΗ Η Η 12 34 56 Η Η ΗΗ Η Η Η ≡ 3 1 2 5 4 6 n-Hexan Zick-Zack-Kette: stabilste Konformation jedoch: H 90° H 90° S H P H H nicht hybridisiert OCI_folie16 sp2- Hybrid – Orbitale: Jedes Mischorbital besteht aus 1 /3 s- und 2/3 p-Orbital trigonal planare Struktur H H C Ethen: C H H nicht hybridisierte py-Orbitale jeweils ^ = mit einem Elektron besetzt σ-Bindungsgerüst 1 σ (C-C) (energetisch günstigstes MO) 1 π (C-C) 4 σ (C-H) OCI_folie17 sp- Hybrid – Orbitale: Jedes Mischorbital besteht aus ½ s- und ½ p-Orbital Berylliumchlorid im Kristall kovalent gebunden (sp-hybridisiert) Cl Be Cl lineare Struktur 180° py- und px-Orbitale sind nicht hybridisiert 180° Ethin: (Acetylen) C H C H 1 σ (C-C) ^ = σ- Bindungsgerüst 2 π (C-C) 2 σ (C-H) OCI_folie18 MO-Diagramm der π-Bindung OCI_folie19 Bindende Molekül-Orbitale von H2C=CH2 (jeweils mit 2 Elektronen besetzt) Highest Occupied MO E HOMO OCI_folie20 Virtuelle, antibindende Molekül-Orbitale von H2C=CH2 (unbesetzt) LUMO Lowest Unoccupied MO OCI_folie21 Molekülorbitale von Ethen LUMO HOMO OCI_folie22 Zusammenfassung σ-Bindungen ⇒ durch Überlappung von Orbitalen in der Bindungsrichtung: s, pz, sp, sp2, sp3 y x z π-Bindungen ⇒ durch Überlappung von Orbitalen senkrecht zur Bindungsrichtung: px, py (Bindungsrichtung: z) Beispiele: Ethin (Acetylen) Ethen (Ethylen) H H 2 sp2 sp H C C H H 1 C-C-σ-Bindung (sp2-sp2) 4 C-H-σ-Bindung (sp2-s) 1 C-C-π-Bindung (py-py) sp C sp C H 1 C-C-σ-Bindung (sp-sp) 2 C-H-σ-Bindung (sp-s) 1 C-C-π-Bindung (py-py) 1 C-C-π-Bindung (px-px) Allen (1,2-Propadien) H H sp2 sp C C H sp2 C H H H H H 2 2 C-C-σ-Bindung (sp -sp) 4 C-H-σ-Bindung (sp2-s) 1 C-C-π-Bindung (px-px) 1 C-C-π-Bindung (py-py) Newman-Projektion OCI_folie23 MO-Schema von Sauerstoff O2 OCI_folie24 Donator-Akzeptor-Bindung (Koordinative oder semipolare Bindung) MO-Diagramm OCI_folie25 Beispiele von Anionen oder Molekülen, die Liganden in Metallkomplexen sein können. Anionen F (Fluorid), Cl CN (Cyanid), SCN OH (Hydroxid), RS (Chlorid) I (Iodid) (Rhodanid), (Thiolat), R C O O (Carboxylat) Moleküle NH3 (Ammoniak), H2O R R NH2 (Amine) OH (Alkohole) O R C PR3 (Phosphan) O (Kohlenmonoxid) Chelatkomplexe K[Fe2+(Fe3+(CN)6)] Berliner-Blau R (Ether) OCI_folie26 Weitere lebenswichtige Tetrapyrrolsysteme: Chlorophyll (Zentralion: Mg2+): Farbstoff der grünen Pflanze wichtig bei der Photosynthese: Licht C (H O) + 6 O2 Kat. 6 2 6 6 CO2 + 6 H2O Glucose 3+ Vitamin B12 (Zentralatom: Co ) gegen perniziöse Anämie NH Pyrrol Struktur des Häms mit den zusätzlichen Liganden im Hämoglobin (Histidin der Proteinkette und Sauerstoff). Elektronenkonfiguration des zentralen Eisen (II)-Kations: N 6 Fe [Ar] 3d 4s 2 2 Fe N 6 [Ar] 3d Fe Histidin N 3+ N [Ar] 3d104s24p6 ^= [Kr] N O2 C O C N C O starkes Atemgift, weil CO stärker als O2 an das Fe2+-Ion des Häms bindet ⇒ Störung des O2-Transportes. 4- ^ [Kr] Beispiel: [Fe(CN)6] = ^ [Ar] 3d104s24p5 [Fe(CN)6]3- = OCI_folie27 ETDA – Ethylendiamintetraessigsäure Verwendung von künstlichen Chelatoren: 1) Entgiftung 2) Hemmung der Blutgerinnung Für die Blutgerinnung ist freies Ca2+ erforderlich. Bei Komplexierung von Ca2+ mit EDTA oder Citrat ⇒ Hemmung der Blutgerinnung. Ca2+-haltige Nierensteine lassen sich z.B. durch Verabreichung von EDTA auflösen. Chelatkomplex von [18] Krone-6 mit K⊕. Salz: K+Cl- unlöslich in organischem Lösungsmittel, dagegen Komplex von K+Clund [18] Krone-6 löslich in Chloroform oder Benzol. OCI_folie28 Dreizentren-Bindung z.B. (BH3)2 angenommene Struktur: H H H B B H H Zahl der Valenzelektronen 6 H-B-Bindung 12 Elektronen H 1 B-B-Bindung 2 Elektronen 14 Elektronen Zahl der Valenzelektronen, die zur Verfügung stehen: 2 B 2 * 3 = 6 Elektronen 6 H 6 * 1 = 6 Elektronen 12 Elektronen sp3 sp3 H H H H H H H Longuett-Higgins H B B B B H H H H