- Unterricht von und mit Frau Sanders-Seidler
Werbung

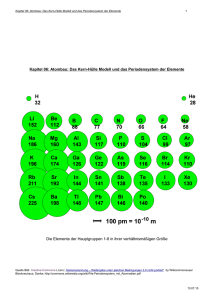
http://sanders-seidler.jimdo.com ELEMENTE LASSEN SICH ORDNEN Chemie Imke Sanders-Seidler Klassenstufe 9 Gliederung Basics Sicherheitshinweise und Gefahrensymbole im Chemieunterricht Atome Atommodelle Aufbau der Atome Rutherford Teilchen und deren Ladung Periodensystem der Elemente (PSE) Aufbau des Periodensystems Elemente http://sanders-seidler.jimdo.com Basics Sicherheit im Unterrichtsraum In jedem naturwissenschaftlichen Unterrichtsraum gibt es allgemeine Sicherheitseinrichtungen, die Du kennen musst: Not-Aus-Schalter für Elektrizität (und teils Gas) Feuerlöscher Löschdecke Erste-Hilfe-Kasten Teilweise eine Augendusche Fluchtwegeplan http://sanders-seidler.jimdo.com Basics Sicherheitshinweise Im Unterricht hast Du gelernt, was Du zum sicheren Experimentieren beitragen kannst. Hier ein paar Beispiele: Weder essen noch trinken im Fachraum Anlagen für Gas, Elektrizität und Wasser werden nur nach Aufforderung angeschaltet. Versuchsvorschriften und Hinweise müssen befolgt werden. Geschmacks- und Geruchsproben werden nur in besprochenen Ausnahmen durchgeführt. Chemikalienreste werden vorschriftsmäßig entsorgt. Persönlichen Schutz beachten: Haare, Schutzbrille, Schutzhandschuhe. Chemikalien sollen nicht mit der Haut in Berührung kommen. Die Arbeitsplätze werden sauber und ordentlich gehalten. http://sanders-seidler.jimdo.com Basics Gefahrensymbole Chemikalien werden mit Gefahrensymbolen kenntlich gemacht: http://sanders-seidler.jimdo.com Atome Atome sind kleinste Bausteine, aus denen sich alle Materie zusammensetzt. Zur Zeit können wir noch keine kleineren Strukturen sehen. Schon Demokrit, ein gelehrter Grieche, machte sich über die kleinsten Bausteine Gedanken. Der Name Atom (gr. atomos) bedeutet das Unzerschneidbare und wurde von ihm ca. 450 vor Christus geprägt. http://sanders-seidler.jimdo.com Atome Atommodelle Im Laufe der Zeit veränderten sich die Vorstellungen von Atomen. Insbesondere ab 1800 konnte die Physik neue Hypothesen entwickeln. Thomsons Atommodell wird auch Rosinenkuchenmodell genannt. Das Rutherfordmodell zeigt einen sehr kleinen Kern und weit verstreut darum noch kleinere Elektronen. Der Däne Nils Bohr entwickelte ein Modell, das an Planetenbahnen erinnert. http://sanders-seidler.jimdo.com Atome Atome bestehen aus Neutronen und positiv geladenen Protonen im Kern und negativ geladenen Elektronen in der Atomhülle. Zwei Neutronen und zwei Protonen im Kern Elektronen umkreisen den Kern - + + Das Modell eines Heliumatoms http://sanders-seidler.jimdo.com Atome Nur das Wasserstoffatom hat einzig ein Proton im Kern. Die Anzahl der Protonen bestimmt, um welches Element es sich handelt. Elemente die gleich viele Protonen, aber unterschiedlich viele Neutronen aufweisen, nennt man Isotope. http://sanders-seidler.jimdo.com Atome Die Atome haben unvorstellbar kleine Massen. Die geringste Masse hat das Wasserstoffatom mit 0,000 000 000 000 000 000 000 0017g. Um sich diese Zahlen zu ersparen, hat man die atomare Masseneinheit u eingeführt. Ein Wasserstoffatom ist daher die kleinste Einheit = 1u. Die übrigen Elemente sind jeweils ein Vielfaches von u. Blei ist beispielweise 207 mal schwerer al Wasserstoff. Ein Bleiatom wiegt demnach 207u. Welche Masse hat ein Schwefelatom? – 32 u! Welche Masse hat ein H2O Molekül? – 18u! (2x1u (für das Wasserstoffatom) + 1x16 (für das Sauerstoffatom) = 18u) http://sanders-seidler.jimdo.com Atome In einem Mol werden immer genau 𝟔 ∙ 𝟏𝟎𝟐𝟑 Teilchen zusammengefasst. Egal welches Element. 1 Mol sind immer so viele Teilchen! Dabei kann Dichte oder Volumen sich natürlich unterscheiden. Die Zahl 𝟔 ∙ 𝟏𝟎𝟐𝟑 nennt man Avogadro-Konstante. http://sanders-seidler.jimdo.com Periodensystem der Elemente Mendelejew entwickelte den ersten Entwurf zur Ordnung der bekannten Elemente. So präsentierte er das erste Periodensystem der Elemente. Beim Kartenspielen hatte er die Idee dazu entwickelt. http://sanders-seidler.jimdo.com Periodensystem der Elemente Massezahl in u = Zahl der Protonen + Zahl der Neutronen 26.98 Al Ordnungszahl = Zahl der Protonen (Kernladungszahl) = Zahl der Elektronen 13 Aluminium http://sanders-seidler.jimdo.com Farbgebung informiert zur Zugehörigkeit. Hier Metalle Elementsymbol Elementname Periodensystem der Elemente Mit dem Schalenmodell lässt sich in der Chemie gut arbeiten. Das Schalenmodell hilft, sich die Zusammensetzung im Atom besser vorstellen zu können. Aber das Schalenmodell ist eben nur ein Modell und unterscheidet sich von der Wirklichkeit, die es vereinfacht darstellt! http://sanders-seidler.jimdo.com Periodensystem der Elemente Die Elektronen bewegen sich in bestimmten Schalen um den Atomkern. Die Elektronen der Außenschale bestimmen das Verhalten der Elemente. K L Schale Maximale Anzahl der Elektronen K 2 L 8 M 18 N 32 O 50 M http://sanders-seidler.jimdo.com Periodensystem der Elemente Innerhalb des Periodensystems gilt: Alle Elemente sind tabellarisch geordnet Die Ordnungszahl bestimmt die Position von rechts oben nach links unten Verwandet Elemente stehen in Gruppen senkrecht untereinander. Diese Gruppen tragen römische Ziffern. Waagrecht stehen die Perioden zusammen. Sie beziehen sich auf die Anzahl der Schalen. Links im Periodensystem stehen Metalle, rechts die Nichtmetalle. Ganz rechts findest Du die Edelgase. Das Periodensystem unterscheidet sich in Hauptgruppen und Nebengruppen. Es werden immer noch neue Elemente entdeckt. Zur Zeit gibt es über einhundert Elemente. http://sanders-seidler.jimdo.com Viel Spaß beim Lernen http://sanders-seidler.jimdo.com