11.2 Genetik ausgewählter neurologischer
Werbung
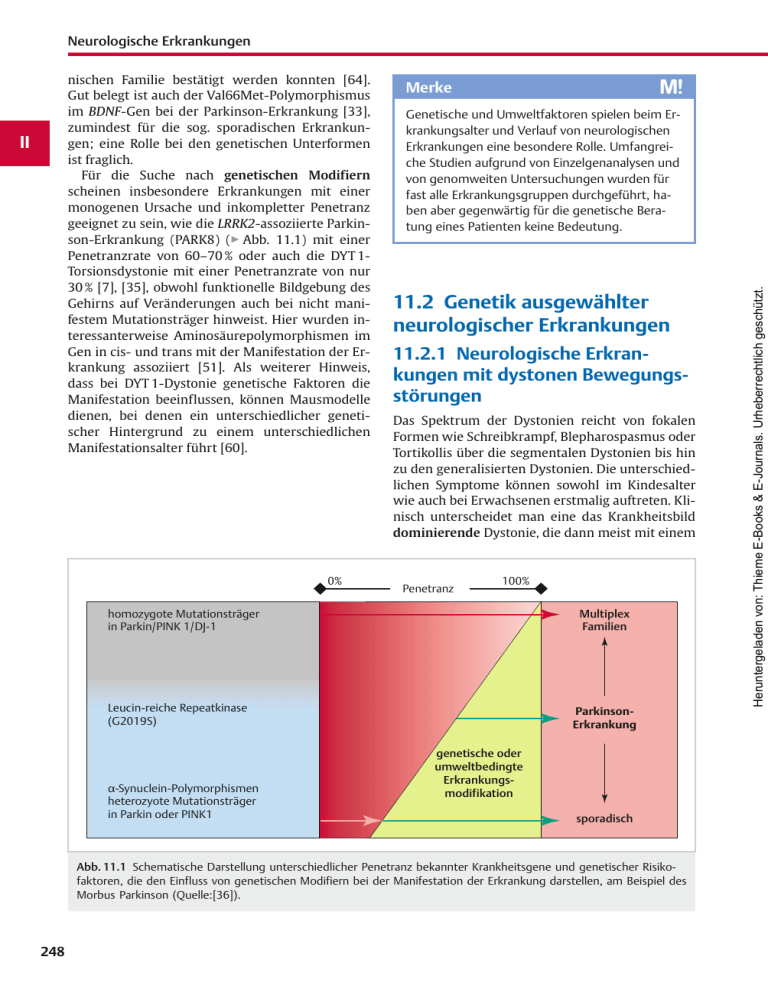
Neurologische Erkrankungen II 0% H Merke Genetische und Umweltfaktoren spielen beim Erkrankungsalter und Verlauf von neurologischen Erkrankungen eine besondere Rolle. Umfangreiche Studien aufgrund von Einzelgenanalysen und von genomweiten Untersuchungen wurden für fast alle Erkrankungsgruppen durchgeführt, haben aber gegenwärtig für die genetische Beratung eines Patienten keine Bedeutung. 11.2 Genetik ausgewählter neurologischer Erkrankungen 11.2.1 Neurologische Erkrankungen mit dystonen Bewegungsstörungen Das Spektrum der Dystonien reicht von fokalen Formen wie Schreibkrampf, Blepharospasmus oder Tortikollis über die segmentalen Dystonien bis hin zu den generalisierten Dystonien. Die unterschiedlichen Symptome können sowohl im Kindesalter wie auch bei Erwachsenen erstmalig auftreten. Klinisch unterscheidet man eine das Krankheitsbild dominierende Dystonie, die dann meist mit einem Penetranz 100% Multiplex Familien homozygote Mutationsträger in Parkin/PINK 1/DJ-1 Leucin-reiche Repeatkinase (G2019S) α-Synuclein-Polymorphismen heterozyote Mutationsträger in Parkin oder PINK1 ParkinsonErkrankung genetische oder umweltbedingte Erkrankungsmodifikation sporadisch Abb. 11.1 Schematische Darstellung unterschiedlicher Penetranz bekannter Krankheitsgene und genetischer Risikofaktoren, die den Einfluss von genetischen Modifiern bei der Manifestation der Erkrankung darstellen, am Beispiel des Morbus Parkinson (Quelle:[36]). 248 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. nischen Familie bestätigt werden konnten [64]. Gut belegt ist auch der Val66Met-Polymorphismus im BDNF-Gen bei der Parkinson-Erkrankung [33], zumindest für die sog. sporadischen Erkrankungen; eine Rolle bei den genetischen Unterformen ist fraglich. Für die Suche nach genetischen Modifiern scheinen insbesondere Erkrankungen mit einer monogenen Ursache und inkompletter Penetranz geeignet zu sein, wie die LRRK2-assoziierte Parkinson-Erkrankung (PARK8) (▶ Abb. 11.1) mit einer Penetranzrate von 60–70 % oder auch die DYT 1Torsionsdystonie mit einer Penetranzrate von nur 30 % [7], [35], obwohl funktionelle Bildgebung des Gehirns auf Veränderungen auch bei nicht manifestem Mutationsträger hinweist. Hier wurden interessanterweise Aminosäurepolymorphismen im Gen in cis- und trans mit der Manifestation der Erkrankung assoziiert [51]. Als weiterer Hinweis, dass bei DYT 1-Dystonie genetische Faktoren die Manifestation beeinflussen, können Mausmodelle dienen, bei denen ein unterschiedlicher genetischer Hintergrund zu einem unterschiedlichen Manifestationsalter führt [60]. 11.2 Genetik ausgewählter neurologischer Erkrankungen Isolierte Dystonien Von der Häufigkeit her bedeutend ist die DYT 1Dystonie, die durch eine Hauptmutation, einer InFrame-GAG-Deletion (∆E) im Torsin-A-Gen, verursacht wird (die kausale Bedeutung weiterer sehr seltener Mutationen ist bisher nicht eindeutig geklärt). DYT 1 macht bis zu 50 % aller früh manifestierenden Dystonien aus. Das mittlere Erkrankungsalter beträgt 13 Jahre, allerdings breitet sich die Dystonie innerhalb von 5 Jahren aus, sodass mit einer Generalisierung bis hin zur Rollstuhlpflichtigkeit gerechnet werden muss. Dennoch sind Einzelfälle mit nur einem Schreibkrampf als einziger Manifestation beschrieben. Klinisch und genetisch interessant ist, dass nur ca. 30 % der Mutationsträger bis zu einem Alter von Mitte 20 erkranken. Überschreitet man diese Altersgrenze symptomfrei, wird man im weiteren Laufe seines Lebens nicht erkranken, obwohl funktionelle MRT Aufnahmen einen veränderten Metabolismus im Gehirn nachweisen. Die Ursachen dafür sind nicht geklärt, man ist jedoch sicher, dass hier weitere genetische Faktoren eine Rolle spielen. Als klinisch sehr variabel auch hinsichtlich der betroffenen Körperregionen (Halsmuskulatur, Laryngeal) gilt die DYT 6-Dystonie, die sich im Alter zwischen 6 und 49 Jahren manifestiert. Zahlreiche Mutationen im Transkriptionsfaktor THAP1 sind beschrieben. Auch hier findet man eine reduzierte Penetranz (60 %). Spät manifestierende Dystonien Diese Gruppe der Dystonien hat oftmals nur eine fokale Manifestation und einen leichteren Verlauf. Obwohl die meisten Unterformen dem autosomaldominanten Erbgang folgen, ist eine Stammbaumanalyse aufgrund von Penetranzraten um die 10 % oft nicht als alleinige Entscheidungshilfe für eine genetische Testung geeignet. Während die Bedeutung von Mutationen im CIZ1-Gen (DYT 23) und im ANO3-Gen (DYT 24) noch näher untersucht werden muss, scheinen Mutationen im GNAL-Gen (DYT 25) eine größere Bedeutung zu haben. Sie sollen bis zu 19 % der Familien insbesondere mit zervikaler Dystonie erklären. 44 % der Patienten zeigen Auffälligkeiten beim Sprechen. Als Erstmanifestation findet sich fast nie eine Beteiligung der Arme und nur bei ⅓ der Mutationsträger ist diese Muskulatur im Krankheitsverlauf beteiligt [18]. 11 Kombinierte Dystonien Zu dieser Gruppe gehören die doparesponsiven Dystonien, auch als Segawa-Syndrom in der Literatur geführt (DYT 5). Auch wenn sie sehr selten ist, sollte man sie nicht übersehen, da sie in der Regel mit L-Dopa gut therapierbar ist. Typisch für diese Dystonieform, die üblicherweise in den unteren Extremitäten im Kindesalter beginnt, ist die Verschlechterung der Symptomatik während des Tages. Obwohl autosomal-dominant vererbt, sind Frauen 2- bis 4-mal häufiger symptomatisch als Männer. Die Penetranz beträgt wie bei der DYT 1Dystonie 30 %. Die wenigen Patienten mit einer homozygoten Mutation im GCH1-Gen haben einen schweren Krankheitsverlauf mit Enzephalopathie und Entwicklungsverzögerung. Auch die beiden rezessiv vererbten Formen DYT 5b und 5c sind oft mit geistiger Behinderung, Spastik oder Epilepsie assoziiert. 249 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tremor kombiniert ist (75 % der Dystonien), von Dystonien, die mit anderen Bewegungsstörungen vergesellschaftet sind. Die neuen Klassifikationen unterscheiden zudem zwischen den erblichen, den erworbenen (früher als sekundär bezeichnet) und den „idiopathischen“ Dystonien, deren Ursache momentan unklar ist. Bevor man die genetischen Ursachen abklärt, sollten zumindest Durchblutungsstörungen, Stoffwechselerkrankungen oder Infektionen als Ursache ausgeschlossen sein. Die Nomenklatur der genetisch bedingten Dystonien ist unabhängig vom Phänotyp und unabhängig vom Erbgang in aufsteigender Reihe als DYT bezeichnet worden. Zu den isolierten Dystonien gehören DYT 1, 2, 4, 6, 7, 13, 17, 21, 23, 24 und 25, zu den kombinierten Dystonien (früher Dystonie-plus-Syndrome) zählen DYT 3, 5a (= DYT 14), 5b, 5c, 11, 12, 15 und 16, und zu den paroxysmalen DYT 8, 10, 18 (= DYT 9), 19 und 20. Von den 24 Genorten sind bisher 16 Gene identifiziert, die meisten mit einem autosomal-dominanten Erbgang, von den autosomal-rezessiv vererbten sind bisher nur DYT 5b (Tyrosin-Hydroxylase), 5c (SPR-Gen; Sepiapterin-Reduktase), sowie DYT 16 (Proteinkinase PRKRA) bekannt. Schließlich ist die Dystonie Typ Lubag (DYT 3; TAF1-Gen) X-chromosomal vererbt (Überblick in [22]). Klinisch interessant, wenn auch sehr selten, ist die DYT 12-Dystonie, die sich meist im Kindesalter „akut“ innerhalb von wenigen Stunden oder Tagen progredient zum Vollbild entwickelt (ATP1A3Gen). Genetisch interessant ist wiederum die EpsilonSarkoglykan-assoziierte Dystonie (DYT 11), da hier ein maternaler Imprinting-Effekt (Kap. 3.4.2) vorliegt. Das mütterliche Allel wird nicht exprimiert, sodass eine Weitergabe der Mutation über die Mutter phänotypisch keine Auswirkungen bei den Nachkommen hat [67]. II Paroxysmale Dystonien Ähnlich wie die episodischen Ataxien (EA) (Kap. 11.2.4) können die paroxysmalen Dystonien durch Umwelteinflüsse wie Alkohol, Koffein oder Stress getriggert werden (DYT 8, PNKD1-Gen). Neben dystonen Bewegungsstörungen, die Minuten oder auch mehrere Stunden andauern können, beobachtet man choreatiforme Bewegungsstörungen oder Athetose. Die DYT 10 ist dagegen über plötzliche Bewegungen auslösbar. Dabei können auch epileptische Anfälle, die gut auf Antikonvulsiva ansprechen, hervorgerufen werden (PRRT 2-Gen). Die DYT 18 wird durch körperliche Anstrengungen und auch Fieber getriggert, oder wie DYT 8 durch Alkohol, Koffein oder Stress. Interessanterweise können Mutationen in demselben Gen (SLC 2A1) auch mit Entwicklungsverzögerung, Mikrozephalie, Ataxie und frühkindlichen Anfällen einhergehen. Ebenso wird die als DYT 9 klinisch mit paroxysmaler dystoner Choreoathetose, EA und Spastik beschriebene Form durch Mutationen im SLC 2A1-Gen hervorgerufen. Eine ketogene Diät mag die Symptomatik lindern. 11.2.2 Demenzielle Erkrankungen Demenzielle Erkrankungen werden oft mit der Alzheimer’schen Erkrankung gleichgesetzt, diese Diagnose kann jedoch definitiv nur neuropathologisch durch den Nachweis von β-AmyloidPlaques, Tau-Protein-positiven neurofibrillären Tangles und amyloidhaltigen Angiopathien gestellt werden (bestätigt in ca. 80 % der Diagnosen). In der Bildgebung, die generell durchgeführt werden sollte, um differenzialdiagnostisch Tumoren oder vaskuläre Ursachen der Symptomatik auszuschließen, findet man eine kortikale Atrophie. Weiterhin sollten andere Ursachen für eine De- 250 menz wie behandelbare Formen bei chronischer Medikamenteneinnahme (z. B. auch bei Depressionen), chronische Infektionen des Gehirns, Schilddrüsenerkrankungen oder auch Vitaminmangel (insbesondere B12), ausgeschlossen werden. In Deutschland sind ca. 700 000 Personen an einer Alzheimer-Erkrankung erkrankt. Jährlich kommen weitere 120 000–160 000 Personen hinzu. Etwa 25–24 % der Personen, die älter als 85 Jahre sind, sollen von einer Demenz betroffen sein; ca. ⅔ davon haben die Alzheimer’sche Demenz (AD). Differenzialdiagnostisch sollte an eine frontotemporale Demenz (FTD) (einschl. frontotemporale Demenz mit Parkinsonismus auf Chromosom 17 = FTDP-17), Morbus Pick, die diffuse Lewy-Körper-Erkrankung, Morbus Parkinson oder auch die Creutzfeldt-Jakob-Krankheit gedacht werden. Früh manifestierende familiäre Alzheimer’sche Demenz Möglichkeiten. einer genetischen Abklärung existieren insbesondere für die frühen Manifestationen vor dem 60. Lebensjahr. Etwa 5 % der Patienten mit einer AD haben eine frühe Manifestation (Early-onset familial AD), davon sind ca. 60 % familiär und 13 % folgen einem autosomal-dominanten Erbgang [8]. Mutationen in 3 Genen (APP, PSEN1 und PSEN2) sind beschrieben. Für diese Formen gibt es prinzipiell bei Nachweis einer kausalen Mutation beim betroffenen Indexpatienten die Möglichkeit der prädiktiven Testung in der Familie, in der Praxis wird diese jedoch eher selten in Anspruch genommen. Die Rolle des APOE-e4-Risikoallels bei der sporadischen Form der AD ist gut belegt, aber für die Prädiktion weder spezifisch noch sensitiv genug. Mutationen im APP-Gen (β-Amyloid-A4-Protein) findet man bei 10–12 % der familiären früh manifestierenden AD-Formen (AD1). Auf eine Überexpression des APP-Gens, das sich auf Chromosom 21 befindet, ist auch die Demenz bei Personen mit Down-Syndrom zurückzuführen, die sich meist nach dem 40. Lebensjahr entwickelt. Während Mutationen im Presenilin-2-Gen (AD4) äußerst selten sind, findet man Veränderungen im Presenilin-1-Gen (AD3) bei frühen familiären Formen häufig (20–70 %). Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Neurologische Erkrankungen 11.2 Genetik ausgewählter neurologischer Erkrankungen ● ● ● Bei der genetischen Beratung sollte darüber aufgeklärt werden, dass AD eine häufige Erkrankung ist und das Risiko, im Laufe des Lebens eine Demenz zu entwickeln, ca. 10–12 % beträgt. Eine genetische Beratung für nicht familiäre Fälle basiert auf empirischen Daten. Verwandte 1. Grades eines Einzelfalls in der Familie haben ein Wiederholungsrisiko von ca. 15–30 %. Erstgradig Verwandte von Patienten mit einer früh manifestierenden familiären Form der AD und bekannter Mutation sind bei dominantem Erbgang mit reduzierter Penetranz und variablem Erkrankungsalter entsprechend den Empfehlungen für die prädiktive Diagnostik bei spät manifestierenden nicht heilbaren neurodegenerativen Erkrankungen zu beraten (Kap. 11.2.3). Merke ● ● ● ● H Eine starke Assoziation besteht vor allem beim e4/e4-Genotyp mit nur ca. 1 % Vorkommen in der Normalbevölkerung, aber ca. 13 % bei ADPatienten. Bei Patienten mit familiärer Erkrankung kommt dieser Genotyp sogar bei ca. 19 % vor. Bei Patienten, die klinisch erkrankt sind und bei denen nach Ausschluss sekundärer Ursachen die Diagnose einer AD gestellt wurde, erhöht sich die Wahrscheinlichkeit der korrekten Diagnose mit einem e4/e4-Genotyp auf 97 %. Daher kann hier differenzialdiagnostisch die molekulargenetische Analyse des APOE-Gens sinnvoll sein. Etwa 42 % aller Personen mit AD haben kein APOE-e4-Allel. Daher ist die APOE-Genotypisierung allein nicht ausreichend für die Diagnosestellung. Eine prädiktive Testung des APOE-Gens von Risikopersonen wird im Allgemeinen nicht empfohlen. Spät manifestierende familiäre Alzheimer’sche Demenz Die zahlenmäßig bedeutendste Gruppe der Demenz stellen die spät manifestierenden Formen (Late-onset familial AD) dar. In dieser Patientengruppe hat man das APOE-e4-Allel in zahlreichen voneinander unabhängigen Studien gut dokumentiert. Das APOE-Gen hat 3 verschiedene Allele, die in unterschiedlicher Kombination und Häufigkeit bei Gesunden und Kranken vorkommen können (▶ Tab. 11.3). Tab. 11.3 APOE-Genotypen bei Kontrollen und AD-Patienten (Quelle: [31]). APOE-Genotyp Gesunde Personen (n = 304) (%) Patienten mit AD (n = 233) (%) e2/e2 1,3 0 e2/e3 12,5 3,4 e2/e4 4,9 4,3 e3/e3 59,9 38,2 e3/e4 20,7 41,2 e4/e4 0,7 12,9 Frontotemporale Demenz Aktuelle genetische Daten weisen überraschenderweise auf eine enge pathogenetische Überlappung der FTD mit der Gruppe der ALS hin. Bisher wurden Mutationen im CHMP2B-Gen (sehr selten), im Tau-Protein-codierenden MAPT-Gen, dem Progranulin-codierenden GRN-Gen und in C 9orf72 bei FTD nachgewiesen [52]. Mutationen im Tau-Protein verursachen FTD mit Parkinsonismus-17. Sie können eine starke extrapyramidale Komponente mit Rigidität, Bradykinesie, supranukleärer Lähmung und Blicksakkaden aufweisen. Die Erkrankung ist stark progredient und wird autosomal-dominant vererbt. Mutationen im Progranulin-Gen führen meist zu einer späteren Manifestation (59 + /–7 Jahre), und können sich sowohl mit Parkinsonismus als auch mit kortikobasaler Symptomatik manifestieren. Kürzlich wurde ein expandiertes Hexanucleotid-Repeat in der nicht codierenden Region des C9orf72-Gens auf Chromosom 9 als eine häufige Ursache (ca. 12 %) der familiären FTD identifiziert [10]. Noch häufiger sind GGGGCC-Hexarepeat-Expansionen in C9orf72 bei familiärer ALS (FALS) (23 %). Familien mit beiden klinischen Manifestationen (einer 11 251 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. H Merke Neurologische Erkrankungen II 11.2.3 Neurologische Erkrankungen mit choreatischen Bewegungsstörungen Als sekundäre Ursachen sind in der Gruppe der choreatischen Bewegungsstörungen zunächst insbesondere toxische (z. B. Alkohol), medikamentöse (z. B. Neuroleptika, L-Dopa, Steroide), vaskuläre (Enzephalopathien, Immunvaskulitis), parainfektiöse (Streptokokkeninfekt bei einer Chorea-minor Typ Sydenham), metabolische (Hyper- und Hypoglykämien, Hyperthyreoidose), paraneoplastische (Anti-CV2/CRMP-5, Anti-Hu, Anti-Yo) oder auch traumatische Ursachen abzuklären. Genetisch kommen autosomal-dominante (Chorea Huntington, einige SCA), autosomal-rezessive (Choreo-Akanthozytose) oder auch X-chromosomale Vererbungen (McLeod-Syndrom) infrage. Chorea Huntington Die Chorea Huntington gilt aus folgenden Gründen als Paradigma für viele andere neurologische Erkrankungen: ● Chorea Huntington war die erste autosomal-dominante Erkrankung, die durch genetische Kopplungsanalysen im Genom kartiert wurde (auf 4p16.3) [23]. ● Die Empfehlungen für eine prädiktive Testung von Risikopersonen bei spät manifestierenden Erkrankungen wurden für die Chorea Huntington modellhaft entwickelt [63], [25]. ● Bei der Chorea Huntington wurde als eine der ersten neurodegenerativen Erkrankungen eine PolyQ-Repeat-Expansion als ursächlich beschrieben [61] und umfassend untersucht, was als Beispiel für andere PolyQ-Erkrankungen gilt. Eine Chorea Huntington kommt in Europa mit ca. 4–8 Betroffenen auf 10 000 Einwohner vor; in Japan und in Afrika ist sie weitaus seltener. Verursacht wird die Chorea Huntington durch eine CAG-Repeat-Verlängerung im Huntingtin-Gen (HTT, auch mit IT 15 bezeichnet). Repeat-Verlängerungen von 40 Einheiten und darüber hinaus werden als voll penetrant definiert; zwischen 36 und 39 Einheiten findet man eine reduzierte Penetranz. Repeat-Längen im hohen Normalbereich 252 (27–35) tragen ein gewisses Risiko der Verlängerung in der paternalen Transmission. Die Größe der verlängerten Repeats korreliert invers mit dem Erkrankungsalter, wobei neben der Repeat-Länge weitere noch nicht definierte genetische und Umweltfaktoren mit ca. 40 % zum Erkrankungsalter beitragen. Hintergrundwissen V Risiko für Familienmitglieder bei Chorea Huntington in einer Indexperson Repeat-Anzahl der Indexperson ≥ 40 CAG ● 50 % Risiko der Weitergabe eines expandierten Allels an die Kinder, unabhängig vom Geschlecht des Kindes bzw. des betroffenen Elternteils ● Bei unauffälliger Familienanamnese kann ○ ein Elternteil entweder eine Repeat-Länge im Intermediärbereich (27–35 Repeats) haben, die in den verlängerten Bereich expandiert ist (hier würde man von einer Neumutation sprechen), oder ○ ein Elternteil eine Repeat-Länge im Bereich von 36–39 Repeats haben, die mit reduzierter Penetranz einhergeht, oder ○ die Erkrankung bei einem Elternteil ist mild ausgeprägt oder durch den Arzt nicht als Chorea Huntington erkannt worden, oder ○ die Stammbaumanalyse ist nicht zielführend, weil das transmittierende Familienmitglied vor Erkrankungsausbruch verstorben ist, oder ○ die Vaterschaft muss hinterfragt werden. Repeat-Anzahl der Indexperson < 40 CAG Das Risiko für Chorea Huntington bei Nachweis eines Repeats im Intermediärbereich von 36– 39 CAG bei einer Indexperson wird für ihre Nachkommen mit ca. 5 % angegeben (50 % × 10 %). ● Eine Person mit einem CAG-Allel im Bereich von 36–39 hat eine reduzierte Penetranz für die Manifestation der Erkrankung. ● Eine männliche Person mit Repeats im hohen Normalbereich (27–35) hat ein geringes Risiko für die Expansion in den Erkrankungsbereich bei Weitergabe an seine Nachkommen. Maternale Expansionen in den Erkrankungsbereich wurden bisher nicht beobachtet. ● Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. FTD sowie einer ALS) sind beschrieben, sowie auch stark unterschiedliche Erkrankungsalter innerhalb einer Familie. Als durchschnittliches Erkrankungsalter wird normalerweise das 30.–40. Lebensjahr angegeben. Ca. 10–20 % der Mutationsträger erkranken jedoch erst nach dem 50. Lebensjahr. Verlängerungen von mehr als 55 Repeats können zu einer Manifestation der Erkrankung vor dem 20. Lebensjahr führen, der sog. juvenilen Form. Klinisch manifestiert diese sich als Westphal-Variante, die meist mit einer akinetisch-rigiden Bewegungsstörung einhergeht. Obwohl ca. 5 % aller Mutationsträger an einer juvenilen Form erkranken, ist eine pränatale genetische Testung in Deutschland nicht erlaubt. Sehr früh manifestierende Erkrankungen (Expansion bis zu 250 Repeats sind beschrieben, vererbt von einem Vater mit 43 Repeat-Einheiten!) sind oftmals mit epileptischen Anfällen (30–50 % der Patienten mit einem Erkrankungsalter vor dem 10. Lebensjahr), schwerer geistiger Behinderung und rasch progredientem Krankheitsverlauf assoziiert [45]. Obwohl das Krankheitsbild dem autosomal-dominanten Erbgang folgt, hängt das Risiko für die Erkrankung von den Repeat-Längen des übertragenden Elternteils ab. ● ● ● ● Prädiktive Diagnostik der Chorea Huntington Die Chorea Huntington gilt als Vorbild für die Entwicklung von Empfehlungen bezüglich der genetischen Testung von spät manifestierenden nicht heilbaren Erkrankungen. Mehrere Guidelines oder Konsensus-Papiere wurden verabschiedet (Kap. 11.4.1). Für den Beratungsablauf bei der prädiktiven Diagnostik hat sich folgende Vorgehensweise bewährt: ● Jeder Beratungstermin im Verlauf einer prädiktiven molekulargenetischen Untersuchung wird durch den Ratsuchenden selbst initiiert. Dies spiegelt seine Selbstbestimmung wieder, ermöglicht ggf. den hürdenfreien Ausstieg aus dem laufenden diagnostischen Prozess und betont das Recht des Ratsuchenden auf Nichtwissen. ● Der Abstand zwischen den Beratungen sollte den Ratsuchenden genügend Zeit zur Reflexion des Beratungsinhalts und zur Besprechung der potenziellen Implikation in der Familie oder mit Freunden geben. ● Es sollte generell das Beratungsangebot für weitere Familienmitglieder geben, auch wenn sie sich nicht direkt testen lassen wollen. ● Demgegenüber muss die Risikoperson auch die Möglichkeit haben, sich allein – also ohne Partner – beraten zu lassen. ● ● Inhalte der Erstberatung vor prädiktiver Diagnostik sind Krankheitsbild, Aussagekraft der genetischen Diagnostik, Bedeutung der möglichen Befunde (auffällig/unauffällig) für den Ratsuchenden und für seine Angehörigen sowie standesrechtliche Rahmenbedingungen. Ergänzend können webbasierte Informationen [26], [27] genutzt werden, wobei damit bisher keine evaluierten Erfahrungen vorliegen. Auf die Möglichkeit paradoxer Reaktionen nach günstigem Testergebnis muss bereits vor dem Test hingewiesen werden. Zum Beispiel bei der Chorea Huntington haben ca. 10 % der prädiktiv Getesteten, die nicht Anlageträger sind, unerwarteterweise für 2–12 Monate nach Befundmitteilung psychische Schwierigkeiten mit dem Testergebnis [29]. Bereits vor der Diagnostik wird eine neurologische Untersuchung bei einem Spezialisten angeboten. Der Neurologe bespricht zudem aktuelle therapeutische Angebote und die potenzielle Anbindung an ein Zentrum. Die psychotherapeutische bzw. psychosoziale Begleitung vor Beginn der prädiktiven Untersuchung kann zwar nicht erzwungen, sollte aber dringend empfohlen werden. Die Konsequenzen eines auffälligen und eines unauffälligen Befunds für möglichst alle Lebensbereiche (Partnerschaft, Familie, Beruf, finanzielle Lage, Hobbys etc.) sollten reflektiert und antizipiert werden. Die bereits geleistete „Vorarbeit“ des Ratsuchenden bestimmt somit u. a. die Dauer dieser Vortestphase. Gesprächspartner können neben professionellen psychologischen oder ärztlichen Psychotherapeuten auch Sozialpädagogen oder Theologen mit entsprechender psychotherapeutischer Ausbildung und Kenntnis des Krankheitsbilds sein. Der Therapeut ist dann in der Phase nach der prädiktiven Testung ein bereits vertrauter Ansprechpartner und Begleiter. Lehnt ein Ratsuchender die psychotherapeutische Begleitung ab, sollte dies schriftlich festgehalten, u. U. vom Ratsuchenden auch unterschrieben werden. Informationen über die Selbsthilfegruppen sollten im Erstgespräch bereits vermittelt werden. Bei direkter Kontaktaufnahme gilt es zu differenzieren, ob in einer regionalen Gruppe überwiegend Risikopersonen oder eher Betroffene mit pflegenden Angehörigen vertreten sind. Unter Umständen werden sonst die Bedürfnisse des Einzelnen nicht befriedigt. Die Blutabnahme für die Testung sollte in der Regel im Rahmen eines 2. Beratungsgesprächs erfolgen. Der Termin wird telefonisch durch den 11 253 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 11.2 Genetik ausgewählter neurologischer Erkrankungen II ● ● ● Ratsuchenden nach dem Kontakt mit dem Neurologen und Psychologen vereinbart. Eine obligate 3-monatige Bedenkzeit ist heute nicht mehr üblich. Auch der Termin zur Befundmitteilung wird durch den Ratsuchenden aktiv angefragt. Das Testergebnis sollte der beratende Arzt in einem verschlossenen Umschlag erhalten, um beim Befundmitteilungstermin zunächst zu eruieren, ob der Ratsuchende eine Mitteilung des Befunds wünscht, und ggf. unvoreingenommen einen Rücktritt von der Befundmitteilung zu ermöglichen. Die Befundmitteilung beinhaltet auch Absprachen zur Nachbetreuung. Statistische Prognosen zum Erkrankungsbeginn und Verlauf anhand des individuellen Testergebnisses (bei Chorea Huntington z. B. [37]) sollten wegen der hohen Streubreite des Erkrankungsalters in der Beratung im Allgemeinen nicht vermittelt werden. Hintergrundwissen V Problematik der Testung von Personen mit einem A-priori-Risiko von 25 % bei Chorea Huntington Obwohl die humangenetische Beratung streng auf die Einhaltung des Rechts auf Nichtwissen achtet und dies auch im GenDG verankert ist, haben sich der Deutsche Huntington Hilfe e. V. (DHH) sowie andere internationale Selbsthilfegruppen für das Recht auf Wissen bei einer Person mit einem A-priori-Risiko von 25 % ausgesprochen. Die Konstellation trifft z. B. zu, wenn einer der Großeltern an einer Chorea Huntington erkrankt ist, deren Kinder noch gesund sind, aber keinen Gentest wünschen, die bereits erwachsenen Enkelkinder sich jedoch testen lassen möchten. Bei einem positiven Testergebnis würde gleichzeitig der noch gesunde Elternteil wissen, dass er die Mutation von seinem Elternteil ererbt hat. Die Selbsthilfegruppen unterstützen nach sorgfältiger Abwägung und dem Versuch der Einbeziehung des entsprechenden Elternteils eine Diagnostik beim erwachsenen Enkelkind, damit dieses seine Familien- und Berufsplanung danach ausrichten kann. 254 Die bisherigen Erfahrungen der prädiktiven Diagnostik weltweit können aufgrund des umfassenden Betreuungskonzepts bezüglich der individuellen Verarbeitung der Ergebnisse sogar bei Mutationsträgern als positiv gewertet werden. In einer großen internationalen Studie von mehr als 4 000 Testungen traten nur bei ca. 1 % der Risikopersonen schwerwiegende Ereignisse wie Suizidversuche oder Krankenhauseinweisungen auf [2], insbesondere bei Personen mit psychischen Vorerkrankungen oder bei Arbeitslosen. Etwa ⅔ der Risikopersonen gaben an, von dem Wissen der Anlageträgerschaft zu profitieren, so bei der Familienplanung, bei der Entscheidungsfindung für Beruf, Partnerschaft und Freizeit. Trotz der positiven Reflexion der genetischen Testung erfuhren ca. ⅓ aller Risikopersonen mehrmalige Diskriminierungen unterschiedlichster Art, was zu Frustration und Niedergeschlagenheit führte. Diese bezogen sich auf Versicherungen (58 %), Arbeitgeber (21 %; Fallbeispiel 11.1), Partnerschaften (5 %; Fallbeispiel 11.2) und Vorkommnisse im Alltag (16 %) [19]. Fallbeispiel 11.1 I Berufliche Auswirkungen einer prädiktiven Testung Für die Diskriminierung durch Arbeitgeber gibt es leider sehr viele Beispiele. So wollte das Land Hessen eine gesunde Lehrerin nicht verbeamten (www.spiegel.de/spiegel/print/d-28 921 844. html), da ihr Vater an einer Chorea Huntington litt. Die Lehrerin sah sich zu einem Gentest genötigt. Ein daraufhin angestrebter Rechtsstreit gab der Lehrerin Recht. Im betreffenden Artikel sind weitere Beispiele der Diskriminierung aufgeführt. Von einer freiwilligen Mitteilung des genetischen Status an den Arbeitgeber ist, auch aufgrund umfangreicher Erfahrungen unserer Sprechstunde, dringend abzuraten. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Neurologische Erkrankungen Fallbeispiel 11.2 I Private Auswirkungen einer prädiktiven Testung Ein unverheiratetes Paar kam in die genetische Beratung. Der Vater des 32-jährigen Mannes war an Chorea Huntington erkrankt. Der Mann bat um prädiktive Testung, mit der Begründung, wenn er die CAG-Repeat-Expansion von seinem Vater ererbt habe, würde er sich von seiner Partnerin trennen, da er ihr die Pflege seiner Person später im Krankheitsfall nicht zumuten möchte. Das Paar wurde wiederholt beraten, auch durch einen Psychotherapeuten. Ein Kontakt mit betroffenen Familien wurde über die Selbsthilfegruppe vermittelt. Bedauerlicherweise testete der Mann positiv, das Paar trennte sich (im gegenseitigen Einverständnis) unmittelbar nach der gemeinsamen Befundmitteilung. Choreatische Bewegungsstörungen (Huntington-ähnliche Erkrankungen) Differenzialdiagnostisch sollte bei einem Vorliegen choreatischer Bewegungsstörungen und nach Ausschluss sekundärer Ursachen sowie der CAG-Repeat-Verlängerung im HTT-Gen eine Prionerkrankung in Erwägung gezogen werden (HDL 1), die meist eine stärkere psychiatrische Komponente hat und stärker progredient als die Chorea Huntington verläuft. Neben der Atrophie der Basalganglien findet man hierbei auch Veränderungen der Frontal- und Temporallappen sowie des Zerebellums. HDL 2, das durch eine CTG/CAG-Repeat-Verlängerung im Junctophilin-3-Gen (JPH3) verursacht wird (Normalbereich 6–28 Einheiten, expandiert 41–58), wurde bisher bei keinem Mitteleuropäer nachgewiesen, sondern nur in der schwarzen südafrikanischen Bevölkerung oder bei deren ausgewanderten Familien. Das Erkrankungsalter liegt in der Regel ebenfalls zwischen dem 3. und 4. Lebensjahrzehnt. Das Gen für die autosomal-rezessiv erbliche HDL 3, die sich üblicherweise im frühen Kindesalter manifestiert, ist bisher nicht bekannt. Für Deutschland hat vor allem die CAG-Repeat-Expansion im TBP-Gen (Kap. Autosomal dominant vererbte Ataxien) differenzialdiagnostisch eine Be- deutung. Diese Veränderungen werden abhängig vom Phänotyp sowohl als SCA17 als auch als HDL 4 bezeichnet. Manifestationsformen sind sowohl Ataxie als auch Chorea, weiterhin können die Patienten parkinsonähnliche Symptome, Dystonie, psychiatrische Auffälligkeiten oder eine Epilepsie aufweisen. Einen ähnlich überlappenden Phänotyp findet man auch bei der in Deutschland sehr seltenen DRPLA (dentatorubrale pallidoluysische Atrophie) (Kap. Autosomal dominant vererbte Ataxien). Findet man bei Vorliegen choreatischer Symptome, manchmal mit oromandibulären Dyskinesien und parkinsonähnlichen Symptomen, meist ohne Tremor, selten auch Spastik, Demenz und Verhaltensauffälligkeiten, im MRT abnorme Eisenablagerungen sowie zystische Veränderungen der Basalganglien, sollte man eine Neuroferritinopathie ausschließen (FTL-Gen). Niedrige Ferritinspiegel im Serum sind dafür ein hinweisender Biomarker. Nach Ausschluss sekundärer Formen und ohne positive autosomal-dominante Familienanamnese sollte man differenzialdiagnostisch unbedingt die Abklärung einer Chorea-Akanthozytose (VPS 13AGen) erwägen. Der Phänotyp kann der Chorea Huntington sehr ähnlich sein, neben Chorea und psychiatrischen Veränderungen findet man auch Parkinsonismus, Tics, Augenbewegungsstörungen und Demenz, gelegentlich sogar Selbstverstümmelung. Wegweisend, aber nicht immer vorhanden, ist der Nachweis von mehr als 15 % Akanthozyten im Blutausstrich sowie eine erhöhte Kreatinkinase, manchmal auch eine Hepatosplenomegalie. Nicht ganz selten kann bei differenzialdiagnostischer Abklärung einer Chorea in spezialisierten Laboren auch eine Pantothenatkinase-assoziierte Neurodegeneration (PKAN) nachgewiesen werden, auch „Neurodegeneration with Brain Iron Accumulation Type 1“ (NBIA 1) oder HallervordenSpatz-Erkrankung genannt. Pathologisch findet man eine Eisenablagerung in der Substantia nigra und im Globus pallidus, im MRT in T 2-gewichteten Aufnahmen oftmals als „Eye-of-the-Tiger“-Zeichen beschrieben. Auch hier haben ca. 10 % eine Akanthozytose im peripheren Blut. Während sich die PKAN üblicherweise im Kindesalter manifestiert und dann mit extrapyramidalen Symptomen, generalisierten Dystonien mit oromandibulärer Beteiligung, Verhaltensauffälligkeiten, Retinitis pigmentosa und Optikusatrophie einhergeht, imponieren Patienten mit einer späteren Manifestation oftmals mit Chorea als Hauptsymptom. 11 255 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 11.2 Genetik ausgewählter neurologischer Erkrankungen Neurologische Erkrankungen II 11.2.4 Neurologische Erkrankungen mit ataktischen Bewegungsstörungen Unter ataktischen Bewegungsstörungen fasst man Störungen der Bewegungskoordination zusammen, bei der die Muskelkraft noch besteht. Oftmals findet man bei Patienten jedoch auch eine reduzierte Muskelkraft bis hin zur Lähmung, sodass klinisch die Abgrenzung von den Paresen manchmal schwierig ist (spastische Ataxien). Man kann Ataxien unterschiedlich einteilen: ● Abhängig davon, bei welchen Bewegungen die Koordination von Körperteilen am meisten betroffen ist, kann man die Gangataxie (breitbeiniges Gangbild), die Standataxie (Stehen nur mit Stütze möglich), die Rumpfataxie (Sitzen nur mit Stütze möglich) oder eine afferente Ataxie (Bewegungsstörungen primär der Arme und Hände, z. B. mit Dysmetrie oder Dysdiadochokinese, sowie der Augen wie Nystagmus) näher beschreiben. Oftmals liegt eine komplexe Koordinierungsstörung mehrerer Systeme vor. ● Abhängig davon, ob primär das Kleinhirn oder das Rückenmark betroffen sind, kann man zwischen zerebellären und spinalen bzw. sensiblen Ataxien unterscheiden. ● Abhängig von der pathogenetischen Kausalität kann man andererseits unterscheiden zwischen: ○ erworbenen Ursachen, die zu einer Beteiligung des Kleinhirns oder Spinaltrakts führen können (z. B. alkoholische, endokrine, inflammatorische, vaskuläre oder paraneoplastische Kleinhirndegeneration) ○ genetisch bedingten Ataxien ○ „sporadischen“ Ataxien mit bislang unbekannter Ursache ● Ataxien im Rahmen eines rein neurologischen Krankheitsbilds und syndromale Ataxien im Rahmen eines übergeordneten Syndroms. 256 2013 wird in der LMD [77] (Neurogenetics Database) bei 621 Erkrankungen eine Ataxie als Symptom geführt. Für die Diagnostik und Therapie ataktischer Erkrankungen, insbesondere die des Erwachsenenalters, sind durch die Deutsche Neurologische Gesellschaft (DNG) S 1-Leitlinien entwickelt worden (www.awmf.org/uploads/tx_szleitlinien/030– 031l_S 1_Ataxien_des_Erwachsenenalters_2012–1. pdf). In den folgenden Abschnitten sollen genetisch bedingte Ataxien exemplarisch dargestellt werden. Prävalenzdaten für genetisch bedingte Ataxien liegen nur eingeschränkt vor; sie schwanken zwischen ca. 9 und 15 auf 100 000 [9], [49], [44], [62], [16]. Auch eine genaue Angabe für autosomal-dominant vererbte im Vergleich zu den rezessiven Ataxien gibt es mit Ausnahme für Portugal (5,6 für dominante und 3,3 auf 100 000 für rezessive Ataxien) [9] kaum. In einigen Populationen sind aufgrund von Gründereffekten bestimmte Ataxieformen häufig, z. B. in Portugal die SCA3 oder in Lateinamerika neben der SCA3 die SCA10, aber insgesamt gilt, dass es sich um eine klinisch und ätiologisch äußerst heterogene Gruppe von Krankheiten handelt. Die Zahl der genetisch definierten Formen von Ataxien wird auf 50–100 geschätzt. Eine umfassende genetische Abklärung sollte aus folgenden Gründen erfolgen: ● Seltene Unterformen, die mit den neuen NGSTechnologien detektiert werden, sind therapierbar. Diese Patienten haben ein Recht auf therapeutische Intervention. ● Kausalitätsabklärung von Erkrankungen führt gegenwärtig zu einem neuen Krankheitsverständnis, der mit dem Begriff „Präzisionsmedizin“ zusammengefasst wird. Dieser ermöglicht sowohl die bessere Erkundung von Biomarkern, die Voraussetzung für effizientere Therapiestudien sind, als auch eine schnellere Übertragung von Therapieoptionen auf weitere genetische Unterformen. ● Genetische Diagnostik hat u. U. familienrelevante Konsequenzen, die zur Beratung und prognostischen Begleitung von bisher nicht betroffenen Familienmitgliedern sowie ggf. zur Pränataldiagnostik führen können (beachte hierbei GenDG, Kap. 1). Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Von den progredient verlaufenden choreatischen Bewegungsstörungen sollte man unbedingt die autosomal-dominant vererbte benigne hereditäre Chorea abgrenzen. Sie tritt bereits im Kindesalter auf, führt aber nicht zu kognitiven oder psychischen Defiziten. Da es sich bei dem zugrunde liegenden Gen (NKX2) um einen Transkriptionsfaktor handelt, der auch in Lunge und Schilddrüse exprimiert wird, findet man bei den Patienten häufig auch Lungenerkrankungen und eine Hypothyreose. Autosomal dominant vererbte Ataxien Die Häufigkeit der autosomal-dominanten zerebellären Ataxien wird mit 3:100 000 Einwohner in Europa geschätzt [13]. Die Nomenklatur der Ataxien ist nicht einheitlich vorgenommen worden. 1983 entwickelte Anita Harding eine für lange Zeit in der Klinik angewandte Klassifikation [24], die die dominanten Ataxien unterteilte in: ● ADCA Typ 1: zerebelläre Ataxie mit weiteren Symptomen ● ADCA Typ 2: autosomal-dominant vererbte Ataxie mit Beteiligung der Retina ● ADCA Typ 3: „rein“ zerebelläre Ataxie Mit der Kartierung der ersten dominanten AtaxieGene wurde diese klinisch-genetische Klassifikation für eine mitunter wenig praktikable Nummerierung der Gene/Genorte in die Bezeichnung „spinozerebelläre Ataxie“ (SCA) in aufsteigender Reihenfolge verlassen [68]. Gegenwärtig werden in OMIM [78] (Juli 2013) 35 Genorte für SCA gelistet (▶ Tab. 11.4). Bisher gibt es keine Daten zur Prävalenz der SCA13, 20, 23, 28 oder 31 in Deutschland. Mit Ausnahme der CAG-Trinukleotid-Repeat-Erkrankungen (SCA1, 2, 3, 6, 7 und 17) werden die anderen Gene nicht in der Routinediagnostik, sondern nur nach spezieller Anforderung getestet. Tab. 11.4 Autosomal-dominant vererbte Ataxien. Genort Gen/Locus Funktion des Genprodukts Genetische Besonderheiten Phänotypmerkmale DRPLA ATN1 Atrophin vorrangig in Japan, nur einzelne Familien in USA und Europa, CAGRepeat-Erkrankung Epilepsie, Chorea, psychiatrische Manifestationen; daher auch als DD für choreatische Bewegungsstörung SCA1 Ataxin1 CAG-Repeat-Erkrankung frühe Schluckstörung, Pyramidenbahnzeichen (mit mittlerer Repeat-Zahl) und ALS (mit langer Repeat-Zahl) SCA2 Ataxin2 CAG-Repeat-Erkrankung verlangsamte Sakkaden, Parkinsonismus SCA3 Ataxin3 Deubiquitinase, interagiert mit Parkin häufigste SCA weltweit, besonders häufig in Portugal und Lateinamerika, CAG-RepeatErkrankung abhängig von der RepeatLänge von Parkinsonismus bis Spastik, große Repeat-Verlängerungen manifestieren sich meist mit Spastik und vor dem 20. Lebensjahr mit Dystonie SCA4 C/T-Mutation in der 5‘-untranslatierten Region des Puratrophin-1-Gens beschrieben Zweifel, ob Puratrophin Krankheitsgen ist, daher gegenwärtig keine Testung Gen in einer großen deutschen Familie nicht bestätigt reine und langsam progrediente zerebelläre Ataxie; mittleres Erkrankungsalter 60 Jahre (+ /– 10) SCA5 SPTBN2 Beta-III-Spectrin beschrieben in der Familie von Abraham Lincoln; bisher je 1 deutsche, amerikanische und französische Familie beschrieben kognitive Beeinträchtigung bei homozygoter Mutation, „reine“ Ataxie, manchmal bulbäre Zeichen, normale Lebenserwartung; Erkrankungsalter zwischen 10 und 68 Jahren SCA6 CACNA1A P/Q-abhängiger Kalziumkanal CAG-Repeat-Expansion spät beginnende, überwiegend rein cerebelläre Ataxie SCA7 ATXN7 häufig in Frankreich, CAG-Repeat-Erkrankung Visusreduktion durch Makuladegeneration (bei langer Repeat-Zahl u. U. vor Ataxiebeginn) 11 257 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 11.2 Genetik ausgewählter neurologischer Erkrankungen Neurologische Erkrankungen II 258 Genort Gen/Locus SCA8 ATXN8 und ATXN8OS SCA9 nicht kartiert SCA10 ATXN10 SCA11 TTBK2 SCA12 Funktion des Genprodukts Genetische Besonderheiten Phänotypmerkmale Cave: Repeat-Verlängerung auch in Kontrollen, sowie in SCA6, Schizophrenie und manisch depressiven Patienten beschrieben, insbesondere Bereich zwischen 250–800 CTG-Repeats geringe Penetranz stark variierendes Erkrankungsalter von 1–73 Jahren, skandierende Dysarthrie, leichte Pyramidenbahnstörung, Nystagmus, Tremor Gen unbekannt Ophthalmoplegie, Dysarthrie, Pyramidenbahnzeichen, Muskelschwäche, extrapyramidale Zeichen, Parkinsonismus ATTCT Repeat; bislang nur in Lateinamerika beschrieben, in Mexiko und Brasilien nach SCA3 zweithäufigste dominante Ataxie Epilepsie häufig Tau-Tubulin-Kinase 2 bisher nur 1 britische Familie beschrieben, kein Nachweis bei deutschen bzw. französischen SCA-Patienten „reine“ Ataxie, Nystagmus, normale Lebenserwartung; Erkrankungsalter zwischen 15 und 43 Jahren PPP2R2B Proteinphosphatase PP2A–PR55β vorrangig indische Familien; nur einzelne Familien aus Italien, USA und China, keine deutsche Familie beschrieben; CAG-RepeatErkrankung zerebrale Atrophie SCA13 KCNC 3 Ca-Voltage gated Potassium Channel sehr selten (< 1 %), 1 französische und 1 philippinische Familie beschrieben mentale Retardierung (moderat IQ 62–76) und faziale Dysmorphien bei früh beginnenden Verläufen, langsam verlaufend SCA14 PRKCG Proteinkinase C γ 1,5 % der SCA in Frankreich, mehrere Familien in Deutschland beschrieben früh beginnender Myoklonus, kognitive Beeinträchtigung, Kopf- und Rumpftremor, langsam progredient, selten zervikale Dystonie; Erkrankungsalter zwischen 12 und 60 Jahren SCA15/16 ITPR1 Inositol-1,4,5-Triphosphatrezeptor große Deletion, aber auch Punktmutationen; 58 Exone, daher schwer in Routine ohne NGS zu testen; ca. 9 % der deutschen und 2 % der französischen Familien Aktions- und Haltetremor, vorwiegend rein zerebellär, Nystagmus, normale Lebenserwartung, nur langsam progredient; Erkrankungsalter zwischen 10 und 66 Jahren SCA17 TBP TATA-Bindeprotein CAG-Repeat-Erkrankung Demenz, Huntington-ähnliche Chorea, daher auch als DD für choreatische Bewegungsstörungen Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tab. 11.4 Fortsetzung 11.2 Genetik ausgewählter neurologischer Erkrankungen Genort Gen/Locus Funktion des Genprodukts Genetische Besonderheiten Phänotypmerkmale SCA18 7q31 Gen unbekannt 1 amerikanische Familie Nystagmus, Pyramidenbahnzeichen, proximal betonte Schwäche; Erkrankungsalter 12–25 Jahre SCA19/22 1p21-q21 Gen unbekannt 1 chinesische und 1 holländische Familie Nystagmus, kognitive Beeinträchtigung, Myoklonus, Tremor, langsam progredient; Erkrankungsalter 10–46 Jahre SCA20 225-kb-Duplikation in der perizentrischen Region von Chromosom 11 Gen unbekannt, Region enthält mindestens 10 Gene 1 anglokeltische Familie Dysphonie, Dentatuskalzifikation, milde Pyramidenbahnzeichen; Erkrankungsalter 19–64 SCA21 7p21-p15 Gen unbekannt 1 französische Familie Langsam progredient, Akinesie, Tremor, Hyporeflexie, milde kognitive Beeinträchtigung; Erkrankungsalter 6– 30 Jahre SCA23 PDYN Prodynorphin, Precursor of opioid Neuropeptides 4 holländische Familien beschrieben (< 0,5 %) extrem selten, langsam progredient, Nystagmus; Erkrankungsalter zwischen 43 und 56 Jahren SCA24 19 Gen unbekannt SCA25 2p15-p21 Gen unbekannt 1 französische Familie sensorische Neuropathie; Erkrankungsalter 1,5– 39 Jahre SCA26 19p13 Gen unbekannt 1 norwegische Familie langsam progrediente Gangataxie, ataktische Bewegungen der Arme; Erkrankungsalter 26–60 Jahre SCA27 FGF14 Fibroblast Growth Factor 14 sehr selten (1 holländische und 1 deutsche Familie) früh beginnender posturaler Tremor, kognitive Defizite, Verhaltensauffälligkeiten, langsam progredient; Erkrankungsalter zwischen 24 und 40 Jahren SCA28 AFG3L 2 mitochondriale AAAProtease; AFG3L 2 bildet homooligomere und heterooligomere Komplexe mit Paraplegin, das bei SPG7 mutiert ist 3 % der italienischen Familien langsam progredient, tiefe Sehnenreflexe der unteren Gliedmaßen erhöht, Ptosis auch in Betracht ziehen bei spastischer Ataxianeuropathie; Erkrankungsalter 12– 36 Jahre SCA29 ITPR1 Inositol-1,4,5-Triphosphatrezeptor 1 australische und 1 kanadische Familie; im Gegensatz zu SCA15 hier Punktmutationen kongenitale nicht progressive Ataxie SCA30 4q34–35 Gen unbekannt 1 australische Familie Langsam progredient, reine Ataxie 11 259 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tab. 11.4 Fortsetzung Neurologische Erkrankungen II 260 Genort Gen/Locus Funktion des Genprodukts Genetische Besonderheiten Phänotypmerkmale SCA31 BEAN-TK2 Thymidine Kinase 2 TGGAA-Repeat, auch in Kontrollen; bislang keine sicher pathogene Variante in Europa; in Japan dritthäufigste Erkrankung nach SCA3 und 6 Hypakusis, später Krankheitsbeginn, meist rein zerebellär; mittleres Erkrankungsalter 61 Jahre SCA32 7q32-q33 Gen unbekannt 1 chinesische Familie Männer mit Azoospermie, bei Erkrankungsalter vor dem 40. Lebensjahr milde kognitive Beeinträchtigung SCA33 nicht vergeben SCA34 6p12.3-q16.2 Gen unbekannt 1 kanadische Familie französischer Abstammung plus neurokutanes Syndrom, unmittelbar nach Geburt Auftreten von ichthyosiformen Plaques, die im Sommer schwächer werden und denen bei Erythrokeratodermie entsprechen (EKVP; 133 200), insbesondere an den Extremitäten; Hautbeteiligung verschwindet nach dem 25. Lebensjahr bei den meisten Patienten und tritt oft ab dem 40. Lebensjahr wieder auf; im späteren Alter langsam progredientes neurologisches Syndrom mit Nystagmus, Dysarthrie und schwerer Ataxie SCA35 TGM6 bislang nicht in Europa beschrieben SCA36 NOP56 GGCCTG-Repeat; vorrangig in Japan, vereinzelt in Spanien und Frankreich; bislang nicht in Deutschland beschrieben Schädigung 1. und 2. Motorneuron; Hypakusis EA1 KCNA1 Kaliumkanal sehr selten (1:500 000); unvollständige Penetranz; autosomal dominant, Neumutationen beschrieben episodische Ataxie meist in Kindheit manifestierend, Anfälle nur wenige Minuten anhaltend, manchmal mehrmals täglich, durch Stress, Angst und Kinesien auslösbar EA2/SCA6 CACNA1A P/Q-abhängiger Kalziumkanal Missense- und Frameshift-Mutationen, Exondeletionen episodische Ataxie; aber auch früh beginnende langsam progrediente Ataxie mit Kleinhirnatrophie EA3 1q42 Gen unbekannt 2 Familien europäischen Ursprungs Schwindelanfälle, Doppelsehen, und ataktische Bewegungsstörungen bereits im Kindesalter, Ataxie langsam progredient Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tab. 11.4 Fortsetzung 11.2 Genetik ausgewählter neurologischer Erkrankungen Genort Gen/Locus Funktion des Genprodukts Genetische Besonderheiten Phänotypmerkmale EA4 unbekannt unbekannt 1 große kanadische Mennonitenfamilie Periodische vestibulozerebelläre Ataxie EA5 CACNB4 Regulatorische beta-Untereinheit eines Ca2 + Kanals 1 kanadische Familie französischer Abstammung; Allelisch zur juvenilen Myoklonusepilepsie (JME) Wiederholte Attacken von Schwindel und Ataxie, mehrere Stunden andauernd EA6 SLC1A3 excitatory amino acid transporter 1 (EAAT 1) Fieber-induzierte Ataxieattacken einhergehend mit verwaschener Sprache und Kopfschmerzen, gelegentlich Hemiplegie EA7 19q13 unbekannt Episodische Ataxie vor dem 20. Lebensjahr beginnend, oft durch körperliche Anstrengung ausgelöst und mit Schwäche und Schwindel einhergehend, Stunden bis Tage anhaltend Merke H Klinische Orientierung für die molekulargenetische Diagnostik bei autosomal-dominant vererbten Ataxien ● ● ● ● ADCA Typ I: klare extrazerebelläre Symptome ○ First-Line: SCA1, 2, 3 ○ Second-Line: 6, 7, 17, DRPLA, 14 ADCA Typ II: Ataxie plus Retinopathie ○ First-Line: SCA7 ○ Second-Line: andere SCA-Gene ADCA Typ III: „reine“ zerebelläre Symptome ○ First-Line: SCA6, 8, 5, (12), 11, 15/16, 28 ○ Second-Line: andere SCA-Loci ADCA Typ „IV“: mit geistiger Behinderung/kognitiver Beeinträchtigung ○ First-Line: SCA27/FGF14, SCA13 Autosomal-rezessiv vererbte Ataxien Die Klassifikation der rezessiv vererbten Ataxien ist äußerst unübersichtlich (s. auch http://neuromuscular.wustl.edu/ataxia/recatax.html). Einige werden nach den zugrunde liegenden Gendefekten benannt, bei anderen hat man versucht, eine Klassifikation entsprechend den dominanten Ata- xien zu beginnen und als ARCA zu bezeichnen. Momentan sind mehr als 50 autosomal-rezessiv vererbte Entitäten bekannt, die primär mit Ataxie einhergehen [17]. Der Phänotyp ist in aller Regel deutlich vielfältiger im Sinne einer Multisystembeteiligung und das Erkrankungsalter liegt häufig vor dem 30. Lebensjahr. Die Erkrankungen schreiten meist schneller als die dominanten Formen voran. Eine genaue klinische Untersuchung zur Erfassung okulomotorischer Apraxien oder Blickparesen, einer Pyramidenbahnbeteiligung oder PNP sowie auch nicht zerebellärer cMRT-Auffälligkeiten ist für die Differenzialdiagnosen oft richtungweisend. Der Vollständigkeit halber sollen hier einige Erkrankungen gelistet, jedoch nicht weiter diskutiert werden, die mit Ataxien als einem von vielen Symptomen einhergehen. Dies betrifft z. B. die Gruppe der kongenitalen Ataxien und zerebellären Malformationen, wie Behr-Syndrom CAMOS (SCAR5), zerebelläre Ataxie Typ 1 (SCAR2), Typ 3 (SCAR6), zerebelläre und pankreatische Aplasie (PTF1A), COACH-Syndrom (CC2D2A, TMEM67), kongenitale Muskeldystrophien mit Dandy-Walker-Malformation (ZIC1, ZIC4, FOXC1), Joubert-Syndrom (u. a. TMEM216, AHI1, NPHP1, CEP290, TMEM67, RPGRIP1L, ARL13B, CC2D2A, OFD1), zerebelläre Hypoplasien (RELN), pontozerebelläre Hypoplasien (PCH), oftmals einhergehend mit progressiven zerebralen Atrophien (TSEN54, TSEN2, TSEN34), aber auch quadrupedale 11 261 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tab. 11.4 Fortsetzung Neurologische Erkrankungen II Mit diesen Tests können zugleich kausal behandelbare Ataxien erfasst werden. Friedreich-Ataxie Mit ca. 3 auf 100 000 Einwohner ist die FriedreichAtaxie (FRDA) die häufigste ARCA in der westlichen Welt, wohingegen die Erkrankung z. B. in Asien eher selten ist. Diese Form der Ataxie gehört zu den Repeat-Expansionserkrankungen (Typ 2) und wird meist durch eine homozygote GAA-Triplet-Expansion (70 bis > 1000 GAA-Triplets) in einem Intron des FXN-Gens verursacht. Auch hier findet man eine inverse Korrelation des Erkrankungsalters mit der expandierten GAA-RepeatLänge. In 2–4 % der Fälle findet sich neben einer heterozygoten Triplet-Expansion eine Punktmutation auf dem zweiten FXN-Allel. Ein solcher compound-heterozygoter Zustand muss bei Patienten ausgeschlossen werden, bei denen primär nur eine heterozygote Triplet-Expansion nachgewiesen wird. Bisher sind keine Patienten mit CompoundHeterozygotie für 2 Punktmutationen beschrieben. Kürzlich wurden auch Exondeletionen bei FRDA beschrieben, die man insbesondere bei frühem Erkrankungsalter und Entwicklung einer schweren Skoliose in Betracht ziehen sollte [3]. Noch vor wenigen Jahren wurde die Erkrankung nur in Betracht gezogen, wenn sie vor dem 20. Le- 262 bensjahr auftrat. Seit dem Nachweis der genetischen Ursache weiß man jedoch, dass eine FRDA im Alter bis zu 60 Jahren auftreten kann. Merke H Patienten mit einer FRDA sollten interdisziplinär in einem Zentrum betreut werden, in dem neben Neurologen auch Kardiologen (hypertrophe nicht obstruktive Kardiomyopathie), Orthopäden (Skoliose), Endokrinologen (Diabetes mellitus bei ca. 30 % der Patienten), Gastroenterologen, Ophthalmologen (Optikusatrophie bei ca. 25 %), HNOÄrzte (13 % Taubheit) und Humangenetiker (25 % iges Wiederholungsrisiko) mit dem Krankheitsbild vertraut sind. Taubheit und Optikusatrophie treten meist erst im fortgeschrittenen Stadium der Erkrankung auf, sodass deren Auftreten vor der Ataxie eher für eine andere Erkrankung wie CMTX5 bei PRPS1-Mutation, OPA1 oder OPA3 spricht. Ebenso spricht eine deutliche Kleinhirnatrophie oder ein Nystagmus eher gegen eine FRDA. Die Heterozygotenfrequenz wird mit 1:60–100 angegeben. Praxistipp Z Einen sehr guten Überblick über die Klinik, Genetik und Behandlung der FRDA findet man in GeneReviews (www.ncbi.nlm.nih.gov/books/ NBK1281/). Weitere autosomal-rezessiv vererbte Ataxien Die autosomal-rezessive spastische Ataxie Charlevoix-Saguenay (ARSACS) wird in die genetische Differenzialdiagnose in Deutschland bisher wenig einbezogen, stellt aber die zweithäufigste ARCA nach FRDA dar [58]. Wie die FRDA beginnt auch ARSACS in der Regel früh (< 20. Lebensjahr), kann aber neben der zerebellären Ataxie auch Pyramidenbahnzeichen der unteren Extremität (Spastik, Babinski-Zeichen, Hyperreflexie) und eine axonale sensomotorische Polyneuropathie (PNP) aufweisen. Differenzialdiagnostisch wichtig ist ein charakteristischer cMRT-Befund mit oberwurmbetonter Kleinhirnatrophie, T 2-hypointensen linearen Streifen in der Pons und einer T 2-hyperintensen Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Fortbewegung (CA8, VLDLR), um nur einige zu nennen. Auch die Gruppe der metabolischen Ataxien wächst ständig. Dazu gehören Abetalipoproteinämie, Biotinidasemangel, Karnitinazetyltransferasemangel, zerebrotendinöse Xanthomatose (CTX), Hartnup-Erkrankung, Hypobetalipoproteinämie, Ahornsiruperkrankung, Niemann-Pick Typ C (NPC), Refsum-Erkrankung oder auch Morbus Wilson. Zur Differenzialdiagnose werden folgende Laborparameter bei früh beginnenden Ataxieformen empfohlen (S 1 Ataxie-Leitlinien der DGN): ● AFP (Ataxie-Teleangiektasie [AT], Ataxie mit okulomotorischer Apraxie Typ 2 [AOA2]) ● Vitamin E (Ataxie mit Vitamin-E-Defizienz [AVED], Abetalipoproteinämie) ● Laktat (mitochondriale Ataxieformen) ● Phytansäure (Refsum-Krankheit) ● Albumin (AOA1) ● Cholesterin (Abetalipoproteinämie, AOA1) ● Cholestanol (CTX) lateralen Pons [50]. Bei der Mehrheit der ARSACSPatienten finden sich auch eine parietale Atrophie und ein dünnes Corpus callosum. Zu der in Deutschland mit bis zu 11 % aller Patienten häufigen Gruppe der früh manifesten Ataxien gehören auch Mutationen im nukleär codierten Gen der mitochondrialen Polymerase γ (POLG) (mittleres Alter bei Krankheitsbeginn 26 Jahre, Spannweite 7–52 Jahre) [54]. Der Phänotyp entspricht weitestgehend einer „mitochondrialen“ autosomal-rezessiven Ataxie mit externer Ophthalmoplegie (PEO) und sensorischer axonaler PNP. Diese phänotypische Kombination hat eine prädiktive Validität von 80 % auf zugrunde liegende POLG-Mutationen [56]. Weitere häufige phänotypische Merkmale sind bilaterale Ptosis (69 %), Epilepsie (38 %) und hyperkinetische Bewegungsstörungen (Chorea 31 %, Dystonie 31 %, Myoklonus 23 %). Ähnlich wie bei FRDA besteht in der Mehrzahl der Fälle (85 %) keine oder eine allenfalls moderate Kleinhirnatrophie [57]. Differenzialdiagnostisch relativ einfach zu erkennen sind Ataxien mit okulomotorischer Apraxie (definiert als verzögerte Sakkadeninitiation, zudem häufig unter Zuhilfenahme einer ipsilateralen Kopfdrehung), von denen es bisher 2 genetisch definierte Unterformen (AOA1 und AOA2) gibt. Die Häufigkeit beider Ataxieformen wird jeweils mit ca. 5 % unter den rezessiven Ataxien angegeben. AOA2 (Senataxindefekt) geht bei fast allen Patienten mit einem erhöhten AFP im Serum einher, während der AFP-Wert bei AOA1 normal ist. Dafür findet man bei AOA1-Patienten mit längerem Krankheitsverlauf eine Hypoalbuminämie (ca. 80 %) und eine Hypercholesterinämie (ca. 70 %). Fast alle Patienten haben eine Kleinhirndegeneration. Wichtig ist zu erwähnen, dass ca. ⅓ aller AOA1-Patienten (Mutation im Aprataxin-Gen) eine kognitive Beeinträchtigung haben. Ebenfalls mit okulomotorischer Apraxie und wie die AOA2 mit erhöhtem AFP-Spiegel einhergehend (Werte > 10 ng/mL) ist die Ataxia teleangiectasia (AT, auch Louis-Bar-Syndrom genannt). Charakteristisch für die AT sind okulokutane Teleangiektasien und eine variabel ausgeprägte Immundefizienz, die mit einem erhöhten Malignomrisiko, insbesondere für Leukämien oder Lymphome, einhergeht. Auch wenn in Europa selten, sollte eine Vitamin-E-Mangel-Ataxie (AVED) wegen der Behandlungsmöglichkeiten bei Patienten mit früh begin- nender Ataxie ausgeschlossen werden. Richtungsweisend können hier erniedrigte Serum-VitaminE-Spiegel sein. Lebenslange orale Vitamin-E-Gaben in hohen Dosen können den Krankheitsprogress verlangsamen oder sogar aufhalten [42]. Ebenfalls selten, aber therapeutisch relevant sind die adulte Verlaufsform des NPC und die CTX. Bei der adulten Verlaufsform der NPC (Mutationen im NPC 1-Gen [95 %] oder NPC 2-Gen [5 %]), die häufig mit einer vertikalen supranukleären Blickparese nach oben (initial oftmals zunächst nur als Verlangsamung der vertikalen Sakkaden imponierend), Gangataxie, Dysphagie, Dysarthrie, gelegentlich mit Dystonie und Hyperreflexie sowie einer früh beginnenden Demenz (20.–40. Lebensjahr) einhergeht, bewirkt die Substanz Miglustat eine gewisse Stabilisierung des Krankheitsverlaufs [47]. Der biochemische Filipin-Test, der nicht verestertes freies Cholesterol bindet und anfärbt, ist bei ca. 20 % der Patienten nicht richtungsweisend für die Diagnosestellung. Bei der CTX, die durch Störung des Gallensäureabbaus (CYP27A1-Gen) zu einer Lipidspeicherung führt und mit Katarakt, Diarrhoe und Xanthomen an den Sehnen einhergeht, sowie ebenfalls zu progressiven neuropsychiatrischen Störungen (Demenz, psychiatrische Störungen, Ataxie, Pyramidenbahnzeichen, Dystonie, Parkinson-Syndrom, periphere Neuropathie) führen kann, dient Chenodeoxycholsäure als therapeutisches Mittel der Wahl. Ataxie mit Augenmanifestationen findet sich beim Marinesco-Sjögren-Syndrom mit Katarakt als richtungsweisendes Symptom, bei CAMOS (zerebelläre Ataxie mit mentaler Retardierung, Optikusatrophie und Hautdefekten) sowie gelegentlich bei einer GM1-Gangliosidose, bei der bei ca. 50 % der Patienten sog. „Cherry-red Spots“ im Augenhintergrund bestehen. Eine Retinitis pigmentosa ist in Kombination mit hinterstrangbetonter Ataxie bei PCARP beschrieben, sowie eine Optikusatrophie, kombiniert mit Ataxie und Lernbehinderung bei Mutationen im MTPAP-Gen. Aus den genannten Häufigkeiten und phänotypischen Merkmalen lässt sich das in ▶ Abb. 11.2 dargestellte Vorgehen bei der genetischen Diagnostik rezessiver Ataxien empfehlen. 11 263 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 11.2 Genetik ausgewählter neurologischer Erkrankungen Neurologische Erkrankungen Erwäge anderen Vererbungsmodus (x-linked, mtDNA, dominant mit red. Penetranz) II früh beginnende Ataxie Ausschluss sekundärer Ursachen Familienanamnese vereinbar mit ARCA + + PEO? – Afferente Ataxie? – – FRDA cMRT = zerebelläre Atrophie? – – + AOA2 + AT α-Fetoprotein↑ CTX Cholesteanol↑ Phytansäure↑ Refsum AOA1 + SCAN1 Cholesterin↑+ Albumin↓ Coeruloplasmin↓ Wilson Vitamin E↓ AVED + Abeta – Pyramidenbahnzeichen? – + – – Demyelinisierende PNP? + ARSACS SYNE1 – Krabbe, MLD, GM1, GM2, NPC, ALD Abb. 11.2 Stufendiagnostische Vorgehensweise bei Verdacht auf eine rezessiv vererbte Ataxie (Quelle: [55]), mit freundlicher Genehmigung von Springer Science + Business Media X-chromosomal vererbte Ataxien Mehrere X-chromosomal vererbte Ataxieformen haben eine kongenitale Manifestation und gehen mit zerebellären Anomalien einher. Hier soll jedoch aufgrund seiner Bedeutung und Häufigkeit ausschließlich auf das FXTAS-Syndrom (Fragile-XTremor-Ataxie-Syndrom) eingegangen werden. FXTAS entsteht auf dem Hintergrund einer CCGRepeat-Expansion im FMR1-Gen zwischen 55 und 200 CGG-Repeats (Fragile-X-Prämutation) (Kap. Repeat-Expansionen als Ursache des Expressionsverlusts eines Gens, Kap. 13.2.4). Männliche und weibliche Prämutationsträger haben ein erhöhtes Risiko für eine neurodegenerative Erkrankung im Alter, die insbesondere durch Intentionstremor und Ataxie gekennzeichnet ist. 20–30 % der Frauen 264 entwickeln darüber hinaus eine vorzeitige Ovarialinsuffizienz (POI). Seltener findet man parkinsonoide Symptome, kognitive Einschränkungen und autonome Funktionsstörungen sowie Hypothyreose. Als beweisend für ein FXTAS gilt folgende Kombination: ● CGG-Repeat-Verlängerungen zwischen 55 und 200 ● Läsionen im mittleren Kleinhirnstiel und zerebellärem oder supratentoriellem Marklager im MRT ● Intentionstremor und/oder Ataxie Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. POLG 11.2 Genetik ausgewählter neurologischer Erkrankungen I Fragile-X-Syndrom In Fallbeispiel 13.1 (Kap. 13.2.4) wurde Antons klinische Symptomatik als Fragile-X-Syndrom nachgewiesen. An dieser Stelle soll auf eine besondere Problematik für die weitere Familie aufmerksam gemacht werden: Im Stammbaum zeigt sich bereits, dass der Großvater von Anton in höherem Alter eine zunehmende Zittrigkeit und Gangunsicherheit entwickelt hatte. Der Nachweis einer Prämutation (ca. 110 Repeats) im FMR1-Gen bestätigte die Vermutung des Vorliegens eines FXTAS. Mit dem Nachweis einer Prämutation von ca. 120 CCG-Einheiten bei der Mutter von Anton ergeben sich zahlreiche Aspekte, die keine primären Fragestellungen bei der Konsultation des Humangenetikers waren: ● Mit dem Nachweis eines Fragile-X-Syndroms bei Anton ist nun eine gesamte Familie mit der Fragestellung von Krankheitsursachen und Risiken involviert. Wir hatten bereits erfahren, dass die Schwester eine Testung und Beratung zunächst abgelehnt hat. ● Der Mutter von Anton ist nun ihr erhöhtes Risiko einer frühen Menopause bekannt, was die Familienplanung möglicherweise einschränkt. ● Wegen des X-chromosomalen Erbgangs könnten sogar weiter entfernte Verwandte mit der Auseinandersetzung einer genetisch bedingten Erkrankung konfrontiert sein. ● Der Großvater von Anton könnte sich evtl. für die Behinderung seines Enkels „verantwortlich“ fühlen, hier ist Beratung dringend empfohlen. ● Ein schwieriger Punkt ist zudem, dass sich die Mutter von Anton, wie eigentlich auch deren Schwester, mit der Situation konfrontiert sieht, dass auch sie ein Risiko für FXTAS im späteren Alter hat. Mit der Aufklärung der genetischen Ursachen bei ihrem Sohn besteht für sie selbst ein Risiko für eine spät manifestierende neurodegenerative Erkrankung sowie für andere Manifestationen bei Trägerschaft von Prämutationen (Kap. 13.2.4). Diese Problematik sollte unbedingt vor einer Testung besprochen werden. Merke H Für FXTAS gelten folgende Merkmale: ● Die klinische Penetranz der Prämutation ist variabel und altersabhängig. ● Männer wie Frauen können an einer FXTAS erkranken, wobei die Penetranz bei Frauen nur etwa halb so hoch ist. ● Das Erkrankungsrisiko nimmt mit dem Alter zu (bei Männern gilt als Richtwert: 50–59 Jahre 17 %; 60–69 Jahre 38 %; 70–79 Jahre 47 %; > 80 Jahre 75 %) [21]. ● Höhere Prämutations-Repeat-Längen gehen mit einem höheren Risiko für FXTAS einher [39]. Episodische Ataxien Auch wenn EA eine seltene Untergruppe darstellen (verlässliche Daten sind in der Literatur nicht ersichtlich), wollen wir sie wegen der klinischen Sichtbarkeit, des besonderen Verlaufs und der prinzipiellen Therapierbarkeit kurz ansprechen. Gegenwärtig unterscheidet man 7 genetische Unterformen (EA1–7; www.ncbi.nlm.nih.gov/ books/NBK25 442/). Nur 2 autosomal-dominant vererbte Unterformen, EA1 und EA2, sind relativ häufig. EA1, bei der Mutationen im KCNA1-Gen kausal sind, manifestiert sich mit kinesiogener Ataxie, die durch körperliche Anstrengung, Erschrecken und manchmal auch durch Positionswechsel ausgelöst werden kann. Diese „Attacken“, auch mit Krämpfen und Steifheit der Gliedmaßen einhergehend, manifestieren bereits im Kindesalter und können häufig auftreten, dauern aber selten länger als 15 Minuten. Bei der EA2 (CACNA1A-Mutationen) handelt es sich um eine nicht kinesiogene EA, die durch Stress, Kaffee, Alkohol und bestimmte Medikamente ausgelöst werden kann. Diese Attacken können Stunden bis Tage andauern und mit Übelkeit, Migräne, Hemiparese, Dystonie, Tinnitus und Diplopie einhergehen. Wichtig ist die differenzialdiagnostische Abgrenzung der EA, da sie mit Azetazolamid, 4-Aminopyridin und Carbamazepin gut behandelt werden können oder deren Auftreten verhindert werden kann. Eine Kaliumsubstitution ist bei EA2 besser wirksam als bei EA1. Meist nimmt die Häufig- 11 265 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Fallbeispiel 11.3 II keit der Attacken im Laufe des Lebens ab, es sollte aber unbedingt darauf geachtet werden, die genannten auslösenden Faktoren zu vermeiden. Neurologische Erkrankungen mit paraplegischen Bewegungsstörungen 11.2.5 Motoneuronerkrankungen Ähnlich komplex wie die Genetik und Klinik der Ataxien ist auch die der Paraplegien. Zum Teil bestehen auch mit den Ataxien überlappende Phänotypen. Genetisch wurden bisher 52 SPG-Genorte beschrieben, davon 19 autosomal-dominante, 27 autosomal-rezessive, eine maternal vererbte und 5 X-chromosomale Formen. Für 35 dieser Genorte konnten die zugrunde liegenden Gene bereits identifiziert werden (▶ Tab. 11.5). Man schätzt jedoch, dass ca. 50 % der kausalen genetischen Ursachen noch aufzudecken sind, was durch den Einsatz der neuen Next-Generation-Technologien auch in schneller Abfolge für einen Großteil der Patienten erfolgen wird (Kap. 15). Die Zahl der gegenwärtig bekannten Gene macht auch deutlich, dass bisher insbesondere für die seltenen Unterformen populationsspezifische Angaben über die Häufigkeit fehlen und Informationen über die phänotypische Manifestation der jeweiligen Erkrankung begrenzt sind. Generell sollten vor einer genetischen Diagnostik auch andere Ursachen einer Paraspastik wie Genetisch bedingte Motoneuronerkrankungen können das 1. Motoneuron (SPG: spastische Spinalparalyse), das 2. Motoneuron (SMA) oder aber beide Motoneurone betreffen (ALS). Bei der SPG finden wir primär eine Affektion der Beine, die zu Gehschwierigkeiten führt. Weitere Gliedmaßen können betroffen sein. Genaue Häufigkeitsangaben finden sich nicht, schätzungsweise sind 2–10 von 100 000 Personen an einer SPG erkrankt. Die ALS ist deutlich häufiger, hier liegt die Neuerkrankungsrate pro Jahr bei 2 Individuen je 100 000 Einwohner. Es handelt sich dabei um eine progrediente degenerative motorische Systemerkrankung. Die klinische Symptomatik bei der SMA wird bestimmt durch die Folgen eines selektiven Untergangs motorischer Vorderhornzellen und der motorischen Kerngebiete des Hirnstamms. Für alle Erkrankungen gibt es komplexe genetische Grundlagen, die in den folgenden Kapiteln erörtert werden. Tab. 11.5 Bekannte HSP-Gene (Quelle: [55]). HSP-Subtyp/Genlocus/ (OMIM) Gen/Genprodukt Erkrankungsalter (Jahre) Phänotyp/MRT Häufigkeit SPG3A, 14q22.1 (182 600) ATL 1, Atlastin-1 2–50 reine HSP mit langsamer Progression, variable axonale PNP, MRT: normal; allelische Erkrankung: hereditäre sensorische und autonome Neuropathie Typ 1 (OMIM 613 708) ∼ 10 % der AD HSP, ∼ 30–50 % der früh beginnenden (< 10 Jahre) AD HSP SPG4, 2p22.3 (182 601) SPAST, Spastin 1–74 meist reine HSP, PNP selten, MRT: meist normal; selten komplizierte Formen mit Demenz, Epilepsie, PNP, Tremor oder Ataxie ∼ 50 % der AD HSP; partielle Deletionen in 10 % der AD HSP; ∼ 10–15 % der S HSP SPG6, 15q11.2-q12 (600 363) NIPA1, Non-imprinted in Prader-Willi/ Angelman Syndrome Region Protein 1 12–35 reine HSP; vereinzelte Fälle mit Epilepsie oder PNP; meist keine PNP; MRT: normal selten (∼ 2 %) SPG8, 8q24.13 (603 563) KIAA0196, Strumpellin 18–69 reine HSP; keine PNP; MRT: spinale Atrophie unbekannt Autosomal-dominant 266 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Neurologische Erkrankungen 11.2 Genetik ausgewählter neurologischer Erkrankungen HSP-Subtyp/Genlocus/ (OMIM) Gen/Genprodukt Erkrankungsalter (Jahre) Phänotyp/MRT Häufigkeit SPG10, 12q13.3 (604 187) KIF5A, Kinesin Family Member 5A 2–51 reine oder komplizierte HSP: Amyotrophie, kognitive Beeinträchtigung; axonale PNP; MRT: normal ∼ 4–10 % der SPG4-negativen AD HSP SPG12, 19q13 (604 805) RTN2, Reticulon 2 1–22 reine HSP, rasch progredient; keine PNP; MRT: normal oder spinale Atrophie unbekannt SPG13, 2q33.1 (605 280) HSPD1, Heat Shock 60kD Protein 1 (Chaperon) 17–68 reine HSP; Neurophysiologie: normal; MRT: normal; potenzieller genetischer Modifier der SPG4; allelische Erkrankung: autosomal-rezessive hypomyelinisierende Leukodystrophie Typ 4 (HLD4; OMIM 612 233) selten (< 1 %) SPG17/Silver-Syndrom, 11q12.3 (270 685) BSCL 2, BerardinelliSeip congenital Lipodystrophy 2 (Seipin) 8–40 Spektrum der reinen HSP bis distale hereditäre motorische Neuropathie (dHMN Typ 5) inkl. SilverSyndrom; axonale PNP; MRT: spinale Atrophie; allelische Erkrankung: kongenitale generalisierte Lipodystrophie Typ 2 (OMIM 269 700); distale hereditäre motorische Neuropathie Typ V (OMIM 600 794) unbekannt meist reine HSP, selten Amyotrophie der Handmuskeln (Silver-Syndrom); selten axonale PNP; MRT: normal ~ 7 % der SPG4-negativen AD HSP komplizierte HSP: Fußdeformitäten unbekannt; auch in Kontrollen gefunden, Kausalität wird debattiert 11 SPG31, 2p11.2 (610 250) REEP1, Receptor Expression-Enhancing Protein 1 SPG33, 10q24.2 (610 244) ZFYVE27, Protrudin SPG42, 3q25.31 (612 539) SLC33A1, SoluteCarrier-Family 33 (Acetyl-CoA Transporter), Member 1 4–42 reine HSP; MRT: normal selten (1 Mutation in einer chinesischen Familie) CYP7B1, Oxysterol 7a-Hydroxylase 1 (OAH1) 1–30 meist reine HSP; keine PNP; MRT: Marklagerläsionen; komplizierte HSP: Optikusatrophie, Kleinhirnfunktionsstörung ~ 16 % der reinen AR HSP; ~ 3 % der S HSP 1–60 Autosomal-rezessiv SPG5, 8q12.3 (270 800) 267 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tab. 11.5 Fortsetzung Neurologische Erkrankungen II 268 HSP-Subtyp/Genlocus/ (OMIM) Gen/Genprodukt Erkrankungsalter (Jahre) Phänotyp/MRT Häufigkeit SPG7, 16q24.3 (607 259) SPG7, Paraplegin 8–42 reine oder komplizierte HSP: Optikusathrophie, zerebelläre Atrophie, variable PNP, Dysarthrie, Dysphagie; MRT: häufig Kleinhirnatrophie ~ 1,5–7 % der S/AR HSP SPG11, 15q21.1 (604 360) SPG11, Spatacsin 1–31 komplizierte HSP: kognitive Beeinträchtigung, Dysarthrie, Amyotrophie der Handmuskeln; häufig axonale PNP; MRT: dünnes Corpus callosum, kortikale Atrophie, Marklagerläsionen ~ 20 % der AR HSP SPG15, 14q24.1 (270 700) ZFYVE26, Spastizin 8–35 komplizierte HSP: kognitive Beeinträchtigung, Dysarthrie, Amyotrophie der Handmuskeln; häufig axonale PNP; MRT: dünnes Corpus callosum, kortikale Atrophie, Marklagerläsionen < 3 % der AR HSP; ~ 28 % der SPG11-negativen HSP mit dünnem Corpus callosum und mentaler Retardierung SPG18, 8p12-p11.21 (611 225) ERLIN-2, SPFH2 Kindheit komplizierte HSP: schwere kognitive Beeinträchtigung, Kontraktur; keine PNP; MRT: normal unbekannt SPG20/Troyer-Syndrom, 13q13.3 (275 900) SPG20, Spartin 1–20 komplizierte HSP: milde kognitive Beeinträchtiung, Dysarthrie, distale Amyotrophie, Kleinwuchs, häufig emotionale Labilität und Affektstörungen; keine PNP; MRT: Marklagerläsionen 1 Mutation in der „OldAmish“- Bevölkerung SPG21/MAST-Syndrom, 15q22.31 (248 900) SPG21, Maspardin 1–31 komplizierte HSP: schwere kognitive Beeinträchtigung, Psychose, Dysarthrie, zerebelläre Dysfunktion, langsam progredient; keine PNP; MRT: dünnes Corpus callosum, kortikale und zerebelläre Atrophie, Marklagerläsionen 1 Mutation in der „OldAmish“-Bevölkerung SPG28, 14q22.1 (609 340) DDHD1, DDHD Domain-Containing Protein 1 Kindheit reine HSP unbekannt (3 Familien) SPG30, 2q37.3 (610 357) KIF1A, Kinesin3 12–21 komplizierte HSP: Kleinhirnzeichen; PNP; MRT: keine oder milde Kleinhirnatrophie; allelische Erkrankung: hereditäre sensorisch-autonome Neuropathie Typ2 (HSAN2; OMIM 614 213) unbekannt (3 Familien) Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tab. 11.5 Fortsetzung 11.2 Genetik ausgewählter neurologischer Erkrankungen HSP-Subtyp/Genlocus/ (OMIM) Gen/Genprodukt Erkrankungsalter (Jahre) Phänotyp/MRT Häufigkeit SPG35, 16q23.1 (612 319) FA2H, Fatty Acid 2Hydroxylase 6–11 reine und komplizierte HSP: kognitive Beeinträchtigung, Optikusatrophie, Opthalmoplegie, Dysarthrie, Ataxie, Krampfanfälle, Dystonie; keine PNP; MRT: milde Marklagerläsionen, Groß- und Kleinhirnatrophie, T 2-Signalabsenkungen des Globus pallidus unbekannt (7 Familien) SPG39, 19p12.2 (612 020) PNPLA6, Patatin-like Phospholipase Domain Containing 6 Kindheit komplizierte HSP: axonale Neuropathie; MRT: spinale Atrophie unbekannt (2 Familien) SPG44, 1q42.13 (613 206) GJC2, Gap Junction Protein Connexin 47 10–31 komplizierte HSP: milde kognitive Beeinträchtigung, milde bis moderate Kleinhirndysfunktion, Dysarthrie; keine PNP; MRT: dünnes Corpus callosum, Marklagerläsionen; allelische Erkrankung: hypomyelinisierende Leukodystrophie Typ 2 (Pelizaeus-Merzbacher-like Disease (PMLD; OMIM 608 804) unbekannt (1 Familie) SPG46, 9p13.3 (n.a.) GBA2, Glucosidase, Beta (Bile Acid) 2 n.a. komplizierte HSP: mentale Retardierung, Katarakt, Hypogonadismus bei männlichen Patienten; MRT: dünnes Corpus callosum unbekannt (4 Familien) 11 SPG47, 1p13.2 (614 066) AP4B1, Adaptorrelated Protein Complex 4, Beta-1 Subunit Kindheit komplizierte HSP: mentale Retardierung, Mikrozephalus, Epilepsie, Kleinwuchs; MRT: dünnes Corpus callosum, Marklagerläsionen unbekannt (2 Familien) SPG48, 7p22.2 (613 647) AP5Z1 (KIAA0415), Adaptor-related Protein Complex 5, Zeta-1 Subunit Erwachsenenalter reine HSP unbekannt (1 Familie) SPG49, 4q25 (n.a.) CYP2U1, Cytochrome P450, Family 2, Subfamily U, Polypeptide 1 0–8 reine oder komplizierte HSP: mentale Retardierung, axonale Neuropathie; MRT: dünnes Corpus callosum, Marklagerläsionen unbekannt (5 Familien) SPG50, 7q22.1 (612 936) AP4M1, Adaptor-related Protein Complex 4, Mu-1 Subunit Kindheit komplizierte HSP: schwere mentale Retardierung, Mikrozephalus, adduzierte Daumen; MRT: Ventrikulomegalie, Marklagerläsionen, variable zerebelläre Atrophie unbekannt (1 Familie) 269 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tab. 11.5 Fortsetzung Neurologische Erkrankungen II HSP-Subtyp/Genlocus/ (OMIM) Gen/Genprodukt Erkrankungsalter (Jahre) Phänotyp/MRT Häufigkeit SPG51, 15q13.3 (613 744) AP4E1, Adaptor-related Protein Complex 4, Epsilon-1 Subunit Kindheit komplizierte HSP: schwere mentale Retardierung, Mikrozephalus, Spitz-Klumpfuß, Epilepsie; MRT: erweiterte Ventrikel, kortikale und zerebelläre Atrophie, Marklagerläsionen unbekannt (2 Familien) SPG52, 14p11.2 (614 067) AP4S1, Adaptor-related Protein Complex 4, Sigma-1 Subunit Kindheit komplizierte HSP: schwere mentale Retardierung, Mikrozephalus, Spitz-KlumpFuß unbekannt (1 Familie) SPG54, 8p11.23 (615 033) DDHD2, DDHD Domain-containing Protein 2 <2 komplizierte HSP: mentale Retardierung; MRT: dünnes Corpus callosum unbekannt (3 Familien) SPG55, 12q24.31 (615 035) C12orf65, Chromosome 12 open Reading Frame 65 Kindheit komplizierte HSP: Optikusathrophie, periphere Neuropathie; allelische Erkrankung: kombinierter Defekt der oxidativen Phosphorylierung Typ 7 (COXPD7; OMIM 613 559) unbekannt (1 Familie) SPG1, Xq28 (303 350) L1CAM, Neural Celladhesion Molecule L 1 (NCAM) perinatal komplizierte HSP: kognitive Beeinträchtigung, adduzierte Daumen (in 50 % der Fälle); MASA-Syndrom; MRT: Hydrozephalus, dünnes Corpus callosum unbekannt SPG2, Xq22.2 (312 920) PLP1, Proteolipid Protein 1 (MPLP) 1–18 reine oder komplizierte HSP: Nystagmus, Ataxie; MRT: Marklagerläsionen; allelische Erkrankung: Pelizaeus-Merzbacher-Erkrankung (OMIM 312 080) unbekannt SPG22/Allan-HerndonDudley-Syndrom (AHDS), Xq13.2 (300 523) SLC16A2, Monocarboxylate Thyroid Hormone Transporter 8 (MCT 8) Kindheit komplizierte HSP: kognitive Beeinträchtigung, generalisierte Schwäche, Hypotonie insb. der Nackenmuskeln in der Kindheit, Dystonie; erhöhtes Trijodthyronin, erniedrigtes freies Thyroxin; MRT: variable kortikale und subkortikale Atrophie unbekannt X-chromosomal AD: autosomal-dominant; BMP: Bone morphogenetic Protein; CMT: Central Motor Conduction Time; ER: endoplasmatisches Retikulum; OMIM: Online Inheritance In Man, Datenbank der Gene, die – wenn verändert – mit einer Krankheit assoziiert sind; PNP: periphere Neuropathie; S: sporadisch 270 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tab. 11.5 Fortsetzung 11.2 Genetik ausgewählter neurologischer Erkrankungen Anamnese und neurologischer Befund nein ja auffällig SPAST-Diagnostik (Sanger-Sequenzierung und Gendosis) auffällig Befund unauffällig nein Spor-HSP AR-HSP Befund unauffällig ja AD-HSP Sanger-Sequenzierung (z.B. SPG11, L1CAM) ja „gene panel sequencing“ (Next-Generation-Sequencing, inklusive Gendosis für SPAST, SPG7, SPG11) Befund Abb. 11.3 Stufendiagnostische Vorgehensweise zur Abklärung einer hereditären Spinalparalyse (Quelle: [57]), mit freundlicher Genehmigung von Springer Science + Business Media. Entzündungen (multiple Sklerose), Fehlbildungen, metabolische Störungen (Vitamin-B12-Mangel, Morbus Krabbe) und mechanische Rückenmarkserkrankungen (Myelopathien) ausgeschlossen werden. Momentan wird aus genetischer Sicht eine Stufendiagnostik insbesondere aufgrund der Häufigkeit der einzelnen Unterformen vorgenommen. Die weltweit sicherlich häufigste Form ist die SPG4 mit Mutationen im SPAST-Gen [4]. Schätzungsweise werden ca. 30–50 % aller dominant vererbten Formen durch Mutationen im SPAST-Gen verursacht. Da aber sowohl eine verminderte Penetranz (Penetranzrate bisher nicht bekannt) als auch seltene Neumutationen dokumentiert sind, sollte das SPAST-Gen auch bei sporadisch erscheinender Paraplegie untersucht werden (Detektionsrate unabhängig vom Vererbungsmodus 12 %) [11]. Männer scheinen einen früheren und schwereren Phänotyp zu entwickeln. Große und kleine Insertionen und Deletionen finden sich häufig, sodass Gendosisanalysen bei einem DNA-Test unumgänglich sind. Eine klinische Einordnung der Patienten in reine und komplizierte SPG hilft hier wenig, da beide Formen manchmal sogar in derselben Familie, auch mit deutlich unterschiedlichem Erkran- kungsalter (1–74 Jahre) und Verläufen, vorkommen. Neben der SPG4 ist auch eine Analyse des SPG7Gens (Paraplegin-Gen) bei sporadisch erscheinenden Patienten indiziert. Bei dieser autosomal-rezessiv vererbten Form der Paraplegie (oftmals Paraspastik) besteht bei etwa 50 % der Patienten auch eine Kleinhirndegeneration im Sinne einer spastischen Ataxie. Im Sinne einer Stufendiagnostik kann man insbesondere bei früh beginnender autosomal-dominanter SPG auch erwägen, SPG3A (Atlastin-1-Gen) zu testen. Mutationen in diesem Gen sollen für ca. 10 % der dominanten Paraplegien und insbesondere für 30–50 % der früh (vor dem 10. Lebensjahr) beginnenden Formen verantwortlich sein. Ebenfalls früh beginnend ist die SPG11 (Spatacsin-Gen), die meist mit kognitiven Einschränkungen und rascher Progredienz sowie einem dünnen Balken im MRT einhergeht. Eine Übersicht über bekannte SPG-Gene, deren Häufigkeit und assoziierte Phänotypen findet sich bei Schöls et al. [55]. 11 271 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Typischer HSP-Phänotyp? (z.B. TCC-HSP, L1-Syndrom) Neurologische Erkrankungen Die genetische Aufklärung der spastischen Paraplegien (SPG) ist in ständiger Entwicklung. Wir haben mit der Einführung der Panel-Diagnostik mehrere Fehlbewertungen bei Einzelgenanalysen anderer Labore nachweisen müssen, bspw. in der Überinterpretation einzelner Mutationen oder aufgrund untypischer klinischer Manifestationen. Daher sollte man sich vor einer genetischen Beratung zu spastischen Paraplegien über den aktuellen Wissensstand zu Phänotypen und Genotypen der SPG, bspw. über GeneReviews, informieren (www.ncbi.nlm.nih.gov/books/NBK1116/). Bei der genetisch basierten Pathogeneseeinteilung der SPG beobachtet man gegenwärtig einen starken Wissenszuwachs, der zur Entwicklung von neuen Biomarkern und Therapiekonzepten führt, sodass man Patienten mit einer SPG unbedingt an ein spezialisiertes Zentrum anbinden sollte. II Spinale Muskelatrophien Bei systematischer Darstellung gehören die SMA zu der Gruppe der Motoneuronerkrankungen. Da sie aber klinisch als Muskelerkrankungen imponieren, werden sie im Kap. 12.9 dargestellt. Amyotrophe Lateralsklerose (LouGehring-Erkrankung) Die ALS mit einer Häufigkeit von ca. 4–8 auf 100 000 betrifft sowohl das obere wie untere Motoneuron, was sich in Form von Hyperreflexie, verstärktem Muskeltonus und Muskelschwäche äußert. Die Erstmanifestation variiert von Patient zu Patient und auch innerhalb einer Familie. Manche Patienten stolpern, andere zeigen einen schwachen Handgriff, wieder andere haben bulbäre Zeichen wie Dysarthie und Dysphagie. Unabhängig von der Erstmanifestation sind nach und nach weitere Muskeln betroffen. Bei familiären ALS-Formen (FALS) (▶ Tab. 11.6) ist die durchschnittliche Erst- Tab. 11.6 Häufigkeit der autosomal-dominanten und -rezessiven FALS. Locus-Name (Gensymbol) Genprodukt Anzahl der Patienten mit FALS Autosomal-dominant vererbte FALS ALS 1 (SOD1) ALS 4 1 (SETX) ALS 6 (FUS/TLS) Superoxide Dismutase 1(Cu-Zn) 20 % Motorneuropathie mit pyramidalen Zeichen, Senataxin, auch Ursache der AOA2 selten RNA-bindendes Protein FUS ~ 4% Finkel Typ SMA or SMA IV, vesikelassoziiertes membranassoziiertes Protein selten ALS 9 (ANG) Angiogenin selten ALS 10 (TARDBP) TAR DNA-binding Protein 43 (TDB-43) 1–4 % ALS 11 (FIG4) Polyphosphoinositid-Phosphatase selten ALS/FTD1 (C9orf72) C 9FTD/ALS, s. auch frontotemporale Demenz 23–30 % ALS 14 (VCP) ATPase des endoplasmischen Reticulums, auch als Ursache von Morbus Paget mit frontotemporaler Demenz unbekannt ALS 2 Alsin selten ALS 12 (OPTN) Optineurin, bei sporadischer, autosomal-dominanter und bei autosomal-rezessiv vererbter ALS selten SPG20 Spartin, Troyer-Syndrom, spastische Paraplegie mit Dsarthrie, distal betonter Amyotrophie, milder Entwicklungsverzögerung, Kleinwuchs selten Ubiquilin-2, mit und ohne FTD, X-chromosomal dominant selten ALS 8 1 (VAPB) Autosomal-rezessiv vererbte FALS X-chromosomale Form der ALS ALS 15 (UBQLN2) 1 272 betrifft sowohl das 1. wie auch das 2. Motoneuron Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. H Merke manifestation ca. 10 Jahre früher (46 Jahre) als bei sporadischen Formen (56 Jahre). Der Krankheitsverlauf ist stark progredient und führt aufgrund der schwächer werdenden Atemmuskulatur zum Tod. Folgende Stufendiagnostik wird momentan bei der molekulargenetischen Analyse der ALS vorgeschlagen: ● Aufgrund seiner Häufigkeit und der Nichterfassung sowohl durch herkömmliche Sanger-Sequenzierung als auch durch die neuen „Next-Generation-Technologien“ (Kap. 15) sollte eine Hexanucleotid-Repeat-Expansion in C9orf72 ausgeschlossen bzw. nachgewiesen werden. ● Insbesondere bei autosomal-dominantem Erbgang ist anschließend die Analyse des SOD1Gens indiziert. Die Interpretation von Mutationen im SOD1-Gen ist schwierig, da sie eine hohe klinische Variabilität aufweisen. ● SOD1-Gendiagnostik ist auch bei sporadischem Vorkommen der ALS indiziert, da ca. 3 % der sporadischen Patienten in diesem Gen eine Mutation aufweisen. ● Auch wenn es für einige ALS-Formen klinische Hinweise auf das spezielle Gen gibt (z. B. Senataxin-Gen bei begleitenden Pyramidenbahnzeichen und Manifestation im Erwachsenenalter, Alsin 2 bei Manifestation in der Kindheit und primärer Affektion der unteren Motoneurone), ist eine Gen-Panel-Diagnostik aufgrund der großen klinischen und genetischen Heterogenität die Methode der Wahl einer effizienten Diagnostik. 11.2.6 Periphere Neuropathien Allgemeine Einführung in die Polyneuropathien Generalisierte Erkrankungen des peripheren Nervensystems werden im Allgemeinen als PNP bezeichnet. Sie können sich durch sensible Reiz- und Ausfallerscheinungen wie Missempfinden insbesondere in den Beinen, Wärme- und Kälteparästhesien, Taubheitsgefühle oder auch schmerzlose Wunden manifestieren, aber auch durch motorische Reiz- und Ausfallerscheinungen wie Muskelzucken, Muskelkrämpfe, -schwäche und -atrophie. Bei manchen PNP finden sich auch autonome Symptome wie orthostatische Hypotonie, Hypo- oder Anhidrosis, kardiovaskuläre oder gastrointestinale Funktionsstörungen. Diagnostisch hinweisend kann der Verlauf sein, hier unterscheidet man einen akuten Verlauf (< 4 Wochen), einen subakuten (4–8 Wochen) und einen chronischen Verlauf (> 8 Wochen). Auf die zahlreichen Ursachen von Neuropathien kann im Rahmen dieses Abschnitts nicht eingegangen werden. Insbesondere sollte man bei der Eigenanamnese jedoch Grunderkrankungen wie Diabetes, Nierenerkrankungen oder Kollagenosen erfragen, sowie Unfälle oder Medikamenten- bzw. Drogeneinnahme (insbesondere Alkoholmissbrauch). Die klinische Differenzialdiagnose obliegt unbedingt einem neurologischen Spezialisten. Die genetische Differenzialdiagnose hat ihren Stellenwert erst nach Ausschluss zahlreicher infektiöser oder tumorbedingter Ursachen (S 1-Leitlinien für Diagnostik und Therapie in der Neurologie, Kapitel „Diagnostik bei Polyneuropathien“), oder aufgrund einer klaren Familienanamnese mit weiteren Erkrankten gleicher Symptomatik. Genetik der Polyneuropathien Die genetisch bedingten peripheren Neuropathien können aufgrund ihrer klinischen Manifestation, ihres Erbgangs und der Elektrophysiologie klassifiziert werden. Die weitaus größte Gruppe stellen die hereditären motorisch-sensiblen Neuropathien (HMSN), die auch als Charcot-MarieTooth-Neuropathie (CMT) bezeichnet werden und mit einer Häufigkeit von 1:2500 auftreten. Die hereditären motorischen Neuropathien (HMN) weisen Übergänge zu den distalen SMA auf. Sehr viel seltener sind die rein sensiblen bzw. autonomen Neuropathien (HSN bzw. HSAN). Innerhalb der HMSN/CMT-Formen unterscheidet man die autosomal-dominant vererbten demyelinisierenden (CMT 1) von den axonalen (CMT 2) Formen sowie die autosomal-rezessiv vererbten und die X-chromosomalen (CMTX) Subtypen, wobei es zahlreiche Mischtypen gibt, die die Klassifikation erschweren. Eine weitere wichtige Form, die differenzialdiagnostische Bedeutung hat, ist die PNP mit Neigung zu Druckparesen (HNPP). Zu der Gruppe der Neuropathien zählt man des Weiteren die hereditären Amyloidneuropathien. Bei den PNP handelt sich um ein sehr heterogenes Krankheitsbild mit über 44 bekannten Genen und mehr als doppelt so vielen mittels Kopplungsanalysen identifizierte Genorten, die in schneller Abfolge sicher in den kommenden Jahren weitest- 11 273 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 11.2 Genetik ausgewählter neurologischer Erkrankungen gehend identifiziert sein werden. Es empfiehlt sich daher insbesondere bei Patienten, bei denen die molekulargenetische Diagnostik bisher zu keiner Klärung führte, eine wiederholte Vorstellung in der Beratung in angemessenen zeitlichen Abständen. Ein aktueller Wissensstand zu den bekannten Genen findet sich bspw. bei www.molgen.ua.ac.be/ CMTMutations/Mutations/MutByGene.cfm. II Hereditäre demyelinisierende Polyneuropathie Nach neueren Studien liegt der Anteil der genetisch identifizierbaren CMT 1-Formen in einer Größenordnung von 60–70 % [46]. Die häufigste genetische Ursache der CMT ist der Typ1A, der verursacht wird durch eine 1,4-Mb-Duplikation der chromosomalen Region 17p11.2–12, die das periphere Myelin-Protein-22-Gen (PMP22-Gen) enthält. Eine stark auf elektrophysiologischen Daten basierende Stufendiagnostik (Nervenleitgeschwindigkeit zwischen 15 und 35 m/s, unter 15 m/s und zwischen 35 und 45 m/s, sowie normale Nervenleitgeschwindigkeit von über 45 m/s) zur genetischen Analyse der CMT wurde durch Miller et al. vorgeschlagen [43], hat aber aufgrund der starken Schwankungen bei der Messung der Nervenleitgeschwindigkeiten und der großen Variabilität bei identischen Gendefekten in der Praxis kaum eine Bedeutung. Als internationale Referenz gilt für die CMT 1 ein Cut-off für die motorische Nervenleitgeschwindigkeit des N. medianus von < 38 m/s. In diesen Fällen wird zunächst die Diagnostik der PMP22-Duplikation empfohlen, gefolgt von CMT 1X (GJB1-Cx32) und CMT 1B (MPZ), erst danach sollte die Sequenzierung des PMP22-Gens oder die Testung weiterer PNP-Gene erfolgen, die eine CMT 1 verursachen. Hereditäre axonale Polyneuropathie Bei den axonal betonten PNP (CMT 2) ist die genetische Aufklärungsrate deutlich geringer als bei der CMT 1 und liegt bei etwa 20–30 %. Am häufigsten sind Mutationen im Mitofusin-2-Gen (MFN2Gen), gefolgt vom GJB1-Cx32-Gen, während MPZund NEFL-Mutationen nur einen kleineren Anteil einnehmen. Hier findet man oftmals normale oder nur geringfügig reduzierte Nervenleitgeschwindigkeiten, bei rascher axonaler Degeneration kann die elektroneurografische Reizleitung jedoch vollstän- 274 dig ausbleiben, sodass dann eine Abgrenzung von einer CMT 1 schwierig ist. Zusätzliche Manifestationen können auf bestimmte Gendefekte hinweisen. So entwickeln ca. 10–20 % aller Patienten mit einer MFN2-Mutation eine Optikusatrophie, wobei man die Kombination mit einer hereditären motosensorischen Neuropathie auch als HMSN IV bezeichnet. Bei Patienten mit MFN2- oder BSCL 2-Mutationen können spastische Tonuserhöhungen oder Pyramidenbahnzeichen vorkommen, was dann als HMSN V bezeichnet wird. Hier zeigt sich deutlich, dass die auf Symptomen beruhende Nomenklatur der HMSN aus genetischer Sicht überarbeitet werden sollte. Mutationen im MFN2-Gen haben meist eine dominante Manifestation und treten zu 30–40 % de novo auf. Compound-heterozygote bzw. homozygote Mutationen wurden in Fällen mit einem sehr frühen Beginn beschrieben (Überblick in [66]). Bei den seltenen autosomal-rezessiven PNP sind sehr unterschiedliche Gendefekte beschrieben, von denen das SH3TC 2- und das GDAP1-Gen die größte Bedeutung haben. Hier finden sich meist ein frühes Erkrankungsalter und ein relativ schwerer Verlauf. In geeigneten Familien (betroffene Geschwister, elterliche Blutsverwandtschaft) kann eine genetische Lokalisierung über Kopplungsuntersuchungen hilfreich sein. Abzugrenzen sind Formen, die eine zusätzliche Organmanifestation aufweisen, so zeigt sich bei Mutationen im Gigaxonin (GAN)-Gen häufig eine ZNS-Beteiligung (periventrikuläre und zerebelläre „White-Matter“-Läsionen und/oder zerebrale, zerebelläre und Hirnstammatrophien), oftmals mit Entwicklungsverzögerung und Gangschwierigkeiten sowie charakteristischem krausem Haar einhergehend. Bei dieser „Giant-axonalen Neuropathie“ sind neuropathologisch sehr dünn myelinisierte und geschwollene Axone charakteristisch. Der klinische Verlauf ist stark progredient und führt meist zu Rollstuhlpflichtigkeit bereits im 2. Lebensjahrzehnt. „Giant Axons“ sind nicht für Mutationen im GAN-Gen spezifisch, sondern können auch bei Patienten mit Mutationen im SH3TC 2(CMT 4C) und im NEFL-Gen (CMT 2E/CMT 1F) hervorgerufen werden. Weitere HMSN gehen mit geistiger Behinderung und Gehirnfehlbildungen einher, bspw. mit Corpus-Callosum-Agenesie, wie eine Form in der französisch-kanadischen Bevölkerung von Quebec, die durch Mutationen in einem Kaliumkanal (KCC 3-Gen) verursacht werden. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Neurologische Erkrankungen 11.2 Genetik ausgewählter neurologischer Erkrankungen Merke H Klinisch-genetische Heterogenität bei Neuropathien des frühen Kindesalters Pränatale und infantile Neuropathien sind selten und extrem heterogen; mehr als 30 Genorte sind bekannt. Die Erkrankungsgruppe zeigt ein sehr variables Erkrankungsalter. Stark überlappende Phänotypen mit der Gruppe der SMA oder mit mitochondrialen Erkrankungen (SCO2-, POLG 1-, TK2-, DGUOK-, MPV17-Gen) sind zahlreich beschrieben. Aufgrund der möglichen Beteiligung anderer Organsysteme, insbesondere des Gehirns, des Herzens, der Nieren und der Leber, sollte eine umfangreiche klinisch-diagnostische Abklärung erfolgen. Hereditäre Neuropathie mit Neigung zu Druckparesen Während bei einem Großteil der Patienten mit einer CMT 1A eine PMP22-Duplikation ursächlich ist, findet man bei ca. 80 % der Patienten mit HNPP das genetische Pendant dazu, die heterozygote Deletion des PMP22-Gens. Homozygote Deletionen des PMP22-Gens sind letal, glücklicherweise jedoch äußerst selten. Bei einem kleinen Teil der Patienten liegen Punktmutationen im PMP22-Gen vor. Die Beeinträchtigung aufgrund mechanischer Beanspruchung wie Kompression oder sich wiederholenden Bewegungen der betroffenen Gliedmaßen sind oft reversibel. Es gibt bei chronischen Verläufen jedoch durchaus Übergänge zu demyelinisierenden PNP. Distale hereditäre sensorisch-autonome Neuropathien Im Gegensatz zu Patienten mit einer CMT haben Patienten mit einer HSN/HSAN aufgrund einer herabgesetzten Sensibilität und autonomer Funktionsstörungen oft Verletzungen. Dies kann zu Ulzera insbesondere an den Füßen oder auch zu Osteomyelitis bis hin zu Amputationen führen. Die genetische Aufklärung ist durch große Heterogenie erschwert und liegt selbst bei familiären Fällen bisher nicht höher als 10–20 %. Mutationen in Serinpalmitoyltransferase (SPTLC 1 und 2), der Rasverwandten GTPase 7 (RAB7) sowie von Atlastin1 (ATL 1) sind bekannt. Kürzlich wurde eine HSANUnterform beschrieben, die mit Hörverlust und Demenz einhergehen kann und autosomal-dominant vererbt wird. Sie wird durch Mutationen in einer DNA-Methyltransferase (DNMT 1) hervorgerufen. Diagnostisch wichtig ist, dass insbesondere Mutationen der autosomal-dominant vererbten Formen bei sporadischen HSAN vorkommen. Autosomal-rezessive Formen (WNK1, KIF1A, FAM134B), u. a. einhergehend mit Gelenkskontrakturen (NTRK1, NGFB), Knochenbrüchen (NGFB) oder Hyperhidrose (IKBKAP), wurden beschrieben (Überblick in [40]). Die klinische Variabilität und die komplexen genetischen Pathomechanismen der hereditären PNP unterstreichen die Ansprüche an die neurologische und genetische Fachkompetenz. 11 275 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Bei Auftreten erster Symptome einer axonal betonten PNP im Erwachsenenalter sollte mit der Testung von MFN2 begonnen und, falls negativ, durch Testung von GJB1/Cx32 MPZ und BSCL 2 ergänzt werden. Erwähnenswert, wenn auch sehr selten, ist, dass autosomal-dominant vererbte Formen wie CMT 2 M, das durch Mutationen im Dynamin-2-Gen verursacht wird, auch eine autosomaldominant vererbte zentronukleäre Myopathie hervorruft. Homozygote Mutationen im DNM2-Gen verursachen jedoch ein letales kongenitales Syndrom, das mit Akinesie, Gelenkkontrakturen, schweren Skelettfehlbildungen und Blutungen des Gehirns und der Retina einhergeht [34]. Wie für andere neurologische Erkrankungen gibt es auch für die Neuropathien zahlreiche Beispiele, dass Mutationen eines Gens unterschiedliche Phänotypen hervorrufen. So können Mutationen im TRPV4-Gen (TRPV4: Transient Receptor Potential Vanilloid 4) sowohl mit einer kongenitalen distalen SMA, einer scapuloperonealen SMA (SPSMA) wie auch mit einer axonalen CMT (CMT 2C) einhergehen. Insbesondere bei den infantilen axonalen Neuropathien (IAN) ist eine genetische Abklärung notwendig, um die klinisch notwendige Betreuung der Kinder ausreichend zu gewährleisten; so gibt es zahlreiche IAN, bei denen die Augen, Herz, Leber oder das Gehirn betroffen sind oder die auch zu schwerwiegenden Atemstörungen führen (Überblick in [66]). Beispielsweise können Patienten mit SPSMA oder mit CMT 2C bereits im Neugeborenenalter Stimmbandparesen haben, u. U. kann sogar ein Tracheostoma notwendig sein.











