Neues zum tripelnegativen Mammakarzinom
Werbung
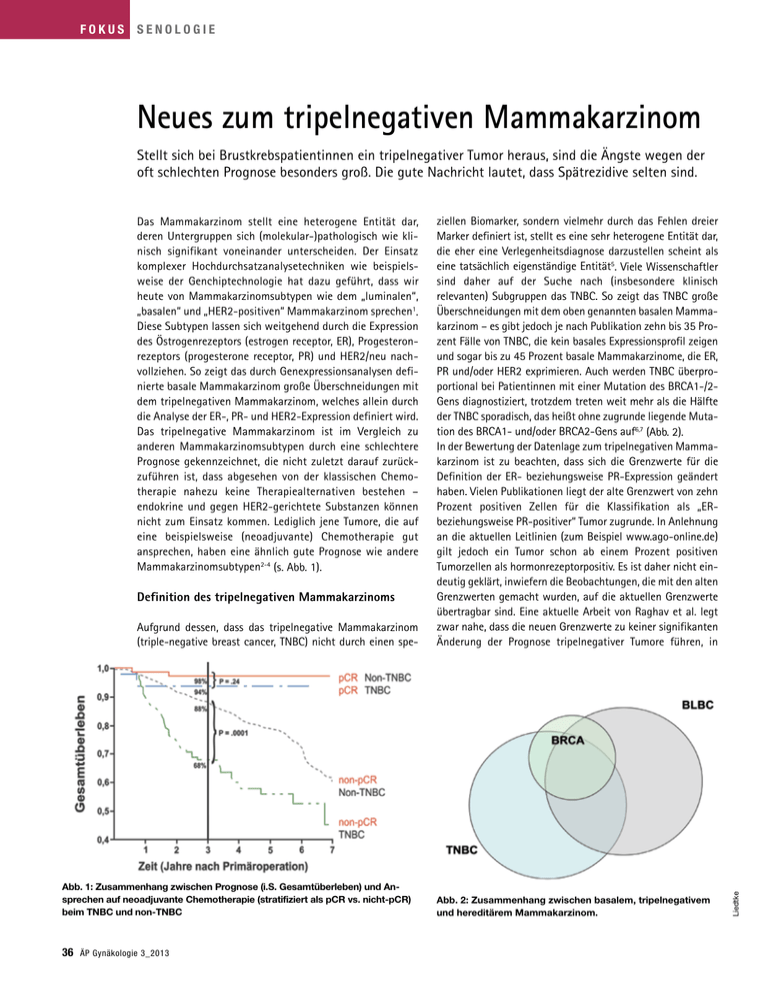
fokus Senologie Neues zum tripelnegativen Mammakarzinom Stellt sich bei Brustkrebspatientinnen ein tripelnegativer Tumor heraus, sind die Ängste wegen der oft schlechten Prognose besonders groß. Die gute Nachricht lautet, dass Spätrezidive selten sind. Definition des tripelnegativen Mammakarzinoms Aufgrund dessen, dass das tripelnegative Mammakarzinom (triple-negative breast cancer, TNBC) nicht durch einen spe­ Abb. 1: Zusammenhang zwischen Prognose (i.S. Gesamtüberleben) und Ansprechen auf neoadjuvante Chemotherapie (stratifiziert als pCR vs. nicht-pCR) beim TNBC und non-TNBC 36 ÄP Gynäkologie 3_2013 ziellen Biomarker, sondern vielmehr durch das Fehlen dreier Marker definiert ist, stellt es eine sehr heterogene Entität dar, die eher eine Verlegenheitsdiagnose darzustellen scheint als eine tatsächlich eigenständige Entität5. Viele Wissenschaftler sind daher auf der Suche nach (insbesondere klinisch ­relevanten) Subgruppen das TNBC. So zeigt das TNBC große Überschneidungen mit dem oben genannten basalen Mammakarzinom – es gibt jedoch je nach Publikation zehn bis 35 Prozent Fälle von TNBC, die kein basales Expressionsprofil zeigen und sogar bis zu 45 Prozent basale Mammakarzinome,­die ER, PR und/oder HER2 exprimieren. Auch werden TNBC überproportional bei Patientinnen mit einer Mutation des BRCA1-/2Gens diagnostiziert, trotzdem treten weit mehr als die Hälfte der TNBC sporadisch, das heißt ohne zugrunde liegende Mutation des BRCA1- und/oder BRCA2-Gens auf6,7 (Abb. 2). In der Bewertung der Datenlage zum tripelnegativen Mamma­ karzinom ist zu beachten, dass sich die Grenzwerte für die Definition der ER- beziehungsweise PR-Expression geändert haben. Vielen Publikationen liegt der alte Grenzwert von zehn Prozent positiven Zellen für die Klassifikation als „ER­beziehungsweise PR-positiver“ Tumor zugrunde. In Anlehnung an die aktuellen Leitlinien (zum Beispiel www.ago-online.de) gilt jedoch ein Tumor schon ab einem Prozent positiven ­Tumorzellen als hormonrezeptorpositiv. Es ist daher nicht eindeutig geklärt, inwiefern die Beobachtungen, die mit den alten Grenzwerten gemacht wurden, auf die aktuellen Grenzwerte übertragbar sind. Eine aktuelle Arbeit von Raghav et al. legt zwar nahe, dass die neuen Grenzwerte zu keiner signifikanten Änderung der Prognose tripelnegativer Tumore führen, in Abb. 2: Zusammenhang zwischen basalem, tripelnegativem und hereditärem Mammakarzinom. Liedtke Das Mammakarzinom stellt eine heterogene Entität dar, deren Untergruppen sich (molekular-)pathologisch wie klinisch signifikant voneinander unterscheiden. Der Einsatz komplexer Hochdurchsatzanalysetechniken wie beispielsweise der Genchiptechnologie hat dazu geführt, dass wir heute von Mammakarzinomsubtypen wie dem „luminalen“, „basalen“ und „HER2-positiven“ Mammakarzinom sprechen1. Diese Subtypen lassen sich weitgehend durch die Expression des Östrogenrezeptors (estrogen receptor, ER), Progesteronrezeptors (progesterone receptor, PR) und HER2/neu nachvollziehen. So zeigt das durch Genexpressionsanalysen definierte basale Mammakarzinom große Überschneidungen mit dem tripelnegativen Mammakarzinom, welches allein durch die Analyse der ER-, PR- und HER2-Expression definiert wird. Das tripelnegative Mammakarzinom ist im Vergleich zu ­anderen Mammakarzinomsubtypen durch eine schlechtere Prognose gekennzeichnet, die nicht zuletzt darauf zurück­ zuführen ist, dass abgesehen von der klassischen Chemo­ therapie nahezu keine Therapiealternativen bestehen – ­endokrine und gegen HER2-gerichtete Substanzen können nicht zum Einsatz kommen. Lediglich jene Tumore, die auf eine beispielsweise (neoadjuvante) Chemotherapie gut ­ansprechen, haben eine ähnlich gute Prognose wie andere Mammakarzinomsubtypen2-4 (s. Abb. 1). dieser­retrospektiven Arbeit waren die verschiedenen Gruppen jedoch unbalanciert und zum Teil sehr klein8. Es bedarf daher weiterer systematischer Analysen, ehe die Bedeutung der geänderten Klassifikation geklärt ist. In einer weiteren Studie untersuchten Iwamoto et al. den ER-Status mittels Immunhistochemie beziehungsweise Affymetrix-Genchip-Analyse bei 465 Patientinnen mit Mammakarzinom. Die mittels Affymetrix-­ Genchip bestimmte Expression des ER-Gens (ESR1) in Tumoren mit ≥10 Prozent ER-Positivität war signifikant höher im Vergleich zu Tumoren mit ein bis neun Prozent Positivität oder ER-Negativität. Die E­ xpression einer ER-Gensignatur bestehend aus 106 mit ER assoziierten Genabschnitten bei ER-negativen Tumoren und Tumoren mit ein bis neun Prozent ERPositivität war vergleichbar, ­ jedoch bei Tumoren mit ER-Expression von ≥10 Prozent signifikant höher9. Cheang et al. untersuchten die Verteilung intrinsischer Subtypen von 48 Tumoren mit „grenzwertiger ER-Expression“ mittels ­PAM-50. Insgesamt wurden 17 Prozent dieser Fälle tatsächlich auch als „basal-like“ stratifiziert; 25 beziehungsweise 21 Prozent der Fälle wurden jedoch als luminal A und luminal B und 29 Prozent sogar in die „HER2-enriched“-Gruppe klassifiziert10. Derzeit ist nicht abschließend geklärt, ob die Fälle mit grenzwertiger Hormonrezeptor­expression aus tumorbiologischer Sicht eher den tripelnegativen oder den nicht tripelnegativen Tumoren z­ uzuordnen sind. Alexander Raths - Fotolia.com Molekularpathologie des TNBC Auf der Basis von neuen analytischen Ansätzen wie dem ­sogenannten Next Generation Sequencing (NGS) ist die r­ asche Analyse des Mutationsspektrums von Tumoren und somit die Bestimmung eines tumoralen Mutationsprofils möglich ­geworden. NGS-Analysen beim TNBC haben das ­bestätigen können, was bereits lang vermutet wurde: Das TNBC ist eine sehr heterogene Erkrankung und zeigt ein breites Spektrum an Mutationen. Die am häufigsten vorkommenden Mutationen betreffen jene von p53, gefolgt von PI3K. Darüber hinaus findet sich jedoch eine Vielzahl an niedrigfrequenten Mutationen. Eine parallel durchgeführte Hochdurchsatz-RNA-Sequenzierung zeigte, dass nur etwa 36 Prozent der Mutationen tatsächlich exprimiert wurden11. In einer weiteren Analyse wurden primäre Mammakarzinome mittels verschiedener Hochdurchsatzanalysen (sogenannten genomic DNA copy number arrays, DNA methylation, exome sequencing, messenger RNA arrays, microRNA sequencing und reverse-phase protein arrays) untersucht. In dieser Analyse zeigte sich unter anderem eine hohe Übereinstimmung der molekularen Profile von TNBC und serösen Ovarialkarzinomen. Diese Daten legen nahe, dass eine ähnliche Ätiologie bestehen könnte, die vergleichbare therapeutische Ansätze rechtfertigen könnte. Auch zeigte sich, dass die unterschiedlichen Subtypen des Mammakarzinoms durch verschiedene, für jeden Subtyp spezifische, genetische und epigenetische Veränderungen bedingt zu sein scheinen. Somit ist offenbar die in der Klinik zu beobachtende Plastizität und Heterogenität auf jene Subtypen beschränkt12. Die klinischen Konsequenzen dieser Erkenntnisse lassen sich bis dato nicht vorhersagen. Zudem bestehen zunehmend Hinweise auf eine besondere Bedeutung des Immunsignallings beim TNBC. So untersuchten Rody et al. erst kürzlich die Fragstellung, inwiefern sich mittels einer Datenbank gepoolter und homogenisierter ­Genexpressionsprofile von Patientinnen mit TNBC prognostisch relevante Genexpressionsprofile entwickeln lassen. Die Autoren konnten zeigen, dass sich mittels einer hohen ­Expression eines sogenannten B-Zell-Metagens sowie einer niedrigen Expression eines IL-8-Metagens eine Subgruppe von etwa 32 Prozent tripelnegativer Mammakarzinome identifizieren lässt, die eine gute Prognose aufweisen13. In einer Folgearbeit untersuchten die Autoren dann, inwiefern die prognostische Bedeutung dieses Markers für das TNBC spezifisch ist oder sich auf andere Mammakarzinomsubtypen übertragen lässt. In dieser Arbeit von Hanker et al. konnten sie darlegen, dass das Immun-Metagen lediglich bei Tumorproben mit einem basalen/triplenegativen Phänotyp pro­ gnostisch relevant ist. Eine signifikante Bedeutung in anderen Mammakarzinomsubgruppen konnte nicht nachgewiesen werden14. Diese wie auch andere Untersuchungen legen nahe, dass das Immunsignalling beim TNBC pathobiologisch relevant sein könnte und gegebenenfalls zukünftig genutzt werden kann. Klinischen Studien hierzu stehen jedoch aus. Therapie des TNBC Der Identifikation und Etablierung neuer potenzieller Therapien sowie der Optimierung der verwendeten Chemotherapie beim TNBC kommt eine wichtige Bedeutung zu. Auch wenn eine Taxan-Anthrazyklin-haltige Chemotherapie den Goldstandard in der zytotoxischen Therapie des TNBC darstellt, wird beispielsweise der Stellenwert der platinhaltigen ÄP Gynäkologie 3_2013 37 fokus Senologie Platinhaltige Chemotherapie Auch wenn der Zusammenhang zwischen TNBC und hereditärem Mammakarzinom die Grundlage für die Annahme einer erhöhten Wirksamkeit platinhaltiger Substanzen beim TNBC bildet, ist es jedoch wichtig zu erkennen, dass der Nachweis einer Überlegenheit platinhaltiger Schemata über die etablierten Anthrazyklin-Taxan-haltigen Schemata bis dato nicht ­erbracht wurde. Es gibt zwar eine überschaubare Anzahl an zumeist neoadjuvanten Studien mit limitierten Patienten­ zahlen, die eine Wirksamkeit der platinhaltigen Substanzen beim TNBC belegen18-20, jedoch steht der Beweis einer Überlegenheit gegenüber den herkömmlichen Schemata bis dato aus. ➤ Hormonrezeptornegativität Studien,­die diesen Beweis erbrin➤ schlechte Differenzierung gen sollen, werden derzeit durch➤ gehäuft medulläre Histologie geführt. Bis deren Ergebnisse vor➤ Lymphozytäres Infiltrat ➤ P53-Mutationen liegen, sollten die erwiesenermaßen ➤ EGFR-Expression wirksamen Anthrazyklin-Taxan➤ Hormonrezeptornegativität haltigen Schemata – zumindest ➤ häufig c-myc-Amplifikationen nicht in der kurativen Situation ➤ begleitendes DCIS selten nicht für platinhaltige Analoga ➤ Aneuploidie verlassen werden. Neue Erkennt➤ Empfindlichkeit gegenüber nisse zum Einsatz platinhaltiger DNA-Schäden ➤ HER2-Negativität Chemotherapie-Regime werden im Rahmen des ASCO 2013 basieTab. 1: Phänomene bzw. Merkmale, die rend auf den Ergebnissen der Gesowohl beim tripelnegativen als auch par-Sixto-Studie erwartet (www. beim hereditären Mammakarzinom zu erwarten sind. germanbreast­group.de). Insgesamt Ziel Substanz / Therapieansatz DNA-Reparaturmechanismen PARP-Inhibitoren, Trabectidin VEGFR Sunitinib Src-kinase Dasatinib Chickpoint-Kinase 1 UCON-01 mTor RAD001, Everolimus, Temserolimus Androgenrezeptor Bicalutamid TRAIL Lexatumumab PDGFR, c-kit Imatinib Tab. 2: Zielgerichtete Substanzen in der Testung beim tripelnegativen Mammakarzinom. 38 ÄP Gynäkologie 3_2013 sollte bis auf Weiteres die Anthrazyklin-Taxan-haltige Chemotherapie (z. B. als EC-Doc oder als TAC-Schema) Standard in der adjuvanten systemischen ­Therapie des TNBC bleiben. Zielgerichtete Substanzen Der Entwicklung neuer (zielgerichteter) Substanzen für das TNBC kommt ein großer Stellenwert zu. Ein Reihe an Sub­ stanzen ist derzeit in der klinischen Testung (Tab. 2). Antiangiogenetische Therapie beim TNBC Auf der Basis der Studiendaten aus der metastasierten Situa­ tion zum Einsatz von Avastin (ECOG2100, RIBBON-1, AVADO) wissen wir, dass Bevacizumab bei Patientinnen mit tripelnegativem Mammakarzinom wirksam ist21,22. Auch wenn Bevacizumab keine für das TNBC maßgeschneiderte Therapie ist, so stellt die Substanz doch die erste zielgerichtete Substanz dar, die beim metastasierten TNBC eingesetzt werden kann. Auch zur neoadjuvanten Therapie gibt es mittlerweile Daten, die insbesondere auf zwei klinischen Studien basieren. In den Studien Gepar Quinto und NSABP-B40 wurden Patientinnen mit einer Anthrazyklin-Taxan-haltigen Chemotherapie mit Abb. 3: Konzept der synthetischen Letalität oder ohne Bevacizumab behandelt. Die beiden Studien führten trotz ähnlicher Studiendesigns zu gänzlich widersprüchlichen Ergebnissen. Während es in der deutschen GeparQuinto-Studie in der Gesamtpopulation der HER2-negativen Patientinnen zu keiner Erhöhung der Ansprechrate kam (das heißt der Rate pathologischer Komplettremissionen [pCR]), war die pCR-Rate bei Patientinnen mit TNBC signifikant erhöht23. In der US-amerikanischen NSABP-B40-Studie war dies genau umgekehrt: In der G ­ esamtpopulation erwies sich die Hinzunahme von Bevacizumab als überlegen, bei Patientinnen mit TNBC führte die Hinzunahme von Bevacizumab zu keiner signifikanten Erhöhung der Ansprechrate24. Bis dato sind die Ursachen für diese divergenten Studienergebnisse nicht geklärt. Der Stellenwert von Bevacizumab beim frühen TNBC ist daher bis heute nicht geklärt. In der metastasierten Situation hingegen stellt Bevacizumab einen wichtigen Bestandteil der Therapie dar und ist aktuell in Kombination mit Paclitaxel oder Capecitabin zugelassen. Liedtke Therapie­intensiv untersucht. Die Hypothese, dass platinhaltige Substanzen beim TNBC eine besondere Wirksamkeit zeigen könnten, beruht darauf, dass für das hereditäre Mamma­ karzinom eine besondere Sensitivität gegenüber platinhaltigen Substanzen angenommen wird15. Wie bereits beschrieben, besteht zwischen dem hereditären Mammakarzinom und dem TNBC ein enger Zusammenhang. Darüber hinaus zeigen viele TNBC ein Phänomen, welches im Angloamerikanischen als „BRCA-ness“ bezeichnet wird, das heißt sie zeigen viele Eigenschaften, die sonst bei hereditären, BRCA-assoziierten Mammakarzinomen nachgewiesen werden16,17 (Tab. 1). Inhibition der Poly-A-Ribose-Polymerase-1 beim tripel­ negativen Mammakarzinom Aufgrund der bereits genannten Ähnlichkeit des TNBC zum hereditären Mammakarzinom wurde angenommen, dass PARP-Inhibitoren eine potenzielle zielgerichtete Therapie beim tripelnegativen Mammakarzinom darstellen könnten. Beim hereditären Mammakarzinom ist das BRCA-System durch Mutation defekt, sodass die Zellen vermehrt auf das noch funktionierende PARP-System zurückgreifen müssen. Wird jedoch dieses System (z. B. iatrogen durch einen PARPInhibitor) gehemmt, so ist dies für die Zelle letal. Dieser Mechanismus wird auch als synthetische Letalität ­ ­bezeichnet25 (Abb. 3). Anhand einer Phase-II-Studie bei Patientinnen mit metastasiertem tripelnegativem Mammakarzinom wurde 2010 erstmalig gezeigt, dass die Hinzunahme des intravenös zu applizierenden PARP-Inhibitors Iniparib (BSI-201) in Ergänzung einer Chemotherapie mit Gemcitabin und Carboplatin zu einer signifikanten Verlängerung sowohl des progressionsfreien Überlebens als auch des Gesamtüberlebens im Vergleich zur alleinigen Chemotherapie führt26,27. Um eine ­Zulassung der Substanz zu erreichen, wurde in den USA eine Phase-III-Studie mit gleichem Design angeschlossen, deren Daten im Rahmen des ASCO 2011 vorgestellt wurden. Dort zeigte sich überraschenderweise, dass die Daten der vorangegangenen Studie in der Phase-III-Studie nicht ­reproduziert werden konnten: Es zeigte sich weder eine ­signifikante Verlängerung des progressionsfreien noch des Gesamtüber­lebens28. Auch wenn sich die Unterschiede ­zwischen beiden Studien unter anderem durch das offene Studiendesign ­erklären lassen und in Subgruppen (z. B. bei Patientinnen mit intensiverer Vortherapie) durchaus eine Überlegenheit des Iniparib-haltigen Studienarms beobachtet werden konnte, sind die in Deutschland geplanten (neoadjuvanten bzw. ­palliativen) Studienprojekte mit Iniparib zunächst pausiert worden. Währenddessen werden in den USA weitere Untersuchungen durchgeführt, die den ­Mechanismus von Iniparib und die optimale Indikationsgruppe weiter untersuchen werden. Auch andere PARP-­ Inhibitoren befinden sich derzeit in der klinischen Testung beim Mammakarzinom. Olaparib ist ein weiterer oral ­verfügbarer PARP-Inhibitor, der insbesondere beim hereditären Mamma- und Ovarialkarzinom in Phase-II-Studien Wirksamkeit gezeigt hat29-31. Die Datenlage zum tripelnegativen Mammakarzinom ist jedoch bis dato unzureichend, weitere Studienergebnisse werden auch hier im Rahmen des ASCO 2013 erwartet. eine differenzierte Aufklärung wichtig. Diese sollte insbesondere folgende Aussagen umfassen: • Nicht alle Patientinnen mit TNBC haben eine schlechte Prognose! Insbesondere Patientinnen mit Chemotherapieempfindlichem Tumor (was z. B. anhand einer pathologischen Komplettremission nach neoadjuvanter Chemotherapie zu bestimmen ist) haben eine Prognose, die nicht schlechter ist als die anderer Mamma­karzinomsubgruppen. • Die Rate an Chemotherapie-empfindlichen Tumoren ist beim TNBC signifikant höher als bei anderen Mamma­ karzinomsubtypen. • Auch wenn die Rezidivrate insbesondere in den ersten drei Jahren nach Erstdiagnose signifikant höher ist als bei anderen Mammakarzinomsubtypen, so ist es wichtig, darauf hinzuweisen, dass ab diesem Zeitpunkt die Rezidivrate unter die anderer Subtypen sinkt – Spätrezidive sind selten! • Das TNBC und seine Therapie gehört zu einem der Bereiche, in denen am intensivsten geforscht wird. Dies wird hoffentlich dazu führen, dass in nicht allzu ferner Zukunft die Prognose von Patientinnen mit TNBC durch die Entwicklung neuer Therapien deutlich gebessert wird. Zusammenfassung Aufgrund seiner schlechten Prognose und eingeschränkten therapeutischen Möglichkeiten bleibt die Behandlung des tripelnegativen Mammakarzinoms schwierig. Bevacizumab stellt eine erste mögliche zielgerichtete Option in der ­Behandlung des tripelnegativen Mammakarzinoms dar; bis dato ist Bevacizumab jedoch nur in Kombiantion mit einer Chemotherapie (d. h. Paclitaxel und Capecitabin) zugelassen und stellt daher keine Alternative zur Chemotherapie dar. Hoffnungen, die in PARP-Inhibitoren wie Iniparib und Olaparib als Therapieoption für Patientinnen mit tripelnegativem Mammakarzinom gesetzt wurden, haben sich leider bis dato nicht bestätigen können. Daher bleibt die Chemotherapie (ggf. in Ergänzung durch Bevacizumab) der einzige Therapieansatz für Patientinnen mit tripelnegativem Mammakarzinom außerhalb klinischer Studien. Die differenzierte Beratung von Patientinnen mit TNBC ist besonders wichtig. Die Literaturliste ist unter [email protected] erhältlich. Priv.-Doz. Dr. med. Cornelia Liedtke Prof. Dr. med. Achim Rody Klinik für Gynäkologie und Geburtshilfe UKSH, Campus Lübeck [email protected] Beratung der TNBC-Patientinnen im klinischen Alltag Die Beratung von Patientinnen mit TNBC stellt eine Herausforderung an den Therapeuten dar. Auch wenn die Prognose von Patientinnen mit TNBC generell schlechter ist als die von Patientinnen mit anderen Mammakarzinomsubgruppen, ist Vortrag „Klinischer Verlauf bei Patienten mit einem triplenegativen Mammakarzinom“ im Rahmen der Sitzung „Das triplenegative Mammakarzinom“ Freitag, 28. Juni, 14.30–16.00 Uhr, Saal 13a ÄP Gynäkologie 3_2013 39