Kap.28 Spez. Diagnostik in der GI
Werbung

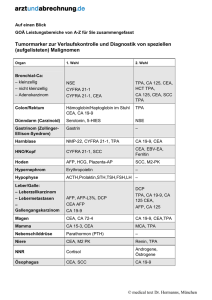
GASTROENTEROLOGIE EINSATZ VON SPEZ. DIAGNOSTIK IN DER GI-ONKOLOGIE TUMORMARKERN Ansprechpartner: Dr. P. Stieber, Inst. für Klin. Chemie, Tel. 3115, Funk -1451 Grundzüge der Indikation zur Tumormarker (TM)-Bestimmung: Maßvoller TM-Einsatz (Kosten ca. 15-20 €/Bestimmung) orientiert sich an möglichst einem TM und optimalem Verlaufsintervall (unterschiedlich, z.B. ¼-jährlich, siehe Tumorzentrums-Empfehlungen). Früherkennung: Für das Krebs-Screening eignen sich fast alle TM nicht (geringe Sensitivität und Spezifität). Ausnahme: Prostata-spezifisches Antigen (PSA). Unter dem Anstieg der Prävalenz einer Erkrankung (Überwachung von Risikogruppen) können einzelne TM von Bedeutung sein: z.B. die Calcitonin-Bestimmung bei Verwandten von Patienten mit familiärem medullären Schilddrüsenkarzinom (C-Zellkarzinom) bzw. einer MEN II zur Früherkennung einer inapparenten Erkrankung (heute zunehmend ersetzt durch Mutations-RET-Proto-Onkogen-Bestimmung), Untersuchung auf Chorionkarzinom bei Patientinnen nach Blasenmole (HCG), bei Patienten mit chronischer Lebererkrankung auf Entstehung eines hepatozellulären Karzinoms (AFP und Ultraschall 2-3x/Jahr, häufiger bei Zirrhose, seltener bei chronischer Hepatitis B/C) sowie als zusätzlicher Parameter bei Patienten mit akuten gastrointestinalen Beschwerden wie abdominellen Schmerzen und Gewichtsverlust (CEA, CA 19-9) im Hinblick auf Dickdarm- und Pankreaskarzinom. Tumor-Lokalisation: Zur Tumorlokalisation sind die meisten TM unbrauchbar wegen mangelnder Tumororgan-Spezifität bis auf den Einsatz von PSA beim Prostatakarzinom und von Thyreoglobulin (TG) bei V.a. auf Rezidiv eines vorher kurativ operierten follikulären/papillären SD-Karzinoms. Ferner mit Einschränkung verwertbar bei AFPErhöhungen >100-200 ng/ml für die beiden wichtigsten AFP-Tumorquellen eines hepatozellulären Karzinoms und Keimzelltumors. Weitere Differenzierung möglich mittels Lektin-Affinitäts-Chromatographie durch Concanavalin A (hohe Bindung beim HCC/benigner Lebererkrankung) oder bei einer malignen AFP-Quelle durch Lens culinaris-Agglutinin (Bindung >15% spricht für Malignität). Ähnliche Bedeutung für ProGRP-Freisetzung >500 pg/ml als Verdacht auf eine kleinzelliges (Bronchial-)Karzinom. Primäre Tumordiagnostik: Der Beitrag eines TM zur primären Tumordiagnostik ist gering. Aber: ein hoher TMWert weist den Verdacht auf eine disseminierte Erkrankung. Es gibt die Möglichkeit einer späteren Verwendung als Verlaufsmarker (z.B. CEA beim kolorektalen Karzinom, CA 125 beim Ovarialkarzinom, CYFRA 21-1 beim Bronchialkarzinom). Die Bestimmung von AFP und HCG bei Patienten mit Keimzelltumoren ist bei Diagnosestellung obligat. Prognose: Der Beitrag eines TM zur Prognose ist gesichert für AFP, HCG und LDH bei Keimzelltumoren und für die HWZ von AFP und HCG nach primärer Chemotherapie beim nicht-seminomatösen Hodentumor, für prätherapeutisches CEA und CA19-9 beim kolorektalen und Magenkarzinom, den postoperativen CEA-Spiegel nach Resektion einer solitären Lebermetastase beim kolorektalen Karzinom, für AFP und DCP (des-γ-carboxy-Prothrombin) beim hepatozellulären Karzinom, ferner für PSA 81 GASTROENTEROLOGIE SPEZ. DIAGNOSTIK IN DER GI-ONKOLOGIE beim Prostatakarzinom, CA 125 beim epithelialen Ovarialkarzinom, für den postoperativen Abfall von CEA beim Mammakarzinom, für CYFRA 21-1 beim nichtkleinzelligen und NSE/ProGRP beim kleinzelligen Bronchialkarzinom und für ß2m beim multiplen Myelom. Tumormarker AFP CA 125 CA 19-9 CA 15-3 CA 72-4 CEA CYFRA 21-1 hCG NSE PSA SCC Halbwertszeit (Tage) 2-8 5 4-8 5-7 3-7 2-8 1 0,5-1,5 1 2-3 1 Oberer Grenzwert 9 IU/ml 35 U/ml 37 U/ml 25 U/ml 4 U/ml 3 g/l 2 g/l 2 IU/l 10 (20) IU/l 4 g/l 1,5 g/l *Biliäre oder/und renale Ausscheidung der Tumormarker auf die Hälfte der Ausgangskonzentration Tabelle 1: Biologische Halbwertszeit* und obere Referenzbereichs-Grenzwerte von Tumormarkern (Grenzwert variiert teilweise nach Hersteller, entspricht i. d. R. dem 95%-Perzentil) Tumor Marker CEA AFP CA CA CA CA NSE Pro SCC CYFRA hCG PSA Calci- HTG 19-9 72-4 125 15-3 GRP tonin 21-1 Kolon Pankreas Magen Ösophagus Leber (HCC) Gallenwege Mamma Ovar Zervix Chorion Lunge SCLC Lunge NSCLC Keimzell Prostata Blase Schilddrüse C-Zell HNO Tabelle 2: Sinnvoller Einsatz und Kombination von Tumomarkern (je größer und dunkler ein Punkt, umso wichtiger der TM) 82 GASTROENTEROLOGIE SPEZ. DIAGNOSTIK IN DER GI-ONKOLOGIE Therapie-Überwachung: Im allgemeinen reflektieren TM im Verlauf die klinische Entwicklung der Erkrankung unter Therapie: sie zeigen z. B. eine hohe Korrelation eines fallenden Markerspiels (>50%) mit dem Ansprechen einer Therapie, eines TM-Anstiegs (>25%) mit einer Progression sowie eines konstanten oder leicht undulierenden pathologisch erhöhten TM-Spiegels (<25%) mit einer stabilen Erkrankung. Ein TM-Spiegelabfall zur Norm im Verlauf von 4-8 Wochen nach kurativer Operation und in Abhängigkeit von seiner physiologischen HWZ gilt als Hinweis auf eine komplette Tumorentfernung, eine postoperative TM-Spiegelpersistenz im pathologischen Bereich oder ein weiterer Anstieg als Hinweis auf Residualtumor oder Metastasierung. Ein in der Therapiepause erneut ansteigender TM-Wert kann erster Hinweis auf Reaktivierung der Grundkrankheit und damit Therapieindikation sein, ein unter Therapie auftretender kontrollierter TM-Anstieg Hinweis auf Therapieresistenz und Indikation für einen Therapie-Abbruch oder -Wechsel. Bei Diskrepanz zwischen unauffälliger bildgebender Kontrolle und pathologischem TM-Verhalten ist im allgemeinen die alleinige TM-Änderung keine ausreichende Indikation für eine Therapieänderung oder -induktion mit Ausnahme für HCG beim Hodentumor. Der Bestimmung von TMVerlaufskontrollen ist immer am noch möglichen therapeutischen Nutzen auszurichten und kann je nach Tumorart und –ausdehnung sowie der Therapieform stark variieren. Früherkennung des Tumorrezidivs: TM können in bis zu 50% der Fälle mit einer Vorzeitigkeit von 1-6 Monaten und oft früher als andere diagnostische z.T. invasive Verfahren auf die Änderung des Tumorverhaltens hinweisen. Ein kontrollierter TM-Wiederanstieg nach erfolgter Normalisierung und vermeintlich kurativer Operation (z.B. Kolonkarzinom-Operation) ist als dringender V.a. ein Rezidiv oder eine Metastasierung zu werten. Dabei hängt eine noch kurative Reoperation stark von der Latenzzeit zwischen erstem TMAnstieg und Diagnosesicherung (CT, Endoskopie, etc.) ab. Deshalb schränkt die Verlängerung des Kontroll-Intervalls von viertel- auf halbjährlich im 1. und 2. postoperativen Jahr in der Nachsorge beim kolorektalen Karzinom im IUCC-Stadium II-III den Wert von CEA-Kontrollen eher ein. Die TM-Spiegelzunahme (Dopplungszeit=DZ) verläuft bei Lokalrezidiv oder Weichteilmetastasierung langsamer (z.B. längere DZ >100d) als bei Metastasierung in Lunge, Leber, Knochen oder multipler Metastasierung (DZ <100d). Literaturhinweise: Duffy, M.J.: Clinical uses of tumor markers: a critical review. Crit. Rev. in Clin. Lab. Sci. 38 (2001):225-262. European Group on tumour markers (EGTM): Recommendations on clinical tumour marker application. EGTM-Homepage www.med2.med.uni-muenchen.de/egtm Stieber P, Lamerz R, Schalhorn A: Stellenwert der Tumormarker in der Verlaufskontrolle kolorektaler Karzinome. Der Bay. Int. 2002;22(4):245-252. 83 GASTROENTEROLOGIE SPEZ. DIAGNOSTIK IN DER GI-ONKOLOGIE KLINISCH RELEVANTE TUMORMARKER HNO SCC, CEA CYFRA 21-1 SCHILDDRÜSE CCC:hCT/NSE pap/diff. TG LUNGE Adeno/grosszellig: CEA, CYFRA 21-1 kleinzl: NSE, ProGRP Pl.Ep:CYFRA 21-1 BRUST CA 15-3*/CEA ÖSOPHAGUS SCC, CEA MAGEN CA 72-4/CEA/ CA 19-9* LEBER HCC: AFP/DCP CCC: CA 19-9* Met:CEA PANKREAS CA 19-9* CA 242 GALLENG. TR. CA 19-9* DICKDARM CEA, CA 19-9* CA 242 BLASE CYFRA 21-1, TPA OVAR CA 125, CA 72-4/ HCG, AFP PROSTATA PSA UTERUS Cervix: SCC/CEA Endom.: CA 125 HODEN Sem: HCG/NSE/PLAP NSGCT: AFP+HCG * = Prototyp Abbildung 1: Tumormarker und Zielorgane 84 GASTROENTEROLOGIE E I N S A T Z V O N PET SPEZ. DIAGNOSTIK IN DER GI-ONKOLOGIE UND PET-CT Ansprechpartner: Dr. W. Koch, Klinik für Nuklearmedizin, Tel. 4646, Funk 1505 • Ösophaguskarzinome weisen regelhaft einen deutlich erhöhten Glukosemetabolismus auf und sind daher positronenemissionstomographisch exzellent nachzuweisen. Anerkannte Indikationen sind bei gesichertem Ösophagus-Ca das lokoregionäre Lymphknoten-Staging und die Abklärung des Ganzkörpers hinsichtlich einer hämatogenen Fernmetastasierung (Accuracy 76%–88%). In der Konsensus-Konferenz Onko-PET wird diese Indikation mit der Ziffer Ia (klinischer Nutzen ist ohne Einschränkung erwiesen) bewertet. • Magenkarzinome weisen nach eigenen Erfahrungen ein heterogenes Speichermuster auf und sind zudem auch im Falle einer Mehrspeicherung relativ schwer von der physiologisch hypermetabolen Magenmuskulatur zu differenzieren. Intestinaler Typ und diffuser Typ können sich hinsichtlich des Speicherverhaltens zusätzlich unterscheiden. Die Datenlage in der Literatur ist heterogen, PET bzw. PET/CT bei Magen-Ca. gilt somit derzeit als nicht gesicherte Indikation. • Pankreaskarzinome weisen einen hohen Glukose-Uptake auf und sind dadurch häufig von der chronischen Pankreatitis zu differenzieren. Die DD Pankreas-Ca. / Pankreatitis wird in dem Konsensus-Paper mit Ia (klinischer Nutzen ohne Einschränkung erwiesen, Sensitivität 85%–92%, Spezifität 78%–88%,), die Rezidiv-Diagnostik mit Ib (klinischer Nutzen wahrscheinlich) bewertet. Eine PET/CT-Kombinationsdiagnostik ist hier der reinen PET-Untersuchung vorzuziehen. • Kolorektale Karzinome zeigen einen deutlich erhöhten Glukosestoffwechsel und sind dadurch der Bildgebung im PET bzw. PET/CT sehr gut zugänglich. Lt. Konsensus-Konferenz gilt das Restaging als Indikation, deren Nutzen ohne Einschränkung erwiesen ist. Insbesondere die Differenzierung Tumorrezidiv / Narbe gilt als anerkannte Indikation (Sensitivität 93%–100%, Spezifität 95%– 98%). Die Therapiekontrolle wird von der Konsensus-Konferenz mit Ib (klinischer Nutzen ist wahrscheinlich) bewertet. Zur Therapieplanung vor geplanter Metastasenchirurgie (z.B. Ausschluß extrahepatischer Metastasen vor geplanter chirurgischer Entfernung von Lebermetastasen) erscheint PET bzw. PET/CT obligat. • Leberzellkarzinome: Bei ungesicherter Datenlage sind Leberzellkarzinome derzeit keine anerkannte Indikation für PET bzw. PET/CT. Das Speicherverhalten von Leberzellkarzinomen ist heterogen und vermutlich abhängig von der Differenzierung des Tumors und somit ein möglicher Parameter für die Prognose. • Lebermetastasen: Nach eigenen Ergebnissen besteht eine sehr gute Indikation für die Durchführung einer PET/CT zur Therapieplanung und Therapiekontrolle vor bzw. nach Durchführung von Therapiemaßnahmen (insb. Radiofrequenzablation (RFA), Leberteilresektion, etc). Ablationsrandrezidive nach RFA können frühzeitig durch den erhöhten Glukosemetabolismus von vollständig abladierten Arealen differenziert werden. Bei geplanter SIRT-Therapie (selektive interne Radiotherapie) von Lebertumoren bzw. Metastasen ist die PET/CT zum 85 GASTROENTEROLOGIE SPEZ. DIAGNOSTIK IN DER GI-ONKOLOGIE Nachweis bzw. Ausschluß einer extrahepatischen Metastasierung und damit zur Abklärung der Indikation indiziert. • Gastrointestinale Stromatumoren weisen regelhaft einen deutlich erhöhten Glukose-Uptake auf. Nach mehreren Literaturberichten und eigenen Ergebnissen ist PET in der Lage, das Ansprechen des Tumors auf Imatinib, Glivec bereits sehr frühzeitig zu beurteilen (Therapiemonitoring), Rezidive sind frühzeitig aufgrund des wieder deutlich erhöhten Glukosemetabolismus zu erkennen. • Karzinoide, GEP-Tumore: Die Datenlage bezüglich Karzinoiden und GEPTumoren ist als nicht ausreichend zu bewerten. Tumore weisen ein unterschiedliches Speichermuster auf, daher gilt diese Tumorentität bislang nicht als gesicherte Indikation für die Durchführung einer PET bzw. PET/CT. Eine PET/CT-Untersuchung ist ggf. bei Patienten hilfreich, bei denen sowohl die Somatostatin-Rezeptor-Szintigraphie als auch die MIBG-Szintigraphie negativ sind, • Biläre Karzinome: Bislang nur wenig publizierte Daten, übereinstimmend mit eigenen Erfahrungen weisen biläre Karzinome einen hohen Glukosemetabolismus auf. PET bzw. PET/CT scheint somit gut zur PrimärtumorDiagnostik und zur DD eines Tumorrezidivs geeignet zu sein und ist hilfreich bei der Detektion von Fernmetastasen. Wenn möglich sollte anstelle einer initialen CT-Untersuchung mit nachfolgender PETDiagnostik schon initial der PET/CT-Untersuchung der Vorzug gegeben werden. Tumorentität Ösophaguskarzinom Magenkarzinom Pankreaskarzinom Kolorektale Karzinome Leberzellkarzinom Lebermetastasen GIST Karzinoide / GEPTumore Biliäre Karzinome Schilddrüsenkarzinome Eigene Erfahrung ++ -++ ++ +/++ ++ 0 Konsensus-Konferenz * Ia I a/b Ib ++ + I a/b bei I-131-negativen, Tg- bei Tg-positiven Tumoren positiven Tumoren I a = klinischer Nutzen ist ohne Einschränkung erwiesen I b = klinischer Nutzen wahrscheinlich Zu einigen Tumorentitäten wurde in der Konsensus-Konferenz keine Stellung genommen, auch wenn zwischenzeitlich zu diesen Erkrankungen publiziert wurde. * European Journal of Nuclear Medicine 2001; 28: 1707-23 86