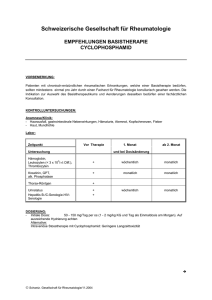
Anlage 0.0
Werbung

Anlage 0.0 Folgende Wirkstoffe besitzen eine Zulassung für „Systemischen Lupus erythematodes (SLE)“ bzw. explizit für „progrediente Formen von Lups nephritis“ Recherche in der Datenbank AMIS, Stand 02.12.2016 Anwendungsgebiet: „Systemischer Lupus erythematodes“ Cyclophosphamid Cyclophosphamid ist zugelassen ……… „zur Behandlung bedrohlich verlaufenden „Autoimmunkrankheiten“ wie schwere, progrediente Formen von Lupus Nephritis.“……….. (Fachinformation Endoxan®, Baxter Oncology GmbH, Stand der Information: September 2013) Azathioprin ………..“Azathioprin, entweder alleine oder meistens in Kombination mit Kortikostero-iden und/oder anderen Arzneimitteln und Behandlungsmethoden, wurde mit klinischem Erfolg (dies kann eine Dosisreduktion oder ein Absetzen von Kortikosteroiden beinhalten) bei Patienten mit folgenden Erkrankungen angewendet - schwere rheumatoide Arthritissystemischer Lupus erythematodes - Dermatomyositis und Polymyositis - autoimmune chronische aktive Hepatitis - Pemphigus vulgaris“…….. (Fachinformation Azathioprin Sandoz, Hexal AG, Stand der Information: Juni 2016) Chloroquin …Chloroquinphosphat ist zugelassen zur Behandlung des „Systemischen Lupus erythematodes.“ (Fachinformation Resochin®Tabletten 250 mg, Bayer Vital GmbH, Stand der Information: Juli 2016) Hydroxychloroquin …Hydroxychloroquin ist zugelassen zur Behandlung des „Systemischen Lupus erythematodes.“….. (Fachinformation Quensyl®, Sanofi-Aventis Deutschland GmbH, Stand der Information: September 2015) 1 Prednisolon …Prednisolon ist zugelassen zur Behandlung des „Systemischen Lupus erythematodes.“….. (Fachinformation Decortin®H, Merck Serono GmbH, Stand der Information: April 2013) Methylprednisolon …Methylprednisolon ist zugelassen zur Behandlung von Autoimmun­ erkrankungen, z. B. Dermatomyositis, systemische Sklerodermie (indurative Phase), „chronisch diskoider und subakut kutaner Lupus erythematodes.“ ….. (Fachinformation Urbason®4mg/8mg/16mg/40mg Tabletten, Sanofi-Aventis Deutschland GmbH, Stand der Information: April 2016) Betamethasonacetat, Betamethasondihydrogenphosphat-Dinatrium …ist zugelassen zur Behandlung des „diskoiden Lupus erythematodes.“….. (Fachinformation Celestan®Depot, MSD SHARP & DOHME GmbH, Stand der Information: März 2015) Dexamethason …Dexamethason „ist zugelassen zur oralen Anfangsbehandlung von Autoimmunerkrankungen, wie systemischer Lupus erythematodes (insbesondere viszerale Formen).“….. (Fachinformation Fortecortin®0,5 mg/2 mg/4 mg/ 8 mg Tabletten, Merck Serono GmbH, Stand der Information: März 2016) Triamcinolon …Triamcinolon ist zugelassen zur Behandlung „aktiver Phasen von rheumatischen Systemerkrankungen wie des Systemischen Lupus erythematodes.“….. (Fachinformation Volon®4/8/16mg, Dermapharm AG, Stand der Information: August 2015) Dapson …Dapson (Diaminodiphenylsulfon) ist zugelassen zur Behandlung der „ulcerösen Exazerbationen des Erythematodes.“….. (Fachinformation Dapson-Fatol®, Riemser Pharma GmbH, Stand der Information: Januar 2015) 2 Belimumab „Belimumab ist indiziert als Zusatztherapie bei erwachsenen Patienten mit aktivem, Autoantikörper-positiven systemischen Lupus erythematodes (SLE), die trotz Standardtherapie eine hohe Krankheitsaktivität (z.B. positiver Test auf Anti-dsDNA-Antikörper und niedriges Komplement) aufweisen.“ (Fachinformation Benlysta®120 mg/400 mg, Glaxo Group Limited, Stand der Information: September 2016) 3 Fachinformation CellCept® 500 mg Filmtabletten 1. BEZEICHNUNG DES ARZNEIMITTELS CellCept® 500 mg Filmtabletten. 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jede Tablette enthält 500 mg Mycopheno­ latmofetil. Vollständige Auflistung der sonstigen Be­ standteile, siehe Abschnitt 6.1. 3. DARREICHUNGSFORM Filmtabletten. CellCept Tabletten: Lilafarbene Tabletten in Caplet-Form, die auf einer Seite die Prä­ gung „CellCept 500“ und auf der anderen den Namen „Roche“ tragen. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete CellCept ist in Kombination mit Ciclosporin und Corticosteroiden zur Prophylaxe von akuten Transplantatabstoßungsreaktionen bei Patienten mit allogener Nieren-, Herzoder Lebertransplantation angezeigt. Kinder und Jugendliche Zu pädiatrischen Herztransplantationspa­ tienten liegen keine Daten vor. Anwendung bei Lebertransplantation Erwachsene CellCept sollte nach einer Lebertransplan­ tation für die ersten 4 Tage i. v. verabreicht werden, dann, sobald eine solche vertragen wird, soll die orale Gabe von CellCept be­ gonnen werden. Bei Lebertransplantations­ patienten beträgt die empfohlene orale Dosis zweimal täglich 1,5 g (Tagesdosis: 3 g). Kinder und Jugendliche Zu pädiatrischen Lebertransplantationspa­ tienten liegen keine Daten vor. Anwendung bei besonderen Patienten­ gruppen Ältere Menschen Bei älteren Menschen erweist sich die emp­ fohlene Dosis von zweimal täglich 1 g für nierentransplantierte Patienten und von zweimal täglich 1,5 g für Herz- oder Lebertransplantierte als geeignet. Niereninsuffizienz 4.2 Dosierung und Art der Anwendung Die Behandlung mit CellCept soll von ent­ sprechend qualifizierten Transplantations­ spezialisten eingeleitet und fortgeführt wer­ den. Dosierung Anwendung bei Nierentransplantation Erwachsene Eine orale Therapie mit CellCept sollte in­ nerhalb von 72 Stunden nach der Transplan­ tation eingeleitet werden. Die empfohlene Dosis für Nierentransplantationspatienten be­ trägt zweimal täglich 1 g (Tagesdosis: 2 g). Kinder und Jugendliche im Alter von 2 bis 18 Jahren Die empfohlene Dosis Mycophenolatmofetil beträgt 600 mg/m2 zweimal täglich oral verabreicht (bis zu einer maximalen Tages­ dosis von 2 g). CellCept Tabletten sollten nur Patienten mit einer Körperoberfläche von mehr als 1,5 m2 in einer Dosis von zweimal täglich 1 g (Tagesdosis: 2 g) verordnet wer­ den. Da im Vergleich zu Erwachsenen in dieser Altersgruppe einige der Nebenwirkun­ gen häufiger auftreten (siehe Abschnitt 4.8), kann eine vorübergehende Herabsetzung der Dosis oder ein Abbruch der Behand­ lung notwendig sein; hierbei müssen rele­ vante klinische Faktoren wie die Stärke der Reaktion berücksichtigt werden. Kinder < 2 Jahre Für Kinder unter 2 Jahren liegen begrenzte Sicherheits- und Wirksamkeitsdaten vor. Sie reichen nicht aus, um Dosierungsvorschläge zu machen, und daher wird eine Anwen­ dung in dieser Altersgruppe nicht empfoh­ len. November 2015 Anwendung bei Herztransplantation Erwachsene Eine orale Therapie mit CellCept sollte in­ nerhalb von 5 Tagen nach der Transplan­ tation eingeleitet werden. Die empfohlene Dosis für Herztransplantationspatienten be­ trägt zweimal täglich 1,5 g (Tagesdosis: 3 g). 000094-17733 Bei Nierentransplantationspatienten mit schwerer chronischer Niereninsuffizienz (glo­ meruläre Filtrationsrate < 25 ml/min/1,73 m²) sind außerhalb der unmittelbaren postope­ rativen Periode Dosen von mehr als 1 g zweimal täglich zu vermeiden. Diese Patien­ ten sollen zudem sorgfältig überwacht wer­ den. Bei Patienten mit verzögertem Funk­ tionseintritt des Nierentransplantats nach der Operation ist keine Anpassung der Dosis erforderlich (siehe Abschnitt 5.2). Zu Herz- oder Lebertransplantationspatienten mit schwerer chronischer Niereninsuffizienz liegen keine Daten vor. Schwere Leberinsuffizienz Bei nierentransplantierten Patienten mit schweren Leberparenchymschäden sind Dosisanpassungen nicht erforderlich. Zu herztransplantierten Patienten mit schweren Leberparenchymschäden liegen keine Da­ ten vor. Behandlung während einer Abstoßungs­ reaktion Mycophenolsäure (MPA) ist der aktive Meta­ bolit von Mycophenolatmofetil. Eine renale Transplantatabstoßung führt nicht zu einer Änderung der Pharmakokinetik von MPA; eine Dosisreduktion oder Unterbrechung der Anwendung von CellCept ist nicht erforder­ lich. Es liegt kein Grund für eine Dosisan­ passung von CellCept nach Herztransplan­ tatabstoßung vor. Pharmakokinetische Da­ ten bei Lebertransplantatabstoßung liegen nicht vor. Art der Anwendung Zum Einnehmen Vorsichtsmaßnahmen vor/bei der Hand­ habung bzw. vor/während der Anwen­ dung des Arzneimittels Da Mycophenolatmofetil bei Ratten und Kaninchen eine teratogene Wirkung gezeigt hat, sollten die Tabletten von CellCept nicht zerdrückt werden. 4.3 Gegenanzeigen • CellCept darf bei Patienten, die über­ empfindlich gegen Mycophenolatmofetil, Mycophenolsäure oder einen der in Ab­ schnitt 6.1 genannten sonstigen Bestand­ teile sind, nicht angewendet werden. Überempfindlichkeitsreaktionen gegen CellCept wurden beobachtet (siehe Ab­ schnitt 4.8). • CellCept darf bei Frauen im gebärfähigen Alter, die keine hochwirksame Verhü­ tungsmethode verwenden, nicht ange­ wendet werden (siehe Abschnitt 4.6). • Eine CellCept Behandlung darf bei Frau­ en im gebärfähigen Alter ohne Vorlage eines Schwangerschaftstestergebnisses nicht begonnen werden, um eine unbe­ absichtigte Anwendung während der Schwangerschaft auszuschließen (siehe Abschnitt 4.6). • CellCept darf in der Schwangerschaft nicht angewendet werden, außer, wenn keine geeignete alternative Behandlung zur Verhinderung einer Transplantatab­ stoßung zur Verfügung steht. • CellCept darf von stillenden Frauen nicht angewendet werden (siehe Abschnitt 4.6). 4.4 Besondere Warnhinweise und Vor­ sichtsmaßnahmen für die Anwendung Neoplasien Patienten, die unter einer Behandlung mit Immunsuppressiva stehen und hierzu eine Kombination von Arzneimitteln, einschließ­ lich CellCept, erhalten, sind einem erhöh­ ten Risiko von Lymphomen und anderen Malignomen, insbesondere der Haut, aus­ gesetzt (siehe Abschnitt 4.8). Das Risiko scheint hierbei eher von der Intensität und der Dauer der Immunsuppression als von der Verwendung eines bestimmten Mittels abzuhängen. Um das Hautkrebsrisiko auf ein Minimum zu reduzieren, wird grundsätzlich geraten, sich nur begrenzt und mit schützender Klei­ dung dem Sonnen- und UV-Licht auszuset­ zen und ein Sonnenschutzmittel mit hohem Lichtschutzfaktor zu benutzen. Infektionen Patienten, die mit Immunsuppressiva, ein­ schließlich CellCept, behandelt werden, haben ein erhöhtes Risiko für opportunis­ tische (durch Bakterien, Pilze, Viren und Protozoen verursachte) Infektionen, töd­ liche Infektionen und Sepsis (siehe Ab­ schnitt 4.8). Derartige Infektionen schließen latente virale Reaktivierung, wie z. B. Hepa­ titis-B- oder Hepatitis-C-Reaktivierung und durch Polyomaviren hervorgerufene Infek­ tionen (BK-Virus-Nephropathie, JC-Virus verbundene progressive multifokale Leuko­ enzephalopathie [PML]) ein. Fälle von He­ patitis durch Hepatitis-B- oder Hepatitis-CReaktivierung sind bei Virusträgern unter Anwendung von Immunsuppressiva berich­ tet worden. Diese Infektionen sind häufig mit einer hohen immunsuppressiven Ge­ samtexposition verbunden und können zu einer schwerwiegenden oder tödlichen 1 Fachinformation CellCept® 500 mg Filmtabletten Erkrankung führen, die Ärzte bei immun­ supprimierten Patienten mit sich verschlech­ ternder Nierenfunktion oder neurologischen Symptomen differentialdiagnostisch in Be­ tracht ziehen müssen. Bei Patienten, die CellCept in Kombination mit anderen Immunsuppressiva erhielten, ist über Hypogammaglobulinämie in Verbin­ dung mit wiederkehrenden Infektionen be­ richtet worden. In einigen dieser Fälle führte die Umstellung von CellCept auf ein alter­ natives Immunsuppressivum zu einer Nor­ malisierung der Serum-IgG-Werte. Bei Pa­ tienten mit wiederkehrenden Infektionen, die mit CellCept behandelt werden, sollten die Serum-Immunglobuline gemessen wer­ den. In Fällen von anhaltender, klinisch rele­ vanter Hypogammaglobulinämie sollten ge­ eignete klinische Maßnahmen, unter Be­ achtung der starken zytostatischen Wir­ kung, die Mycophenolsäure auf T- und BLymphozyten hat, in Betracht gezogen werden. Bei Erwachsenen und Kindern, die CellCept in Kombination mit anderen Immunsuppres­ siva erhielten, sind Fälle von Bronchiektasie berichtet worden. In einigen dieser Fälle führte die Umstellung von CellCept auf ein anderes Immunsuppressivum zu einer Ver­ besserung der Atemwegsbeschwerden. Das Risiko einer Bronchiektasie kann mit einer Hypogammaglobulinämie assoziiert oder eine direkte Auswirkung auf die Lunge sein. In Einzelfällen wurden auch interstitielle Lungenerkrankung und Lungenfibrose be­ richtet, von denen einige einen tödlichen Ausgang hatten (siehe Abschnitt 4.8). Es wird empfohlen, Patienten, die anhaltende pulmonale Symptome, wie Husten oder Dyspnoe entwickeln, umgehend ärztlich zu untersuchen. Blut und Immunsystem Patienten, die mit CellCept behandelt wer­ den, sind bezüglich des Auftretens einer Neu­ tropenie zu überwachen, die auf CellCept selbst, auf die Begleitmedikation, virale In­ fektionen oder eine Kombination dieser Ur­ sachen zurückzuführen sein kann. Bei Pa­ tienten, die mit CellCept behandelt werden, soll ein komplettes Blutbild während des ersten Monats der Behandlung wöchentlich, während des zweiten und dritten Monats der Behandlung zweimal pro Monat und dann monatlich für die restlichen 9 Monate des ersten Behandlungsjahres erhoben wer­ den. Wenn sich eine Neutropenie entwickelt (absolute Neutrophilen-Zahl < 1,3 · 103/μl), könnte es angebracht sein, die Behandlung abzubrechen oder zu unterbrechen. Fälle von Erythroblastopenien (pure red cell aplasia [PRCA]) wurden bei Patienten, die mit CellCept in Kombination mit anderen Immunsuppressiva behandelt wurden, be­ richtet. Der Mechanismus einer durch My­ cophenolatmofetil induzierten PRCA ist un­ bekannt. Eine PRCA kann nach einer Dosis­ reduktion oder einem Abbruch der Thera­ pie mit CellCept reversibel sein. Bei Trans­ plantationspatienten sollte eine Änderung der Behandlung mit CellCept nur unter ge­ eigneter Kontrolle vorgenommen werden, 2 um das Risiko einer Abstoßungsreaktion so gering wie möglich zu halten (siehe Ab­ schnitt 4.8). Patienten, die mit CellCept behandelt wer­ den, sollen angewiesen werden, sofort über jedes Anzeichen einer Infektion, unerwartete Blutergüsse, Blutungen oder andere Mani­ festationen einer Knochenmarksdepression zu berichten. Die Patienten sollen informiert werden, dass Impfungen während der Behandlung mit CellCept weniger wirksam sein können, und dass die Anwendung von attenuierten Lebendimpfstoffen vermieden werden soll (siehe Abschnitt 4.5). Eine Grippeimpfung könnte vorteilhaft sein. Der verschreibende Arzt soll sich an die nationalen Richtlinien zur Grippeimpfung halten. Verdauungstrakt CellCept ist mit einer erhöhten Inzidenz von Nebenwirkungen im Verdauungstrakt – ein­ schließlich seltener Fälle von gastrointes­ tinalen Ulcera, Blutungen und Perforatio­ nen – in Zusammenhang gebracht worden. CellCept sollte bei Patienten mit aktiven, schwerwiegenden Erkrankungen des Ver­ dauungstraktes nur zurückhaltend verab­ reicht werden. CellCept ist ein Inhibitor der IMPDH (Inosin­ monophosphatdehydrogenase). Aus diesem Grund soll das Präparat bei Patienten mit seltener erblicher Defizienz der Hypoxanthin­ Guanin-Phosphoribosyltransferase (HGPRT) wie dem Lesch-Nyhan- und dem Kelley­ Seegmiller-Syndrom nicht angewandt wer­ den. Wechselwirkungen Vorsicht ist geboten bei der Umstellung von Kombinationstherapien, die Immunsuppres­ siva enthalten, die den enterohepatischen Kreislauf von MPA beeinflussen, z. B. Ciclo­ sporin, auf andere Kombinationstherapien, die keine solchen Auswirkungen haben, z. B. Sirolimus, Belatacept, oder umge­ kehrt, da dies zu Veränderungen der MPAExposition führen kann. Arzneimittel ande­ rer Substanzklassen, die den enterohepati­ schen Kreislauf von MPA beeinflussen, z. B. Cholestyramin, sollten mit Vorsicht ange­ wendet werden, da hierdurch die Plasma­ spiegel und die Wirksamkeit von CellCept verringert werden können (siehe auch Ab­ schnitt 4.5). Es wird empfohlen, CellCept nicht zusam­ men mit Azathioprin zu geben, da die gleich­ zeitige Anwendung nicht untersucht wor­ den ist. Das Nutzen-Risiko-Verhältnis von Myco­ phenolatmofetil in Kombination mit Tacroli­ mus oder Sirolimus wurde noch nicht un­ tersucht (siehe auch Abschnitt 4.5). Besondere Patientengruppen Bei älteren Patienten kann das Risiko für Nebenwirkungen im Vergleich zu jüngeren erhöht sein; dazu zählen bestimmte Infek­ tionen (einschließlich invasiver Gewebebe­ fall durch das Zytomegalie-Virus) und mög­ licherweise gastrointestinale Blutungen und Lungenödem (siehe Abschnitt 4.8). Teratogene Wirkungen Mycophenolat ist ein beim Menschen stark wirksames Teratogen. Fehlgeburten (Rate 45 % – 49 %) und kongenitale Missbildun­ gen (geschätzte Rate 23 % – 27 %) sind nach MMF-Exposition in der Schwanger­ schaft berichtet worden. Daher ist CellCept in der Schwangerschaft kontraindiziert, au­ ßer wenn keine geeignete alternative Be­ handlung zur Verfügung steht, um eine Transplantatabstoßung zu verhindern. Weibliche und männliche Patienten im fort­ pflanzungsfähigen Alter müssen über die Risiken aufgeklärt werden und vor, während und nach Behandlung mit CellCept die Empfehlungen in Abschnitt 4.6 befolgen (z. B. Verhütungsmethoden, Schwanger­ schaftstests). Ärzte sollen sicherstellen, dass Frauen und Männer, die Mycophenolat an­ wenden, die Risiken einer Schädigung des Babys, die Notwendigkeit einer wirksamen Verhütung und die Notwendigkeit im Fall einer möglichen Schwangerschaft ihren Arzt sofort zu benachrichtigen, verstehen. Verhütung (siehe Abschnitt 4.6) Aufgrund des mutagenen und teratogenen Potenzials von CellCept müssen Frauen im gebärfähigen Alter vor Beginn der Behand­ lung, während der Behandlung sowie noch für 6 Wochen nach Beendigung der Be­ handlung mit CellCept zwei zuverlässige Formen der Kontrazeption gleichzeitig an­ wenden; es sei denn, Abstinenz wird als Kontrazeptionsmethode gewählt (siehe Ab­ schnitt 4.5). Sexuell aktiven Männern wird empfohlen, während der Behandlung und für mindes­ tens 90 Tage nach Beendigung der Be­ handlung Kondome zu benutzen. Die An­ wendung von Kondomen gilt sowohl für fortpflanzungsfähige Männer als auch für Männer mit Vasektomie, da die Risiken, die mit dem Transfer von Samenflüssigkeit ver­ bunden sind, auch bei Männern mit Vasek­ tomie bestehen. Zusätzlich wird Partnerin­ nen von männlichen Patienten empfohlen, während der Behandlung und noch insge­ samt 90 Tage nach der letzten Dosis von CellCept eine hochwirksame Verhütungs­ methode anzuwenden. Schulungsmaterialien Der Inhaber der Genehmigung für das In­ verkehrbringen stellt Angehörigen der Ge­ sundheitsberufe Schulungsmaterialien zur Verfügung, um Patienten zu unterstützen, eine Exposition des Fetus gegenüber My­ cophenolat zu vermeiden, und um weitere wichtige Sicherheitsinformationen bereitzu­ stellen. Die Schulungsmaterialien werden die Warnhinweise zur Teratogenität von Mycophenolat stützen, Ratschläge zur Ver­ hütung vor Beginn der Therapie und An­ weisungen über die Notwendigkeit von Schwangerschaftstests geben. Der Arzt soll Frauen im gebärfähigen Alter und, soweit erforderlich, den männlichen Patienten voll­ umfängliche Patienteninformationen über das teratogene Risiko und die Schwanger­ schaftverhütungsmaßnahmen geben. Zusätzliche Vorsichtsmaßnahmen Patienten dürfen während und für mindes­ tens 6 Wochen nach Abbruch einer Behand­ lung mit Mycophenolat kein Blut spenden. Männer dürfen während und für 90 Tage 000094-17733 Fachinformation CellCept® 500 mg Filmtabletten nach Abbruch einer Behandlung von Myco­ phenolat keinen Samen spenden. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Aciclovir Im Vergleich zur alleinigen Gabe von Aciclo­ vir wurden höhere Plasmakonzentrationen von Aciclovir beobachtet, wenn Mycophe­ nolatmofetil und Aciclovir zusammen ver­ abreicht wurden. Die Veränderungen der Pharmakokinetik von MPAG (dem phenoli­ schen Glucuronid von MPA) waren minimal (MPAG-Anstieg um 8 %) und werden als klinisch nicht signifikant betrachtet. Da die Plasmakonzentrationen von MPAG und von Aciclovir bei Niereninsuffizienz erhöht sind, besteht die Möglichkeit, dass Mycopheno­ latmofetil und Aciclovir oder deren Pro­ drugs, z. B. Valaciclovir, um die tubuläre Sekretion konkurrieren und es zu einem weiteren Konzentrationsanstieg der beiden Substanzen kommen kann. Antazida und Protonenpumpeninhibitoren (PPIs) Bei gleichzeitiger Verabreichung von CellCept mit Antazida, wie z. B. Magne sium- und Aluminiumhydroxid, und Protonenpumpen­ inhibitoren, einschließlich Lansoprazol und Pantoprazol, wurde eine verringerte MPAExposition beobachtet. Ein Vergleich der Häufigkeit des Auftretens von Transplantatabstoßungen oder Transplantatverlusten zwischen Patienten, die mit CellCept und Protonenpumpeninhibitoren und Patienten, die mit CellCept ohne Protonenpumpen­ inhibitoren behandelt wurden, ergab keine signifikanten Unterschiede. Diese Daten stützen die Extrapolation dieses Ergebnis­ ses auf alle Antazida, da die Verringerung der Exposition bei gleichzeitiger Anwendung von CellCept mit Magnesium- und Alumi­ niumhydroxid weitaus geringer war als bei gleichzeitiger Anwendung von CellCept mit Protonenpumpeninhibitoren. Colestyramin Nach Verabreichung einer Einzeldosis von 1,5 g Mycophenolatmofetil an gesunde Probanden, die vier Tage lang mit dreimal täglich 4 g Colestyramin vorbehandelt wor­ den waren, ging die AUC von MPA um 40 % zurück (siehe Abschnitt 4.4 und Ab­ schnitt 5.2). Aufgrund des Potenzials, die Wirksamkeit von CellCept zu reduzieren, ist bei gleichzeitiger Verabreichung Vorsicht geboten. November 2015 Arzneimittel, die den enterohepatischen Kreislauf beeinflussen Vorsicht ist aufgrund ihres Potenzials, die Wirksamkeit von CellCept zu reduzieren, bei Arzneimitteln geboten, die den entero­ hepatischen Kreislauf beeinflussen. Ciclosporin A Die Pharmakokinetik von Ciclosporin A (CsA) wird durch Mycophenolatmofetil nicht be­ einflusst. Im Gegensatz dazu ist ein Anstieg der AUC von MPA um ca. 30 % zu erwarten, wenn die Begleitbehandlung mit Ciclosporin ab­ gebrochen wird. CsA beeinflusst den entero­ hepatischen Kreislauf von MPA, was bei Nierentransplantationspatienten, die mit CellCept und CsA behandelt werden, im 000094-17733 Vergleich zu Patienten, die Sirolimus oder Belatacept und vergleichbare Dosen von CellCept erhielten, zu einem Abfall der MPAExposition um 30 % – 50 % führte (siehe auch Abschnitt 4.4). Umgekehrt sind Verän­ derungen in der MPA-Exposition zu erwar­ ten, wenn Patienten von CsA auf ein Im­ munsuppressivum umgestellt werden, das den enterohepatischen Kreislauf von MPA nicht beeinflusst. Telmisartan Die gleichzeitige Anwendung von Telmisar­ tan und CellCept führte zu einer Verringe­ rung der MPA-Konzentrationen von unge­ fähr 30 %. Telmisartan beeinflusst die Aus­ scheidung von MPA durch eine Verstärkung der PPAR-Gamma-Expression (Peroxisom­ Proliferator-aktivierte Rezeptoren Gamma), was wiederum zu einer verstärkten UGT1A9­ Expression und -Aktivität führt. Bei einem Vergleich der Transplantatabstoßungsraten, Transplantatverlustraten oder Nebenwir­ kungsprofilen zwischen CellCept Patienten mit und ohne gleichzeitiger Anwendung von Telmisartan wurden keine klinischen Kon­ sequenzen der pharmakokinetischen Wech­ selwirkungen zwischen Arzneimitteln beob­ achtet. Ganciclovir Basierend auf den Resultaten einer Einzel­ dosisstudie mit der empfohlenen Dosis von oral verabreichtem Mycophenolatmofetil und intravenös verabreichtem Ganciclovir sowie den bekannten Effekten einer Nie­ reninsuffizienz auf die Pharmakokinetik von CellCept (siehe Abschnitt 4.2) und Ganci­ clovir wird erwartet, dass die gleichzeitige Verabreichung dieser Wirkstoffe (die um die renale tubuläre Sekretion konkurrieren) in erhöhten Konzentrationen von MPAG und Ganciclovir resultieren wird. Es wird keine wesentliche Veränderung der MPA-Phar­ makokinetik erwartet, demzufolge ist eine Dosisanpassung von CellCept nicht erfor­ derlich. Bei Patienten mit Niereninsuffizienz, denen CellCept und Ganciclovir oder ihre Prodrugs, z. B. Valganciclovir, gleichzeitig verabreicht werden, sind die Dosierungs­ empfehlungen für Ganciclovir zu beachten und die Patienten müssen sorgfältig über­ wacht werden. Orale Kontrazeptiva Die Pharmakokinetik und Pharmakodyna­ mik oraler Kontrazeptiva wurde durch gleich­ zeitige Verabreichung von CellCept nicht beeinflusst (siehe auch Abschnitt 5.2). Rifampicin Bei Patienten, die kein Ciclosporin einneh­ men, führte die gleichzeitige Anwendung von CellCept und Rifampicin zu einem Abfall der MPA-Exposition (AUC0 – 12h) um 18 % – 70 %. Es wird empfohlen, die MPAExposition zu überwachen und die Dosis von CellCept entsprechend anzupassen, um die klinische Wirksamkeit aufrechtzuer­ halten, wenn gleichzeitig Rifampicin verab­ reicht wird. Sevelamer Ein Abfall der Cmax und der AUC0 – 12h von MPA um 30 % bzw. 25 % wurde beobach­ tet, wenn CellCept zusammen mit Sevela­ mer verabreicht wurde, dies hatte jedoch keine klinischen Konsequenzen (d. h. Trans­ plantatabstoßungsreaktion). Es ist dennoch empfehlenswert, CellCept mindestens eine Stunde vor oder drei Stunden nach der Ein­ nahme von Sevelamer zu verabreichen, um die Auswirkungen auf die Absorption von MPA so gering wie möglich zu halten. Zur Kombination von CellCept mit anderen Phosphatbindern als Sevelamer liegen keine Daten vor. Trimethoprim/Sulfamethoxazol Es wurde keine Auswirkung auf die Biover­ fügbarkeit von MPA beobachtet. Norfloxacin und Metronidazol Bei gesunden Freiwilligen wurde keine si­ gnifikante Interaktion beobachtet, wenn CellCept zusammen mit Norfloxacin oder Metronidazol zeitlich getrennt verabreicht wurde. Die kombinierte Gabe von Norfloxa­ cin und Metronidazol reduzierte jedoch die MPA-Exposition nach einer Einzeldosis von CellCept um ca. 30 %. Ciprofloxacin und Amoxicillin plus Clavulan­ säure In den ersten Tagen nach Beginn einer ora­ len Therapie mit Ciprofloxacin oder Amoxi­ cillin plus Clavulansäure wurde bei Nieren­ transplantationspatienten eine Reduktion der MPA-Talspiegel um ca. 50 % berichtet. Dieser Effekt tendierte während einer an­ dauernden Antibiotikagabe dazu, sich ab­ zuschwächen und innerhalb weniger Tage nach dem antibiotischen Absetzen wegzu­ fallen. Die Veränderung der Talspiegel könn­ te möglicherweise die Veränderungen der Gesamt-MPA-Exposition nicht korrekt wi­ derspiegeln. Daher sollte normalerweise und solange keine klinische Evidenz einer Dys­ funktion des transplantierten Organs vor­ liegt, eine Änderung der Dosis von CellCept nicht notwendig sein. Während der Kombi­ nationstherapie und für kurze Zeit nach der Antibiotikabehandlung sollte jedoch eine intensive klinische Kontrolle erfolgen. Tacrolimus Bei Lebertransplantationspatienten, die von Anfang an CellCept und Tacrolimus erhielten, wurden die AUC und die Cmax von MPA, dem aktiven Metaboliten von CellCept, durch gleichzeitige Verabreichung von Tacrolimus nicht signifikant beeinflusst. Im Gegensatz dazu kam es bei wiederholter Gabe von CellCept (1,5 g zweimal täglich) an Lebertransplantationspatienten, die gleichzeitig mit Tacrolimus behandelt wur­ den, zu einer Erhöhung der Tacrolimus-AUC um ca. 20 %. Bei Nierentransplantations­ patienten scheint CellCept die Konzentra­ tion von Tacrolimus jedoch nicht zu verän­ dern (siehe auch Abschnitt 4.4). Weitere Interaktionen Die gleichzeitige Verabreichung von Probe­ necid und Mycophenolatmofetil an Affen bewirkt einen dreifachen Anstieg der AUC von MPAG. Daher können andere Präparate, die bekanntermaßen in den Nierentubuli sezerniert werden, mit MPAG in Konkurrenz treten, wodurch es zu einer Erhöhung der Plasmakonzentration von MPAG oder des anderen Präparates, das der tubulären Se­ kretion unterworfen ist, kommen kann. Lebendimpfstoffe Patienten mit einer geschwächten Immun­ antwort sollen nicht mit Lebendimpfstoffen immunisiert werden. Die Bildung von Anti3 Fachinformation CellCept® 500 mg Filmtabletten körpern auf andere Impfstoffe könnte abge­ schwächt sein (siehe auch Abschnitt 4.4). nachrichtigen müssen, falls sie schwanger geworden sind. Kinder und Jugendliche Studien zur Erfassung von Wechselwirkun­ gen wurden nur bei Erwachsenen durchge­ führt. Mycophenolat ist ein beim Menschen stark wirksames Teratogen, bei dem bei Exposi­ tion in der Schwangerschaft ein erhöhtes Risiko für Fehlgeburten und kongenitale Missbildungen besteht. 4.6 Schwangerschaft und Stillzeit Verhütung bei Männern und Frauen CellCept ist bei Frauen im gebärfähigen Al­ ter, die keine hochwirksame Verhütung an­ wenden, kontraindiziert. Aufgrund des mutagenen und teratogenen Potenzials von CellCept müssen Frauen im gebärfähigen Alter vor Beginn der Behand­ lung, während der Behandlung sowie für 6 Wochen nach Beendigung der Behand­ lung mit CellCept zwei zuverlässige Formen der Kontrazeption gleichzeitig anwenden, es sei denn, Abstinenz wird als Kontrazep­ tionsmethode gewählt (siehe Abschnitt 4.5). Sexuell aktiven Männern wird empfohlen, während der Behandlung und mindestens für 90 Tage nach Beendigung der Behand­ lung Kondome zu benutzen. Die Anwen­ dung von Kondomen gilt sowohl für fort­ pflanzungsfähige Männer als auch für Män­ ner mit Vasektomie, da die Risiken, die mit dem Transfer von Samenflüssigkeit verbun­ den sind, auch bei Männern mit Vasektomie bestehen. Zusätzlich wird Partnerinnen von männlichen Patienten empfohlen, während der Behandlung und noch insgesamt 90 Ta­ ge nach der letzten Dosis von CellCept eine hochwirksame Verhütungsmethode anzu­ wenden. Schwangerschaft CellCept ist in der Schwangerschaft kontra­ indiziert, außer wenn es keine geeignete alternative Behandlung zur Verhinderung einer Transplantatabstoßung gibt. Eine Be­ handlung darf ohne Vorlage eines negati­ ven Schwangerschaftstestergebnisses nicht begonnen werden, um eine unbeabsichtig­ te Anwendung während der Schwanger­ schaft auszuschließen. Weibliche und männliche Patienten im fort­ pflanzungsfähigen Alter müssen zu Beginn der Behandlung über das erhöhte Risiko für Fehlgeburten und kongenitale Missbildun­ gen informiert werden und zu Schwanger­ schaftsverhütung und -planung beraten wer­ den. Vor Beginn einer CellCept Behandlung müs­ sen Frauen im gebärfähigen Alter einen Schwangerschaftstest haben, um eine un­ beabsichtigte Exposition des Embryos ge­ genüber Mycophenolat auszuschließen. Zwei Serum- oder Urin-Schwangerschafts­ tests mit einer Sensitivität von mindestens 25 mIE/ml werden empfohlen. Der zweite Test soll 8 – 10 Tage nach dem ersten durch­ geführt werden und unmittelbar vor Beginn der Behandlung mit Mycophenolatmofetil. Schwangerschaftstests sollen wiederholt werden, falls klinisch indiziert (z. B. nach­ dem eine Verhütungslücke berichtet wurde). Die Ergebnisse aller Schwangerschafts­ tests sollen mit den Patientinnen bespro­ chen werden. Die Patientinnen sind darauf hinzuweisen, dass sie ihren Arzt sofort be­ 4 • Fehlgeburten wurden bei 45 % bis 49 % der schwangeren Frauen berichtet, die Mycophenolatmofetil angewendet haben, verglichen mit einer berichteten Rate von 12 % bis 33 % bei Patienten mit solider Organtransplantation, die mit anderen Immunsuppressiva als Mycophenolat­ mofetil behandelt wurden. • Nach Berichten in der Literatur traten Missbildungen bei 23 % bis 27 % der Lebendgeburten bei Frauen auf, die My­ cophenolatmofetil während der Schwan­ gerschaft angewendet hatten (verglichen mit 2 % bis 3 % bei Lebendgeburten in der Allgemeinpopulation und ungefähr 4 % bis 5 % bei Lebendgeburten bei so­ liden Organtransplantationsempfängern, die mit anderen Immunsuppressiva als Mycophenolatmofetil behandelt wurden). Nach der Markteinführung wurde bei Kin­ dern von mit CellCept in Kombination mit anderen Immunsuppressiva während der Schwangerschaft behandelten Patienten, über angeborene Missbildungen, einschließ­ lich multipler Missbildungen, berichtet. Die folgenden Missbildungen wurden am häu­ figsten berichtet: • Missbildungen der Ohren (z. B. anormal geformtes oder fehlendes Außen-/Mittel­ ohr), Atresie des äußeren Gehörgangs; • Kongenitale Herzerkrankungen, wie z. B. artriale und ventrikuläre Septumdefekte; • Missbildungen im Gesicht, wie z. B. Lip­ penspalte, Gaumenspalte, Mikrognathie und Hypertelorismus der Augenhöhlen; • Anomalien der Augen (z. B. Kolobom); • Missbildungen der Finger (z. B. Polydak­ tylie, Syndaktylie); • Tracheoösophageale Missbildungen (z. B. ösophageale Atresie); • Missbildungen des Nervensystems, wie z. B. Spina bifida; • Anomalien der Niere. Zusätzlich gab es einzelne Berichte über folgende Missbildungen: • Mikrophthalmie; • Kongenitale Plexus choroideus–Zysten; • Agenesie des Septum pellucidum; • Agenesie des olfaktorischen Nervs. T ierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Ab­ schnitt 5.3). Stillzeit Es hat sich gezeigt, dass Mycophenolat­ mofetil in die Muttermilch von laktierenden Ratten übertritt. Es ist nicht bekannt, ob der Wirkstoff auch beim Menschen in die Mut­ termilch übergeht. Aufgrund des Risikos schwerer unerwünschter Wirkungen von Mycophenolatmofetil beim gestillten Kind, ist CellCept bei stillenden Müttern kontra­ indiziert (siehe Abschnitt 4.3). 4.7 Auswirkungen auf die Verkehrs­ tüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Es wurden keine Studien zu den Auswir­ kungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Aufgrund der pharmakody­ namischen Eigenschaften und der beob­ achteten Nebenwirkungen ist ein Einfluss unwahrscheinlich. 4.8 Nebenwirkungen Die folgenden Nebenwirkungen sind während klinischer Studien aufgetreten Die häufigsten Nebenwirkungen im Zu­ sammenhang mit der Verabreichung von CellCept in Kombination mit Ciclosporin und Corticosteroiden sind Diarrhö, Leuko­ penie, Sepsis und Erbrechen, und es ist erwiesen, dass bestimmte Infektionsarten häufiger auftreten (siehe Abschnitt 4.4). Malignome Patienten, die unter Behandlung mit Im­ munsuppressiva stehen und hierzu eine Kombination von Arzneimitteln, einschließ­ lich CellCept, erhalten, sind einem erhöh­ ten Risiko von Lymphomen und anderen Malignomen, insbesondere der Haut, aus­ gesetzt (siehe Abschnitt 4.4). 0,6 % der Patienten, die CellCept (2 g oder 3 g täg­ lich) zusammen mit anderen immunsup­ pressiven Substanzen in kontrollierten kli­ nischen Studien mit Nieren- (2-g-Daten), Herz- und Lebertransplantationspatienten erhielten und mindestens 1 Jahr nach­ beobachtet wurden, entwickelten lympho­ proliferative Erkrankungen und Lymphome. Nicht-Melanom-Hautkarzinome traten bei 3,6 % der Patienten auf; andere Malignome bei 1,1 % der Patienten. Sicherheitsdaten über 3 Jahre ergaben bei Nieren- und Herztransplantationspatienten im Vergleich zu den 1-Jahresdaten keine unerwarteten Veränderungen bei der Malignominzidenz. Lebertransplantationspatienten wurden min­ destens 1 Jahr, aber weniger als 3 Jahre nachbeobachtet. Opportunistische Infektionen Alle Transplantationspatienten sind einem erhöhten Risiko für opportunistische Infek­ tionen ausgesetzt; das Risiko steigt mit der Gesamtbelastung durch immunsuppressi­ ve Medikationen (siehe Abschnitt 4.4). Die häufigsten opportunistischen Infektionen bei Patienten, die CellCept (2 g oder 3 g täglich) zusammen mit anderen immunsuppressiven Substanzen in kontrollierten klinischen Stu­ dien mit Nieren- (2-g-Daten), Herz- und Lebertransplantationspatienten, die mindes­ tens 1 Jahr nachbeobachtet wurden, erhiel­ ten, waren mukokutane Candidose, CMVVirämie/Syndrom und Herpes simplex. Der Anteil der Patienten mit CMV-Virämie/Syn­ drom betrug 13,5 %. Kinder und Jugendliche Die Art und Häufigkeit von Nebenwirkun­ gen bei 92 in eine klinische Studie einge­ schlossenen pädiatrischen Patienten im Alter von 2 bis 18 Jahren, denen oral zwei­ mal täglich 600 mg/m2 Mycophenolatmo­ fetil verabreicht wurde, ähnelten im Allge­ meinen denen, die bei erwachsenen Pa­ tienten, welche CellCept in einer Dosis von zweimal täglich 1 g erhielten, beobachtet 000094-17733 Fachinformation CellCept® 500 mg Filmtabletten wurden. Die folgenden therapieabhängigen Nebenwirkungen traten jedoch in der pä­ diatrischen Population, und dort vor allem bei Kindern unter 6 Jahren, im Vergleich zu Erwachsenen häufiger auf: Diarrhö, Sepsis, Leukopenie, Anämie und Infektionen. Systemorganklasse Infektionen und parasitäre Erkrankungen Nebenwirkungen Sehr häufig Sepsis, gastrointestinale Candidose, Harnwegsinfektion, Herpes simplex, Herpes zoster Häufig Lungenentzündung, Influenza, Infektion der Atemwege, Candidose der Atemwege, gastrointestinale Infektion, Candidose, Gastroenteritis, Infektion, Bronchitis, Pharyngitis, Sinusitis, pilzbedingte Derma­ titis, Candidose der Haut, vaginale Candi­ dose, Rhinitis Ältere Menschen Ältere Patienten (≥ 65 Jahre) können grund­ sätzlich einem höheren Risiko für Neben­ wirkungen aufgrund von Immunsuppres­ sion unterliegen. Für ältere Patienten, die CellCept als Teil einer immunsuppressiven Kombinationstherapie erhalten, kann im Vergleich zu jüngeren Patienten ein erhöh­ tes Risiko für bestimmte Infektionen (ein­ schließlich eines invasiven Gewebebefalls durch das Zytomegalie-Virus) und mög­ licherweise für gastrointestinale Blutungen und Lungenödeme bestehen. Andere Nebenwirkungen Nebenwirkungen, die wahrscheinlich oder möglicherweise mit CellCept in Zusammen­ hang stehen und in kontrollierten klinischen Studien bei ≥ 1/10 und bei ≥ 1/100 bis < 1/10 der mit CellCept behandelten Nieren(2-g-Daten), Herz- und Lebertransplanta­ tionspatienten gemeldet wurden, sind in der nachfolgenden Tabelle aufgelistet. Wahrscheinlich oder möglicherweise mit CellCept verbundene Nebenwirkun­ gen, die bei Patienten beschrieben wur­ den, die in klinischen Nieren-, Herzoder Lebertransplantationsstudien mit CellCept in Kombination mit Ciclosporin und Corticosteroiden behandelt wurden Innerhalb der Systemorganklassen werden die Nebenwirkungen unter Überschriften zur Häufigkeit aufgeführt, wobei folgende Kategorien Anwendung finden: Sehr häufig (≥ 1/10), häufig (≥ 1/100 bis < 1/10), gele­ gentlich (≥ 1/1.000 bis < 1/100), selten (≥ 1/10.000 bis < 1/1.000), sehr selten (< 1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht ab­ schätzbar). Innerhalb jeder Häufigkeitsgrup­ pe werden die Nebenwirkungen nach ab­ nehmendem Schweregrad angegeben. Siehe neben stehende Tabelle Die folgenden Nebenwirkungen sind nach der Markteinführung beobachtet worden Die Nebenwirkungen, über die nach der Markteinführung von CellCept berichtet wurde, gleichen denen, die in den kontrol­ lierten Nieren-, Herz- und Lebertransplan­ tationsstudien beobachtet wurden. Weitere Nebenwirkungen, über die nach der Markt­ einführung berichtet wurde, sind unter An­ gabe der Häufigkeit in Klammern, falls sie bekannt ist, nachfolgend beschrieben. Verdauungstrakt November 2015 Zahnfleischhyperplasie (≥ 1/100 bis < 1/10), Colitis, einschließlich CytomegalievirusColitis (≥ 1/100 bis < 1/10), Pankreatitis (≥ 1/100 bis < 1/10) und Atrophie der Villi intestinales. Infektionen Schwerwiegende, lebensbedrohende Infek­ tionen einschließlich Meningitis, Endokardi­ tis, Tuberkulose und atypische Mykobakte­ rieninfektion. Fälle von BK-Virus-Nephropathie sowie mit dem JC-Virus verbundener progressiver 000094-17733 Gutartige, bösartige und unspezifische Neubildungen (einschl. Zysten und Polypen) Sehr häufig Häufig Hautkrebs, benigne Neoplasie der Haut Erkrankungen des Blutes und des Lymphsystems Sehr häufig Leukopenie, Thrombozytopenie, Anämie Stoffwechsel- und Ernährungs­ störungen Sehr häufig Psychiatrische Erkrankungen Sehr häufig Häufig Häufig Häufig Erkrankungen des Nerven­ systems Sehr häufig Herzerkrankungen Sehr häufig Häufig Häufig Gefäßerkrankungen Sehr häufig Häufig Erkrankungen der Atemwege, des Brustraums und Mediastinums Sehr häufig Erkrankungen des Gastro­ intestinaltrakts Sehr häufig Häufig Häufig Leber- und Gallenerkrankungen Sehr häufig Häufig Erkrankungen der Haut und des Unterhautzellgewebes Sehr häufig Skelettmuskulatur-, Binde­ gewebs- und Knochen­ erkrankungen Sehr häufig Erkrankungen der Nieren und Harnwege Sehr häufig Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Sehr häufig Untersuchungen Sehr häufig Häufig Häufig Häufig Häufig Häufig – Panzytopenie, Leukozytose – Azidose, Hyperkaliämie, Hypokaliämie, Hy­ perglykämie, Hypomagnesiämie, Hypokal­ ziämie, Hypercholesterinämie, Hyperlipid­ ämie, Hypophosphatämie, Hyperurikämie, Gicht, Anorexie – Erregung, Verwirrung, Depression, Angst, abnormes Denken, Schlaflosigkeit – Konvulsionen, Hypertonie, Tremor, Somno­ lenz, pseudomyasthenisches Syndrom, Be­ nommenheit, Kopfschmerzen, Parästhesie, Dysgeusia – Tachykardie – Hypotonie, Hypertonie, Vasodilatation – Pleuraerguss, Dyspnoe, Husten Erbrechen, Bauchschmerzen, Diarrhö, Übelkeit Magen-Darm-Blutungen, Peritonitis, Ileus, Colitis, Magengeschwür, Duodenalge­ schwür, Gastritis, Ösophagitis, Stomatitis, Verstopfung, Dyspepsie, Flatulenz, Aufstoßen – Hepatitis, Ikterus, Hyperbilirubinämie – Hypertrophie der Haut, Exanthem, Akne, Alopezie – Gelenkschmerzen – Niereninsuffizienz – Ödeme, Fieber, Schüttelfrost, Schmerzen, Unwohlsein, Asthenie – Erhöhte Leberenzymwerte, erhöhte Kreatinin­ werte im Blut, erhöhte Laktat-Dehydroge­ nase-Werte im Blut, erhöhte Blut-HarnstoffWerte, erhöhte alkalische Phosphatase im Blut, Gewichtsverlust Anmerkung: 501 (Tagesdosis: 2 g CellCept), 289 (Tagesdosis: 3 g CellCept) und 277 (Tages­ dosis: 2 g i. v./3 g CellCept oral) Patienten wurden in Phase-III-Studien zur Verhinderung einer Abstoßung nach Nieren-, Herz- und Lebertransplantation behandelt. 5 Fachinformation CellCept® 500 mg Filmtabletten multifokaler Leukoenzephalopathie (PML) wurden bei Patienten berichtet, die mit Im­ munsuppressiva, einschließlich CellCept, behandelt wurden. Agranulozytose (≥ 1/1.000 bis < 1/100) und Neutropenie wurden gemeldet; daher ist ein regelmäßiges Monitoring der Patienten, welche CellCept einnehmen, ratsam (siehe Abschnitt 4.4). Es gab Berichte über aplas­ tische Anämie und Knochenmarksdepres­ sion bei Patienten, die mit CellCept behan­ delt wurden, einige davon mit letalem Aus­ gang. Erkrankungen des Blutes und des Lymphsystems Fälle von Erythroblastopenien (pure red cell aplasia [PRCA]) wurden bei Patienten, die mit CellCept behandelt wurden, berichtet (siehe Abschnitt 4.4). Einzelfälle abnormaler Morphologie neutro­ philer Granulozyten, wie die erworbene Pelger-Huët-Anomalie, wurden bei Patien­ ten, die mit CellCept behandelt wurden, beobachtet. Diese Veränderungen sind nicht mit einer ungenügenden Funktion der neutrophilen Granulozyten verbunden. Die­ se Veränderungen können bei Blutuntersu­ chungen eine „Linksverschiebung“ in der Reifung der neutrophilen Granulozyten ver­ muten lassen, die bei immunsupprimierten Patienten, wie Patienten, die CellCept er­ halten, versehentlich als Infektion interpre­ tiert werden kann. Überempfindlichkeit Es wurden Überempfindlichkeitsreaktionen, einschließlich angioneurotischem Ödem und anaphylaktischer Reaktionen, gemeldet. Schwangerschaft, Wochenbett und perinatale Erkrankungen Bei Patienten, die Mycophenolatmofetil an­ gewendet haben, wurden Fälle von Fehlge­ burten berichtet, die hauptsächlich im ers­ ten Trimenon auftraten, siehe Abschnitt 4.6. Kongenitale Erkrankungen Nach der Markteinführung wurden bei Kin­ dern von mit CellCept in Kombination mit anderen Immunsuppressiva behandelten Patienten kongenitale Missbildungen beob­ achtet, siehe Abschnitt 4.6. Erkrankungen der Atemwege, des Brustraums und Mediastinums Bei Patienten, die eine Kombinationsbe­ handlung von CellCept mit anderen Immun­ suppressiva erhielten, gab es Einzelfallbe­ richte über interstitielle Lungenerkrankun­ gen und Lungenfibrosen, von denen einige einen tödlichen Ausgang hatten. Bei Kin­ dern und Erwachsenen ist auch Bronchiek­ tasie berichtet worden (Häufigkeit nicht be­ kannt). Erkrankungen des Immunsystems Bei Patienten, die CellCept in Kombination mit anderen Immunsuppressiva erhielten, ist über Hypogammaglobulinämie berichtet worden (Häufigkeit nicht bekannt). Meldung des Verdachts auf Nebenwirkun­ gen Die Meldung des Verdachts auf Nebenwir­ kungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuier­ liche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, 6 jeden Verdachtsfall einer Nebenwirkung über das nationale Meldesystem dem Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn Website: http://www.bfarm.de anzuzeigen. 4.9 Überdosierung Berichte zu Überdosierungen von Mycophe­ nolatmofetil gingen während klinischer Prü­ fungen und nach der Markteinführung ein. In vielen dieser Fälle wurden keine Nebenwir­ kungen gemeldet. In den Fällen von Über­ dosierung, in denen Nebenwirkungen ge­ meldet wurden, fallen die Ereignisse in das bekannte Sicherheitsprofil des Arzneimittels. Es ist zu erwarten, dass eine Überdosis My­ cophenolatmofetil möglicherweise zu einer übermäßigen Unterdrückung des Immun­ systems führt und die Infektionsanfälligkeit und die Suppression des Knochenmarks erhöht (siehe Abschnitt 4.4). Wenn sich eine Neutropenie entwickelt, muss die Verabrei­ chung von CellCept unterbrochen oder die Dosis reduziert werden (siehe Abschnitt 4.4). Es ist nicht zu erwarten, dass durch Hämo­ dialyse klinisch signifikante Mengen MPA oder MPAG eliminiert werden können. Gal­ lensäurebindende Substanzen wie Colestyr­ amin können MPA durch eine Verminderung der Wiederaufnahme des Arzneimittels in den enterohepatischen Kreislauf eliminieren (siehe Abschnitt 5.2). 5. PHARMAKOLOGISCHE EIGEN­ SCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Immun­ suppressiva, ATC-Code: L04AA06 Wirkmechanismus Mycophenolatmofetil ist der 2-Morpholino­ ethylester von MPA. MPA ist ein hoch wirk­ samer, selektiver, nicht kompetitiver und reversibler Hemmer der Inosinmonophos­ phat-Dehydrogenase und hemmt daher den De-novo-Weg der Guanosin-Nucleotidsyn­ these, ohne in die DNA eingebaut zu wer­ den. Da für die Proliferation von T- und BLymphozyten die De-novo-Synthese von Purinen unerlässlich ist, während andere Zellarten den Wiederverwertungsstoffwech­ sel benutzen können, wirkt MPA stärker zytostatisch auf Lymphozyten als auf ande­ re Zellen. 5.2 Pharmakokinetische Eigenschaften Resorption Nach oraler Verabreichung wird Mycophe­ nolatmofetil schnell und zu einem großen Teil absorbiert und in einer vollständigen präsystemischen Metabolisierung in MPA, den aktiven Metaboliten, umgewandelt. Wie durch die Suppression der akuten Absto­ ßungsreaktion nach Nierentransplantation gezeigt werden konnte, korreliert die immun­ suppressive Wirkung von CellCept mit der MPA-Konzentration. Die mittlere Bioverfüg­ barkeit von oral verabreichtem Mycophe­ nolatmofetil, basierend auf der AUC von MPA, beträgt 94 % im Vergleich zu i. v. ver­ abreichtem Mycophenolatmofetil. Der Ab­ sorptionsgrad (MPA-AUC) von Mycophe­ nolatmofetil wurde durch Nahrung nicht beeinflusst, wenn das Präparat in Dosen von zweimal täglich 1,5 g an Nierentrans­ plantationspatienten verabreicht wurde. Hin­ gegen nahm die Cmax von MPA in Gegen­ wart von Nahrung um 40 % ab. Mycophe­ nolatmofetil ist nach oraler Verabreichung im Plasma nicht messbar. Verteilung Aufgrund des enterohepatischen Kreis­ laufs beobachtet man im Allgemeinen 6 – 12 Stunden nach der Verabreichung einen sekundären Anstieg der Plasmakon­ zentration von MPA. Die AUC von MPA geht um ca. 40 % zurück, wenn Mycophe­ nolatmofetil gleichzeitig mit Colestyramin (4 g dreimal täglich) verabreicht wird, was auf einen ausgeprägten enterohepatischen Kreislauf hinweist. In klinisch relevanten Konzentrationen ist Mycophenolsäure zu 97 % an Plasmaalbu­ min gebunden. Biotransformation MPA wird hauptsächlich durch Glucuronyl­ transferase (Isoform UGT1A9) in inaktives phenolisches MPA-Glucuronid (MPAG) umgewandelt. In vivo wird MPAG über den enterohepatischen Kreislauf wieder in freies MPA umgewandelt. Acylglucuronid (AcMPAG) wird ebenfalls geringfügig gebil­ det. AcMPAG ist pharmakologisch wirksam und steht im Verdacht, für einige der Ne­ benwirkungen von MMF verantwortlich zu sein (Diarrhö, Leukopenie). Elimination Vernachlässigbare Mengen der Substanz werden als MPA (< 1 % der Dosis) mit dem Urin ausgeschieden. Nach oraler Verabrei­ chung von radioaktiv markiertem Myco­ phenolatmofetil wurde die verabreichte Dosis vollständig ausgeschieden, wobei 93 % der verabreichten Dosis mit dem Urin und 6 % mit den Fäzes eliminiert wurden. Der größte Teil (ca. 87 %) der verabreichten Dosis wird als MPAG mit dem Urin ausge­ schieden. Bei den üblichen klinischen Konzentrationen werden MPA und MPAG nicht durch Dialyse entfernt. Bei hohen MPAG-Plasmakonzen­ trationen (> 100 μg/ml) werden jedoch ge­ ringe Mengen MPAG entfernt. Durch die Beeinflussung des enterohepatischen Kreis­ laufs des Wirkstoffes verringern gallensäure­ bindende Substanzen wie Cholestyramin die MPA-AUC (siehe Abschnitt 4.9). Die Verteilung von MPA ist von verschiede­ nen Transportern abhängig. Organo-AnionTransporter-Polypeptide (OATPs) und das multidrug resistance associated protein 2 (MRP2) sind an der MPA-Verteilung beteiligt; OATP-Isoformen, MRP2 und breast cancer resistance protein (BCRP) sind Transporter, die mit der Gallenausscheidung der Glucu­ ronide in Verbindung gebracht werden. Das multidrug resistance protein 1 (MDR1) kann auch MPA transportieren, aber dessen Ein­ fluss scheint auf den Absorptionsprozess beschränkt zu sein. In der Niere interagieren 000094-17733 Fachinformation CellCept® 500 mg Filmtabletten MPA und deren Metabolite wirksam mit den Organo-Anion-Transportern der Niere. späten Posttransplantationsphase in allen Altersgruppen ähnlich. In der frühen Posttransplantationsphase (< 40 Tage nach Transplantation) lag die mittlere MPA-AUC der Nieren-, Herz- und Lebertransplantationspatienten um ca. 30 % und die Cmax um ca. 40 % unter den ent­ sprechenden Werten der späten Posttrans­ plantationsphase (3 – 6 Monate nach Trans­ plantation). Ältere Menschen Besondere Patientengruppen Niereninsuffizienz In einer Einzeldosisstudie (6 Probanden/ Gruppe) waren die mittleren AUC von MPA im Plasma bei Patienten mit schwerer chronischer Niereninsuffizienz (glomerulä­ re Filtrationsrate < 25 ml/min/1,73 m2) um 28 % – 75 % höher als die mittleren AUC gesunder Personen oder von Patienten mit Niereninsuffizienz geringeren Schweregra­ des. Jedoch war die mittlere MPAG-AUC nach Einzeldosen bei Patienten mit schwe­ rer Niereninsuffizienz 3- bis 6-mal größer als bei solchen mit leichter Nierenfunktions­ störung oder gesunden Probanden, was mit der bekannten renalen Elimination von MPAG in Einklang steht. Die Verabreichung von Mycophenolatmofetil in Mehrfachdo­ sen an Patienten mit schweren chronischen Nierenfunktionsstörungen ist nicht unter­ sucht worden. Für herz- oder lebertransplan­ tierte Patienten mit schwerer chronischer Niereninsuffizienz liegen keine Daten vor. Verzögerte renale Transplantatfunktion Bei Patienten mit verzögerter renaler Trans­ plantatfunktion nach der Verpflanzung war die mittlere MPA-AUC0 – 12h vergleichbar mit derjenigen von Patienten nach der Trans­ plantation, bei denen die Organfunktion nicht verzögert einsetzte. Die durchschnitt­ liche Plasma-MPAG-AUC0 – 12h war 2- bis 3-mal größer als bei Patienten nach der Transplantation, bei denen die Organfunk­ tion nicht verzögert war. Bei Patienten mit verzögerter renaler Transplantatfunktion kann ein vorübergehender Anstieg des freien MPA und der MPA-Plasmakonzen­ tration auftreten. Eine Dosisanpassung von CellCept erscheint nicht erforderlich. Beeinträchtigte Leberfunktion Bei Probanden mit Alkoholzirrhose waren die Glucuronidierungsprozesse von MPA in der Leber durch die Erkrankung des Leber­ parenchyms relativ wenig beeinträchtigt. Der Einfluss der Lebererkrankung auf die­ sen Prozess hängt wahrscheinlich von der jeweiligen Krankheit ab. Lebererkrankungen mit vorwiegender Schädigung der Galle, wie zum Beispiel die primäre biliäre Zirrhose, können sich jedoch anders auswirken. November 2015 Kinder und Jugendliche Bei 49 pädiatrischen Nierentransplanta­ tionspatienten (im Alter von 2 bis 18 Jah­ ren), denen oral zweimal täglich 600 mg/m2 Mycophenolatmofetil verabreicht wurde, wurden die pharmakokinetischen Parame­ ter ausgewertet. Mit dieser Dosis wurden ähnliche MPA-AUC-Werte erreicht wie bei erwachsenen Nierentransplantationspatien­ ten, welche CellCept in einer Dosis von zweimal täglich 1 g in der frühen und spä­ ten Posttransplantationsphase erhielten. Die MPA-AUC-Werte waren in der frühen und 000094-17733 Bei älteren Menschen (≥ 65 Jahre) ist die Pharmakokinetik von CellCept nicht ent­ sprechend untersucht worden. Patienten, die orale Kontrazeptiva einnehmen Die Pharmakokinetik oraler Kontrazeptiva wurde durch gleichzeitige Verabreichung von CellCept nicht beeinflusst (siehe Ab­ schnitt 4.5). Eine Studie, in der gleichzeitig CellCept (zweimal täglich 1 g) und orale Kontrazeptiva, welche Ethinylestradiol (0,02 mg bis 0,04 mg) und Levonorgestrel (0,05 mg bis 0,15 mg), Desogestrel (0,15 mg) oder Gestoden (0,05 mg bis 0,10 mg) ent­ halten, verabreicht wurden und welche bei 18 Frauen ohne Transplantat (die keine an­ deren Immunsuppressiva einnahmen) wäh­ rend 3 aufeinanderfolgenden Menstruations­ zyklen durchgeführt wurde, zeigte keinen klinisch relevanten Einfluss von CellCept auf die ovulationshemmende Wirkung von ora­ len Kontrazeptiva. Die Serumspiegel von LH, FSH und Progesteron wurden nicht si­ gnifikant beeinflusst. 5.3 Präklinische Daten zur Sicherheit In experimentellen Modellen war Mycophe­ nolatmofetil nicht tumorerzeugend. Die höchste Dosis, die in den Tierstudien zur Kanzerogenität geprüft wurde, ergab un­ gefähr die 2- bis 3-fache systemische Ver­ fügbarkeit (AUC oder Cmax) dessen, was bei Nierentransplantationspatienten nach Gabe der empfohlenen klinischen Dosis von 2 g/ Tag bzw. die 1,3- bis 2-fache systemische Verfügbarkeit (AUC oder Cmax) dessen, was bei Herztransplantationspatienten nach Gabe der empfohlenen klinischen Dosis von 3 g/ Tag gefunden wurde. Zwei Genotoxizitätsuntersuchungen (der In-vitro-Maus-Lymphom-Test und der In­ vivo-Maus-Knochenmark-Mikronucleustest) deuteten darauf hin, dass Mycophenolat­ mofetil ein Potenzial aufweist, chromoso­ male Aberrationen zu bewirken. Diese Ef­ fekte können mit der pharmakodynami­ schen Wirkungsweise in Verbindung ge­ bracht werden, d. h. mit der Inhibition der Nucleotidsynthese in sensitiven Zellen. An­ dere In-vitro-Untersuchungen zur Detektion von Genmutationen ergaben keinen Hin­ weis auf Genotoxizität. Mycophenolatmofetil beeinflusste in oralen Dosen von bis zu 20 mg/kg/Tag die Fertili­ tät männlicher Ratten nicht. Die systemi­ sche Verfügbarkeit dieser Dosis entspricht dem 2- bis 3-Fachen der empfohlenen kli­ nischen Dosis von 2 g/Tag für Nierentrans­ plantationspatienten bzw. der 1,3- bis 2-fa­ chen empfohlenen klinischen Dosis von 3 g/Tag für Herztransplantationspatienten. In einer Studie über die weibliche Fertilität und Fortpflanzung bei Ratten traten nach Verab­ reichung oraler Dosen von 4,5 mg/kg/Tag in der ersten Generation Missbildungen (ein­ schließlich Anophthalmie, Agnathie und Hy­ drocephalus) auf, ohne dass beim Mutter­ tier toxische Symptome beobachtet wurden. Die systemische Verfügbarkeit dieser Dosis entsprach ungefähr dem 0,5-Fachen der empfohlenen klinischen Dosis von 2 g/Tag für Nierentransplantationspatienten und un­ gefähr dem 0,3-Fachen der empfohlenen klinischen Dosis von 3 g/Tag für Herztrans­ plantationspatienten. Bei den behandelten Weibchen sowie bei den Nachkommen wurden keine Auswirkungen auf die Fertili­ tät und die Fortpflanzungsparameter fest­ gestellt. In teratologischen Studien an Ratten und Kaninchen kam es mit 6 mg/kg/Tag bei Ratten bzw. 90 mg/kg/Tag bei Kaninchen zu einer fetalen Resorption und zu Miss­ bildungen (einschließlich Anophthalmie, Ag­ nathie und Hydrocephalus [bei Ratten] bzw. kardiovaskulären und renalen Anomalien, wie z. B. Ektopie des Herzens und der Nie­ ren, Hernia diaphragmatica und Hernia umbilicalis [bei Kaninchen]), ohne dass beim Muttertier toxische Symptome auftraten. Die systemische Verfügbarkeit dieser Dosen entspricht ungefähr dem 0,5-Fachen oder weniger der empfohlenen klinischen Dosis von 2 g/Tag für Nierentransplantationspa­ tienten und ungefähr dem 0,3-Fachen der empfohlenen klinischen Dosis von 3 g/Tag für Herztransplantationspatienten (siehe Ab­ schnitt 4.6). Das blutbildende System und das Lymph­ system waren die Organe, die in den toxi­ kologischen Studien mit Mycophenolatmo­ fetil bei Ratten, Mäusen, Hunden und Affen in erster Linie betroffen waren. Diese Er­ scheinungen traten bei einer systemischen Verfügbarkeit auf, die der empfohlenen kli­ nischen Dosis von 2 g/Tag für Nierentrans­ plantationspatienten entsprach oder niedri­ ger war. Gastrointestinale Nebenwirkungen wurden bei Hunden bei einer systemischen Verfügbarkeit beobachtet, die der empfoh­ lenen klinischen Dosis entsprach bzw. niedriger war. Gastrointestinale und renale Nebenwirkungen in Verbindung mit Dehy­ dratation wurden auch bei Affen bei der höchsten Dosis beobachtet (die systemi­ sche Verfügbarkeit entsprach der nach Gabe der klinischen Dosis bzw. war grö­ ßer). Das präklinische Toxizitätsprofil von Mycophenolatmofetil scheint mit den Ne­ benwirkungen übereinzustimmen, die bei klinischen Studien beim Menschen beob­ achtet wurden. Dadurch liegen nun für die Patienten maßgebliche Ergebnisse zur Ver­ träglichkeit vor (siehe Abschnitt 4.8). 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile CellCept Tabletten Mikrokristalline Cellulose Povidon (K 90) Croscarmellose-Natrium Magnesiumstearat Überzug der Tablette Hypromellose Hyprolose Titandioxid (E 171) Macrogol 400 Indigocarmin, Aluminiumsalz (E 132) Eisen(III)-oxid (E 172) 6.2 Inkompatibilitäten Nicht zutreffend. 7 Fachinformation CellCept® 500 mg Filmtabletten 6.3 Dauer der Haltbarkeit 3 Jahre. 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht über 30 °C lagern. Die Blisterpackung im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen. 6.5 Art und Inhalt des Behältnisses CellCept Filmtabletten zu 500 mg: 1 Packung enthält 50 Tabletten (in Blister­ packungen zu 10 Stück) 1 Packung enthält 150 Tabletten (in Blister­ packungen zu 10 Stück) Es werden möglicherweise nicht alle Pa­ ckungsgrößen in den Verkehr gebracht. 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung Nicht verwendetes Arzneimittel oder Abfall­ material ist entsprechend den nationalen Anforderungen zu beseitigen. 7. INHABER DER ZULASSUNG Roche Registration Limited 6 Falcon Way Shire Park Welwyn Garden City AL7 1TW Vereinigtes Königreich 8. ZULASSUNGSNUMMER(N) EU/1/96/005/002 CellCept (50 Tabletten) EU/1/96/005/004 CellCept (150 Tabletten) 9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG Datum der Erteilung der Zulassung: 14. Februar 1996 Datum der letzten Verlängerung der Zulas­ sung: 13. März 2006 10. STAND DER INFORMATION November 2015 11. VERKAUFSABGRENZUNG Verschreibungspflichtig 12. PACKUNGSGRÖSSEN IN DEUTSCHLAND 50 Filmtabletten N 1 150 Filmtabletten N 2 13. KONTAKTADRESSE IN DEUTSCHLAND Roche Pharma AG Emil-Barell-Str. 1 79639 Grenzach-Wyhlen Telefon (07624) 14-0 Telefax (07624) 1019 Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar. Zentrale Anforderung an: Rote Liste Service GmbH Fachinfo-Service Mainzer Landstraße 55 60329 Frankfurt 8 000094-17733 Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SmPC) Myfortic® 180 mg/- 360 mg Tabletten 1. Bezeichnung der Arzneimittel Myfortic® 180 mg magensaftresistente Tab­ letten Myfortic® 360 mg magensaftresistente Tab­ letten 2. Qualitative und quantitative Zusammensetzung Jede magensaftresistente Tablette enthält 180 mg bzw. 360 mg Mycophenolsäure (als Mycophenolat-Natrium). Sonstige Bestandteile von Myfortic 180 mg magensaftresistente Tabletten: Lactose: 45 mg pro Tablette Sonstige Bestandteile von Myfortic 360 mg magensaftresistente Tabletten: Lactose: 90 mg pro Tablette Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1. 3. Darreichungsform Magensaftresistente Tablette Die Myfortic 180 mg Tabletten sind hellgrün, rund, mit abgeschrägter Kante und der Prä­ gung „C“ auf einer Seite. Die Myfortic 360 mg Tabletten sind hell­ orange und oval mit der Prägung „CT“ auf einer Seite. 4. Klinische Angaben 4.1 Anwendungsgebiete Myfortic ist in Kombination mit Ciclosporin und Kortikosteroiden zur Prophylaxe der akuten Transplantatabstoßung nach alloge­ ner Nierentransplantation bei erwachsenen Patienten angezeigt. 4.2 Dosierung, Art und Dauer der Anwendung Die Behandlung mit Myfortic soll nur von Ärzten mit hinreichender Erfahrung in der immunsuppressiven Therapie nach Organ­ transplantationen eingeleitet und fortgeführt werden. Die empfohlene Dosierung beträgt 720 mg zweimal täglich (Tagesgesamtdosis 1440 mg). Diese Dosis an MycophenolatNatrium entspricht 1 g Mycophenolat-Mofetil zweimal täglich (Tagesgesamtdosis 2 g), be­ zogen auf Mycophenolsäure (MPA). Für weitere Informationen zu sich entspre­ chenden therapeutischen Dosen an Myco­ phenolat-Natrium und Mycophenolat-Mofetil siehe Abschnitte 4.4 und 5.2. März 2015 MS 03/15 V 007 Bei De-novo-Patienten sollte die Behand­ lung mit Myfortic innerhalb von 72 Stunden nach der Transplantation begonnen werden. Myfortic kann zu den Mahlzeiten oder unab­ hängig davon eingenommen werden. Die Patienten können eine der beiden Möglich­ keiten auswählen, sollten diese dann jedoch beibehalten (siehe Abschnitt 5.2). Um die Unversehrtheit des magensaftresis­ tenten Tablettenüberzuges zu erhalten, soll­ ten die Tabletten nicht zerstoßen werden. Falls das Zerstoßen von Myfortic Tabletten nötig ist, ist die Aufnahme des Pulvers durch Inhalation oder direkten Kontakt mit der Haut oder Schleimhaut zu vermeiden. 008338-11519 Pädiatrische Population und Jugendliche Es liegen nicht genügend Daten vor, um die Wirksamkeit und Sicherheit von Myfortic bei Kindern und Jugendlichen zu belegen. In begrenztem Umfang sind für pädiatrische Patienten nach Nierentransplantation phar­ makokinetische Daten verfügbar (siehe Ab­ schnitt 5.2). Ältere Menschen Die empfohlene Dosis bei älteren Patienten ist 2-mal täglich 720 mg. Patienten mit eingeschränkter Nierenfunk­ tion Bei Patienten mit verzögertem Funktionseintritt des Nierentransplantats nach der Operation ist keine Anpassung der Dosis erforderlich (siehe Abschnitt 5.2). Patienten mit schweren Nierenfunktionsstö­ rungen (glomeruläre Filtrationsrate < 25 ml × min – 1 × 1,73 m – 2) sollten sorgfältig über­ wacht werden und die tägliche Dosis von Myfortic sollte 1440 mg nicht überschreiten. Patienten mit Leberinsuffizienz Bei nierentransplantierten Patienten mit schweren Leberschäden sind Dosisanpas­ sungen nicht erforderlich. Behandlung während einer Abstoßungs­ reaktion Renale Transplantat-Abstoßungsreaktionen führten zu keiner Änderung der Pharmako­ kinetik von Mycophenolsäure (MPA); eine Änderung der Dosierung oder Unterbre­ chung der Anwendung von Myfortic ist nicht erforderlich. 4.3 Gegenanzeigen Überempfindlichkeit gegenüber Mycophe­ nolat-Natrium, Mycophenolsäure oder My­ cophenolat-Mofetil bzw. einen der sonstigen Bestandteile (siehe Abschnitt 6.1). Myfortic ist für stillende Mütter und Frauen, die potentiell schwanger werden könnten und für Frauen im gebärfähigen Alter, die keine hoch effektiven Methoden zur Emp­ fängnisverhütung verwenden, kontraindiziert (siehe Abschnitt 4.6). Für weitere Informationen bezüglich des Ge­ brauchs in der Schwangerschaft und Stillzeit sowie Anforderungen zur Verhütung einer Schwangerschaft siehe Abschnitt 4.6. 4.4 Besondere Warnhinweise und Vor­ sichtsmaßnahmen für die Anwendung Patienten, die eine Kombinationstherapie mit Immunsuppressiva inklusive Myfortic erhal­ ten, sind einem erhöhten Risiko an Lympho­ men oder Malignomen, insbesondere der Haut, zu erkranken, ausgesetzt (siehe Ab­ schnitt 4.8). Das Risiko hierfür scheint eher von der Intensität und Dauer der Immun­ suppression als von der Verwendung eines bestimmten Arzneimittels abzuhängen. Um das Hautkrebsrisiko auf ein Minimum zu reduzieren, sollten die Patienten sich nur begrenzt dem Sonnen- und UV-Licht aus­ setzen, schützende Kleidung tragen und Sonnenschutzmittel mit hohem Lichtschutz­ faktor benutzen. Patienten, die mit Myfortic behandelt werden, sollten angewiesen werden, sofort über je­ des Anzeichen einer Infektion, ohne erkenn­ bare Ursache auftretende Blutergüsse, Blutungen oder andere Manifestationen einer Suppression des Knochenmarks zu berichten. Patienten, die mit Immunsuppressiva, My­ fortic eingeschlossen, behandelt werden, haben ein erhöhtes Risiko für opportunisti­ sche Infektionen (bakterielle, Pilz-, virale und Protozoen-Infektionen), tödliche Infektionen und Sepsis (siehe Abschnitt 4.8). Zu den opportunistischen Infektionen zählen die BK­ Virus-assoziierte Nephropathie und die JC­ Virus-assoziierte progressive multifokale Leu­ koenzephalopathie (PML). Diese Infektionen stehen oft in Zusammenhang mit einer hohen immunsuppressiven Belastung und können zu schwerwiegenden Zuständen oder To­ desfällen führen. Dies sollten Ärzte bei der Differenzialdiagnose von immunsupprimier­ ten Patienten mit einer Verschlechterung der renalen Funktion oder mit neurologischer Symptomatik berücksichtigen. Es wurde über Fälle von Hypogammaglo­ bulinämien in Verbindung mit rezidivieren­ den Infektionen bei Patienten, die Myfortic in Kombination mit anderen Immunsup­ pressiva erhalten, berichtet. Die Umstellung von MPA-Derivaten auf ein alternatives Im­ munsuppressivum führte in einigen dieser Fälle dazu, dass sich die Serum-IgG-Spie­ gel, wieder normalisierten. Patienten, die mit Myfortic therapiert werden und rezidi­ vierende Infektionen entwickeln, sollten ihre Serum-Immunglobulin-Spiegel messen las­ sen. In Fällen von anhaltenden, klinisch re­ levanten Hypogammaglobulinämien sollten unter Berücksichtigung der möglichen zy­ tostatischen Effekte, welche Mycophenol­ säure auf T- und B-Lymphozyten hat, ge­ eignete klinische Maßnahmen in Betracht gezogen werden. Es wurden Fälle von Bronchiektasen bei Patienten, die Myfortic in Kombination mit anderen Immunsuppressiva erhalten, be­ richtet. Die Umstellung von MPA-Derivaten auf ein anderes Immunsuppressivum bewirk­ te in einigen dieser Fälle eine Verbesserung der respiratorischen Symptome. Das Risiko von Bronchiektasen kann mit Hypogamma­ globulinämie oder mit einem direkten Effekt auf die Lunge zusammenhängen. Es wur­ den auch isolierte Fälle von interstitiellen Lungenerkrankungen berichtet (siehe Ab­ schnitt 4.8). Es wird empfohlen, dass Pa­ tienten, die anhaltende pulmonale Symp­ tome, wie Husten und Atemnot, entwickeln, auf jegliche Hinweise einer zugrunde liegen­ den interstitiellen Lungenerkrankung unter­ sucht werden. Eine Reaktivierung von Hepatitis B (HBV) oder Hepatitis C (HCV) wurde bei Patienten beobachtet, die mit Immunsuppressiva, einschließlich dem Mycophenolsäure(MPA)­ Derivaten Myfortic und Mycophenolatmo­ fetil (MMF), behandelt wurden. Die Über­ wachung von infizierten Patienten auf klini­ sche und labortechnische Signale einer aktiven HBV- oder HCV-Infektion wird emp­ fohlen. Es wurden Fälle von Erythroblastopenien (Pure Red Cell Aplasia [PRCA]) bei Patien­ ten berichtet, die mit MPA-Derivaten (ein­ schließlich Mycophenolat-Mofetil und Myco­ phenolat-Natrium) in Kombination mit ande­ ren Immunsuppressiva behandelt wurden. 1 Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SmPC) Myfortic® 180 mg/- 360 mg Tabletten Der Mechanismus, durch den MPA-Derivate PRCA induzieren können, ist nicht bekannt. Möglicherweise hat eine Dosisreduktion bzw. der Abbruch der Therapie einen Rückgang der PRCA zur Folge. Eine Änderung der Behandlung mit Myfortic darf jedoch nur unter geeigneter Kontrolle vorgenommen werden, um das Risiko einer Organabsto­ ßung zu minimieren (siehe Abschnitt 4.8). Patienten, die mit Myfortic behandelt wer­ den, sollten bezüglich des Auftretens von Blutkrankheiten (z. B. einer Neutropenie oder Anämie – siehe Abschnitt 4.8) überwacht werden, die auf Mycophenolsäure (MPA) selbst, auf die Begleitmedikation, virale In­ fektionen oder eine Kombination dieser Ur­ sachen zurückgeführt werden kann. Von Patienten, die Myfortic einnehmen, sollte regelmäßig ein komplettes Blutbild erstellt werden: im ersten Monat wöchentlich, im zweiten und dritten Monat 14-täglich und danach monatlich während des ersten Be­ handlungsjahres. Sollten Bluterkrankungen auftreten (z. B. Neutropenie mit einer abso­ luten Neutrophilenzahl < 1,5 × 103/μl oder Anämie), muss die Therapie mit Myfortic möglicherweise unterbrochen oder beendet werden. Die Patienten sollen informiert werden, dass Impfungen während der Behandlung mit Myfortic weniger wirksam sein können und dass die Impfung mit attenuierten Lebend­ impfstoffen vermieden werden sollte (siehe Abschnitt 4.5). Eine Grippeschutzimpfung könnte vorteilhaft sein. Der verschreibende Arzt soll sich an die nationalen Richtlinien zur Grippeschutzimpfung halten. Da Derivate von MPA mit einer erhöhten Inzidenz von Nebenwirkungen im Verdau­ ungstrakt – einschließlich seltenen Fällen von gastrointestinalen Ulzera, Blutungen und Perforation – in Verbindung gebracht wurden, sollte Myfortic Patienten mit aktiven, schwerwiegenden Erkrankungen des Ver­ dauungstraktes nur zurückhaltend verab­ reicht werden. Es wird empfohlen, Myfortic nicht zusam­ men mit Azathioprin zu verabreichen, da die gleichzeitige Anwendung beider Arzneimittel nicht untersucht wurde. Mycophenolsäure (als Natriumsalz) und Mycophenolat-Mofetil dürfen aufgrund ihres verschiedenen pharmakokinetischen Profils nicht wahllos ausgetauscht oder ersetzt werden. Myfortic wurde in Kombination mit Kortiko­ steroiden und Ciclosporin angewendet. Es gibt nur begrenzte Erfahrung mit der zusätz­ lichen Anwendung einer Induktionstherapie, wie z. B. mit Anti-T-Lymphozyten-Globulin oder Basiliximab. Die Wirksamkeit und Sicherheit von Myfortic in Kombination mit anderen Immunsuppres­ siva (z. B. Tacrolimus) wurde nicht unter­ sucht. 2 schen Kreislauf störend beeinflussen, z. B. Colestyramin oder Aktivkohle, kann zu einer sub-therapeutischen systemischen Exposi­ tion und verminderten Wirksamkeit von MPA führen. Myfortic ist ein IMPDH (Inosin-Monophos­ phat-Dehydrogenase)-Inhibitor. Deshalb soll­ te die Anwendung von Myfortic bei Patienten mit einem seltenen hereditären Mangel an Hypoxanthin-Guanin-Phosphoribosyl-Trans­ ferase (HGPRT), wie Lesch-Nyhan- und Kelley-Seegmiller-Syndrom, vermieden wer­ den. Die Therapie mit Myfortic darf nur begon­ nen werden, wenn ein negativer Schwan­ gerschaftstest vorliegt. Vor Beginn, wäh­ rend und 6 Wochen nach Beendigung der Therapie mit Myfortic muss eine wirksame Schwangerschaftsverhütung gegeben sein (siehe Abschnitt 4.6). 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Die folgenden Interaktionen zwischen My­ cophenolsäure (MPA) und anderen Arznei­ mitteln wurden berichtet. Aciclovir und Ganciclovir: Das Gefährdungs­ potenzial für eine Myelosuppression bei Patienten, die sowohl Myfortic als auch Aciclovir oder Ganciclovir erhalten, wurde nicht untersucht. Gesteigerte Spiegel von Mycophenolsäure-Glucuronid (MPAG) und Aciclovir/Ganciclovir können auftreten, wenn Aciclovir/Ganciclovir und Myfortic gemein­ sam verabreicht werden; möglicherweise ist dies das Ergebnis einer Konkurrenz der Substanzen bei der tubulären Sekretion. Die Änderungen der MPAG-Pharmakokine­ tik sind bei Patienten mit adäquater Nieren­ funktion wahrscheinlich nicht klinisch signi­ fikant. Bei Patienten mit Nierenfunktionsstö­ rungen besteht allerdings die Möglichkeit der Erhöhung der MPAG- und Aciclovir/ Ganciclovir-Konzentrationen; die Dosie­ rungsempfehlungen für Aciclovir/Ganciclovir sollten eingehalten und die Patienten sorg­ fältig beobachtet werden. Gastroprotektive Arzneimittel: Magnesium- und Aluminium-haltige Ant­ azida: Es wurde beobachtet, dass die AUC und cmax von MPA um etwa 37 % bzw. 25 % verringert sind, wenn eine einzige Dosis von Magnesium-Aluminium-haltigen Antazida zusammen mit Myfortic verabreicht wird. Magnesium-Aluminium-haltige Antazida können intermittierend für die Behandlung einer gelegentlich auftretenden Dyspepsie eingenommen werden. Die tägliche chroni­ sche Anwendung von Myfortic und Magnesi­ um-Aluminium-haltigen Antazida wird we­ gen der Gefahr einer verringerten MPA-Ex­ position und Wirksamkeit nicht empfohlen. Protonenpumpen-Inhibitoren: Myfortic enthält Lactose. Patienten mit sel­ tenen hereditären Störungen, wie Galac­ tose-Intoleranz, Lapp-Laktase-Mangel oder Glucose-Galactose-Malabsorption, sollten dieses Arzneimittel nicht einnehmen. Bei gesunden Probanden konnte nach 4-tägiger gleichzeitiger Gabe von Myfortic und 2-mal täglich 40 mg Pantoprazol keine Änderung der Pharmakokinetik von MPA beobachtet werden. Es gibt keine Daten zu anderen Protonenpumpen-Inhibitoren in ho­ her Dosierung. Die gleichzeitige Anwendung von Myfortic und Arzneimitteln, die den enterohepati­ Orale Kontrazeptiva: Interaktionsstudien zwi­ schen MMF und oralen Kontrazeptiva zeig­ ten keine Interaktionen. Aufgrund des meta­ bolischen Profils von MPA werden auch keine Interaktionen zwischen oralen Kontra­ zeptiva und Myfortic erwartet. Colestyramin und Gallensäuren-bindende Arzneimittel: Arzneimittel oder Therapien, die Gallensäuren binden können, wie zum Beispiel Gallensäuren-Sequestrate oder oral verabreichte Aktivkohle, sollten wegen einer möglicherweise reduzierten MPA-Ex­ position und damit verringerten Wirksamkeit von Myfortic nur mit Vorsicht gleichzeitig angewendet oder durchgeführt werden. Ciclosporin: Bei stabilen Nieren-Transplan­ tationspatienten wurde die Pharmakokinetik von Ciclosporin durch die wiederholte Gabe von Myfortic nicht beeinflusst. Die gemein­ same Gabe von Ciclosporin und Mycophe­ nolat-Mofetil führt jedoch zu einer verringer­ ten MPA-Exposition. Bei gemeinsamer An­ wendung von Ciclosporin und MPA kann Ciclosporin die Konzentration von MPA ebenfalls senken (um ungefähr 20 %, wie aus Daten zu Mycophenolat-Mofetil extra­ poliert wurde), das genaue Ausmaß dieser Senkung wurde jedoch nicht ermittelt. Die Studien zur Wirksamkeit wurden jedoch in Kombination mit Ciclosporin durchgeführt, so dass diese Interaktion keinen Einfluss auf die Dosierungsempfehlung für Myfortic hat. Für den Fall einer Unterbrechung oder Beendigung der Ciclosporin-Einnahme sollte die Dosierung von MPA in Abhängigkeit vom immunsuppressiven Protokoll insgesamt überprüft werden. Tacrolimus: In einer Calcineurin-Cross­ over-Studie an Patienten mit stabilem Nie­ rentransplantat wurde die Steady-statePharmakokinetik von Myfortic bei gleichzeiti­ ger Behandlung mit Sandimmun® Optoral oder Tacrolimus gemessen. Bei einer Tacro­ limus-Behandlung lag die mittlere AUC von MPA 19 % (90 % CI: – 3, + 47) höher, die mittlere AUC von MPAG hingegen ca. 30 % (90 % CI: 16, 42) niedriger im Vergleich zu einer Behandlung mit Sandimmun® Optoral. Zusätzlich verdoppelte sich beim Wechsel von Sandimmun® Optoral zu Tacrolimus die intraindividuelle Variabilität der AUC von MPA. Kliniker sollten diese Erhöhung der AUC und der Variabilität von MPA berück­ sichtigen und abhängig von der klinischen Situation die Dosierung von Myfortic anpas­ sen. Eine engmaschige klinische Überwa­ chung sollte erfolgen, wenn ein Wechsel von einem Calcineurin-Inhibitor zu einem ande­ ren Calcineurin-Inhibitor geplant ist. Attenuierte Lebendimpfstoffe: Lebendimpf­ stoffe sollten bei Patienten mit verminderter Immunantwort nicht angewendet werden. Bei anderen Impfstoffen kann die Antikör­ perbildung verringert sein. 4.6 Fertilität, Schwangerschaft und Stillzeit Frauen in gebärfähigem Alter Die Therapie mit Myfortic darf nur begonnen werden, wenn ein negativer Schwanger­ schaftstest vorliegt. Schwangerschaftsverhütung bei Männern und Frauen Frauen in gebärfähigem Alter müssen vor Beginn und während der Therapie mit My­ fortic sowie 6 Wochen nach der letzten Ein­ 008338-11519 Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SmPC) Myfortic® 180 mg/- 360 mg Tabletten nahme von Myfortic eine hochwirksame Methode zur Schwangerschaftsverhütung anwenden. Sexuell aktiven Männern wird empfohlen, während der Behandlung mit Myfortic und 13 Wochen nach der letzten Einnahme von Myfortic Kondome zu benutzen. Zusätzlich wird auch den Partnerinnen dieser männ­ lichen Patienten empfohlen, während der Behandlung und 13 Wochen nach der letz­ ten Einnahme von Myfortic eine hochwirk­ same Methode zur Schwangerschaftsver­ hütung anzuwenden. Schwangerschaft Die Einnahme von Myfortic während der Schwangerschaft wird nicht empfohlen und ist nur vorgesehen für Fälle, bei denen keine alternative Behandlung möglich ist. Über den Einsatz von Myfortic bei schwangeren Frauen liegen nur limitierte Daten vor. Bei Kindern von Patienten, die Mycophenolat während der Schwangerschaft erhielten, wurde jedoch über kongenitale Missbildun­ gen, einschließlich Missbildungen am Ohr, wie zum Beispiel abnorm geformtes oder fehlendes Außen-/ Mittelohr, Lippen-KieferGaumenspalte, Mikrognathie und Herz­ krankheiten berichtet. Es wurden spontane Fehlgeburten bei Patientinnen nach Myco­ phenolsäure-Exposition berichtet. Tierstu­ dien zeigten eine Reproduktionstoxizität (siehe Abschnitt 5.3). Stillzeit Mycophenolsäure tritt in die Muttermilch von stillenden Ratten über. Es ist nicht bekannt, ob Myfortic beim Menschen in die Muttermilch übertritt. Auf­ grund des Risikos schwerer Nebenwirkun­ gen beim gestillten Säugling ist Myfortic für stillende Mütter kontraindiziert (siehe Ab­ schnitt 4.3). Fertilität Es wurden keine spezifischen Studien zur Auswirkung von Myfortic auf die Fertilität beim Menschen durchgeführt. In einer Tier­ studie zur Fertilität bei männlichen und weib­ lichen Ratten konnten bis zu einer Dosis von 40 mg/kg bzw. 20 mg/kg keine Aus­ wirkungen festgestellt werden (siehe Ab­ schnitt 5.3). 4.7 Auswirkungen auf die Verkehrs­ tüchtigkeit und die Fähigkeit zum Bedienen von Maschinen März 2015 MS 03/15 V 007 Es wurden keine Studien zu den Auswir­ kungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen durchgeführt. Die Wirkungsweise, das pharmakodynamische Profil und die beobachteten Nebenwirkun­ gen lassen erwarten, dass ein Einfluss un­ wahrscheinlich ist. 4.8 Nebenwirkungen Die nachfolgend genannten unerwünschten Wirkungen umfassen Nebenwirkungen, die während klinischer Studien beobachtet wur­ den. Maligne Erkrankungen Patienten, die unter Behandlung mit Immun­ suppressiva stehen und hierzu eine Kombi­ nation von Arzneimitteln einschließlich My­ cophenolsäure (MPA) erhalten, sind einem erhöhten Risiko an Lymphomen und ande­ 008338-11519 ren Malignomen, insbesondere der Haut, zu erkranken, ausgesetzt (siehe Abschnitt 4.4). Lymphoproliferative Erkrankungen oder Lymphome entwickelten 2 (0,9 %) der De­ novo-Patienten und 2 (1,3 %) der Patienten mit länger zurückliegender Transplantation, die bis zu einem Jahr Myfortic erhielten. Nicht Melanom-artige Hautkarzinome traten bei 0,9 % der De-novo-Patienten und 1,8 % der Patienten mit länger zurückliegender Transplantation auf, die Myfortic bis zu einem Jahr einnahmen; andere maligne Verände­ rungen wurden bei 0,5 % der De-novo-Pa­ tienten und 0,6 % der Patienten mit länger zurückliegender Transplantation beobach­ tet. schließlich Meningitis, infektiöser Endokar­ ditis, Tuberkulose und atypischer myko­ bakterieller Infektionen. Bei mit Immunsup­ pressiva behandelten Patienten, Myfortic eingeschlossen, wurden sowohl Fälle von BK-Virus assoziierter Nephropathie als auch von JC-Virus assoziierter progressiver multi­ fokaler Leukoenzephalopathie (PML) be­ richtet (siehe Abschnitt 4.4). Opportunistische Infektionen Alle Transplantationspatienten sind einem erhöhten Risiko für opportunistische Infek­ tionen ausgesetzt; das Risiko steigt mit der Gesamtbelastung durch die immunsup­ pressive Medikation (siehe Abschnitt 4.4). Die häufigsten opportunistischen Infektionen bei Patienten nach De-novo-Nierentrans­ plantation, die Myfortic zusammen mit ande­ ren Immunsuppressiva in kontrollierten klini­ schen Studien mit einem Jahr Nachbeob­ achtung erhielten, waren Cytomegalievirus (CMV), Candidiasis und Herpes simplex. CMV-Infektionen (Serologie, Virämie oder klinisches Bild) wurden bei 21,6 % der De­ novo-Transplantierten und bei 1,9 % der vorbehandelten Patienten beobachtet. Erkrankungen des Immunsystems: Hypogammaglobulinämien wurden bei Pa­ tienten berichtet, die Myfortic in Kombi­ nation mit anderen Immunsuppressiva ein­ nehmen. Ältere Menschen Bei älteren Patienten kann grundsätzlich ein erhöhtes Risiko für Nebenwirkungen einer Immunsuppression bestehen. Andere Nebenwirkungen Die Tabelle 1 auf Seite 4 enthält Neben­ wirkungen, die möglicherweise oder wahr­ scheinlich auf Myfortic zurückzuführen sind und während kontrollierter klinischer Stu­ dien bei nierentransplantierten Patienten auftraten, denen Myfortic zusammen mit Ciclosporin-Mikroemulsion und Kortikoste­ roiden in einer Dosierung von 1440 mg täg­ lich für 12 Monate verabreicht wurde. Die Angaben sind nach den MedDRA-Organ­ klassen zusammengestellt. Die Nebenwirkungen sind gemäß den fol­ genden Kategorien aufgelistet: Sehr häufig: (≥ 1/10) Häufig: (≥ 1/100 bis < 1/10) Gelegentlich: (≥ 1/1 000 bis < 1/100) Selten: (≥ 1/10 000 bis < 1/1 000) Sehr selten: (< 1/10 000) Bemerkung: Nieren-Transplantationspa­ tienten wurden bis zu einem Jahr mit 1440 mg Myfortic täglich behandelt. Bei der De-novo- und der vorbehandelten Popula­ tion trat ein vergleichbares Nebenwirkungs­ profil auf, wenngleich die Häufigkeiten bei Patienten mit länger zurückliegender Trans­ plantation tendenziell niedriger waren. Aus Erfahrungen seit der Markteinführung ist bekannt, dass Hautausschlag und Agra­ nulozytose Arzneimittelnebenwirkungen sein können. Die folgenden zusätzlichen Nebenwirkun­ gen werden mit einem Klassen-Effekt der MPA-Derivate in Zusammenhang gebracht: Infektionen und parasitäre Erkrankungen: Schwere, lebensbedrohliche Infektionen ein­ Erkrankungen des Blutes und des Lymph­ systems: Neutropenie, Panzytopenie. Es wurden Fälle von Erythroblastopenien (Pure Red Cell Aplasia [PRCA]) bei Patienten berichtet, die mit MPA-Derivaten behandelt wurden (siehe Abschnitt 4.4). Erkrankungen der Atemwege, des Brust­ raums und des Mediastinums: Vereinzelt wurde über interstitielle Lungen­ erkrankungen bei Patienten berichtet, die mit Myfortic in Kombination mit anderen Immunsuppressiva behandelt wurden. Es wurden Fälle von Bronchiektasien in Kom­ bination mit anderen Immunsuppressiva berichtet. Vereinzelt wurden bei Patienten, die mit MPA-Derivaten behandelt wurden, morpho­ logische Veränderungen der Neutrophilen, einschließlich der Pelger-Huet-Anomalie, beobachtet. Diese Veränderungen gehen nicht mit einer eingeschränkten Funktion der Neutrophilen einher. Vielmehr lassen hämatologische Untersuchungen auf eine „Linksverschiebung“ der Neutrophilen und deren Reifungsmuster schließen, was fälsch­ licher Weise als Anzeichen einer Infektion bei immunsupprimierten Patienten – wie unter Myfortic-Therapie – interpretiert wer­ den kann. Erkrankungen des Gastrointestinaltrakts: Kolitis, CMV-Gastritis, intestinale Perforation, Magenulcera, Duodenalulcera. Meldung des Verdachts auf Nebenwirkun­ gen Die Meldung des Verdachts auf Nebenwir­ kungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuier­ liche Überwachung des Nutzen-Risiko-Ver­ hältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, je­ den Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medi­ zinprodukte, Abt. Pharmakovigilanz, KurtGeorg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de, anzuzeigen. 4.9 Überdosierung Es gibt Berichte über absichtliche und un­ beabsichtigte Fälle einer Überdosierung mit Myfortic, bei denen jedoch nicht alle Pa­ tienten hierauf bezogene Nebenwirkungen hatten. In den Fällen, in welchen eine Nebenwirkung berichtet worden ist, deckt sich das Ereig­ nis mit dem bekannten Sicherheitsprofil der Klasse (vor allem Blutbildveränderungen, Sepsis ...) (siehe Abschnitte 4.4 und 4.8). 3 Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SmPC) Myfortic® 180 mg/- 360 mg Tabletten Tabelle 1 Infektionen und parasitäre Erkrankungen Gutartige, bösartige und unspezifische Neubildungen (einschl. Zysten und Polypen) Erkrankungen des Blutes und des Lymphsystems Sehr häufig Häufig Gelegentlich Gelegentlich Sehr häufig Häufig Gelegentlich Stoffwechsel- und Ernährungs- Sehr häufig störungen Häufig Gelegentlich Psychiatrische Erkrankungen Sehr häufig Gelegentlich Erkrankungen des Nervensystems Häufig Gelegentlich Gelegentlich Gelegentlich Sehr häufig Häufig Gelegentlich Häufig Gelegentlich Augenerkrankungen Herzerkrankungen Gefäßerkrankungen Erkrankungen der Atemwege, des Brustraums und Mediastinums Erkrankungen des Gastrointestinaltraktes Sehr häufig Häufig Gelegentlich Leber- und Gallenerkrankungen Häufig Erkrankungen der Haut und Häufig des Unterhautgewebes Gelegentlich Skelett-, Bindegewebs- und Sehr häufig Knochenerkrankungen Häufig Gelegentlich Erkrankungen der Nieren und Harnwege Häufig Gelegentlich Erkrankungen der Geschlechts- Gelegentlich organe und der Brustdrüse Allgemeine Erkrankungen Häufig und Beschwerden am Verabreichungsort Gelegentlich Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen Gelegentlich Virale, bakterielle und Pilzinfektionen Infektionen der oberen Atemwege, Pneu­ monie Wundinfektionen, Sepsis*, Osteomyelitis* Papillom der Haut*, Basalzellkarzinom*, Kaposi-Sarkom*, lymphoproliferative Erkrankungen, Plattenepithelkarzinom* Leukopenie Anämie, Thrombozytopenie Lymphopenie*, Neutropenie*, Lymph­ adenopathie* Hypokalziämie, Hypokaliämie, Hyper­ urikämie Hyperkaliämie, Hypomagnesiämie Anorexie, Hyperlipidämie, Diabetes melli­ tus*, Hypercholesterinämie*, Hypophos­ phatämie Angst Ungewöhnliche Träume*, Wahnwahr­ nehmung*, Schlaflosigkeit* Schwindel, Kopfschmerzen Tremor Konjunktivitis*, verschwommenes Sehen* Tachykardie, ventrikuläre Extrasystolen Hypertonie Hypotonie Lymphozele* Husten, Atemnot Interstitielle Lungenerkrankung, Lungenstauung*, Stenoseatmung*, Lungenödeme* Diarrhö Bauchblähung, abdominelle Schmerzen, Verstopfung, Dyspepsie, Blähungen, Gastritis, Übelkeit, Erbrechen Schmerzhafte Bauchdeckenspannung, gastrointestinale Blutung, Aufstoßen, Mundgeruch*, Ileus*, Lippenulzeration*, Ösophagitis*, Subileus*, Zungenverfärbung*, trockener Mund*, gastroösophageale Reflux­ krankheit*, Gingivahyperplasie*, Pankreatitis, Verstopfung des Ohrdrüsenausführgangs*, peptisches Ulcus*, Peritonitis* Anormale Leberfunktionstests Akne, Pruritus Alopezie Arthralgie Myalgie Arthritis*, Rückenschmerzen*, Muskelkrämpfe Anstieg des Blut-Kreatinins Hämaturie*, renale tubuläre Nekrose*, Harnröhrenstenose Impotenz* Asthenie, Müdigkeit, periphere Ödeme, Fieber Influenza-artige Erkrankungen, Ödeme an den unteren Extremitäten*, Schmerzen, Rigor*, Durst*, Schwäche* Kontusion* * Der Fall trat nur bei einem einzigen Patienten (von 372 Patienten) auf. Obwohl eine Dialyse zur Entfernung des inaktiven Metaboliten MPAG eingesetzt werden könnte, ist nicht zu erwarten, dass klinisch signifikante Mengen des aktiven Bestandteils Mycophenolsäure (MPA) ent­ fernt werden können. Dies liegt vor allem an der sehr hohen Plasmaproteinbindung von MPA von 97 %. Gallensäurebindende Sub­ stanzen wie Colestyramin können die sys­ temische MPA-Exposition reduzieren, indem sie in den enterohepatischen Kreislauf ein­ greifen. 5. Pharmakologische Eigenschaften 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Immun­ suppressivum, ATC-Code: L04AA06 Mycophenolsäure (MPA) ist ein potenter, selektiver, nicht kompetitiver und reversibler Inhibitor der Inosin-Monophosphat-Dehy­ drogenase und hemmt daher den De-novoSyntheseweg von Guanosin-Nukleotiden, ohne dabei in die DNA inkorporiert zu wer­ den. Da die Proliferation von T- und B-Lym­ phozyten entscheidend von der De-novoSynthese von Purinen abhängig ist, wohin­ gegen andere Zelltypen einen Salvage-Path­ way nutzen können, hat MPA einen stärke­ ren zytostatischen Effekt auf Lymphozyten als auf andere Zellen. 5.2 Pharmakokinetische Eigenschaften Resorption Nach oraler Anwendung wird Mycopheno­ lat-Natrium nahezu vollständig resorbiert. Zu einer magensaftresistenten Formulierung passend, betrug die Zeit bis zur maximalen Mycophenolsäure (MPA)-Konzentrationen (tmax) 1,5 – 2 Stunden. Ungefähr 10 % aller morgens ermittelten pharmakokinetischen Profile zeigten ein verzögertes tmax, manch­ mal bis zu einigen Stunden, ohne einen erwarteten Einfluss auf die MPA-Exposition über 24 Stunden/Tag. Bei stabilen nierentransplantierten Patienten, die Ciclosporin als Basis-Immunsuppression erhielten, betrug die gastrointestinale Re­ sorption von MPA 93 % und die absolute Bioverfügbarkeit 72 %. Die Pharmakokinetik von Myfortic verhält sich dosisproportional und linear über den untersuchten Dosisbe­ reich von 180 bis 2160 mg. Im Vergleich zu Nüchtern-Bedingungen hatte die Verabrei­ chung einer einzelnen Dosis von 720 mg Myfortic mit einer fettreichen Mahlzeit (55 g Fett, 1000 Kalorien) keinen Einfluss auf die systemische Verfügbarkeit von MPA (AUC), dem für die Wirksamkeit relevantesten phar­ makokinetischen Parameter. Es kam jedoch zu einem Abfall der maximalen MPA-Kon­ zentration (cmax) um 33 %. Zusätzlich waren tlag und tmax durchschnittlich 3 bis 5 Stunden verzögert, wobei einige Patienten ein tmax von > 15 Stunden aufwiesen. Der Einfluss von Nahrung führt möglicherweise zu einer Überlappung der Resorption von einem zum nächsten Dosisintervall von Myfortic. Es wurde allerdings nicht gezeigt, dass dieser Effekt klinisch signifikant ist. Verteilung Das Verteilungsvolumen von MPA im Stea­ dy State beträgt 50 Liter. Sowohl MPA als auch Mycophenolsäure-Glucuronid (MPAG) werden in hohem Maß an Proteine gebun­ 4 008338-11519 Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SmPC) Myfortic® 180 mg/- 360 mg Tabletten Tabelle 2 Mittlere (SD) pharmakokinetische Parameter von MPA nach oraler Gabe von Myfortic an nierentransplantierte Patienten unter Ciclosporin-Basisimmunsuppression Dosis tmax* (h) cmax (μg/ml) AUC 0 – 12 (μg*h/ml) 14 Tage nach Transplantation 720 mg 2 13,9 (8,6) 29,1 (10,4) 3 Monate nach Transplantation 720 mg 2 24,6 (13,2) 50,7 (17,3) 6 Monate nach Transplantation 720 mg 2 23,0 (10,1) 55,7 (14,6) Dosis tmax* (h) cmax (μg/ml) AUC 0 – 12 (μg*h/ml) 720 mg 1,5 18,9 (7,9) 57,4 (15,0) Dosis tmax* (h) cmax (μg/ml) AUC 0 – ∞ (μg*h/ml) 2,5 31,9 (18,2) 74,5 (28,3) Erwachsene Langzeit-Mehrfachdosierung Zweimal täglich 720 mg (Studie ERLB 301) n = 48 Erwachsene Langzeit-Mehrfachdosierung Zweimal täglich 720 mg (Studie ERLB 302) n = 18 18 Monate nach Transplantation Kinder 450 mg/m2 Einzeldosis (Studie ERL 0106) 450 mg/m2 n = 16 * Median den (97 % bzw. 82 %). Die Konzentration von freier MPA kann unter Bedingungen mit reduzierten Proteinbindungsstellen anstei­ gen (Urämie, Leberversagen, Hypoalbumin­ ämie, gleichzeitige Verabreichung von Medi­ kamenten mit hoher Proteinbindung). Dies kann bei Patienten das Risiko von MPAabhängigen Nebenwirkungen erhöhen. März 2015 MS 03/15 V 007 Biotransformation MPA wird hauptsächlich durch die Glucuro­ nyltransferase metabolisiert, die das pheno­ lische Glucuronid von MPA, Mycophenol­ säure-Glucuronid (MPAG) bildet. MPAG ist der Hauptmetabolit von MPA und zeigt keine biologische Aktivität. Bei stabilen nieren­ transplantierten Patienten, die Ciclosporin als Basis-Immunsuppression erhalten, werden ungefähr 28 % der oralen Myfortic-Dosis präsystemisch zu MPAG umgewandelt. Die Halbwertszeit von MPAG ist länger als die von MPA, sie beträgt ungefähr 16 Stunden, die Clearance liegt bei 0,45 l/Stunde. Elimination Die Halbwertszeit von MPA beträgt etwa 12 Stunden, die Clearance liegt bei 8,6 l/Stunde. Obwohl vernachlässigbare Mengen von MPA im Urin vorhanden sind (< 1,0 %), wird der Großteil von MPA über den Urin als MPAG ausgeschieden. Über die Galle aus­ geschiedenes MPAG wird durch die Darm­ flora dekonjugiert. MPA, die durch diese Dekonjugation entsteht, kann dann reab­ sorbiert werden. Etwa 6 – 8 Stunden nach Verabreichung einer Myfortic-Dosis kann in Übereinstimmung mit der Reabsorption von dekonjugierter MPA eine zweite Spitzen­ konzentration von MPA gemessen werden. Typisch für die verschiedenen MPA-Präpa­ rate ist die große Variabilität der Tal-Blut­ spiegel. Ungefähr bei 2 % der mit Myfortic behandelten Patienten wurden hohe mor­ gendliche Tal-Blutspiegel (C0 > 10 μg/ml) beobachtet. Über die Studien hinweg zeigte die AUC im Steady-State (0 – 12 Stunden), die als Indikator für die Gesamtexposition gilt, eine geringere Variabilität als die ent­ sprechenden Tal-Blutspiegel (Ctrough). 008338-11519 Pharmakokinetik bei nierentransplantierten Patienten unter Ciclosporin-Basis-Immun­ suppression In der Tabelle 2 werden mittlere pharma­ kokinetische Parameter von MPA nach My­ fortic-Verabreichung aufgeführt. In der frühen Posttransplantationsperiode betrugen die mittlere AUC von MPA und die mittlere cmax von MPA ungefähr die Hälfte derjenigen Werte, die 6 Monate nach der Transplantation gemessen wurden. Nierenfunktionsstörung Die Pharmakokinetik von MPA war über das Spektrum der normalen Nierenfunktion bis hin zur völligen Niereninsuffizienz unverän­ dert. Im Gegensatz dazu stieg die MPAG-Expo­ sition mit abnehmender Nierenfunktion an; die MPAG-Exposition war bei Anurie etwa 8-mal höher. Die Clearance von MPA und MPAG wird durch Hämodialyse nicht beeinflusst. Die Konzentration an freier MPA kann bei Nie­ reninsuffizienz signifikant ansteigen. Dies könnte durch die verminderte Plasmapro­ teinbindung von MPA aufgrund von hohen Harnstoff-Konzentrationen im Blut verursacht werden. Leberfunktionsstörung Bei Probanden mit Alkohol-bedingter Zirrho­ se blieb die hepatische MPA-Glucuronisie­ rung durch die Leberparenchym-Erkrankung relativ unbeeinflusst. Die Auswirkungen einer Lebererkrankung auf diesen Prozess hängen wahrscheinlich von der speziellen Erkran­ kung ab. Lebererkrankungen mit vorwiegend biliärer Schädigung, wie z. B. primär biliäre Zirrhose, können einen anderen Effekt ha­ ben. Pädiatrische Population und Jugendliche Über die Anwendung von Myfortic bei Kin­ dern und Jugendlichen stehen limitierte Da­ ten zur Verfügung. In der Tabelle 2 werden die mittleren (SD) pharmakokinetischen Pa­ rameter von MPA bei stabilen pädiatrischen nierentransplantierten Patienten (Alter: 5 bis 16 Jahre) unter Immunsuppression mit Ci­ closporin dargestellt. Die mittlere AUC von MPA bei einer Dosis von 450 mg/m2 war vergleichbar mit derjenigen bei Erwachse­ nen unter einer Dosis von 720 mg Myfortic. Die mittlere Clearance von MPA betrug un­ gefähr 6,7 l/h/m2. Geschlecht Es gibt keine signifikanten geschlechtsspe­ zifischen Unterschiede in der Pharmakoki­ netik von Myfortic. Ältere Menschen Die Pharmakokinetik bei älteren Patienten wurde formal nicht untersucht. Die MPAExposition scheint mit dem Alter nicht klinisch signifikant zu variieren. 5.3 Präklinische Daten zur Sicherheit Die in Toxizitätsstudien mit Mehrfachdosie­ rungen mit Mycophenolat-Natrium an Rat­ ten und Mäusen primär betroffenen Organe waren das hämatopoetische und lymphoide System. Aplastische, regenerative Anämie wurde als dosislimitierende Toxizität bei Na­ gern, denen MPA verabreicht wurde, identifi­ ziert. Die Auswertung von Myelogrammen zeigte eine deutliche Abnahme der Erythro­ zyten (polychromatische Erythroblasten und Normoblasten), eine dosisabhängige Ver­ größerung der Milz und einen Anstieg der extramedullären Hämatopoese. Diese Effek­ te traten bei einer systemischen Exposition auf, die gleich oder niedriger als die klini­ sche Exposition bei der empfohlenen Dosis von 1,44 g Myfortic/Tag für Patienten nach einer Nierentransplantation lag. An Hunden wurden gastrointestinale Effekte bei einer systemischen Exposition beobachtet, die gleich oder niedriger als die klinische Ex­ position bei der empfohlenen Dosis lag. Das nicht klinische Toxizitätsprofil von My­ cophenolsäure (als Natriumsalz) stimmt of­ fenbar mit den Nebenwirkungen überein, die beim Menschen in klinischen Studien beobachtet wurden, die derzeit die relevan­ teren Daten zur Arzneimittelsicherheit bei Patienten darstellen (siehe Abschnitt 4.8). Drei Assays zur Genotoxizität (in vitro Maus­ Lymphoma-Assay, Mikrokerntest in V97 Chi­ nesischen Hamsterzellen und in vivo Maus­ Knochenmark-Mikronukleus-Test) zeigten, dass Mycophenolsäure (MPA) das Potenzial zur Verursachung von chromosomalen Ab­ errationen hat. Diese Effekte können in Ver­ bindung zur pharmakodynamischen Wir­ kungsweise, d. h. Inhibierung der Nukleotid­ synthese in anfälligen Zellen, stehen. Andere In-vitro-Tests zur Genmutation zeigten keine genotoxische Aktivität. Mycophenolsäure (als Natriumsalz) war nicht tumorigen in Ratten und Mäusen. Die höchste Dosis, die bei Kanzerogenitätsstu­ dien in Tieren getestet wurde, führte zu einer ca. 0,6- bis 5-mal höheren systemischen Exposition (AUC oder cmax) als die, die bei Nieren-Transplantationspatienten bei der empfohlenen Dosis von 1,44 g/Tag beob­ achtet wurde. Mycophenolsäure (als Natriumsalz) hatte keinen Effekt auf die Fruchtbarkeit von männlichen und weiblichen Ratten bei Do­ sen bis zu Konzentrationen, bei denen eine 5 Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SmPC) Myfortic® 180 mg/- 360 mg Tabletten allgemeine Toxizität und Embryotoxizität be­ obachtet wurde. ten die Tabletten nicht zerstoßen werden (siehe Abschnitt 4.2). In einer Studie mit Mycophenolsäure (als Natriumsalz) zur Teratogenität an Ratten wurden bei einer Dosierung von nur 1 mg/ kg Missbildungen der Nachkommen, ein­ schließlich Anophthalmie, Exencephalie und Hernia umbilicalis beobachtet. Die syste­ mische Exposition bei dieser Dosierung beträgt das 0,05fache der klinischen Ex­ position von 1,44 g Myfortic/Tag (siehe Ab­ schnitt 4.6). Es wurde gezeigt, dass Mycophenolsäure einen teratogenen Effekt hat (siehe Ab­ schnitt 4.6). Falls das Zerstoßen von Myfortic Tabletten nötig ist, ist die Aufnahme des Pulvers durch Inhalation oder direkten Kon­ takt mit der Haut oder Schleimhaut zu ver­ meiden. In einer prä- und postnatalen Entwicklungs­ studie in Ratten verursachte Mycophenol­ säure (als Natriumsalz) Entwicklungsver­ zögerungen (abnorme Pupillenreflexe bei weiblichen und „preputial separation“ bei männlichen Tieren). Nach Behandlung mit der Höchstdosis von 3 mg/kg wurden auch Missbildungen beobachtet. Mycophenolsäure (als Natriumsalz) zeigte phototoxisches Potenzial in einem in vitro 3T3 NRU Phototoxizitätstest. 6. Pharmazeutische Angaben 6.1 Liste der sonstigen Bestandteile Tablettenkern Maisstärke Povidon Crospovidon wasserfreie Lactose hochdisperses Siliciumdioxid Magnesiumstearat Tablettenüberzug Myfortic 180 mg: Hypromellosephthalat Titandioxid (E 171) Eisen(III)-hydroxid-oxid × H2O (E 172) Indigocarmin (E 132) Myfortic 360 mg: Hypromellosephthalat Titandioxid (E 171) Eisen(III)-hydroxid-oxid × H2O (E 172) Eisen(III)-oxid (E 172) Nicht verwendetes Arzneimittel oder Abfall­ material ist entsprechend den nationalen Anforderungen zu entsorgen. 7. Inhaber der Zulassung Novartis Pharma GmbH Roonstraße 25 90429 Nürnberg Telefon: (09 11) 273-0 Telefax: (09 11) 273-12 653 Internet/E-Mail: www.novartis.de Postanschrift: Novartis Pharma GmbH 90327 Nürnberg Info-Service: Telefon: (0 18 02) 23 23 00 (0,06 € pro Anruf aus dem deutschen Festnetz; max. 0,42 € pro Minute aus dem deutschen Mobilfunknetz) Telefax: (09 11) 273-12 160 8. Zulassungsnummer(n) Myfortic 180 mg magensaftresistente Tab­ letten 58399.00.00 Myfortic 360 mg magensaftresistente Tab­ letten 58399.01.00 9. Datum der Erteilung der Zulassung/ Verlängerung der Zulassung 7. April 2004/13. Juli 2009 10. Stand der Information März 2015 6.2 Inkompatibilitäten Nicht zutreffend 11. Verkaufsabgrenzung Verschreibungspflichtig 6.3 Dauer der Haltbarkeit 30 Monate 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Diese Arzneimittel enthalten einen Stoff, des­ sen Wirkung in der medizinischen Wissen­ schaft noch nicht allgemein bekannt ist. Nicht über 30 °C lagern. In der Originalver­ packung aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen. 6.5 Art und Inhalt des Behältnisses Die Tabletten sind in Polyamid/Aluminium/ PVC/Aluminium-Blistern zu je 10 Tabletten pro Blister mit Gesamtmengen von 20, 50, 100, 120 und 250 Tabletten pro Faltschachtel verpackt. Es werden möglicherweise nicht alle Pa­ ckungsgrößen in den Verkehr gebracht. 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung Um die Unversehrtheit des magensaftresis­ tenten Tablettenüberzuges zu erhalten, soll­ 6 Zentrale Anforderung an: Rote Liste Service GmbH Fachinfo-Service Mainzer Landstraße 55 60329 Frankfurt 008338-11519 Wortlaut der für die Fachinformation vorgesehenen Angaben FACHINFORMATION 1. BEZEICHNUNG DER ARZNEIMITTEL Imurek® 25 mg Filmtabletten Imurek® 50 mg Filmtabletten Imurek® i.v. 50 mg Pulver zur Herstellung einer Infusions- oder Injektionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Imurek 25 mg Filmtabletten 1 Filmtablette enthält 25 mg Azathioprin. Imurek 50 mg Filmtabletten 1 Filmtablette enthält 50 mg Azathioprin. Sonstige Bestandteile: Lactose-Monohydrat Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1. Imurek i.v. Jede Durchstechflasche enthält 50 mg des Wirkstoffes Azathioprin in Form seines Natriumsalzes. Sonstige Bestandteile: Natriumhydroxid Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1. 3. DARREICHUNGSFORMEN Imurek 25 mg Filmtabletten Orange, runde, bikonvexe Filmtabletten. Auf einer Tablettenseite tragen sie die Prägung „GX EL5“. Imurek 50 mg Filmtabletten Gelbe, runde, bikonvexe Filmtabletten. Auf einer Tablettenseite tragen sie die Prägung „GX – CH1“. Imurek i.v. Gelbes bis bernsteinfarbenes, gefriergetrocknetes Pulver zur Herstellung einer Infusions- oder Injektionslösung. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Imurek ist in Kombination mit anderen Immunsuppressiva zur Vorbeugung von Abstoßungsreaktionen nach allogener Transplantation von Niere, Leber, Herz, Lunge oder Pankreas angezeigt. Azathioprin ist innerhalb immunsuppressiver Regime üblicherweise als ein Zusatz zu immunsuppressiven Substanzen angezeigt, die den Hauptpfeiler der Behandlung darstellen (Basisimmunsuppression). Imurek ist, üblicherweise in Kombination mit Glukokortikosteroiden, bei mäßig schweren bis schweren Verlaufsformen der nachfolgend genannten Erkrankungen angezeigt. In Kombination mit Glukokortikosteroiden hat die Anwendung von Imurek in der Regel eine Glukokortikosteroid­ 1 einsparende Wirkung. Weiterhin ist Imurek bei Patienten mit nachfolgend genannten Erkrankungen angezeigt, wenn Glukokortikosteroide nicht vertragen werden bzw. wenn mit hohen Dosen von Glukokortikosteroiden keine ausreichende therapeutische Wirkung erzielt werden kann: Schwere Formen der aktiven rheumatoiden Arthritis (chronische Polyarthritis), die mit weniger toxischen, antirheumatischen Basis-Therapeutika (disease modifying anti-rheumatic drugs DMARDs) nicht kontrolliert werden können Autoimmunhepatitis Systemischer Lupus erythematodes Dermatomyositis Polyarteriitis nodosa Pemphigus vulgaris und bullöses Pemphigoid Morbus Behçet Refraktäre autoimmune hämolytische Anämie, hervorgerufen durch IgG-Wärmeantikörper Chronisch refraktäre idiopathische thrombozytopenische Purpura Imurek ist zur Behandlung mittelschwerer bis schwerer chronisch-entzündlicher Darmerkrankungen (CED) (Morbus Crohn oder Colitis ulcerosa) bei Patienten angezeigt, bei denen eine Glukokortikosteroid-Therapie notwendig ist, die keine Glukokortikosteroid-Therapie vertragen oder bei denen die Krankheit mit anderen üblichen Mitteln der ersten Wahl nicht behandelbar ist. Imurek ist angezeigt bei schubförmiger Multipler Sklerose, wenn eine immunmodulatorische Therapie angezeigt und eine Therapie mit Beta-Interferonen nicht möglich ist, oder unter einer bisherigen Therapie mit Azathioprin ein stabiler Verlauf erreicht wurde. Imurek ist angezeigt zur Behandlung der generalisierten Myasthenia gravis. In Abhängigkeit vom Schweregrad der Erkrankung sollte Imurek wegen des langsamen Wirkungseintritts zu Beginn der Behandlung in Kombination mit Glukokortikosteroiden verabreicht und die Glukokortikosteroid-Dosis nach Monaten der Behandlung schrittweise reduziert werden. 4.2 Dosierung, Art und Dauer der Anwendung Dosierung und Dauer der Anwendung Nach Organtransplantation - Erwachsene In Abhängigkeit vom immunsuppressiven Regime beträgt die Anfangsdosis in der Regel bis zu 5 mg/kg Körpergewicht/Tag, oral oder intravenös. Die Erhaltungsdosis liegt zwischen 1 mg/kg und 4 mg/kg Körpergewicht/Tag und muss den klinischen Erfordernissen und der hämatologischen Verträglichkeit angepasst werden. Die Behandlung mit Azathioprin, auch in niedrigen Dosierungen, muss unbegrenzt erfolgen, da es sonst zu einer Abstoßung des Transplantats kommen kann. Multiple Sklerose Die übliche Dosis zur Behandlung der schubförmigen Multiplen Sklerose beträgt zwischen 2 mg/kg und 3 mg/kg Körpergewicht/Tag. Eine Behandlungsdauer von mehr als 1 Jahr kann bis zur Manifestation der Wirkung erforderlich sein, und wenigstens 2 Jahre können erforderlich sein, bis die Krankheit tatsächlich unter Kontrolle ist. Myasthenia gravis Für die Behandlung der Myasthenia gravis liegt die empfohlene Dosis bei 2 mg/kg bis 3 mg/kg Körpergewicht/Tag. 2 Üblicherweise tritt ein Behandlungserfolg frühestens 2 bis 6 Monate nach Behandlungsbeginn auf. Je nach Schweregrad der Erkrankung sollte Imurek wegen des langsamen Wirkungseintritts zu Beginn der Behandlung in Kombination mit Glukokortikosteroiden gegeben werden. Die Dosis an Glukokortikosteroiden kann schrittweise über Monate verringert werden. Die Behandlung mit Imurek sollte über wenigstens 2 bis 3 Jahre fortgesetzt werden. Andere Anwendungsgebiete - Erwachsene Für die Behandlung der chronisch-aktiven Autoimmunhepatitis beträgt die Anfangsdosis gewöhnlich zwischen 1 mg/kg und 1,5 mg/kg Körpergewicht/Tag, die Erhaltungsdosis bis zu 2 mg/kg Körpergewicht/Tag.ß In den anderen Anwendungsgebieten beträgt die Anfangsdosis in der Regel 1 mg/kg bis 3 mg/kg Körpergewicht/Tag und die Erhaltungsdosis zwischen weniger als 1 mg/kg und 3 mg/kg Körpergewicht/Tag. Die Dosierung sollte der therapeutischen Wirkung, die unter Umständen erst nach Wochen oder Monaten eintritt, und der hämatologischen Verträglichkeit angepasst werden. Wird ein Ansprechen auf die Therapie festgestellt, sollte die niedrigste wirksame Dosis, die zur Aufrechterhaltung der therapeutischen Wirkung erforderlich ist, angewendet werden. Wenn nach 3- bis 6-monatiger Behandlung keine Besserung eintritt, sollte ein Absetzen der Therapie in Erwägung gezogen werden. Allerdings sollte bei Patienten mit CED eine Behandlungsdauer von mindestens 12 Monaten in Erwägung gezogen werden, wobei ein Ansprechen auf die Behandlung klinisch erst nach drei bis vier Monaten erkennbar werden kann. Kinder und Jugendliche Transplantate Siehe Dosierung und Dauer der Anwendung: nach Organtransplantation - Erwachsene Zur Behandlung der juvenilen idiopathischen Arthritis mit Azathioprin liegen keine hinreichenden Daten zum Beleg der Wirksamkeit und Unbedenklichkeit vor. Multiple Sklerose Erfahrungen zur Anwendung von Azathioprin bei Multipler Sklerose im Kindesalter liegen nicht vor. Daher wird die Anwendung von Azathioprin bei Kindern in dieser Indikation nicht empfohlen. Weitere Indikationen: Übergewichtige Kinder Übergewichtigen Kindern müssen gegebenenfalls Dosen im oberen Bereich des Dosisspektrums verschrieben werden. Daher wird eine engmaschige Überwachung hinsichtlich des Ansprechens auf die Behandlung empfohlen (siehe Abschnitt 5.2 Pharmakokinetische Eigenschaften; Besondere Patientengruppen; Übergewichtige Kinder). Bei den übrigen Anwendungsgebieten gelten die gleichen Dosierungsempfehlungen wie für Erwachsene. 3 Ältere Patienten Es wird empfohlen, die Nieren- und Leberfunktion zu überwachen und die Dosis im Falle einer eingeschränkten Funktion zu reduzieren (siehe Abschnitt 4.2 Dosierung, Art und Dauer der Anwendung – Nieren- und/oder Leberfunktionsstörungen). Zu Blutbildkontrollen siehe Abschnitt 4.4. Nieren- und/oder Leberfunktionsstörungen Bei Patienten mit eingeschränkter Nieren- und/oder Leberfunktionsstörung ist eine Dosisreduzierung in Erwägung zu ziehen. (siehe Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung). Arzneimittelwechselwirkungen Bei gleichzeitiger Einnahme von Xanthinoxidase-Inhibitoren wie Allopurinol sollte die Dosis von Azathioprin auf ein Viertel der normalen Dosis reduziert werden, da Allopurinol die Metabolisierung von Azathioprin verringert (siehe Abschnitt 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen). Patienten mit TPMT-Mangel Bei Patienten mit vererbter geringer oder fehlender Thiopurinmethyltransferase-Aktivität besteht das erhöhte Risiko einer schweren Azathioprin-Vergiftung bei üblichen Azathioprindosen, was im Allgemeinen eine erhebliche Dosisreduzierung erforderlich macht. Die optimale Initialdosis bei homozygoten Patienten mit TPMT-Mangel ist nicht bekannt (siehe Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung: Überwachung und Abschnitt 5.2 Pharmakokinetische Eigenschaften). Empfohlene Azathioprindosen werden durch die meisten heterozygoten Patienten mit TPMT-Mangel toleriert, wobei bei einigen eine Dosisreduzierung erforderlich sein kann. Es sind genotypische und phänotypische TPMT-Tests erhältlich (siehe Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung: Überwachung und Abschnitt 5.2 Pharmakokinetische Eigenschaften). Art der Anwendung Allgemein Imurek 25 mg/50 mg Filmtabletten Imurek Filmtabletten sollten mindestens 1 Stunde vor oder 3 Stunden nach Einnahme einer Mahlzeit oder von Milch eingenommen werden (siehe Abschnitt 5.2 Pharmakokinetische Eigenschaften: Resorption). Die Filmtabletten sind zum Einnehmen und sollten unzerkaut mit reichlich Flüssigkeit (mindestens 200 ml) geschluckt werden. Imurek i.v. Imurek i.v. sollte nur dann angewendet werden, wenn die orale Azathioprin-Behandlung nicht möglich ist. Zudem sollte zum frühestmöglichen Zeitpunkt auf Filmtabletten umgestellt werden. Zur Herstellung und Handhabung der Imurek-Lösungen siehe Abschnitt 6.6. Die konzentrierte Imurek-Lösung wie auch die mit Infusionslösungen verdünnte Darreichungsform sind stark reizend und alkalisch. Sie müssen daher langsam verabreicht werden. Vorzugsweise erfolgt die Anwendung von Imurek i.v. nach Verdünnung mit Infusionslösungen als intravenöse Infusion. 4 Die intravenöse Injektion sollte nur dann gewählt werden, wenn die Infusion mit einer verdünnten Infusionslösung nicht möglich ist. In diesem Fall wird die konzentrierte Imurek-Lösung langsam über mindestens 1 Minute intravenös injiziert, sofort gefolgt von einer intravenösen Gabe von mindestens 50 ml einer der im Abschnitt 6.6 näher beschriebenen Infusionslösungen. Die Imurek-Lösungen dürfen nur intravenös verabreicht werden! Eine versehentliche paravenöse Injektion kann Gewebeschäden verursachen. 4.3 Gegenanzeigen - - Überempfindlichkeit gegen den Wirkstoff Azathioprin, gegen Mercaptopurin (einen Metaboliten von Azathioprin) oder einen der sonstigen Bestandteile, Impfung mit Lebendimpfstoffen (insbesondere BCG, Pocken und Gelbfieber) (siehe Abschnitt 4.5), Stillzeit (siehe Abschnitt 4.6). 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung - Eine Impfung mit Lebendimpfstoffen kann bei immungeschwächten Patienten zu Infektionen führen. Impfungen mit Lebendimpfstoffen sind daher kontraindiziert (siehe Abschnitt 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen). Eine gleichzeitige Anwendung von Ribavirin und Azathioprin wird nicht empfohlen. Ribavirin kann die Wirksamkeit von Azathioprin verringern und die Azathioprin-Toxizität erhöhen (siehe Abschnitt 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen). Überwachung Die Einleitung einer Therapie mit Imurek bei vorbestehenden, schweren Infektionen, schweren Störungen der Leber- und Knochenmarkfunktion sowie beim Vorliegen einer Pankreatitis sollte nur unter sorgfältiger Nutzen-Risiko-Abwägung und den nachfolgend beschriebenen Vorsichtsmaßnahmen erfolgen. Besondere Aufmerksamkeit sollte der Überwachung des Blutbildes gelten. Die Erhaltungsdosis ist gegebenenfalls soweit zu reduzieren, solange eine klinische Reaktion stattfindet. Azathioprin sollte nur verordnet werden, wenn der Patient während der gesamten Therapie ausreichend auf unerwünschte Wirkungen hin überwacht werden kann. Während der ersten 8 Wochen der Therapie sollte mindestens einmal wöchentlich ein Blutbild einschließlich Thrombozytenzählung angefertigt werden. Häufigere Kontrollen sind angezeigt bei: Einsatz höherer Dosen Älteren Patienten Nierenfunktionsstörungen; beim Auftreten einer hämatologischen Toxizität muss die Dosis reduziert werden (siehe auch Abschnitte 4.2 Dosierung, Art und Dauer der Anwendung und 5.2 Pharmakokinetische Eigenschaften). Leberfunktionsstörungen; in diesem Fall müssen zudem regelmäßige Leberfunktionstests durchgeführt werden und beim Auftreten einer hepatischen oder hämatologischen Toxizität muss die Dosis verringert werden (siehe auch Abschnitte 4.2 Dosierung, Art und Dauer der Anwendung und 5.2 Pharmakokinetische Eigenschaften). Grundsätzlich ist besondere Vorsicht bei der Anwendung von Azathioprin bei Patienten mit Leberfunktionsstörungen erforderlich, da über lebensbedrohliche Leberschädigungen berichtet wurde (siehe Abschnitt 4.8). Dies ist insbesondere bei Patienten mit schweren Leberfunktionsstörungen wichtig und Azathioprin sollte in diesem Fall nur nach sorgfältiger Risiko-Nutzen-Abwägung angewendet werden. 5 Azathioprin ist hepatotoxisch, weshalb im Verlauf der Behandlung regelmäßige Kontrollen durch Leberfunktionstests durchgeführt werden sollten. Häufigere Kontrollen werden empfohlen bei Patienten mit vorbestehender Lebererkrankung und solchen, die sich einer Therapie mit möglicherweise hepatotoxischer Nebenwirkung unterziehen. Der Patient sollte darüber informiert werden, Azathioprin bei Auftreten eines Ikterus sofort abzusetzen. Nach 8 Wochen kann die Häufigkeit der Blutbildkontrollen auf monatliche Abstände (maximal vierteljährlich) reduziert werden. Bei ersten Anzeichen einer abnormalen Änderung des Blutbildes sollte die Behandlung sofort unterbrochen werden, da die Anzahl der Leukozyten und Thrombozyten auch nach Behandlungsende weiter abnehmen kann. Patienten, die Azathioprin erhalten, müssen darauf hingewiesen werden, ihren behandelnden Arzt unverzüglich über alle Anzeichen einer Infektion, ungeklärte blaue Flecken oder Blutungen oder über andere Anzeichen auf eine Knochenmarksuppression zu informieren. Eine Knochenmarksuppression ist bei rechtzeitigem Absetzen von Azathioprin reversibel. Etwa 10 % der Patienten haben durch genetischen Polymorphismus eine verminderte Aktivität des Enzyms Thiopurin-Methyltransferase (TPMT). Insbesondere bei homozygoten Merkmalsträgern ist der Abbau von Azathioprin beeinträchtigt, so dass ein höheres Risiko für myelotoxische Wirkungen besteht. Gleichzeitig verabreichte Arzneimittel, die das Enzym TPMT hemmen (z. B. Olsalazin, Mesalazin und Sulfasalazin), können diesen Effekt verstärken. Des Weiteren wurde ein möglicher Zusammenhang zwischen einer verminderten TPMT-Aktivität und sekundären Leukämien und Myelodysplasien bei einzelnen Patienten berichtet, die 6-Mercaptopurin (aktiver Metabolit von Azathioprin) in Kombination mit anderen zytotoxischen Substanzen erhielten (siehe Abschnitt 4.8). Einige Laboratorien bieten Tests zur Erkennung eines TPMT-Mangels an und obwohl diese Tests nicht alle Patienten mit einem Risiko für eine schwere Toxizität identifizieren können, wird die Testung auf TMPT-Mangel insbesondere prä-therapeutisch bei hochdosierter Azathioprin-Therapie sowie bei rascher Verschlechterung des Blutbildes empfohlen. Bei gleichzeitiger Anwendung von Azathioprin und Arzneimitteln mit myelosuppressiven Eigenschaften sollte die Dosierung reduziert werden (siehe Abschnitt 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen: Zytostatische/Myelosuppressive Arzneimittel). Bei gleichzeitiger Einnahme von Allopurinol, Oxipurinol oder Thiopurinol sollte die Dosis von Azathioprin auf ein Viertel der normalen Dosis reduziert werden (siehe Abschnitt 4.5). Besondere Vorsicht ist geboten, wenn Azathioprin zusammen mit Tubocurarin und Succinylcholin angewendet wird (siehe Abschnitt 4.5). Lesch-Nyhan-Syndrom Begrenzte Daten deuten darauf hin, dass Azathioprin bei Patienten mit einem erblichen Mangel des Enzyms Hypoxanthin-Guanin-Phosphoribosyltransferase (Lesch-Nyhan-Syndrom) nicht wirksam ist. Daher sollte Azathioprin nicht bei Patienten mit dieser Stoffwechselerkrankung verabreicht werden. Varicella-Zoster-Virus-Infektionen (siehe Abschnitt 4.8) Eine Infektion mit dem Varicella-Zoster-Virus (VZV; Windpocken und Herpes zoster) kann unter der Behandlung mit Immunsuppressiva schwerwiegend verlaufen. Vor Behandlungsbeginn mit Immunsuppressiva sollte der verschreibende Arzt den Patienten daher auf eine VZV-Infektion in der Anamnese hin überprüfen. Serologische Untersuchungen können zur Bestimmung einer früheren Exposition hilfreich sein. 6 Patienten ohne VZV-Exposition in der Anamnese sollten jeglichen Kontakt mit Personen mit Windpocken oder Herpes zoster vermeiden. Wenn solche Patienten trotzdem einer VZV-Infektion ausgesetzt sein sollten, ist besondere Vorsicht geboten, um den Ausbruch von Windpocken oder Herpes zoster bei diesen Patienten zu vermeiden. Außerdem ist eine passive Immunisierung mit Varicella-Zoster-Immunglobulin (VZIG) in Betracht zu ziehen. Falls der Patient bereits infiziert ist, sind geeignete Maßnahmen zu ergreifen, die eine antivirale Therapie, eine Unterbrechung der Azathioprin-Therapie und eine unterstützende Behandlung einschließen können. Progressive multifokale Leukenzephalopathie (PML) Über PML, eine durch den JC-Virus verursachte opportunistische Infektion, wurde bei Patienten, die gleichzeitig mit Azathioprin und anderen Immunsuppressiva behandelt wurden, berichtet. Die immunsuppressive Therapie sollte bei ersten Anzeichen oder Symptomen, die auf eine PML hinweisen, beendet und eine entsprechende Evaluierung zur Erstellung einer Diagnose vorgenommen werden (siehe Abschnitt 4.8 Nebenwirkungen). Mutagenität Chromosomale Veränderungen wurden sowohl bei weiblichen als auch bei männlichen Patienten, die mit Azathioprin behandelt wurden, nachgewiesen. Die Rolle, die Azathioprin bei der Entwicklung dieser Veränderungen spielte, ist schwer zu beurteilen. Vorübergehende chromosomale Veränderungen der Lymphozyten wurden bei Nachkommen von Patienten, die mit Azathioprin behandelt wurden, nachgewiesen. Mit Ausnahme einiger sehr seltener Fälle wurden keine offensichtlichen Anzeichen körperlicher Abnormalität bei Nachkommen von Patienten, die mit Azathioprin behandelt wurden, beobachtet. Azathioprin und langwelliges UV-Licht zeigen synergistisch klastogene Wirkungen bei Patienten, die mit Azathioprin bei einer Reihe von Krankheiten behandelt wurden. Karzinogenität (siehe auch Abschnitt 4.8) Patienten unter immunsuppressiver Behandlung haben ein erhöhtes Risiko, Non-Hodgkin-Lymphome oder andere bösartige Geschwülste zu entwickeln, insbesondere Karzinome der Haut (Melanom und andere Karzinome), Sarkome (Kaposi-Sarkom und andere Sarkome) oder Zervixkarzinome in situ. Das Risiko scheint mit der Intensität und Dauer der Immunsuppression und weniger mit der Anwendung spezifischer Immunsuppressiva zusammenzuhängen. Über einen Zusammenhang zwischen einer Reduktion oder einem Absetzen der immunsuppressiven Therapie und einer teilweisen oder vollständigen Regression von Non-Hodgkin-Lymphomen und Kaposi-Sarkomen wurde berichtet. Es gibt Berichte über hepatosplenische T-Zell-Lymphome bei CED-Patienten, die Azathioprin zusammen mit anti-TNF-Arzneimitteln anwenden. Bei mit mehreren Immunsuppressiva behandelten Patienten besteht das Risiko einer „ÜberImmunsuppression“, daher sollte eine solche Therapie in der niedrigsten noch wirksamen Dosierung weitergeführt werden. Wie bei Patienten mit einem erhöhten Risiko für Karzinome der Haut üblich, sollte die Exposition gegenüber Sonnenlicht und UV-Strahlung begrenzt werden. Die Patienten sollten zudem schützende Kleidung tragen und Sonnenschutzmittel mit hohem Lichtschutzfaktor verwenden. Teratogenität/Empfängnisverhütende Maßnahmen Da es beim Menschen widersprüchliche Befunde über ein teratogenes Potenzial von Azathioprin gibt, sollten sowohl männliche als auch weibliche Patienten im reproduktiven Alter während der 7 Anwendung von Azathioprin empfängnisverhütende Maßnahmen treffen. Männer sollten während und bis 6 Monate nach Ende der Behandlung keine Kinder zeugen. Dies gilt auch für Patientinnen und Patienten mit eingeschränkter Fruchtbarkeit aufgrund chronischer Urämie, da sich die Fruchtbarkeit nach Transplantation im Allgemeinen wieder normalisiert. Fertilität Sowohl die männliche als auch die weibliche Fertilität kann sich als Folge der Verbesserung der Nierenfunktion nach Nierentransplantation und damit verbundener Behandlung mit Azathioprin wieder normalisieren. Fallberichte deuten darauf hin, dass Intrauterinpessare (Spirale, Kupfer-T) unter einer AzathioprinTherapie versagen können. Daher sind andere oder zusätzliche empfängnisverhütende Maßnahmen anzuraten (siehe Abschnitt 4.6). Sonstige Bestandteile Imurek 25 mg/50 mg Filmtabletten enthalten Lactose-Monohydrat. Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Imurek 25 mg/50 mg Filmtabletten nicht einnehmen. Imurek i.v. enthält Natrium, aber weniger als 1 mmol (23 mg) Natrium pro Durchstechflasche. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Impfstoffe Die immunsuppressive Wirkung von Azathioprin kann zu einer untypischen und potenziell schädlichen Reaktion mit Lebendimpfstoffen führen, weshalb die Anwendung von Lebendimpfstoffen bei Patienten, die mit Azathioprin behandelt werden, kontraindiziert ist (siehe Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung). Immunsupprimierte Patienten dürfen nicht mit Lebendimpfstoffen geimpft werden, da bei ihnen die Gefahr einer Infektion durch den Lebendimpfstoff besteht (siehe auch Abschnitt 4.4). Bei Impfstoffen aus abgetöteten Erregern oder Toxoiden ist eine verminderte Immunantwort wahrscheinlich. Dies wurde im Rahmen einer Hepatitis B-Impfung bei Patienten, die mit einer Kombination aus Azathioprin und Glukokortikosteroiden behandelt wurden, beobachtet. Der Impferfolg sollte daher immer mit einer Titerbestimmung überprüft werden. In einer kleineren klinischen Studie wurde gezeigt, dass therapeutische Standarddosen von Azathioprin die Immunantwort auf einen polyvalenten Pneumokokken-Impfstoff (auf Basis der mittleren antikapsulären spezifischen Antikörperkonzentration) nicht beeinträchtigen. Wirkungen von gleichzeitig verabreichten Arzneimitteln auf Azathioprin Ribavirin Ribavirin hemmt das Enzym Inosinmonophosphat-Dehydrogenase (IMPDH) und führt zu einer geringeren Produktion der aktiven 6-Thioguanin-Nukleotide. Über eine schwere Myelosuppression wurde bei gleichzeitiger Anwendung von Azathioprin und Ribavirin berichtet. Daher wird eine gleichzeitige Anwendung nicht empfohlen (siehe Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung und Abschnitt 5.2 Pharmakokinetische Eigenschaften: Metabolisierung). 8 Zytostatische/Myelosuppressive Arzneimittel (siehe Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung) Falls möglich, sollte die gleichzeitige Anwendung von Zytostatika oder Arzneimitteln mit myelosuppressiven Eigenschaften wie Penicillamin vermieden werden. Es liegen widersprüchliche klinische Berichte über Wechselwirkungen bei Azathioprin und Co-trimoxazol vor, in denen über schwerwiegende hämatologische Störungen berichtet wird. Einige Fallberichte weisen darauf hin, dass hämatologische Störungen bei gleichzeitiger Anwendung von Azathioprin und ACE-Inhibitoren auftreten können. Es gibt Hinweise darauf, dass Cimetidin und Indometacin eine myelosuppressive Wirkung haben, die bei gleichzeitiger Anwendung von Azathioprin verstärkt werden kann. Allopurinol/ Oxipurinol/ Thiopurinol Die Xanthinoxidase-Aktivität wird durch Allopurinol, Oxipurinol und Thiopurinol gehemmt, was zu einer verringerten Verstoffwechselung der biologisch aktiven 6-Thioinosinsäure zur biologisch inaktiven 6-Thioharnsäure führt. Bei gleichzeitiger Einnahme von Allopurinol, Oxipurinol und/oder Thiopurinol zusammen mit 6-Mercaptopurin oder Azathioprin sollte die Dosis von 6-Mercaptopurin und Azathioprin auf ein Viertel der normalen Dosis reduziert werden (siehe Abschnitt 4.2 Dosierung, Art und Dauer der Anwendung: Arzneimittelwechselwirkungen). Aminosalicylsäure Es liegen In-vitro und In-vivo Hinweise vor, dass Aminosalicylsäurederivate wie Olsalazin, Mesalazin oder Sulfasalazin das Enzym TPMT hemmen. Daher sind bei gleichzeitiger Anwendung von Aminosalicylsäurederivaten geringere Azathioprin-Dosen in Erwägung zu ziehen (siehe auch Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung). Methotrexat 20 mg/m2 Methotrexat oral erhöhte die AUC von 6-Mercaptopurin um etwa 31 %, während 2 bzw. 5 g/m2 Methotrexat i.v. die AUC von 6-Mercaptopurin um 69 bzw. 93 % erhöhte, Daher sollte bei gleichzeitiger Anwendung hoher Methotrexat-Dosen die Azathioprin-Dosis angepasst werden, um die Anzahl weißer Blutkörperchen auf einem adäquaten Wert zu halten. Wirkungen von Azathioprin auf gleichzeitig verabreichte Arzneimittel Antikoagulanzien Eine Verminderung der gerinnungshemmenden Wirkung von Warfarin wurde bei gleichzeitiger Anwendung von Azathioprin beschrieben. 4.6 Fertilität, Schwangerschaft und Stillzeit Fertilität Siehe Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung: Fertilität). Schwangerschaft Im Tierversuch sind Missbildungen durch Azathioprin aufgetreten (siehe Abschnitt 5.3), beim Menschen gibt es aber widersprüchliche Befunde über ein teratogenes Potenzial von Azathioprin. 9 Azathioprin darf in der Schwangerschaft nur nach sorgfältiger Nutzen-Risiko-Abwägung angewendet werden. Sowohl männliche als auch weibliche Patienten im reproduktiven Alter sollten während der Anwendung von Azathioprin empfängnisverhütende Maßnahmen treffen. Männer sollten während und bis 6 Monate nach Ende der Behandlung keine Kinder zeugen. Dies gilt auch für Patienten mit eingeschränkter Fruchtbarkeit aufgrund chronischer Urämie, da sich die Fruchtbarkeit nach Transplantation im Allgemeinen wieder normalisiert. Fallberichte deuten darauf hin, dass Intrauterinpessare (Spirale, Kupfer-T) unter einer AzathioprinTherapie versagen können. Daher sind andere oder zusätzliche empfängnisverhütende Maßnahmen anzuraten. Es ist bekannt, dass Azathioprin und seine Metaboliten in erheblichem Maße die Plazenta und Fruchtblase passieren und so von der Mutter in den Fetus gelangen können. Bei einer Reihe von Neugeborenen, deren Mütter Azathioprin während der Schwangerschaft einnahmen, wurde eine Veränderung des Blutbildes (Leukozytopenie und/oder Thrombozytopenie) festgestellt. Während der Schwangerschaft ist eine besonders sorgfältige hämatologische Überwachung anzuraten. Bei einer Kombination von Azathioprin mit Prednison wurde bei intrauterin exponierten Neugeborenen eine vorübergehende Beeinträchtigung der Immunreaktion festgestellt. Es existieren Berichte über Frühgeburten und verringerte Geburtsgewichte nach mütterlicher AzathioprinExposition, insbesondere in Kombination mit Glukokortikosteroiden. Ferner liegen Berichte über spontane Aborte sowohl nach mütterlicher wie nach väterlicher Exposition vor. Chromosomale Veränderungen, die im Laufe der Zeit verschwanden, wurden in Lymphozyten von Kindern gefunden, deren Eltern mit Azathioprin behandelt wurden. Mit Ausnahme von extrem seltenen Fällen wurden keine sichtbaren physischen Anzeichen für eine Abnormalität bei den Nachkommen von mit Azathioprin behandelten Patienten beobachtet. Stillzeit Der aktive Metabolit von Azathioprin, Mercaptopurin, wurde im Kolostrum und in der Muttermilch von Frauen nachgewiesen, die mit Azathioprin behandelt wurden. Deshalb ist eine Therapie mit Azathioprin während der Stillzeit kontraindiziert (siehe Abschnitt 4.3). Falls eine Behandlung mit Azathioprin unumgänglich ist, muss abgestillt werden. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Der klinische Zustand des Patienten und das Nebenwirkungsprofil von Azathioprin sollten bei der Beurteilung der Fähigkeit des Patienten, ein Fahrzeug zu führen oder Maschinen zu bedienen, in Betracht gezogen werden. Es wurden keine Studien zur Wirkung von Azathioprin auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Von der Pharmakologie des Wirkstoffs Azathioprin kann eine schädliche Wirkung auf diese Tätigkeiten nicht abgeleitet werden. 4.8 Nebenwirkungen Für dieses Arzneimittel existiert keine klinische Dokumentation nach heutigen Maßstäben, die eine exakte Häufigkeitsbeschreibung der Nebenwirkungen begründen würde. Nebenwirkungen können je nach Indikation, Dosierung sowie Art der Kombination mit anderen therapeutischen Mitteln unterschiedlich häufig auftreten. 10 Nachfolgend sind die Nebenwirkungen nach Systemorganklassen und Häufigkeit aufgelistet. Die Häufigkeiten sind wie folgt definiert: sehr häufig (≥ 1/10), häufig (≥ 1/100, < 1/10), gelegentlich (≥ 1/1.000, < 1/100), selten (≥ 1/10.000, < 1/1.000), sehr selten (< 1/10.000) einschließlich Einzelfälle. Infektionen und parasitäre Erkrankungen Sehr häufig: Virale, mykotische und bakterielle Infektionen bei Transplantatempfängern, die Azathioprin in Kombination mit anderen Immunsuppressiva erhalten Gelegentlich: Virale, mykotische und bakterielle Infektionen bei den anderen Patienten Patienten, die Azathioprin allein oder in Kombination mit anderen Immunsuppressiva, insbesondere mit Glukokortikosteroiden, erhalten, besitzen eine erhöhte Anfälligkeit für virale, mykotische und bakterielle Infektionen, einschließlich schwerer oder atypischer Infektionen durch den Varicella­ Zoster-Virus und andere infektiöse Erreger (siehe auch Abschnitt 4.4). Sehr selten: Nach Anwendung von Azathioprin zusammen mit anderen Immunsuppressiva wurde über Fälle von durch den JC-Virus verursachter PML berichtet (siehe Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung). Gutartige, bösartige und unspezifische Neubildungen (einschließlich Zysten und Polypen) Selten: Tumoren einschließlich Non-Hodgkin-Lymphome, Karzinome der Haut (Melanom und andere Karzinome), Sarkome (Kaposi-Sarkom und andere Sarkome) und Zervixkarzinome in situ, akute myeloische Leukämien und Myelodysplasien (siehe auch Abschnitt 4.4) Das Risiko, Non-Hodgkin-Lymphome und andere bösartige Geschwülste zu entwickeln, insbesondere Karzinome der Haut (Melanom und andere Karzinome), Sarkome (Kaposi-Sarkom und andere Sarkome) und Zervixkarzinome in situ, ist bei Patienten, die immunsuppressiv wirkende Arzneimittel erhalten, und besonders bei Transplantatempfängern unter aggressiver Behandlung erhöht. Daher sollte eine derartige Therapie mit der niedrigsten noch wirksamen Dosierung weitergeführt werden. Das erhöhte Risiko für die Entwicklung von Non-Hodgkin-Lymphomen bei immunsupprimierten Patienten mit rheumatoider Arthritis im Vergleich zur normalen Bevölkerung scheint zumindest teilweise auf die Erkrankung selbst zurückzuführen zu sein. Berichte über akute myeloische Leukämien und Myelodysplasien (einige davon in Verbindung mit Chromosomenveränderungen) waren selten. Sehr selten: Hepatosplenisches T-Zell-Lymphom bei CED-Patienten, die gleichzeitig andere anti­ TNF-Arzneimittel anwenden Erkrankungen des Blutes und des Lymphsystems Sehr häufig: Häufig: Gelegentlich: Selten: Sehr selten: Knochenmarkdepression, Leukozytopenie Thrombozytopenie Anämie Agranulozytose, Panzytopenie, aplastische Anämie, megaloblastische Anämie und erythrozytäre Hypoplasie Hämolytische Anämie Die häufigste Nebenwirkung von Azathioprin ist eine dosisabhängige, im Allgemeinen reversible Depression des Knochenmarks, die sich meistens als Leukozytopenie, manchmal auch als Thrombozytopenie und Anämie und selten als Agranulozytose, Panzytopenie und aplastische Anämie äußert. Sie tritt insbesondere bei Patienten auf, die durch TPMT-Mangel oder Leber- bzw. 11 Nierenfunktionsstörungen für eine Myelosuppression prädisponiert sind, oder bei Patienten, bei denen bei gleichzeitiger Therapie mit Allopurinol die Azathioprin-Dosis nicht verringert wird. Reversible, dosisabhängige Makrozytose und Erhöhungen des Hämoglobingehaltes der roten Blutkörperchen sind unter Azathioprintherapie aufgetreten. Außerdem wurden megaloblastäre Veränderungen des Knochenmarks beobachtet. Schwere megaloblastische Anämie und erythrozytäre Hypoplasie sind jedoch selten. Erkrankungen des Immunsystems Gelegentlich: Überempfindlichkeitsreaktionen Sehr selten: Stevens-Johnson-Syndrom, toxisch epidermale Nekrolyse Eine Vielzahl verschiedener klinischer Syndrome, die als idiosynkratische Manifestationen einer Überempfindlichkeitsreaktion gewertet werden können, wurde gelegentlich nach Verabreichung von Azathioprin beschrieben. Klinische Symptome beinhalten allgemeines Unwohlsein, Schwindel, Übelkeit, Erbrechen, Diarrhö, Fieber, Schüttelfrost, Hautausschlag, Vaskulitis, Myalgie, Arthralgie, Hypotonie, renale Dysfunktion, Leberfunktionsstörungen und Cholestase (siehe auch in Abschnitt 4.8 unter Leber- und Gallenerkrankungen). In vielen Fällen wurde ein Zusammenhang mit Azathioprin nach Re-Exposition bestätigt. In sehr seltenen Fällen wurden Überempfindlichkeitsreaktionen mit letalem Ausgang berichtet. Andere ausgeprägte Begleiterkrankungen können dazu beigetragen haben. Sofortiges Absetzen von Azathioprin und, wenn nötig, Maßnahmen zur Unterstützung des Kreislaufs sind als Therapie meist ausreichend. Nach dem Auftreten einer Überempfindlichkeitsreaktion auf Azathioprin muss die Notwendigkeit einer weiteren Therapie mit Azathioprin in jedem Einzelfall sorgfältig abgewogen werden. Erkrankungen der Atemwege, des Brustraums und Mediastinums Sehr selten: Reversible Pneumonitis Erkrankungen des Gastrointestinaltrakts Häufig: Übelkeit, bisweilen mit Erbrechen Gastrointestinale Störungen nach Einnahme von Azathioprin-haltigen Tabletten treten vorwiegend in Form von Übelkeit auf. Bei der ersten Einnahme von Azathioprin tritt bei einer geringen Anzahl von Patienten Übelkeit auf. Zur besseren Verträglichkeit sollten die Tabletten nach einer Mahlzeit eingenommen werden. Gelegentlich: Sehr selten: Pankreatitis Kolitis, Divertikulitis und Darmperforation bei Transplantatempfängern, schwere Diarrhö bei Patienten mit entzündlichen Darmerkrankungen Insbesondere bei Patienten nach Nierentransplantation und bei Patienten mit entzündlichen Darmerkrankungen wurde über das Auftreten von Pankreatitiden unter Azathioprin-Therapie berichtet. Es ist schwierig, die Pankreatitis mit der Anwendung eines bestimmten Arzneimittels in Verbindung zu bringen, obwohl nach Re-Exposition gelegentlich ein Zusammenhang mit Azathioprin bestätigt wurde. Schwere Komplikationen einschließlich Kolitis, Divertikulitis und Darmperforation wurden bei Transplantatempfängern unter immunsuppressiver Behandlung beschrieben. Die Ätiologie ist jedoch nicht eindeutig bewiesen, ebenso können hoch dosierte Glukokortikosteroide beteiligt sein. 12 Bei Patienten mit entzündlichen Darmerkrankungen wurden schwere Durchfälle unter AzathioprinTherapie beobachtet, die bei Re-Exposition wieder auftraten. Bei einer Exazerbation dieser Symptome sollte bei diesen Patienten der mögliche Zusammenhang mit der Azathioprin-Behandlung in Betracht gezogen werden. Leber- und Gallenerkrankungen Gelegentlich: Selten: Cholestase und Verschlechterung von Leberfunktionswerten Lebensbedrohliche Leberschädigungen Dosisabhängig auftretende Cholestasen und Verschlechterungen der Leberfunktion wurden gelegentlich im Zusammenhang mit einer Azathioprin-Therapie berichtet und sind üblicherweise nach Absetzen der Behandlung mit Azathioprin reversibel. Diese können mit Symptomen einer Überempfindlichkeitsreaktion im Zusammenhang stehen (siehe auch in Abschnitt 4.8 unter Erkrankungen des Immunsystems). Seltene, jedoch lebensbedrohliche Leberschädigungen in Verbindung mit chronischer Einnahme von Azathioprin wurden hauptsächlich bei Transplantatempfängern beschrieben. Histologische Befunde umfassen sinusoidale Dilatation, Peliosis hepatis, Lebervenenverschluss und noduläre regenerative Hyperplasie. In einigen Fällen konnte durch Absetzen der Behandlung mit Azathioprin eine vorübergehende oder andauernde Erholung der histologischen Leberveränderungen und ihrer Symptomatik erreicht werden. Erkrankungen der Haut und des Unterhautzellgewebes Selten: Haarausfall Haarausfall wurde sowohl unter Mono- als auch unter Kombinationstherapie mit Azathioprin beobachtet. In vielen Fällen trat eine spontane Besserung trotz Weiterführung der Behandlung ein. Der Zusammenhang zwischen Haarausfall und der Azathioprin-Behandlung ist noch unklar. 4.9 Überdosierung Symptome Die häufigste Auswirkung einer Überdosierung mit Azathioprin ist eine Myelosuppression mit Störung des Blutbildes, die gewöhnlich ihr Maximum 9 bis 14 Tage nach der Überdosierung erreicht. Die Hauptsymptome der Myelosuppression sind Ulzerationen im Mund- und Rachenraum, blaue Flecken, Fieber unklarer Genese und ungeklärte Infektionen. Weiterhin können Spontanblutungen und starke Abgeschlagenheit auftreten. Diese Symptome sind eher nach länger dauernder, geringgradiger Überdosierung als nach einer hohen Einzeldosis zu erwarten. Es liegt ein Bericht über einen Patienten vor, der 7,5 g Azathioprin als Einzeldosis eingenommen hatte. Sofort auftretende toxische Wirkungen dieser Überdosierung waren Übelkeit, Erbrechen und Diarrhö, gefolgt von mittelgradiger Leukozytopenie und einer geringfügigen Störung der Leberfunktion. Die Erholung des Patienten war komplikationslos. Behandlung Da es kein spezifisches Antidot gibt, sollten die Blutwerte engmaschig überwacht und allgemeine unterstützende Maßnahmen bei Bedarf eingeleitet sowie entsprechende Bluttransfusionen verabreicht werden. Aktive Maßnahmen (wie die Verwendung von Aktivkohle) werden im Fall einer AzathioprinÜberdosierung wahrscheinlich nur dann effektiv sein, wenn sie innerhalb von 60 Minuten nach Einnahme durchgeführt werden. Azathioprin ist teilweise dialysierbar. Trotzdem kann der Nutzen einer Dialyse bei Patienten, die eine Überdosis eingenommen haben, nicht bewertet werden. 13 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Immunsuppressiva ATC-Code: L04A X01 Azathioprin ist ein Prodrug des 6-Mercaptopurins (6-MP). 6-MP ist inaktiv, wirkt allerdings als ein Purin-Antagonist und wirkt erst nach zellulärer Aufnahme und intrazellulärer Umwandlung zu Thioguanin-Nukleotiden (TGN) immunsuppressiv. TGN und andere Metaboliten (z. B. 6-Methylmercaptopurin-Ribonukleotide) hemmen die de-novo-Purin-Synthese und Purin-NukleotidUmwandlungen. TGN wird ebenfalls in Nukleinsäuren eingebaut, was zur immunsuppressiven Wirkung des Arzneimittels beiträgt. Weitere potenzielle Wirkmechanismen von Azathioprin sind - Hemmung mehrerer Stufen der Nukleinsäuresynthese und dadurch Hemmung der Proliferation und Aktivität immunkompetenter Zellen (B- und T-Lymphozyten). Infolge dieser Mechanismen kann die therapeutische Wirkung von Azathioprin erst nach mehreren Wochen oder Monaten der Behandlung erkennbar sein (siehe Abschnitt 4.2). Die Aktivität des Azathioprin-Metaboliten 1-Methyl-4-nitro-5-thioimidazol wurde, im Gegensatz zu 6-MP, bisher noch nicht ganz geklärt. Im Vergleich zu 6-MP scheint es allerdings in verschiedenen Systemen die Azathioprin-Aktivität zu modifizieren. In einer kontrollierten Studie an Patienten mit Myasthenia gravis erwies sich Imurek (2,5 mg/kg Körpergewicht/Tag) in Kombination mit Prednisolon in Bezug auf Therapieversager als signifikant besser im Vergleich zu Prednisolon und Placebo. Ferner war eine Glukokortikosteroid-einsparende Wirkung nach 15 Monaten ersichtlich. Nach 36 Monaten benötigten 63 % in der Azathioprin-Gruppe im Vergleich zu nur 20 % in der Placebo-Gruppe keine Glukokortikosteroide mehr. 5.2 Pharmakokinetische Eigenschaften Resorption: Azathioprin wird unvollständig und unterschiedlich resorbiert. Die mittlere (Spannweite) absolute Bioverfügbarkeit von 6-MP nach Anwendung von 50 mg Azathioprin liegt bei 47 % (27– 80 %). Das Ausmaß der Resorption von Azathioprin ist im gesamten Gastrointestinaltrakt ähnlich, einschließlich Magen, Jejunum und Blinddarm. Das Ausmaß der Resorption von 6-MP nach Anwendung von Azathioprin ist allerdings unterschiedlich und variiert je nach Lokalität der Resorption, wobei das höchste Ausmaß an Resorption im Jejunum stattfindet, gefolgt von Magen und Blinddarm. Azathioprin-relevante pharmakokinetische Studien mit 6-MP wurden durchgeführt, allerdings ohne den Einfluss von Nahrungsmitteln zu untersuchen. Die mittlere relative Bioverfügbarkeit von 6-MP war nach Einnahme einer Mahlzeit und Milch morgens ungefähr 26 % niedriger im Vergleich zum Nüchternzustand. Die in Milch enthaltene Xanthinoxidase baut 6-MP ab (Abbau von 30 % innerhalb von 30 Minuten) (siehe Pharmakokinetische Eigenschaften: Metabolisierung). Azathioprin sollte mindestens 1 Stunde vor oder 3 Stunden nach Einnahme einer Mahlzeit oder von Milch eingenommen werden (siehe Abschnitt 4.2. Dosierung, Art und Dauer der Anwendung). Es gibt keine Korrelation zwischen den Plasmaspiegeln von Azathioprin und 6-Mercaptopurin und der therapeutischen Wirksamkeit oder Toxizität von Azathioprin. Verteilung: Das Verteilungsvolumen im Steady-State (Vdss) von Azathioprin ist nicht bekannt. Das mittlere (± SD) offensichtliche Vdss von 6-MP beträgt 0,9 (±0,8) l/kg, obwohl dieser Wert wohl als zu niedrig anzusehen ist, da 6-MP im gesamten Körper abgebaut wird und nicht nur in der Leber. 14 Die 6-MP-Konzentrationen im Liquor sind nach i.v. oder oraler Anwendung niedrig oder vernachlässigbar. Azathioprin wird rasch im Körper verteilt. Die Plasmahalbwertszeit beträgt 3 bis 5 Stunden. Lediglich 30 % der Substanz werden an Plasmaproteine gebunden. Azathioprin und seine Metaboliten sind liquorgängig. Metabolisierung: Azathioprin wird In-vivo rasch durch Glutathion-S-transferase in die Metaboliten 6-MP und 1-Methyl-4-nitro-5-thioimidazol metabolisiert. 6-MP passiert Zellmembranen rasch und wird in zahlreichen mehrstufigen Stoffwechselvorgängen in aktive und inaktive Metaboliten extensiv metabolisiert, ohne dass ein Enzym vorrangig aktiv ist. Aufgrund des komplexen Metabolismus sind alle Fälle ausbleibender Wirksamkeit und/oder Myelosuppression nicht durch die Hemmung eines einzelnen Enzyms zu erklären. Die hauptsächlich für die Metabolisierung von 6-MP und der darauf basierenden Metaboliten verantwortlichen Enzyme sind das polymorphe Enzym Thiopurinmethyltransferase (TPMT) (siehe Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung: Überwachung und Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen: Aminosalicylsäure), Xanthinoxidase (siehe Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen: Allopurinol/Oxipurinol/Thiopurinol und Pharmakokinetische Eigenschaften: Resorption), Inosinmonophosphat-Dehydrogenase (IMPDH) (siehe Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen: Ribavirin) und Hypoxanthin-Guanin-Phosphoribosyltransferase (HPRT). Weitere an der Bildung aktiver und inaktiver Metaboliten beteiligter Enzyme sind Guanosinmonophosphat-Synthetase (GMPS, welches TGNs bildet) und Inosintriphosphat-Pyrophosphatase (ITPase). Azathioprin wird selbst ebenfalls durch die Aldehydoxidase zum wahrscheinlich aktiven 8-hydroxy-Azathioprin. In weiteren Stoffwechselvorgängen werden außerdem verschiedene inaktive Metaboliten gebildet. Es liegen Hinweise vor, dass Polymorphismen in den Genen, welche die verschiedenen an der Metabolisierung von Azathioprin beteiligten Enzymsysteme kodieren, Arzneimittelnebenwirkungen bei einer Azathioprin-Therapie prognostizieren können. Thiopurinmethyltransferase (TPMT) Die TMPT-Aktivität ist umgekehrt proportional zur von 6-MP-abgeleiteten Thioguanin-NukleotidKonzentration roter Blutkörperchen. Höhere Thioguanin-Nukleotid-Konzentrationen führen zu stärkeren Reduzierungen der Anzahl weißer Blutkörperchen und neutrophiler Granulozyten. Bei Personen mit einem TMPT-Mangel kommt es zu sehr hohen zytotoxischen Thioguanin-NukleotidKonzentrationen. Eine genotypische Untersuchung kann das Allel-Muster eines Patienten bestimmen. Derzeit werden bei 95 % der Personen mit reduzierter TPMT-Aktivität 3 Allele—TPMT*2, TPMT*3A und TPMT*3C—dafür verantwortlich gemacht. Etwa 0,3 % (1:300) aller Patienten haben zwei nicht funktionsfähige Allele (homozygot defizient) des TPMT-Gens und weisen keine oder nur eine gering erkennbare Enzymaktivität auf. Etwa 10 % aller Patienten haben ein nicht funktionsfähiges TPMTAllel (heterozygot) und weisen eine geringe oder intermediäre TPMT-Aktivität auf, während 90 % aller Personen über eine normale TPMT-Aktivität mit zwei funktionierenden Allelen verfügen. Bei einer Gruppe von etwa 2 % kann es auch zu einer sehr hohen TPMT-Aktivität kommen. Eine phänotypische Untersuchung bestimmt die Werte der Thiopurin-Nukleotide oder der TPMT-Aktivität roter Blutkörperchen und kann auch sonst weitere Informationen liefern (siehe Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung). Bei eingeschränkter Leberfunktion ist der Metabolismus von Azathioprin verändert. Die Umwandlung in die aktiven Metaboliten ist eingeschränkt. Vor allem aber ist der Abbau zu eliminierbaren Stoffwechselprodukten vermindert (siehe Abschnitte 4.2 und 4.4). 15 Exkretion: Nach oraler Verabreichung von 100 mg 35S- Azathioprin wurden innerhalb von 24 Stunden 50 % der Radioaktivität mit dem Urin und 12 % mit den Fäzes ausgeschieden. Der Hauptbestandteil im Urin war der inaktive oxidierte Metabolit Thioharnsäure. Im Urin wurden weniger als 2 % in Form von Azathioprin oder 6-MP ausgeschieden. Bei gesunden Probanden unterliegt Azathioprin mit einer Gesamt-Clearance größer 3 l/min einer hohen Eliminierungsrate. Es liegen keine Daten zur renalen Eliminierung oder der Halbwertszeit von Azathioprin vor. Die renale Elimination von 6-MP und die Halbwertszeit von 6-MP liegen bei 191 ml/min/m2 bzw. 0,9 Stunden. 6-Mercaptopurin (Metabolit von Azathioprin) wird in Konzentrationen von 3,4 ng/ml bis 18 ng/ml mit der Muttermilch ausgeschieden. Besondere Patientengruppen Ältere Patienten Es wurden keine speziellen Studien bei älteren Personen durchgeführt (siehe Dosierung, Art und Dauer der Anwendung). Übergewichtige Kinder In einer US-amerikanischen klinischen Studie wurden 18 Kinder im Alter zwischen 3 und 14 Jahren gleichmäßig in zwei Gruppen aufgeteilt; ausschlaggebend war das Gewichts-/Größen-Verhältnis größer oder kleiner der 75. Perzentile. Jedes Kind befand sich in einer Erhaltungsbehandlung mit 6-MP, wobei die Körperoberfläche Grundlage der Dosisberechnung war. Die mittlere AUC (0-∞) von 6-MP in der Gruppe größer der 75. Perzentile war 2,4-mal kleiner als die der Gruppe kleiner der 75. Perzentile. Daher benötigen übergewichtige Kinder unter Umständen Azathioprin- Dosen im oberen Bereich des Dosisspektrums und eine engmaschige Überwachung des Ansprechens auf die Behandlung (siehe Dosierung, Art und Dauer der Anwendung). Nierenfunktionsstörung Studien mit Azathioprin zeigten bei urämischen Patienten keinen Unterschied in der Pharmakokinetik von 6-MP im Vergleich zu Patienten mit einer transplantierten Niere. Da nur wenig über die aktiven Metaboliten von Azathioprin bei renaler Funktionsstörung bekannt ist, sollte eine Dosisreduzierung bei Patienten mit eingeschränkter Nierenfunktion in Erwägung gezogen werden (siehe Dosierung, Art und Dauer der Anwendung). Azathioprin und/oder seine Metaboliten werden durch Hämodialyse entfernt, wobei etwa 45 % der radioaktiven Metaboliten während einer 8-stündigen Dialyse entfernt werden. Leberfunktionsstörung Eine Azathioprin-Studie wurde mit Patienten durchgeführt, welche alle eine transplantierten Niere hatten, und in drei Gruppen eingeteilt waren: Patienten ohne Lebererkrankung, Patienten mit Leberfunktionsstörung (aber ohne Zirrhose) und Patienten mit Leberfunktionsstörung und Zirrhose. Die Studie zeigte, dass der 6-Mercaptopurin-Spiegel im Vergleich zu Patienten ohne Lebererkrankung bei Patienten mit Leberfunktionsstörung (aber ohne Zirrhose) 1,6-mal höher und bei Patienten mit Leberfunktionsstörung und Zirrhose 6-mal höher war. Daher sollte eine Dosisreduzierung bei Patienten mit eingeschränkter Leberfunktion in Erwägung gezogen werden (siehe Abschnitt 4.2 Dosierung, Art und Dauer der Anwendung). 5.3 Präklinische Daten zur Sicherheit In Embryotoxizitätsstudien zeigte Azathioprin in verschiedenen Tierspezies teratogene oder embryoletale Wirkungen. Bei Kaninchen führten Dosen von 5 mg/kg bis 15 mg/kg 16 Körpergewicht/Tag zu Missbildungen des Skeletts. Bei Ratten und Mäusen kam es nach Gabe von 1 mg/kg bis 2 mg/kg Körpergewicht/Tag zum Absterben der Embryonen. In einer Reihe von In-vitro- und In-vivo-Tests erwies sich Azathioprin als mutagen. In Langzeitstudien zur Kanzerogenität von Azathioprin an Mäusen und Ratten, in denen Azathioprin bis zum Zweifachen der entsprechenden humantherapeutischen Dosierung verabreicht wurde, traten vermehrt Lymphosarkome (Maus) und Plattenepitheltumoren (Ratte) auf. 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile Imurek 25 mg Filmtabletten Lactose-Monohydrat, Maisstärke, vorverkleisterte Stärke, Magnesiumstearat, Stearinsäure, Hypromellose, Macrogol 400, Titandioxid (E 171), Eisen(III)-oxid (E 172), Eisen(III)-hydroxid-oxid (E 172) Imurek 50 mg Filmtabletten Lactose-Monohydrat, Maisstärke, vorverkleisterte Stärke, Magnesiumstearat, Stearinsäure, Hypromellose, Macrogol 400 Imurek i.v. Natriumhydroxid Der Natriumionengehalt der Injektionszubereitung beträgt ungefähr 4,5 mg (0,2 mVal). 6.2 Inkompatibilitäten Imurek 25 mg/50 mg Filmtabletten Nicht zutreffend. Imurek i.v. Das Arzneimittel darf, außer mit den unter 6.6 aufgeführten Arzneimitteln, nicht mit anderen Arzneimitteln gemischt werden. 6.3 Dauer der Haltbarkeit Imurek 25 mg/50 mg Filmtabletten 5 Jahre Imurek i.v. 3 Jahre Die aus der Auflösung des Inhaltes einer Durchstechflasche Imurek i.v. in 5 ml bis 15 ml Wasser für Injektionszwecke erhaltene Lösung ist bei 5°C bis 25°C bis zu 5 Tage stabil. Infusionslösungen, die aus 5 ml der konzentrierten Imurek-Lösung und 20 ml bis 200 ml der angegebenen Verdünnungsmittel hergestellt werden, sind bei Raumtemperatur (15°C bis 25°C) über 24 Stunden stabil. 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht über 25ºC lagern. Das Behältnis im Umkarton aufbewahren, um den Inhalt vor Licht und Feuchtigkeit zu schützen. 17 6.5 Art und Inhalt der Behältnisse Imurek 25 mg Filmtabletten Imurek 25 mg Filmtabletten sind in opaken PVC/Aluminium-Durchdrückpackungen zu 100 Filmtabletten (N3) oder 50 Filmtabletten (N2) erhältlich. Imurek 50 mg Filmtabletten Imurek 50 mg Filmtabletten sind in opaken PVC/Aluminium-Durchdrückpackungen zu 100 Filmtabletten (N3) oder 50 Filmtabletten (N2) erhältlich. Imurek i.v. Imurek i.v. ist als weißes, gefriergetrocknetes Pulver erhältlich. 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung Azathioprin ist mutagen und potenziell karzinogen. Beim Umgang mit dieser Substanz sind entsprechende Vorsichtsmaßnahmen zu ergreifen. Bei der Handhabung von Imurek Filmtabletten oder Imurek i.v. sollte das verantwortliche medizinische Fachpersonal die Richtlinien zum Umgang mit zytotoxischen Substanzen im Einklang mit aktuellen lokalen Empfehlungen oder Vorschriften beachten. Imurek 25 mg/50 mg Filmtabletten Die Filmtabletten dürfen nicht geteilt werden. Solange der Filmüberzug unbeschädigt ist, besteht kein Risiko bei der Handhabung der Filmtabletten sowie keine Erfordernis zusätzlicher Vorsichtsmaßnahmen. Imurek-Tabletten sind entsprechend den nationalen Anforderungen zu entsorgen. Imurek i.v. Vor Anwendung sollte Imurek i.v. entweder durch einen Apotheker oder unter dessen Aufsicht zubereitet werden, oder durch eine speziell geschulte Person, die mit dessen Eigenschaften vertraut ist und Erfahrung in der sicheren Handhabung vergleichbarer Präparate hat. Vor Anwendung sollte Imurek i.v. unter aseptischen Bedingungen in einer Apotheke zubereitet werden, die über eine geeignete Sicherheitswerkbank verfügt, welche sowohl ausreichenden Schutz für die zubereitende Person als auch das Produkt selbst bietet und vorzugsweise nur zur Herstellung zytotoxischer Präparate verwendet wird. Steht eine solche Einrichtung nicht zur Verfügung, kann auch ein speziell dafür vorgesehener Nebenraum einer Station oder Klinik verwendet werden. Das für die Zubereitung von Imurek i.v. zuständige Personal sollte folgende Schutzkleidung tragen: - Geeignete Einweg-PVC-Handschuhe (Gummihandschuhe sind nicht ausreichend) - Geeignete chirurgische Gesichtsmaske - Schutzbrille oder -gläser, welche nach Gebrauch gründlich mit Wasser gespült werden sollten - Einweg-Schürzen. In einer aseptischen Arbeitsumgebung wird andere geeignete Kleidung erforderlich sein. Verschüttetes sollte sofort durch Aufwischen mit feuchten Einweg-Papiertüchern entfernt werden, die dann im Beutel für Gefahrgut entsorgt werden müssen. Kontaminierte Oberflächen sollten mit reichlich Wasser gewaschen werden. 18 Bei Kontakt von Imurek i.v. mit der Haut sollte die Hautpartie gründlich mit Seife und reichlich kaltem Wasser gewaschen werden. Bei Kontakt mit den Augen sind diese sofort mit einer Natriumchlorid-Augenwaschlösung auszuspülen und unmittelbar danach muss ein Arzt aufgesucht werden. Falls keine NatriumchloridLösung zur Verfügung steht, kann auch eine große Menge sauberen Leitungswassers verwendet werden. Herstellung der Imurek-Lösungen: Der Inhalt einer Durchstechflasche wird durch Zugabe von 5 ml bis 15 ml Wasser für Injektionszwecke aufgelöst. Die resultierende Lösung ist alkalisch (pH 10 bis 12). Sollten bei der Auflösung oder der darauf folgenden Verdünnung Trübungen oder Auskristallisationen auftreten, darf die Lösung nicht verwendet werden. Für die weitere Verdünnung der konzentrierten Imurek-Lösung können folgende Infusionslösungen eingesetzt werden: Natriumchlorid (0,45%ig oder 0,9%ig) Natriumchlorid (0,18%ig) zusammen mit Glucose (4%ig) Andere Infusionslösungen werden nicht empfohlen. Die Imurek-Infusionslösung ist unmittelbar vor Gebrauch herzustellen und jeglicher Rest zu verwerfen. Infusionslösungen, die aus 5 ml der konzentrierten Imurek-Lösung und 20 ml bis 200 ml der angegebenen Verdünnungsmittel hergestellt werden, haben einen pH-Wert von ca. 8,0 bis 9,5. Zur Anwendung der Imurek-Lösungen siehe Abschnitt 4.2. Entsorgung Imurek i.v.-Lösung ist entsprechend den nationalen Anforderungen zu entsorgen (z. B. tief vergraben oder Hochtemperaturverbrennung). Die Entsorgung scharfer Gegenstände wie Nadeln, Spritzen, Verabreichungssets und Ampullen sollte in stabilen Behältern erfolgen, die mit einem geeigneten Gefahrenhinweis versiegelt sind. Das für die Entsorgung zuständige Personal sollte über die einzuhaltenden Vorsichtsmaßnahmen informiert sein und das Material sollte entsprechend den nationalen Anforderungen entsorgt werden, unter anderem durch Verbrennung. 7. INHABER DER ZULASSUNG Aspen Pharma Trading Limited, 3016 Lake Drive, Citywest Business Campus, Dublin 24, Irland 8. ZULASSUNGSNUMMERN Imurek 25 mg Filmtabletten Zul.-Nr.: 6101735.01.00 Imurek 50 mg Filmtabletten Zul.-Nr.: 6101735.00.00 19 Imurek i.v. Zul.-Nr.: 6101758.00.00 9. DATUM DER ERTEILUNG DER ZULASSUNGEN / VERLÄNGERUNG DER ZULASSUNGEN 30. November 2004 10. STAND DER INFORMATION Dezember 2013 11. VERKAUFSABGRENZUNG Verschreibungspflichtig. [Aspen-Logo] 20 Fachinformation 1. BEZEICHNUNG DES ARZNEIMITTELS Endoxan 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Endoxan 100 mg 1 Durchstechflasche enthält: 106,9 mg Cyclophosphamid 1 H2O (entspricht 100 mg wasserfreiem Cyclophosphamid) Endoxan 200 mg 1 Durchstechflasche enthält: 213,8 mg Cyclophosphamid 1 H2O (entspricht 200 mg wasserfreiem Cyclophosphamid) Endoxan 500 mg 1 Durchstechflasche enthält: 534,5 mg Cyclophosphamid 1 H2O (entspricht 500 mg wasserfreiem Cyclophosphamid) Endoxan 1 g 1 Durchstechflasche enthält: 1069,0 mg Cyclophosphamid 1 H2O (entspricht 1000,0 mg wasserfreiem Cyclophosphamid) Endoxan 1 überzogene Tablette enthält: 53,5 mg Cyclophosphamid-Monohydrat (entspricht 50 mg wasserfreiem Cyclophosphamid) Sonstiger Bestandteil: Lactose-Monohydrat. Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1. 3. DARREICHUNGSFORM Endoxan 100 mg / 200 mg / 500 mg / 1 g in Durchstechflaschen: weißes Pulver zur Herstellung einer Injektionslösung. Endoxan: weiße, runde, bikonvexe, überzogene Tabletten zum Einnehmen. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Endoxan ist ein Zytostatikum und in Kombination mit weiteren antineoplastisch wirksamen Arzneimitteln bei der Chemotherapie folgender Tumoren angezeigt: Endoxan Pulver zur Herstellung einer Injektionslösung: - Remissionsinduktion und Konsolidierungstherapie bei akuter lymphatischer Leukämie - Remissionsinduktion bei Morbus Hodgkin - Non-Hodgkin-Lymphome (in Abhängigkeit vom histologischen Typ und vom Krankheitsstadium auch als Monotherapie) - Chronisch lymphatische Leukämie (CLL) nach Versagen der Standardtherapie FI Endoxan 09.2013 1 (Chlorambucil/Prednison) - Remissionsinduktion bei Plasmozytom (auch in Kombination mit Prednison) - Adjuvante Therapie des Mammakarzinoms nach Resektion des Tumors beziehungsweise Mastektomie - Palliative Therapie des fortgeschrittenen Mammakarzinoms - Fortgeschrittenes Ovarialkarzinom - Kleinzelliges Bronchialkarzinom - Ewing-Sarkom - Neuroblastom - Rhabdomyosarkom bei Kindern - Osteosarkom Konditionierung vor allogener Knochenmarkstransplantation bei: - schwerer aplastischer Anämie als Monotherapie oder in Kombination mit Anti­ Thrombozyten-Globulin - akuter myeloischer und akuter lymphoblastischer Leukämie in Kombination mit Ganzkörperbestrahlung oder Busulfan - chronischer myeloischer Leukämie in Kombination mit Ganzkörperbestrahlung oder Busulfan Hinweise zur Konditionierung vor allogener Knochenmarkstransplantation: Die Indikationsstellung zur Knochenmarkstransplantation und damit zur vorausgehenden Konditionierungstherapie mit Endoxan ist von einer komplexen Faktorenkonstellation abhängig und individuell zu treffen. Als wesentliche Faktoren können hier Krankheitsstadium, Prognose (Risikogruppe), Art sowie Erfolg vorausgegangener Behandlungen der Grunderkrankung, Patientenalter bzw. -allgemeinzustand sowie Verfügbarkeit eines geeigneten Knochenmarkspenders genannt werden. - Bedrohlich verlaufende „Autoimmunkrankheiten“: schwere, progrediente Formen von Lupus Nephritis und Wegener-Granulomatose. Eine Behandlung von Lupus Nephritis und Wegener-Granulomatose mit Endoxan sollte nur durch Ärzte erfolgen, die über spezielle Erfahrungen zu den Krankheitsbildern und zu Endoxan verfügen. Endoxan überzogene Tabletten: - Adjuvante Therapie des Mammakarzinoms nach Resektion des Tumors beziehungsweise Mastektomie. - Palliative Therapie des metastasierten Mammakarzinoms. - Bedrohlich verlaufende „Autoimmunkrankheiten“: schwere, progrediente Formen von Lupus Nephritis und Wegener-Granulomatose. Eine Behandlung von Lupus Nephritis und Wegener-Granulomatose mit Endoxan sollte nur durch Ärzte erfolgen, die über spezielle Erfahrungen zu den Krankheitsbildern und zu Endoxan verfügen. Besonderer Hinweis: Tritt unter der Behandlung mit Endoxan eine Zystitis mit Mikro- oder Makrohämaturie auf, sollte die Therapie bis zur Normalisierung abgebrochen werden. 4.2 Dosierung und Art der Anwendung Dosierung Die Dosierung ist stets individuell anzupassen. Für Kinder und Erwachsene gelten folgende Dosierungsempfehlungen: Endoxan Pulver zur Herstellung einer Injektionslösung FI Endoxan 09.2013 2 Remissionsinduktion und Konsolidierungstherapie bei akuter lymphatischer Leukämie (ALL): Cyclophosphamid wird im Kindes- und Erwachsenenalter abhängig von der Zugehörigkeit zu verschiedenen Risikogruppen im Rahmen unterschiedlicher komplexer Polychemotherapien angewendet. Eine typische Dosierung für die Remissionsinduktion und Konsolidierungs-Therapie im Erwachsenenalter beträgt 650 mg/m2 Körperoberfläche (KOF) Cyclophosphamid i.v. unter anderem in Kombination mit Cytarabin und Mercaptopurin (Protokoll der deutschen multizentrischen Studie zur Therapie der ALL im Erwachsenenalter 1978 - 1983). Speziellere Dosierungsanleitungen sowie weitere Einzelheiten sind der speziellen Fachliteratur zu entnehmen. Chronische lymphatische Leukämie: 600 mg/m2 KOF Cyclophosphamid i.v. an Tag 6 in Kombination mit Vincristin und Prednison oder 400 mg/m2 KOF Cyclophosphamid i.v. an den Tagen 1 bis 5 ebenfalls in Kombination mit Vincristin und Prednison, Wiederholung alle 3 Wochen. Morbus Hodgkin: 650 mg/m2 KOF Cyclophosphamid i.v. an Tag 1 und 8 in Kombination mit Vincristin, Procarbazin und Prednison („COPP-Protokoll“). Non-Hodgkin-Lymphome: Cyclophosphamid kann bei Non-Hodgkin-Lymphomen (NHL) in Abhängigkeit vom histologischen Typ und vom Krankheitsstadium als Monotherapie oder in Kombination mit weiteren antineoplastisch wirksamen Arzneimitteln angewendet werden. Im Folgenden wird jeweils eine Standardtherapie für NHL von niedrigem sowie intermediärem/hohen Malignitätsgrad angegeben: NHL von niedrigem Malignitätsgrad: 600 - 900 mg/m2 KOF Cyclophosphamid i.v. am Tag 1 als Monotherapie beziehungsweise in Kombination mit einem Kortikosteroid; Wiederholung: alle 3 bis 4 Wochen. NHL von intermediärem oder hohem Malignitätsgrad: 750 mg/m2 KOF Cyclophosphamid i.v. an Tag 1 in Kombination mit Doxorubicin, Vincristin und Prednison („CHOP-Protokoll“); Wiederholung: alle 3 bis 4 Wochen. Plasmozytom: 1000 mg/m2 KOF Cyclophosphamid i.v. an Tag 1 in Kombination mit Prednison; Wiederholung: alle 3 Wochen. Als Beispiel einer Polychemotherapie, die sich beim Plasmozytom als wirksam erwiesen hat, wird im Folgenden das sogenannte „VBMCP-Protokoll“ angegeben: 400 mg/m2 KOF Cyclophosphamid i.v. an Tag 1 in Kombination mit Melphalan, Carmustin, Vincristin, und Prednison; Wiederholung: alle 5 Wochen. Mammakarzinom: Cyclophosphamid wird in der adjuvanten und palliativen Therapie des Mammakarzinoms in Kombination mit anderen Zytostatika verwendet. Im Folgenden werden beispielhaft zwei Therapieprotokolle genannt, die sich als wirksam erwiesen haben: „CMF-Protokoll“: 600 mg/m2 KOF Cyclophosphamid i.v. an Tag 1 und 8 in Kombination mit Methotrextat und 5-Fluorouracil; Wiederholung: alle 3 bis 4 Wochen. „CAF-Protokoll“: 500 mg/m2 KOF. Cyclophosphamid i.v. an Tag 1 in Kombination mit Doxorubicin und 5-Fluorouracil; Wiederholung: alle 3 bis 4 Wochen. Fortgeschrittenes Ovarialkarzinom: FI Endoxan 09.2013 3 750 mg/m2 KOF Cyclophosphamid i.v. an Tag 1 in Kombination mit Cisplatin; Wiederholung: alle 3 Wochen. 500 - 600 mg/m2 KOF Cyclophosphamid i.v. an Tag 1 in Kombination mit Carboplatin; Wiederholung: alle 4 Wochen. Kleinzelliges Bronchialkarzinom: Cyclophosphamid wird in Kombination mit weiteren antineoplastisch wirksamen Medikamenten angewendet. Als Beispiel für eine wirksame Polychemotherapie wird im Folgenden das sogenannte „CAV-Protokoll“ angegeben: 1000 mg/m2 KOF Cyclophosphamid i.v. an Tag 1 in Kombination mit Doxorubicin und Vincristin; Wiederholung: alle 3 Wochen. Ewing-Sarkom: Beispielhaft für eine Polychemotherapie, die sich beim Ewing-Sarkom als wirksam erwiesen hat, wird im Folgenden das „VACA-Protokoll“ der Intergroup Study genannt: 500 mg/m2 KOF Cyclophosphamid i.v. einmal wöchentlich in Kombination mit Vincristin, Doxorubicin und Actinomycin D. Weitere Einzelheiten sind der speziellen Fachliteratur zu entnehmen. Osteosarkom: Cyclophosphamid wird im Rahmen komplexer Polychemotherapien zur neoadjuvanten (präoperativen) und adjuvanten (postoperativen) Therapie angewendet. Im Folgenden wird beispielhaft das Protokoll der Multi-Institutional Osteosarcoma Study (MIOS) für die adjuvante Therapie angegeben:600 mg/m2 KOF Cyclophosphamid i.v. täglich an 2 Tagen in der 2., 13., 26., 39. und 42 Therapiewoche in Kombination mit Bleomycin, Actinomycin D, Doxorubicin, Cisplatin und Methotrexat. Weitere Einzelheiten sind der speziellen Fachliteratur zu entnehmen. Neuroblastom: Abhängig vom Krankheitsstadium und vom Alter wird Cyclophosphamid im Rahmen unter­ schiedlicher Chemotherapieprotokolle angewendet. Als Beispiel für eine Kombinationstherapie des fortgeschrittenen Neuroblastoms wird im Folgenden das „OPEC-Protokoll“ angegeben: 600 mg/m2 KOF Cyclophosphamid i.v. an Tag 1 in Kombination mit Vincristin, Cisplatin und Teniposid; Wiederholung: alle 3 Wochen. Weitere Einzelheiten sind der speziellen Fachliteratur zu entnehmen. Rhabdomyosarkom im Kindesalter: Cyclophosphamid wird abhängig vom Krankheitsstadium und vom histologischen Typ in unter­ schiedlichen komplexen Polychemotherapieprotokollen angewendet. Eine typische Dosierung für Patienten im Stadium III (postoperativ makroskopischer Resttumor) und IV (Fernmetastasen) beträgt 10 mg/kg KG Cyclophosphamid i.v. an 3 aufeinanderfolgenden Tagen mit mehrfacher Wiederholung in Kombination mit Vincristin und Actinomycin D („VAC-Protokoll“ der Intergroup Rhabdomyosarcoma Study-II). Weitere Einzelheiten sind der speziellen Fachliteratur zu entnehmen. Konditionierung vor allogener Knochenmarktransplantation bei akuter myeloischer und akuter lymphoblastischer Leukämie: 60 mg/kg KG Cyclophosphamid i.v. täglich an 2 aufeinanderfolgenden Tagen in Kombination mit Ganzkörperbestrahlung oder Busulfan. Die geeignete Wahl des Kombinationspartners für Cyclophosphamid setzt entsprechende Spezialkenntnisse voraus, da die Behandlungsergebnisse in Abhängigkeit von der Grunderkrankung und deren Stadien je nach Kombinationspartner zum Teil erheblich variieren können. Konditionierung vor allogener Knochenmarktransplantation bei chronischer myeloischer Leukämie: 60 mg/kg KG Cyclophosphamid i.v. täglich an 2 aufeinanderfolgenden Tagen in Kombination mit Ganzkörperbestrahlung oder Busulfan. FI Endoxan 09.2013 4 Bei chronischer myeloischer Leukämie führen beide möglichen Kombinationspartner von Cyclophosphamid zu vergleichbaren therapeutischen Ergebnissen. Konditionierung vor allogener Knochenmarktransplantation bei schwerer aplastischer Anämie: Folgende Dosierungsanleitungen gelten für die Konditionierung ohne Ganzkörper-Bestrahlung, auf die üblicherweise bei schwerer aplastischer Anämie verzichtet wird: 50 mg/kg KG Cyclophosphamid i.v. täglich an 4 aufeinanderfolgenden Tagen als Monotherapie oder in Kombination mit Anti-Thymozyten-Globulin. Beim Vorliegen einer Fanconi-Anämie sollte die Tagesdosis von 50 auf 35mg/kg KG Cyclophosphamid i.v. täglich an 4 aufeinanderfolgenden Tagen reduziert werden. Schwere, progrediente Formen von Lupus Nephritis und Wegener-Granulomatose Dosierung bei i.v.-Anwendung Initial 500 - 1000 mg/m² KOF i.v. Endoxan überzogene Tabletten Adjuvante Therapie des Mammakarzinoms, palliative Therapie des metastasierten Mammakarzinoms: „Klassiches“ CMF-Protokoll: 100 mg/m2 KOF Cyclophosphamid p.o. an den Tagen 1 bis 14 eines Therapiezyklus in Kombination mit Methotrexat und 5-Fluorouracil: Wiederholung des Therapiezyklus: alle 4 Wochen. Schwere, progrediente Formen von Lupus Nephritis und Wegener-Granulomatose Bei täglicher Anwendung 1-2 mg/kg KG (2 mg/kg bei Wegener-Granulomatose) Für die orale Stoßtherapie gilt die gleiche Dosisempfehlung wie für die entsprechende i.v. Anwendung (initial 500-1000 mg/m2 KOF) Hinweis: Hochdosierte orale Stoßtherapie ist bei zuverlässigen Patienten prinzipiell außerhalb der Klinik anwendbar. Eine Einnahme hoher Dosen zu Hause sollte jedoch nur in Anwesenheit (auch längere Zeit nach der Einnahme) einer kompetenten Person und an Tagen erfolgen, an denen der behandelnde Arzt oder ein informierter Vertreter im Bedarfsfall jederzeit erreichbar ist. Patienten mit Leberfunktionsstörungen Schwere Leberfunktionsstörungen können mit einer verringerten Aktivierung von Cyclophosphamid verbunden sein. Dies kann die Wirksamkeit der Endoxan-Therapie beeinflussen und muss bei der Dosierung und der Interpretation der Reaktion auf die gewählte Dosis berücksichtigt werden. Bei einer eingeschränkten Leberfunktion wird üblicherweise eine Dosisreduktion um 25 % bei einem Serumbilirubinwert von 3,1 bis 5 mg/100 ml empfohlen. Patienten mit Nierenfunktionsstörungen Bei Patienten mit Nierenfunktionsstörungen, vor allem in schwerer Ausprägung, kann eine verringerte renale Ausscheidung zu einer erhöhten Konzentration von Cyclophosphamid und seinen Metaboliten im Plasma führen. Dies kann eine erhöhte Toxizität zur Folge haben und muss bei diesen Patienten bei der Bestimmung der Dosis berücksichtigt werden. Bei einer eingeschränkten Nierenfunktion wird üblicherweise eine Dosisreduktion um 50 % bei einer glomulären Filtrationsrate von unter 10 ml pro Minute empfohlen. Cyclophosphamid und seine Metabolite sind dialysierbar, wobei es je nach verwendetem Dialyseverfahren zu Unterschieden in der Clearance kommen kann. Bei dialysepflichtigen Patienten sollte zwischen der Gabe von Endoxan und der Dialyse möglichst ein gleichbleibender Zeitraum liegen (siehe Abschnitt 4.4). Empfehlungen zur Dosisreduktion bei Myelosuppression FI Endoxan 09.2013 5 Leukozytenzahl [l] 4000 Thrombozytenzahl [l] 100 000 100 % der vorgesehenen Dosis 4000 – 2500 100 000 bis 50 000 50 % der vorgesehenen Dosis 2500 50 000 Verschiebung bis zur Normalisierung oder individuelle Entscheidung Ältere Menschen Da es bei älteren Patienten häufiger vorkommt, dass die Funktion von Leber, Niere, Herz oder anderen Organen beeinträchtigt ist und Begleiterkrankungen vorliegen oder andere medikamentöse Therapien durchgeführt werden, sollte Endoxan bei dieser Population mit besonderer Vorsicht angewendet werden. Eine verstärkte Überwachung auf toxische Wirkungen ist daher erforderlich, gegebenenfalls muss die Dosierung angepasst werden. Art der Anwendung Die Anwendung von Endoxan sollte nur durch oder unter Aufsicht von onkologisch / rheumatologisch erfahrenen Ärzten erfolgen. Die Dosierung und die Therapiedauer bzw. Intervallabstände richten sich nach der jeweiligen Indikation und dem angewandten Kombinationstherapieregime, und hängen ab vom allgemeinen Gesundheitszustand und den Organfunktionen des Patienten sowie von den Laborparametern (vor allem der Bestimmung der Blutzellen). Bei Kombination mit anderen Zytostatika ähnlicher Toxizität kann eine Dosisreduktion oder eine Verlängerung der therapiefreien Intervalle erforderlich sein. Die Anwendung von Hämatopoese-stimulierenden Wirkstoffen (Kolonie-stimulierende Faktoren und Erythropoese-stimulierende Wirkstoffe) kann in Betracht gezogen werden, um das Risiko von myelosuppressiven Komplikationen zu reduzieren und/oder die Gabe der zu verabreichenden Dosen zu erleichtern. Vor dem Therapiebeginn müssen etwaige Abflussbehinderungen innerhalb der ableitenden Harnwege, Harnblasenentzündungen sowie Infektionen und Elektrolytstörungen ausgeschlossen bzw. behoben werden (siehe Abschnitt 4.4). Während oder unmittelbar nach der Anwendung von Endoxan ist für die Aufnahme oder Infusion ausreichender Flüssigkeitsmengen zu sorgen, um eine Diurese zu induzieren und so das Risiko einer Harnwegstoxizität zu reduzieren. Daher sollte das Arzneimittel morgens angewendet werden (siehe Abschnitt 4.4). Auf den Genuss von Grapefruits oder Grapefruitsaft sollte während der Behandlung verzichtet werden, da die Wirksamkeit von Cyclophosphamid dadurch vermindert sein kann. Während der Behandlung mit Endoxan müssen Blutbild und Harnsediment regelmäßig kontrolliert und überwacht werden (siehe Abschnitt 4.4). Auf die rechtzeitige Gabe von Antiemetika sowie eine sorgfältige Mundpflege ist zu achten. Endoxan Pulver zur Herstellung einer Injektionslösung Endoxan wird intravenös angewendet. Die Applikation kann als Bolusinjektion oder Kurzinfusion erfolgen. Die intravenöse Anwendung der Lösung sollte bevorzugt als Infusion durchgeführt werden. FI Endoxan 09.2013 6 Um das Risiko von Nebenwirkungen zu verringern, die offenbar mit der Verabreichungsrate zusammenhängen (z. B. Gesichtsschwellung, Kopfschmerzen, Schwellung der Nasenschleimhäute, Brennen der Kopfhaut), ist Endoxan sehr langsam zu injizieren oder infundieren. Die Dauer der Infusion ist auch an das Volumen und die Art der zu infundierenden Trägerlösung anzupassen. Sie kann zwischen 30 Minuten und 2 Stunden betragen. Für eine direkte Bolusinjektion im Rahmen der parenteralen Anwendung ist Endoxan mit physiologischer Kochsalzlösung (0,9 % Natriumchlorid) zu rekonstituieren. In Wasser rekonstituiertes Endoxan ist hypoton und darf nicht direkt injiziert werden. Für die Anwendung als Infusion Endoxan durch Zugabe von sterilem Wasser oder physiologischer Kochsalzlösung rekonstituieren und einer empfohlenen Infusionslösung hinzufügen. Das Arzneimittel vor Gebrauch auf sichtbare Partikel und Verfärbungen überprüfen, sofern dies die Lösung und das Behältnis erlauben. Vor der intravenösen Anwendung muss die Substanz vollständig aufgelöst sein. Hinweise zur Herstellung und Handhabung der Lösung Zur Herstellung einer 2%igen isotonen Lösung wird der Trockensubstanz die entsprechende Menge physiologische Kochsalzlösung zugesetzt (dabei werden zu Endoxan 100 mg 5 ml, Endoxan 200 mg 10 ml, Endoxan 500 mg 25 ml und Endoxan 1 g 50 ml physiologische Kochsalzlösung zugesetzt). Die Substanz löst sich leicht, wenn die Durchstechflasche nach Einspritzen des Lösungsmittels kräftig geschüttelt wird. Gegebenenfalls ist es zweckmäßig, die Lösung einige Minuten stehen zu lassen. Zur intravenösen Kurzinfusion wird die Endoxan-Lösung z.B. mit Ringer-Lösung, Kochsalz- oder Glucose- Lösung auf 500 ml aufgefüllt. Endoxan Tabletten Endoxan Tabletten sind zur oralen Einnahme bestimmt. Es empfiehlt sich, die Tabletten morgens einzunehmen und vor, während bzw. unmittelbar nach der Gabe ausreichende Mengen Flüssigkeit zu sich zu nehmen und auf eine regelmäßige Blasenentleerung zu achten. 4.3 Gegenanzeigen Endoxan soll nicht angewendet werden bei: - bekannter Überempfindlichkeit gegen Cyclophosphamid, seinen Metaboliten oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile. - schwerer Beeinträchtigung der Knochenmarkfunktion (Myelosuppression, insbesondere bei zytostatisch und/oder strahlentherapeutisch vorbehandelten Patienten) - Blasenentzündung (Zystitis) - Harnabflussbehinderungen - floriden Infektionen Zur Anwendung in Schwangerschaft und Stillzeit siehe Abschnitt 4.6. Allgemeine Gegenanzeigen für die Durchführung einer allogenen Knochenmarktransplantation, wie eine obere Altersgrenze von 50-60 Jahren, Kontamination des Knochenmarks durch Metastasen maligner (epithelialer) Tumoren sowie fehlende Identität des HLA-Systems beim vorgesehenen Spender bei chronischer myeloischer Leukämie müssen vor Einleitung einer Konditionierungstherapie mit Endoxan sorgfältig abgeklärt werden. 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung FI Endoxan 09.2013 7 Die hier und in anderen Abschnitten beschriebenen Risikofaktoren für Cyclophosphamid-Toxizitäten und deren Spätfolgen können Gegenanzeigen darstellen, es sei denn, Endoxan wird für die Behandlung einer lebensbedrohlichen Erkrankung angewendet. In solchen Situationen ist eine fallspezifische Abwägung des Risikos gegenüber dem zu erwartenden Nutzen erforderlich. Endoxan sollte wie alle Zytostatika generell mit Vorsicht bei geschwächten und älteren Patienten sowie bei Patienten, die zuvor eine Strahlentherapie erhielten, angewendet werden. Patienten mit geschwächtem Immunsystem, mit Diabetes mellitus, mit chronischen Leber- oder Nierenerkrankungen und mit vorbestehender kardialer Erkrankung müssen ebenfalls engmaschig überwacht werden. Bei Diabetikern ist zudem der Zuckerstoffwechsel während der Cyclophosphamidtherapie engmaschig zu überwachen. Wegen der porphyrogenen Wirkung von Cyclophosphamid ist bei der Behandlung von Patienten mit akuter Porphyrie Vorsicht geboten. WARNHINWEISE Myelosuppression, Immunsuppression, Infektionen Eine Therapie mit Endoxan kann zu einer Myelosuppression und einer signifikanten Unterdrückung der Immunreaktion führen. Eine Cyclophosphamid-induzierte Myelosuppression kann Leukopenie, Neutropenie, Thrombozytopenie (in Verbindung mit einem erhöhten Blutungsrisiko) und Anämie zur Folge haben. Eine schwere Immunsuppression hat zu schwerwiegenden Infektionen mit manchmal tödlichem Ausgang geführt. Auch über Sepsis und septischen Schock wurde berichtet. Zu den Infektionen, über die im Zusammenhang mit Cyclophosphamid berichtet wurden, zählen Pneumonien sowie andere bakterielle, fungale, virale, protozoale und parasitäre Infektionen. Latente Infektionen können erneut ausbrechen. Eine Reaktivierung wurde bei verschiedenen bakteriellen, fungalen, viralen, protozoalen und parasitären Infektionen beobachtet. Infektionen müssen adäquat behandelt werden. Eine antimikrobielle Prophylaxe kann in bestimmten Fällen einer Neutropenie nach Ermessen des behandelnden Arztes angezeigt sein. Bei neutropenischem Fieber sind Antibiotika und/oder Antimykotika zu verabreichen. Grundsätzlich kann sich bei einer Erhöhung der Cyclophosphamid-Dosis die Anzahl der peripheren Blutzellen und der Thrombozyten rascher verringern, und die Zeit bis zur Erholung kann sich verlängern. Die Nadir-Werte für die Reduzierung der Leukozyten- und Thrombozytenzahl werden für gewöhnlich innerhalb der ersten und zweiten Behandlungswoche erreicht. Das Knochenmark erholt sich relativ rasch, und die Konzentration an peripheren Blutzellen normalisiert sich für gewöhnlich nach etwa 20 Tagen. Mit einer schweren Myelosuppression ist vor allem bei Patienten zu rechnen, die mit einer begleitenden Chemo- und/oder Strahlentherapie vorbehandelt wurden bzw. behandelt werden. Bei allen Patienten ist während der Behandlung eine engmaschige Überwachung der Blutwerte erforderlich. - Die Leukozytenzahl muss vor jeder Gabe und auch regelmäßig während der Behandlung kontrolliert werden (in Abständen von 5 bis 7 Tagen zu Beginn der Therapie und alle 2 Tage, wenn die Zahl unter 3.000 Zellen/Mikroliter (Zellen/mm3) fällt). Bei einer Dauerbehandlung genügen im Allgemeinen Kontrollen in Abständen von etwa 14 Tagen. - Thrombozytenzahl und Hämoglobinwert sind vor jeder Gabe und in angemessenen Abständen nach der Gabe zu kontrollieren. Harnwegs- und Nierentoxizität Hämorrhagische Zystitis, Pyelitis, Ureteritis und Hämaturie wurden im Zusammenhang mit der Cyclophosphamid-Therapie berichtet. Ulzeration/Nekrose der Harnblase, Fibrose/Kontrakturen und Sekundärtumore können sich bilden. FI Endoxan 09.2013 8 Eine Urotoxizität kann eine Unterbrechung der Behandlung erfordern. Eine Zystektomie aufgrund von Fibrose, Blutungen oder sekundären Malignomen kann nötig sein. Es wurde über Fälle einer Urotoxizität mit tödlichem Ausgang berichtet. Eine Urotoxizität kann sowohl bei der Kurzzeit- als auch bei der Langzeit-Therapie mit Endoxan auftreten. Über hämorrhagische Zystitis nach einer Einzeldosis Cyclophosphamid wurde berichtet. Eine frühere oder begleitende Strahlen- oder Busulfantherapie kann das Risiko einer Cyclophosphamid-induzierten hämorrhagischen Zystitis erhöhen. Die Zystitis ist im Allgemeinen zunächst abakteriell. Später kann es zu einer sekundären Keimbesiedelung kommen. Vor Beginn der Behandlung muss eine eventuelle Harnwegsobstruktion ausgeschlossen oder korrigiert werden (siehe Abschnitt 4.3). Das Harnsediment muss regelmäßig auf Erythrozyten und andere Anzeichen einer Uro­ /Nephrotoxizität kontrolliert werden. Eine angemessene Behandlung mit Mesna und/oder eine starke Hydratation zum Induzieren einer Diurese können die Häufigkeit und den Ausprägungsgrad einer Blasentoxizität deutlich herabsetzen. Dabei muss unbedingt sichergestellt werden, dass die Patienten ihre Blase regelmäßig entleeren. Eine Hämaturie klingt normalerweise innerhalb von wenigen Tagen nach Absetzen der Cyclophosphamid-Therapie ab, kann aber auch länger anhalten. Tritt unter der Behandlung eine Blasenentzündung mit Mikro-oder Makrohämaturie auf, sollte die Behandlung bis zur Normalisierung abgebrochen werden. Cyclophosphamid wurde auch mit Nephrotoxizität, einschließlich Tubulusnekrose, in Verbindung gebracht. Hyponatriämie in Verbindung mit erhöhtem Gesamtkörperwasser, akuter Wasserintoxikation und einem Krankheitsbild ähnlich dem Syndrom der inadäquaten ADH-Sekretion (SIADH) wurde mit der Gabe von Cyclophosphamid assoziiert. Es wurde über Fälle mit tödlichem Ausgang berichtet. Kardiotoxizität: Verwendung bei Patienten mit Herzerkrankungen Myokarditis und Myoperikarditis, die von einem Perikarderguss und Herztamponade begleitet sein können, wurden im Zusammenhang mit einer Cyclophosphamid-Therapie beschrieben und haben zu schwerer dekompensierter Herzinsuffizienz mit manchmal tödlichem Ausgang geführt. Histopathologische Untersuchungen haben in erster Linie eine hämorrhagische Myokarditis ergeben. Zu einem Hämoperikard kam es in Folge einer hämorrhagischen Myokarditis und einer Myokardnekrose. Über eine akute kardiale Toxizität wurde bei einer Einzeldosis von weniger als 20 mg/kg Cyclophosphamid berichtet. Nach einem Behandlungsregime mit Cyclophosphamid wurde bei Patienten mit oder ohne andere Anzeichen für eine Kardiotoxizität über supraventrikuläre Arrhythmien (einschließlich Vorhofflimmern und -flattern) sowie Ventrikelarrhythmien (einschließlich stark ausgeprägter QT-Verlängerung in Verbindung mit ventrikulären Tachyarrhythmien) berichtet. Das Risiko einer kardiotoxischen Wirkung von Cyclophosphamid kann beispielsweise erhöht sein, wenn hohe Dosen von Cyclophosphamid angewendet wurden, sowie bei Patienten in fortgeschrittenem Alter und bei Patienten mit einer vorangegangenen Strahlenbehandlung in der Herzregion und/oder einer vorangegangenen oder begleitenden Behandlung mit anderen kardiotoxischen Mitteln (siehe Abschnitt 4.5). Besondere Vorsicht ist geboten bei Patienten mit Risikofaktoren für eine Kardiotoxizität oder vorbestehende Herzerkrankung. Pulmonale Toxizität Über Pneumonitis und Lungenfibrose wurde während und nach der Behandlung mit Cyclophosphamid berichtet. Über eine pulmonale venookklusive Erkrankung und andere Formen FI Endoxan 09.2013 9 einer pulmonalen Toxizität wurde ebenfalls berichtet. Es gab Berichte über pulmonale Toxizität, die zu respiratorischer Insuffizienz führte. Die Inzidenz einer pulmonalen Toxizität in Verbindung mit Cyclophosphamid ist gering; die Prognose für die betroffenen Patienten ist jedoch schlecht. Eine spät auftretende Pneumonitis (mehr als 6 Monate nach Beginn der CyclophosphamidTherapie) scheint mit einer besonders hohen Mortalität verbunden zu sein. Eine Pneumonitis kann sich selbst Jahre nach der Behandlung mit Cyclophosphamid entwickeln. Über akute pulmonale Toxizität nach einer Einzeldosis Cyclophosphamid wurde berichtet. Sekundäre Malignome Wie bei allen Therapien mit Zytostatika besteht auch bei der Behandlung mit Cyclophosphamid das Risiko von Zweittumoren oder ihren Vorstufen als Spätfolge. Es besteht ein erhöhtes Risiko für Harnwegskarzinome oder myelodysplastische Veränderungen, teilweise bis hin zur akuten Leukämie. Zu den anderen Malignomen, die nach der Anwendung von Cyclophosphamid oder nach Behandlungsregimes mit Cyclophosphamid aufgetreten sind, zählen Lymphome, Schilddrüsenkarzinome und Sarkome. In manchen Fällen entwickelte sich das Zweitmalignom erst mehrere Jahre nach Beendigung der Cyclophosphamid-Therapie. Zu Malignomen kam es auch nach einer Exposition in utero. Das Risiko für Blasenkarzinome kann durch Prävention einer hämorrhagischen Zystitis deutlich reduziert werden. Venookklusive Lebererkrankung Über eine venookklusive Lebererkrankung (VOD) wurde bei Patienten berichtet, die mit Cyclophosphamid behandelt wurden. Eine zytoreduktive Therapie zur Vorbereitung einer Knochenmarktransplantation, bestehend aus Cyclophosphamid in Kombination mit Ganzkörperbestrahlung, Busulfan oder anderen Mitteln, hat sich als bedeutender Risikofaktor für die Entwicklung einer VOD erwiesen (siehe Abschnitt 4.5). Das klinische Syndrom entwickelt sich nach der zytoreduktiven Therapie typischerweise 1 bis 2 Wochen nach der Transplantation und ist durch plötzliche Gewichtszunahme, schmerzhafte Hepatomegalie, Aszites und Hyperbilirubinämie/Ikterus charakterisiert. Es wurde aber auch über Fälle berichtet, in denen sich eine VOD allmählich bei Patienten entwickelte, die eine niedrig dosierte Langzeit-Immunsuppression mit Cyclophosphamid erhielten. Als Komplikation einer VOD kann es zu einem hepatorenalen Syndrom und Multiorganversagen kommen. Es gibt Berichte über Cyclophosphamid-assoziierte VOD mit tödlichem Ausgang. Zu den Faktoren, die für den Patienten mit einem erhöhten Risiko für die Entwicklung einer VOD im Zusammenhang mit einer hoch dosierten zytoreduktiven Therapie einhergehen, zählen vorbestehende Leberfunktionsstörungen, vorangegangene Strahlenbehandlung im Bauchbereich, und niedrige Werte beim Performance-Score. Genotoxizität Cyclophosphamid ist genotoxisch und mutagen, sowohl bei somatischen Zellen als auch bei männlichen und weiblichen Keimzellen. Während der Behandlung mit Cyclophosphamid dürfen daher Frauen nicht schwanger werden und Männer keine Kinder zeugen. Männer sollten auch innerhalb der ersten 6 Monate nach dem Ende der Therapie auf keinen Fall ein Kind zeugen. Daten aus Tierversuchen zeigen, dass eine Exposition von Oozyten während der Follikelentwicklung mit einer verringerten Rate an Einnistungen und intakten Schwangerschaften und einem erhöhten Risiko von Missbildungen einhergeht. Diese Wirkung ist zu berücksichtigen, falls nach Beendigung der Cyclophosphamid-Therapie eine künstliche Befruchtung oder Schwangerschaft geplant ist. Die genaue Dauer der Follikelentwicklung beim Menschen ist nicht bekannt, kann aber länger als 12 Monate betragen. FI Endoxan 09.2013 10 Sexuell aktive Frauen und Männer müssen während dieser Zeit eine zuverlässige Methode der Empfängnisverhütung anwenden (siehe Abschnitt 4.6.). Auswirkungen auf die Fruchtbarkeit Cyclophosphamid hat Auswirkungen auf Oogenese und Spermatogenese. Es kann bei beiden Geschlechtern zur Sterilität führen. Ob es zu einer Sterilität kommt, scheint abzuhängen von der Cyclophosphamid-Dosis, der Dauer der Therapie und dem Zustand der Gonadenfunktion zum Zeitpunkt der Behandlung. Eine Cyclophosphamid-bedingte Sterilität kann bei manchen Patienten irreversibel sein. Weibliche Patienten Bei einem beträchtlichen Anteil der Frauen, die mit Cyclophosphamid behandelt werden, kommt es zu vorübergehender oder bleibender Amenorrhoe in Verbindung mit einer verringerten Östrogen- und einer erhöhten Gonadotropin-Sekretion. Vor allem bei älteren Frauen kann die Amenorrhoe von Dauer sein. Auch zu einer Oligomenorrhoe ist es in Verbindung mit einer Cyclophosphamid-Therapie gekommen. Bei Mädchen, die in der Vorpubertät mit Cyclophosphamid behandelt werden, entwickeln sich die sekundären Geschlechtsmerkmale meist normal, und die Menstruation ist regelmäßig. Bei Mädchen, die in der Vorpubertät mit Cyclophosphamid behandelt wurden, kam es später zu einer Empfängnis. Bei Mädchen, die mit Cyclophosphamid behandelt wurden, und bei denen die Ovarialfunktion nach Abschluss der Behandlung erhalten blieb, besteht ein erhöhtes Risiko einer vorzeitigen Menopause (Ende der Monatsblutung vor dem 40. Lebensjahr). Männliche Patienten Männern, die mit Cyclophosphamid behandelt werden, wird empfohlen, sich vor Therapiebeginn über eine Spermakonservierung beraten zu lassen. Bei Männern, die mit Cyclophosphamid behandelt werden, kann sich eine Oligospermie oder eine Azoospermie entwickeln, was normalerweise mit einer erhöhten Gonadotropin-, aber einer normalen Testosteron-Sekretion einhergeht. Sexuelle Potenz und Libido werden bei diesen Patienten für gewöhnlich nicht beeinträchtigt. Bei Jungen, die in der Vorpubertät mit Cyclophosphamid behandelt werden, können sich die sekundären Geschlechtsmerkmale normal entwickeln; es kann aber zu einer Oligospermie oder Azoospermie kommen. Es kann in einem gewissen Grad zu einer Hodenatrophie kommen. Eine Cyclophosphamid-bedingte Azoospermie ist bei manchen Patienten reversibel, wenn auch unter Umständen erst mehrere Jahre nach Abschluss der Therapie. Männer, die durch Cyclophosphamid vorübergehend steril wurden, haben später Kinder gezeugt. Anaphylaktische Reaktionen, Kreuzallergien mit anderen Alkylierungsmitteln Über anaphylaktische Reaktionen, unter anderem auch mit tödlichem Ausgang, wurde im Zusammenhang mit Cyclophosphamid berichtet. Es gibt Berichte über mögliche Kreuzallergien mit anderen Alkylierungsmitteln. Beeinträchtigung der Wundheilung Cyclophosphamid kann die normale Wundheilung beeinträchtigen. VORSICHTSMASSNAHMEN Alopezie Fälle von Alopezie sind bekannt und können mit steigender Dosis zunehmen. Die Alopezie kann bis zur Kahlheit fortschreiten. Man kann davon ausgehen, dass die Haare nach oder sogar noch während der Behandlung mit dem Medikament wieder wachsen, wobei Struktur oder Farbe verändert sein können. FI Endoxan 09.2013 11 Übelkeit und Erbrechen Die Anwendung von Cyclophosphamid kann zu Übelkeit und Erbrechen führen. Die geltenden Richtlinien für den Einsatz von Antiemetika zur Vorbeugung und Linderung von Übelkeit und Erbrechen sind zu beachten. Durch den Konsum von Alkohol können sich Cyclophosphamid-bedingte Übelkeit und Erbrechen verstärken. Stomatitis Die Anwendung von Cyclophosphamid kann zu Stomatitis (oraler Mukositis) führen. Die geltenden Richtlinien für Maßnahmen zur Vorbeugung und Linderung von Stomatitis sind zu beachten. Paravenöse Injektion Die zytostatische Wirkung von Cyclophosphamid entfaltet sich erst nach seiner Aktivierung, die hauptsächlich in der Leber stattfindet. Das Risiko für eine Gewebsschädigung durch eine versehentliche paravenöse Injektion ist daher gering. Bei einer versehentlichen paravenösen Injektion von Cyclophosphamid muss die Infusion sofort gestoppt und das Paravasat bei liegender Nadel aspiriert werden. Gegebenenfalls sind zusätzliche geeignete Maßnahmen zu ergreifen. Anwendung bei Patienten nach Adrenalektomie Bei Patienten mit Nebenniereninsuffizienz kann eine Erhöhung der Kortikoid-Substitutionsdosis erforderlich sein, wenn sie wegen Cyclophosphamid oder anderer Zytostatika toxizitätsbedingtem Stress ausgesetzt sind. Bei eingeschränkter Leber- oder Nierenfunktion ist die Cyclophosphamid-Dosis zu reduzieren (siehe Abschnitt 4.2). Die Anwendung von Cyclophosphamid im Rahmen der Konditionierung vor Knochenmarktransplantation ist hämatologisch-onkologischen Zentren vorbehalten, die über entsprechende Sachkenntnis und Ausstattung zur Durchführung von allogenen Knochenmarktransplantationen verfügen. Hinweis für Endoxan Tabletten: Patienten mit der seltenen hereditären Fructose-Intoleranz, Glucose-Galactose-Malabsorption, Saccharase-Isomaltase-Mangel, Galactose-Intoleranz, Lactase-Mangel oder Glucose-GalactoseMalabsorption sollten Endoxan nicht einnehmen. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkung Vor einer geplanten gleichzeitigen oder sequenziellen Anwendung von anderen Substanzen oder Therapien, durch die sich die Wahrscheinlichkeit oder der Schweregrad toxischer Wirkungen (in Folge pharmakodynamischer oder pharmakokinetischer Wechselwirkungen) erhöhen könnte, ist eine sorgfältige fallspezifische Abwägung des erwarteten Nutzens gegenüber den Risiken erforderlich. Patienten, die mit solchen Kombinationen behandelt werden, müssen engmaschig auf Anzeichen einer Toxizität überwacht werden, um ein frühzeitiges Eingreifen zu ermöglichen. Wenn Patienten mit Cyclophosphamid und Mitteln behandelt werden, die dessen Aktivierung vermindern, sind sie auf eine potenzielle Reduzierung der therapeutischen Wirksamkeit und die Notwendigkeit einer Dosisanpassung zu überwachen. Generell sollten Patienten auf eine verstärkte/reduzierte therapeutische Wirksamkeit und/oder einen Anstieg der Häufigkeiten und Schwere der Nebenwirkungen der wechselwirkenden Substanz überwacht werden. Gegebenenfalls muss die Dosierung angepasst werden. FI Endoxan 09.2013 12 Wechselwirkungen, die die pharmakokinetischen Eigenschaften von Cyclophosphamid und seinen Metaboliten beeinträchtigen Eine verminderte Aktivierung von Cyclophosphamid kann die Wirksamkeit der CyclophosphamidTherapie reduzieren. Zu den Substanzen, die die Aktivierung von Cyclophosphamid vermindern und dadurch die Wirksamkeit der Cyclophosphamid-Therapie reduzieren können, zählen folgende: Aprepitant Bupropion Busulfan: Neben einer verminderten Aktivierung von Cyclophosphamid ist Berichten zufolge bei Patienten, die Cyclophosphamid in hohen Dosen erhalten, weniger als 24 Stunden nach einer hohen Dosis Busulfan die Cyclophosphamid-Clearance verringert und die Halbwertzeit verlängert. Chloramphenicol Ciprofloxacin: Neben einer verminderten Aktivierung von Cyclophosphamid kam es bei der Anwendung von Ciprofloxacin vor der Cyclophosphamid-Therapie (im Rahmen der Konditionierung vor Knochenmarktransplantation) zu einem Rezidiv der Grunderkrankung. Fluconazol Itraconazol Prasugrel Sulfonamide Thiotepa: Über eine starke Hemmung der Bioaktivierung von Cyclophosphamid durch Thiotepa im Rahmen einer Hochdosis-Chemotherapie wurde berichtet, wenn Thiotepa eine Stunde vor Cyclophosphamid verabreicht wurde. In Verbindung mit folgenden Mitteln kann es zu einer erhöhten Konzentration an zytotoxischen Metaboliten kommen, die zu einem Anstieg der Häufigkeiten und Schwere der Nebenwirkungen führen: Allopurinol Chloralhydrat Cimetidin Disulfiram Glyceraldehyd Mittel, die humane hepatische und extrahepatische mikrosomale Enzyme induzieren (z. B. Cytochrom-P450-Enzyme) können die Konzentration von zytotoxischen Metaboliten erhöhen: Die Möglichkeit einer Induktion von hepatischen und extrahepatischen mikrosomalen Enzymen muss in Fällen in Betracht gezogen werden, in denen vorher oder gleichzeitig Substanzen angewendet werden, die bekanntermaßen eine erhöhte Aktivität solcher Enzyme bewirken können, wie z. B. Rifampin, Phenobarbital, Carbamazepin, Phenytoin, Johanniskraut und Kortikosteroide. Protease-Inhibitoren: Bei gleichzeitiger Gabe von Protease-Inhibitoren kann es zu einer erhöhten Konzentration an zytotoxischen Metaboliten kommen. In Verbindung mit der Anwendung von Behandlungsregimes auf der Basis von Protease-Inhibitoren zeigte sich bei Patienten, die mit Cyclophosphamid, Doxorubicin und Etoposid (CDE) behandelt werden, eine höhere Inzidenz von Infektionen und Neutropenie als bei einem Behandlungsregime auf NNRTI-Basis. Ondansetron Es gab Berichte über eine pharmakokinetische Wechselwirkung zwischen Ondansetron und hoch dosiertem Cyclophosphamid, die zu einer verringerten AUC von Cyclophosphamid führte. Pharmakodynamische Wechselwirkungen und Wechselwirkungen mit unbekannten Mechanismen, die die Anwendung von Cyclophosphamid beeinträchtigen Eine kombinierte oder sequenzielle Anwendung von Cyclophosphamid und anderen Mitteln mit ähnlichen Toxizitäten kann zu kombinierten (verstärkten) toxischen Wirkungen führen. • Zu einer erhöhten Hämatotoxizität und/oder Immunsuppression kann es kommen, wenn Cyclophosphamid z. B. mit folgenden Mitteln kombiniert wird: FI Endoxan 09.2013 13 - - - - • • - - • - - • - ACE-Inhibitoren: ACE-Inhibitoren können zu einer Leukopenie führen. Natalizumab Paclitaxel: Bei Anwendung von Cyclophosphamid nach einer Infusion von Paclitaxel wurde über eine erhöhte Hämatotoxizität berichtet. Thiazid-Diuretika Zidovudin Zu einer erhöhten Kardiotoxizität kann es kommen, wenn Cyclophosphamid z. B. mit folgenden Mitteln kombiniert wird: Anthracycline Cytarabin Pentostatin Strahlentherapie in der Herzgegend Trastuzumab Zu einer erhöhten pulmonalen Toxizität kann es kommen, wenn Cyclophosphamid z. B. mit folgenden Mitteln kombiniert wird: Amiodaron G-CSF, GM-CSF (Granulozyten-Kolonie-Stimulationsfaktor, Granulozyten-Makrophagen­ Kolonie-Stimulationsfaktor): Berichte lassen auf ein erhöhtes Risiko einer pulmonalen Toxizität bei Patienten schließen, die im Rahmen einer zytotoxischen Chemotherapie mit Cyclophosphamid und G-CSF oder GM-CSF behandelt werden. Zu einer erhöhten Nephrotoxizität kann es kommen, wenn Cyclophosphamid z. B. mit folgenden Mitteln kombiniert wird: Amphotericin B Indomethacin: Eine akute Wasserintoxikation wurde bei einer begleitenden Anwendung von Indomethacin beobachtet. Zunahme anderer Toxizitäten Azathioprin: Erhöhtes Risiko einer Hepatotoxizität (Lebernekrose) Busulfan: Es wurde über eine erhöhte Inzidenz von venookklusiver Lebererkrankung und Mukositis berichtet. Protease-Inhibitoren: Erhöhte Inzidenz von Mucositis. Allopurinol und Hydrochlorothiazid: verstärkte myelosuppressive Wirkung. Andere Wechselwirkungen • Alkohol Eine verringerte Antitumor-Aktivität wurde bei tumortragenden Tieren im Zusammenhang mit der Aufnahme von Ethanol (Alkohol) und einer begleitenden oralen Cyclophosphamid-Therapie in niedriger Dosierung beobachtet. Durch den Konsum von Alkohol können sich bei manchen Patienten Cyclophosphamid-bedingte Übelkeit und Erbrechen verstärken. • Etanercept Bei Patienten mit Wegener-Granulomatose wurde bei Gabe von Etanercept zur Standard-Behandlung mit Cyclophosphamid eine erhöhte Inzidenz von nicht-kutanen soliden Malignomen beobachtet. • Metronidazol Über eine akute Enzephalopathie wurde bei einem Patienten berichtet, der mit Cyclophosphamid und Metronidazol behandelt wurde. Ob ein kausaler Zusammenhang besteht, ist nicht geklärt. In einem Tierversuch ging die Kombination von Cyclophosphamid und Metronidazol mit einer erhöhten Cyclophosphamid-Toxizität einher. • Tamoxifen FI Endoxan 09.2013 14 Bei der gleichzeitigen Gabe von Tamoxifen während einer Chemotherapie kann ein erhöhtes Risiko für thromboembolische Komplikationen bestehen. Wechselwirkungen, die die Pharmakokinetik und/oder Wirkungen anderer Arzneimittel betreffen • Bupropion Der Cyclophosphamid-Stoffwechsel durch CYP2B6 kann den Stoffwechsel von Bupropion hemmen. Die Bupropion-Aktivierung kann reduziert sein, was eine verminderte Wirksamkeit zur Folge hat. • Cumarine Sowohl über eine verstärkte (erhöhtes Blutungsrisiko) als auch eine abgeschwächte (verminderte Blutverdünnung) Wirkung von Warfarin wurde bei Patienten berichtet, die mit Warfarin und Cyclophosphamid behandelt wurden. • Cyclosporin Bei Patienten, die eine Kombination aus Cyclophosphamid und Cyclosporin erhielten, wurden niedrigere Cyclosporin-Serumkonzentrationen beobachtet als bei Patienten, die nur mit Cyclosporin behandelt wurden. Diese Wechselwirkung kann eine erhöhte Inzidenz der Graft-versus-Host-Reaktion mit sich bringen. • Depolarisierende Muskelrelaxanzien Durch die Behandlung mit Cyclophosphamid kommt es zu einer beträchtlichen und persistierenden Hemmung der Cholinesterase-Aktivität. Dies kann zu einer länger andauernden neuromuskulären Blockade durch Succinylcholin führen. Bei gleichzeitiger Gabe von depolarisierenden Muskelrelaxanzien (z. B. Succinylcholin) kann es zu einer länger anhaltenden Apnoe kommen. Wenn ein Patient innerhalb von 10 Tagen vor einer Vollnarkose mit Cyclophosphamid behandelt wurde, muss der Anästhesist darauf hingewiesen werden. • Digoxin, β-Acetyldigoxin Es wurde berichtet, dass durch die Behandlung mit Zytostatika die Absorption von Digoxin- und β­ Acetyldigoxin-Tabletten im Darm beeinträchtigt war, was zu einer verminderten therapeutischen Wirkung von Digoxin und β-Acetyldigoxin führt. • Impfstoffe Durch die immunsuppressive Wirkung von Cyclophosphamid ist mit einer verminderten Impfantwort zu rechnen. Bei Lebendvakzinen besteht das Risiko einer Infektion durch den Impfstoff. • Sulfonylharnstoffe Bei gleichzeitiger Gabe kann die blutzuckersenkende Wirkung von Sulfonylharnstoffen verstärkt werden. • Verapamil Es wurde berichtet, dass durch die Behandlung mit Zytostatika die Absorption von oral eingenommenem Verapamil im Darm beeinträchtigt war, was zu einer verminderten therapeutischen Wirkung von Verapamil führen kann. 4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft Die Behandlung mit Cyclophosphamid kann bei Frauen erbgutschädigend wirken. Cyclophosphamid sollte daher nicht während der Schwangerschaft angewendet werden. Bei vitaler Indikation zur Behandlung einer Patientin ist während des 1. Trimenons der Schwangerschaft eine medizinische Beratung über das mit der Behandlung verbundene Risiko von schädigenden Wirkungen für das Kind und zur Schwangerschaftsunterbrechung zwingend erforderlich. FI Endoxan 09.2013 15 Nach dem 1. Trimenon der Schwangerschaft sollte bei nicht aufzuschiebender Dringlichkeit der Therapie und Kinderwunsch eine Chemotherapie nach vorheriger Aufklärung über das geringe, aber nicht auszuschließende Risiko von Auffälligkeiten der Kinder durchgeführt werden. Frauen sollten während und bis 6 Monate nach der Behandlung mit Cyclophosphamid nicht schwanger werden. Tritt während der Behandlung dennoch eine Schwangerschaft ein, so ist die Möglichkeit einer genetischen Beratung zu nutzen. Stillzeit Da Cyclophosphamid in die Muttermilch übertritt, darf während der Behandlung nicht gestillt werden. Fertilität Bei männlichen und weiblichen Patienten im geschlechtsreifen Alter sind während und bis mindestens 6 Monate nach Beendigung der Therapie empfängnisverhütende Maßnahmen vorzunehmen. Zu den erbgutschädigenden Wirkungen und den Auswirkungen auf die Fruchtbarkeit siehe Abschnitt 4.4. Bei männlichen und weiblichen Patienten im geschlechtsreifen Alter sind während und bis mindestens 6 Monate nach Beendigung der Therapie empfängnisverhütende Maßnahmen vorzunehmen. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Bei Patienten, die mit Endoxan behandelt wurden, sollte wegen möglicher Nebenwirkungen wie Übelkeit, Erbrechen und dadurch möglicherweise auftretender Kreislaufschwäche im Einzelfall vom Arzt über die aktive Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen entschieden werden. Dies gilt in verstärktem Maße im Zusammenwirken mit Alkohol. 4.8 Nebenwirkungen Die folgenden unerwünschten Arzneimittelwirkungen beruhen auf Daten der Marktbeobachtung. Sie sind in der Tabelle nach Systemorganklassen entsprechend der MedDRA-Klassifizierung und nach Häufigkeiten gelistet. Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: Sehr häufig: Häufig: (1/10) (1/100 bis <1/10) Gelegentlich: Selten: (1/1.000 bis <1/100) (1/10.000 bis <1/1.000) Sehr selten: (<1/10.000) Nicht bekannt: Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) Unerwünschte Arzneimittelwirkungen Systemorganklasse Nebenwirkung Infektionen und parasitäre Infektionen1 Erkrankungen Pneumonien2 Sepsis1 Septischer Schock Gutartige, bösartige und unspezifische Neubildung (einschl. Zysten und Polypen) FI Endoxan Sekundäre Tumore4 Akute Leukämie Myelodysplastisches Syndrom Blasenkarzinom 09.2013 Häufigkeit Häufig Gelegentlich Gelegentlich Sehr selten Selten Selten Selten Selten 16 Harnleiterkarzinom Tumorlyse-Syndrom Lymphome Progression zugrunde liegender maligner Erkrankungen Sarkome Nierenzellkarzinom Nierenbeckenkarzinom Schilddrüsenkarzinom Karzinogene Auswirkungen bei den Nachkommen Selten Sehr selten Nicht bekannt Nicht bekannt Erkrankungen des Blutes und des Lymphsystems Myelosuppression Leukozytopenie Neutropenie Thrombozytopenie Agranulozytose Anämie Panzytopenie Verringerte Hämoglobin-Werte Febrile Neutropenie Neutropenisches Fieber Disseminierte intravasale Gerinnung Hämolytisch-urämisches Syndrom Granulozytopenie Lymphopenie Sehr häufig Sehr häufig Sehr häufig Sehr häufig Sehr häufig Sehr häufig Sehr häufig Sehr häufig Häufig Häufig Sehr selten Sehr selten Nicht bekannt Nicht bekannt Erkrankungen des Immunsystems Immunsuppression Überempfindlichkeitsreaktionen Anaphylaktischer Schock Anaphylaktische/anaphylaktoide Reaktion2 Sehr häufig Gelegentlich Sehr selten Sehr selten Endokrine Erkrankungen Syndrom der inadäquaten ADH-Sekretion (SIADH) Wasserintoxikation Sehr selten Stoffwechsel- und Ernährungsstörungen Anorexie Dehydratation Hyponatriämie Flüssigkeitsretention Veränderter Blutzuckerspiegel (Anstieg oder Absinken) Häufig Selten Sehr selten Sehr selten Nicht bekannt Psychiatrische Erkrankungen Erkrankungen des Nervensystems Verwirrtheitszustand Sehr selten Periphere Neuropathie Polyneuropathie Neuralgie Schwindel Krampfanfälle Enzephalopathie Parästhesie Veränderter Geschmackssinn Neurotoxizität Dysgeusie Hypogeusie Leberenzephalopathie Reversibles posteriores Leukenzephalopathie-Syndrom Myelopathie Dysästhesie Gelegentlich Gelegentlich Gelegentlich Selten Sehr selten Sehr selten Sehr selten Sehr selten Nicht bekannt Nicht bekanntNicht bekanntNicht bekannt Nicht bekannt FI Endoxan 09.2013 Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt 17 Hypoästhesie Tremor Parosmie Nicht bekannt Nicht bekannt Nicht bekannt Augenerkrankungen Unscharfes Sehen Sehstörungen Konjunktivitis Augenödem Verstärkter Tränenfluss Selten Sehr selten Sehr selten Sehr selten Nicht bekannt Erkrankungen des Ohrs und des Labyrinths Taubheit Tinnitus Gelegentlich Nicht bekannt Herzerkrankungen Kardiomyopathie Myokarditis Herzversagen (in Einzelfällen mit Todesfolge) Tachykardie Arrhythmien Ventrikuläre Arrhythmie (incl. Ventrikuläre Tachykardie und Kammerflimmern) Supraventrikuläre Arrhythmie Vorhofflimmern Herzstillstand Myokardinfarkt Perikarditis Kardiogener Schock Perikarderguss/Herztamponade Myokardblutung Linksherzversagen Bradykardie Herzrhythmusstörungen Verlängertes QT-Intervall im Elektrokardiogramm Verminderte Auswurffraktion Gelegentlich Gelegentlich Gelegentlich Gelegentlich Selten Selten Gefäßerkrankungen Hitzegefühl Niedriger Blutdruck Thromboembolie Hypertonie Hypotonie Lungenembolie Venenthrombose Vaskulitis Periphere Ischämie Gelegentlich Gelegentlich Sehr selten Sehr selten Sehr selten Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Erkrankungen der Atemwege, des Brustraums und Mediastinums Pneumonitis4 Akutes respiratorisches Syndrom Chronische interstitielle Lungenfibrose Lungenödem Pulmonare Hypertonie Bronchospasmus Dyspnoe Hypoxie Husten Unbestimmte Lungenfunktionsstörungen Schwellung der Nasenschleimhäute Nasale Beschwerden Oropharyngeale Schmerzen Rhinorrhoe Niesen Pulmonale venookklusive Erkrankung Selten Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt FI Endoxan 09.2013 Selten Sehr selten Sehr selten Sehr selten Sehr selten Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt 18 Obliterative Bronchiolitis Organisierende Pneumonie Allergische Alveolitis Pleuraerguss Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Erkrankungen des Gastrointestinaltrakts Stomatitis Diarrhoe Erbrechen Obstipation Übelkeit Hämorrhagische Enterokolitis Akute Pankreatitis Aszites Mukosale Ulzeration Gastrointestinale Blutungen Bauchschmerzen Entzündung der Ohrspeicheldrüse Kolitis Enteritis Blinddarmentzündung Häufig Häufig Häufig Häufig Häufig Sehr selten Sehr selten Sehr selten Sehr selten Sehr selten Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Leber- und Gallenerkrankungen Leberfunktionsstörungen Venookklusive Lebererkrankung4 Erhöhte Bilirubinwerte im Blut Erhöhte Leberenzymwerte (SGOT, SGPT, gamma-GT, alkalische Phosphatase) Aktivierung einer Virushepatitis Hepatomegalie Ikterus Hepatitis Cholestatische Hepatitis Zytolytische Hepatitis Cholestase Hepatische Enzephalopathie Hepatotoxizität mit Leberversagen Häufig Selten Selten Selten Erkrankungen der Haut und des Unterhautzellgewebes Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen FI Endoxan Sehr selten Sehr selten Sehr selten Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Alopezie Exanthem Dermatitis Verfärbung von Handflächen, Fingernägeln und Fußsohlen Stevens-Johnson-Syndrom Toxische epidermale Nekrolyse Erythema multiforme Hautschäden an bestrahlten Stellen Verbrennungen an bestrahlten Stellen Juckreiz (inklusive entzündlichem Juckreiz) Hautrötung Toxischer Hautausschlag Palmar-plantares Erythrodysästhesie-Syndrom Urtikaria Bläschenbildung Hautrötung Gesichtsschwellung Hyperhidrose Sehr häufig Selten Selten Selten Rhabdomyolyse Sklerodermie Muskelkrämpfe Myalgie Arthralgie Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt 09.2013 Sehr selten Sehr selten Sehr selten Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt 19 Erkrankungen der Niere und Harnwege Zystitis Mikrohämaturie Hämorrhagische Zystitis (in Einzelfällen mit Todesfolge) Makrohämaturie Suburotheliale Blutung Ödem der Blasenwand Interstitielle Entzündung mit Fibrose und Sklerose der Blase Nierenversagen Erhöhte Kreatininwerte im Blut Tubulusnekrose Nierentubulusstörung Toxische Nephropathie Hämorrhagische Ureteritis Ulzerative Zystitis Kontraktur der Harnblase Nephrogener Diabetes insipidus Atypische Epithelzellen der Harnblase Erhöhter Blutharnstoff Sehr häufig Sehr häufig Häufig Schwangerschaft, Wochenbett und perinatale Erkrankungen Erkrankungen der Geschlechtsorgane und der Brustdrüse Vorzeitige Wehen Nicht bekannt Störungen der Spermatogenese Ovulationsstörung Amenorrhoe5 Azoospermie5 Oligospermie5 Infertilität Ovarialinsuffizienz Ovulationsbeschwerden Oligomenorrhoe Hodenatrophie Östrogen im Blut reduziert Gonatropin im Blut erhöht Häufig Gelegentlich Selten Selten Selten Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Kongenitale, familiäre und genetische Erkrankungen Intrauteriner Fruchttod Missbildung des Fetus Wachstumsverzögerung des Fetus Fetale Toxizität (Incl. Myelosuppression/ Gastroenteritis) Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Fieber Schüttelfrost Asthenie Müdigkeit Unwohlsein Entzündung der Schleimhaut Brustschmerzen Kopfschmerzen Schmerzen Multiorganversagen Phlebitis Reaktionen an der Injektions- bzw. Infusionsstelle (Thrombose, Nekrose, Entzündung, Schmerzen, Schwellung, Hautrötung) Ödem Grippeähnliche Erkrankung Sehr häufig Häufig Häufig Häufig Häufig Häufig Selten Sehr selten Sehr selten Sehr selten Sehr selten Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt FI Endoxan 09.2013 Häufig Sehr selten Sehr selten Sehr selten Sehr selten Sehr selten Sehr selten Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt Nicht bekannt 20 Untersuchungen Generelle physische Instabilität Verzögerte Wundheilung Nicht bekannt Nicht bekannt Hyperuriekämie infolge eines TumorlyseSyndroms Erhöhter Lactatdehydrogenase-Spiegel im Blut C-reaktives Protein erhöht Sehr selten Nicht bekannt Nicht bekannt 1 einschließlich andere bakterielle, fungale, virale, protozoale und parasitäre Reaktivierung latenter Infektionen, einschließlich Virushepatitis, Tuberkulose, JC-Virus mit progressiver multifokaler Leukenzephalopathie (auch mit tödlichem Ausgang), Pneumocystis jiroveci, Herpes zoster, Strongyloides, Sepsis und septischer Schock (auch mit tödlichem Ausgang) 2 auch mit tödlichem Ausgang 3 einschließlich akute myeloische Leukämie und akute promyelozytische Leukämie 4 bei Hochdosistherapie: sehr häufig 5 persistent 4.9 • • • • • • Überdosierung Zu den schwerwiegenden Folgen einer Überdosierung zählen Manifestationen dosisabhängiger Toxizitäten wie Myelosuppression, Urotoxizität, Kardiotoxizität (einschließlich Herzversagen), venookklusive Lebererkrankung und Stomatitis (siehe Abschnitt 4.4). Patienten, die eine Überdosis erhalten haben, sind engmaschig auf die Entwicklung von Toxizitäten zu überwachen, insbesondere auf Hämatotoxizität. Ein spezifisches Gegenmittel zu Endoxan ist nicht bekannt. Cyclophosphamid und seine Metabolite sind dialysierbar. Bei der Behandlung einer Überdosierung oder Intoxikation suizidaler oder akzidenteller Art ist daher eine rasche Hämodialyse angezeigt. Bei einer Überdosierung ist die Endoxan-Gabe abzubrechen und es sind unterstützende Maßnahmen zu ergreifen, einschließlich der angemessenen Behandlung eventueller begleitender Infektionen, Myelosuppression oder anderer Toxizitäten gemäß dem Stand der wissenschaftlichen Erkenntnis. Eine Zystitis-Prophylaxe mit dem Wirkstoff Mesna kann sinnvoll sein, um urotoxische Effekte in Folge einer Cyclophosphamid-Überdosierung zu verhindern oder einzuschränken (siehe Abschnitt 4.4). Mesna sollte möglichst unmittelbar nach Gabe der Überdosis von Endoxan verabreicht werden. Zur Vorbeugung einer hämorrhagischen Zystitis kann Mesna i.v. innerhalb von 24 - 48 Stunden eingesetzt werden (siehe Gebrauchsinformation). Hinweis: Bei unbeabsichtigter paravenöser Injektion einer vorschriftsmäßig rekonstituierten CyclophosphamidLösung besteht üblicherweise nicht die Gefahr einer zytotoxisch bedingten Gewebeschädigung, da diese überwiegend erst nach Bioaktivierung, die überwiegend in der Leber stattfindet seine zytotoxische Aktivität entfaltet. Kommt es zu einer Paravasation, sollte die Infusion dennoch sofort gestoppt werden, das Paravasat bei liegender Nadel aspiriert, mit Kochsalzlösung nachgespült und die Extremität ruhiggestellt werden. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Alkylantien, Stickstofflost-Analoga ATC-Code: L01AA01 FI Endoxan 09.2013 21 Cyclophosphamid ist ein Zytostatikum aus der Gruppe der Oxazaphosphorine. Es ist chemisch dem Stickstofflost verwandt. Cyclophosphamid ist in vitro inaktiv und wird in vivo überwiegend in der Leber durch mikrosomale Enzyme zu 4-Hydroxycyclophosphamid aktiviert, das mit seinem Tautomeren Aldophosphamid im Gleichgewicht steht. Diese Tautomere unterliegen einer zum Teil spontanen, zum Teil enzymatischen Konversion in inaktive und aktive Metaboliten (insbesondere Phosphoramidlost und Acrolein). Die zytotoxische Wirkung von Cyclophosphamid beruht auf einer Interaktion seiner alkylierenden Metaboliten mit der DNS. Folge der Alkylierung sind Strangbrüche und Vernetzungen der DNSStränge bzw. DNS-Proteinvernetzungen (”cross-links”). Im Zellzyklus wird eine Verlangsamung der Passage durch die G2-Phase verursacht. Die zytotoxische Wirkung ist nicht zellzyklusphasenspezifisch, aber zellzyklusspezifisch. Acrolein hat keine antineo-plastische Aktivität, ist aber für die urotoxischen Nebenwirkungen verantwortlich. Außerdem wird eine immunsuppressive Wirkung von Cyclophosphamid diskutiert. Eine Kreuzresistenz vor allem mit strukturverwandten Zytostatika, wie z. B. Ifosfamid, aber auch an­ deren Alkylantien, ist nicht auszuschließen. 5.2 Pharmakokinetische Eigenschaften Die Blutspiegel nach i.v. und oraler Applikation sind bioäquivalent. Resporption Cyclophosphamid wird aus dem Magen-Darm-Trakt nahezu vollständig resorbiert. Beim Menschen fällt nach einmaliger intravenöser Gabe von radioaktiv markiertem Cyclophosphamid die Plasmakonzentration der Substanz und ihrer Metaboliten innerhalb von 24 Stunden sehr stark ab, wobei aber nachweisbare Plasmakonzentrationen bis zu 72 Stunden vorhanden sein können. Biotransformation Cyclophosphamid ist unter in vitro-Bedingungen inaktiv und wird erst im Organismus bioaktiviert. Patienten mit eingeschränkter Leberfunktion weisen eine verzögerte Biotransformation von Cyclophosphamid auf. In Fällen mit pathologisch verringerter Cholinesteraseaktivität kommt es dadurch zu einem Anstieg der Serumhalbwertszeit. Cyclophosphamid konnte in der Zerebrospinalflüssigkeit und der Muttermilch nachgewiesen werden. Cyclophosphamid und seine Metaboliten passieren die Plazentaschranke. Elimination Die mittlere Halbwertszeit von Cyclophosphamid im Serum beträgt bei Erwachsenen ca. 7 und bei Kindern ca. 4 Stunden. Cyclophosphamid selbst unterliegt keiner wesentlichen Proteinbindung, wohl aber seine Metaboliten, die zu ca. 50% an Plasmaproteine gebunden sind. Cyclophosphamid und seine Metaboliten werden zum größten Teil renal ausgeschieden, eine Dosismodifikation bei Niereninsuffizienz ist notwendig. Eine übliche Empfehlung ist die Dosisreduktion um 50% bei einer glomerularen Filtrationsrate unter 10 ml pro Minute. Eine Dosisreduktion von 25% wird bei Serumbilirubinwerten zwischen 3.1 und 5 mg/ 100 ml empfohlen. Pharmakokinetische/pharmakodynamische Zusammenhänge Nach hochdosierter i.v. Applikation im Rahmen der allogenen Knochenmarktransplantation folgt die Plasmakonzentration des nativen Cyclophosphamids einer linearen Kinetik 1. Ordnung. Eine intraindividuelle Dosiseskalation um den Faktor 8 verändert die pharmakokinetischen Kenn-größen für das native Cyclophoshamid nicht. Weniger als 15% der applizierten Dosis werden unverändert mit dem Urin ausgeschieden. Im Vergleich mit einer konventionelen Cyclophosphamidtherapie kommt es aber zu einer Zunahme inaktiver Metaboliten, die auf eine Sättigung der aktivierenden Enzymsysteme, FI Endoxan 09.2013 22 nicht jedoch der zu inaktiven Metaboliten führenden Metabolisierungsschritte hindeutet. Im Verlauf einer mehrtägigen hochdosierten Cyclophosphamidtherapie nehmen die Flächen unter der Plasmakonzentrations-Zeit-Kurve der Muttersubstanz, vermutlich aufgrund der Autoinduktion der mikrosomalen Metabolisierungsaktivität, ab. 5.3 Präklinische Daten zur Sicherheit Akute Toxizität Die akute Toxizität von Cyclophosphamid ist im Vergleich zu anderen Zytostatika verhältnis-mäßig gering. Dies wurde in Experimenten an Mäusen, Meerschweinchen, Kaninchen und Hunden nachge­ wiesen. Bei einmaliger i.v. Injektion beträgt die LD50 bei der Ratte etwa 160 mg/kg, bei Maus und Meerschweinchen 400 mg/kg, beim Kaninchen 130 mg/kg und beim Hund 40 mg/kg. Chronische Toxizität Die chronische Gabe toxischer Dosen führt zu Leberläsionen im Sinne einer Verfettung mit anschlie­ ßender Nekrose. Die Darmschleimhaut wird nicht angegriffen. Die Schwelle für die hepatotoxische Wirkung liegt beim Kaninchen bei 100 mg/kg, beim Hund bei 10 mg/kg. Mutagenes und tumorerzeugendes Potential Für Cyclophosphamid konnte in zahlreichen in vitro und in vivo Tests ein mutagenes Potential nachgewiesen werden. Auch beim Menschen wurden nach der Gabe von Cyclophosphamid chromosomale Aberrationen beobachtet. Bei Patienten im geschlechtsreifen Alter sind während und bis mindestens 6 Monate nach Beendigung der Therapie kontrazeptive Maßnahmen vorzunehmen (siehe Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung). In Tierversuchen an Ratten und Mäusen konnte eine tumorerzeugende Wirkung von Cyclophosphamid nachgewiesen werden. Aufgrund epidemiologischer Studien muss davon ausgegangen werden, dass durch die Behandlung mit Cyclophosphamid beim Menschen Sekundärtumoren hervorgerufen werden können. Reproduktionstoxizität Cyclophosphamid wirkt bei verschiedenen Tierarten einschließlich Maus, Ratte, Kaninchen, RhesusAffe und Hund teratogen. Es löst eine Reihe von Skelett-, Weichteil- und anderen Missbildungen aus. Bisherige Erfahrungen beim Menschen geben Hinweise auf ein erhöhtes Fehlbildungsrisiko bei der Anwendung von Cyclophosphamid während der ersten drei Schwangerschaftsmonate. Es liegen keine Untersuchungen über mögliche Spätfolgen bei im zweiten oder dritten Trimester exponierten Kindern vor. 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile Endoxan Tabletten: Calciumcarbonat, Calciumhydrogenphosphat-Dihydrat, Carmellose Natrium, Gelatine, Glycerol, Lactose-Monohydrat, Maisstärke, Magnesiumstearat, Macrogol, Montanglycolwachs, Polysorbat, Polyvidon 25, Sucrose (Saccharose), Siliciumdioxid, Talkum, Farbstoff E171. Endoxan Pulver zur Herstellung einer Injektionslösung: Es sind keine sonstigen Bestandteile enthalten. 6.2 Inkompatibilitäten FI Endoxan 09.2013 23 Die Stabilität von Cyclophosphamid kann in Benzylalkohol-haltigen Trägerlösungen eingeschränkt sein. 6.3 Dauer der Haltbarkeit Endoxan und Endoxan 100 mg, 200 mg, 500 mg und 1 g: 3 Jahre Die rekonstituierte Lösung sollte nach der Herstellung innerhalb von 24 Stunden verwendet werden. 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Endoxan Durchstechflaschen und Tabletten sollen bei Raumtemperatur nicht über 25° C aufbewahrt werden. In der Originalverpackung aufbewahren. Die rekonstituierte Lösung im Kühlschrank (bei 2 - 8°C) lagern. Nicht über 8° C lagern. Durch Temperatureinflüsse während des Transportes oder der Lagerung von Endoxan Pulver zur Herstellung einer Injektionslösung kann es zum Schmelzen des Wirkstoffes Cyclophosphamid kommen. Durchstechflaschen mit geschmolzener Substanz sind optisch leicht von Flaschen mit intaktem Wirkstoff zu unterscheiden. Geschmolzenes Cyclophosphamid ist eine klare oder gelbliche Flüssigkeit, die sich als zusammenhängende Phase oder in Tröpfchen in den betroffenen Flaschen findet. Durchstechflaschen mit geschmolzenem Inhalt dürfen nicht mehr verwendet werden. 6.5 Art und Inhalt des Behältnisses Endoxan 100 mg / 200 mg Packungen mit 10 Durchstechflaschen, Klinikpackungen Endoxan 500 mg / 1 g Packungen mit 1 oder 6 Durchstechflaschen, Klinikpackungen Endoxan Packungen mit 30, 50 oder 100 Tabletten, Klinikpackungen 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung Bei der Handhabung, Zubereitung und Entsorgung von Cyclophosphamid sind stets die geltenden Richtlinien zum sicheren Umgang mit Zytostatika einzuhalten (siehe aktuelles Merkblatt M 620 der Berufsgenossenschaft für Gesundheitsdienst und Wohlfahrtspflege und Abfallschlüssel-Nr.18 01 05 D1”zytostatische Mittel”). Endoxan überzogene Tabletten: Durch die Beschichtung der Tabletten wird ein direkter Kontakt der verabreichenden Person mit dem Wirkstoff vermieden. Um eine versehentliche Exposition Dritter gegenüber dem Wirkstoff zu vermeiden, dürfen die Tabletten nicht zerteilt oder zerdrückt werden. 7. INHABER DER ZULASSUNG Baxter Oncology GmbH Kantstraße 2 33790 Halle/Westfalen Korrespondenzadresse: Baxter Deutschland GmbH FI Endoxan 09.2013 24 Edisonstraße 4 85716 Unterschleißheim Telefon: 089/31701-0 Fax: 089/31701-177 E-Mail: [email protected] 8. ZULASSUNGSNUMMERN Endoxan Endoxan 100 mg Endoxan 200 mg Endoxan 500 mg Endoxan 1 g 6035903.00.01 6035903.03.00 6035903.01.00 6035903.02.00 6035903.00.00 9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG Datum der Erteilung der Zulassung: 29.10.1965 Datum der letzten Verlängerung der Zulassung: 10.09.2004 10. STAND DER INFORMATION 09.2013 11. VERKAUFSABGRENZUNG Verschreibungspflichtig __________________________________________________________________________ Baxter und Endoxan sind eingetragene Marken der Baxter International Inc. FI Endoxan 09.2013 25