Details - Innere Medizin II - Nephrologie, Rheumatologie
Werbung

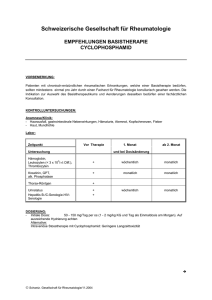
JavaScript scheint in Ihrem Browser deaktiviert zu sein. Sie müssen JavaScript in Ihrem Browser aktivieren um alle Funktionen der Seite nutzen zu können. Notfall Kontakt Uniklinik Köln International Suche starten https://www.uk-koeln.de/ Erkrankungen & Therapien Klinik Forschung Lehre Zuweiser & Professionals Karriere Informationen Sie sind hier: Startseite Forschung Klinische Studien Studienregister CL010_168 Prüfplancode ISRCTN EudraCT Clinicaltrials.gov DRKS CL010_168 Eine randomisierte, doppelblinde, placebo-kontrollierte Phase-3-Studie zur Auswertung der Sicherheit und Wirksamkeit von CCX168 bei Patienten mit ANCA-Vaskulitis, welche begleitend mit Rituximab oder Cyclophophamid/Azathioprin behandelt werden Status: Aktiv Studienziel / Fragestellung Primäres Prüfziel Ziel ist es, die Wirksamkeit von CCX168 und Rituximab oder Cyclophosphamid, gefolgt von Azathioprin zu vergleichen mit Prednisolon und Rituximab oder Cyclophosphamid, gefolgt von Azathioprin; in Bezug auf die Remission der Erkrankung bei Patienten mit aktiver ANCA-Vaskulitis. Remission der Erkrankung wird definiert durch das Erreichen eines BVAS(Birmingham Vasculitis Activity Score)-Scores von 0 und der Beendigung der Einnahme von Glucokortikoiden für mind. 4 Wochen. Ziel ist es, die Sicherheit von CCX168 und Rituximab oder Cyclophosphamid, gefolgt von Azathioprin zu vergleichen mit Prednisolon und Rituximab oder Cyclophosphamid, gefolgt von Azathioprin; basierend auf dem Auftreten von schwerwiegenden, unerwünschten Ereignissen bei diesen Patienten. Sekundäre Prüfziele Auswertung von Gesundheitsveränderungen, basierend auf Short Form-36 version 2 (SF-36 v2) und EuroQOL-5D-5L (EQ-5D-5L). Auswertung von Veränderungen der Nierenerkrankung, einschliesslich Albuminurie, Urinexkretion von MCP-1, eGFR, Hämaturie bei Patienten mit aktiver Nierenerkrankung zum Zeitpunkt 0 bei Therapie mit CCX168 und Rituximab oder Cyclophosphamid/Azathioprin,verglichen mit Prednisolon und Rituximab oder Cyclophosphamid/Azathioprin. Auswertung von Veränderungen bei zunehmender Organschädigung, basierend auf dem VDI (Vasculitis Damage Index) bei Therapie mit CCX168 und Rituximab oder Cyclophosphamid/Azathioprin,verglichen mit Prednisolon und Rituximab oder Cyclophosphamid/Azathioprin. Auswertung des Sicherheitsprofils von CCX168, basierend auf Unerwünschten Ereignissen, Infektionen, und mit Glucokortikoid zusammenhängender Ereignisse. Auswertung von Veränderungen der pharmakodynamischen Marker im Plasma und Urin bei Therapie mit CCX168 und Rituximab oder Cyclophosphamid/Azathioprin,verglichen mit Prednisolon und Rituximab oder Cyclophosphamid/Azathioprin. Auswertung des pharmakokinetischen Profils von CCX168 bei Patienten mit AAV. Diagnose Patientenmerkmale Alter 12 - 0 Einschlusskriterien 1. Klinische Diagnose von Mb. Wegener oder mikroskopische Polyangiitis, vereinbar mit Chapel-Hill Consensus Conference definitions (Jennette et al., 2013) 2. Mindestens 12 Jahre alt, neu diagnostizierte oder Rezidiv-AAV, Indikation zur Therapie mit Rituximab oder Cyclophosphamid; Frauen im gebärfähigen Alter können teilnehmen bei adäquater Verhütung, mind. 6 Monate nach letzter Cyclophosphamid-Gabe und mind. 12 Monate nach letzter Rituximab-Gabe liegen; Männer mit Partnerinnen im gebärfähigen Alter können teilnehmen, wenn sie eine Vasektomie mind. 6 Monate vor Randomisierung hatten, oder eine adäquate Verhütung während Studienteilnahme genutzt wird und mind. 6 Monate nach letzter Cyclophosphamid-Gabe und mind. 12 Monate nach letzter RituximabGabe liegen. 3. Positiver Test auf anti-PR3 or anti-MPO 4. Mind. 1 Hauptpunkt, oder mind. 3 Punkte, oder mind. 2 renale Punkte im BVAS-Score 5. Geschätzte GFR ≥15 mL/minute/1.73 m2 (MDRD) 6. Unterschriebene Einverständniserklärung des Teilnehmers bzw. der gesetzlichen Vertreter bei 12-17jährigen Teilnehmern 7. Teilnehmen können auch Patienten, die nach Einschätzung des Prüfers anderweitig gesund sind. Patienten mit auffälligen Laborparametern können auch nach Einschätzung des Prüfers teilnehmen, wenn diese nicht klinisch signifikant sind Ausschlusskriterien 1. Schwangere oder stillende Frauen 2. Alveoläre Hämorrhagie mit Beatmungsunterstützung 3. Jede andere bekannte multisystemische Autimmunerkrankung, einschliesslich Churg-Strauss-Syndrom, systemischer Lupus erythematosus, IgA-Vaskulitis (Henoch-Schönlein purpura), rheumatoide Vaskulitis, Sjögren's Syndrom, anti-GBM-Glomerulonephritis, oder kryoglobulinämische Vaskulitis 4. Dialyse innerhalb von 12 Wochen vor Screening 5. Nierentransplantation 6. Cyclophosphamid innerhalb von 12 Wochen vor Screening; Azathioprin, Mycophenolate mofetil oder Methotrexat müssen vor Gabe von Cyclophosphamid oder Rituximab an Day 1 abgesetzt werden. 7. i.v.-Glucokortikoide (entsprechend>3000mg Methyprednisolon) innerhalb von 12 Wochen vor Screening 8. orale Glucokortikoide (entsprechend mehr als 10mg Prednisolon) für mehr als 6 Wochen durchgehend vor Screening 9. Rituximab oder andere B-Zell-Antikörper innerhalb von 52 Wochen vor Screening oder B-Zell-Wiederherstellung innerhalb von 26 Wochen (i.e., CD19 count > 0.01x109/L); anti-TNF-Therapie, Abatacept, Alemtuzumab, IVIg, Belimumab, Tocilizumab, oder Plasmaaustausch innerhalb von 12 Wochen vor Screening 10. Einnahme von starken CYP3A4-Induktoren, z.B. Carbamazepin, Phenobarbital, Phenytoin, Rifampin, oder Johanniskraut 11. Jedes der nachfolgenden Punkte: symptomatische Herzinsuffizienz (therapiebedürftig), nicht eingestellter Bluthochdruck (syst. >160 oder diast. >100), instabile Angina (sofern nicht mit Stent oder Bypass therapiert), klinisch signifikante Arrhythmie, Herzinfarkt oder Apoplex 12. Aktuelle oder in der Vorgeschichte bekannte Krebserkrankung innerhalb von 5 Jahren vor Screening, mit Ausnahme von operativ entferntem Hautkrebs oder Karzinoma in situ wie Gebärmutterhalskrebs oder Brustkrebs, welches operativ entfernt wurde und ohne erneutes Auftreten und Metastasen ist 13. Nachweis von Tuberkulose, basierend auf γ-Interferon test, PPD-hauttest, oder Röntgen Thorax, bei Screening oder innerhalb von 6 Wochen vor Screening 14. Nachweis einer aktiven Virusinfektion durch HBV, HCV, oder HIVScreeningtest bei Screening oder innerhalb von 6 Wochen vor Screening 15. Impfung mit Lebendimpfstoff innerhalb 4 Wochen vor Screening 16. Leukozyten weniger als 3000/μL, oder Neutrophile weniger als 1500/μL, oder Lymphocyten weniger als 800/μL vor Start der Medikation 17. Nachweis einer Lebererkrankung: AST, ALT, AP, oder Bilirubin 3x über dem oberen Limit vor Start der Medikation 18. Klinisch signifikantes abnormales EKG während Screening, z.B. QTcF größer als 450 msec 19. Bekannte Überempfindlichkeit gegenüber CCX168 oder inaktiven Inhaltsstoffen der CCX168 Kapseln (Gelatin, Polyethylenglycol, oder Cremophor), Cyclophosphamid oder seinen Abbauprodukten (betrifft Patienten, die Cyclophosphamid erhalten sollen), oder bekannte Typ-IÜberempfindlichkeit oder anaphylaktische Reaktionen gegen Murine Proteine, Eierstockzellproteine des Chinesischen Hamsters , oder jede andere Komponente von Rituximab (betrifft Patienten, die Rituximab erhalten sollen) 20. Harnabflussstörung, aktive Infektion (besonders mit Varizella-ZosterVirus), oder Thrombozyten < 50,000/μL (betrifft Patienten, die Cyclophosphamid erhalten sollen) vor Start der Medikation 21. Teilnahme an anderen interventionellen Studien innerhalb der letzten 30 Tage vor Screening, oder 5 Halbwertszeiten nach der letzten Einnahme eines Studienmedikamentes 22. Aktuelle oder Vorgeschichte einer Erkrankung, welche nach Meinung des Prüfers eine Gefährdung des Teilnehmers im Rahmen dieser Studie darstellen könnte Studiendesign Doppelblind,Multizentrisch,Phase III,Placebokontrolliert,Prospektiv,Randomisiert,Zweiarmig Dokumente (passwortgeschützt) (noch keine Dokumente) Zuständigkeiten Gesamtstudie Sponsor ChemoCentryx, Inc. Leiter der klinischen Prüfung Dr. med. Franziska Grundmann Prüfzentren Köln Nephrologie - Klinik II für Innere Medizin (UK Köln) Studienbüro Studienzentrum Med II (UK Köln) Tel.+49(0)221-478-97222 [email protected] Status Aktiv Prüfer (Hauptprüfer im Zentrum) Dr. med. Franziska Grundmann Stellvertretender Prüfer Dr. med. Volker Burst Studienkontakt im Prüfzentrum Dr. med. Franziska Grundmann [email protected] Forschung Publikationen Nephrologische Forschung Klinische Studien Studienregister Klinische Altersforschung Informationen Ansprechpartner auf einen Blick Kontakt & Anfahrt Pflege und Service Veranstaltungen & Fortbildungen Aktuelles Downloads International Patients Nach oben scrollen Themenbereich Erkrankungen & Therapien Nierenerkrankungen & Bluthochdruck Rheumatologie Nierentransplantation Diagnostik & Therapie ADPKD Klinik Stationärer Aufenthalt Ambulante Behandlung Zentrale Notaufnahme Direktor und Team Forschung Nephrologische Forschung Klinische Studien Klinische Altersforschung Uniklinik Köln Social Media Seitenfunktionen Seite drucken Als PDF speichern Bookmark Teilen Datenschutz Impressum Sitemap