Kohlenstoff - bei der SGTK
Werbung

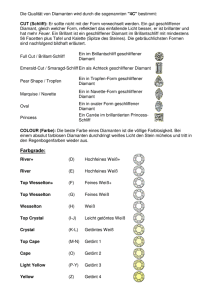
1 Rainer Kündig, Christoph Bühler, Heinz Surbeck IMP/ETHZ HS 2011 651-4097-00G Applied Mineralogy and non-metallic resources I Angewandte Mineralogie und nichtmetallische Rohstoffe: Nutzung und Umweltaspekte I Kohlenstoff: –> Graphit, Diamant; Fullerene Eigenschaften, Vorkommen und Verwendung Kohlenstoff Das Kohlenstoffatom hat die Eigenschaft, mit weiteren Kohlenstoffatomen sehr stabile Bindungen einzugehen. «Stabil» bedeutet, dass die Bindung nicht durch die Gegenwart von Wasser oder Luftsauerstoff angegriffen wird, und dass eine ausreichende Wärmestabilität vorhanden ist. Da es praktisch keinerlei Obergrenze für die Zahl von Kohlenstoffatomen in einem Molekül gibt, sind beliebig komplexe Strukturen denkbar. Bis vor wenigen Jahren waren nur zwei Kohlenstoff-Modifikationen bekannt: Graphit und Diamant. 1985 entdeckten die Wissenschaftler Robert F. Curl, Harold W. Kroto und Richard E. Smalley eine weitere Modifikation des Kohlenstoffs: die Fullerene. Dafür wurden sie 1996 mit dem Chemie-Nobelpreis geehrt. Heute sind weitere Erscheinungsformen des Kohlenstoffs bekannt, so beispielsweise die Kohlenstoffnanoröhren, Kohlenstoffnanoschaum, Kohlenstofffasern, Graphen und in gewisser Weise auch Russ. Diese Vielseitigkeit des Kohlenstoffatoms wird dadurch potenziert, dass es auch zu Elementen wie Wasserstoff, Sauerstoff, Stickstoff usw. stabile, leicht polare Bindungen eingehen kann. Neben den als klassische zu bezeichnenden Strukturen (Graphit und Diamant) und den Fullerenen wurden in jüngster Zeit zwei neue kristalline Modifikationen des elementaren Kohlenstoffs gefunden. Es handelt sich zum einen um eine durch Hochdruckumwandlung (shock conversion) von Graphit mit Nickel-Zusatz produzierte hexagonale Strukturvariante des Diamants. Diese DiamantPhase erhielt den Namen «Lonsdaleit». Die andere Modifikation wird als «weisser Kohlenstoff» bezeichnet und erhielt den Namen «Chaoit». Es handelt sich dabei um eine reine HochtemperaturModifikation. So extrem die Eigenschaften von Graphit, Diamant und Fullerenen auch sind, alle Mineralarten sind zu 100% aus Kohlenstoff aufgebaut. Dies sieht man zum Beispiel beim Verbrennen: Sowohl Diamant als auch Graphit verbrennen in Sauerstoff bei hohen Temperaturen zu Kohlendioxid und lösen sich hierbei gleichsam in «Luft» auf. Diamant steht mit Härte 10 an der Spitze der Mohs'schen Härteskala. Bezogen auf die Mikrohärte nach Vickers steigt die Härte von Diamant um mehrere Zeh- 2 nerpotenzen gegenüber den weicheren Mineralien (siehe Tabelle Seite 9). Diamant ist der «unvergänglichste» Edelstein, aber auch ein geniales Werkzeug für zahllose Anwendungen. In reiner Form ist Diamant wasserklar, von leuchtendem «Weiss» (Diamantleute sagen nicht «farblos») und zeigt einen äusserst hohen Brechungsindex, der ihm das «Feuer» verleiht. Diamant ist ein guter elektrischer Isolator. Graphit hingegen gehört zu den weichsten Mineralien und dient aufgrund seiner Konsistenz unter anderem auch als technisches Gleit- und Schmiermittel. Im Gegensatz zum reinen Diamant ist Graphit schwarz und undurchsichtig; er weist einen leicht metallischen Glanz auf. Ebenfalls im Gegensatz zum Diamant ist Graphit gut leitfähig für elektrischen Strom. Gerade wegen seinen verschiedenartigen Modifikationen hat Kohlenstoff mit seiner Reihe bemerkenswerter physikalischer und chemischer Eigenschaften grosse technische Bedeutung erlangt. Niedriger Dampfdruck auch bei hohen Temperaturen, gute Temperatur-Wechselbeständigkeit, chemische Resistenz gegenüber Säuren und anderen Agressorien, gute thermische und elektrische Leitfähigkeit und einfache Bearbeitbarkeit der graphitartigen Modifikationen sowie die extreme Härte und Verschleissfestigkelt der diamantartigen Modifikationen und die chemische Resistenz (ausgenommen gegen oxidierende Stoffe) sind nur einige der wichtigsten Eigenschaften des Kohlenstoffs. Aufgrund dieser Eigenschaften sind sowohl die natürlichen wie auch die synthetischen, polykristallinen Kohlenstoffe heute unentbehrliche Werkstoffe der metallurgischen, chemischen und elektrotechnischen Industrie. Die Wärmeleitfähigkeit nimmt mit der Temperatur stetig ab. Die Sublimationstemperatur des Kohlenstoffs beträgt 4000°K, die Verdampfungsgeschwindigkeit ist etwa 10-4 bis 10-6 g/cm2s bei 3000°K. Auch andere wichtige Stoffgrössen ändern mit der Temperatur. Die Festigkeit nimmt bis etwa 2500°K zu, der Temperaturkoeffizient des elektrischen Widerstandes ist bis etwa 600°K negativ und bei höheren Temperaturen wie bei Metallen positiv. Aus der Vielzahl der synthetischen und natürlichen Kohlenstoffarten lassen sich strukturmässig nur wenige eindeutig zuordnen (z.B. natürliche und synthetische Diamanten, Elektro-Graphite). Die übrigen Kohlenstoffarten zeigen mehr oder weniger grosse Abweichungen von den kristallinen Idealstrukturen. Man bezeichnet sie deshalb auch etwa als parakristalline Kohlenstoffe (früher auch als «amorpher Kohlenstoff» bezeichnet). Neue Entwicklungen, vor allem in der Nukleartechnologie sowie in der Luft- und Raumfahrt, haben durch ihre speziellen Erfordernisse auch die Weiterentwicklung des Werkstoffes Kohlenstoff beeinflusst und zu neuartigen synthetischen Kohlenstoff-Modifikationen geführt. Zu diesen modernen Kohlenstoffen gehören der pyrolytische Graphit sowie der glasartige Glaskohlenstoff. Auch Kohlenstoff-Nanoröhren und Kohlenstoff-Nanoschaum (röhrenförmig/zylindrisch oder netzartig angeordnete Kohlenstoffatome oder Kohlenstoffcluster) werden heute wegen spezieller elektrischer und ferromagnetischer Eigenschaften intensiv erforscht. Ebenso Graphen, eine Art zweidimensionales, graphitähnliches Gitter aus einer sehr dünnen, welligen Fläche (meist nur eine Atomlage «dick»). Dieses kürzlich (wieder)entdeckte Material hat ausgezeichnete Leitfähigkeit und – wie alle Kohlenstoff Allotrope* – vermutlich eine grosse Zukunft vor sich. Kohlenstoffasern spielen bei vielen modernen Werkstoffen eine wichtige Rolle und schliesslich wird auch Russ auf Graphitbasis in vielen technischen Produkten verwendet. * Allotropie: Ein chemisches Element kann im gleichen Aggregatszustand in zwei oder mehreren Strukturformen auftreten, die sich physikalisch und in ihrer chemischen Reaktionsbereitschaft voneinander unterscheiden. 3 Graphit Graphit (hexagonal) hat eine Schichtstruktur, bei der regelmässige, ebene Sechserringe wie Blätterteigschichten übereinander gelegt sind. In einer Schicht ist jedes Kohlenstoffatom mit drei anderen kovalent verbunden. Für diese kovalenten Bindungen werden jeweils drei der vier Valenzelektronen des Kohlenstoffs benötigt. Die «vierten» Valenzelektronen bauen ein über die ganze Schicht reichendes delokalisiertes Elektronensystem auf. Vorkommen, Entstehung und Verwendung: Natürlicher Graphit kommt vor allem in China, Indien, Mexiko, Nordkorea und Brasilien vor. Diese fünf Länder sind für 75% der Weltproduktion zuständig. Pro Jahr werden weltweit ungefähr 6-700'000 Tonnen sowohl im Tagebau als auch unter Tag abgebaut. Die Aufbereitung erfolgt durch mechanische Separation, schonendes Mahlen (wegen Flockengrösse) und durch Flotation. Natürlicher Graphit entsteht durch metamorphe Prozesse (Kontaktmetamorphose, Regionalmetamorphose und Metasomatose) aus organischem Material. Mit zunehmendem Druck und höheren Temperaturen entstehen aus den zuerst ungeordneten amorphen Graphiten über verschiedene Stufen intermediäre und schliesslich (über 400°C) vollständig geordnete Graphitvarietäten. Naturgraphit Im kommerziellen Bereich werden drei natürliche Graphittypen unterschieden: die strukturell gut geordneten, metallischen Glanz und hohe Plastizität aufweisenden Flockengraphite, hochkristalline Graphite und kryptokristalline erdige (amorphe) Sorten (flake, high-crystalline, amorphous). Diese drei Sorten werden wiederum in eine Vielzahl von Handelsprodukten unterteilt, je nach Kohlenstoffgehalt, Partikelgrösse und Gehalt an Verunreinigungen. Naturgraphit wird sowohl im Tagebau (z.B. Madagaskar) oder untertage in Bergwerken (z.B. Kropfmühl, Deutschland) abgebaut. Die mineralische Gangart wird meistens durch Flotation entfernt. Eine Verminderung des Verunreinigungen auf unter 1% ist im allgemeinen nur durch besondere chemische oder thermische Reinigungsbehandlungen möglich. Synthetischer Graphit und parakristalline Kohlenstoff-Formen mit Schichtstruktur Synthetischer Graphit wird vorwiegend durch Pyrolyse (d.h. bei hohen Temperaturen unter Sauerstoffausschluss) von Kohle und Erdöl gewonnen. Jährlich werden durch dieses Verfahren ca. 100 Millionen Tonnen Graphit hergestellt, hauptsächlich für die Herstellung von Elektroden (siehe unten). 4 Verwendung von Kohlenstoff und Graphit Graphit-Elektroden Mit der Entwicklung der Elektrotechnik entstand ein schnell wachsender Bedarf an thermisch beständigen und korrosionsfesten Elektroden und elektrischen Kontakten. Da aus Naturgraphit hergestellte Werkstücke den Anforderungen nur zu einem Teil genügten, mischte man Kokspulver mit Pech um das Gemisch zu formen und daraufhin den Pechbinder zu verkoken. Die Formlinge bestehen dann aus einer Vielzahl von Kokskörnern (polygranular), die durch Koksbrücken starr miteinander verbunden sind, und aus Poren, die sich vor allem beim Verkoken des Binders (bei der Pyrolyse) bilden. Die einzelnen Kristallite sind stark fehlgeordnet. Werden die Formlinge anschliessend auf etwa 3000 Grad erhitzt, nimmt die kristalline Ordnung zu. Daher werden die Begriffe «Kohlenstoff» für die verkokten Produkte und «Graphit» für Produkte verwendet, die einer Hochtemperaturbehandlung unterzogen wurden. Der beim Graphitieren erreichbare Ordnungsgrad der Kristallite ist eine Funktion der Vorordnung und man stellt deshalb zunnehmend Kokssorten (Nadelkoks) mit einer hohen kristallinen Ordnung her. Etwa 90% der so gewonnenen Kohlenstoff- und Graphitproduktion werden für Elektroden für die Schmelzflusselektrolyse und für Lichtbogenöfen verwendet, die Restmenge verteilt sich auf eine Vielzahl von Anwendungen. Dank der Variabilität von Parametern wie Art, Anteil, Grösse und Orientierung der Kohlenstoffkörner, Porengrössenverteilung, Gehalt an Fremdelementen können Kohlenstoff- und Graphitsorten gut an den jeweiligen Verwendungszweck angepasst werden. Es lassen sich sowohl Produkte mit guten refraktären Eigenschaften (Feuerfest-Materialien) wie auch Produkte mit metallischen Eigenschaften herstellen. Die Elektrostahlproduktion wurde durch die Einführung neuer Verfahren zur Direktreduktion von Eisenerz und durch die Leistungssteigerung der Lichtbogenöfen verbessert. An die Qualität der Graphit-Elektroden wurden dadurch immer grössere Anforderungen gestellt. Die Elektroden bestehen aus mehreren langen zylindrischen Abschnitten die durch Gewindenippel verschraubt sind. Entsprechend den Abbrandverlusten der Elektrode von etwa 6 Kilogramm pro Tonne erzeugter Stahl werden fortlaufend neue Elektrodenabschnitte auf den Elektrodenstrang aufgeschraubt. Bei der Aluminiumherstellung beträgt der Anodenabbrand für vorgebrannte Anoden durchschnittlich etwa 470 Kilogramm pro Tonne Aluminium. Widerstandselemente, Beschichtungen, Kontakte Eine andere elektro-thermische Verwendung von Graphit sind Widerstandsheizelemente für Vakuum- und Schutzgasöfen. Kohlenstoff- und Graphitsteine werden von den meisten metallischen und keramischen Schmelzen nicht benetzt und eignen sich (soweit der Angriff von Luftsauerstoff beschränkt werden kann) ausgezeichnet als Auskleidung metallurgischer Öfen. Andere Beispiele für die Verwendung von Kohlenstoff und Graphit auf metallurgischem Gebiet sind Giessformen, Kokillen und Tiegel. Graphit ist wegen seiner Korrosionsfestigkeit, Wärmeleitfähigkeit und Impermeabilität auch ein vorteilhafter Werkstoff für gewisse Chemieapparate (Wärmeaustauscher, Kolonnen, Pumpen, Ventile). Die Undurchlässigkeit wird erreicht durch Imprägnierung mit einer CVD-Beschichtung mit Kohlenstoff (CVD = Chemical Vapor Deposition, siehe später, bei Diamant). Kohlenstoff und Graphit sind klassische Kontaktwerkstoffe für elektrische und mechanische Schleifkontakte, wie Bürsten, Schleifbügel, Gleitringe, und Kolbenringe, die ohne Schmierung arbeiten und bei werkstoffgerechter Verwendung einen sehr geringen Verschleiss aufweisen. Schliesslich sind noch zu nennen Elektroden für elektrisch abtragende Fertigungsverfahren (EDM), Spektralkohlen, Druckwiderstände und Kontaktstifte für Leclanche-Zellen. 5 Schmiermittel, Bremsbeläge, Bleistiftminen, Spezialanwendungen Als Schmiermittel wird Graphit verwendet, falls der Einsatz von Öl problematisch ist (z.B. weil es verharzt). Weitere wichtige Anwendungen sind Bremsbeläge (anstelle von Asbest). Ebenfalls ein wichtiger Anwendungsbereich, wenn auch mit abnehmender Tendenz, ist die Herstellung von Bleistiftminen. In gewissen Atomreaktoren (Graphitreaktoren) wird Graphit in riesigen Mengen zur Aufnahme der Brennelemente verwendet. Auch in der Raumfahrtindustrie spielt Graphit eine wichtige Rolle. Bläh-Graphit Aufgrund der Schichtgitterstruktur von Graphit können Atome oder kleine Moleküle zwischen die Kohlenstoff-Schichten eingelagert (interkaliert) werden. Dadurch entsteht so genanntes Blähsalz oder GIC (Graphite Intercalation Compound). Hochwertige Blähgraphite weisen einen grossen Anteil interkalierter Schichten auf. Bei den eingelagerten Molekülen handelt es sich meist um Schwefel- oder Stickstoffverbindungen. Unter Hitzeeinwirkung werden die Schichten durch Thermolyse ziehharmonikaartig auseinandergetrieben, die Graphitflocken expandieren. Je nach Blähgraphitsorte kann die Expansion bereits bei ca. 150°C einsetzen und nahezu schlagartig erfolgen. Bei freier Expansion kann das Endvolumen das Mehrhundertfache des Ausgangsvolumens erreichen. Die Eigenschaften des Blähgraphits, d.h. Starttemperatur und Blähvermögen, werden hauptsächlich von der Interkalationsgüte (wie viele der basisparallelen Schichten wurden interkaliert) und vom Interkalationsmittel bestimmt. Eine der Hauptanwendungen von Blähgraphit stellt der Flammschutz dar. Bei Hitzeeinwirkung expandiert der Blähgraphit und bildet eine Schutzschicht (Intumeszenzschicht) auf der Materialoberfläche. Graphit als Leitfähigkeitsadditiv Zur Herstellung antistatisch oder gar leitfähig ausgerüsteter Polymerwerkstoffe stehen eine Reihe von Möglichkeiten zur Verfügung, angefangen von dem wohl am verbreitetsten eingesetzten Russ über Kohlenstofffasern, Metallpulver, bis hin zu leitfähigen Polymeren. Durch gezielte Auswahl von Rohmaterial und Aufarbeitungsverfahren kann das Leitfähigkeitsverhalten von Graphiten optimiert werden, wobei die Partikelstruktur den bedeutendsten Einflussfaktor darstellt. Monogranularer Kohlenstoff/Graphit, Kohlenstoff-Fasern, Kohlenstoff-Folien Monogranulare Formen des Kohlenstoffs und Graphits enthalten keine unterscheidbaren Kokskörner mehr; die Struktur ist (bei Vernachlässigung der Porosität) praktisch einphasig. Am wichtigsten sind Kohlenstoff-Fasern, die durch Karbonisieren thermisch stabilisierter und gestreckter Chemiefasern hergestellt werden. Zugfestigkeit und Elastizitätsmodul derartiger Fasern betragen etwa 2 bis 3 kN/mm2 bzw. 200 bis 400 kN/mm2 bei einer Dichte um 1,8 g/cm3. Für die Technik sind Kohlenstoffasern vor allem wegen des günstigen Verhältnisses Festikgeit/Masse als Verstärkungskomponente von Verbundwerkstoffen interessant. In Form von Filz und Watte sind Kohlenstoffasern auch als flexible Wärmeisolierung von Hochtemperaturöfen und Apparaten besonders gut geeignet. Zu nennen ist auch Graphitfolie, die für Packungen, Gleitring- und Flachdichtungen verwendet wird. 6 Diamant Vorkommen Primär ist Diamant nur aus ultrabasischem Alkali-Olivingestein, dem Kimberlit, bekannt. Man nimmt an, dass Diamanten in etwa von 140-150 km Tiefe, d.h. bei etwa 50 Kilobar und in einem Temperaturbereich zwischen 600 und 1300°C kristallisieren. Allerdings sind in jüngster Zeit auch kleinste Diamanten in hochmetamorphen pelitischen Gesteinen entdeckt worden. Sekundär wird er in rezenten und fossilen Seifen (Konglomeraten) gefunden. Für die Weltversorgung sind die alluvialen Fluss-Seifen, marine Strandseifen sowie Terrassenschotter älterer Flusssysteme von grosser Bedeutung. Solche marinen Strand-Terrassen, die als Folge junger Hebungen im Küstengebiet gestaffelt erhalten sind, erstrecken sich an der südwestafrikanischen Küste auf mehr als 300 km. Die diamantführenden Ablagerungen liegen unter mächtigen jungen Flugsanden. Entstehung von Diamanten; Kimberlite Die meisten primären Diamantvorkommen sind an sogenannte Kimberlite gebunden und wurden lange Zeit allein als Kristallisationsprodukte einer kimberlitischen Gesteinsschmelze angesehen. Neben den berühmten südafrikanischen und russischen Vorkommen werden zunehmend auch in Kanada Kimberlite abgebaut. Man weiss heute aber, dass wirtschaftlich gewinnbare Diamantgehalte nicht nur in Kimberliten auftreten. Spektakulär war die Geschichte der Entdeckung diamantführender Gesteine in Australien. Nachdem man bereits Mitte des 19. Jahrhundert als «Nebenprodukt» der Goldgewinnung sporadisch Diamanten gefunden hatte, entdeckte man zwischen 1968 und 1979 in New South Wales «Kimberlite», die später als diamantführende Olivin-Lamproite bezeichnet wurden. Mit dem Auffinden dieser Diamantvorkommen in nicht kimberlitischen Gesteinen, welche in Australien (Argyle-Lagerstätte) in einem jüngeren Kraton auftreten, sowie mit dem Nachweis von Diamanten in metamorphen Gesteinen wurden die wissenschaftlichen Vorstellungen der Diamantbildung revidiert. Australien gehört heute zu den Leadern auf dem Diamant-Weltmarkt (ca 30%)! 7 Kimberlite, Lamproite, Orangeite Kimberlite, Lamproite und Orangeite gehören zu den wirtschaftlich bedeutenden primären Diamantquellen. Trotz der unterschiedlichen Bezeichnungen besitzen diese Gesteine teilweise sehr ähnliche Zusammensetzungen, Merkmale und Eigenschaften. Es handelt sich um: • vulkanische Schlotfüllungen, oft als Brekzien (mit Fremdgesteins- Bruchstücken) ausgebildet • kieselsäurearme (ultrabasische) und teilweise kaliumreiche Gesteine • Gesteine, die fast ausschliesslich «dunkle» Bestandteile führen • Gesteine, deren primärer Mineralbestand teils intensiven Umwandlungsvorgängen unterworfen war (Serpentinisierung, Karbonatisierung etc.) Die Unterscheidung von Kimberliten, Orangeiten und Lamproiten erfolgt auf der Grundlage des Mineralbestandes und der geochemischen Eigenschaften. Kimberlite sind petrographisch und geochemisch gesehen ultramafische Gesteine – Alkaligesteine mit geringen SiO2-Gehalten und vergleichsweise hohen Magnesium- und Alkalianteilen. In Kimberliten sind viele Elemente angereichert, die in anderen ultramafischen Gesteinen nicht vorkommen; dazu gehören Rb, Sr, Cs, Ba, Seltenerde-Elemente, Nb, Ta, Pb, Th und U. Sie enthalten ausserdem einen hohen Anteil leichtflüchtiger Bestandteile (H2O und CO2 bis gegen 9% als Karbonat). Lamproite zählt man der hohen Kaliumgehalte wegen (6–8% K2O) zu den Ultra-Alkaligesteinen. Sie zeigen im Vergleich zu Kimberlit geringere Mg- und Ca-Gehalte sowie höhere Si- und AlAnteile. Die Häufigkeit des leichtflüchtigen CO2 ist aber wesentlich geringer. Der hohe Kaliumgehalt der Lamproite wird durch Phlogopit, Sanidin und Leucit verursacht; die beiden letzten treten in Kimberliten nicht auf. Im Hinblick auf diese Besonderheiten und die oft hohen Karbonatgehalte bestehen enge Beziehungen von Lamproiten zu karbonatitischen Gesteinen. Weltweit sind 50 Lamproit-Vorkommen untersucht; nur sieben davon führen Diamanten (wirtschaftliche Gehalte treten allerdings nur im Argyle-Lamproit in Australien auf). 8 Orangeite: Diese von R. H. Mitchell (1996) eingeführte Bezeichnung wird in der petrographischen Nomenklatur offiziell nicht verwendet. Bereits frühzeitig wurden aber bei manchen «Kimberliten» beträchtliche Schwankungen in der Zusammensetzung sowie bei den Isotopensignaturen erkannt. Deshalb definierte man einfach Typ I-Kimberlite (Kimberlite im eigentlichen Sinne) und Typ II Kimberlite (Orangeite). Danach stehen die Orangeite im Hinblick auf die Zusammensetzung und den Chemismus zwischen den Kimberliten und den Lamproiten. Explosionsröhren: die «Pipes» Alle drei Gesteine – Kimberlite, Lamproite und Orangeite – bilden Schlot- bzw. Kraterstrukturen, die durch eine explosiv-vulkanische Platznahme entstanden. Aus diesem Grund spricht man auch von Explosionsröhren, Diatremen oder ähnlichem; oft wird auch nur der Begriff «Pipe» verwendet. Ein nicht erodierter Kimberlit-Schlot besteht aus drei Zonen; den oberen Teil bildet ein typisch trichterförmiger Krater. Die Durchmesser der Pipes an der Erdoberfläche variieren stark, von 10m bis 1,5 km. Der Kraterzone folgt der eigentliche Förderkanal, das Diatrem, und mit zunehmender Tiefe verengt sich der Schlot. In der dritten Zone, der Wurzelzone, löst sich der verjüngte Zufuhrkanal in ein System von Gangspalten auf, die wahrscheinlich zum Bildungsort der Gesteine führen. Die Kimberlit-Pipes werden von unterschiedlichen vulkanischen Ganggesteinen begleitet, die älter oder auch jünger als die Kimberlite sein können (flachliegende Lagergänge/Sills oder steilstehende Gänge). Die Füllmasse eines Schlotes besteht aus einer Brekzie von peridotitartigem Gestein «Kimberlit», Tuff und Nebengesteinsstücken. Dieser «blue ground» ist an der Oberfläche zu einem weichen Gestein gelber Farbe, dem «yellow ground» zersetzt. Die vulkanische Explosion erfolgte in mehreren aufeinander folgenden Phasen mit qualitativ unterschiedlicher Diamantförderung. Die Diamanten finden sich eingesprengt in der Brekzie. Die Gehalte an Diamant sind sehr gering; auch sehr reiche Minen haben nicht mehr als 0,1 g Diamant pro Tonne. Der Abbau erfolgt im Tiefbau bis auf etwa 1100 m. In der Republik Südafrika stammen mehr als 80% der geförderten Diamanten aus Kimberlit-Pipes und 18% aus Seifen, welche die beste Edelsteinqualität liefern. Ähnliche Lagerstätten wurden 1954 in der sibirischen Taiga und in den späten Neunzigerjahren in Kanada entdeckt. Die primären Lagerstätten vieler alluvialer Fluss-Seifen mit Diamanten sind bisher wegen teilweise mehrfacher Umlagerung unbekannt; für die sekundären Lagerstätten in Angola, Zaire, Kongo, Ghana, Sierra Leone werden präkambrische Ultrabasite als Muttergesteine angenommen, ebenso für die brasilianischen Vorkommen. Diamant als Edelstein Der Diamant ist als Edelstein seit den ältesten Zeiten bekannt und nahm wegen seiner grossen Härte von Anfang an eine Sonderstellung ein. Sicher nutzte man schon im Altertum seine Härte zum Schneiden harten Materials, z.B. anderer Edelsteine, aus, doch ist seine bedeutende industrielle Verwertung erst in jüngster Zeit aufgekommen. Im Altertum stammten die Diamanten wohl vorwiegend aus Indien. Die grossen Funde erfolgten aber ab ca1865 in der Südafrikanischen Union. Lange Zeit waren afrikanische Länder die Hauptproduzenten, australische und kanadische Fundstellen haben sie heute überholt. Härte, Härteskala Der Diamant ist das härteste Mineral mit der Härte 10 nach Mohs. Im Diamantgitter ist jedes Kohlenstoffatom mit vier benachbarten Kohlenstoffatomen über eine feste, kovalente Bindung verbunden. Insgesamt entsteht so ein dreidimensional venetztes Atomgitter – ein einziges «Riesenmolekül». Aus den Atomabständen lässt sich errechnen, dass entlang eines Millimeters von der Kante eines Diamant-Oktaeders über 9'000'000 Kohlenstoffatome aneinandergereiht sind. Weil sich die vier bindenden Elektronenpaare in ihren Elektronenwolken gegenseitig abstossen, sind die Bindun- 9 gen räumlich auf grösstmöglichem Abstand fixiert: in tetraedrischer Anordnung. Diese aussergewöhnlich festen Bindungen machen den Diamanten zum härtesten und am schwersten deformierbaren Kristall. Dass man Diamant überhaupt bearbeiten kann, beruht auf unterschiedlich dichten Atombesetzungen in verschiedenen Raumrichtungen. Trifft einen Diamant ein harter Schlag, wird die Energie durch ein Aufbrechen von Bindungen absorbiert: Der Kristall zerbricht. Nur wenn der Schlag genau entlang einer Gitterebene (parallel zum Oktaeder) ausgeführt wird, kann der Kristall glatt in zwei Teile gespalten werden! Bei kleinen Abweichungen verteilt sich die Energie auf viele Ebenen: Der Kristall zerspringt in viele Teile. Härte: Die Härte eines Stoffes ist im Prinzip immer durch die Bestimmungsmethode definiert. In der Technik wendet man ganz unterschiedliche Messverfahren und -geräte an. Man misst zum Beispiel die Eindringtiefe, die ein genormter Prüfkörper (Kegel, Kugel, Pyramide) bei einer Druckanwendung im Prüfling hinterlässt, und schliesst dann auf die Härte des Stoffes. Das Mikrohärte-Messverfahren nach Vickers zeigt, dass Diamant wesentlich härter ist, als die Zahl 10 zum Ausdruck bringen kann. Die Vickers Härte beträgt bei Diamant über 10000 gegenüber gut 1000 bei Quarz! Die Grafik zeigt deutlich den eigentlichen Unterschied zwischen Härte 9 und 10. Für die Bearbeitung von Hartstoffen ist weniger der Widerstand eines Stoffes gegen das Eindringen eines Prüfkörpers interessant, sondern eher der Widerstand gegen Abschliff. Mit einem speziellen Messverfahren kann man die Schleifhärte nach Rosiwal bestimmen. Mit diesem Verfahren wird die Überlegenheit des Superhartstoffes Diamant noch deutlicher. Setzt man nach dem Rosiwal Verfahren den Wert für Korund auf 1.000, ergibt sich für Quarz der Wert 120; Topas erreicht 175 und Diamant den sagenhaften Wert 140'000. Nach diesem Verfahren ist Diamant also 140mal härter als Korund (Edelsteine Rubin und Saphir) – in der Mohs-Skala ist dies jedoch nur ein einziger Schritt: von 9 bis 10! Die feste Bindung der Kohlenstoffatome im Diamant erklärt noch weitere Eigenschaften: • Hervorragende Wärmeleitfähigkeit. Die Atome sind «hart» gekoppelt – Wärmeschwingungen breiten sich rasant schnell im Gitter aus (Wärme ist Bewegung von Atomen, Wärmeleitung die Impulsweitergabe von Atom zu Atom). Diese Wärmeleitung schützt z. B. beim Sägen von Diamanten vor Überhitzen. • Klarheit. In reinen Diamanten kann sichtbares Licht nicht mit den Elektronen in Wechselwirkung treten und absorbiert werden, deshalb sind sehr reine Diamanten farblos. • Hohe Lichtbrechung. Die hohe Dichte führt zur entsprechend hohen Lichtbrechung. • Elektrisch isolierend. Da fest fixierte Elektronen nichts zum Leiten von Strom beitragen können, ist reiner Diamant ein Nichtleiter. Halbleiter-Eigenschaften bekommt Diamant erst mit bestimmten Beimengungen (Dotierungen). 10 • Der Schmelzpunkt des Diamanten ist aufgrund des starken Zusammenhaltes der Atome mit rund 4100 °C ausserordentlich hoch. Dies ist wohlgemerkt der Schmelzpunkt - verbrennen kann Diamant ab ca. 700 °C. Handel und Wert der Diamanten: Als Edelstein (Brillant) findet der Diamant Verwendung in der Schmuckindustrie. Die Bewertung von Juwelierware erfolgt nach Farben, die vom feinsten blauweiss (Jaeger) über weiss (Wesselton), leicht gelblich (Crystol) gelblich (Cape) bis gelb (Yellow) in 12 Stufen unterteilt werden. Um die bisherige subjektive Farbempfindung auszuschliessen, hat das Gemmological Institute of America die elektronische Farbmessung mit Fotozelle eingeführt. Grössere Steine werden immer einzeln verhandelt. Normale Rohware geht in Losen, die qualitativ unterschiedliche Diamanten enthalten, über den Tisch. Hier besteht die Schwierigkeit darin, das mögliche Gesamtergebnis realistisch einzuschätzen und sich nicht durch einzelne schöne Steine blenden zu lassen, die sich immer auffällig aus einer Partie hervorheben. Der Käufer eines Rohsteins muss das Endprodukt, den geschliffenen Stein, ganz genau vor Augen haben und alle Schwierigkeiten und Überraschungen, die im Bearbeitungsprozess auftreten können, einkalkulieren. Bei Diamant kann es schliesslich um sehr hohe Beträge gehen: So wechselte ein 262.7 Karat schwerer Diamant aus Guinea 1994 in Antwerpen für 3,2 Millionen US-Dollar den Besitzer. Auf dem offenen Diamantmarkt wird gefeilscht. Eine Ausnahme ist der geschlossene Markt des De Beers Konzerns. Dieser Konzern kontrolliert dem Wertumfang nach rund 70% des Rohdiamanthandels. Zehnmal im Jahr wird den ca. 300 von De Beers zugelassenen Käufern in der Central Selling Organisation (CSO) ein Sortiment zum Kauf angeboten. Es besteht aus Diamanten unterschiedlicher Grösse und Qualität. Die Zusammensetzung wechselt je nach Marktentwicklung. Nutzung von Natur- und Industriediamanten Die über 2500 Jahre als Werkzeugstoff bewährten Naturdiamanten werden für spanende (Bohren, Trennen, Schneiden, Schleifen, Läppen und Polieren) oder spanlose Anwendungen (Ziehmatrizen, Härteprüfer, Druckstempel, Lager, Anschläge, Tastwerkzeuge) eingesetzt. Materialien, die bevorzugt mit Diamant bearbeitet werden, sind neben Beton, Kunst- und Naturstein vor allem Hartmetalle, Titanlegierungen, Edelmetalle, Buntmetalle, Hartkeramik, Edelsteine, G1äser, Plastikwerkstoffe und Schichtpressstoffe. Es gibt viele Materialien, die zwar nicht hart sind, aber ausserordentlich verschleissend wirken, so zum Beispiel Elektrographit, Holzspanplatten und Papier. In solchen Bereichen hat sich der Einsatz von Diamant als Schneidstoff gut bewährt. Der strategische Rohstoff Diamant als ultraharter Schneidstoff ermöglichte in vielen Anwendungsbereichen höhere Präzision und Produktivität. Aber erst das Aufkommen der Hartmetalle (gesinterte Metallcarbide), die mit klassischen Schleifmitteln nur schwer bearbeitbar waren, verschaffte dem Diamanten als effektives Arbeitsmittel den Durchbruch. Diamant als Werkzeug-Werkstoff wurde schnell zum unverzichtbaren Rationalisierungsfaktor. Die Produktivität - und vor allem auch die Erzeugnisqualität - wurde im Maschinenbau, in der optischen Industrie und beim Bau wissenschaftlicher Geräte entscheidend verbessert. Im 2. Weltkrieg und zu Zeiten des Kalten Krieges wurde der Industriediamant als ein strategischer Rohstoff behandelt; zeitweise unterlag er sogar einem Embargo. Mit Naturdiamanten konnte der steigende Bedarf allerdings nicht gedeckt werden, obwohl man über 80% der gewonnenen Diamanten in der Industrie einsetzte. Die Massenanwendung von Industriediamanten und die Erschliessung immer neuer Einsatzbereiche ging deshalb mit der Entwicklung der Diamantsynthese einher (1954 gelang General Electric Comp. die Diamantsynthese). Völlig neue und ungeahnte Per- 11 spektiven eröffneten sich nach neuen Syntheseverfahren, bei denen eine Diamantabscheidung unter normalen Druckbedingungen aus heissen Gasphasen erfolgt (CVD = Chemical Vapor Deposition). Heute können bereits Diamantplatten oder Schichten von mehreren mm Dicke und bis zu 15 cm Durchmesser hergestellt werden - und zwar relativ preiswert. CVD-Diamant wird deshalb natürliche Industriediamanten und die klassischen Synthesen wohl langsam verdrängen. Industriediamanten Die Industrie nutzt sowohl natürliche als auch synthetische Diamanten. Alle Naturdiamanten, die sich zum Bezugszeitpunkt nicht gewinnbringend zu Schmucksteinen verarbeiten lassen, werden als Industrieware eingestuft. Der (Übergang ist fliessend und sogar zeit- bzw. zeitgeschmackabhängig: Ein Material, das noch 1980 zweifelsfrei zur Industrieware gehörte, wurde wenige Jahre später zu Schmucksteinen verarbeitet. Im Industriediamantgeschäft bezieht sich die Terminologie der Sorten auf die Kristallform oder auf den konkreten Anwendungszweck: Bort (auch: Boort, Board) bezeichnet die unterste Qualitätsstufe; sie umfasst das Rohmaterial zum Aufmahlen für Diamantgranulate und Polierpulver. Es handelt sich um unregelmässig verwachsene, einschlussreiche, opake Kristalle, Aggregate, irregulär verwachsene, polykristalline Gebilde oder Bruchstücke, die sich nicht zur Verarbeitung in Einkornwerkzeugen eignen. Drills oder Drillings sind Diamanten mit kugeligem Habitus, die vorzugsweise in Bohrkronen eingesetzt werden. Carbonado ist eine polykristalline Varietät; winzige, nur ca. 20 Mikrometer grosse Kristallite sind unregelmässig miteinander verwachsen. Carbonado bildet unregelmässige schwarzgraue bis schwarzbraune Aggregate von koksartigem Aussehen. Da keine bevorzugte Spaltbarkeit auftritt, sind sie besonders zähfest. Carbonados werden nahezu ausschliesslich zu Bohrwerkzeugen verarbeitet. Ballas bildet kugelige, radialstrahlig aufgebaute Aggregate. Auch Ballas ist polykristallin; die Kristallite sind 30 –40 Mikrometer gross. Die Verwendung ist ebenfalls auf Bohrwerkzeuge begrenzt. Points oder Spitzen nennt man reiskorn- bis nadelförmige Diamanten, die zu MehrkornAbrichtwerkzeugen verarbeitet werden. Neben naturgewachsenen Kristallen werden künstlich gerundete Steine als «treated» oder «processed» Drills oder Points angewendet. Triangles oder Dreiecknahtsteine heissen flache, nach dem Spinellgesetz verzwillingte Kristalle, die man als Profilabrichter in Diaform-Abrichtgeräten benutzt. Schleifkörper mit komplizierter Geometrie können bei Verschleisserscheinungen mit geschliffenen Diamanten nachprofiliert und wieder schneidfähig gemacht werden. Shapes oder Shapetools sind flache (flats) oder lang verzerrte Kristalle (elongated stones). Das Haupteinsatzgebiet ist das Glanzdrehen oder Fräsen von Edelmetallen oder Kunststoffen sowie das Nachprofilieren von Schleifkörpern. Dressers sind Abrichtdiamanten: Oktaeder und Rhombendodekaeder mit gut entwickelten Spitzen. Mit den natürlichen Kristallspitzen werden feste Schleifkörper geometrisch nachprofiliert und schneidfähig gehalten. Dies sind Ziehsteindiamanten: transparente weitgehend einschlussfreie, regelmässige Kristalle. Die feinen Löcher werden mit Lasern gebohrt und mit Ultraschalltechnik nachgearbeitet; die Bobrungen werden auf Hochglanz poliert. Feinste Drähte – in der Dicke nur noch der Bruchteil eines Menschenhaares – werden durch diese Ziehsteine auf immer dünnere Durchmesser verformt. Jährlich 100 Tonnen künstliche Diamanten Heute werden weltweit in über 20 Industriestaaten Diamanten künstlich produziert, um den ständig steigenden Bedarf zu decken (praktisch ausschliesslich Industriediamanten). Dazu kommt, dass immer wieder neue Anwendungen des kostbaren Werkstoffs mit den exotischen Eigenschaften 12 entwickelt werden. Diamant ist längst zum industriellen Schlüsselmineral geworden. Mit jährlich rund 100 Tonnen synthetisch hergestellter Diamanten wird die Menge der bergmännisch gewonnenen natürlichen Diamanten um ein Mehrfaches übertroffen. Es fehlte nicht an Versuchen, Diamanten auch in einer für Schmuckzwecke geeigneten Form herzustellen. Schon kurz nach den ersten Winzlingen startete man Versuche zur Züchtung grösserer Einkristalle - reiner als natürliche Diamanten – für spezielle technische Anwendungen. Mittlerweile produzieren Sumitomo in Japan (seit 1985) und De Beers (seit 1987) kontinuierlich grössere Einkristalle für die Industrie. Doch sie sind vorläufig noch durchgängig gelb. Neben den genannten Herstellern sind einzelne Gruppen auch bei der Synthese weisser Diamanten in Edelsteinqualität erfolgreich, in Russland ebenso wie in den USA. Man beherrscht auch die Synthese herrlich blau gefärbter Diamanten. Diese durch Dotierung (vor allem mit dem Element Bor) hergestellten Diamanten besitzen wie ihre natürlichen Vorbilder Halbleiter-Eigenschaften. Diamant aus der Gasphase Die ersten Patente für Verfahren, polykristalline Diamantschichten aus heissen Gasen abzuscheiden, wurden 1956 in Moskau angemeldet. Auf Diamantoberflächen wurden mittels thermischer Zersetzung von Tetrabrom- und Tetrajodmethan feine Diamantschichten erzeugt. Zwei Jahre später gelang auch in den USA die Herstellung von Diamantschichten auf der Grundlage eines Kohlenmonoxid/Kohlendioxid-Gemisches. Der Vorgang erscheint denkbar einfach: In beiden Fällen handelt es sich um eine zweistufige thermische Abscheidung: Zuerst wird Kohlenstoffgas zu Diamant und Graphit umgewandelt; anschliessend wird der Niederschlag mittels Wasserstoff bei ca. 1000 °C und nur rund 50 bar vom Graphit befreit, so dass die Diamantschicht übrigbleibt. Inzwischen ist die «Chemical Vapour Deposition» (CVD-Methode) weiter optimiert worden: Man kann heute industriemässig in einem einzigen, kontinuierlichen Prozess auf Fremdmaterialien (Silizium, Metalle) zusammenhängende Diamantschichten erzeugen. Diese können in der Computertechnik und Mikroelektronik als Wärmesenke, aber auch im optischen Bereich eingesetzt werden. Diamant aus aus Methan-Wasserstoff-Plasma 1999 gelang es Peter Koidl und seinem Team vom Fraunhofer-Institut für Angewandte Festkörperphysik in Freiburg in einem speziellen Reaktor Diamantscheiben bis zu 15 cm Durchmesser und 3 mm Dicke preiswert herzustellen! Die polykristalline Diamantsubstanz wird aus einem mit Mikrowellen erzeugten Methan-Wasserstoff-Plasma direkt aus der Gasphase abgeschieden. Aus Simulationen ergab sich, dass ein eiförmiger Reaktor die beste Voraussetzung dafür bietet, um das Plasma möglichst lange an einer gewünschten Stelle stabil zu halten. Nur so können sich DiamantKristallite gleichmässig auf einem Substrat, Schicht für Schicht, abscheiden. Aus der erstaunlichen Grösse und den geringen Kosten ergeben sich wieder neue Einsatzbereiche für Diamant. 13 Fullerene, Graphene Im Jahr 1985 kam zu den bisher bekannten Modifikationen des Kohlenstoff eine neue reine Form hinzu. Mit der Entdeckung der Fullerene durch Curl, Smalley und Kroto (Nobelpreis 1996) und insbesondere durch den präparativen Zugang zu den Fullerenen im Jahr 1990 wurde diese neue Modifikation des Kohlenstoffs intensiv untersucht. Struktur und Stabilität Die bekanntesten Fullerene bestehen aus 12 Fünfecken, die von einer unterschiedlichen Anzahl an Sechsecken umgeben sind. Durch die Unmöglichkeit, eine Ebene mit Fünfecken vollständig zu bedecken, ergibt sich die sphärische Wölbung. C60 hat Ikosaeder-Symmetrie. Die Fullerene mit mehr als 60 C-Atomen weichen zwangsläufig von der Kugelform ab, C70 etwa ist ein Ellipsoid. Die Stabilität eines Fullerens ist dann am grössten, wenn die Fünfecke nicht aneinander grenzen, sondern nur von Sechsecken umgeben sind (Fünfeckregel), wenn der aromatische Charakter ausgeprägt ist, und/oder wenn es eine magische Zahl (60,70,76 usw.) an C-Atomen besitzt Das mit Abstand am besten erforschte Fulleren ist C60, das zu Ehren des Architekten Buckminster Fuller Buckminster-Fulleren genannt wurde. Es gleicht den von ihm konstruierten geodätischen Kuppeln, welche aus 12 Fünfecken und 20 Sechsecken bestehen und zusammen ein abgestumpftes Ikosaeder (Archimedischer Körper) bilden. Da ein Fussball die gleiche Struktur hat, wird es im deutschen Sprachgebrauch auch Fussballmolekül genannt; im englischen Sprachbereich oft auch Bucky Ball. Fullerene kommen in natürlicher Form in verschiedenen Gesteinsformationen vor. Es wurde unter anderem über das Vorhandensein von Fullerenen im Shungit (Shunga, Russland), in Kreide-Tertiär Grenzschichten (Neuseeland) und in Kratern von Meteoriteneinschlägen (Sudbury, Kanada) berichtet. Herstellung Graphit wird unter Schutzgas mit einer Widerstandsheizung oder am Lichtbogen verdampft. Dabei entstehen kleine Kohlenstoff-Moleküle wie C2, C4 und C6 die bei Abkühlung wieder zu grösseren Einheiten zusammenfallen. Im Russ, der nach Abkühlung zurückbleibt, werden Fullerene, aber auch Kohlenstoff-Nanoröhren gefunden. Durch Chromatographie können die Bestandteile des Russes aufgetrennt und die Fullerene isoliert werden. Eigenschaften Fullerene sind ein braun-schwarzes Pulver von metallischem Glanz. Sie lösen sich in organischen Lösungsmitteln unter charakteristischer Färbung. An der Luft zersetzen sich die Fullerene langsam unter Bildung von Graphit. 14 Heute sind neben den klassischen Fullerenen noch weitere Kohlenstoff-Allotrope bekannt, so beispielsweise Kohlenstoff-Nanoröhrchen oder Graphen, ein ultradünnes Netz aus Kohlenstoffatomen. Gemeinsam ist all diesen Modifikationen die sehr grosse Oberfläche und die sich aus der Anordnung von 5er und 6er Ringen ergebenden strukturellen «Platzprobleme», was zur «Wellung», respektive Röhren-, Kugel- oder Ellipsoidenform führt. Dadurch lassen sich extrem gut fremde Atome oder Moleküle in diese Strukturen bringen und daraus ergeben sich interessante neue Anwendungsgebiete (Medizin, Raumfahrt etc.). Entsprechend gross ist denn auch der aktuelle Forschungsaufwand, nicht zuletzt weil der Rohstoff Kohlenstoff sehr günstig ist und weil die Fabrikationstechnik, wenn man den «Trick» einmal kennt, recht einfach ist. Graphen beispielsweise kann mittels geeignetem Klebeband aus Graphit gewonnen werden, indem man kontinuierlich dünnere Schichten abzieht! Literatur: Edward I. Erlich, W. Dan Hausel (2002): Diamond Deposits - Origin, Exploration and History of Discovery. - Society for Mining, Metallurgy and Exploration Inc. SME, ISBN 0-87335-213-0, 374p. Alois Haas, Ludwig Hödl, Horst Schneider (2004): Diamant - Zauber und Geschichte eines Wunders der Welt. - Margot und Friedrich Becke Stiftung (Hrsg.), Springer Verlag, ISBN 3-540-408770. 256S. Roger H. Mitchell (1986): Kimberlites - Mineralogy, Geochemistry, and Petrology. - Plenum Press, New York J. Barry Dawson (1980): Kimberlites and their Xenoliths. - Springer Verlag Berlin,Heidelberg, Deutschland J. E. Field (1979): The Properties of Diamond. - Academic Press London, England Henry O.A. Meyer and Othon H. Leonardos (1994): Diamonds: Characterization, Genesis and Exploration. - Volume 2 Brazil 1991 Fifth International Kimberlite Conference; Companhia de Pesquisa de Recursos Minerais-CPRM, Rio de Janeiro, Brasil Diamanten-Fibel – Handbuch der Diamanten-Graduierung. 8. Erweiterte und neubearbeitete Auflage 1991. Verena Pagel-Theisen. ISBN 3-9800434-0-1 (ZB GS 6447) Vicky Paterson (2005): Diamonds. - Natural History Museum, London, ISBN 0-565-09196-0, 112p (Bildband, Populärwissenschaftlich). Lapis (extra Lapis No. 18) Heinz Mahlzahn (2000): Diamant - der extreme Edelstein, das geniale Werkzeug. - Lapis, München, Weise, 2000. ISBN 3-921656-53-2, 104S. Walter L. Pohl (2005): Mineralische und Energierohstoffe. E. Schweizerbartsche Verlagsbuchhandlung, 528 S. ISBN 3-510-65212-6 Stephen E. Kesler (1994, 2002): Mineral Resources, Economics ant the Environment. - Macmillan College Publishing Company. 394 p. ISBN 0-02-362842-1 Peter W. Harben & Milos Kuzvart (1996): Industrial Minerals. A Global Geology.- Industrial Minerals Information Ldt, Metal Bulletin PLC, London, 462 S., ISBN 1 900663 07 4 Anke Krüger (2007): Neue Kohlenstoffmaterialien, Eine Einführung. Teubner Verlag, Wiesbaden, 472 S., ISBN 978-3-519-00510-0