Lösung zur Übungsklausur - Uni
Werbung

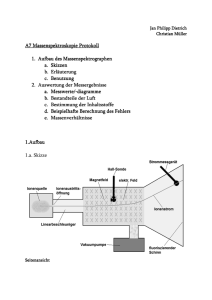
Übungsklausur zum chemischen Praktikum für Studierende mit Chemie als Nebenfach 1. (10P) Was ist richtig (mehrere Richtige sind möglich)? a) Fructose besitzt 5 Kohlenstoffatome. FALSCH, Fructose besitzt 6 Kohlenstoffatome b) Die alpha- und beta-Ringform eines Zuckers liegen in wässriger Lösung im Gleichgewicht vor. RICHTIG c) Die D- und L-Form eines Zuckers liegen in wässriger Lösung im Gleichgewicht vor. FALSCH, D- und L-Form sind Enantiomere. Bis auf wenige Ausnahmen liegen Enantiomere nicht im Gleichgewicht miteinander vor. d) Saccharose ist ein Disaccharid. RICHTIG e) Glucose und Fructose sind Konstitutionsisomere. RICHTIG, sie haben beide die gleiche Summenformel bei unterschiedlicher Konnektivität 2. (8P) a) Zeichnen Sie D-Glucose in der Fischer-Projektion. b) Zeichnen Sie L-alpha-Idopyranose in der Haworth-Projektion. L-alpha-Idopyranose Achtung: Ich möchte an dieser Stelle darauf hinweisen, dass in der Lösung von Übung 7 die Strukturen von alpha- udn beta-L-Fructofuranose versehentlich vertauscht waren. Der Übungszettel liegt nun korrigiert vor. Ich bitte dies zu entschuldigen. 3. (10P) a) Welche Funktion hat ein Scheidetrichter? (ein Satz) Ein Scheidetrichter wird verwendet, um zwei nicht mischbare Flüssigkeiten voneinander zu trennen. b) Welche der folgenden Lösungsmittel sind mit Wasser mischbar? Bitte einkreisen. n-Pentan, Aceton, Ethanol, Benzen (Benzol), Chloroform c) Welche der folgenden Lösungsmittel sind mit n-Hexan mischbar? Bitte einkreisen. n-Pentan, Aceton, Ethanol, Benzen (Benzol), Chloroform (d.h. ALLLE) d) Nennen Sie drei Methoden mit denen Sie die Konzentration einer Salzsäurelösung bestimmen können. - Titration - pH-Elektrode - pH-Papier mit Farbindikatoren (grob) e) Mit welcher Methode können Sie ein Aminosäuregemisch trennen? Dünnschichtchromatographie 4. (10P) Was ist richtig (mehrere Richtige sind möglich)? a) Konzentrierte Natronlauge zerstört die Sekundärstruktur von Proteinen. RICHTIG. Da Natronlauge die Primärstruktur zerstört, wird die Sekundärstruktur automatische ebenfalls zerstört. b) Die Tertiärstruktur besteht aus mehreren Proteinen. FALSCH, die Quartärstruktur besteht aus mehreren Proteinen. c) Die alpha-Helix wird durch Disulfidbrücken zwischen den Cystein-Bausteinen stabilisiert. FALSCH, die alpha-Helix wird durch Wasserstoffbrückenbindungen stabilisiert. Disulfidbrücken sind eine Stabilisierungsmöglichkeit der Tertiärstruktur. d) Die Hitzedenaturierung eines Proteins kann reversibel sein. RICHTIG. Im Falle von Hühnereiweis ist die Hitzedenaturieren irreversibel. Es gibt jedoch auch Proteine die Ihre natürliche Faltung nach Abkühlung wieder herstellen können. e) Die Aminosäuren in einem Protein sind über Imid-Bindungen miteinander verknüpft. FALSCH, Aminosäuren in einem Protein sind über Amide miteinander verknüpft, welche im Falle von Aminosäuren Peptidbindung heißen. 5. (10P) Zeichnen Sie die Valenzstrichformel des Tripeptids Glutaminsäure-Alanin-Prolin. Für den Notall: Falls Sie eine der Aminosäuren nicht kennen, ersetzen Sie diese durch eine andere proteinogen Aminosäure Ihrer Wahl (-1P pro ersetzter Aminosäure; es nicht erlaubt zweimal durch die gleiche Aminosäure zu ersetzen). 6. (14P) Zeichnen Sie die Titrationskurven von 100 mL 1 molarer Salzsäure + 200 mL 1 molarer Ammoniaklösung UND 100 mL 1 molarer Ammoniaklösung + 200 mL 1 molarer Salzsäure (pKB(NH3) = 4,75). a) Welche pH-Werte liegen jeweils zu Beginn und zum Ende der Titration vor? (Rechnung!) b) Welcher pH-Wert liegt am Äquivalenzpunkt vor? (Rechnung!) c) Markieren Sie (falls vorhanden) den Pufferbereich. d) Markieren Sie die Neutralpunkte. a) Salzsäure + Ammoniak Beginn: HCl, c = 1 mol/L starke Säure --> Ende: Stoffmenge der Säure vor Titration Salzsäure, V = 100 mL, c = 1 mol/L → Die Stoffmenge der Base Ammoniak ist n(Ammoniak) = 0,2 mol (weil V = 200 mL, gleiche Rechnung). 0,1 mol HCl + 0,2 mol NH3 → 0,1 mol NH4Cl + 0,1 mol NH3 Das Volumen beträgt am Ende der Titration 300 mL = 0,3 L. → c(NH4Cl) = 0,33 mol/L und c(NH3) = 0,33 mol/L Das Gemisch aus NH4Cl und NH3 ist ein basischer Puffer! Henderson-Hasselbalch-Gleichung für basische Puffer Ammoniak + Salzsäure Beginn: NH3, c = 1 mol/L schwache Base → Ende: Stoffmenge der Base vor der Titration V = 0,1 L, c = 1 mol/L → n = 0,1 mol Stoffmenge der Säure vor der Titration V = 0,2 L, c = 1 mol/L → n = 0,2 mol 0,1 mol NH3 + 0,2 mol HCl → 0,1 mol NH4Cl + 0,1 mol HCl Am Ende der Titration liegt eine sehr schwach saures Salz und eine sehr starke Säure vor. Der Beitrag des schwach sauren Salzes zum pH-Wert ist vernachlässigbar. Daher muss nur die starke Säure bei der Berechnung berücksichtigt werden. Das Volumen beträgt am Ende der Titration 300 mL = 0,3 L. → c(HCl) = 0,33 mol/L starke Säure → b) Der Äquivalenzpunkt ist erreicht, nach Zugabe von 100 mL des Titranden, da Säure und Base hier die gleiche Konzentration hatten. Die Stoffmenge der Base und Säure vor der Titration sind jeweils 0,1 mol (siehe Rechnungen in Aufgabe a). 0,1 mol NH3 + 0,1 mol HCl → 0,1 mol NH4Cl Es entstehen 0,1 mol NH4Cl. Dies ist das Salz der korrespondierenden Säure von Ammoniak und daher leicht sauer. Das Volumen der Lösung am Äquivalenzpunkt beträgt 200 mL. Die Konzentration ist daher c(NH4Cl) = 0,5 mol/L. Die pH-Wert-Berechnung wird durchgeführt, wie für eine schwache Säure. Der pKS-Wert der zu Ammoniak korrespondierenden Säure NH4+ kann über den pKB-Wert von Ammoniak erhalten werden. pKS(korrespondierende Säure) = 14 – pKB(schwache Base) = 9,25 Mit Hilfe der berechneten Punkte lassen sich die Titrationskurven gut zeichnen. Salzsäure (starke Säure) + Ammoniak (schwache Base) ACHTUNG: diese Skizze zeigt nur die Grundform. Die 25 cm3 sind falsch. In unserem Beispiel wären es 100 mL am Äquivalenzpunkt. Der Pufferpunkt, Pufferbereich und Neutralpunkt sind hier nicht gekennzeichnet. Ammoniak (schwache Base) + Salzsäure (starke Säure) ACHTUNG: diese Skizze zeigt nur die Grundform. Die 25 cm3 sind falsch. In unserem Beispiel wären es 100 mL am Äquivalenzpunkt. Der Pufferpunkt, Pufferbereich und Neutralpunkt sind hier nicht gekennzeichnet. 7. (8P) a) Wie ist die Summenformel von Kalk? CaCO3 b) Zeichnen Sie die Valenzstrichformel von Kohlenstoffdioxid. c) Zeichnen Sie die Valenzstrichformel des Hydrogencarbonatanions. d) Wieso geht Kalk in Lösung, wenn Sie Kohlenstoffdioxid in die Lösung einleiten? Argumentieren Sie mit Hilfe von Reaktionsgleichungen und Gleichgewichten. Kalk ist schwerlöslich, d.h. das Lösungsgleichgewicht liegt auf der Seite von Kalk und nur ein extrem kleiner Teil von Kalk liegt gelöst vor. 1) CaCO3 Ca2+ + CO32- Bei der Einleitung von CO2 entsteht Kohlensäure, welche dissoziiert als Hydrogencarbonat und Proton vorliegt. 2) CO2 + H2O HCO3- + H+ Durch die Protonierung des Carbonats wird Carbonat aus dem Gleichgewicht 1) entfernt somit das Lösen von Kalk begünstigt. 3) CO32- + H+ HCO3- Fasst man die drei Gleichgewichte zusammen wird ersichtlich, dass durch Zugabe von Zugabe von CO2 (linke Seite des Gleichgewichts) Kalk in das lösliche Calciumhydrogencarbonat umgewandelt wird. Gesamtgleichung: Ca(CO3) + CO2 + H2O Ca(HCO3)2 8. (12P) a) Zeichnen Sie ein Schema eines „Nickel-Cadmium“-Akkumulators während des Entladevorgangs. Beschriften Sie Anode und Kathode. Als Elektrolyt wird Kaliumhydroxidlösung verwendet. NiO(OH) ist im Elektrolyt unlöslich. 0 2+ E (Cd/Cd ) = −0,81 V 0 E (Ni(OH)2/NiO(OH)) = +0,49 V Die Halbzelle mit dem höheren Redoxpotential enthält das Oxidationsmittel. In dieser Halbzelle ist die Verbindung mit der höheren Oxidationsstufe das Oxidationsmittel. In dieser Halbzelle findet während des Entladevorgangs (freiwillige Reaktion) die Reduktion (Kathode) statt. 0 2+ 0 E (Cd/Cd ) = −0,81 V < E (Ni(OH)2/NiO(OH)) = +0,49 V 0 → E (Ni(OH)2/NiO(OH)) Halbzelle mit Oxidationsmittel Nickel in NiO(OH) hat Oxidationsstufe +III, Nickel in Ni(OH) 2 hat Oxidationsstufe +II → NiO(OH) ist Oxidationsmittel NiO(OH) ist im Elektrolyt unlöslich und stellt das Elektrodenmaterial in der Halbzelle, während Ni(OH)2 sich im Elektrolyt gelöst ist. Die andere Halbzelle enthält das Reduktionsmittel. In dieser Halbzelle ist die Verbindung mit der niedrigeren Oxidationsstufe das Reduktionsmittel. In dieser Halbzelle findet während des Entladevorgangs (freiwillige Reaktion) die Oxidation (Anode) statt. Das neutrale Element Cadmium ist im Elektrolyt unlöslich und stellt das Elektrodenmaterial in der Halbzelle, während die Cd2+-Ionen im Elektrolyt gelöst ist. (siehe Skizze aus dem Seminar) b) Geben Sie die Oxidations- und Reduktionsteilgleichung, sowie die Gesamtgleichung während des Entladevorgangs an. Oxidation: Cd → Cd2+ + 2 eReduktion: NiO(OH) + H2O + 1 e- → Ni(OH)2 + OH- |·2 Gesamtgleichung: Cd + 2 NiO(OH) +2 H2O → 2 Ni(OH)2 + Cd(OH)2 9. (8P) Ordnen Sie die folgenden Substanzen nach Nucleophilie. Begründen Sie die Reihenfolge mit Stichworten. (In den Formeln wurden die freien Elektronenpaare nicht eingezeichnet.) Thiolat: negative Ladung, nicht stabilisiert, sterisch ungehindert → gutes Nucleophil Pyrrolidin (sekundäres Amin): normale Nucleophilie, keine besondere sterische Belastung, keine Mesomeriestabilisierung Dihydrogenphosphat: negative Ladung, aber stabilisiert durch Mesomerie Pyrrol: Aromat. Sehr schlechtes Nucleophil, da das freie Elektronenpaar des Stickstoffs am aromatischen System beteiligt ist. Wenn dieses Molekül als Nucleophil agiert, würde das günstige aromatische System zerstört. 10. (10P) Beschreiben Sie den Mechanismus der sauer katalysierten Estersynthese detailliert mit Hilfe von Valenzstrichformeln.