Pro_E11 - Webstil.info
Werbung

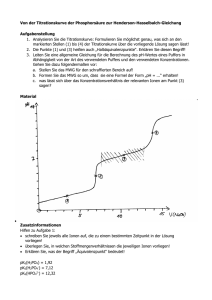
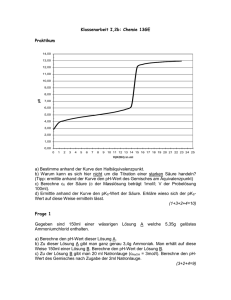
Axel Gottwald Thomas Hendel Gr.50 Gr.50 24.01.06 Versuch E 11 Potentiometrische pH-Messung mit der Wasserstoffelektrode und potentiometrische Bestimmung der Dissoziationskonstante einer Säure durch Aufnahme einer pHTitrationskurve mit der Glaselektrode Zielstellung: Der unbekannte pH-Wert einer Elektrolytlösung ist mit der Wasserstoffelektrode nach der Poggendorfschen Kompensationsmethode zu bestimmen. Ferner ist der pH-Wert einer unbekannten schwachen Säure durch potentiometrische Titration zu bestimmen. Grundlagen: Zusammenhang pH-Wert – Zellspannung, NERNSTsche Gleichung Schaltet man eine Zelle, in deren Elektrolyt (meist wässrige Lösung) die klassischen Dissoziationsgleichgewichte des Wassers (2H2O H3O+ + OH-) stattfinden, so liegen die durch eben diese Gleichgewichte vorhandenen zusätzlichen freien Ionen als zusätzliche potenzialsteigernde Ladungsträger mit im Elektrolyt vor, so dass diese bei Berechnung der Zellspannung berücksichtigt werden müssen. Die Zellspannung an sich ist definiert über: U U U Z ,eq Anode Katode wobei die einzelnen Elektrodenpotenziale über die NERNSTsche Gleichung bestimmt sind: allgemein gilt für Ox.Ox. Red Red + z e-: Ox a RT Ox U U ln H H , Re d zFa Re d wobei der Index „H“ bei der Elektrodenspannung immer auf die StandardWasserstoffelektrode als Referenz bezogen ist, da die Spannung nur einer Elektrode nicht messbar ist. Die Spannung der Standard-Wasserstoff-Elektrode ist definiert mit dem Wert Null. Diese Elektrode ist wie folgt aufgebaut: Pt/H2 (25°C, 1atm), H+ (aq, a(H+) ), d.h. um ein platiniertes Pt-Blech wird Wasserstoff des Standardruckes von einer atm geblasen, woraufhin folgende Reaktion stattfindet: H2 2H+ + 2e- Die NERNSTsche Gleichung lautet dann hierbei: 2 a RTH U U ln H H 2 F p H 2 mit der Standardspannung UH,H = 0V sodass unter Umrechnung des Nernstfaktors mit der Konstanten ln10 lg x = 2,302 lg x gilt: 2 /H U 59 , 16 mV lg a 59 , 16 mV pH H . H Wie hieraus erkenntlich wird, ist demnach eine Wasserstoffelektrode bestens geeignet, den pH-Wert einer Lösung zu messen. Da aber eine einzelne Elektrodenspannung wie gesagt nicht messbar ist, muss man gegen eine standardisierte, reproduzierbare Referenzelektrode messen. Hier bietet sich z.B. die Standard-Kalomel-Elektrode (Elektrodensymbol: Pt/Hg/Hg2Cl2(s)/KCl(aq, sa)) UH(SCE, T=298,15K)= +0,241V) an. Mit der ersten Elektrode zusammengeschaltet ergibt sich nun folgende Zellspannung: U U ( Pt / H / H ) U ( SCE ) . Z , eq H 2 H Hinzu kommt noch ein kinetischer Faktor UDiff, die Diffusionsüberspannung, die durch die Annäherung und Bremsung der Ladungsträger an das entgegengesetzte Ladungsfeld zustande kommt, jedoch nicht gemessen werden kann und in der Gleichung für die Zellspannung als weiterer Summand seine Beachtung findet. Letztlich gilt somit: U U ( SCE ) Z , eq H pH gesucht . 59 , 16 mV Glaselektrode, pK-Wert-Bestimmung Neben der Wasserstoffelektrode existieren noch wesentlich genauere und reproduzierbarere Methoden zur pH-Ermittlung, z.B. die der Glaselektrode, die folgendem Aufbau gleich kommt: Ag/AgCl(s),KCl(s),KCl(aq)//H+(aq)(a1unbekannt)/Glasoberflächenquellschicht/Glas/ Glasoberflächenquellschicht/H+(aq)(a2bekannt)//AgCl(s),KCl(s),KCl(aq)/Ag. Der Trick bei einer solchen Glaselektrode besteht in der Diffusion der H+-Protonen durch die semipermeable Quellschicht des Glases. Somit folgt ein Ausgleich beider Galvanispannungen der Elektroden, sodass die NERNSTsche Gleichung einfach lautet: U 59 , 16 mV ( pH pH ) . Z , eq 2 1 Selbst bei unbekanntem inneren pH-Wert der Glaselektrode kann man mittels Kalibrierung mit Pufferlösungen eines bekannten pH-Wertes den pH-Wert einer unbekannten Lösung bestimmen. Dies wird auch im zweiten folgenden Teil des Versuches durchgeführt. Eine (schwache) Säure dissoziiert nach dem folgenden Gleichgewicht: HA + H2O H3O+ + Awobei die Gleichgewichtskonstante über das MWG folgendermaßen definiert ist: aHO aA K 3 aHA und dessen negativer dekadischer Logarithmus analog des pH-Wertes als pK-Wert bezeichnet wird: c HA pK lg( c f ) lg a lg( c f ) pH lg HA HA (bei idealem Verhalten, d.h. f1). H A A c A Da der pK-Wert über lediglich den pH-Wert ermittelt werden kann, indem die Konzentration von restlicher Säure bzw. dissoziiertem Säurerestion A- verschwindet, bietet sich zur Bestimmung eine Titration mit genauer Bestimmung des Äquivalenzpunktes an, denn der zusätzliche logarithmische Summand verschwindet, wenn cHA = cA-. Dies gilt bei einer einwertigen Säure beim Titrationsgrad =0,5. Somit ist der pK-Wert direkt aus der Titrationskurve bei der Hälfte der Basenzugabe am ÄP abzulesen. Da die Detektion des ÄP hier potentiometrisch erfolgt, muss der Zusammenhang aus der Kalibrierkurve geschlussfolgert werden. Dieser sollte linear sein. Messung der Spannung, POGGENDORFFsche Kompensation Wichtig bei der Messung der Zellspannung ist die stromlose Messung. Diese wird erreicht mittels der POGGENDORFFschen Kompensationsmethode, bei der mit einer definierten Spannungsquelle UA und einem definierten Normalwiderstand mit Spannung UN nach Einstellung von Stromlosigkeit mit und ohne Probe ein Strom I0 ermöglicht werden kann. Über einem definierten Widerstand liegt die variable, bekannte (Schleifkontakt) Spannung UA an. Ein Spannungsabfall über der vom Schleifkontakt abgegriffenen Strecke b verhält sich gegenüber dem gesamten Spannungsabfall UA wie b zur Gesamtlänge des Widerstandes a. Schaltet man nun um auf die Messung der Probe (hier Glaselektrode) so kann man das ganze analog behandeln. Durchführung: Die Versuchsdurchführung ist in der Anleitung sehr ausführlich dargestellt und wurde ohne größere Abweichung erledigt. Es ist lediglich zu bemerken, dass von den ausstehenden Puffern nur fünf mit sich deutlich unterscheidendem pH-Wert für die Ermittlung einer Kalibriergeraden verwendet werden konnten. Ebenso wurde der Messwert an der Wasserstoffelektrode erst am Ende des Versuches verwendet, da bis dahin stets noch kleinste Änderungen am Galvanometer zu verzeichnen waren. Messwerte: Wasserstoffelektrode Gemessene Zellspannung: UZelle = -459,75mV Gemessene Raumtemperatur und Luftdruck: T=20,8°C pa=1034kPa Da die Raumtemperatur an diesem näher an 20°C als an 25°C lag, wurde der zweite tabellierte Wert des Elektrodenpotentials der Kalomel-Elektrode verwendet. U U ( SCE ) 0 , 45975 V 0 , 244 V eq H pH 3 , 66 C 0 , 059 V 0 , 059 V Glaselektrode Zunächst wurde die Gleichgewichtszellspannung von Pufferlösungen bekannter pH-Werte gemessen und daraus eine Kalibriergerade erstellt. pH-Werte der Pufferlösungen 1,68 Ueq in mV 264 3,6 157 4 130 6,6 -24 9,2 -167 U in mV 400 y = -57,688x + 361,36 R2 = 0,9997 300 200 100 4,65; 93 pH 0 -100 0 1 2 3 4 5 6 7 8 9 10 -200 -300 -400 Eichkurve Pufferlösungen Linear (Eichkurve Pufferlösungen) pKs-Wert der Säure 11 Zweimalige Titration der unbekannten, schwachen Säure gegen 0,1N NaOH Titration der Unbekannten (grob) VNaOH in ml Ueq in mV 0,0 161 0,5 149 1,0 138 2,0 120 3,0 105 4,0 93 5,0 81 6,0 66 7,0 45 8,5 -235 9,0 262 Titration der Unbekannten (präzise) VNaOH in ml Ueq in mV 0,0 161 3,0 105 3,5 100 3,6 99 3,7 98 3,8 97 3,9 95 4,0 94 4,1 93 4,2 92 4,3 90 7,0 47 7,1 44 7,2 41 7,3 38 7,4 34 7,5 29 7,6 24 7,7 18 7,9 5 8,0 -9 8,2 -108 8,3 -213 8,5 -234 9,0 -264 10,0 -285 Titrationskurve U in m V 300 200 100 0 -100 0,0 1,0 2,0 3,0 4,0 5,0 -200 -300 -400 präzise Titration 6,0 7,0 V(NaOH) in m l 8,0 9,0 10,0 11,0 Der Äquivalenzpunkt wurde mithilfe zweier paralleler Tangenten ermittelt, welche ober- und unterhalb des Punktes angelegt wurden. Zwischen diesen Tangenten wurde die Gerade gesucht, welche zu beiden den gleichen Abstand aufweist. Der Schnittpunkt dieser Geraden mit dem Graphen der Titration ergibt den Äquivalenzpunkt. Dieser Punkt entsprach genau dem Messwert V=8,2ml/U=-108mV (in der Tabelle fett dargestellt). VÄP=8,2ml VÄP/2=4,1ml Mit dem Spannungswert bei halber Titration (V=4,1ml/U=93mV) wurde nur mithilfe der Kalibriergeraden der pH-Wert ermittelt, welcher für schwache Protolyte genau dem pKs-Wert entspricht: pKS = 4,65 Fehlerbetrachtung: Die Diffusionsüberspannung wird mit der Folge eines quantitativ unbestimmten Fehlers außer Acht gelassen (siehe Grundlagen). Es ist nicht zu beurteilen inwiefern die Platinelektrode durch zuvorigen Aufenthalt an der Luft vergiftet sein könnte, was zu einer Verfälschung der Messwerte führen würde. Da gezielt im Bereich des halben Titrationsgrades präzise titriert wurde, konnte dieser Wert ziemlich genau festgelegt werden. Jedoch ist allgemein die graphische Ermittlung eines solchen Punktes als unpräzise einzuschätzen. Als systematische Fehlerquelle ist hier die Skaleneinteilung der Bürette aufzuführen. Diese ist mit 0,1ml relativ unpräzise. Als Fazit ist festzuhalten, dass trotz diverser Fehlerquellen die beiden Versuche zu sehr guten Ergebnissen geführt haben. Die Methoden sind also als sehr präzise einzuschätzen.