Jahn-Teller Effekt (oder Jahn
Werbung
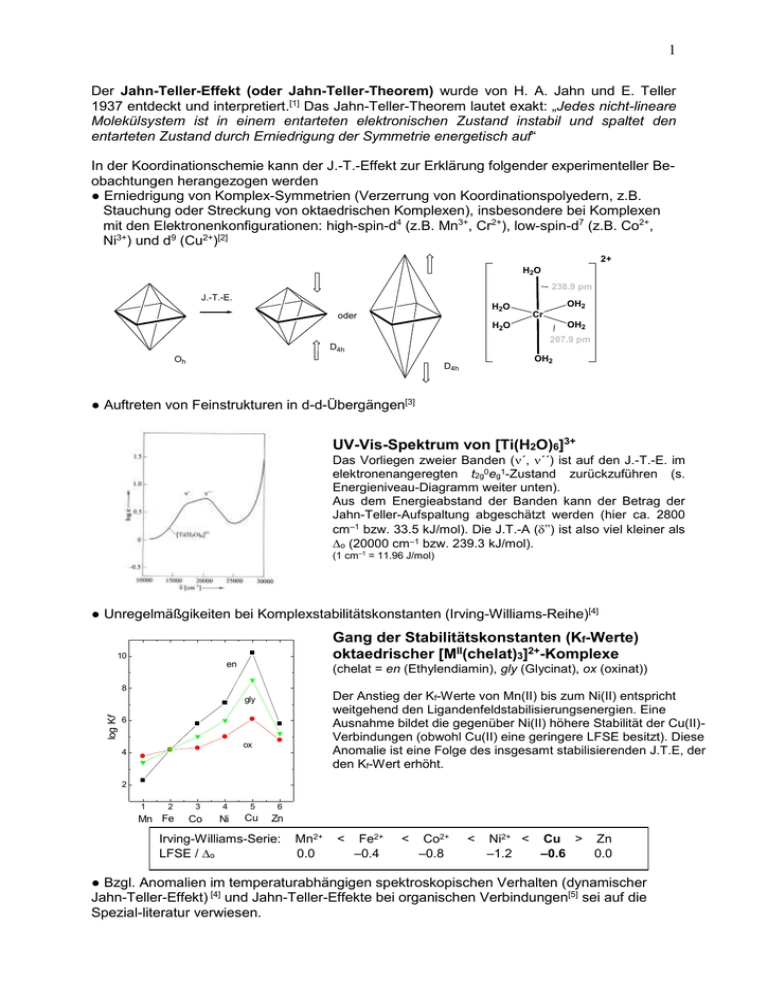
1 Der Jahn-Teller-Effekt (oder Jahn-Teller-Theorem) wurde von H. A. Jahn und E. Teller 1937 entdeckt und interpretiert.[1] Das Jahn-Teller-Theorem lautet exakt: „Jedes nicht-lineare Molekülsystem ist in einem entarteten elektronischen Zustand instabil und spaltet den entarteten Zustand durch Erniedrigung der Symmetrie energetisch auf“ In der Koordinationschemie kann der J.-T.-Effekt zur Erklärung folgender experimenteller Beobachtungen herangezogen werden ● Erniedrigung von Komplex-Symmetrien (Verzerrung von Koordinationspolyedern, z.B. Stauchung oder Streckung von oktaedrischen Komplexen), insbesondere bei Komplexen mit den Elektronenkonfigurationen: high-spin-d4 (z.B. Mn3+, Cr2+), low-spin-d7 (z.B. Co2+, Ni3+) und d9 (Cu2+)[2] 2+ H2 O 238.9 pm J.-T.-E. H2O oder OH2 Cr OH2 H2O 207.9 pm D4h Oh OH2 D4h ● Auftreten von Feinstrukturen in d-d-Übergängen[3] UV-Vis-Spektrum von [Ti(H2O)6]3+ Das Vorliegen zweier Banden (´, ´´) ist auf den J.-T.-E. im elektronenangeregten t2g0eg1-Zustand zurückzuführen (s. Energieniveau-Diagramm weiter unten). Aus dem Energieabstand der Banden kann der Betrag der Jahn-Teller-Aufspaltung abgeschätzt werden (hier ca. 2800 cm–1 bzw. 33.5 kJ/mol). Die J.T.-A (’’) ist also viel kleiner als o (20000 cm–1 bzw. 239.3 kJ/mol). (1 cm–1 = 11.96 J/mol) ● Unregelmäßgikeiten bei Komplexstabilitätskonstanten (Irving-Williams-Reihe)[4] Gang der Stabilitätskonstanten (Kf-Werte) oktaedrischer [MII(chelat)3]2+-Komplexe 10 en (chelat = en (Ethylendiamin), gly (Glycinat), ox (oxinat)) 8 Der Anstieg der Kf-Werte von Mn(II) bis zum Ni(II) entspricht weitgehend den Ligandenfeldstabilisierungsenergien. Eine Ausnahme bildet die gegenüber Ni(II) höhere Stabilität der Cu(II)Verbindungen (obwohl Cu(II) eine geringere LFSE besitzt). Diese Anomalie ist eine Folge des insgesamt stabilisierenden J.T.E, der den Kf-Wert erhöht. log Kf gly 6 ox 4 2 2 3 4 5 6 Mn Fe 1 Co Ni Cu Zn Irving-Williams-Serie: LFSE / o Mn2+ 0.0 < Fe2+ –0.4 < Co2+ –0.8 < Ni2+ < Cu > Zn –1.2 –0.6 0.0 ● Bzgl. Anomalien im temperaturabhängigen spektroskopischen Verhalten (dynamischer Jahn-Teller-Effekt) [4] und Jahn-Teller-Effekte bei organischen Verbindungen[5] sei auf die Spezial-literatur verwiesen. 2 Der Jahn-Teller-Effekt ist ein elektronischer Effekt. Gewöhnlich (aber nicht ausnahmslos) wird der J.-T.-E. beobachtet, wenn die eg- und t2g-Orbitale (bei oktaedrischen Komplexen) bzw. die e- und t2-Orbitale (bei tetraedrischen Komplexen) weder halb noch ganz besetzt sind. Der J.-T.-E. ist besonders stark bei oktaedrischen Komplexen bei Besetzung der egOrbitale. Die folgende Tabelle zeigt die Elektronenkonfigurationen, für die der J.-T.-E. zu erwarten ist (dunkelgrau = starker Jahn-Teller-Effekt,* hellgrau = schwacher Jahn-TellerEffekt). Die Streckung des Oktaeders ist häufiger als die Stauchung (Dehnung von 2 Bindungen (gegenüber 4 Bindungen) ist energetisch günstiger). oktaedrisches tetraedrisches Ligandenfeld Ligandenfeld ------------------------------------------------------------------------------------------------d0 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 t2g0 t2g1 t2g2 t2g3 t2g3eg1 (hs) t2g3eg2 (hs) t2g4eg2 (hs) t2g5eg2 (hs) t2g6eg2 t2g6eg3 t2g6eg4 e0 e1 e2 e2t21 (hs) e2t22 (hs) e2t23 (hs) e3t23 (hs) e4t23 (hs) e4t24 (hs) e4t25 (hs) e4t26 (hs) t2g4eg0 (ls) t2g5eg0 (ls) t2g6eg0 (ls) t2g6eg1 (ls) e3t20 (ls) e4t20 (ls) e4t21 (ls) e4t22 (ls) ------------------------------------------------------------------------------------------------*Strukturelle Auswirkungen des J.-T.-E. sind besonders stark bei Besetzung der eg-Orbitale (Liganden-Orbitale), aufgrund stärkerer elektrostatischer Wechselwirkungen zwischen den d-Elektronen und Liganden d-Orbitalenergie oktaedrisches Ligandenfeld d-Orbitalenergie Jahn-Teller-Effekt gestrecktes Oktaeder 0.6 o dx2-y2 1/2 " eg Jahn-Teller-Effekt oktaedrisches Ligandenfeld dz2, dx2-y2 gestrecktes Oktaeder dz2, dx2-y2 0.6 o -1/2 " eg dz2 o dx2-y2 1/2 " 1/2 " dz2 '' o o dxy, dxz, dyz dxy 2/3 ' -0.4 o t2g ' dxy, dxz, dyz dxy -0.4 o -1/3 ' 2/3 ' 1/3 ' t2g dxz dyz dxz dyz Energieaufspaltung der d-Zustände eines Zentralatoms Links: ideales Oktaeder; Rechts: gestrecktes Oktaeder Bei J.-T.-E. (gestreckt quadratisch-bipyramidal). Für gestauchte Oktaeder sind die Verhältnisse gerade umgekehrt. d9 gestrecktes Oktaeder 1/2 " dx2-y2 -1/2 " d-Orbitalenergie Bsp: J.-T.-E. für high-spin-d4 und d9 a) J.-T.-S. t2g4eg0-Konfiguration = ½ ’’ b) J.-T.-S. t2g6eg3-Konfiguration = ½ ’’ d4 d-Orbitalenergie Jahn-Teller-Stabilisierungsenergie = der mit der Verzerrung der Polyeder einhergehende Energiegewinn. Jahn-Teller-Effekt im elektronenangeregten Zustand von Ti3+ (vgl. das UV-Vis Spektrum oben) gestrecktes Oktaeder 1/2 " -1/2 " dz2 2/3 ' dxy -1/3 ' dx2-y2 dz2 2/3 ' dxy -1/3 ' dxz dyz dxz dyz 3 Ligandenfeld-Theorie Annahmen • elektrostatische Wechselwirkungen zwischen Elektronen der Liganden u. Metallionen • Punktladungen • Ligandenfeld = elektrisches Feld, das von den Liganden erzeugt wird Ligandenfeld-Theorie betrachtet energetische Lage der fünf d-Orbitale in einem bestimmten Kristallfeld: z y x dx2-y2 dz2 dxy dxz dzy eg-Orbitale (Orbitallappen auf den Achsen) t2g-Orbitale (Orbitallappen zwischen den Achsen) Abb. 1. Grenzflächendarstellung für die d-Orbitale Beispiel: Oktaedrischer Komplex - im oktaedrischen Ligandenfeld: d-Orbitale haben nicht mehr die gleiche Energie - Liganden weisen direkt auf die dz2- u. dx2-y2-Orbitale (starke elektrost. WW) - Liganden liegen zwischen den dxy, dxz, dyz-Orbitalen (geringere elektrost. WW) => zwei Sätze von d-Orbitalen: t2g- und eg-Orbitale, eg-Orbitale sind energiereicher, t2g-Orbitale energieärmer, Bezeichnung der Differenz: o Ligandenfeldaufspaltung Ligand dxz dx2-y2 stärkere Abstoßung Anhebung der Energie geringere Abstoßung Absenkung der Energie Abb. 2. Anordnung der Liganden (kleine Punkte) und Orbitale (hier nur dx2-y2- und dxzOrbitale) in einem oktaedrischen Komplex. dz2, dx2-y2 eg Energie d-Orbitale 0.6 o o d-Orbitale o 0.4 o kugelsymmetrisches Ligandenfeld t2g dxy, dxz, dyz isoliertes Ion oktaedrisches Ligandenfeld Abb. 3. Energieniveaudiagramm der d-Orbitale eines Metallions in einem oktaedrischen Ligandenfeld. [1] H. Jahn, E. Teller, Proc. R. Soc. London, A 161 (1937), 220. [2] B. N. Figgis, E. F. Kucharski, P. A. Reynolds, Acta. Cryst. 1990, B46, 577-584. [3] A. F. Holleman, E. Wiberg, Lehrbuch der Anorganischen Chemie, 102. Aufl., de Gruyter, Berlin 2007, S. 1361 u. 1369. [4] a) D. F. Shriver, P. W. Atkins, C.H. Langford, Anorganische Chemie, 2. Aufl, Wiley-VCH, 1997, Weinheim, S. 254. b) ebenda, S. 244, S. 253. [5] R. Lindner, H. Sekiya, K. Müller-Dethlefs, Angew. Chem. 1993, 105, 1384–1387.