Kapitel 3.3-3.5
Werbung
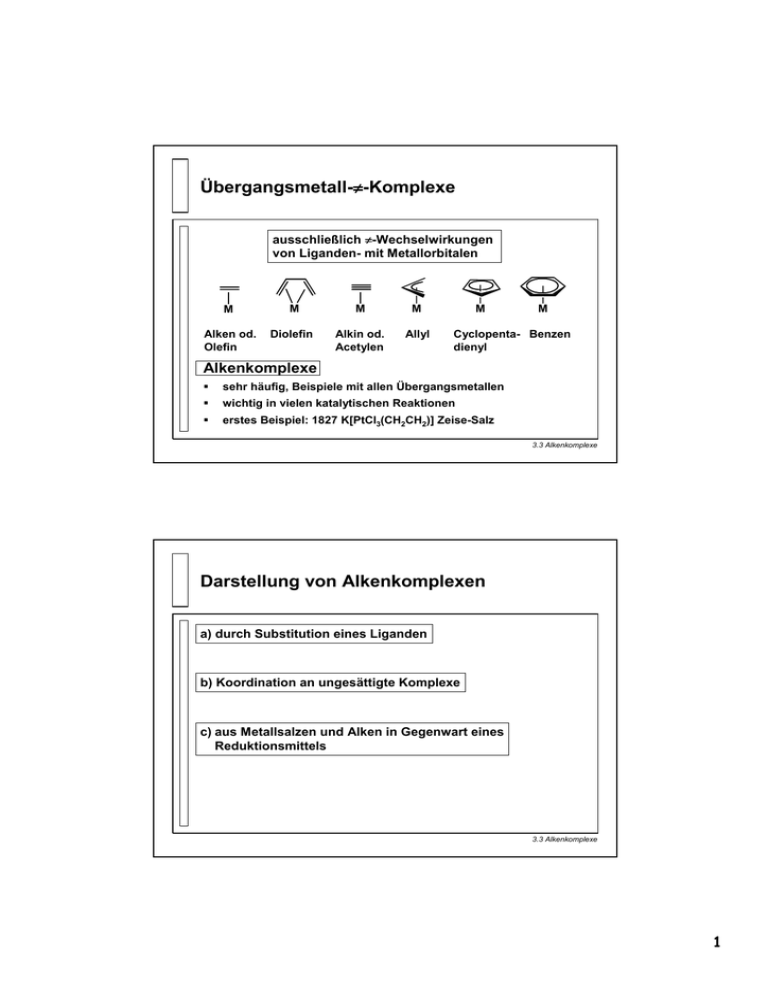
Übergangsmetall-π π-Komplexe ausschließlich π-Wechselwirkungen von Liganden- mit Metallorbitalen M M M M Alken od. Olefin Diolefin Alkin od. Acetylen Allyl M M Cyclopenta- Benzen dienyl Alkenkomplexe sehr häufig, Beispiele mit allen Übergangsmetallen wichtig in vielen katalytischen Reaktionen erstes Beispiel: 1827 K[PtCl3(CH2CH2)] Zeise-Salz 3.3 Alkenkomplexe Darstellung von Alkenkomplexen a) durch Substitution eines Liganden b) Koordination an ungesättigte Komplexe c) aus Metallsalzen und Alken in Gegenwart eines Reduktionsmittels 3.3 Alkenkomplexe 1 Bindung in Alkenkomplexen: das Chatt-Dewar-Duncanson-Modell M M oder M C σ-Hinbindung C C C π-Rückbindung in π*-Orbital Alken ist ein neutraler 2-Elektronendonor Alkene sich schwache Liganden für elektronenarmen Metalle (ähnlich CO) sowohl σ-Hin- wie auch π-Rückbindung schwächen die C=C Bindung Abnahme der C=C Streckschwingung bei Koordination (freies CH2=CH2 ν 1623 cm-1, bei Koordination 1500 – 1590 cm-1) Erniedrigung des Winkels am C-Atom bei Koordination (120° 100°) 3.3 Alkenkomplexe Strukturelle Details in Alkenkomplexen am Beispiel des Zeise-Salzes Alken steht im rechten Winkel zur PtCl3-Ebene Cl Cl C=C-Bindungslänge fast gleich wie in freiem Ethen koordiniert: 137 pm; frei: 135 pm Pt H Cl H H H Ethen nicht mehr planar Winkel zwischen den beiden CH2-Ebenen: 146° 3.3 Alkenkomplexe 2 Alken-Addukt vs. Metallacyclopropan Alken-Addukt Metallacyclopropan C C Zunehmende π*-Rückbindung M M C C • im Chatt-Dewar-Duncanson-Modell: sehr starke π-Rückbindung führt zur Aufhebung der Doppelbindung π-basische LnM-Fragmente begünstigen eine starke Rückbindung elektronenziehende Substituenten an der Doppelbindung begünstigen eine starke Rückbindung 3.3 Alkenkomplexe Bindung in konjugierten Dialkenkomplexen MOs geeigneter Symmetrie δ-Rückbindung M dxy z M Ln y M M dxz py M M dyz pz π-Rückbindung x dz2 π-Hinbindung M M s pz σ-Hinbindung 3.3 Alkenkomplexe 3 Bindung in konjugierten Dialkenkomplexen M Ln M M dyz dxz σ-Hinbindung π-Rückbindung σ-Hin-und π-Rückbindung führen zur Verkürzung der C-C-Einfachbindung und zur Verlängerung der C=C-Doppelbindung 146 pm 145 pm 140 pm 145 pm 146 pm 136 pm Zr Cp2 Fe (CO)3 3.3 Alkenkomplexe Reaktionen mit Alkenkomplexen a) Einschub in Metal-Alkylbindung oder -Hydridbindung L M R R M +L R M R = Alkyl, Hydrid b) Reaktion mit Elektrophilen begünstigt bei elektronenreichen Metallen H H H Fe (CO)3 konjugierter Dien-Komplex H[BF4] Fe (CO)3 [BF4] Allyl-Komplex 3.3 Alkenkomplexe 4 Reaktionen mit Alkenkomplexen c) Reaktionen mit Nukleophilen unter Bildung von Alkylkomplexen R Elektronenreiche Alkene werden in der Regel nicht nukleophil angegriffen Nu Elektronenarmes Metal M aktiviert das Alken M R M η1 η2 möglichst: hohe Oxidationsstufen positiv geladener Komplex elektronenziehende L. 18-Elektronenkomplexe Nu R R Bei nukleophilem Angriff „rutscht“ das Metall zum weniger substituierten Ende des Alkens Das Nukleophil greift am substituierteren Ende des Alkens an 3.3 Alkenkomplexe Reaktionen mit Alkenkomplexen d) Reaktionen mit Nukleophilen unter Bildung von Alkylkomplexen Nu R R Nu M R Nu M häufiger M Nu Intermolekular: Angriff am substituierterem C -Atom Nu M Nu M R + Nu Intramolekular (Insertion): Angriff am weniger substituierten C-Atom R Nebenreaktion: Substitution Nukleophiler Angriff nur an mono- und disubstituierten Alkenen, sonst wird Substitution beobachtet 3.3 Alkenkomplexe 5 Alkin- (oder Acetylen)komplexe Alkinkomplexe verhalten sich ähnlich zu Alkenkomplexen Zeise-Salz Pt Cl Cl H H Cl H H Pt Cl Cl H Cl H Unterschiede: C-Atome in Alkinen sind elektronegativer Alkine haben eine höhere π-Akzeptorstärke können Alkene verdrängen M M Alkin Metallacyclopropen Alkine haben zwei π- und zwei π*-Molekülorbitale (orthogonal zueinander) 3.3 Alkinkomplexe Koordinationsarten von Alkinen Koordinationsarten Ln M Zähnigkeit des Liganden Elektronendonor C C LnM Et2N M M 1 2 2 2 4 4 NEt2 S S S CH W S CH CO 16 e¯ C C C C M M 4 4 NEt2 Et2N S S S CH W S CH CO 18 e¯ 3.3 Alkinkomplexe 6 Molekülorbitalschema von Alkinen z y x σ∗ π∗ π∗ pz stehen für π-Rückbindungen zur Verfügung py pz π sp-Hybridorbital π C py sp-Hybridorbital C stehen für π-Hinbindungen zur Verfügung σ 3.3 Alkinkomplexe Bindung in Alkinkomplexen z C C C C y x 2 π∗-Orbitale M M 2 π-Orbitale σ-Hinbindung C C M π∗-Rückbindung C C dyz π-Hinbindung dxz M dxy δ∗-Rückbindung 3.3 Alkinkomplexe 7 Alkin als ein- bzw. zweizähniger Ligand Cl RH2N Pt Cl tBu2C2, EtOH Na2[PtCl4] R-NH2 R = 4-MeC6H4 Ti - CO Ph2C2 Ph3P CR2 Pt Ph3P CR2 -C2R4 C C Ph3P Pt Ph3P C freies C2H2: ν(C≡ ≡C) = 2190 - 2260 cm-1 d(C≡ ≡C) = 120 pm d(C-C) = 124 pm tBu CO C Ph2C2 Cp2Ti(CO)2 tBu 165° d(C-C) = 128 pm 146° Ph 140° d(C-C) = 132 pm Ph Komplex 1 2 ν(C≡ ≡C) [cm-1] 2028 1780 3 1750 (Vergleich: freies C2H4: d(C=C) = 134 pm) 3.3 Alkinkomplexe Reaktivität von Alkinkomplexen: Cyclooligomerisierung Ph PdCl2 + 2PhC CPh Ph Ph Ph Pd Cl CpCo Cl 2 CpCo(C2H4)2 + 3 MeC CMe CpCo(COD) 2 HC CH + RC N N R = COD 3.3 Alkinkomplexe 8 Trimerisierung unter Bildung von Metallacyclopentadien 2 CpCo CpCo + "CpCo" CpCo oder CpCo CpCo 3.3 Alkinkomplexe Allylkomplexe Elektronenzahl Allylanion: 4 π-Elektronen Haptizität M M M M η1-Allyl η3-Allyl • σ-Allylkomplex • 2-Elektronendonor • π-Allylkomplex • 4-Elektronendonor M 3.4 Allylkomplexe 9 Allylkomplexe: Bindung π-Allylorbitale z geeignete Metallorbitale x leer y π-Rückbindung px dxz 2e π-Hinbindung M dyz py 2e σ-Hinbindung dz2 s pz 3.4 Allylkomplexe Allylkomplexe: Darstellung a) Allylierung von Metallhalogeniden (mit Allylgrignard oder andern Hauptgruppenallylen) NiCl2 + 2 MgCl + SnMe3 in Et2O, - 10 °C Ni - 2 MgCl2 ∆ [MnBr(CO)5] b) - SnMe3Br - CO Mn(CO)4 Substitution eines Carbonylmetallats mit einem Allylhalogenid Na[Mn(CO)5] + Cl - NaCl Mn(CO)5 hν ν od. ∆ Mn(CO)4 3.4 Allylkomplexe 10 Allylkomplexe: Reaktivität a) Addition von Nukleophilen (syn-Addition) syn anti Nu + OC b) Nu- + Mn Mn OC CO CO Hydrid-Übertragung (Insertion) α H3C β R γ H H α-H H α H LnM H H H β γ R H LnM γ H α H γ-H R β H LnM H 3.4 Allylkomplexe Zyklische π-Liganden R R R R R Cyclobutadien R R R R R R R R R R R Cyclopentadienyl R Indenyl R R R + R R R Benzol R R Cycloheptatrienyl R = H Cp R = Me Cp* neutral 4-ElektronenDonor anionisch neutral anionisch 6-ElektronenDonoren kationisch R = Alkyl, Aryl SiMe3, etc. 3.5 Cyclopentadienyl-Komplexe 11 Molekülorbitale des Cp-Ligand Energie MO von Cp Knotenebenen (Symmetrie) 2 (e2) LUMO 1 (e1) HOMO 0 (a1) 3.5 Cyclopentadienyl-Komplexe Linearkombinationen: σ- und π-Wechselwirkungen e1u a2u pz px e1g π-Wechselwirkungen dxz σ-Wechselwirkungen a1g s dz2 3.5 Cyclopentadienyl-Komplexe 12 Linearkombinationen: δ-Wechselwirkungen e2g dxy dx2-y2 e2g 3.5 Cyclopentadienyl-Komplexe MO-Schema eines Metallocens e*2g e2g, e2u p a2u, e1u Orbitale mit d-Charakter a*1g e*2u e*1g s a1g π-Ww., xz, yz σ-Ww. s, z2 a1g a1g, e1g, e2g e2g d e1g, e1u e1u δ-Ww. x2-y2, xy M e1g a1g, a1u a2u a1g gestaffelte Form D5d 3.5 Cyclopentadienyl-Komplexe 13 Beispiele von Metallocenen + - Co 2 -e Co Ti Ti H Ti H Ti Ti Cp* N2 H Cp*2Ti-N N-TiCp*2 3.5 Cyclopentadienyl-Komplexe Einfluss von Temperatur und Druck auf die Elektronenkonfiguration 1.73 Å Temperatur Druck Mn 2.05 Å Mn e1g* a'1g e2g e1g* Spin-Crossover a'1g e2g 3.5 Cyclopentadienyl-Komplexe 14 Einfluss von Substituenten auf die Elektronenkonfiguration high-spin Cp2Mn e1g* e1g* a'1g a'1g e2g e2g Mn Mn low-spin Cp*2Mn 3.5 Cyclopentadienyl-Komplexe Reaktionen von Cp-Komplexen Elektrophile Alkylierung und Acylierung am Cp-Ring CH3 Fe O H2C=CH2 AlCl3 CH3COCl AlCl3 Fe Fe CH3 Metallierung von Ferrocen mit starken Basen Li Fe nBuLi tmeda Fe Li + Fe Li Protonierung von Ferrocen mit starken Säuren + Fe H+ Fe H 3.5 Cyclopentadienyl-Komplexe 15 Gewinkelte Metallocene Cl Ti Cl 16 VE leeres Orbital harte Lewis-Säure reagiert mit -OR OR 2 ROLi Ti - 2LiCl OR + H+ H H H M + H Mo Mo H H Mo 18 VE freies Elektronenpaar weiche Lewis-Base reagiert mit + π-Akzeptoren z. B. Ethen 3.5 Cyclopentadienyl-Komplexe Cp als “spectator ligand” [Cp2Ti(NCMe)2][PF6]2 Substitution Reduktion Tl[PF6] MeCN [Cp2Ti(CO)2] [Cp2TiMe2] Alkylierung Zn, CO 2 MeLi [Cp2TiCl2] H2O Cp2Ti Hydrolyse O TiCp2 3.5 Cyclopentadienyl-Komplexe 16 π-Benzol-Komplexe Darstellung: Friedel-Crafts-Reaktion 3 CrCl3 + 2 Al + AlCl3 + 6 C6H6 + Cr 3 AlCl4- Na2S2O4 Cr KOH analoge Synthese mit M = V, Mo, W, Re Fe, Ru, Os Co, Rh, Ir, Ni Reaktivität: Metallierung des Arens durch Koordination erleichtert BuLi tmeda Cr OCC O CO Li Cr OCC O + ClPPh2 - LiCl CO PPh2 Cr OCC O CO 3.5 Komplexe mit zyklischen π-Liganden π-Aren-Komplexe Cycloheptatrienyl-Komplexe (Tropylium) H H Mo(CO)6 + C7H8 BF4 + [Ph3C]BF4 ∆ Mo OCC O CO - Ph3CH Mo OCC O CO • C7H7+ • 6-Elektronen-Donor Cyclooctatetrenyl-Komplexe (COT) Ti C8H82¯ , planar, 10-e¯ -Donor frühe Übergangsmetalle THF Lanthanoide und Actinoide UCl4 + 2 K2C8H8 U C8H8, gewellt (η8-C8H8)(η4-C8H8)Ti (η η8-C8H8)2U 3.5 Komplexe mit zyklischen π-Liganden 17