Das chemische Gleichgewicht - Fachdidaktik Chemie ETH
Werbung

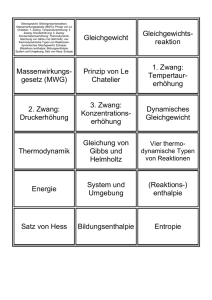
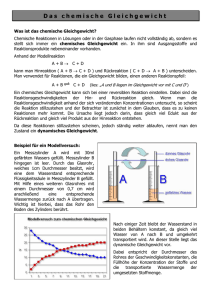
Chemisches Gleichgewicht S. 1 Fachdidaktik Chemie ETH Das chemische Gleichgewicht Vorwort: Am Anfang den Schülerinnen erklären, dass wir zuerst ein Konzept kennen lernen und erst nachher sehen werden, wie wichtig es ist und wo es Anwendung findet. Viele Reaktionen sind umkehrbar Kohlendioxid und Kohlensäure Kohlendioxid reagiert mit Wasser zu Kohlensäure: CO2(g) + H2O(l) H2CO3(aq) Dabei handelt es sich um eine umkehrbare Reaktion: Wenn man Kohlendioxid in eine Flasche mit Wasser presst, entsteht Kohlensäure. Wenn ein Glas Wasser mit Kohlensäure herumsteht, enthält es bald keine Kohlensäure mehr, weil bei der Rückreaktion Kohlensäure zu Kohlendioxid und Wasser wird und Kohlendioxid entweicht. In einer geschlossenen Flasche gibt es immer beides, Kohlendioxid und Kohlensäure. Dabei hat sich gezeigt, dass es ständig CO2-Moleküle gibt, die zu H2CO3 werden und H2CO3-Moleküle, die sich in CO2 und Wasser verwandeln. Anfangszustand: Kohlendioxid wird in eine Wasserflasche gegeben Nach einiger Zeit ändert sich das Verhältnis von CO2 und H2CO3 nicht mehr. Die Flasche wird kurz geöffnet. Das Zischen verrät das CO2. Ein Teil des CO2 entweicht. Folge: Kohlensäure wird zu CO2. Die Flasche wird verschlossen. Wenn man wartet nimmt der Druck nicht mehr zu und auch die Konzentration von Kohlensäure ändert sich nicht mehr. Je mehr CO2-Moleküle in der Gasphase umherfliegen, desto mehr kommen mit Wasser in Kontakt und werden zu Kohlensäure. Die Reaktionsgeschwindigkeit hängt von der Konzentration ab: vhin = khin · [CO2] · [H2O] Auch die Geschwindigkeit der Rückreaktion hängt von der Konzentration ab. Je mehr Kohlensäure vorhanden sind, desto mehr Moleküle werden zerfallen und CO 2 bilden: vrück = krück · [H2CO3] Das Verhältnis von CO2 und Kohlensäure ändert sich nicht mehr, wenn die beiden Geschwindigkeiten gleich gross sind. Man sagt, dass ein chemisches Gleichgewicht erreicht ist. vhin = vrück khin · [CO2] · [H2O] = krück · [H2CO3] khin [H2CO3] K = ——– = —————— krück [CO2] · [H2O] Amadeus Bärtsch 16. April 2016 Chemisches Gleichgewicht S. 2 Fachdidaktik Chemie ETH Die Geschwindigkeitskonstanten khin und krück müssen gemessen werden. Da khin und krück für die Reaktion von CO2 und Wasser bestimmte Werte sind, ergibt sich im Gleichgewicht immer dasselbe Verhältnis der Konzentrationen. Die Vorgänge auf Teilchenebene Bild 1: Start Bild 2 Bild 3 Bild 4 Aufgabe: Vergleichen Sie Bild 2 mit Bild 4. In dynamischen Gleichgewichten läuft ständig etwas und trotzdem ändert sich nichts. Bsp. aus dem Alltag 1. Ein Bankkonto ist im dynamischen Gleichgewicht, wenn ... 2. Die Bevölkerung eines Landes hat ein Gleichgewicht erreicht, wenn ... 3. Mein Körpergewicht befindet sich im Gleichgewicht, wenn ... Weshalb diskutieren wir das Gleichgewicht? Viele Schülerinnen und Schüler können das Gesagte zwar nachvollziehen, sehen aber nicht ein, wohin diese Überlegungen führen. Was nützt es, wenn sich in chemischen Reaktionen ein Konzentrations-Verhältnis ergibt, dessen Grösse man nicht kennt? Wie in der Grundlagenforschung brauchen wir etwas Geduld. Zuerst müssen wir das Phänomen verstehen, bis sich wichtige Anwendungen ergeben. Modellvorstellung Der Holzapfelkrieg Eine Bildergeschichte von R. E. Dickerson & I. Geis, Chemie - eine lebendige und anschauliche Einführung, Verlag Chemie, Weinheim, S. 321f. (1981) Bild 1: Amadeus Bärtsch 16. April 2016 Fachdidaktik Chemie ETH Chemisches Gleichgewicht S. 3 Bild 2: Bild 3: Bild 4: Bild 5: Amadeus Bärtsch 16. April 2016 Chemisches Gleichgewicht S. 4 Fachdidaktik Chemie ETH Fragen 1. Wie geht die Geschichte weiter? Überlegen Sie wie Bild 5 aussehen wird. 2. Warum kann der Junge seinen Garten nie ganz leeren? 3. Warum ist die Zahl der Äpfel in den Gärten verschieden? 4. Was hat die Geschichte mit dem chemischen Gleichgewicht zu tun? Auswertung Am Ende stellt sich ein dynamisches Gleichgewicht ein: Der Junge und der Mann werfen in derselben Zeit die gleiche Zahl Äpfel. Wie ist das möglich? Modellexperiment Wasser wird mit unterschiedlich dicken Glasrohren zwischen den beiden Messzylindern ausgetauscht (W. Asselborn et al. (Hrsg.), Chemie heute SII, Schroedel, Braunschweig, 2009) Erkenntnisse: Gleichgewicht bedeutet nicht gleich grosse Konzentration von Edukt und Produkt Der Anfangszustand beeinflusst die Gleichgewichtslage nicht Amadeus Bärtsch 16. April 2016 Fachdidaktik Chemie ETH Chemisches Gleichgewicht S. 5 Erfahrung beim Einsatz im Unterricht: Problem: das System ist weit weg von chem. Reaktionen Die Schülerinnen und Schüler, die den Holzapfelkrieg nicht durchschauen, verstehen auch nicht, warum sich hier ein Gleichgewichtszustand einstellt Das Massenwirkungsgesetz Die Reaktion von Wasserstoff H2 und Iod I2 wurde besonders gut untersucht. Werden die beiden Substanzen gemischt und erhitzt, so reagieren sie nicht vollständig zu Iodwasserstoff HI. Ein Teil der Edukte bleibt übrig, weil sich ein dynamisches Gleichgewicht einstellt, wie es in der Abbildung von Dickerson und Geis zu sehen ist (R. E. Dickerson & I. Geis, Chemie - eine lebendige und anschauliche Einführung, Verlag Chemie, Weinheim, S. 328, 1981): In einem Gefäss von 10 Litern werden Iod und Wasserstoff bei Raumtemperatur gemischt: Damit die Substanzen miteinander reagieren, wird die Mischung auf 450 °C erhitzt. Nach einigen Stunden stellt sich ein Gleichgewicht ein. Die Zusammensetzung ändert sich jetzt nicht mehr. Eine Messung ergibt, dass 0,22 mol H2, 0,22 mol I2 und 1,56 mol HI vorliegen. In der Reaktionsgleichung ist die Analogie mit dem Holzapfelkrieg besser zu erkennen als in der Abbildung mit den Gasmolekülen. H2 + I2 2 HI Links stehen die Edukte, die den Äpfeln auf der Seite des Alten entsprechen. Rechts findet man die Produkte, die Äpfel im Garten des Jungen. Amadeus Bärtsch 16. April 2016 Chemisches Gleichgewicht S. 6 Fachdidaktik Chemie ETH Die Reaktionsgeschwindigkeiten hängen von den Konzentrationen ab: Für die Hinreaktion ist vhin = khin · [H2] · [I2] Für die Rückreaktion ist vrück = krück · [HI]2 Ein Gleichgewicht stellt sich ein, wenn die Hin- und Rückreaktion gleich schnell sind: vhin = vrück khin · [H2] · [I2] = krück · [HI]2 khin [HI]2 K = ——– = ————– krück [H2] · [I2] Die Gesetzmässigkeit des konstanten Konzentrationsverhältnis von Produkten und Edukten in einem Gleichgewicht wurde 1867 von den Norwegern Guldberg und Waage entdeckt und als Massenwirkungsgesetz bezeichnet, weil Konzentrationen damals noch als wirksame Massen bezeichnet wurden. Es bietet sich an, die Gleichgewichtskonstante auszurechnen. Das Gleichgewicht liegt rechts. Erklären Sie was mit dieser Sprechweise gemeint ist. An dieser Stelle sollten die Schüler einige Aufgaben lösen, damit sie andere Reaktionen kennen lernen und sich aktiv mit dem Konzept des dynamischen Gleichgewichts auseinandersetzen. Auf Partialdruck und Kp gehe ich im Unterricht nicht ein. Experimente Eisen(III)- und Rhodanid-Ionen reagieren miteinander Fe3+(aq) + 3 SCN-(aq) Fe(SCN)3(aq) Die Edukte sind farblos, das Fe(SCN)3 rostrot. (Reaktionsgleichung gemäss M. Stieger, Elemente, Klett und Balmer, Zug, S. 197 (2007) . Die Anleitung finden Sie in der Versuchsammlung der Kantonsschule Freudenberg auf http://fdchemie.pbworks.com/w/page/47971610/Experimentierkurs) Empfehlung: Reaktionsgleichung vereinfachen Fe3+(aq) + SCN-(aq) Amadeus Bärtsch FeSCN2+(aq) 16. April 2016 Chemisches Gleichgewicht S. 7 Fachdidaktik Chemie ETH Welche zentralen Erkenntnisse können mit diesem Experiment demonstriert werden? Im chemischen Gleichgewicht sind immer noch alle Substanzen vorhanden Wird die Konzentration einer Substanz verändert, werden alle Konzentrationen verändert so, dass die Gleichgewichtskonstante eingehalten wird. Veresterung mit Wasserabscheider (siehe Arbeitsblatt von Renato Galli, Praktikumslehrer an der Kantonsschule Zürcher Oberland in Wetzikon, http://fdchemie.pbworks.com/w/page/52263492/Chemisches Gleichgewicht) CH3COOH + CH3(CH2)4OH CH3COO(CH2)4CH3 + H2O Einige Tropfen konzentrierte Schwefelsäure dienen als Katalysator Alternativen ohne Toluol: Wie Toluol bildet auch Cyclohexan ein Azeotrop mit Wasser. Vorteil: Cyclohexan besitzt einen tieferen Siedepunkt und verdampft zuerst aus dem Reaktionsgemisch Essigsäure und Pentanol; kein Lösungsmittel. Edukte und Produkte verdampfen. Im Wasserabscheider wird das Wasser aus dem Gleichgewicht entfernt. Der Ester hat einen angenehmen Geruch. Ameisensäure und Methanol. Ester abdestillieren. Kein Wasserabscheider Erkenntnis: In diesem Experiment sehen wir, dass sich die Auseinandersetzung mit dem Gleichgewicht gelohnt hat: Edukte können vollständig umgesetzt werden Amadeus Bärtsch 16. April 2016 Fachdidaktik Chemie ETH Chemisches Gleichgewicht S. 8 Das Prinzip von Le Châtelier "Das Prinzip des kleinsten Zwangs" fasst alle Beobachtungen zusammen: Werden Temperatur, Druck oder Konzentration verändert, verschiebt sich ein chemisches Gleichgewicht so, dass die Änderung abgeschwächt wird. (formuliert nach Klemens Koch, Fachdidaktik Chemie, Universität Bern) oder: Übt man auf ein im Gleichgewicht befindliches System einen Zwang aus, verschiebt sich das Gleichgewicht so, dass die Folgen des Zwanges vermindert werden. (Markus Stieger, Elemente, Grundlagen der Chemie für Schweizer Maturitätsschulen, Klett und Balmer, Zug, S. 201, 2007) Henry Louis Le Châtelier (1888) Bemerkung: Das Wort "verschieben" ist gefährlich und muss gut erklärt werden Vorgehen Das Prinzip von Le Châtelier ist eine wichtige und sinnvolle Merkhilfe. Es ist aber kein Gesetz, weil die Verschiebung des Gleichgewichts nicht mit physikalisch-chemischen Argumenten begründet wird. Weil die Schülerinnen den Einfluss einer Konzentrationsänderung auf das Gleichgewicht bereits kennen, kann jetzt gezeigt werden, dass das Prinzip von Le Châtelier plausibel ist, weil es zu demselben Resultat führt. Anschliessend kann der Einfluss von Temperatur- und Druckänderungen auf Gleichgewichte auf der Basis von Le Châtelier diskutiert werden. Wenn die Konzentration ändert Die Häufigkeit der Zusammenstösse erklärt, wie Konzentrationsänderungen chemische Gleichgewichte beeinflussen. Das Prinzip des kleinsten Zwangs kommt zum selben Ergebnis. Es beschreibt den Einfluss folgendermassen: (Markus Stieger, Elemente, Grundlagen der Chemie für Schweizer Maturitätsschulen, Klett und Balmer, Zug, S. 198, 2007) Amadeus Bärtsch 16. April 2016 Chemisches Gleichgewicht S. 9 Fachdidaktik Chemie ETH Die Beobachtungen mit dem Holzapfelkrieg deuten 1. Ein Gärtner leert eine Schubkarre voll Äpfel in den Garten des Jungen. Welche Folgen haben diese Äpfel auf den Ausgang des Holzapfelkriegs? 2. Im Garten des Jungen taucht ein Schwein auf, das die Äpfel frisst. Welche Folgen hat ein fressendes Schwein im Garten des Jungen auf den Verlauf des Holzapfelkriegs? Wenn die Temperatur ändert Experiment: N2O4 2 NO2 N2O4 ist farblos, Stickstoffdioxid ist braun. Die Anleitung finden Sie in der Versuchsammlung der Kantonsschule Freudenberg unter http://fdchemie.pbworks.com/w/page/47971610/Experimentierkurs Eine Tabelle mit den Bindungsenergien steht am Ende des Dossiers Ziel: Das Prinzip von Le Châtelier an einem Experiment aufzeigen Auswertung Variante a) von Prof. Blumes Bildungsserver für Chemie http://www.chemieunterricht.de/dc2/mwg/no2-n2o4.htm Amadeus Bärtsch 16. April 2016 Fachdidaktik Chemie ETH Chemisches Gleichgewicht S. 10 Variante b) von Andrea Lindblom Variante c) Variante d) Amadeus Bärtsch 16. April 2016 Fachdidaktik Chemie ETH Chemisches Gleichgewicht S. 11 Ammoniak aus den Elementen herstellen Ammoniak ist wichtig Aus Ammoniak werden beispielsweise Dünger, Sprengstoffe und Kunststoffe gewonnen: Wie kann möglichst schnell viel Ammoniak hergestellt werden? Es lohnt sich, diese Frage als Aufgabe und Zusammenfassung des ganzen Kapitels zu stellen. Auftrag: Erklären Sie mit dem Prinzip von Le Châtelier, welche Temperatur und welcher Druck optimal für die Synthese von Ammoniak aus Wasserstoff und Stickstoff sind? Die Reaktionswärme kann mit Hilfe der Bindungsenergien bestimmt werden. Eine Tabelle mit den Bindungsenergien finden Sie auf der nächsten Seite. Geschichte Fritz Haber (1868 - 1934): Im Frieden für die Menschheit, im Krieg fürs Vaterland Hervorragender Film: Im Krieg fürs Vaterland (FWU, Institut für Film und Bild in Wissenschaft und Unterricht, Grünwald, 1998). Der Film zeigt, dass eine Reaktionsgleichung den Krieg und die Landwirtschaft beeinflusst hat. Amadeus Bärtsch 16. April 2016 Chemisches Gleichgewicht S. 12 Fachdidaktik Chemie ETH Bindungsenergien (Durchschnittliche Werte in kJ/mol bei 25 °C) Br Br 193 Cl Cl 242 N C 305 Br C 285 Cl H 431 N C 891 Br H 366 N H 391 F C 489 N N 163 C Br 285 F F 159 N N 418 C C 348 F H 567 N N 945 C C 614 N O 201 C C 839 H Br 366 N O 607 C Cl 339 H C 413 C F 489 H Cl 431 O C 358 C H 413 H F 567 C in CO2 803 C N 305 H H 436 O C 707 C N 891 H I 298 O H 463 C O 358 H N 391 O N 201 O in CO2 803 H O 463 O N 607 O O 146 O O 498 C C Cl O C 707 339 I H 298 I I 151 O Übung 5: Säuren & Basen 1. Entwerfen Sie eine Lernaufgabe mit beliebigen Protolysen, die den Gebrauch der S/B-Reihe zeigt. Bitte geben Sie den Input, die Aufgaben, die Lösungen und die Erkenntnisse an. Eine S/B-Reihe finden Sie auf S. 450 im Buch "Elemente". oder: Sie erklären das Auflösen von Kalk an der Wandtafel. Entwerfen Sie die Wandtafeldarstellung. 2. a) Es ist sinnvoll, wenn Sie das chemische Gleichgewicht vor den Säure-Base-Reaktionen diskutieren. So kennen die Schüler die Gleichgewichtskonstante K, wenn Sie den pKs-Wert einführen. Bitte erklären Sie den pKs-Wert an einem Beispiel, so dass es ein Schüler verstehen kann und beschreiben Sie die Knackpunkte der Erklärung. b) Kann der pKs-Wert weggelassen werden? Welche Nachteile ergeben sich? 3. Welche Erkenntnisse über Indikatoren sollen die Schülerinnen im Unterricht gewinnen? Erwartung: Dokument von 1 bis 2 Seiten Länge, das kleiner als 2 MB ist. Am liebsten im WordFormat, im Notfall als PDF. Abgabe bis spätestens Donnerstag, 21. April 2016, 15 Uhr per Mail an [email protected]. Amadeus Bärtsch 16. April 2016