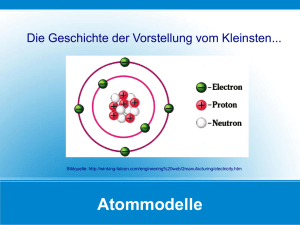
PowerPoint-Präsentation
Werbung

uSchritt 1 Wie lautet die Formel? Überlegt zunächst welche Eigenschaften der Atome für das Ausbilden chemischer Bindungen wichtig sind. Wichtige Eigenschaften der Atome für das Ausbilden chemischer Bindungen sind: Wie könnt ihr diese Eigenschaften in Erfahrung bringen? Diese Information lässt sich dem Periodensystem der Elemente entnehmen. Metall oder Nichtmetall ? Anzahl der Außenelektronen? uSchritt 2 Wie lautet die Formel? Zeichnet für alle an eurem Beispiel beteiligten Atomsorten, wie die Elektronen in den Sphären verteilt sind. Hebt die Außenelektronen farbig hervor. zB Li: ● 3+ ● ● Vergleicht mit eurer Mitschrift (Vorderseite des DINA3Blattes) uSchritt 3 Wie lautet die Formel? Vereinfache in einer zweiten Zeichnung die Darstellung der Atome so weit, dass sie nur mehr das Elementsymbol und die Außenelektronen zeigt. N Cl Na Mg uSchritt 4 Wie lautet die Formel? Besprecht, welche Art der chemischen Bindung diese Atome untereinander eingehen. Berücksichtigt dabei, ob die Atome viele oder wenige Außenelektronen haben. Nichtmetallatome (viele Außenelektronen) unter sich Elektronenpaarbindung (Atombindung) Metallatome (wenig Außenelektronen) unter sich Metallbindung Metallatome und Nichtmetallatome Ionenbindung Elektronenpaarbindung uSchritt 5 Wie lautet die Formel? Erklärt einander, was ihr über das Zustandekommen dieser Bindung wisst. Überlegt, ob in der Folge Moleküle, Ionengitter (Salze) oder Metallgitter entstehen? Elektronenpaarbindung: Nichtmetallatome bilden und benützen gemeinsam Elektronenpaare. Dabei entstehen in der Regel Moleküle (selten Atomgitter) Metallbindung: Metallatome geben ihre Außenelektronen an die Gemeinschaft ab. Die entstehenden Metallkationen (+) sind in den freibeweglichen Elektronen (-) eingebettet. Es entstehen Metallgitter Ionenbindung: Die Metallatome geben ihre Außenelektronen an die Nichtmetallatome ab. Die entstehen Metallkationen (+) und Nichtmetallanionen (-) ordnen sich regelmäßig an. Es entstehen Ionengitter (Salze) uSchritt 6 Wie lautet die Formel? Veranschaulicht nun anhand einer Skizze, die Bindung zwischen den Atomen eures Beispiels. Berücksichtigt bei Molekülen (Elektronenpaarbindung) wie viele Bindungen jedes Atom eingehen muss. Beachtet bei Metallen (Metallbindung) und bei Salzen (Ionenbindung) wie viel e- abgegeben bzw. aufgenommen werden. Vergleicht euer Ergebnis mit dem einer anderen Schülergruppe. Handelt es sich um ein Molekül, so baut mit Hilfe des Molekülbaukastens ein Modell dafür und vergleicht es mit eurem Ergebnis. Besprecht euer Ergebnis abschließend mit der Lehrperson. Vorderseite Rückseite (später innen) Hinweise und Fragen, die helfen sollen der Antwort der Leitfrage schrittweise näher zu kommen. Lösung/Antwort für den Schritt x uSchritt x Thema/Leitfrage