VL Biochemie 9
Werbung

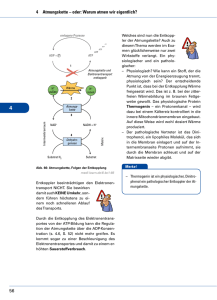
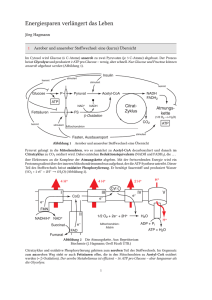
Bioenergetik Prof. Dr. Albert Duschl Gesetze der Thermodynamik 1. Gesetz: Die Summe der Energie im Universum ist gleich. 2. Gesetz: Die Entropie nimmt zu. Geordnete Strukturen, wie Lebewesen, verletzen den 2. Satz der Thermodynamik nicht. Sie stellen zwar lokale Anomalien dar, halten die eigene Ordung aber nur aufrecht indem sie anderswo die Entropie erhöhen. Der zweite Satz verletzt den ersten auch nicht, denn die Energie geht ja nicht verloren. Sie wird nur in eine nicht für Arbeit nutzbare Form umgewandelt (Wärme). Die Gesamtmenge an Energie eines Systems ist immer grösser als die freie Energie, also die Menge an Energie die zur Verfügung steht um Arbeit zu leisten. Ein Teil der Gesamtenergie wird bei jeder Umsetzung zu Wärme umgesetzt und erhöht so die Entropie. Keith Haring: Ohne Titel Gibbs'sche Freie Energie 1 Die potentiell nutzbare, freie Energie ist die Gibbs'sche freie Energie, G. Wenn das System während einer Reaktion freie Energie verliert, ist die Änderung von G, ΔG, negativ: ΔG < 0. Die Reaktion ist dann exergonisch. Wird während der Reaktion die freie Energie erhöht, ΔG > 0, ist die Reaktion endergonisch. Für jede Reaktion gilt ΔG = ΔH - TΔS. H ist der Wärmegehalt des Sytems. Wird Wärme freigesetzt so hat das System nachher ein niedrigeres H, also ist ΔH < 0 (exotherme Reaktion). Muss von aussen Wärme zugeführt werden damit die Reaktion abläuft ist ΔH > 0. Positives ΔH definiert eine endotherme Reaktion. T ist die absolute Temperatur in °K und S ist die Entropie. Wenn die Produkte weniger Ordnung haben als die Substrate ist ΔS >0. Wird durch die Reaktion die Ordnung erhöht ist ΔS < 0. Beispiel für Zunahme der Entropie: Lösung von Salz in Wasser. Beispiel für Abnahme der Entropie: Kristallisation von Salz bei Verdunsten des Wassers. Da Wasserdampf eine höhere Entropie hat als flüssiges Wasser, wird insgesamt gesehen auch in diesem Fall die Entropie erhöht. Gibbs'sche Freie Energie 2 Die Beziehung ΔG = ΔH - TΔS beschreibt also, ob eine Reaktion Energie freisetzt (exergonisch) oder Energiezufuhr benötigt (endergonisch). Das hängt ab von der Änderung der Temperatur (exotherm oder endotherm) und der Änderung der Entropie. Immer dann wenn ein System nicht im Gleichgewicht ist, gibt es eine Triebkraft die auf eine Einstellung des Gleichgewichts hindrängt. Diese Triebkraft ist die Änderung der Gibbs'schen freien Energie, ΔG. Für eine chemische Reaktion A → B lässt sich definieren: [B] ΔG = ΔG° + RT ∙ ln ——— [A] ΔG° ist die Änderung der freien Energie unter Standardbedingungen (1 atm, 25°C, 1 M Konzentration von Substrat und Produkt) R ist die Gaskonstante T ist die absolute Temperatur Für biologische Reaktionen verwendet man ΔG°', dabei ist noch pH = 7 Gibbs'sche Freie Energie 3 Mit der Beziehung [B] ΔG = ΔG°' + RT ∙ ln ——— [A] kann man ausrechnen, ob eine Reaktion A → B abläuft. Bei negativem ΔG (ΔG < 0) erniedrigt sich die freie Energie des Systems und die Reaktion läuft freiwillig ab. Im Gleichgewicht ist die treibende Kraft ΔG = 0 [B] [B] ΔG = 0 = ΔG°' + RT ∙ ln —— oder - ΔG°' = RT ∙ ln —--[A] [A] Ob die Reaktion in vivo wirklich abläuft wird von weiteren Parametern abhängen, wie dem Schicksal der Produkte (Fließgleichgewicht!). © Nelson/Cox: Lehninger Principles of Biochemistry Massendefekt Die Quelle fast aller biologisch genützten Energie ist letztlich die Sonne. Zu einem geringen Anteil spielen auch andere Prozesse eine Rolle, etwa Wärmegradienten die durch natürliche Radioaktivität oder durch geothermale Prozesse erzeugt werden. In der Sonne findet der Prozess 4 H → He statt. Da ein Helium leichter ist als vier Wasserstoff (Massendefekt) wird die fehlende Masse in die äquivalente Energie überführt (E = m ∙ c²). Diese Energie wird in Form von elektromagnetischer Strahlung abgegeben. Ein Teil der auf die Erde fallenden Sonnenstrahlung kann durch Photosynthese biologisch genutzt werden. © Henri Rousseau: Urwaldlandschaft mit untergehender Sonne. Bioenergetics made simple to the point of inaccuracy Photosynthese Die Lichtreaktion der Photosynthese erzeugt Reduktionsäquivalente (NADPH) und einen Protonengradienten, der zur ATP-Synthese verwendet wird (Peter Mitchell). © both figures Nelson/Cox: Lehninger Principles of Biochemistry Calvin-Zyklus Im Calvin-Zyklus wird CO2 aus der Luft fixiert. Es wird Glycerinaldehyd-3-Phosphat erzeugt, das letzlich zu Glucose umgewandelt werden kann. © both figures Mohr/Schopfer: Lehrbuch der Pflanzenpysiologie Glycolyse Für die Glycolyse wird aus Glycogen, Stärke oder anderen Quellen Glucose erzeugt und dann in zwei Moleküle Pyruvat zerlegt. Die Reaktion gewinnt netto 2 ATP und 2 NADH. © Nelson/Cox: Lehninger Principles of Biochemistry Pyruvat Das Endprodukt der Glykolyse ist Pyruvat. Für den aeroben Abbau wird Pyruvat in die Mitochondrienmatrix transportiert und dort von der Pyruvatdehydrogenase in AcetlyCoA umgesetzt. Der Transport über die innere Mitochondrienmembran erfolgt teils durch passive Diffusion über die Membran, teils über den Mitochondrial Pyruvate Carrier (MPC). Beide Prozesse werden vom pH-Gradienten angetrieben. TCA Cycle (Tricarboxylic acid cycle) ist ein Synonym für den Krebs Cycle der wieder das gleiche ist wie der Citratzyklus. Zu dem kommen wir gleich. © Divakaruni and Murphy, Science 337:41-43 (2012) Citratzyklus Im Citratzyklus werden aktivierte Acetylgruppen (also Acetyl Coenzym A) in 2 CO2 zerlegt. An vier Stellen werden Reduktionsäquivalente gewonnen (3 NADH + H+, 1 FADH2). Ausserdem wird 1 GTP erzeugt. Das CO2 wird abgeatmet. Das eingeschleuste AcetylCoA muß nicht aus der Glycolyse kommen. Ein wichtiger Lieferant ist die ß-Oxidation der Fettsäuren. © Stryer: Biochemistry Atmungskette In der Atmungskette werden die Reduktionsäquivalente verwendet um mit Luftsauerstoff Wasser zu erzeugen. Dabei entsteht ein Protonengradient, der zur Gewinnung von ATP genutzt werden kann (nochmal Peter Mitchell). © Löffler/Petrides: Biochemie und Pathobiochemie © Koolman/Röhm: Taschenatlas Biochemie Hemmstoffe der Atmungskette Die Atmungskette verbraucht 90% des eingeatmeten O2. Sie wird gehemmt durch - Substratmangel (Sauerstoffmangel) - Rotenon (hemmt Komplex I ; Insektizid) - Antimycin (hemmt Cytochrom c-Reduktase) - Cyanid (hemmt Cytochrom-c-Oxidase) - Kohlenmonoxid (hemmt Cytochrom-c-Oxidase) Der Elektronentransport der Atmungskette wird nicht gehemmt durch Zerstörung der Mitochondrienmembran, wie sie etwa in der Apoptose auftritt. Man kann in Mitochondrienfragmenten alle Reaktionen der Atmungskette bis zu Komplex IV messen. Nur Komplex V, die ATPsynthase, ist aus Mangel an Triebkraft nicht mehr funktionsfähig. Die Atmungskette wird auch nicht gehemmt durch Entkoppler die Protonen über die innere Mitochondrienmembran befördern, wie 2,4-Dinitrophenol. Im Fall des Protonenkanals Thermogenin im braunen Fettgewebe von Neugeborenen und Winterschläfern ist das physiologisch erwünscht: Die Atmungskette läuft hier nur um Wärme zu erzeugen, nicht aber ATP. Zusammenfassung Leben benötigt Energie in nutzbarer Form. Das ist zunächst vor allem Lichtenergie. In Licht- und Dunkelreaktion der Photosynthese wird Glucose erzeugt: 6 CO2 + 6 H2O → C6H12O6 + 6 O2. Das ist auch die Quelle des Luftsauerstoffs. In Glycolyse, Citratzyklus und Atmungskette wird Glucose wieder zu CO2 und H2O zerlegt. Beim vollständigen Abbau eines Moleküls Glucose entstehen 38 Moleküle ATP. Die Energieausbeute beträgt damit ca. 40% der physikalischen Verbrennungsenergie. Der Rest geht als Wärme verloren, kann dabei aber noch als Körperwärme nützlich sein. Jan Breughel d. Ä.: Der Garten Eden