Synthese von Aromastoffen (Fruchtestern)
Werbung

Schwerpunktfach Biologie/Chemie
6. Kl.
1/4
Praktikum 1: Synthese von Aromastoffen (Fruchtestern)
Synthese von Aromastoffen (Fruchtestern)
Einführung
In diesem Praktikum sollst du Aromastoffe, jeweils aus einem Alkohol und einer Carbonsäure, synthetisieren. Die Alkohole und Carbonsäuren lassen sich von den Alkanen ableiten – eine bestimmte funktionelle Gruppe ist diesen Stoffklassen zu eigen.
Alkohole
Alkohole ('Alkan-ole') enthalten die funktionelle Gruppe ~OH (Hydroxylgruppe):
R–OH
Methanol (Methylalkohol)
Ethanol (Ethylalkohol)
Ethan-1,2-diol (Glykol)
Propan-1,2,3-triol (Glycerin)
3-Methylbutan-2-ol (Isopentylalkohol)
1-Pentanol (Pentylalkohol)
Die stark polare Hydroxylgruppe bestimmt die Eigenschaften der Alkohole:
• Hohe Siedepunkte im Vergleich zu den entsprechenden Alkanen durch Bildung von H-Brücken.
• Bessere Wasserlöslichkeit als entsprechende Alkane durch stark polare OH-Gruppe. Bei kurzkettigen
Alkoholen überwiegt der Einfluss der hydrophilen OH-Gruppe. Mit wachsender Kettenlänge nimmt das
hydrophobe Verhalten des Kohlenwasserstoffrests zu – die Wasserlöslichkeit sinkt.
Alkohole finden Anwendung als Lösungs-, Desinfektions-, Frostschutzmittel, Bremsflüssigkeit sowie als
Trägersubstanz für Wirkstoffe in Kosmetika und Medikamenten.
Carbonsäuren
Carbonsäuren enthalten die funktionelle Gruppe ~COOH (Carboxylgruppe):
R–COOH
Methansäure (Ameisensäure)
Ethansäure (Essigsäure)
Propansäure (Propionsäure)
Butansäure (Buttersäure)
Hexadecansäure (Palmitinsäure)
C15H31COOH
2-Hydroxypropan-1,2,3-tricarbonsäure (IUPAC), 3-Carboxy-3-hydroxypentan-1,5-disäure (Citronensäure)
E 330
Schwerpunktfach Biologie/Chemie
6. Kl.
2/4
Praktikum 1: Synthese von Aromastoffen (Fruchtestern)
Die funktionelle Gruppe COOH (Carboxylgruppe) bestimmt die Eigenschaften der Carbonsäuren:
• Hohe Siedepunkte im Vergleich zu den entsprechenden Alkanen und Alkoholen durch Bildung
von H-Brücken und Anwesenheit einer weiteren
polaren Gruppe (C=O-Bindung).
• Bei kurzkettigen Carbonsäuren überwiegt der Einfluss der hydrophilen COOH-Gruppe. Mit wachsender Kettenlänge nimmt das hydrophobe Verhalten des Kohlenwasserstoffrests zu – die Wasserlöslichkeit sinkt.
• Die langkettigen Carbonsäuren sind am Aufbau
der Fette beteiligt. Man nennt sie deshalb Fettsäuren. Fettsäuren mit C=C-Doppelbindungen gehören zu den ungesättigten Fettsäuren.
• Das H-Atom der COOH-Gruppe kann abgespalten
werden: Carbonsäuren sind schwache Säuren.
In Triacylglycerinen (Fette) sind langkettige Carbonsäuren
(Fettsäuren) an Glycerin gebunden.
Carbonsäuren finden Anwendung als Konservierungsmittel sowie Entkalkungsmittel.
Carbonsäureester
Carbonsäuren reagieren mit Alkoholen unter geeigneten Bedingungen (konz. Schwefelsäure, Erhitzen)
1
2
und unter Abspaltung von Wasser zu Estern (Carbonsäureestern: R –COO–R ):
Bsp.:
O
O
OH
+
Ethansäure
(Carbonsäure)
HO
O
Ethanol
(Alkohol)
Ethansäureethylester
(Carbonsäurester)
+
H2O
Wasser
In gleicher Weise können andere Carbonsäuren mit anderen Alkoholen zu Estern reagieren. In diesem
Praktikum wirst du im Rahmen einer Postenarbeit 6 Aromastoffe (Fruchtester) synthetisieren. An jedem
Posten (Abzug 1–6) stellst du je einen Aromastoff her.
Lernziele:
Sicherheit:
•
Du kannst einfache Alkohole und Carbonsäuren benennen (homologe Reihe) sowie
deren Siedepunkt und Wasserlöslichkeit im Vergleich zu den entsprechenden Alkanen beurteilen.
•
Du kannst die Reaktionsgleichung für die Reaktion eines gegebenen Alkohols und
einer Carbonsäure mit Lewis-Formeln formulieren sowie die Produkte benennen.
Du arbeitest mit konzentrierten Säuren, insbesondere mit Schwefelsäure. Das
Tragen der Schutzbrille ist für alle obligatorisch, auch für Personen, die nicht direkt
hantieren! Hautkontakt mit Säure: sofort mit Wasser abwaschen. Säure in den Augen: Sofort den ganzen Inhalt des Augensprays (ganz vorne bei der zentralen Ablage) zur Anwendung bringen. Ansonsten das Auge sofort unter dem Wasserhahn
ausspülen – mindestens 10 min lang. Anschliessend Arzt aufsuchen. Säure auf der
Arbeitsfläche: mit Haushaltspapier aufputzen. Hände waschen.
Buttersäure riecht sehr penetrant, das ist dann besonders unangenehm, wenn ein
(!) Tropfen auf die Kleidung gerät.
Schwerpunktfach Biologie/Chemie
6. Kl.
3/4
Praktikum 1: Synthese von Aromastoffen (Fruchtestern)
Versuch
Geräte / Material
•
•
•
•
•
6 Reagenzgläser
RG-Stopfen (Plastik)
RG-Gestell
Folienstift
Haushaltspapier
• Schutzbrille
• Postenblätter 1–6 (Abzug 1–6)
• Sammelglas zur Entsorgung,
zentral (Abzug 1)
Vorbereitet für je 2 Gruppen (3x):
• Heizgerät
• Thermometer
• Becherglas (250 ml) mit
150 ml Wasser bei rund 60 °C
Chemikalien
Vorbereitet mit je einer beschrifteten Pastette pro Flüssigkeit:
• Posten 1: Ameisensäure, Ethanol
• Posten 2: Essigsäure,
1-Pentanol
• Posten 3: Propionsäure, Methanol
• Posten 4: Propionsäure, Isopentylalkohol
• Posten 5: Buttersäure,
Methanol
• Posten 6: Buttersäure (von Posten 5), Ethanol
(1)
Vorbereitet für je 2 Gruppen (3x):
• konz. Schwefelsäure mit
Pastette und Halter
• Natriumhydrogencarbonatlösung (5 %) in Pipettenflasche zur Neutralisation
Beschrifte 6 Reagenzgläser mit deinen Initialen und nummeriere diese von 1–6. Auf der Tabelle,
S. 4, hast du 6 Reaktionen aufgeführt, die du heute durchführen wirst. In den nummerierten Reagenzgläsern führst du bitte die entsprechenden Reaktionen durch (RG Nr. 1 = Reaktion Nr. 1,
durchzuführen am Posten Nr. 1). Beginne bei einem freien Posten.
Verwende unbedingt für jeden Reinstoff (Flüssigkeit) die dafür vorgesehene Pastette.
(2)
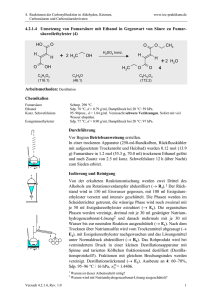
(Abzug) In ein Reagenzglas werden 8 Tropfen der Carbonsäure (Achtung – von der übel
riechenden Buttersäure nur 2 Tropfen!) und 8 Tropfen des Alkohols gegeben. Anschliessend wird
das Gemisch vorsichtig (!!!) mit 8 Tropfen der konz. Schwefelsäure versetzt. Dabei erwärmt sich
das Reaktionsgemisch leicht.
Erklärung: Die Schwefelsäure übernimmt hier zwei Funktionen: Sie ist Katalysator und gleichzeitig Reaktionspartner. Zudem
entzieht sie dem Gleichgewichtssystem das während der Reaktion entstehende Wasser.
Verschliesse das Reagenzglas nur mit wenig Druck mit einem Stopfen. Stelle das Gemisch für ca.
5 Minuten in das heisse Wasser (steht am Arbeitsplatz bereit, sollte immer etwa 60 °C warm sein).
(3)
In der Zwischenzeit kannst du jeweils die Strukturformeln der beteiligten respektive entstehenden
Stoffe in der Tabelle auf der Seite 4 (und auf der Seite 1) ergänzen. Orientiere die Moleküle so (vgl.
S. 2), wie sie sich über ihre funktionellen Gruppen miteinander verbinden.
(4)
Zur Aufbereitung des Reaktionsgemisches aus Schritt (2) werden vorsichtig 2 ml (1 ganze Pasteurpipette voll) einer wässrigen Natriumhydrogencarbonatlösung (5 %) in das Reagenzglas gegeben.
Dabei entsteht Kohlensäure, welche sich unter Freisetzung von Kohlendioxidgas zersetzt. Schüttle
das Reagenzglas leicht ('Tap-tap-tap' mit kleinem Finger), bis keine Gasentwicklung mehr zu beobachten ist.
Erklärung: Der kleine Anteil der nicht umgesetzten Carbonsäure und die Schwefelsäure werden durch die Natriumhydrogencarbonatlösung neutralisiert, wobei aus den stechend bis übel riechenden Carbonsäuren organische Salze entstehen:
Bsp:
+
–
CH3COOH (l) + Na (aq) + HCO3 (aq)
Ethansäure
Natriumhydrogencarbonat
→
+
–
H2CO3 (aq) + Na (aq) + CH3COO (aq)
Kohlensäure
Natriumethanoat (Natriumacetat)
Das Carbonsäuresalz löst sich gut in der wässrigen Phase. Deshalb gelangt beim Geruchtstest nur wenig nicht in die Salzform übergeführte Carbonsäure in äusserst geringer Konzentration zu deiner Nase. Der leichtflüchtige Carbonsäureester löst
sich zu einem sehr viel geringerem Teil in der wässrigen Phase und wird deshalb von deiner Nase sofort wahrgenommen.
(5)
Nun hält man ein mehrfach zusammengefaltetes Haushaltspapier auf die Öffnung des Reagenzglases und neigt das Reagenzglas vorsichtig, so dass etwas Flüssigkeit auf das Papiertüchlein gelangt: Nach welcher Frucht riecht der Carbonsäureester? Halte deine Wahrnehmung ebenfalls in
der Tabelle S. 4 fest.
(6)
Aufräumen/Entsorgung: Allfällige Reste sind in das zentrale Sammelgefäss (Becherglas) beim Posten 1 (vorderste Kapelle) zu entsorgen. Verwendetes Haushaltspapier kommt in den Papierkorb.
Die Reagenzgläser werden gereinigt, die Beschriftung entfernt (Ethanol/Haushaltspapier).
Schwerpunktfach Biologie/Chemie
6. Kl.
4/4
Praktikum 1: Synthese von Aromastoffen (Fruchtestern)
Auswertung
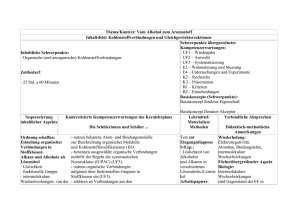
Po
Carbonsäure
(Strukturformel)
Alkohol
(Strukturformel)
Entstandener Ester
(Name und Strukturformel)
Geruch
1
Methansäure
(Ameisensäure)
Ethanol
Ananas
Apfel
Banane
'fruchtig'
Rum
2
Ethansäure
(Essigsäure)
1-Pentanol
Ananas
Apfel
Banane
'fruchtig'
Rum
3
Propansäure
(Propionsäure)
Methanol
Ananas
Apfel
Banane
'fruchtig'
Rum
4
Propansäure
(Propionsäure)
3-Methylbutan-1-ol
(Isopentylalkohol)
Ananas
Apfel
Banane
'fruchtig'
Rum
5
Butansäure
(Buttersäure)
Methanol
Ananas
Apfel
Banane
'fruchtig'
Rum
6
Butansäure
(Buttersäure)
Ethanol
Ananas
Apfel
Banane
'fruchtig'
Rum
Aufgaben
(1)
Formuliere die Reaktionsgleichung für die Reaktion 5 (mit Lewisformeln). Benenne Edukte und Produkte.
(2)
Zeige durch Rechnung bei der Reaktion 5, dass nicht stöchiometrische Mengen von Buttersäure
und Ethanol eingesetzt wurden.
Wir haben grundsätzlich von der Carbonsäure und vom Alkohol jeweils die gleiche Anzahl Tropfen
und damit das gleiche Volumen verwendet. Gehe für beide Stoffe von je 2 ml verwendetem Volumen aus. Die Dichte der Buttersäure ist 0.96 g/ml, die von Methanol liegt bei 0.80 g/ml.
(3)
Erkläre die beiden Fachbegriffe Kondensation und Hydrolyse.
(4)
Wieso hat der jeweilige Ester einen tieferen Siedepunkt als ein Alkohol oder eine Carbonsäure von
gleicher Kohlenstoffzahl?
(5)
Sind Ester in Wasser eher gut löslich? Begründe.
(6)
(Recherche) Was sind Wachse? Welche Funktion erfüllen sie physiologisch?
(7)
Was versteht man unter einem Fettsäureester?
(8)
Vergleiche die Esterbildung mit der Neutralisationsreaktion einer Säure und einer Lauge. Stelle die
Gemeinsamkeiten und Unterschiede in einer Tabelle dar.