3 Grundtypen der chemischen Bindung
Werbung
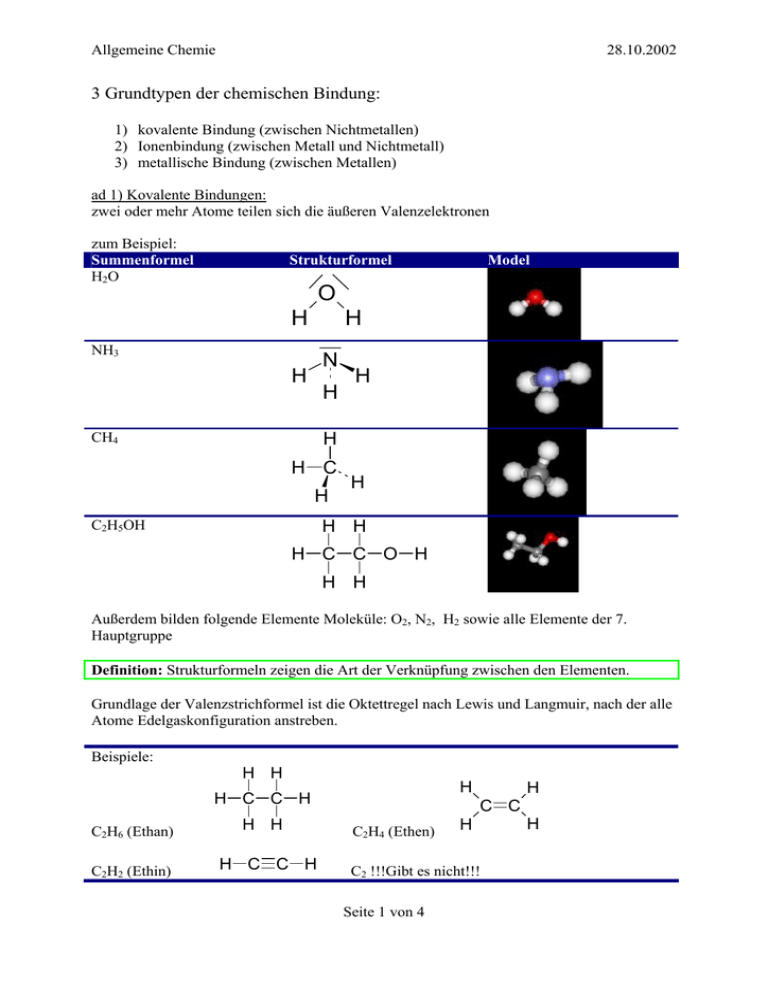
Allgemeine Chemie 28.10.2002 3 Grundtypen der chemischen Bindung: 1) kovalente Bindung (zwischen Nichtmetallen) 2) Ionenbindung (zwischen Metall und Nichtmetall) 3) metallische Bindung (zwischen Metallen) ad 1) Kovalente Bindungen: zwei oder mehr Atome teilen sich die äußeren Valenzelektronen zum Beispiel: Summenformel H2O Strukturformel Model O H H NH3 N H H H H CH4 H C H H H H C2H5OH H C C O H H H Außerdem bilden folgende Elemente Moleküle: O2, N2, H2 sowie alle Elemente der 7. Hauptgruppe Definition: Strukturformeln zeigen die Art der Verknüpfung zwischen den Elementen. Grundlage der Valenzstrichformel ist die Oktettregel nach Lewis und Langmuir, nach der alle Atome Edelgaskonfiguration anstreben. Beispiele: H H H H C C H C2H6 (Ethan) C2H2 (Ethin) H H H C C H H C C C2H4 (Ethen) H C2 !!!Gibt es nicht!!! Seite 1 von 4 H Allgemeine Chemie 28.10.2002 ad 2) Ionenbindung: vollständige Ladungsübertragung (Kation = positiv geladenes Teilchen, Anion = negativ geladenes Teilchen) 1 Beispiel: Kochsalzbildung 2 Na + Cl2 2 NaCl 2 Beispiel: Herstellung von Magnesiumchlorid Mg + Cl2 MgCl2 Die geladenen Teilchen (Ionen: Kation, Anion) bilden einen dreidimensionalen Verband aus, da die elektrostatischen Kräfte ungerichtet sind. ad 3) Metallbindung: freies Elektronengas umschließt positive Metallkerne Exkurs: Atome sichtbar gemacht: - endgültige Bestätigung des atomaren Aufbaus der Materie durch Röntgenbeugung in den 20er Jahren - vorher schon große Teile der Chemie geschaffen, auf der Atomhypothese aufbauend 1981 Team der IBM in Zürich (Binnig und Rohrer) bauen das erste Rastertunnelmirkoskop: Scanning Tunneling Microscope (STM) Prinzip: Tunnelspitze überstreift ein Objekt. Tunnelstrom (zwischen Spitze und Probe) wird in ein optisches Signal umgewandelt > atomare Auflösung Anwendung: Analysen von Biomolekülen (DNA) atomares verschieben von Atomen Ein ähnliches Prinzip liegt auch beim Rasterkraftmikroskop vor, wobei die Kraft gemessen wird mitdem auf die Oberfläche gedrückt wird. Seite 2 von 4 Allgemeine Chemie 28.10.2002 Das Rastertunnelmikroskop 1981 stellten die beiden IBMMitarbeiter Gerd Binning und Heinrich Röhrer der Öffentlichkeit ein neues Elektronenmikroskop vor. Bei diesem Mikroskop werden Elektronen eingesetzt welche einen schmalen Spalt zwischen zwei elektrisch leitenden Oberflächen „übertunneln“ können. Beim Rastertunnelmikroskop setzt man eine sehr feine Wolfrahmnadel ein welche als Elektronenquelle dient. An der Spitze der Wolframnadel steht genau ein Atom. Die Nadel wird in einem geringen Abstand zeilenweise (Atomzeilen) über die Oberfläche geführt. Dabei springen Elektronen von der Wolframnadel über den Spalt zur Probe. Zwischen Probe und Wolframnadel liegt nur eine Spannung von etwa 1 Volt, dass die Elektronen den Spalt überspringen kann mit einem quantenphysikalischen Phänomen erklärt werden. Man spricht in diesem Zusammenhang von einem so genannten Tunneleffekt. Der entstehende Tunnelstrom kann gemessen werden und in einem Rechner zu einem optischen Signal verrechnet werden. Da an der Spitze der Wolframnadel nur ein Atom steht erhält man ein Bild von dem atomaren Aufbau der Materie. Das Rastertunnelmikroskop kommt in nahezu allen naturwissenschaftlichen Disziplinen zum Einsatz und dient der Aufklärung des strukturellen Aufbaus der Materie. Avogardo, Molbegriff, Summenformel Nomenklatur zur Beschreibung chemischer Umsetzung in reiner Form beziehungsweise in Lösung: 2 H2 + O2 2 H2O (RKT Kalottenmodel) 2 Na + Cl2 2 NaCl “chemische Formel” beschreibt Zusammensetzung einer Verbindung - Ausgleich der Reaktionsgleichung: Masse bleibt konstant Begriff der Formeleinheit als „kleinstes gemeinsames chemisches Vielfaches“, das heißt H2O und nicht H4O2 Seite 3 von 4 Allgemeine Chemie - 28.10.2002 die Formeleinheit kann nur dann angegeben werden, wenn mikroskopische Kenntnis vorliegt Beispiel: Na2C2 und nicht NaC; NaCl und nicht Na100Cl100 Beispiel: Aufstellen einer Reaktionsgleichung hier: Verbrennen von Propan C3H8 + O2 CO2 + H2O (1) C3H8 + O2 3 CO2 + H2O (2, C ) C3H8 + O2 3 CO2 + 4 H2O (3, C , H ) C3H8 + 5 O2 3 CO2 + 4 H2O (4, C , H , O ) Überlegung: Beziehen sich die Gleichungen auf größere Ensembles oder werden hier nur Moleküle/ Atome/ Ionen bezeichnet? - Anstelle des Abzählens von kleinsten Teilchen, ist es sinnvoll, eine standardisierte größere Anzahl einzuführen: das Mol - 1 Mol: Stoffmenge, die so viele Atome, Moleküle, Ionen, Formeleinheiten enthält, wie Atome in genau 12g von 12C enthalten sind Das Mol überführt sozusagen von atomaren Maßeinheiten in Gramm, der dabei verwendete Multiplikator ist die Avogadro-Konstante/ Loschmid’sche Zahl NA= 6,022 · 1023 Teilchen/mol 12 Moleküle HCl = 1 Dutzend Moleküle HCl 6,022 · 1023 Moleküle HCl = 1 Mol Moleküle HCl NaCl: Na hat 23,0 amu Cl hat 35,5 amu 58,5 amu > 1 mol NaCl wiegt 58,5g Molare Masse: M(x) in g/mol beziehungsweise g·mol-1 - chemische Arithmetrik wird Stöchiometrie genannt (Lehre von den Zusammensetzungen und ihren Umrechnungen) Beispiel: C2H4 (g) + HCl C2H5 (l) (Ethylchlorid) 15g Ethen sind gegeben, Wie viel HCl ist für die vollständige Umsetzung notwendig? M(C2H4) = 28 g/mol M (HCl) = 36,5 g/mol 15 g n(C H ) = = 0,536mol 2 4 28 g / mol m(HCl) = 0,536 mol · 36,5 g/mol = 19,6g HCl Seite 4 von 4











