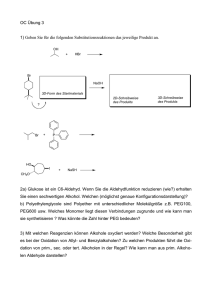
Netscape: Allgemeine Chemie BI
Werbung

Friday, February 2, 2001 Allgemeine Chemie B II Inhalt Index 9. Alkohole, Ether und Phenole Bis jetzt haben wir fast bei jedem Kapitel eine neue funktionelle Gruppe und auch eine wichtige neue Klasse von Mechanismen kennengelernt : Funktionelle Gruppe Alkene Schwerpunkt-Mechanismus Elektrophile Addition an Doppelbindungen Schwerpunkt - Reaktionen und Darstellung Reaktionen : Addition von HX, X2, H2O Hydrierung, Oxidation, Ozonolyse, Polymerisation. Darstellung : Eliminierungen (-HX),Dehydratisierung. Aromaten Halogenalkane Reaktionen : Nitrierung, Sulphonierung, Aromatizität Halogenierung, Friedel-Crafts - Alkylierung und - Acylierung. Mesomerie-Effekte Elektrophile Substitution an Benzolderivate Darstellung : Anwendung von Substitutionsreaktionen. Nucleophile-Substitutionen an sp3 Zentren (SN1, SN2) Eliminationsreaktionen (E1- und E2- Prozesse) Reaktionen : Nucleophile Substitutionen, Eliminierungen, Grignard -Verbindungen Darstellung : Elektrophile Addition an Alkene (X2, HX), Halogenierung von Alkanen, aus Alkoholen. In diesem Kapitel werden wir keine neue mechanistische Klasse sehen, sondern werden als Schwerpunkte folgendes betrachten ; 1) Struktur, Reaktionen und Darstellung und 2) Alkohole und Phenole als Säuren und Basen. 9.1 Nomenklatur Alkohole Nach der IUPAC-Nomenklatur werden Alkohole als Alkanderivate behandelt. Dem Namen des Alkans wird die Endung -ol angehängt. Bei komplizierten verzweigten Systemen richtet sich der Name des Alkohols nach der längsten Kette, die den OH-Substituenten trägt : Um den Platz der funktionellen Gruppe im Molekül festzulegen, beginnt man mit der Zählung so, dass die OH-Gruppe eine möglichst niedrige Nummer erhält. Die Namen der Substituenten werden dem Alkanol vorangestellt : Wie Alkylsubstituenten und Halogenalkane teilen wir Alkohole in primäre, sekundäre und tertiäre Alkohole ein : Phenole Verbindungen mit Hydroxygruppen am Benzolring bezeichnet man als Phenole. Bei der Benennung der substituierten Benzole haben die Carboxyund die Carbonylgruppe eine höhere Priorität als die Hydroxygruppe : Ether Die IUPAC-Nomenklatur behandelt Äther als Alkan mit einem Alkoxy-Substituent, also als Alkoxyalkan. Der kleinere Substituent gilt als Teil der Alkoxygruppe, der grössere Substituent bildet den Stamm des Moleküls : 9.2 Eigenschaften der Alkohole, Phenole und Ether Die Struktur der Alkohole ähnelt der von Wasser. Unten werden die Strukturen von Methanol, Wasser und Dimethylether miteinander verglichen : file:///HD%20Robinson%20G3%20rechts/Desktop%20Folder/G3YChemuser/Kerstin/Lecture/Kap9/kap9.html Page: 1 Friday, February 2, 2001 Allgemeine Chemie B II Die Elektronegativität des Sauerstoffatoms bewirkt eine ungleichmässige Ladungsverteilung im Molekül, sodass ein Dipolmoment ähnlich dem von Wasser entsteht: Alkohole haben im Vergleich zu Alkanen und Chloralkanen unterschiedliche physikalische Eigenschaften: besonders auffalend sind die höheren Siedepunkte. Siedepukte verschiedener Alkane, Chloralkane und Alkohole Alkylgruppe, R Alkane, R-H Chloralkane, R-Cl Alkohole, R-OH CH 3- -162 -24 64.5 CH 3 CH 2 - -88.5 12.5 78.3 CH 3 CH 2 CH 2 - -42 46.6 97 (CH 3)2CH- -42 36.5 82.5 CH 3 CH 2 CH 2 CH 2 - -0.5 83.5 117 (CH 3 )3 C- 51 83 -12 Auch Phenole und aromatische Kohlenwasserstoffe haben unterschiedliche Siedepunkte : z.B. Toluol Sdp 110oC, Phenol Sdp 182oC. Der Grund dafür liegt in der Ausbildung von Wasserstoffbrücken. Diese werden zwischen dem Sauerstoffatom des einen Moleküls und dem Hydroxy-Wasserstoffatom eines anderen Moleküls gebildet : Diese Wechselwirkung führt zu einem weiten Netz derart verknüpfter Moleküle. Obwohl eine H-Bindung viel schwächer ist (21 KJ/mol) als eine kovalente O-H Bindung (435 KJ/mol, erschwert die Vielzahl der vorhandenen Wasserstoffbrücken den Siedevorgang. Dies führt zu verhaltnismässig hohen Siedepunkten. Im Wasser ist dieser Effekt noch stärker ausgeprägt. 9.3 Säuren und Basen Alkohole und Phenole sind schwache Säuren. Aber sie können auch basisch reagieren, indem das freie Elektronenpaar des Sauerstoffatoms ein Proton bindet (siehe auch Kapitel 8.5.3). Was bedeutet Säure und Base, und wie werden ihre Stärken verglichen ? Nach dem Konzept von Brønsted sind Säuren Substanzen die ein Proton übertragen können. Eine Base ist eine Substanz die ein Proton aufnehmen kann - sie muss ein freies Elektronenpaar haben, um eine σ-Bindung mit H+ bilden zu können. z.B.: Die Stärke einer Säure oder Base (in Wasser ) wird durch ihre Aciditätskonstante Ka oder pKa definiert, z.B.: Die Konstante pKa ist der pH-Wert für den Fall [HA] = [A-]. Je kleiner der pKa-Wert ist, umso stärker ist die Säure. Eine schwächere Säure hat ein höheres pKa. file:///HD%20Robinson%20G3%20rechts/Desktop%20Folder/G3YChemuser/Kerstin/Lecture/Kap9/kap9.html Page: 2 Friday, February 2, 2001 Allgemeine Chemie B II pKa = -log Ka d.h. = pH wenn Ka = 1 ! Wenn Sie eine schwache Säure betrachten (z.B. Ethanol), dann ist ihre konjugierte Base eine starke Base. Wenn Sie eine starke Säure betrachten (z.B. HCl) dann ist ihre konjugierte Base eine schwache Base: Relative Stärke verschiedener Säuren und ihrer konjugierten Basen Säure pKa Name konjugierte Base CH 3 CH 2 O - Name CH 3 CH 2 OH Ethanol 16.0 H 2O Wasser 15.74 OH- HCN Cyanwasserstoff 9.2 CN - Cyanid CH 3 COOH Essigsäure 4.72 CH 3 COO - Acetat HF Fluorwasserstoff 3.2 F- Fluorid HNO 3 Salpetersäure -1.3 NO3- Nitrat HCl Chlorwasserstoff -7.0 Cl- Chlorid Ethanolat Hydroxid Nach dem Konzept von Lewis sind Säuren Substanzen die ein Elektronenpaar aufnehmen können (Elektronenpaar-Akzeptoren). Dagegen ist eine Lewis-Base eine Substanz die ein Elektronenpaar übertragen kann (Elektronenpaar-Donatoren). z.B : 9.4 Alkohole und Phenole als Säuren Wenn Sie einen Alkohol oder ein Phenol in Wasser lösen, ensteht ein Gleichgewicht : Wenn wir ihre Stärke als Säuren vergleichen möchten, müssen wir ihre Aciditätskonstante betrachten: Alkohol oder Phenol pKa (Me) 3COH 18.0 CH 3 CH 2 OH 16.0 HOH [ 15.74 ]* MeOH 15.54 p-Methylphenol 10.17 Phenol 9.89 p-Bromphenol 9.25 p-Nitrophenol 7.15 CH 3 COOH [ 4.72 ]* HCl [ -7.00 ]* * Als Vergleich Alkohole sind als Säuren etwa gleich stark wie Wasser. Mit Alkalihydroxid zum Beispiel liegt ein Gleichgewicht vor: Aber mit Alkali-Metall findet eine vollständige Reaktion statt (nicht reversibel) : file:///HD%20Robinson%20G3%20rechts/Desktop%20Folder/G3YChemuser/Kerstin/Lecture/Kap9/kap9.html Page: 3 Friday, February 2, 2001 Allgemeine Chemie B II Warum sind Phenole stärkere Säuren als Alkohole ? Der Grund dafür muss darin liegen, dass das Phenoxid-Anion im Vergleich zu einem Phenol stabiler ist, als ein Alkoxid-Anion gegenüber einem Alkohol. Das Phenoxid-Anion ist durch Resonanz (Mesomerie-Effekt) stabilisiert : Wenn der Benzol-Ring auch einem Substituent trägt, kann das Phenol entweder eine noch stärkere Säure oder eine schwächere Säure als das Phenol selbst sein : z.B. Nitrophenol : Es liegt schon bei pH 7 im Wasser fast bis zu 50% in der Phenoxid Form vor. Ether haben kein Wasserstoffatom am O und sind deshalb nicht sauer. Sie sind neutral. 9.5 Darstellung der Alkohole Alkohole besetzen eine zentrale Position in der Organischen Chemie. Sie können ausgehend von verschiedenen funktionellen Gruppen hergestellt werden und lassen sich in zahlreiche andere funktionelle Gruppen umwandeln. Welche Methoden haben wir schon gesehen ? 1) Hydratisierung von Alkenen (siehe Kapitel 4.3): (Achtung - Die Reaktion ist reversibel, und Bedingungen die die gewünschte Richtung bevorzugen, müssen gefunden werden). 2) Oxidation von Alkenen mit OsO4 (siehe Kapitel 4.5): 3) Nucleophile Substitutionsreaktionen (siehe Kapitel 8) Ein wichtiger neuer Zugang zu Alkoholen, der uns bis jetzt nicht begegnet ist, ist die Reduktion von Carbonyl-Verbindungen: Die Mechanismen von Reaktionen an Carbonyl-Gruppen werden wir erst im Kapitel 10-12 behandeln. Alkohole ausgehend von Carbonyl-Verbindungen i) Durch die Reduktion von Aldehyden und Ketonen file:///HD%20Robinson%20G3%20rechts/Desktop%20Folder/G3YChemuser/Kerstin/Lecture/Kap9/kap9.html Page: 4 Friday, February 2, 2001 Allgemeine Chemie B II Dieser Prozess kann folgenderweise geschildert werden : Es gibt mehrere Reagenzien, die für diese Reaktionen geeignet sind. Wir werden zwei betrachten, weil sie einen ziemlich breiten Anwendungsbereich haben : Reduktion mit Natrium Borohydrid (NaBH 4 ): Reduktion durch heterogene Katalysatoren und Wasserstoff : Diese Bedingungen werden auch für die Reduktion von Alkenen und Alkinen zu Alkanen verwendet (siehe Kapitel 4.5, Kapitel 4.8). Aber Alkene und Alkine können nicht mit NaBH4 reduziert werden. ii Reduktion von Estern und Carbonsäuren Die Reduktion von Estern und Säuren kann folgenderweise beschrieben werden : iii Nucleophile Addition von Grignard-Reagenzien an Carbonyl Verbindungen Dieses Thema wird sorgfältig in den nächsten Kapiteln behandelt. Wir sollten hier bemerken, dass Grignard-Reagenzien für die Synthese von 1o-, 2ound 3o-Alkoholen eingestetzt werden können, z.B.: mit Formaldehyd: mit anderen Aldehyden: mit Ketonen: mit Estern: file:///HD%20Robinson%20G3%20rechts/Desktop%20Folder/G3YChemuser/Kerstin/Lecture/Kap9/kap9.html Page: 5 Friday, February 2, 2001 Allgemeine Chemie B II Eine Zusammenfassung über die synthetischen Anwendungen von Grignard-Reagenzien: 9.6 Darstellung von Ethern aus Alkoholen Ether stellt man am einfachsten durch die Reaktion eines Alkoxids mit einem primären Halogenalkan oder einem Sulfonsäureester (Mesylat oder Tosylat siehe Kapitel 8.4.2) unter typischen SN2-Bedingungen her. Dieses Verfahren ist als Williamson-Ethersynthese bekannt. Z.B.: Die Alkoxide können aus dem entsprechenden Alkohol und Na erzeugt werden. Da Alkoxide starke Basen sind, bleibt ihre Anwendung bei der Ethersynthese auf primäre ungehinderte Systeme beschränkt, da sonst ein erheblicher Anteil an E2-Produkt entstehen würde : z.B. Synthese von t-Butyl-Methyl-Ether : 9.7 Reaktionen von Alkoholen 9.7.1 Dehydratisierung Wir haben schon auf (siehe Kapitel 8.5) Eliminierungsreaktionen für die Synthese von Alkenen kennengelernt. Hier werden wir die Mechanismus von Dehydratisierungen behandeln: Z.B.: Oxonium-Ionen entstehen durch Protonierung von Alkoholen. Sekundäre und teritäre Oxonium-Ionen können daraufhin Wasser abspalten und relativ stabile sekundäre oder tertiäre Carbenium-Ionen ausbilden : file:///HD%20Robinson%20G3%20rechts/Desktop%20Folder/G3YChemuser/Kerstin/Lecture/Kap9/kap9.html Page: 6 Friday, February 2, 2001 Allgemeine Chemie B II 9.7.2 Bildung von Halogenalkanen Primäre Oxonium-Ionen hingegen sind bezüglich dieser Weiterreaktion recht stabil, da das daraus entstehende primäre Carbenium-Ion zu energiereich (instabil) ist. Sie können jedoch von einem Nucleophil angegriffen werden (siehe Kapitel 8.4.2) : 2o- und 3o-Alkohole lassen sich auch durch Behandlung mit HCl oder HBr bei 0oC (jetzt SN1) in Halogenalkanen umwandeln. Am besten werden 1ound 2o-Alkohole durch Behandlung mit SOCl2 oder PBr3 zu Halogenalkanen umgesetzt (siehe Kapitel 8.2). 9.7.3 Oxidation von Alkoholen Im Abschnitt 9.5.1 wurde die Darstellung von Alkoholen aus Aldehyden, Ketonen und Carbonsäuren beschrieben, die mit Wasserstoff (nur RCHO und RCOR) oder Hydriden reduziert wurden. Auch die umgekehrte Reaktion, die Oxidation von Alkoholen zu Aldehyden, Ketonen oder Carbonsäuren ist möglich. Solche Oxidations-Reaktionen bilden eine der wichtigsten Reaktionsklassen, die für Alkohole möglich sind. Z.B.: Primäre Alkohole können entweder zu Aldehyden oder zu Carbonsäuren oxidiert werden ; welches Produkt gebildet wird, hängt von den Reagenzien und Reaktionsbedingungen ab. Sekundäre Alkohole liefern nur Ketone. Ein häufig verwendetes Reagenz zur Oxidation von Alkoholen ist Chrom (VI), ein Übergangsmetall in einer hohen Oxidationsstufe. In dieser Form ist Chrom gewöhnlich gelb bis orange. Bei der Umsetzung mit einem Alkohol wird Chrom (VI) zu tiefgrünem Chrom (III) reduziert. z.B. Alkohol zu Aldehyd : Die Weiteroxidation zur Säure lässt sich vermeiden, wenn man wasserfrei arbeitet, da dann das Aldehyd stabil ist : Wenn die Oxidation in wässeriger Lösung durchgeführt wird, erhält man ausgehend von 1o-Alkoholen Carbonsäuren. z. B.: file:///HD%20Robinson%20G3%20rechts/Desktop%20Folder/G3YChemuser/Kerstin/Lecture/Kap9/kap9.html Page: 7 Friday, February 2, 2001 Allgemeine Chemie B II Das Aldehyd tritt als Zwischenprodukt auf, aber unter diesen Reaktionsbedingungen wird er gewöhnlich weiter zur Säure oxidiert. 2o-Alkohole können entweder unter wasserfreien Bedingungen oder in wässeriger Lösung zu Ketonen oxidiert werden : 9.8 Reaktionen von Ether Ether sind recht reaktionsträge. Sie sind unter den meisten Bedingungen inert und werden deswegen oftmals als Lösungsmittel verwendet. Einige Ether reagieren jedoch langsam mit Sauerstoff zu Hydroperoxiden und Peroxiden nach einem radikalischen Mechanismus. Peroxide sind gefährlich, da sie sich explosionsartig zersetzen können. Starke Säuren greifen Ether unter Ausbildung von Alkoholen oder Halogenalkanen an (erwähnt in Kapitel 8.4.2). Z.B.: Wegen der stark sauren Bedingungen ist dieses Verfahren jedoch nur von begrenztem Nutzen. Eine Ausnahme ist die Verwendung von t-Butylgruppen als "Schutzgruppen". Beispiele werden später angegeben, aber wir sollten jetzt bemerken, dass ein t-Butyl-Ether relativ leicht mit Trifluoressigsäure (TFA) gespalten werden kann: t-Butylether werden durch SN1 oder E1 Prozessen gespalten, weil relativ stabile Carbenium-Ionen gebildet werden. 9.8.1. Epoxide Obwohl gewöhnliche Ether relativ inert sind, kann der gespannte Ring von Epoxiden (Oxacyclopropan) eine Reihe von Ringöffnungsreaktionen mit Nucleophilen eingehen. Unter mild-sauren Bedingungen reagieren Epoxide sehr schnell : file:///HD%20Robinson%20G3%20rechts/Desktop%20Folder/G3YChemuser/Kerstin/Lecture/Kap9/kap9.html Page: 8 Friday, February 2, 2001 Allgemeine Chemie B II Zwei Millionen Tonnen Ethylenglycol für Automobil Frostschutzmittel wird jährlich durch säure-katalysierte Hydratisierung aus Ethylen-Oxid hergestellt. 9.9 Phenole : Darstellung und Reaktionen Die direkte elektrophile Addition von OH an Benzole ist schwierig, da Reagenzien, die eine elektrophile OH-Gruppe wie OH+ erzeugen können, sehr selten sind. Man kann aber Phenol aus Natriumbenzolsulfonat oder Chlorbenzol durch Erhitzen in geschmolzenem NaOH darstellen (Mechanismus wird nicht behandelt) : Phenole können nicht mit Säure dehydratisiert werden, und sie können nicht mit HX in Arylhalogene umgewandelt werden. Aber Phenole gehen in der Williamson-Ether-Synthese (Seite 94) ein: z.B.: Phenole als elektronenreiche Aromaten gehen elektrophile Substitutionsreaktionen, wie Nitrierung, Sulphonierung und Halogenierung, rasch ein (siehe auch Kapitel 5.5): o- und p-Dihydroxybenzole (Hydrochinone) können leicht oxidiert werden und bilden dadurch Chinone (Quinones) : z.B. Die Chinone wirken als milde Oxidationsmittel, wobei die Dion-Einheit zurück zum Diol reduziert wird. Solche Chinone kommen in wichtigen Naturstoffen vor, wie dem Ubichinon (Coenzym Q) und dem Vitamin K: Inhalt Index file:///HD%20Robinson%20G3%20rechts/Desktop%20Folder/G3YChemuser/Kerstin/Lecture/Kap9/kap9.html Page: 9