Chemie - Klasse 08
Werbung

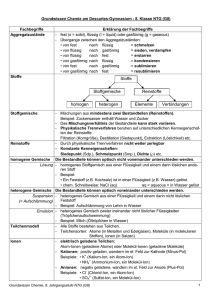
Stoffgemische 8C1 Stoffgemische a) Nebel, b) Rauch, c) Emulsion, d) Suspension, e) Lösung, f) Legierung 8C2 zeigen Eigenschaften beider Stoffe homogene: eine Phase, einheitliches Aussehen heterogene: zwei oder mehr Phasen, uneinheitliches Aussehen mittels physikalischer Trennverfahren in Reinstoffe trennbar a) heterogen: Flüssigkeit in Gas fein verteilt b) heterogen: Feststoff in Gas fein verteilt c) heterogene Mischung zweier Flüssigkeiten z. B. Frischmilch: Fetttröpfchen im Wasser d) heterogen: Feststoff in Flüssigkeit verteilt z. B. Schmutz in Wasser e) homogen: Feststofflösung, z. B. Salzwasser Gaslösung, z. B. Mineralwasser Flüssigkeitsgemisch: Wein f) homogen: Mischung zweier Metalle: z. B. Messing (Kupfer + Zink) a) Destillation aufgrund Siedepunktunterschied z. B. Alkohol und Wasser Trennverfahren 8C3 b) Filtration aufgrund Teilchengrößenunterschied z. B. Schmutzfilter Kläranlage c) Eindampfen aufgrund Siedepunktunterschied z. B. Meersalzgewinnung d) Entmischung aufgrund Dichteunterschied z. B. Fett in Bratensoße Reinstoffe 8C4 besitzen typische Kenneigenschaften wie z.B. Siedepunkt, Schmelzpunkt, Dichte, Aggregatszustand bei RT, Leitfähigkeit, Geruch, Farbe, Kristallform…. mittels physikalische Trennverfahren nicht weiter trennbar Teilchenmodell 8C5 alle Stoffe bestehen aus kleinsten Teilchen. Teilchen können sein: Atome (atomos gr. = unteilbar): z. B. Neon Moleküle aus Atomen zusammengesetzte Teilchen, z. B. Wasser H2O Ionen geladene Teilchen, z. B. Kochsalz besteht aus den Ionen Na+ und Cl Aggregatszustände 8C6 Verbindung 8C7 Chemische Formel 8C8 Stoffebene: Reinstoff, der aus zwei oder mehreren Elementen durch eine chemische Reaktion entstanden ist z. B. Bildung von Wasser aus Wasserstoff und Sauerstoff Teilchenebene: ein Stoff, der die verschiedenen Teilchen zweier oder mehrerer Elemente in einem bestimmten Zahlenverhältnis enthält, z. B. H2O: H : O = 2 : 1 Moleküle: Zahlenverhältnis der Atome Salze: Verhältnisformel der Ionen Ermittlung: 1. Elemente anschreiben 2. Wertigkeiten über Elementen angeben 3. kleinstes gemeinsames Vielfaches ermitteln 4. Index = kgV / Wertigkeit des Elements oder Kreuzregel: III II Al O Al2O3 ACHTUNG: auf kleinste mögliche Koeffizienten achten kürzen! (Verbindung aus C und O nach Kreuzregel C2O4 aber richtig ist CO2) Nomenklatur 8C9 griechische Vorsilben: 1: mono, 2: di, 3: tri, 4: tetra, 5: penta, 6: hexa, 7: hepta, 8: octa, 9: nona, 10: deca Endungen: O: -oxid; N: -nitrid, S: -sulfid; p: -phosphid, F:-fluorid, Cl:-chlorid, Br: -bromid, I: -jodid Benennung chemischer Verbindungen 8C10 Salze (Metall- und Nichtmetallelement): o Metallelement mit unterschiedlichen Wertigkeiten: Metall(Wertigkeit)-Nichtmetall z. B. Eisen(III)-chlorid o Metallelement mit einer Wertigkeit MetallNichtmetall z.B. Natriumchlorid Moleküle (Nichtemall- und Nichtmetallelement) Index als griechische Vorsilbe angeben z. B. P2O5: Diphosphorpentaoxid Ist Verbindung ein Salz (Metall- und Nichtmetallelement) Ermittlung der chemischen Formle 8C11 ja Aufstellen mit Hilfe der Wertigkeiten Aufstellen mit Hilfe der griechischen Vorsilben Magnesiumchlor id II I MgCl2 (Mono)Schwefeldioxid SO2 Element • 8C12 nein Stoffebene: Reinstoff der chemisch nicht mehr weiter in andere Stoffe zerlegt werden kann Teilchenebene: Verband aus Atomen einer einzigen Art ,d.h. derselben Protonenzahl jedem Element ist ein Elementsymbol zugeordnet Auflistung im PSE: 3 große Gruppen: Metalle – Halbmetalle - Nichtmetalle Chemische Reaktionen sind Stoff- und Energieumwandlungen Stoffebene: Vorgang, bei dem aus einem oder mehreren Reinstoffen ein oder mehrere neue Reinstoffe entstehen; Teilchenebene: Chemische Reaktionen sind gekennzeichnet durch Umordnung und Veränderung von Teilchen Umbau von chemischen Bindungen Chemische Reaktion 8C13 Aufstellen einer Reaktionsgleichung 8C14 Grundlage: Anzahl der Atome eines Elements muss auf beiden Seiten der Gleichung gleich sein! NUR MT KOEFFIZIENTEN AUSGLEICHEN! 1. Edukte und Produkte angeben: Ermittlung der Formel für die Verbindungen über Wertigkeit 2. Anzahl der Atome = Koeffizient x Index 3. mit kompliziertester Verbindung beginnen, auch x,5 als Koeffizient zunächst zulässig 4. durch Multiplikation der ganzen Gleichung ganzzahlige Koeffizienten anstreben Reaktionsgleichung gibt an, welche Teilchen in welchem kleinstmöglichen Zahlenverhältnis miteinander reagieren bzw. entstehen. Fähigkeit eines Systems, Arbeit zu verrichten Energieformen: Wärme-, Licht-, Lage-, Bewegungsenergie, elektrische, mechanische, chemische Energie geht nicht verloren, verschiedene Energieformen sind ineinander umwandelbar innere Energie: in einem Stoff / in Stoffen gespeicherte Energie Energie 8C15 Reaktion unter Energieabgabe (Wärme, Licht, Strom...) Edukte sind in metastabilen Zustand, gehen aber nicht spontan in einen stabilen (energiearmen Zustand) über Zufuhr von EA zum Starten der Reaktion notwendig Ei exotherme Reaktion / exoenergetische Reaktion 8C16 E1 instabil Aktivierungsenergie Einnere A Edukte metastabil Produkte E2 stabil Produkte Reaktionskoordinate (-weg) Energie Ei < 0 Edukte > inner Energie endotherme Reaktion / endoenergetische Reaktion 8C17 Reaktion, die nur unter ständiger Energiezufuhr (Wärme, Licht, Strom) läuft innere Energie Edukte < inner Energie Produkte instabil Ei Aktivierungsenergie E1 Produkte metastabil Ei > 0 E2 Edukte stabil Reaktionskoordinate (-weg) Atom 8C18 kleinste Teilchen eines Elements. o Atomhülle: Elektronen o Atomkern: die Protonen und Neutronen. Atome eines Elementes haben gleiche Protonenzahl Nukleonenzahl: Summe aus Protonenzahl und Neutronenzahl Atome eines Elements mit gleicher Protonen-zahl (Elektronenzahl) und verschiedener Neutronenzahl gleiches chemisches Verhalten, aber unter-schiedliche Masse der Atome Isotop 8C19 Bindungstypen in der Chemie 8C20 Beispiel: Atombindung in Molekülen nur zwischen Nichtmetallatomen Atome teilen sich ein / mehrere Elektronenpaar /e Molekülformel: Anzahl der Atome durch Index Ionenbindung in Salzen nur zwischen Metall- und Nichtmetallatomen Metallatom: Abgabe aller Valenzelektronen, Nichtmetallatom: Aufnahme von Elektronen bis zum Oktett Verhältnisformel: Verhältnis Kationen : Anionen Metallbindung bei Metallen und Legierungen nur zwischen Metallatomen Abgabe der Valenzelektronen durch alle Atome positive Atomrümpfe werden vom negativen Elektronengas zusammengehalten Elemente, die als zweiatomige Moleküle vorkommen 8C21 Wasserstoff (H2) Stickstoff (N2) Sauerstoff (O2) alle Elemente der 7. Hauptgruppe (Halogene) Fluor (F2) Chlor (Cl2) Brom (Br2) Iod (I2) (Merke: Hals-Nasen-Ohrenarzt in der Hauptstraße Nr. 7) Valenzelektronen Elektronen der äußersten Schale (= höchsten Energiestufe) Punkt: 1 Elektron, Strich: Elektronenpaar Valenzstrich-Schreibweise 8C22 Metallbindung / Eigenschaften der Metalle 8C23 Salze / Eigenschaften der Salze 8C24 Elektronengasmodell: Atome an festen Gitterplätzen geben Valenzelektronen ab positive Atomrümpfe werden von negativem Elektronengas zusammengehalten Eigenschaften: metallischer Glanz, gute Wärmeleitfähigkeit, elektrische Leitfähigkeit leichte Verformbarkeit Ionen = elektrisch geladene Atome (Atom-Ionen, z. Na+, Cl-) oder Atomverbände (Molekül-Ionen, z. B. NO3-) o Anionen (negativ geladen) o Kationen (positiv geladen) o gegenseitige Anziehung Bildung Ionengitter, dabei wird Gitterenergie wird frei Eigenschaften: Kristallinität, Sprödigkeit, elektrische Leitfähigkeit in Lösungen und Schmelzen, nicht aber im festen Zustand Edelgas-Konfiguration Oktettregel 8C25 Energiestufenmodell der Atomhülle (Bohr`sches Atommodell) 8C26 Atommodelle 8C27 Orbitalmodell 8C28 besonders stabile Elektronenkonfiguration (e- Anordnung in der Schale) Elektronenkonfiguration der eines Edelgase 8 Valenzelektronen = Außenelektronen (Elektronenoktett) Ausnahme Helium (Elektronendublett) Atomhülle ist in „Schalen“ (Energiestufen) K, L, M, .. Q bzw. Hauptquantenzahl (n = 1, 2 ..7)gegliedert maximal mit 2 n2 Elektronen pro Schale verschiedene Modelle: beobachtbare Phänomene mit jeweils möglichst einfachem Modell erklärt werden jedes Modell hat seine Grenzen Modelle: Dalton: Kugelmodell: Atomhypothese Rutherford: Kern-Hülle-Modell: Streuversuch Bohr: Schalenmodell: Bindungsarten: Ionenbindung, Metallbindung, Elektronenpaarbindung Orbitalmodell: Orbital = Aufenthaltsraum eines Elektrons Orbital: Raum, in dem sich Elektron mit größter Wahrscheinlichkeit (99 %) aufhält Schalen des Bohr´schen Atommodells spalten in Unterschalen auf o s-, p-, d- und f-Orbitale Atommodell von Dalton 8C29 1. Atome sind kleinste unteilbar Teilchen 2. Die Atome eines Elements haben die gleiche Größe und Masse 3. Die Atome der verschiedenen chemischen Elemente unterscheiden sich in der Größe und der Masse 4. Bei chemischen Reaktionen reagieren ganze Atome und keine Bruchteile Wertigkeit 8C30 Hilfsmittel zur Ermittlung der Formel von chemischen Verbindungen, KEINE Eigenschaft der Atome Ermittlung: PSE: Hauptgruppe:I II III IV V VI VII VIII Wertigkeit: I II III IV III II I / auch Elemente mit mehreren Wertigkeiten: o Hauptgruppe: S, N, P, Pb o Nebengruppe: Fe: II; III, Cu: I, II