Lebensmittelchemie - dblay.de :: Chemie
Werbung

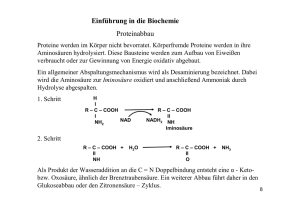
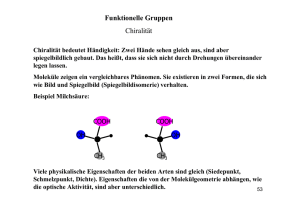
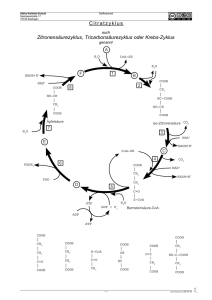
Lebensmittelchemie Proteine • • • • • • • Primärstruktur: Polypeptid (Abfolge von L-Aminosäuren) Sekundärstruktur: Aneinanderlagerung von Polypeptiden (Helix), H···H Tertiärstruktur: »Aufgewickelte« Helixstruktur, S—S, Ionenbdg., H···H, Van-der-W. Quartärstruktur: Molekül, mehrere Polypeptide mit eigener Tertiärstruktur, globulär oder fibrillär Nachweise: o Xanthoproteinreaktion: c. HNO3, gelb o Biuret-Reaktion: aq. KOH + aq. CuSO4, rotviolett Biologische Funktionen: o Enzyme, Antikörper, Transportmittel, Nährstoff, Hormone, Muskelfasern Zersetzung durch Enzyme n NH2—CHR—COOH [–NH—CHR—CO–]n + n H2O • • • • Proteasen Einteilung: o Proteine: Unterscheidung nach Struktur des Moleküls, globulär (Kolloid) oder fibrillär (schraubenf., schwer wasserlöslich) o Proteide: Unterscheidung nach peptidfremden Bestandteilen (Chromo~, Lipo~, Nukleo~, Gluko~) Denaturierung: Auflösen aller Verbindungen bis auf Peptidbindung (Primärstruktur) Nachweis von N in Eiweißen: + KOH NH3 (Unitest: blau) Nachweis von S in Eiweißen: + Pb2+ (z.B. Bleiacetat) PbS (schwarzer NS) Aminosäuren • • • Aminosäuren: NH2—CHR—COOH Peptidbindung: NH2—CHR—CO—NH—CHR—COOH, partieller Doppelbindungscharakter NH2—CHR—CO+NH–—CHR—COOH; Peptidbildung: Substitution Eigenschaften: o kristallin, gut in Wasser löslich, rel. hohe Schmelz. u. Siedetemp. o chirale Verbindung: opt. aktiv, drehen linear polarisiertes Licht COOH H2N C COOH H CH3 L-Alanin o • C NH2 CH3 D-Alanin Säure-Base-Ampholyt (bilden S-B-GG aus), Pufferlsg. NH2—CHR—COOH • H NH3+—CHR—COO– o Zwitterionen: isoelektr. Pkt. bei pH 6 o Mischung mit Kationen: Puffer im sauren Bereich (1:1) o Mischung mit Anionen: Puffer im basischen Bereich (1:1) Analytische Bestimmung, Identifizierung o Chromatographie (Dünnschicht~) o Titration mit NaOH: erst maskieren mit CH2O CH2N—CHR—COOH elektr. Feld: am isoelektr. Pkt. keine Wanderung der Ionen, bei pH < i.P. Anode (Kationen liegen vor), bei pH > i.P. Katode (Anionen liegen vor) © 2006 by Jonas Bresien, www.dblay.de H Kohlenhydrate • • C Allgemeine Summenformel: Cn(H2O)m Glucose C6H12O6 (Aldose): o Aldehydgruppe: —CHO o Nachweis: Fehling I+II (roter NS) C5H11O5—CHO + 2 Cu(OH)2 2 Cu2+ + 2 e– o • OH HO C H H C OH H C OH CH2OH 2 Ag + C5H11O5—COOH + H2O 2 Ag; Reduktion o Monosaccharid Fructose C6H12O6 (Ketose): o Ketogruppe: CO o Nachweis: »Seliwanow-Reaktion« HCl + Resorcinkrist. (dunkelrot) o Monosaccharid Hydrolyse + H2 O Polysacch. [–C6H10O5–]n [z.B. Stärke, Cellulose] • C Cu2O + C5H11O5—COOH + H2O 2 Cu+; Reduktion Hydrolyse + H2 O Disacch. C12H22O11 Enzyme • • H Nachweis: ammonikalische AgNO3-Lsg. (Silberspiegel) C5H11O5—CHO + AgOH 2 Ag+ + 2 e– • O CH2OH C O H C OH H C OH H C OH Monosacch. C6H12O6 CH2OH Enzyme [z.B. Maltose, Saccharose] [z.B. Glucose, Fructose] Bedeutung: Energiespeicher, Gerüstsubstanz (bei Pflanzen), Baustein des Erbmat. Stärkenachweis mit Iodkaliumiodid-Lsg.: Einlagerung von IKI in Amylosemoleküs, Einschlussverb. (blau) Cellulosenachweis mit Chlorzinkiodid-Lsg. (blau) Fette • • • • • • • Definition: Ester aus Fettsäuren und Glycerin Fett: CH2(OOC—R)—CH(OOC—R)—CH2(OOC—R) Vorkommen: Öl, Margarine, Butter, Schmalz etc. Säurezahl SZ: Gibt Anteil der ungebundenen Fettsäuren an Verseifungszahl VZ: Gibt Anteil der gebundenen Fettsäuren an Iodzahl IZ: Gibt Anteil an ungesättigten Fettsäuren an Reaktionen: Autooxidation (»ranzig werden«), alkalische Hydrolyse, Erhitzen 200°C CH2(OOC—R)—CH(OOC—R)—CH2(OOC—R) + 3 H2O CH2OH—CHOH—CH2OH +3 R—COOH Lipasen Enzyme • • • • Biokatalysatoren hochmolekulare Proteine u. Proteide Holoenzym = Apoenzym (Protein) + Coenzym (nicht-proteinhaltiger Anteil) Bau: aktives Zentrum Substrat Coenzym Apoenzym • • • • • • • Reaktion: Substrat + Enzym Substrat-Enzym-Komplex RP + Enzym Coenzym geht in Rkt. mit ein, reversibel Enzyme liegen nach Rkt. unverändert vor (beschl. oder blockieren Rkt.) Eigenschaften von Enzymen sind substratspezifisch, wirkungsspezifisch Enzyme setzen EA herab beschleunigen Reaktion Kompetitive Hemmung: ähnlich gebaute Substrate blockieren aktives Zentrum Nicht kompetitive Hemmung: Inhibitor am Enzym ändert aktives Zentrum © 2006 by Jonas Bresien, www.dblay.de • pH-Abhängigkeit, Abhängigkeit von Konzentration d. Substrats, Temp.-Abhängigkeit Katalyse Katalyse Katalyse gesättigt pH Denaturierung ab 40°C cSubstr. Chromatographie • • • • • • Qualitatives Trennen von Stoffgemischen z.B. Analysieren der Bestandteile einer Aminosäuremischung Papierchromatographie Dünnschichtchromatographie Mobile Phase: Wasser, Alkohol etc. (auch Laufmittel, Trennmittel) Stationäre Phase: Papier, Cellulose etc. Temp Fließmittelfront Startlinie Mineralstoffe, Vitamine, Ballaststoffe • • • Mineralstoffe: o anorg. Stoffe, müssen durch Nahrung aufgenommen werden o Mengenelemente (Na+, K+, Mg2+, Ca2+, P in PO43–, S in SO42–) o Spurenelemente (Fe, I, Zn, Cu, Co, Mn, Cr, Se, Ar, Si, Pb, Hg) o Baustoffe wie Ca und Mg, Regelstoffe wie I, Fe und Cl Ballaststoffe: o schlecht verdaulich, regen Verdauung an o Cellulose, Pektin (z.B. in Getreideprodukten) Vitamine: o werden nicht verdaut, Zufuhr durch Nahrung o Provitamine werden erst im Körper zu Vitaminen umgewandelt o An Enzymen: Coenzym Nahrungsmittelzusätze • • • • • • • Konservierungsstoffe: o Haltbarkeit erhöhen, Verderb verzögern o hemmen Stoffwechsel der Mikroorganismen o Höchstmengen festgesetzt o E-Nummern Lebensmittelfarbstoffe: o Verkaufsförderndes, appetitanregendes Aussehen o nat. Farbstoffe: Chlorophyll, β-Karotin, Authocyane (blau-rot) o synthetische Farbstoffe: Azofarbstoffe, Alizarin Antioxidantien: o verzögern chem. Verderb von Lebensmitteln, indem sie die Oxidation durch Luftsauerstoff verhindern (binden freie Radikale) o z.B. in Margarine, Ölen, Backwaren o z.B. L-Ascorbinsäure u. Derivate, Gallussäureester Süßstoffe: o Traubenzucker, Sorbid etc. Emulgatoren: o z.B. Ammoniumphosphatide, Citronensäurelecithin Aromastoffe: o z.B. Ester, Vanille, Citrone Schadstoffe: o natürliche Inhaltsstoffe mit toxischer Wirkung o z.B. Blausäure (Rhabarber), Atropin (Tollkirsche) © 2006 by Jonas Bresien, www.dblay.de