PDF anzeigen
Werbung
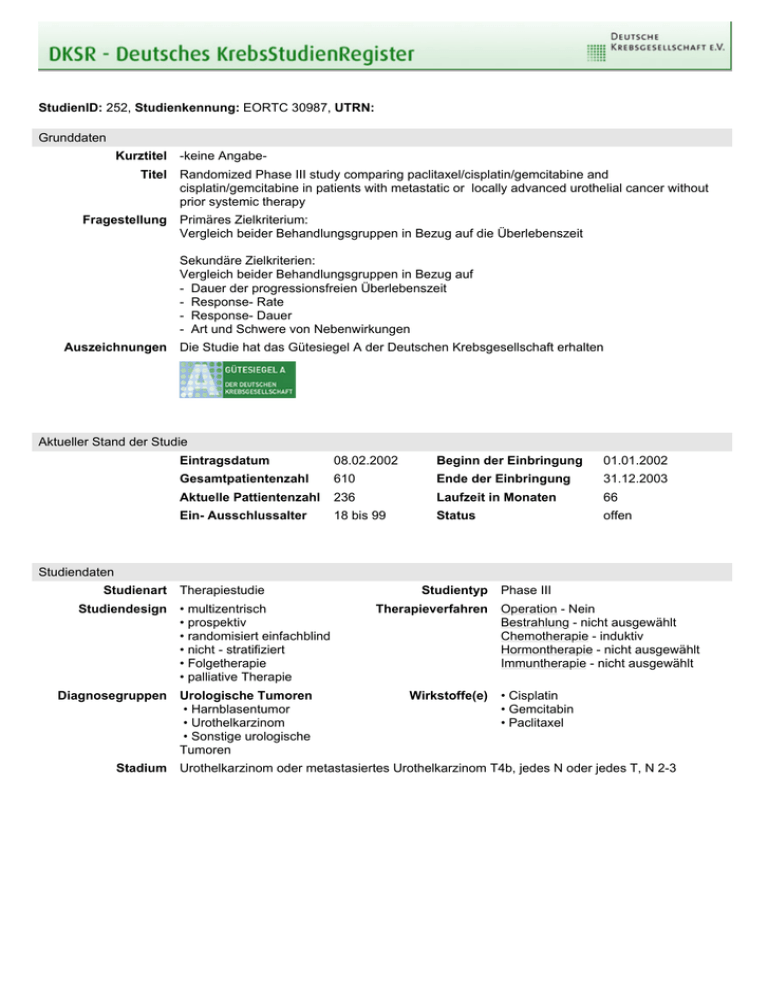
StudienID: 252, Studienkennung: EORTC 30987, UTRN: Grunddaten Kurztitel Titel Fragestellung -keine AngabeRandomized Phase III study comparing paclitaxel/cisplatin/gemcitabine and cisplatin/gemcitabine in patients with metastatic or locally advanced urothelial cancer without prior systemic therapy Primäres Zielkriterium: Vergleich beider Behandlungsgruppen in Bezug auf die Überlebenszeit Sekundäre Zielkriterien: Vergleich beider Behandlungsgruppen in Bezug auf - Dauer der progressionsfreien Überlebenszeit - Response- Rate - Response- Dauer - Art und Schwere von Nebenwirkungen Auszeichnungen Die Studie hat das Gütesiegel A der Deutschen Krebsgesellschaft erhalten Aktueller Stand der Studie Eintragsdatum 08.02.2002 Beginn der Einbringung 01.01.2002 Gesamtpatientenzahl 610 Ende der Einbringung 31.12.2003 Aktuelle Pattientenzahl 236 Laufzeit in Monaten 66 Ein- Ausschlussalter 18 bis 99 Status offen Studiendaten Studienart Studiendesign Diagnosegruppen Stadium Therapiestudie • multizentrisch • prospektiv • randomisiert einfachblind • nicht - stratifiziert • Folgetherapie • palliative Therapie Urologische Tumoren • Harnblasentumor • Urothelkarzinom • Sonstige urologische Tumoren Studientyp Therapieverfahren Wirkstoffe(e) Phase III Operation - Nein Bestrahlung - nicht ausgewählt Chemotherapie - induktiv Hormontherapie - nicht ausgewählt Immuntherapie - nicht ausgewählt • Cisplatin • Gemcitabin • Paclitaxel Urothelkarzinom oder metastasiertes Urothelkarzinom T4b, jedes N oder jedes T, N 2-3 Einschlusskriterien Ausschlusskriterien Stratifizierung 1. Behandelt werden Patienten mit einem histologisch gesicherten, lokal fort-geschrittenen Urothelkarzinom (pT4bNx oder pTxN2-3) und/oder metastasierten Urothelkarzinom der Harnblase, der Urethra, des Urethers und Nierenbeckens. 2. Patienten mit messbarer oder nichtmessbarem Tumorläsion 3. Ohne Vorbehandlung mit einer Chemotherapie oder einer Vorbehandlung mit Entwicklungsprodukten (Antiangiogene Substanzen, Signal transduction pathway-Inhibitoren, Immunomodulatoren, monoklonale Antikörper gegen Zellrezeptoren und andere biologische Substanzen). Eine vorausgegangene lokale intravesikale Chemotherapie oder Immunotherapie ist erlaubt, wenn diese mindestens 4 Wochen vor der Studienaufnahme abgeschlossen worden ist. 4. Eine vorrausgegangene Radiatio von einem Zyklus ist erlaubt. Die vorrausgegangen Radiatio muss 4Wochen vor Studienaufnahme abgeschlossen worden sein und alle auf diese Vorbehandlung eventuell zurückzuführenden Nebenwirkungen verschwunden sein. 5. Performance nach WHO: 0 -1 6. Leberfunktion: Bilirubin 1. 2. 3. 4. 5. Akute Infektion Grad 3-4 Hirnmetastasen Schwangere oder Stillende Schwere Begleiterkrankungen, die den Studienablauf beeinträchtigen Patienten mit vorausgegangenen oder begleitenden Malignomen (Ausnahme: erfolgreich therapiertes CIS der Cervix, Basaliom der Haut oder inzidentelles Prostatakarzinom T1 (Gleason Score) < 6, PSA< 0.5 ng/ml) 6. Periphere Neuropathie > Grad 2 7. Kardiale Erkrankung: klinisch relevante Arrhythmie, klinisch manifeste KHK, Herzinsuffizienz ³ Grad III nach NYHA -keine Angabe- Studienziele Hauptziel(e) • Gesamtüberlebensrate • Zeit bis zur Progression / Rezidiv • Ansprechrate • Nebenwirkungen Nebenziel(e) • Krankheitsfreie Überlebensrate • Zeit bis zur Progression / Rezidiv • Ansprechrate • Nebenwirkungen Die Studie wird in folgenden Ländern durchgeführt Bundesland Land • Baden-Württemberg • Bayern • Berlin • Brandenburg • Bremen • Hamburg • Hessen • MecklenburgVorpommern • Niedersachsen • Nordrhein-Westfalen • Rheinland-Pfalz • Saarland • Sachsen • Sachsen-Anhalt • Schleswig-Holstein • Thüringen • Frankreich • Kanada • Spanien • Vereinigte Staaten von Amerika Publikationen -keine Angabe- Kontaktadressen Studienleiter Herr Prof. Dr. Andreas Böhle Urologische klinik und Poliklinik Universitätsklinikum Lübeck Ratzeburger Allee 160 23538 Lübeck, Deutschland Studienkoordinator Herr Dr. Jörg Heyer Ratzeburger Allee 160 23538 Lübeck, Deutschland Telefon 0451 500 6112 0451 500 6112 Fax 0451 500 2242 Email Telefon 0451-5003701 0451-5003701 Fax 0451-5002242 Email Studienkoordinator Herr Dr. Jörg Heyer Ratzeburger Allee 160 23538 Lübeck, Deutschland [email protected] Telefon 0451-5003701 0451-5003701 Fax 0451-5002242 Email alternative Kontaktadresse [email protected] [email protected] Telefon Fax Email Stand: 21.03.2012, 11:54 Uhr Nutzungsbedingungen Die über die Website abrufbaren Inhalte und Dokumente dürfen gespeichert, weitergegeben und vervielfältigt werden. Sie dürfen jedoch nicht verändert, verfälscht oder aus dem Zusammenhang herausgenommen dargestellt werden. Die Weitergabe oder Vervielfältigung ist nur unter deutlicher Angabe der Quelle zulässig. Haftungsbeschränkung Die Studiendaten dieser Website werden mit größtmöglicher Sorgfalt zusammengestellt, die Deutsche Krebsgesellschaft e.V. ist bemüht, die bereitgestellten Informationen stetig zu erweitern und zu aktualisieren. Hinsichtlich Aktualität, Vollständigkeit und Richtigkeit der abrufbaren Inhalte und Dokumente wird jedoch keine Gewähr übernommen. Haftungsansprüche gegen die Deutsche Krebsgesellschaft e.V., deren Mitarbeiter bzw. den Verantwortlichen dieser Website für Schäden materieller oder immaterieller Art, die direkt oder indirekt durch die Nutzung dieser Website entstehen, sind ausgeschlossen, soweit diese nicht auf Vorsatz oder grober Fahrlässigkeit beruhen. Die Haftung der Deutsche Krebsgesellschaft e.V. für Schäden aus der Verletzung des Lebens, des Körpers oder der Gesundheit, die auf einer fahrlässigen Pflichtverletzung der Deutsche Krebsgesellschaft e.V. oder einer vorsätzlichen oder fahrlässigen Pflichtverletzung deren Mitarbeitern bzw. den Verantwortlichen dieser Website beruhen, bleiben hiervon unberührt.











