1.2.2 - IOC
Werbung
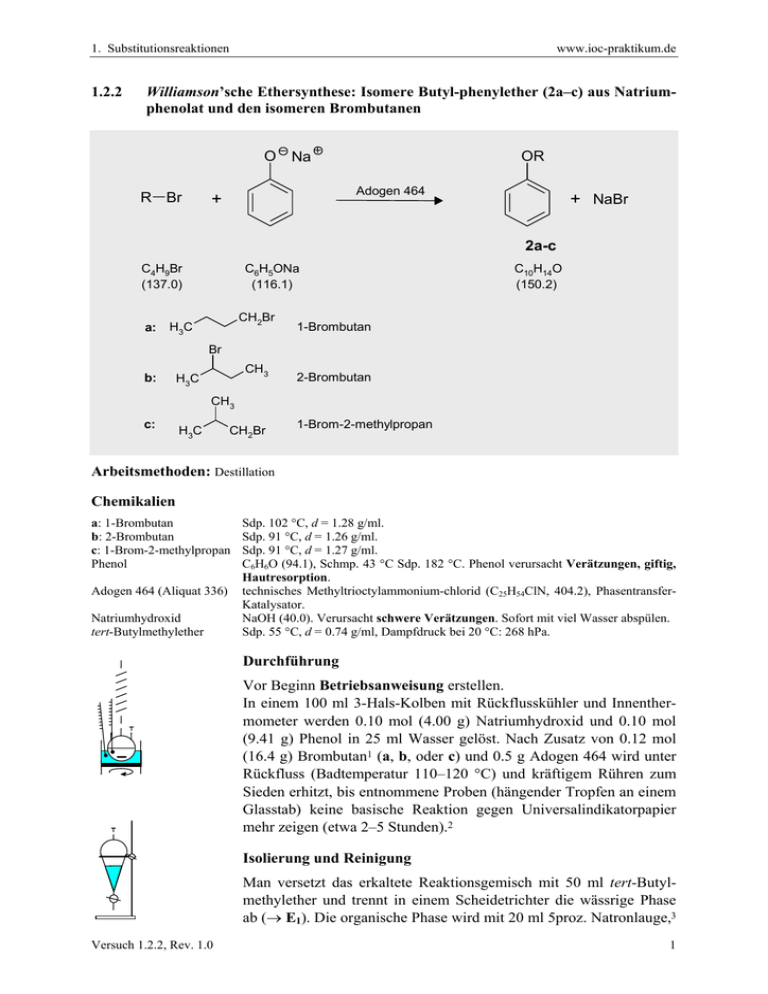
1. Substitutionsreaktionen 1.2.2 www.ioc-praktikum.de Williamson’sche Ethersynthese: Isomere Butyl-phenylether (2a–c) aus Natriumphenolat und den isomeren Brombutanen O Na R Br OR Adogen 464 + + NaBr 2a-c C4H9Br (137.0) a: C6H5ONa (116.1) CH2Br H3C C10H14O (150.2) 1-Brombutan Br b: CH3 H3C 2-Brombutan CH3 c: H3C CH2Br 1-Brom-2-methylpropan Arbeitsmethoden: Destillation Chemikalien a: 1-Brombutan b: 2-Brombutan c: 1-Brom-2-methylpropan Phenol Adogen 464 (Aliquat 336) Natriumhydroxid tert-Butylmethylether Sdp. 102 °C, d = 1.28 g/ml. Sdp. 91 °C, d = 1.26 g/ml. Sdp. 91 °C, d = 1.27 g/ml. C6H6O (94.1), Schmp. 43 °C Sdp. 182 °C. Phenol verursacht Verätzungen, giftig, Hautresorption. technisches Methyltrioctylammonium-chlorid (C25H54ClN, 404.2), PhasentransferKatalysator. NaOH (40.0). Verursacht schwere Verätzungen. Sofort mit viel Wasser abspülen. Sdp. 55 °C, d = 0.74 g/ml, Dampfdruck bei 20 °C: 268 hPa. Durchführung Vor Beginn Betriebsanweisung erstellen. In einem 100 ml 3-Hals-Kolben mit Rückflusskühler und Innenthermometer werden 0.10 mol (4.00 g) Natriumhydroxid und 0.10 mol (9.41 g) Phenol in 25 ml Wasser gelöst. Nach Zusatz von 0.12 mol (16.4 g) Brombutan1 (a, b, oder c) und 0.5 g Adogen 464 wird unter Rückfluss (Badtemperatur 110–120 °C) und kräftigem Rühren zum Sieden erhitzt, bis entnommene Proben (hängender Tropfen an einem Glasstab) keine basische Reaktion gegen Universalindikatorpapier mehr zeigen (etwa 2–5 Stunden).2 Isolierung und Reinigung Man versetzt das erkaltete Reaktionsgemisch mit 50 ml tert-Butylmethylether und trennt in einem Scheidetrichter die wässrige Phase ab (→ E1). Die organische Phase wird mit 20 ml 5proz. Natronlauge,3 Versuch 1.2.2, Rev. 1.0 1 1. Substitutionsreaktionen www.ioc-praktikum.de dann mit 20 ml Wasser gewaschen (→ E1) und über Natriumsulfat getrocknet. Nach dem Abfiltrieren vom Trockenmittel (→ E2) wird das Lösungsmittel am Rotationsverdampfer abdestilliert und der ölige Rückstand bei vermindertem Druck in einer kleinen Destillationsapparatur mit Spinne und tarierten Vorlagekölbchen fraktionierend destilliert. Man führe ein Destillationsprotokoll und bestimme Menge und Brechungsindizes der erhaltenen Fraktionen, die bei gleichem Brechungsindex vereinigt werden (→ E3). Ausbeute an 2a: 60–70%, Sdp. 85–87 oC/16 hPa, nD20 =1.4969; Ausbeute an 2b: 50–60%, Sdp. 76–78 oC/16 hPa, nD20 =1.4926; Ausbeute an 2c: 35–40%, Sdp. 83–85 oC/16 hPa, nD20 =1.4932. 1 Man erläutere die angewandten Molverhältnisse. Man protokolliere die Innentemperatur der siedenden Mischung im Verlauf der Reaktion! Deutung? 3 Welchen Zweck erfüllt diese Operation? 2 Hinweise zur Entsorgung (E) E1: Wässrige, basische Lösung mit organischen Verbindungen → Neutralisation → Entsorgung (H2O mit RHal/Halogenid). E2: Kontaminiertes Trockenmittel → Entsorgung (Anorg. Feststoffe). E3: Destillationsrückstand und verunreinigte Fraktionen in wenig Aceton lösen → Entsorgung (RHal). Auswertung des Versuchs H-NMR-Spektrum von 2a (300 MHz, CDCl3): δ = 1.04 (3 H), 1.55 (2 H), 1.82 (2 H), 4.01 (2 H), 6.92–7.01 (3 H), 7.28–7.37 (2 H). 1 8.0 Versuch 1.2.2, Rev. 1.0 6.0 4.0 2.0 [ppm] 0.0 2 1. Substitutionsreaktionen www.ioc-praktikum.de C-NMR-Spektrum (75.5 MHz, CDCl3) von 2a: δ = 14.00 (CH3), 19.40 (CH2), 31.50 (CH2), 67.62 (CH2), 114.58 (CH), 120.56 (CH), 129.52 (CH), 159.26 (C). 13 LM 160 140 120 100 80 60 40 20 [ppm] 0 IR-Spektrum von 2a (Film): 100 T [%] 3080 3050 50 2890 2950 2980 1600 1495 0 4000 3000 2000 1500 ~ [cm-1] ν 1000 H-NMR-Spektrum von 2b (300 MHz, CDCl3): δ = 1.02 (3 H), 1.33 (3 H), 1.53–1.88 (2 H), 4.33 (1 H), 6.90– 6.99 (3 H), 7.26–7.35 (2 H). 1316.4 Hz 1310.4 Hz 1304.3 Hz 1298.2 Hz 1292.2 Hz 1286.2 Hz 404.2 Hz 398.1 Hz 314.9 Hz 307.4 Hz 300.0 Hz 1 a) b) a) 8.0 Versuch 1.2.2, Rev. 1.0 6.0 b) 4.0 2.0 [ppm] 0.0 3 1. Substitutionsreaktionen www.ioc-praktikum.de C-NMR-Spektrum (75.5 MHz, CDCl3) von 2b: δ = 9.85 (CH3), 19.29 (CH3), 29.23 (CH2), 74.90 (CH), 115.90 (CH), 120.4 (CH), 129.6 (CH), 158.25 (C). 13 LM 160 140 120 100 80 60 40 20 [ppm] 0 IR-Spektrum von 2b (Film): 100 T [%] 50 3065 3040 2880 0 4000 1600 2935 2970 3000 1490 2000 1500 -1 ~ ν [cm ] 1000 H-NMR-Spektrum von 2c (300 MHz, CDCl3): δ = 1.10 (6 H), 2.15 (1 H), 3.78 (2 H), 6.93–7.03 (3 H), 7.29– 7.38 (2 H). 8.0 6.0 4.0 2.0 326.6 Hz 333.3 Hz 673.2 Hz 666.6 Hz 659.9 Hz 653.2 Hz 646.5 Hz 639.9 Hz 633.3 Hz 626.6 Hz 619.9 Hz 1131.5 Hz 1138.0 Hz 1 [ppm] 0.0 C-NMR-Spektrum (75.5 MHz, CDCl3) von 2c: δ = 19.29 (CH3), 28.30 (CH), 74.26 (CH2), 114.51 (CH), 120.42 (CH), 129.39 (CH), 159.28 (C). 13 Versuch 1.2.2, Rev. 1.0 4 1. Substitutionsreaktionen www.ioc-praktikum.de LM 160 140 120 100 80 60 40 20 [ppm] 0 IR-Spektrum von 2c (Film): 100 T [%] 3065 3035 50 2870 2910 1600 2960 0 4000 * 1495 3000 2000 1500 1000 -1 ~ ν [cm ] Formulieren Sie die zu 2a–2c führenden Reaktionsmechanismen. Weitere denkbare Reaktionsprodukte: H H CH2 H3C CH3 H3C H A H3C CH3 H B H3C H O CH2 H3C C CH3 CH3 H3C D E * Mit welchen spektroskopischen Daten und einfachen Versuchen lassen sich A–E ausschließen? * Diskutieren Sie die denkbaren Reaktionsmechanismen. Literatur, allgemeine Anwendbarkeit der Methode Gemischt aromatisch-aliphatische Ether lassen sich allgemein durch nucleophile Substitution in wässrigem, basischen Medium unter Phasentransfer-Katalyse aus Phenolen und Halogenalkanen herstellen.[1–4] Als Konkurrenzreaktion können Eliminierungen die Ausbeute mindern, dies ist besonders bei sekundären Alkoholen zu erwarten. [1] E.V. Dehmlow, S.S. Dehmlow, PhaseTransfer Catalysis, 3. Aufl., VCH Weinheim, 1993. [2] W.P. Weber, G.W. Gokel, Phase Transfer Catalysis in Organic Synthesis, Springer-Verlag, New York 1977. [3] C.M. Stark, C. Liotta, Phase Transfer Catalysis, Academic Press, New York, 1978. [4] W.E. Keller, Phase-Transfer-Reactions, Fluka Compendium Vol. 3, G. Thieme, Stuttgart 1992. Versuch 1.2.2, Rev. 1.0 5
![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)










